 去看看
去看看


1.乳腺癌
1.1 背景
中国女性乳腺癌发病率为268.6/10万[1],是中国女性发病率最高的恶性肿瘤,占女性所有恶性肿瘤病例的
[1] 15.1%。在亚洲,女性乳腺癌发病年龄峰值在40~50岁,中位年龄是48岁,比西方国家早10年[2,3]。
乳腺癌的诊断及其治疗都有可能给患者带来心理痛苦。国内调查显示,乳腺癌患者的抑郁症患病率为11.6%~52.9%,焦虑症的患病率为14.9%~61.9%,因不同调查使用量表不同,故结果差异比较大[4-7]。中国香港研究者发现,中国乳腺癌患者在被诊断为乳腺癌后,其心[8]理痛苦轨迹可分为4种类型 :大约有66.3%的患者呈现立即复原型,也就是说这部分患者自诊断起便一直维持着比较低的心理痛苦水平;有11.6%的患者属于逐渐恢复性,这部分患者在诊断初期的心理痛苦水平是比较高的,但随着时间的延长,心理痛苦水平逐渐降低,大约在诊断后4~8个月的时候心理痛苦水平逐渐稳定在一个比较低的水平;有6.6%的患者属于延迟恢复型,这部分患者在得知诊断后,心理痛苦在一定时间逐渐加重,大约在诊断后4个月,心理痛苦最平达到最高,之后缓慢下降,在诊断后8个月降至比较低的水平;还有15.4%的患者属于慢性痛苦型,这部分患者自诊断起就呈现出比较高的心理痛苦水平,且心理痛苦不会随着时间延长而缓解,在诊断后8个月依然维持在与刚得知诊断时类似的较高的心理痛苦水平。随访研究显示,这部分患者如果得不到干预,会长期存在心理痛苦,甚至在诊断后第6年的心理痛苦水平依然显著高于其他患者,且社会适应及生活质量显著低于其他患者[9]。纵向研究表明,有49%(95%CI 45%~54%)的术后的乳腺癌患者的心理方面的共病会持
[9]续到术后8个月或更长时间 。
1.2 证据
1.2.1 躯体状况影响心理状况
影响乳腺癌患者生活质量的症状有:缺乏活力、焦虑不安、疼痛、睡眠不好、便秘、急躁易怒、口干、出汗、手脚感到麻木或刺痛、皮肤改变、腹泻、恶心、没有食欲、气促或呼吸困难,它们可以共同解释乳腺癌患者整体生活质量评分总变异的79.0%[10]。以上症状既有躯体症状又有心理症状。2008年对上海市乳腺癌患者的大样本调查(N=1172)[5]显示乳腺癌患者存活期、诊断时的分期、治疗状况、体能(KPS)评分和疼痛评分是患者抑郁症发生率的重要影响因素。那些存活期长、诊断时分期较早、接受手术治疗、KPS评分在80分以上,没有疼痛的患者抑郁的发生率较低。2013年对北京255例乳腺癌患者进行的研[6] r=0.56,究显示,躯体症状与焦虑、抑郁情绪呈正相关(r=0.44,P值均<0.01)。有重度躯体症状的患者焦虑、抑郁发生率分别为50.0%和42.3%。研究表明,手术类型并不会影响患者术后的心理共病的风险,但如果患者在术前对于手术类型的决策有困难通常能够预测患者在术后较长时间会存在心理共病的风险较高[11]。
1.2.2 乳房缺失对夫妻关系及性关系的影响
国外研究显示,33%的患者认为乳房切除术对夫妻关系有负面影响,31%的患者认为自己的吸引力减弱,30%配偶认为她们吸引力减弱,80%的年轻患者和58%的老年患者在性生活的过程中会有意遮盖自己的身体[12]。对186例术后一年的、年轻(年龄25~45岁)的早期乳腺癌患者调查显示,57%的患者在性生活过程中存在润滑障碍,53.8%的患者存在性满足障碍,42.5%的患者存在性欲障碍,37.0%的患者存在性唤起障碍。其中,接受激素治疗的患者报告更多性功能障碍(P=0.006)。接受过放疗、化疗和激素治疗的乳腺癌患者其性功能障碍的发生率是同年龄健康女性的6倍[13]。晚期乳腺癌患者性关系方面的困扰与抑郁呈显著相关,患者与配偶的沟通方式在性关系困扰与抑郁间起到调节作用。即,如果患者能与配偶更开放地交流性关系方面的困扰,那么这些困扰导致抑郁的可能性就会降低[14]。国内这方面研究较少,2003年对90例乳腺癌术后乳房缺损患者的心理调查中,有58%的患者报告有性欲减退[15]。2009年国内一项对乳腺癌患者根治术后婚姻体验的质性研究显示术后患者感到婚姻质量下降,对婚姻的前景和期望值降低,性生活减少甚至消失,患者对婚姻状况的改变感到自责和无能为力[16]。
1.2.3 体象痛苦和低自尊
国外研究显示,接受乳房全切的患者会比接受保乳
[17][18]治疗的患者体验到更多体象痛苦 和低自尊的问题 。年轻、还在工作以及治疗后出现脱发、上肢水肿等不良反应往往预示着患者更容易出现体象痛苦;而年轻、治疗后不良反应、社会支持差则预示着患者更容易出现低自尊的问题[19]。国内调查也显示有64%的乳房缺失患者会存在体象障碍的问题[15]。2014年中南大学的张劲强等[20]对乳腺癌患者体象问卷中文版(the body image after breast cancer questionnaire-Chinese version,BIBCQ-C)进行了信度、效度检验,总量表的Cronbach’s,α系数为0.90,6个因子的α系数为0.62~0.87;总量表的条目间平均相关系数为0.16,6个分量表的条目间平均相关系数为0.21~0.57;总量表及6个因子的重测信度均在0.6以上;验证性因素的分析结果支持该量表的6个因子结构;BIBCQ-C总量表与抑郁和焦虑症状得分呈显著相关(r=0.20,r=0.21,P值均<0.01),证实了该问卷能有效评估乳腺癌患者的体象状况。
1.2.4 对乳腺癌复发的恐惧
国外一项对乳腺癌长期生存者(生存期在10年以上)大样本(N=2671)调查显示,即便生存期已经超过10年,几乎所有接受调查的被试都存在着对恶性肿瘤复发的恐惧,其中82%为轻度恐惧,11%为中度恐惧,6%为重度恐惧[21]。另有研究显示[22],在恐惧转移复发的患者中,43%符合疑病症的筛查标准,36%符合焦虑的筛查标准。
1.2.5 生育方面的需求
国外有研究综述报道,很多年轻乳腺癌患者会有生育方面的困扰[23]。大部分年轻乳腺癌患者都需要接受化疗[24]。英国的临床指南要求,对于有生育要求的患者,如果患者身体状况允许,应当在其治疗前就采用低温贮存技术帮其保留卵子或胚胎以备日后生育[25]。为了减少复发,通常会建议患者在治疗结束后两年再怀孕,如果患者接受激素治疗,通常会建议患者在治疗结束后5年再考虑生育[26]。
1.2.6 乳腺癌患者未满足的支持需求
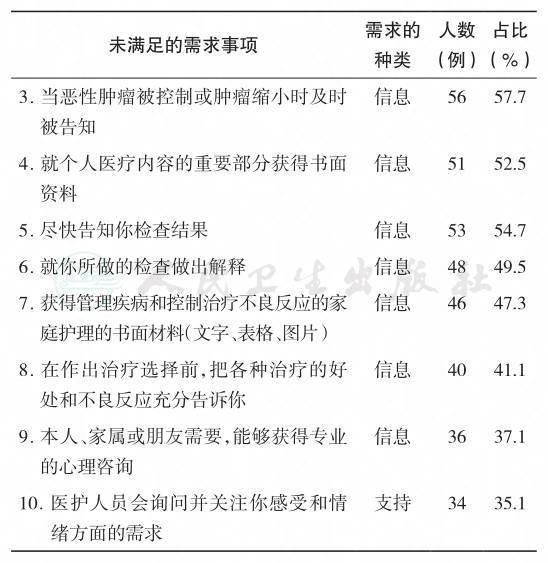
2013年中国香港对乳腺癌患者支持需求调查(N= 90)[27]显示,89.7%的中国乳腺癌患者报告有未满足的需求,排在前10位的未满足需求绝大多数为信息方面的需求(表11-1),提示目前医患沟通的不足。年轻患者有更多对医疗系统和性方面的信息需求。未满足的需求与患者症状痛苦得分呈正相关,对信息的需求与总体痛苦分数呈正相关与抑郁分数呈负相关,心理需求与焦虑分数呈正相关。
表11-1 中国乳腺癌患者位列前十位的未满足需求

续表
1.3 推荐意见
1.3.1 推荐对乳腺癌患者的心理痛苦(特别是焦虑、抑郁)进行早期筛查,特别是在刚诊断时、诊断后4个月、8个月等,对于筛查出的心理痛苦水平较高的患者给予干预或转诊至肿瘤心理科或精神科。(强烈推荐,证据等级中等)
1.3.2 对于有重度躯体症状,或体能状况差(KPS评分<80分)的患者应注意评估其心理状态。(强烈推荐,证据等级中等)
1.3.3 对于术前对手术类型决策困难的患者,应关注其术后情绪的变化,及时评估其心理状态(强烈推荐,证据等级中等)。
1.3.4 对于乳房缺失的患者,特别是年轻,仍然在工作的患者应给予体象方面的评估,推荐使用乳腺癌患者体象问卷中文版(BIBCQ-C),对于有体象障碍的患者应给予必要的信息支持(义乳、乳房重建)或转诊(肿瘤心理科、精神科、整形外科)。(强烈推荐,证据等级低)
1.3.5 应当关注患者对乳腺癌复发的恐惧,并给予专业上的解释,如果患者恐惧程度强烈,并伴有焦虑,甚至疑病倾向应转诊至肿瘤心理科或精神科。(强烈推荐,证据等级高)
1.3.6 对于年轻乳腺癌患者,在开始治疗前应了解其是否有生育方面的需求或顾虑,并给予信息方面的支持和指导或转诊至专业的生育机构进行咨询。(弱推荐,证据等级低)
1.3.7 重视患者,特别是年轻患者对于信息的需求,在沟通时能够邀请患者提问。如果因为时间不够不能充分沟通时,也尽量通过书面材料、图片等满足患者对于诊断、检查、治疗、康复等方面的信息需求。(强烈推荐,证据等级中等)
2.胃肠道肿瘤
2.1 背景
本部分所提到的胃肠道肿瘤包括食管癌、胃癌和结直肠癌。胃肠道肿瘤在我国的发病率很高。最近一次全国恶性肿瘤发病分析[28]显示,胃癌和食管癌发病率分别位列第二和第三,结直肠癌发病率位列第五。国内有研究报道,消化系统肿瘤患者普遍存在抑郁情绪,化疗前抑郁发生率为33.0%,化疗后的抑郁发生率为35.9%,化疗后患者抑郁发生率显著高于化疗前[29]。另有研究报道[30],胃肠道恶性肿瘤在诊断初期呈中等程度的焦虑,大约1/4的患者有抑郁,焦虑与抑郁得分为中度相关,年轻患者的不良情绪表现更为明显,焦虑得分和生活质量大多数维度得分在半年中较稳定,但半年后患者的抑郁程度加重,生命质量中的婚姻关系维度、性关系维度得分下降。在职人员、自费、婚姻不和谐、家庭收入低、平素身体状况差、对疾病及手术有恐惧、担心给家庭增加负担、有严重并发症、疾病分期晚的胃肠恶性肿瘤患者更易产生焦虑、抑郁情绪[31]。国外研究[32]显示,大约有一半的胃肠道肿瘤患者对疾病进展有高度恐惧,而患者对疾病进展的恐惧程度与患者病情和治疗情况无关,但与恐惧程度低的患者相比有更强的心理痛苦,功能受损以及很难为自己的未来做计划。
在心理社会肿瘤学研究中,关于结直肠癌患者的研究比较多,因为结直肠癌患者术后5年总体生存率在60%左右(包括带瘤生存患者)。结肠癌患者根治性切除术后5年生存率一般为60%~80%,直肠癌约为50%~70%;Dukes A期患者根治性切除术后的5年生存率可达90%以[33]上 ,由于生存期比较长,这部分患者的心理社会需求备受关注。
2.2 证据
2.2.1 食管癌
[34]
国内有研究 报道,食管癌患者焦虑、抑郁的发生率为48.9%和46.7%,而体能差和疼痛是食管癌患者发生焦虑、抑郁的重要影响因素。KPS评分≤40分的患者焦虑、抑郁发生率比KPS评分>40分的患者高1倍;疼痛组焦虑、抑郁发生率显著高于无疼痛组(75.0% vs 29.0%;57.1% vs 33.9%)。恐惧疾病、治疗不良反应、家庭支持差、治疗效果不理想、死亡威胁、照护问题、治疗费用也是食
[35]管癌患者焦虑的影响因素 。食管癌术后化疗的患者常常会受到脱发、胃口差、体重减轻、反流、疲劳、失眠、恶心[36]等症状,且症状困扰与焦虑抑郁相互影响 。国内有随机对照研究[37,38]报告,心理教育干预(包括手术、放化疗及康复的相关知识和信息)能够改善患者疲劳、食欲和进食、失眠等症状,提高患者术后近期(3个月内)的生活质量。放疗是食管癌非常重要的常规治疗方法,有研究报道[39]放疗前患者的焦虑抑郁水平显著高于正常,在放疗开始后约4周左右显著下降,放疗前的教育干预有助于缓解患者的焦虑、抑郁。
2.2.2 胃癌
早在二十世纪80年代,国内的张宗卫等[40]就提出了负性生活事件,抑郁情绪等心理社会因素是胃癌发病的
[41]病因之一。1995年,徐震雷等 对比了30名胃癌患者和50名健康者,发现与健康组相比,胃癌组患者倾向于抑郁和情绪内泄,不表达愤怒;另外,还发现62%的患者在确诊前3年遇到负性生活事件。2001年王建等[42]对比了晚期胃癌患者、胃癌长期生存者以及健康人群(每组30人)发现与胃癌晚期患者相比,胃癌长期生存者更为外向,负性情绪较少,更多采取成熟的应对方式,其NK细
[43]胞水平也较高。2008年汪晓炜等 的研究(胃癌组与健康人群各70例)进一步验证了上述结论。很多研究提到胃癌患者高发抑郁情绪[44],且情绪问题会影响患者的康复[45]。
2013年,张泓等[46]对心理干预对胃癌患者焦虑和抑郁影响的Meta分析共纳入了从2007—2012年,共12项临床对照实验,共1028例胃癌患者,结果显示干预组抑郁、焦虑评分显著低于对照组,心理干预能够有效改善胃癌患者的焦虑、抑郁症状。后续国内又有文献报道认知干
[47]预能够改善胃癌患者的失眠和焦虑、抑郁情绪 以及团体心理干预能够改善胃癌患者的情绪和生活质量、促进康复[48]。另外,康复期患者在护理人员的指导下在家中有规律地进行有氧运动也能够改善患者的情绪和生活质量[49]。
2.2.3 结直肠癌
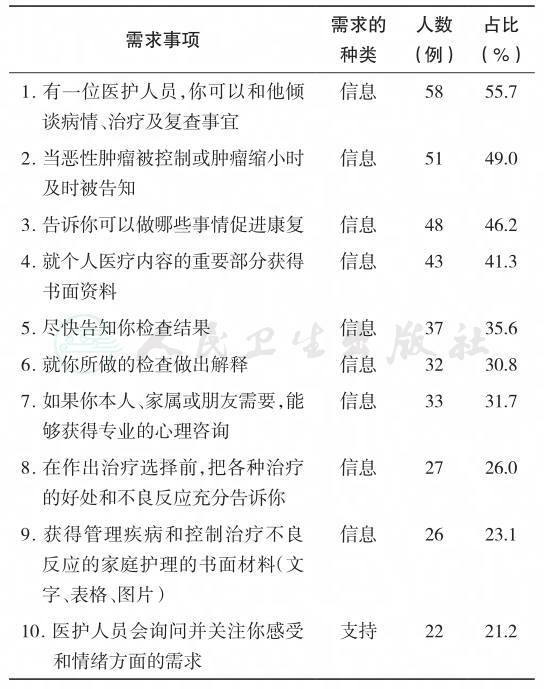
国内调查(N=64)[50]显示抑郁和焦虑发生率分别为42.2%、20.3%,其中造口患者抑郁得分高于非造口患者,Miles术患者抑郁得分高于非造瘘根治术患者,姑息手术患者抑郁得分高于非造瘘根治术患者。患者术前的焦[50]虑、抑郁水平要高于术后 。在接受术后化疗的结直肠癌患者中,53%的患者存在抑郁症状,57%的患者存在焦虑症状,且焦虑抑郁共病约41%,73%的患者存在睡眠障碍,术后化疗的结直肠癌患者存在认知损害,且认知损害程度与焦虑、抑郁及睡眠障碍呈正相关[51]。国外对诊断12~36个月的结直肠癌患者的大样本(N=21 802)调查[52]显示,失业、疾病复发或尚未治愈以及有造口的患者更容易体验到社会痛苦(social distress);此外,年轻(<55岁)、居住环境差、疾病分期晚、正在做放疗、有家属需要照顾也是社会痛苦的高危预测因素。2015年,荷兰维多利亚大学开展了对晚期结直肠癌患者进行心理痛苦筛查和分层干预的TES项目研究计划[53],这是一项多中心随机对照研究,目前该研究还在进行中,其目的是将心理社会筛查和干预常规化和标准化。国外研究还发现,有胃肠功能紊乱和体象障碍的结直肠癌患者更容易发生焦虑、抑郁,而体象障碍是胃肠功能紊乱和抑郁间的中介变量,也就是说胃肠功能紊乱是通过影响患者对的体象认知而引发抑郁的。中国香港学者Lam等[27]对结直肠癌患者未被满足的支持需求进行了调查(N=104),发现与乳腺癌患者类似,患者未被满足的需求主要是信息支持方面的,见表11-2。
表11-2 中国结直肠癌患者位列前十位的未满足需求
2.3 推荐意见
2.3.1 建议对胃肠道肿瘤患者进行常规的心理痛苦筛查,特别是在刚诊断时、术前、放化疗过程中关于焦虑、抑郁的筛查。(强烈推荐,证据等级中等)
2.3.2 对于在职人员、自费、婚姻不和谐、家庭收入低、平素身体状况差、对疾病及手术有恐惧、担心给家庭增加负担、有严重并发症、疾病分期晚的胃肠恶性肿瘤患者,更要关注其情绪变化,必要时转诊至肿瘤心理科或精神科接受专业的评估和干预(强烈推荐,证据等级低)。
2.3.3 对于有胃肠功能紊乱的患者要注意评估是否存在体象障碍和抑郁情绪,如果存在体象障碍或抑郁,需要转诊至肿瘤心理科或精神科接受干预(强烈推荐,证据等级低)。
2.3.4 对于食管癌患者,建议在治疗前进行结构性的教育干预,包括以下几个方面:
(1)术前教育:
①向患者讲解肿瘤以及治疗康复等方面的相关知识和手术的必要性,术前准备、术中配合及注意事项,术后插管的重要性,禁食的目的,手术费用等;②让患者坚定治疗疾病的信心,鼓励患者讲出顾虑,进行心理疏导,纠正患者对疾病的态度从而改善其情绪,为术后康复创造条件。
(2)术后教育:
①向患者讲解术后消化系统生理功能的变化,合理饮食对提高生活自理能力的重要性,鼓励患者多进高蛋白、高维生素、易消化的软食或半流质饮食;讲明半卧位的意义、食管癌常见并发症的预防及功能锻炼等;②宣讲术后放/化疗的过程以及可能出现的不良反应及处理方法,带领患者参观放疗机房及设备,并嘱咐患者合理用药,养成好的生活习惯,戒除不良嗜好;③出院时要交代按时复查、按时服药的作用以及怎样做好自我护理等。(强烈推荐,证据等级中等)
2.3.5 对于胃癌患者要更加关注患者是否有抑郁情绪,特别是晚期胃癌患者。对于性格内向、不善表达的患者更要关注,多与其沟通,必要时转诊至肿瘤心理或精神科接受专业的评估和干预。(强烈推荐,证据等级中等)
2.3.6 对于结直肠癌患者,特别是有造口的患者应该给予特别关注,评估其情绪、社会交往、体象问题。对于有体象问题的患者要注意评估其抑郁情绪。(强烈推荐,证据等级中等)
2.3.7 对于结直肠癌患者,注意满足其信息方面的需求,最好有一名医护人员能与患者进行充分的沟通,邀请患者提问并倾谈其病情、治疗和康复的相关事宜。(强烈推荐,证据等级弱)
2.3.8 如果有条件可以对于康复期的胃肠道肿瘤患者进行团体心理干预,在同一团体中的患者最好诊断和分期类似,团体领导者中最好有了解疾病专业知识的胃肠道肿瘤专科的医护人员,干预内容应包括结构性的教育,支持—表达和认知行为干预。(强烈推荐,证据等级弱)
3.肺癌
3.1 背景
目前,肺癌仍是威胁全球人类生命健康的主要杀手[54]之一。2015年全国恶性肿瘤发病率为429.16万例,其中肺癌73.33万例,死亡281.4万例,其中肺癌61.02万例,均处首位[1]。调查数据显示,我国肺癌患者的性别和城乡差异正逐渐缩小,其中女性和城镇居民人口正在逐年增[55]加 ,因而心理社会问题也正在发生变化。作为预后较差的肿瘤,肺癌患者与其他肿瘤患者有许多相似的症状和问题,如疲乏、疼痛、失眠、抑郁、心理痛苦、负罪感、病耻感、生活质量下降、需求得不到满足等[56,57],但肺癌的康复问题引起的心理痛苦以及心理需求未满足的情况多于其他肿瘤[58]。即使在抗肿瘤治疗结束后,有些症状并不会随之改善,甚至会加重,如抑郁等心理痛苦[59,60],这些痛苦可能影响患者的治疗决策,甚至缩短其生存期[61]。但肺癌的部位及特点还伴有特定的躯体症状和心理社会问题,比如慢性咳嗽、呼吸困难、戒烟、重度抑郁发病率高等,并且躯体症状也会诱发或进一步加重心理症状,如呼吸困难引起焦虑、惊恐发作等[62],慢性咳嗽会引起睡眠障碍和耗竭感[63]。尽管仍有许多难题需要攻克,肺癌已不再是从前那个不可治愈的疾病,而且肺鳞癌比例的下降也减少了吸烟相关的负罪感或病耻感;另外,信息和社会支持也比以前更易获得,使得许多患者得到更好的照顾[64]。
3.2 证据
3.2.1 生活质量下降
除了躯体症状和心理痛苦,生活质量下降也是肺癌患者面临的一大困难,生活质量在治疗决策中的作用
[65]越来越重要 。目前肺癌患者的生活质量也大都采用EORTC QLQ-C30和EORTC QLQ-LC-13来评估。Ediebah DE等[66]对391名晚期非小细胞肺癌患者的生活质量进行了调查研究,他们发现生活质量的许多方面与肺癌患者的生存期长短有关:疼痛、吞咽困难分数增加与死亡风险增加相关,而躯体功能和社会功能分数增加与死亡风险下降相关,但是这些数据来自于一项前瞻性、多中心、随机选择的三期临床试验,这一结果更能代表基线状态较好、症状较少的患者。在生活质量相关的其他方面上,新诊断为肺癌的患者中,最常见的症状是疲劳、疼痛、失眠和抑郁,还可能会有呼吸困难和咳嗽[67]。Wang XS[68]等对局部发生转移(Ⅱb-Ⅲ期)的非小细胞肺癌患者进行的调查研究表明,63%的患者在治疗期间存在两个及以上的中重度水平的生活质量相关症状,疲劳是治疗期间最严重的症状。美国一项针对151名晚期非小细胞肺癌患者的随机对照试验[69]发现,早期的姑息治疗可以明显提高患者的生活质量和情绪状态,并且早期姑息治疗组患者的中位生存时间较常规姑息治疗组有显著增加(11.2个月 vs 8.9个月,P=0.02)。
3.2.2 情感痛苦[70]Graves KD等的一项研究,发现被调查的333名在门诊就诊的肺癌患者中,62%存在明显的痛苦,情感痛苦的预测因素有年轻、疼痛、疲劳、焦虑和抑郁。情感上的痛苦在肺癌患者中普遍存在,肺癌患者面临最多的是抑郁情绪,国内外的多项调查都报告了肺癌患者的抑郁症发病率是所有恶性肿瘤中最高的,包括重症抑郁的发病率[71,72]。Uchitomi等对212名非小细胞肺癌术后一年的患者进行了调查,结果显示术后抑郁的发生率为5%~8%,并且持续1年以上没有变化;术后1年心理状况与诊断时存在抑郁或术后1个月左右发生抑郁,以及受教育水平[73]低呈显著相关 ,但这一证据尚缺乏随机对照试验支持。既往有抑郁病史的人更易再次出现,并且很难随病情好转和时间推进而得到自然缓解[59]。抑郁很可能会影响患者的治疗决策,进一步可能对生存时间带来影响[61],同时肺癌患者的自杀风险也高于其他肿瘤[74]。Jane Walker等在一项研究中对142名肺癌患者进行综合的抗抑郁治疗后发现,肺癌患者的抑郁情绪得到了很好的改善[75,76]。国内也有研究发现,肺癌患者在接受心理治疗时在抑郁情绪上的改善较为明显,但部分研究的样本量偏小,还需
[77]要更多研究来支持。
3.2.3 吸烟与病耻感
肺癌患者比其他恶性肿瘤患者更能产生疾病相关的病耻感,因为他们仿佛被贴上了标签,认为他们自己吸烟导致了高致死率的肺癌和痛苦等[78],当他们听到治疗的负面评价或者受到歧视时,病耻感就可能出现或加重[79]。病耻感会增加患者压力,导致消极应对,以至产生负面的[80]心理和生理状态,增加心理社会问题的发生率 。认知行为训练可以帮助改善自责和病耻感引起的一些心理社会问题,提高了患者生活质量[81]。当然,戒烟应该是肺癌患者的一项重要课题,Walker MS[82]等对154名术前3个月内仍吸过烟的肺癌患者进行了跟踪,发现部分患者在治疗期间仍然吸烟,近一半的非小细胞肺癌患者在手术后1年内复吸,其中六成以上的患者在术后2个月内再次开始吸烟。吸烟不仅增加了罹患肿瘤的风险,也会增加手术、化疗和放疗并发症的发生几率。有文献支持对患者和家属进行早期戒烟干预,并且进行持续的支持和干预[83,84]可以降低复吸率,但目前医疗机构和医生护士关于[85]戒烟干预支持较少。另有研究者发现,对于终末期的肺癌患者,如果吸烟难以戒除,且可以带来乐趣,可不提倡强制戒烟,但目前大多数医护人员对此持相对保守的意见,需要更多相关证据支持[86]。
3.2.4 小细胞肺癌的特殊问题
相比非小细胞肺癌,小细胞肺癌患者的躯体症状更加多,心理社会问题也更严重,常见的症状有疲乏、精力缺乏、呼吸困难、咳嗽、食欲丧失、睡眠障碍、焦虑、抑郁,
[87]以及化疗相关的脱发、厌食、恶心呕吐等 。同时接受放化疗的患者在生存时间延长的同时生活质量也随之下降,也承受了更多的痛苦[88]。抑郁症状和无法集中注意力症状更为常见,一项对987名肺癌患者的研究中,小细胞肺癌患者抑郁的发生率是非小细胞肺癌患者的3倍,分别为25%和9%[89]。Hurny C等人的研究发现127名接受6周期化疗的小细胞肺癌患者中,总共有43%出现了中重度的疲乏,其中前两个周期症状较轻,第3~4周期化疗时疲乏症状加重,在第6个周期前症状再次减轻,疲乏的主要原因是疾病和化疗毒性[90]。
3.3 推荐意见
3.3.1 作为全球发病率最高的恶性肿瘤,且预后较差,肺癌及其治疗带给患者许多躯体症状和心理痛苦,但目前肺癌患者人群的特定心理社会需求仍未得到很好的满足。我们推荐对肺癌患者进行及时、有效的心理干预,以减轻其心理痛苦,提高其生活质量,进而对生存起到积极作用。(强烈推荐,证据等级中)
3.3.2 在影响肺癌患者生活质量的因素中,疼痛和吞咽困难对生存有负面作用,而躯体功能和社会功能的改善可以降低死亡风险。我们推荐及时地控制症状、进行功能锻炼,以及提供心理社会干预。(强烈推荐,证据等级中)
3.3.3 在肺癌患者的情感痛苦中,最常见的是抑郁,抑郁可能会加重其他症状的严重程度,甚至可能会影响治疗决策和结局,同时抑郁比较难以随时间和抗肿瘤治疗自行好转,但在心理干预中的反应良好。因此,我们强烈推荐密切关注肺癌患者的抑郁问题,并及时帮助处理。(强烈推荐,证据等级高)
3.3.4 肺癌患者的自责和病耻感发生率高于其他肿瘤,且大多与吸烟相关,病耻感可能引起其他心理社会问题,我们推荐引入认知行为治疗进行干预。(强烈推荐,证据等级高)
3.3.5 吸烟是肺癌的发病因素之一,戒烟有益于患者接受治疗和康复,但术后复吸的比率很高,我们推荐对戒烟有困难的患者进行心理支持或干预。建议医疗工作者学习戒烟干预相关知识,提供相应支持。如果戒烟对于疾病和健康改善的意义不大,且可以作为减压或乐趣所在,我们不建议强行戒烟。(强烈推荐,证据等级弱)
3.3.6 小细胞肺癌在肺癌中所占比例虽小,但其死亡率却高于非小细胞肺癌,同时小细胞肺癌患者的躯体和心理症状也要更加突出。化疗是患者痛苦的主要因素之一,同步放化疗的患者承受的痛苦更多。因此,我们推荐在治疗的同时注重控制小细胞肺癌患者的症状,包括躯体症状和心理症状。(强烈推荐,证据等级中)
4.肝胆胰恶性肿瘤
4.1 背景
在所有的肿瘤中,肝癌、胆囊癌和胰腺癌的恶性程度较高,预后较差,生存时间短。在中国,原发性肝细胞肝癌的发病率仅次于肺癌和胃癌,居第三位(19.44/10万),死亡率仅次于肺癌居第二位(16.84/10万),且农村人口肝癌负担较重;肝内胆管癌(intrahepatic cholangiocarcinoma,ICC)在肝脏肿瘤中占5%~15%,仅次于原发性肝细胞肝癌,中国的发病患者数占全球ICC发病总人数的55%,早期病程隐匿,就诊时多处于晚期,总发病率约0.95/10万[91-93];胆囊癌由于早期发现率低,仅有约10%的患者可以进行[94][95]治疗性的手术切除 ,所以致死率仍高居不下 ;胰腺癌的发病率居第十位(4.41/10万),死亡率居第六位(3.92/ 10万)[96]。
目前的治疗手段尚不能有效地延长患者的生存时间,所以减少患者的痛苦、提高其生活质量应当作为治疗的重要方向。在这些肿瘤患者中,有许多特殊的或者相对较重的躯体症状主要包括疼痛、食欲丧失、疲乏、黄疸、恶病质、腹腔积液、恶心、呕吐、腹泻等,心理社会方面的困扰主要有经济负担、抑郁、焦虑、失志(demoralization,是指面临压力性事件或躯体疾病时出现的一组感觉,包括难以适应、无助、无意义、无能感、自我效能感低等,若
[97,98]持续超过2周可达到临床诊断标准 )、病耻感(包括恶性肿瘤、乙型肝炎和丙型肝炎)等。证据表明,目前国内的肝癌患者以农村比例较大,治疗条件欠缺,经济压力大也是值得关注的一点[99]。在国内的一项调查中,研究者发现这部分患者对生理的需求要低于心理的需求,比如寻求家属安慰、得到家属肯定和鼓励等[100]。症状控制的同时,亟须知识教育和心理社会支持来缓解这些患者的心理社会痛苦和灵性痛苦[101-103]。目前针对肝胆胰恶性肿瘤患者的护理以躯体症状控制为主,系统的心理社会干预研究较少。
4.2 证据
4.2.1 疼痛
由于原发性肝癌、胆管癌、胆囊癌,以及胰腺癌都是恶性程度较高,疾病进展较快,预后较差,生存时间较短的肿瘤。肝癌的躯体症状中最常见也是影响最大的是腹部疼痛,其疼痛发生率高,且持续加剧,疼痛还会加剧患者焦虑、抑郁和疲乏[104,105]。胰腺癌患者的疼痛是腹腔肿瘤中发病率最高,且最严重的,也是胰腺癌不良预后的重要预测因素[106,107]。
4.2.2 情感痛苦
[108]
胰腺癌患者伴有明显的焦虑、抑郁和睡眠障碍 。Petzel MQ等人的研究发现,即使在行切除术后的240名胰腺癌患者中,也有近1/3的患者存在严重的复发恐惧,尽管这些患者的中位生存期达到48个月;他们还发现复发恐惧最重要的相关因素是焦虑等情绪功能受损和生活质[109]量下降,而与病理诊断和临床指标无明显相关,但这项研究未能纳入一些症状多且重的患者,以及未能考虑婚姻、宗教和时间等因素,结果需要更多研究来支持。胰腺癌患者伴有抑郁时体内的炎症因子(主要是白介素-6)水平会升高,并且与抑郁的严重程度呈正相关[110]。尽管大量研究已经显示胰腺癌患者发生抑郁的风险非常高,但是具体生理机制仍在探索之中,抑郁与胰腺癌疼痛的关系也还不确定,但早期干预抑郁症状对于提高胰腺癌
[103]患者生活质量具有重要作用 。
4.2.3 疲乏
疲乏对肝癌患者的影响也非常大,其持续时间长,影响范围广,且不能通过休息缓解,大部分患者的疲乏与恶性肿瘤本身、治疗方式、情绪状态(抑郁)等有关[111]。Lai YH等人在一项前瞻性队列研究中发现肝脏放疗也会增加患者的疲乏,但是放疗前存在疲乏的患者主要受抑郁情绪和症状影响,而放疗后出现的疲乏主要受睡眠障[112]碍影响,但二者的疲乏均在放疗后第6周时达到顶峰 。国内外的研究也都发现胰腺癌患者中疲乏的发生率高于其他腹腔恶性肿瘤[107,113]。疲乏给患者造成多方面的痛苦,涉及生理、心理、精神以及社会等,其中情感疲乏尤为明显,其次是躯体疲乏、行为疲乏和认知疲乏[111]。
4.2.4 食欲丧失
肝胆胰部位的肿瘤大多会影响患者消化功能,胰酶的使用可以帮助患者缓解一部分消化吸收障碍的症状,但需要医生给予明确的用药剂量和饮食建议[114],必要时可以求助营养科进行饮食调整[115]。部分晚期患者因肿瘤侵犯或压迫十二指肠引起的症状,影响进食和吸收,可[116]以借助支架来帮助患者提高生活质量 。但医生在提供饮食建议是,需要注意患者的依从性。
4.2.5 谵妄
谵妄经常出现在恶性肿瘤患者中,尤其是接受姑息治疗的患者。肝癌、胆囊癌和胰腺癌患者在终末期时,许多因素都会增加谵妄风险,如使用阿片、抗惊厥药、苯二氮类、类固醇激素的药物,或存在感染、营养不良、活动受限、睡眠障碍、便秘、高胆红素血症、肝衰竭或肾衰竭、[117]肺衰竭或缺氧、电解质紊乱、脑转移瘤等。(详见第九章)
4.2.6 肝脏介入治疗和肝移植
肝动脉化疗栓塞(transcatheter arterial chemoembolization,TACE)是肝脏介入治疗中最常用的方法,患者经过TACE后常会出现疼痛、疲乏、发热、腹胀等症状,医生在治疗之前应给予足够的沟通解释[118,119],Wang Q等[120]发现心理社会干预可辅助药物治疗来减缓栓塞后的疼痛,效果好于单纯药物治疗。国内有研究支持音乐治疗对改善TACE后的疼痛、焦虑和恶心呕吐有较好的效果,但需要更多的证据支持[121,122]。肝脏移植是终末期肝病的重要治疗手段,同时也会带给患者和家属很大心理痛苦。Malik P等人发现肝移植患者和家属最常见的问题是焦虑,其次是抑郁,并且家属的焦虑和抑郁通常从得知需要手术上开始,随着等待时间延长而加重,而患者的焦虑和抑郁程度趋于稳定,可能与患者并未“敞开心扉”有关[123]。
4.3 推荐意见
4.3.1 由于预后较差,该部分肿瘤患者躯体症状程度会更加严重,其中疼痛、疲乏最常见,同时伴有严重的情绪和情感痛苦,焦虑、抑郁和复发恐惧发生率高,我们强烈推荐给予更多症状控制和心理社会灵性方面干预。(强烈推荐,证据等级高)
4.3.2 在预后极差的恶性肿瘤患者中,复发恐惧并未与临床指标和病理诊断呈明确相关,而与情绪功能损伤和低生活质量相关,焦虑是其中重要因素,医疗工作者应注意识别害怕肿瘤复发背后的原因。(强烈推荐,证据等级中)
4.3.3 胰腺癌患者中抑郁高发,我们推荐及时进行抗抑郁治疗,这对减轻患者心理痛苦,提高生活质量具有重要意义。(强烈推荐,证据等级高)
4.3.4 肝脏和胰腺恶性肿瘤患者的疲乏发病率和严重程度高,受治疗方式、情绪状态和睡眠障碍影响,而且情感疲乏是非常重要的一方面,临床医生应该在治疗前进行良好的沟通和充分的社会支持以及症状控制,这可以帮助患者处理患者疲乏等症状。(强烈推荐,证据等级中)
4.3.5 肝胆胰恶性肿瘤患者大部分会出现消化道症状,临床医生应该提供必要的药物和饮食建议,而且建议应尽量明确,确保患者能正确理解。(强烈推荐,证据等级弱)
4.3.6 谵妄在晚期肿瘤中发生率较高,临床医生应该提高谵妄的识别率,及时寻找谵妄发病诱因,控制症状。(强烈推荐,证据等级中)
4.3.7 肝癌患者可能需要接受肝动脉栓塞治疗或肝移植,临床医生应该在治疗前充分说明治疗后可能出现的并发症以及应对措施,减轻患者痛苦,并关注家属的焦虑和抑郁情绪,给予心理和信息支持。(强烈推荐,证据等级中)
5.恶性淋巴瘤
5.1 背景
2012年我国淋巴瘤发病率在所有肿瘤中排名第十一位,在女性肿瘤中排名第十;死亡率排到了第十位,女性患者死亡率排名第九位[1,97]。近年来的数据显示,霍奇金淋巴瘤的发病率呈下降趋势,而非霍奇金淋巴瘤的发病率逐步升高。我国的淋巴瘤发病年龄平均为47.6岁,尤
[124]其在年轻人肿瘤中所占的比例逐年升高 。目前,尽管对淋巴瘤的治疗已经取得了一些进步,生存率也有了提升,但恶性淋巴瘤及其治疗仍然带给患者巨大的痛苦,严重地影响患者的生活质量。由于存在诸多痛苦和困扰,这些患者在完成治疗之后也会存在许多支持照顾需求,如心理需求和担心复发,而绝大部分肿瘤患者的需求没有表达或者未得到满足,需求得不到表达或满足的因素主要有负面情绪以及经历不良生活事件等,其中男性患
[125,126]者表达心理痛苦的比例低于女性患者 。研究也提示部分患者可能会从针对性的心理治疗中获益,目前恶性淋巴瘤患者的心理痛苦识别率还非常低[126]。
5.2 证据
5.2.1 心理痛苦
有研究发现白血病或恶性淋巴瘤患者的中重度心理痛苦发病率(>65%)不低于其他常见的实体肿瘤患[127]者 ,国内研究者发现60%的淋巴瘤患者会出现焦虑或
[128]抑郁情绪 。姜愚等人使用心理痛苦温度计(distress thermometer)和医院焦虑抑郁量表(HADS)在恶性淋巴瘤患者中患者进行筛查,并对两种工具做了对比,发现DT在临床上使用更方便和更能被患者接受,并建议将DT在淋巴瘤患者中的临界值设为5(NCCN指南中建议全体恶性肿瘤人群的DT临界值为3或4)[128]。研究证实B症状(发热、盗汗和体重减轻)是引起淋巴瘤患者的心理痛苦非常重要的因素,及时有效的处理这些症状可以减轻心
[128,129]理痛苦,提高生活质量 。淋巴瘤侵犯到皮肤的患者也需要特别关注,其工作、生活和人际关系都会受到影响,比如夜间瘙痒严重时可能需要换一张单人床,对自己的外表形象不满意。给予社会支持和提供疾病相关信息会帮助患者减轻皮肤不适和人际交往困扰[130,131]。
5.2.2 生活质量下降
Oerlemans等人总结发现恶性淋巴瘤患者的生活质量下降有一定规律:霍奇金淋巴瘤患者的问题主要集中在躯体功能、社会功能和认知功能、整体健康、疲乏、经济负担,并且霍奇金淋巴瘤的治疗方案采用多联药物,这使得年长患者和女性患者的生活质量进一步降低;而非霍奇金淋巴瘤患者的问题主要是躯体功能、食欲丧失、经济
[132]负担和缺乏活力 。许多研究都证实生活质量的下降
[133,134]与化疗有关 ,但不同化疗方案之间没有发现该方面存在差异[135-137]。年轻患者的生活质量高低在情绪功能等方面要略差,但躯体功能相对于年长患者更好,同时也会受经济状况影响[138]。除此之外,男性、受教育程度高(大学以上)、有工作、癌龄长都是高生活质量的独立因素;而收入低、严重并发症、正在接受治疗、接受干细胞移植或生物治疗都是低生活质量的相关因素[138]。
5.2.3 慢性疲乏(chronic fatigue symptoms,CFS)
霍奇金淋巴瘤患者的慢性疲乏发生率为11%~76%(使用EORTC QLQ-C30或SF-36或FQ)[139],但可随治疗后的时间延长而逐步缓解[140,141],Ganz PA等人发现早期霍奇金淋巴瘤患者的慢性疲乏的程度从诊断后的6个月开始下降,约在诊断后2年时基本恢复到诊断之初的疲乏水平[142]。持续疲乏可以加重精神症状,并且增加身体的敏感性,甚至将压力内化成一种身体感觉[139,142]。MenshadiN等人在研究中指出医生或护士向非霍奇金淋巴瘤患者进行疾病和疲乏的知识教育可以减轻疲乏程度[143]。
5.2.4 情感或情绪反应
恶性淋巴瘤患者的焦虑和抑郁情绪发生率较高,约有60%的患者遭受不同程度情绪问题的困扰,其中焦虑最常见,其次为焦虑合并抑郁,而单纯的抑郁较少[142]。许多因素都可能诱发或加重焦虑或抑郁情绪,值得注意的是接受干扰素和类固醇激素治疗的恶性淋巴瘤患者中出现焦虑和抑郁的风险增加最大[130]。采取回避的方式来应对疾病的患者人群也表现出来了更高的焦虑和生活
[144]质量下降 。除了焦虑抑郁,患者还有许多担忧,如担心复发、对定期复查存在预期性焦虑、担心影响生育以及对未来缺少信心等[145]。
5.2.5 造血干细胞移植
造血干细胞移植(hematopoietic stem cell transplantation,HCT)已经成为治疗难治性恶性淋巴瘤的一项重要方法,但是仍然存在许多难题亟待解决,其中在心理社会方面也有许多问题值得探讨。研究证实,移植后的患者会出现明显的情感上的痛苦,其中最常出现的情绪反应是抑郁,并且主要集中在治疗后一年内,可随躯体症状好转而出现缓解[146,147]。有研究发现在长期生存(移植后时间平均7年)的移植患者中,仍然有许多问题困扰着患者,约有43%的患者在移植后1年以后仍存在许多心理社会痛苦,主要在躯体功能、心理社会适应、抑郁、疲乏、认知功能障碍、孤独感、记忆力下降等[148,149]。Syrjala KL等[150]试图找出抑郁等情绪困扰与生活质量下降之间的联系,他们在一项前瞻性队列研究中发现抑郁可能影响移植后的康复和预后,增加自我效能感、增加社会支持和改善抑郁能加快患者的康复。Stephens等在一项质性研究发现患者本人对于移植后的痛苦,反映最多的是医疗费用、身体和心理的适应问题和孤独感等,会感觉到移植前后“不是同一个人了”,医护人员应该了解这些“亲身体会”,以便提供相关的健康教育和治疗相关信息,让患者理解治疗过程以及治疗中、治疗后可能出现的反应或并发症,并告知应对措施(住院期间可以尝试音乐治疗[151],居家期
[152]间可以尝试一些个体康复锻炼 ),缓解患者及家属的
[153]焦虑和担忧 。
5.2.6 青少年及年轻成年人面临的特殊问题
由于淋巴瘤患者中年轻人比例大,尤其是霍奇金淋巴瘤中有相当一部分未成年患者(我国多见于10~15岁)或刚刚成年的患者,所以这部分患者有特殊之处,需要多加关注[154]。恶性淋巴瘤患儿在完全缓解早期(1年内),其生存质量在角色技能、社会技能等方面都显著低于一般患儿,可随康复时间延长得到改善,良好的社会支持可
[155]以帮助其度过这一困难时期 。约有76%的患病儿童对行为方面(日常生活中的功能执行等)的担心更多,而对认知和情感方面的担心较少[156]。恶性淋巴瘤的功能损伤并不仅限于幼小的儿童,对青少年以及年轻成年人(11~21岁)的影响同样明显,尤其是在神经认知、情绪功能,以及就业方面[157]。调查显示约有1/3的年轻白血病或恶性淋巴瘤患者达到了焦虑、抑郁或者创伤后应激障碍
[158]的诊断标准,但是这些问题很可能被忽略 。但年龄较小(18~35岁)的患者更能表现出积极的影响(健康意识、恶性肿瘤的意义、积极地自我评价),这一方面要好于年长患者;但在其他方面(负面影响、自我形象担忧等),两组人群未发现明显差别[159]。就业(重返工作或就业歧视)和经济收入也是部分年轻患者的困扰所在,经济负担很可能会影响其生活质量和心理状态[160]。
5.3 推荐意见
1.恶性淋巴瘤患者的心理痛苦程度较高,发生率较常见实体肿瘤更高,使用心理痛苦温度计测量时临界点可以设在5,而许多心理痛苦未能得到表达和纾解,临床医生应该关注并及时有效的处理患者的心理痛苦,以提高患者的生活质量。(强烈推荐,证据等级高)
2.虽然霍奇金淋巴瘤和非霍奇金淋巴瘤患者的生活质量下降方面会有所不同,但同时都受到了化疗的严重影响,其他因素如性别、年龄阶段、经济收入状况、受教育程度、是否正在接受生物治疗等也会对患者的生活质量产生影响,临床医生应该注意治疗的个体化。(强烈推荐,证据等级高)
3.慢性疲乏在恶性淋巴瘤患者中同样高发,但其随时间和治疗会出现缓解,临床医生应该提供必要的知识教育和信息,这可以帮助患者更好地应对这一困扰。(强烈推荐,证据等级中)
4.恶性淋巴瘤患者的情绪问题以焦虑为主,临床医生应该注意药物,尤其是生物制剂(如皮质醇激素、干扰素等)对情绪的影响,同时注意识别预期性的焦虑和担忧,并且应该予以积极关注和有效处理。(强烈推荐,证据等级高)
5.干细胞移植作为恶性淋巴瘤治疗的重要手段,其伴随的心理社会痛苦也需要给予更多关注和支持,主要包括抑郁、疲乏、适应障碍、孤独感、躯体功能和认知功能下降等。临床医生和护理人员应该给予充分的支持和信息提供,以便患者能更好地处理出现的心理社会痛苦。(强烈推荐,证据等级高)
6.淋巴瘤患者中年轻人较多,该年龄段的人群比老年患者面临更多问题,如就业、婚姻、生育、经济收入等问题,而年轻患者的学习和接受改变能力可能要更好。医疗工作者应该提供必要的心理教育和信息,这可以减轻患者的心理痛苦和不良情绪。(强烈推荐,证据等级中)
1.Chen WQ, Zheng RS, Baade PD, et al. Cancer statistics in China, 2015. CA CANCER J CLIN, 2016, 66: 115-132.
2.Leong SP, Shen ZZ, Liu TJ, et al. Is breast cancer the same disease in Asian and western countries? World J Surg, 2010, 34(10) : 2308-2324.
3.方琼英,吴琼,张秀玲,等.乳腺癌的流行现状分析.中国社会医学杂志,2012,29(5):333-335.
4.蒋丽红,刘西芳.乳腺癌患者抑郁情绪与应对方式的相关研究.中国临床心理学杂志,2007,20(8):652-653.
5.黄哲宙,吴春晓,郑莹.上海市社区女性乳腺癌患者抑郁和生活质量状况研究.中国恶性肿瘤杂志,2008,18(3):204-208.
6.庞英,Fischer I,KOCH M.乳腺癌患者的心身症状与生活质量.中国心理卫生杂志,2013,24(4):257-261.
7.胥刘秀,沈珊珊,何静静等.乳腺癌患者的身心症状与生活质量.中国心理卫生杂志,2013,27(4):257-261.
8.Lam WWT, Bonanno GA, Mancini AD et al. Trajectories of psychological distress among Chinese women diagnosed with breast cancer. Psycho-Oncology, 2009, 19: 1044-1051.
9.Lam WWT, Shing YT, Bonanno GA, et al. Distress trajectories at the first year diagnosis of breast cancer in relation to 6 years survivorship. Psycho-Oncology, 2012, 21: 90-99.
10.马玲.乳腺癌患者疼痛、相关症状与生活质量的调查研究.四川大学,2006.
11.Lam WWT, Chan M, KA HW, et al. Treatment decision difficulties and post-operativedistress predict persistence of psychological morbidity in Chinese women following breast cancer surgery. Psycho-Oncology, 2007, 16: 904–912.
12.Andrzejczak E, Markocka-Mączka K, Lewandowski A. Partner relationships after mastectomy in women not offered breast reconstruction. Psycho-Oncology, 2013, 22: 1653-1657.
13.Safarinejad MR, Shafiei N, Safarinejad S. Quality of life and sexual functioning in young women with early-stage breast cancer 1 year after lumpectomy. Psycho-Oncology, 2013, 22: 1242-1248.
14.Milbury K, Badr H. Sexual problems, communication patterns, and depressivesymptoms in couples coping with metastatic breast cancer. Psycho-Oncology, 2013, 22: 814–822.
15.赵茹,乔群,岳颍等.乳腺癌术后乳房缺损患者的心理调查.中华整形外科杂志,2003,19(4) :294-296.
16.仇晓霞.乳腺癌患者根治术后婚姻情感体验的质性研究.上海护理,2009,19(5):20-23.
17.Nano MT, Gill PG, Kollias J, et al. Psychological impact and cosmetic outcome of surgical breast cancer strategies. ANZ J Surg, 2005, 75(11): 940-947.
18.Yeo W, Kwan WH, Teo PM, et al. Psychosocial impact of breast cancer surgeries in Chinese patients and their spouses. Psycho-Oncology, 2004, 13(2): 132-139.
19.Paloma Gmez-Campelo, Carmen Bragado-vareza, Maria JosHernndez-Lloreda. Psychological distress in women with breast and gynecological cancer treated with radical surgery Psycho-Oncology, 2014, 23: 459-466.
20.张劲强,朱熊兆,唐利立等.中南大学学报(医学版),2014,39(1):73-77.
21.Koch L, Bertram H, Eberle A, et al. Fear of recurrence in longterm breast cancer survivors—still an issue. Results on prevalence, determinants, and the association with quality of life and depression from the Cancer Survivorship—a multi-regional populationbasedstudy. Psycho-Oncology, 2014, 23: 547-554.
22.Thewes B, Bell ML, Butow P, et al. Psychological morbidity and stress but not social factors influence level of fear of cancer recurrence in young women with early breast cancer: results of a cross-sectional study. Psycho-Oncology, 2013, 22: 2797-2806.
23.Howard-Anderson J, Ganz PA, Bower JE, et al. Quality of life, fertility concerns, and behavioral health outcomes in younger breast cancer survivors: a systematic review. Natl Cancer Inst, 2012, 104(5): 386-405.
24.Westphal L, Wapnir I. Integration and safety of fertility preservation in a breast cancer program Gynecol Oncol, 2012, 124: 474-476.
25.National Institute of Clinical Excellence. Fertility: Assessment and Treatment for People With Fertility Problems. NICE clinical guideline, 2013, 156.
26.Azim HA, Santoro L, Pavlidis N et al. Safety of pregnancy following breast cancer diagnosis: a meta- analysis of 14 studies. Eur J Cancer, 2010, 47: 74-83.
27.Wylie WY Li, Wendy WT Lam, Angel HY Au, et al. Interpreting differences in patterns of supportive care needs between patients with breast cancer and patients with colorectal cancer. Psycho-Oncology, 2013, 22: 792-798.
28.Chen W, Zheng R, Baade PD, et al. Cancer statistics in China, 2015. CA Cancer J Clin, 2016, 66(2): 115-132.
29.潘勇娜.化疗对消化系统肿瘤患者抑郁情绪的影响分析.见:张瑞星,主编.消化内科学,2015.
30.胡雁,Sellick K.消化道恶性肿瘤患者焦虑和抑郁及生命质量追踪调查.中国心理卫生杂志,2003(12).
31.胡全君.胃肠恶性肿瘤手术患者抑郁、焦虑状况及其影响因素的研究.见:周岩冰,主编.外科学,2012.
32.Custers JA, Tielen R, Prins JB, et al. Fear of progression in patients with gastrointestinal stromal tumors( GIST): Is extended lifetime related to the Sword of Damocles. Acta Oncol, 2015, 54(8): 1202-1208.
33.颜斐斐.术后结直肠癌患者癌因性疲乏与影响因素的研究.见:张立力,主编.护理学,2009.
34.陈志军,高亚丽.食管癌患者的情绪障碍分析.肿瘤基础与临床,2010(03):268-269.
35.陈卫銮,周纯华,陈楚君.食管癌患者放化疗后焦虑状况的调查分析.全科护理,2014(31):2885-2886.
36.吴晓丹,张美芬,张俊娥,等.食管癌术后化疗患者症状困扰与焦虑抑郁的相关性研究.护理学杂志,2013(06):72-75.
37.杨丽,孙晓旭.健康教育对食管癌患者术后生活质量和临床症状的影响.中国临床研究,2013(05):515-516.
38.李鹤飞,严保平,王海波,等.结构性心理干预对食管癌术后营养不良患者的影响.中华实用诊断与治疗杂志,2012(04):402-404.
39.王娇.食管癌放疗中对患者心理影响的评估.见:胡立宽,主编.肿瘤学,2010.
40.张宗卫,郭艳容,赵雷.胃癌高风险因素中社会心理因素的研究.中国社会医学,1988(01):19-22.
41.徐震雷,李心天,韩冰,等.人格特征对胃癌发病的影响.心理学报,1995(03):263-267.
42.王健,邹义壮,唐丽丽等.胃癌患者的生存期与个性特征、应付方式及免疫功能的相关性研究.中华精神科杂志,2001(03):172-175.
43.汪晓炜,汪萍,关泉林,等.胃癌患者C型行为特征及其与机体免疫指标相关性研究.细胞与分子免疫学杂志,2008(06):615-616.
44.解婧,于观贞,王杰军.胃癌患者抑郁相关基因的基因芯片研究和通路分析.临床肿瘤学杂志,2010(04):323-329.
45.王晓杰,郭增清,金晓薇.心理因素与胃癌患者康复的关系分析.中国肿瘤,2009(03):202-203.
46.张泓,袁莺,侯东泽,等.心理干预对胃癌患者焦虑和抑郁影响的Meta分析.护理与康复,2013(08).
47.洪士焱,何静静,裘华森.认知干预对胃癌患者术后抑郁、焦虑及失眠的疗效.医学研究杂志,2013( 12).
48.王亚朋,庞英,唐丽丽.团体心理治疗对胃癌患者生活质量及情绪状况的效果.中国心理卫生杂志,2013( 7).
49.赵咏梅.家庭有氧运动对胃癌患者负性情绪和生活质量的影响.中国肿瘤临床与康复,2014( 02):235-236.
50.张丽娜,李继平.结直肠癌术后患者抑郁和焦虑状况的调查研究.华西医学,2011(04):590-593.
51.仝太山,兰光华,唐小伟.结直肠癌术后化疗患者认知功能及相关影响因素分析.精神医学杂志.2015(06):429-432.
52.Wright P, Downing A, Morris EJ, et al. Identifying Social Distress: A Cross-Sectional Survey of Social Outcomes 12 to 36 Months After Colorectal Cancer Diagnosis. J Clin Oncol, 2015, 33(30): 3423-4330.
53.Schuurhuizen CS, Braamse AM, Beekman AT, et al. Screening and treatment of psychological distress in patients with metastatic colorectal cancer: study protocol of the TES trial. BMC Cancer, 2015, 15: 302.
54.Fitzmaurice C, Dicker D, Pain A, et al. The Global Burden of Cancer 2013. JAMA Oncol, 2015, 1(4): 505-527.
55.韩仁强,郑荣寿,张思维,等.1989—2008年中国肺癌发病性别、城乡差异及平均年龄趋势分析.中国肺癌杂志,2013,9.
56.Rohan EA, Boehm J, Allen KG, et al. In Their Own Words: A Qualitative Study of the Psychosocial Concerns of Post-treatment and Long-term Lung Cancer Survivors. J Psychosoc Oncol. 2016.
57.Domingues V, Albuquerque E. [Lung cancer: psychological and psychiatric aspects]. Rev Port Pneumol, 2008, 14(2): 261-269.
58.Li J, Girgis A. Supportive care needs: are patients with lung cancer a neglected population. Psycho-Oncology, 2006, 15(6): 509-516.
59.Uchitomi Y, Mikami I, Nagai K, et al. Depression and psychological distress in patients during the year after curative resection of non-small-cell lung cancer. J Clin Oncol, 2003, 21(1): 69-77.
60.Neron S, Correa JA, Dajczman E, et al. Screening for depressive symptoms in patients with unresectable lung cancer. Support Care Cancer, 2007, 15(10): 1207-1212.
61.Novotny P, Colligan RC, Szydlo DW, et al. A pessimistic explanatory style is prognostic for poor lung cancer survival. J Thorac Oncol, 2010, 5(3): 326-332.
62.Tanaka K, Akechi T, Okuyama T, et al. Factors correlated with dyspnea in advanced lung cancer patients: organic causes and what else. J Pain Symptom Manage, 2002, 23(6): 490-500.
63.Vena C, Parker K, Allen R, et al. Sleep-wake disturbances and quality of life in patients with advanced lung cancer. Oncol Nurs Forum, 2006, 33(4): 761-769.
64.Weiss T, Weinberger M, Schwerd AM, et al. A 30-year perspective on psychosocial issues in lung cancer: how lung cancer "Came out of the Closet". Thorac Surg Clin, 2012, 22(4): 449-456.
65.Basch E, Abernethy AP, Mullins CD, et al. Recommendations for incorporating patient-reported outcomes into clinical comparative effectiveness research in adult oncology. J Clin Oncol, 2012, 30(34): 4249-4255.
66.. Ediebah DE, Coens C, Zikos E, et al. Does change in healthrelated quality of life score predict survival? Analysis of EORTC 08975 lung cancer trial. Br J Cancer, 201, 110(10): 2427-2433.
67.Cooley ME, Short TH, Moriarty HJ. Symptom prevalence, distress, and change over time in adults receiving treatment for lung cancer. Psycho-Oncology, 2003, 12(7): 694-708.
68.Wang XS, Fairclough DL, Liao Z, et al. Longitudinal study of the relationship between chemoradiation therapy for non-small-cell lung cancer and patient symptoms. J Clin Oncol, 2006, 24(27): 448.
69.Temel JS, Greer JA, Muzikansky A, et al. Early palliative care for patients with metastatic non-small-cell lung cancer. N Engl J Med. 2010. 363(8): 733-742.
70.Graves KD, Arnold SM, Love CL, et al. Distress screening in a multidisciplinary lung cancer clinic: prevalence and predictors of clinically significant distress. Lung Cancer, 2007, 55(2): 215-224.
71.Walker J, Hansen CH, Martin P, et al. Prevalence, associations, and adequacy of treatment of major depression in patients with cancer: a cross-sectional analysis of routinely collected clinical data. Lancet Psychiatry, 2014, 1(5): 343-350.
72.Hong JS, Tian J. Prevalence of anxiety and depression and their risk factors in Chinese cancer patients. Support Care Cancer, 2014, 22(2): 453-459.
73.Uchitomi Y, Mikami I, Nagai K, et al. Depression and psychological distress in patients during the year after curative resection of nonsmall-cell lung cancer. J Clin Oncol, 2003, 21(1): 69-77.
74.Misono S, Weiss NS, Fann JR, et al. Incidence of suicide in persons with cancer. J Clin Oncol, 2008, 26(29): 4731-4738.
75.Sharpe M, Walker J, Holm HC, et al. Integrated collaborative care for comorbid major depression in patients with cancer( SMaRT Oncology-2): a multicentre randomised controlled effectiveness trial. Lancet, 2014, 384(9948): 1099-1108.
76.Walker J, Hansen CH, Martin P, et al. Integrated collaborative care for major depression comorbid with a poor prognosis cancer(SMaRT Oncology-3): a multicentre randomised controlled trial in patients with lung cancer. Lancet Oncol, 2014, 15(10): 1168-1176.
77.Li JJ, Pang Y, Tang LL. An open controlled study of group psychotherapy on quality od life and mood in patients with lung cancer. Chinese Mental Health Journal, 2014, 28(9): 657-662.
78.Chambers SK, Dunn J, Occhipinti S, et al. A systematic review of the impact of stigma and nihilism on lung cancer outcomes. BMC Cancer. 2012. 12: 184.
79.Major B, O'Brien LT. The social psychology of stigma. Annu Rev Psychol, 2005, 56: 393-421.
80.Heijnders M, Van Der Meij S. The fight against stigma: an overview of stigma-reduction strategies and interventions. Psychol Health Med, 2006, 11(3): 353-363.
81.Chambers SK, Morris BA, Clutton S, et al. Psychological wellness and health-related stigma: a pilot study of an acceptance-focused cognitive behavioural intervention for people with lung cancer. Eur J Cancer Care, 2015, 24(1): 60-70.
82.Walker MS, Vidrine DJ, Gritz ER, et al. Smoking relapse during the first year after treatment for early-stage non-small-cell lung cancer. Cancer Epidemiol Biomarkers Prev, 2006, 15(12): 2370-2377.
83.Zeng L, Yu X, Yu T, et al. Interventions for smoking cessation in people diagnosed with lung cancer. Cochrane Database Syst Rev, 2015, 12: 011751.
84.刘红丽,叶志华,彭玲霞,等.护理干预对肺癌吸烟患者戒烟的影响.护理管理杂志,2010,7.
85.Warren GW, Dibaj S, Hutson A, et al. Identifying Targeted Strategies to Improve Smoking Cessation Support for Cancer Patients. J Thorac Oncol, 2015, 10(11): 1532-1537.
86.Taniguchi C, Sakakibara H, Saka H, et al. Japanese Nurses' Perceptions Toward Tobacco Use Intervention for Hospitalized Cancer Patients Who Entered End of Life. Cancer Nurs, 2016.
87.Randomised trial of four-drug vs less intensive two-drug chemotherapy in the palliative treatment of patients with smallcell lung cancer( SCLC) and poor prognosis. Medical Research Council Lung Cancer Working Party. Br J Cancer, 1996, 73(3): 406-413.
88.Ahles TA, Silberfarb PM, Rundle AC, et al. Quality of life in patients with limited small-cell carcinoma of the lung receiving chemotherapy with or without radiation therapy, for cancer and leukemia group B. Psychother Psychosom, 1994, 62(3-4): 193-199.
89.Hopwood P, Stephens RJ. Depression in patients with lung cancer: prevalence and risk factors derived from quality-of-life data. J Clin Oncol, 2000, 8(4): 893-903.
90.Hurny C, Bernhard J, Joss R, et al. "Fatigue and malaise" as a quality-of-life indicator in small-cell lung cancer patients. The Swiss Group for Clinical Cancer Research( SAKK). Support Care Cancer, 1993, 1(6): 316-320.
91.Luo X, Yuan L, Wang Y, et al. Survival outcomes and prognostic factors of surgical therapy for all potentially resectable intrahepatic cholangiocarcinoma: a large single-center cohort study. J Gastrointest Surg. 2014, 18(3): 562-572.
92.Zhang H, Yang T, Wu M, et al. Intrahepatic cholangiocarcinoma: Epidemiology, risk factors, diagnosis and surgical management. Cancer Lett. 2015.
93.Aljiffry M, Abdulelah A, Walsh M, et al. Evidence-based approach to cholangiocarcinoma: a systematic review of the current literature. J Am Coll Surg. 2009, 208(1): 134-147.
94.Zhu AX, Hong TS, Hezel AF, et al. Current management of gallbladder carcinoma. Oncologist. 2010, 15(2): 168-181.
95.Kanthan R, Senger JL, Ahmed S, et al. Gallbladder Cancer in the 21st Century. J Oncol. 2015: 967472.
96.陈万青,郑荣寿,张思维等.2012年中国恶性肿瘤发病和死亡分析.中国肿瘤.2016( 01).
97.Kissane DW. Demoralization: a life-preserving diagnosis to make for the severely medically ill. J Palliat Care. 2014, 30(4): 255-258.
98.Clarke DM, Kissane DW. Demoralization: its phenomenology and importance. Aust N Z J Psychiatry. 2002, 36(6): 733-742.
99.唐丹华,白亚娜,胡晓斌等.农村居民常见肿瘤直接经济负担趋势的调查分析.中国全科医学.2012( 4).
100.段娇博,付菊芳,宋汉歌等.原发性肝癌患者的需求评估研究.护理研究.2011( 24).
101.Bai M, Reynolds NR, McCorkle R. The promise of clinical interventions for hepatocellular carcinoma from the west to mainland China. Palliat Support Care. 2013, 11(6): 503-522.
102.Alter CL. Palliative and supportive care of patients with pancreatic cancer. Semin Oncol. 1996, 23(2): 229-240.
103.Kuchler T, Bestmann B, Rappat S, et al. Impact of psychotherapeutic support for patients with gastrointestinal cancer undergoing surgery: 10-year survival results of a randomized trial. J Clin Oncol. 2007, 25(19): 2702-2708.
104.邹建军,郑莹,曹传武等.疼痛对恶性肿瘤患者抑郁和生活质量影响的研究.恶性肿瘤进展.2004( 5).
105.聂鋆,刘淑俊,邸立军等.癌痛及其对恶性肿瘤患者生活质量影响的调查.中华肿瘤杂志.2000(5).
106.Sugimoto H, Kawashima H, Ohno E, et al. The prognostic factors and trajectory of HRQOL in patients with pancreatic cancer who received psychiatric intervention. J Gastroenterol Hepatol. 2015 .
107.Jia L, Jiang SM, Shang YY, et al. Investigation of the incidence of pancreatic cancer-related depression and its relationship with the quality of life of patients. Digestion. 2010, 82(1): 4-9.
108.Boyd AD, Brown D, Henrickson C, et al. Screening for depression, sleep-related disturbances, and anxiety in patients with adenocarcinoma of the pancreas: a preliminary study. ScientificWorldJournal. 2012: 650707.
109.Petzel MQ, Parker NH, Valentine AD, et al. Fear of cancer recurrence after curative pancreatectomy: a cross-sectional study in survivors of pancreatic and periampullary tumors. Ann Surg Oncol. 2012, 19(13): 4078-4084.
110.Breitbart W, Rosenfeld B, Tobias K, et al. Depression, cytokines, and pancreatic cancer. Psycho-Oncology. 2014, 23(3): 339-345.
111.谭益冰,张美芬,张俊娥.原发性肝癌经皮肝动脉化疗栓塞术后疲乏及其影响因素调查.护理学杂志.2010( 15).
112.Lai YH, Shun SC, Hsiao YL, et al. Fatigue experiences in hepatocellular carcinoma patients during six weeks of stereotactic radiotherapy. Oncologist. 2007, 12(2): 221-230.
113.Clark KL, Loscalzo M, Trask PC, et al. Psychological distress in patients with pancreatic cancer-an understudied group. Psycho-Oncology. 2010, 19(12): 1313-1320.
114.Gooden HM, White KJ. Pancreatic cancer and supportive carepancreatic exocrine insufficiency negatively impacts on quality of life. Support Care Cancer. 2013, 21(7): 1835-1841.
115.Ravasco P, Monteiro-Grillo I, Camilo ME. Does nutrition influence quality of life in cancer patients undergoing radiotherapy. Radiother Oncol. 2003, 67(2): 213-220.
116.Dutta U. Gallbladder cancer: can newer insights improve the outcome. J Gastroenterol Hepatol. 2012, 27(4): 642-653.
117.Senel G, Uysal N, Oguz G, et al. Delirium Frequency and Risk Factors Among Patients With Cancer in Palliative Care Unit. Am J Hosp Palliat Care. 2015 .
118.Li CF, Feng SH, Chien LY. [Relationship Between Symptom Distress and Fatigue in Hepatocellular Carcinoma Patients Who Received Transcatheter Arterial Embolization]. Hu Li Za Zhi. 2015, 62(3): 57-65.
119.Cao W, Li J, Hu C, et al. Symptom clusters and symptom interference of HCC patients undergoing TACE: a cross-sectional study in China. Support Care Cancer. 2013. 21(2): 475-483.
120.Wang ZX, Liu SL, Sun CH, et al. Psychological intervention reduces postembolization pain during hepatic arterial chemoembolization therapy: a complementary approach to drug analgesia. World J Gastroenterol. 2008. 14(6): 931-935.
121.金凤娟.音乐放松疗法对肝癌经导管动脉化疗栓塞术后综合征及焦虑心理的影响效果研究.见:赵岳,主编.护理学.2012.
122.陈纯柳.音乐疗法对肝癌介入术后患者腹痛、恶心、呕吐的影响.齐鲁护理杂志,2007( 22).
123.Malik P, Kohl C, Holzner B, et al. Distress in primary caregivers and patients listed for liver transplantation. Psychiatry Res, 2014, 215(1): 159-162.
124.Birch JM, Alston RD, Quinn M, Kelsey AM. Incidence of malignant disease by morphological type, in young persons aged 12-24 years in England, 1979-1997. Eur J Cancer, 2003, 39(18): 2622-2631.
125.Arden-Close E, Absolom K, Greenfield DM, et al. Gender differences in self-reported late effects, quality of life and satisfaction with clinic in survivors of lymphoma. Psychooncology, 2011, 20(11): 1202-1210.
126.Armes J, Crowe M, Colbourne L, et al. Patients' supportive care needs beyond the end of cancer treatment: a prospective, longitudinal survey. J Clin Oncol, 2009, 27(36): 6172-6179.
127.Montgomery C, Pocock M, Titley K, et al. Predicting psychological distress in patients with leukaemia and lymphoma. J Psychosom Res, 2003, 54(4): 289-292.
128.Wang Y, Zou L, Jiang M, et al. Measurement of distress in Chinese inpatients with lymphoma. Psycho-Oncology, 2013, 22(7): 1581-1586.
129.Loge JH, Abrahamsen AF, Ekeberg O, et al. Psychological distress after cancer cure: a survey of 459 Hodgkin's disease survivors. Br J Cancer, 1997, 76(6): 791-796.
130.Sampogna F, Frontani M, Baliva G, et al. Quality of life and psychological distress in patients with cutaneous lymphoma. Br J Dermatol, 2009, 160(4): 815-822.
131.Beynon T, Selman L, Radcliffe E, et al. We had to change to single beds because I itch in the night: a qualitative study of the experiences, attitudes and approaches to coping of patients with cutaneous T-cell lymphoma. Br J Dermatol, 2015, 173(1): 83-92.
132.Oerlemans S, Mols F, Nijziel MR, et al. The impact of treatment socio-demographic and clinical characteristics on health-related quality of life among Hodgkin's and non-Hodgkin's lymphoma survivors: a systematic review. Ann Hematol, 2011, 90(9): 993-1004.
133.Mols F, Aaronson NK, Vingerhoets AJ, et al. Quality of life among long-term non-Hodgkin lymphoma survivors: a populationbased study. Cancer, 2007, 109(8): 1659-1667.
134.Pettengell R, Donatti C, Hoskin P, et al. The impact of follicular lymphoma on health-related quality of life. Ann Oncol, 2008, 19(3): 570-576.
135.Jerkeman M, Kaasa S, Hjermstad M, et al. Health-related quality of life and its potential prognostic implications in patients with aggressive lymphoma: a Nordic Lymphoma Group Trial. Med Oncol, 2001, 18(1): 85-94.
136.Doorduijn J, Buijt I, Holt B, et al. Self-reported quality of life in elderly patients with aggressive non-Hodgkin's lymphoma treated with CHOP chemotherapy. Eur J Haematol, 2005, 75(2): 116-123.
137.Merli F, Bertini M, Luminari S, et al. Quality of life assessment in elderly patients with aggressive non-Hodgkin's Lymphoma treated with anthracycline-containing regimens. Report of a prospective study by the Intergruppo Italiano Linfomi. Haematologica, 2004, 89(8): 973-978.
138.Leak A, Smith SK, Crandell J, et al. Demographic and disease characteristics associated with non-hodgkin lymphoma survivors' quality of life: does age matter. Oncol Nurs Forum, 2013, 40(2): 157-162.
139.Daniels LA, Oerlemans S, Krol AD, et al. Persisting fatigue in Hodgkin lymphoma survivors: a systematic review. Ann Hematol, 2013, 92(8): 1023-1032.
140.Ganz PA, Moinpour CM, Pauler DK, et al. Health status and quality of life in patients with early-stage Hodgkin's disease treated on Southwest Oncology Group Study 9133. J Clin Oncol, 2003, 21(18): 3512-3519.
141.Heutte N, Flechtner HH, Mounier N, et al. Quality of life after successful treatment of early-stage Hodgkin's lymphoma: 10-year follow-up of the EORTC-GELA H8 randomised controlled trial. Lancet Oncol, 2009, 10(12): 1160-1170.
142.Loge JH, Abrahamsen AF, Ekeberg, et al. Fatigue and psychiatric morbidity among Hodgkin's disease survivors. J Pain Symptom Manage, 2000, 19(2): 91-99.
143.Menshadi N, Bar-Tal Y, Barnoy S. The relationship between learned resourcefulness and cancer-related fatigue in patients with non-Hodgkin lymphoma. Oncol Nurs Forum, 2013, 40(2): 133-138.
144.Wagner LI, Zhao F, Hong F, et al. Anxiety and health-related quality of life among patients with low-tumor burden non-Hodgkin lymphoma randomly assigned to two different rituximab dosing regimens: results from ECOG trial E4402( RESORT). J Clin Oncol, 2015, 33(7): 740-748.
145.Jones WC, Parry C, Devine S, et al. Understanding distress in posttreatment adult leukemia and lymphoma survivors: a lifespan perspective. J Psychosoc Oncol, 2015, 33(2): 142-162.
146.Syrjala KL, Langer S, Abrams J, et al. Physical and mental recovery after hematopoietic stem cell transplantation. Discov Med, 2004, 4(23): 263-269.
147.Hjermstad MJ, Loge JH, Evensen SA, et al. The course of anxiety and depression during the first year after allogeneic or autologous stem cell transplantation. Bone Marrow Transplant, 1999, 24(11): 1219-1228.
148.Andrykowski MA, Bishop MM, Hahn EA, et al. Long-term health-related quality of life, growth, and spiritual well-being after hematopoietic stem-cell transplantation. J Clin Oncol, 2005, 23(3): 599-608.
149.Rusiewicz A, DuHamel KN, Burkhalter J, et al. Psychological distress in long-term survivors of hematopoietic stem cell transplantation. Psycho-Oncology, 2008, 17(4): 329-337.
150.Syrjala KL, Langer SL, Abrams JR, et al. Recovery and long-term function after hematopoietic cell transplantation for leukemia or lymphoma. JAMA. 2004. 291(19): 2335-2343.
151.Cassileth BR, Vickers AJ, Magill LA. Music therapy for mood disturbance during hospitalization for autologous stem cell transplantation: a randomized controlled trial. Cancer. 2003. 98(12): 2723-2729.
152.Carlson LE, Smith D, Russell J, et al. Individualized exercise program for the treatment of severe fatigue in patients after allogeneic hematopoietic stem-cell transplant: a pilot study. Bone Marrow Transplant. 2006. 37(10): 945-954.
153.Stephens M. The lived experience post-autologous haematopoietic stem cell transplant( HSCT): a phenomenological study. Eur J Oncol Nurs. 2005. 9(3): 204-15.
154.黄欣,高子芬.儿童霍奇金淋巴瘤流行病学及病理学特点.中国小儿血液与肿瘤杂志.2014( 03).
155.樊志明,郭伟雄.恶性淋巴瘤长期生存患儿生存质量调查.华南国防医学杂志.2007( 04).
156.Kahalley LS, Wilson SJ, Tyc VL, et al. Are the psychological needs of adolescent survivors of pediatric cancer adequately identified and treated. Psychooncology. 2013. 22(2): 447-458.
157.Prasad PK, Hardy KK, Zhang N, et al. Psychosocial and Neurocognitive Outcomes in Adult Survivors of Adolescent and Early Young Adult Cancer: A Report From the Childhood Cancer Survivor Study. J Clin Oncol, 2015, 33(23): 2545-2552.
158.Muffly LS, Hlubocky FJ, Khan N, et al. Psychological morbidities in adolescent and young adult blood cancer patients during curative-intent therapy and early survivorship, Cancer, 2016.
159.Drost FM, Mols F, Kaal SE, et al. Psychological impact of lymphoma on adolescents and young adults: not a matter of black or white. J Cancer Surviv, 2016.
160.Kent EE, Sender LS, Morris RA, et al. Multilevel socioeconomic effects on quality of life in adolescent and young adult survivors of leukemia and lymphoma. Qual Life Res, 2013, 22(6): 1339-1351.