 去看看
去看看


1 前言
动脉硬化性心血管疾病(atherosclerotic cardiovascular disease,ASCVD)包括冠状动脉粥样硬化性心脏病(冠心病)、脑卒中以及其他周围血管病,是目前全球范围内疾病死亡的首位原因。在我国,随着城镇化的进展和生活水平的提高,这一疾病在我国的发病率和死亡率呈逐年上升趋势[1-2]。血脂代谢异常是ASCVD的重要致病因素。我国普通人群的研究表明,血清总胆固醇(total cholesterol,TC)和低密度脂蛋白胆固醇(low density lipoprotein cholesterol,LDL-C)升高是冠心病和缺血性脑卒中发病的独立危险因素之一[3-4]。
实体器官移植(solid organ transplantation,SOT)受者因其治疗的特殊性,是发生高脂血症的高危人群。另一方面,随着外科技术以及抗排斥和其他相关药物的不断完善,肾脏、心脏和肝脏等实体器官移植受者的长期存活率有了显著的提高,ASCVD已经成为移植器官衰竭和受者死亡的主要原因之一[5]。
数据显示,肾移植术后血脂异常的发生率高达80%[6]。主要表现为TC、LDL-C和甘油三酯(triglyceride,TG)均升高。与此相关,ASCVD已经取代急性排斥反应成为移植肾功能丧失和受者死亡的首要原因[5,7-8]。
与肾移植不同,肝病复发和慢性排斥反应是移植肝衰竭和受者死亡的主要原因[9-10]。但ASCVD也正逐渐成为非移植物相关死亡的重要原因,在老年受者中尤其明显。首先是受者的生存期延长、功能状态改善后,重新回归社会生活,健康生活方式制约力减弱,出现了体质量增加、胰岛素抵抗等与ASCVD密切相关的病症[11]。另外,接受肝移植的患者几乎都存在不同程度的代谢障碍,血脂异常发生率高达40%~66%[12]。
移植心脏血管病变(cardiac allograft vasculopathy,CAV)是心脏移植术后3~5年的主要死亡原因[13]。CAV是慢性排斥反应的表现之一,主要特征是冠状动脉大血管和毛细血管平滑肌增生导致的血管连续性狭窄,与粥样斑块的孤立性狭窄有显著的形态学差异。免疫因素是CAV发病的主导因素,而高脂血症则是重要的非免疫因素[14-15]。
目前,国内仍然缺乏器官移植受者人群血脂代谢的大规模、多中心、前瞻性、随机化流行病学研究。国际上,2004年美国发布了《肾移植受者血脂代谢障碍临床实践指南》。结合2007年国家卫生部发布的《中国成人血脂异常防治指南》,我国于2008年发布了《器官移植术后高脂血症临床诊疗指南》。此后较有影响力的指南包括:2011年欧洲卒中会议(European Stroke Council,ESC)和欧洲动脉粥样硬化协会(European Atherosclerosis Society,EAS)发布的《欧洲血脂异常管理指南》[16],2013年美国心脏学院(American College of Cardiology,ACC)和美国心脏病协会(American Heart Association,AHA)发布的《成人血脂治疗降低动脉粥样硬化心血管病风险指南》[17]。然而,上述文献均缺乏针对器官移植受者的建议。本版指南作为2008版指南的更新,总结了最新的临床证据和实践理念,旨在进一步提高临床工作质量,改善患者预后。
本指南中所涉及的诊断和治疗策略绝大部分有循证医学证据支持。根据循证医学证据的质量等级标准分为:1级为多个随机对照试验(randomized controlled trial,RCT)的系统综述,2级为单个随机对照试验,3级为单个队列试验或病例对照试验;4级为多个非试验性研究、专家意见、描述性研究。本指南中的推荐意见的推荐等级分为:A级为高质量循证医学证据支持;B级为中等质量循证医学证据支持;C级为低质量循证医学证据支持,或该治疗的不良反应大于其疗效,D级为中等质量循证医学证据反对;E级为高质量循证医学证据反对。
2 实体器官移植受者血脂异常相关心血管疾病的发病因素
发病因素主要分为普通人群共有因素、移植相关因素和其他继发性因素。
2.1 普通人群共有因素
包括高血压(血压≥140/90mmHg,或接受降压药物治疗,10mmHg=1.33kPa)、糖尿病、肥胖[体质量指数(body mass index,BMI)≥28kg/m2]、吸烟、年龄(男性≥45岁,女性≥55岁)、性别、激素替代治疗、饮食习惯、遗传因素、冠心病或其他ASCVD家族史,尤其是直系亲属中有早发冠心病或其他ASCVD疾病者(男性一级亲属发病时<55岁,女性一级亲属发病时<65岁)、皮肤黄色瘤和家族性高脂血症者[1,18]。接受器官移植者可同时具有这些因素,而移植技术的进步也允许更高龄的患者接受手术,因此这些因素有普遍化的趋势。
2.2 移植相关因素
免疫抑制剂的应用对脂质代谢通路发生改变和修饰,导致不同程度的TC和TG升高,并具有剂量相关性。此外,免疫抑制剂也可导致高血压、新发糖尿病等代谢异常,进一步增加ASCVD的风险(表1)[19-21]。临床常用的免疫抑制剂包括糖皮质激素、钙神经蛋白抑制剂(calcineurin inhibitor,CNI,环孢素和他克莫司)、哺乳动物雷帕霉素靶蛋白抑制剂(mammalian target of rapamycin inhibitor,mTORi,西罗莫司和伊维莫司)。这些药物对血脂的影响参见表2[19,22-25]。
表1 免疫抑制剂对心血管危险因素的影响
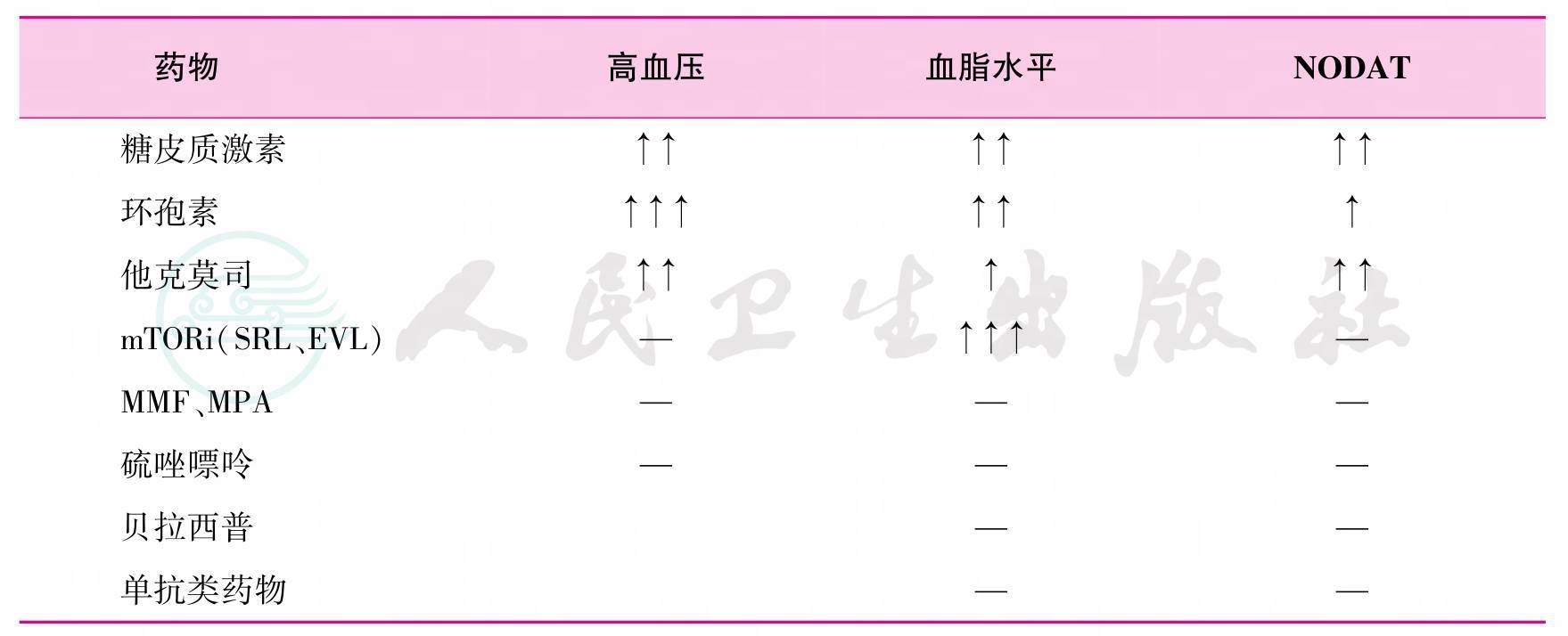
注:NODAT指移植后新发糖尿病;mTORi指哺乳动物雷帕霉素靶蛋白抑制剂;SRL指西罗莫司;EVL指依维莫司;MMF指吗替麦考酚酸酯;MPA指霉酚酸酯。↑代表增加风险,箭头数量代表影响的大小;—代表无影响
表2 临床常用免疫抑制剂对血脂的影响
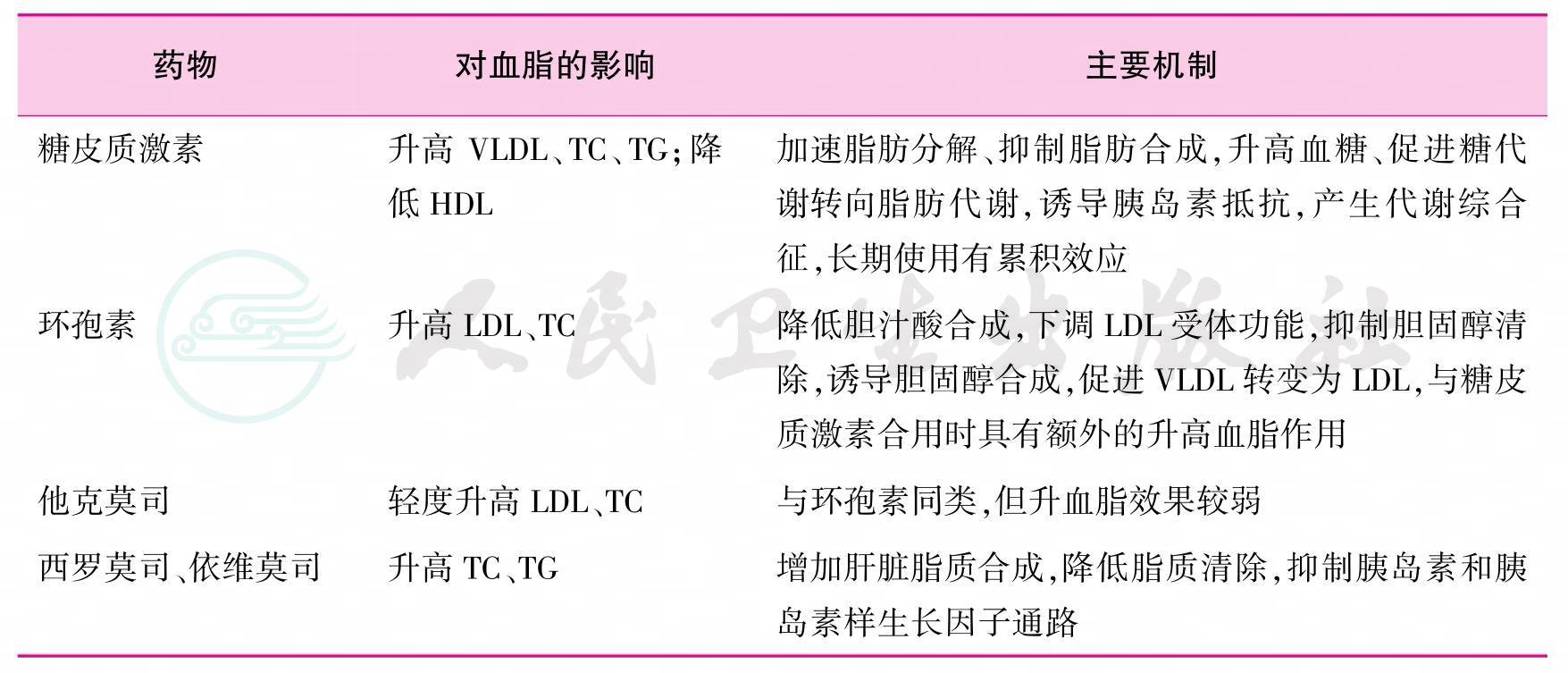
注:HDL为高密度脂蛋白;LDL为低密度脂蛋白;TC为总胆固醇;TG为甘油三酯;VLDL为极低密度脂蛋白
2.3 其他继发性因素
升高LDL-C的药物有:某些孕激素、合成代谢类固醇、达那唑、异维A酸、免疫抑制剂(环孢素)、胺碘酮、噻嗪类利尿药、糖皮质激素、噻唑烷二酮(胰岛素增敏剂)、苯氧酸(可引起严重的高甘油三酯血症)、长链ω-3脂肪酸(在严重高胆固醇血症中,如果包含十二碳六烯酸)[1,26-27]。
升高TG药物有:口服雌激素、他莫昔芬、雷洛昔芬、维A酸、免疫抑制剂(环孢素、西罗莫司)、干扰素、β受体拮抗药(特别是非-β1选择性药物)、非典型抗精神病药(fluperlapine,氯氮平,奥氮平)、蛋白酶抑制剂、噻嗪类利尿药、糖皮质激素、罗格列酮、胆汁酸多价螯合剂、左旋门冬酰胺酶、环磷酰胺[1,26-27]。
3 移植术后血脂代谢异常的确定和危险分层
3.1 血脂的监测方法
接受器官移植手术的患者应在术前和术后常规监测血脂水平并详细记录备案。同时分析全面的病史和联合用药记录,以利于排查潜在的继发性因素。
推荐意见:
1.对于肾移植受者,血脂代谢异常最早可发生在术后3个月内,术后6~9个月高脂血症达到发病最高峰,因此应从围手术期开始监测血脂水平,终末期CKD接受透析治疗者,应在透析前监测血脂水平。术后前6个月应每月复查;6~12个月应根据代谢异常程度和治疗情况每1~3个月复查血脂情况,同时检查尿蛋白;随后每年至少检查1次。其他器官移植受体也可参照这一标准进行血脂检查(1-A)。
2.接受器官移植手术者血脂检测内容应包括TC、LDL-C、HDL-C和TG。它们可作为评估ASCVD风险的参考指标(1-A)。
3.有条件的受者和严重血脂异常的受者,应进一步进行详细的脂蛋白分类检测(2-B)。
3.2 血脂水平的评估检测
器官移植后的血脂代谢特点使移植受者成为ASCVD的高危人群。因此,相对于普通人群,器官移植受者应采取更严格的控制标准。治疗前的血脂异常危险因素评估是制定治疗方案和目标的基础和依据。
推荐意见:
4.参照2007年《中国成人血脂异常防治指南》,器官移植受者的血脂水平分层方案总结如表3所示[1,28](未分级)。
表3 移植受者的血脂代谢参考标准及分层方案
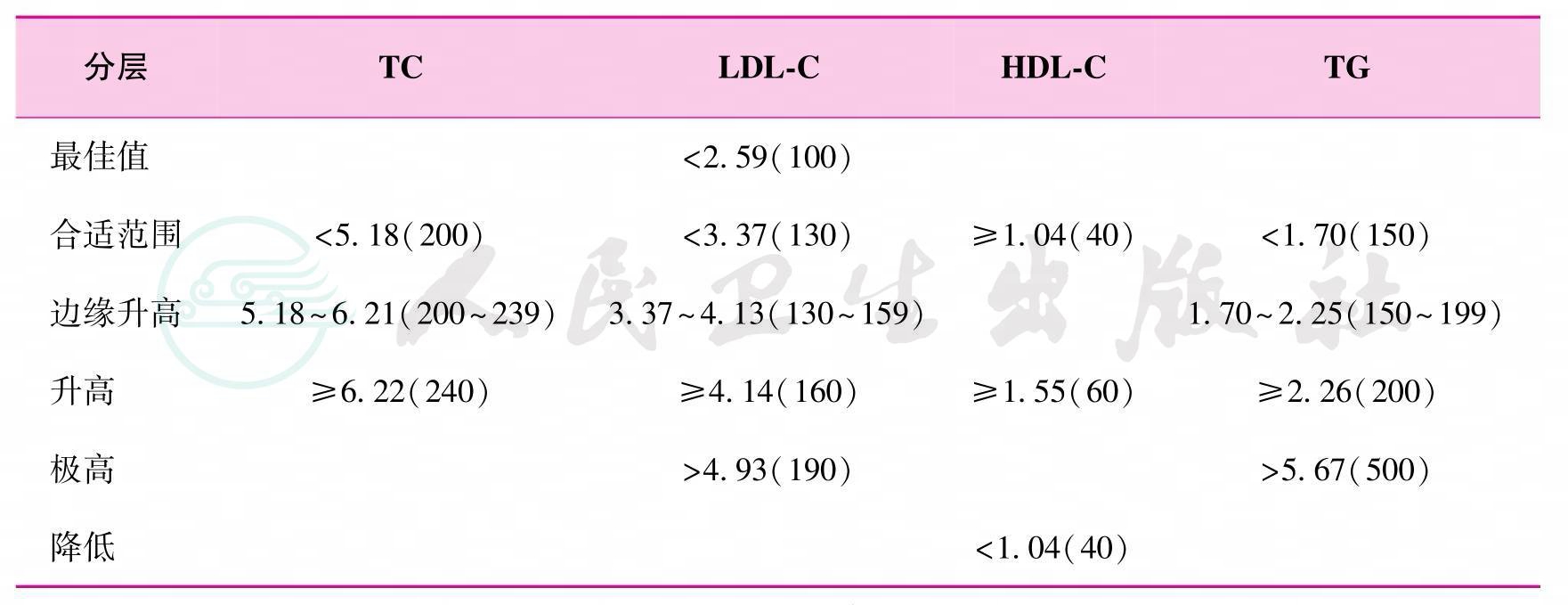
注:TC为总胆固醇;LDL-C为低密度脂蛋白胆固醇;HDL-C为高密度脂蛋白胆固醇;TG为甘油三酯
5.LDL-C可作为调脂治疗的主要目标。TC、TG和HDL-C可以作为次级目标(未分级)。
3.3 移植术后血脂异常危险因素评估和分层
移植术后血脂代谢异常危险因素的评估是指导制订治疗方案的第2个重要部分,旨在积极寻找导致继发性脂质代谢异常的因素,根据这些因素的等级和数量,对患者进行危险程度分层,以决定治疗的目标和强度。
移植术后血脂异常危险因素评估步骤如下:
(1)明确并存疾病的数量和程度:如器官移植、冠心病及等危险因素症或动脉粥样硬化、高血压、糖尿病等。
(2)明确导致继发性高血脂的医学因素:如接受激素替代及免疫抑制剂治疗、移植物功能不全、蛋白尿(尤其是24h尿蛋白定量>3g时)。
(3)明确是否存在明显代谢异常因素:如肥胖、BMI超标等代谢综合征。
(4)明确是否有家族性高脂血症和直系亲属中有早发冠心病或其他动脉粥样硬化性血管疾病史。
(5)明确是否存在移植后新发或复发的肾病综合征。
(6)明确是否存在其他药物因素。
推荐意见:
6.根据血脂指标和影响脂质代谢的继发性因素,对患者发生ASCVD的风险进行分层,以利于病情分析和患者管理。根据这些评估结果,对危险因素进行量化,将移植术后发生ASCVD的风险分为低危、中危、高危3层。参见表4[1,28]。(1-B)。
表4 移植术后血脂异常危险分层

注:其他危险因素包括:器官移植;蛋白尿≥3g/24h;血压≥140/90mmHg或接受降压治疗;吸烟;肥胖(BMI≥28kg/m2);低HDL-C水平(<1.04mmol/L);年龄(男性≥45岁,女性≥55岁);早发性ASCVD家族史(男性一级亲属发病时<55岁,女性一级亲属发病时<65岁)。冠心病等危险因素包括:有临床表现的冠状动脉以外的动脉粥样硬化,包括脑血管和周围动脉疾病;糖尿病;有多种发生冠状动脉疾病的危险因素,其风险相当于已确诊冠心病;代谢综合征。代谢综合征的诊断标准,符合以下的3项或更多,包括BMI≥25kg/m2,TG≥1.70mmol/L,血HDL-C男性<0.91mmol/L、女性<1.01mmol/L,血压≥140/90mmHg,空腹血糖≥6.1mmol/L、餐后2h血糖7.8mmol/L或有糖尿病史
4 移植术后血脂代谢异常的预防和治疗
4.1 预防策略
推荐意见:
7.对危险分层中没有血脂代谢异常的受者进行预防知识的宣传教育,内容包括饮食、运动指导、改变不良生活方式和嗜好(1-A)。
8.要求受者戒烟、限制饮酒量、计算BMI范围并要求控制体重,同时定期监测血脂水平(1-A)。
9.建议受者开始以治疗为目的改变生活方式(therapeutic life-style change,TLC)(1-A)。
10.对已经开始调脂治疗并有效的受者,仍然需要坚持TLC以预防病情反复和加重(1-B)。
4.2 治疗策略
全面评估器官移植受者的血脂水平和移植术后血脂代谢异常危险因素,制订个体化的血脂管理策略。药物治疗首先要考虑受者的安全性及其对移植物的影响。
推荐意见:
11.首先采用非药物治疗,包括控制饮食和改变生活方式(1-B)。
12.采取积极非药物治疗3~6个月仍不能见效者,要根据危险分层制定药物治疗方案和目标(1-B)。
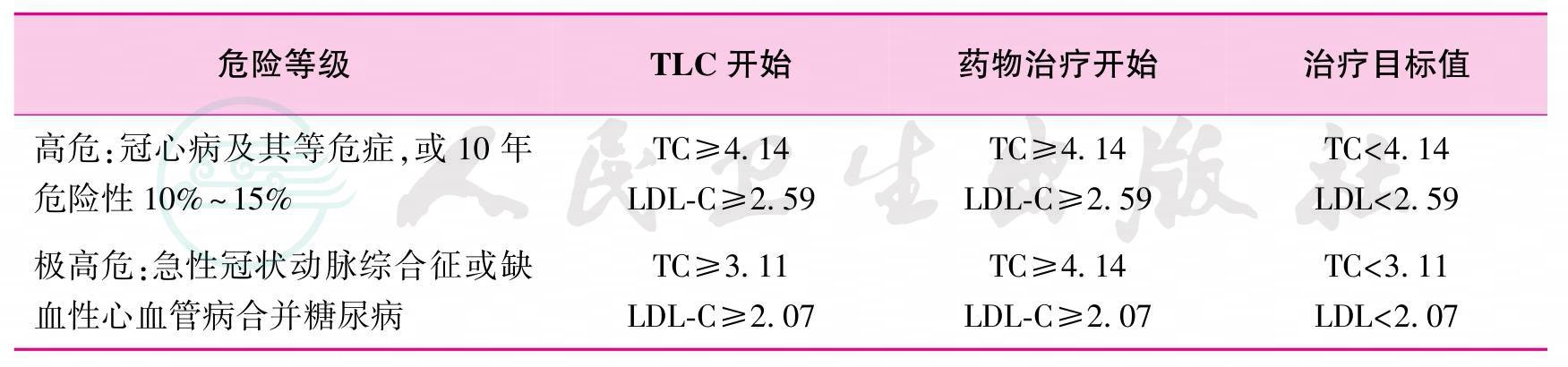
13.参考2007年《中国成人血脂异常防治指南》,器官移植受者开始调脂治疗的推荐标准和治疗目标如表5所示(1-B)。
表5 血脂异常受者开始调脂治疗的检验值及目标值
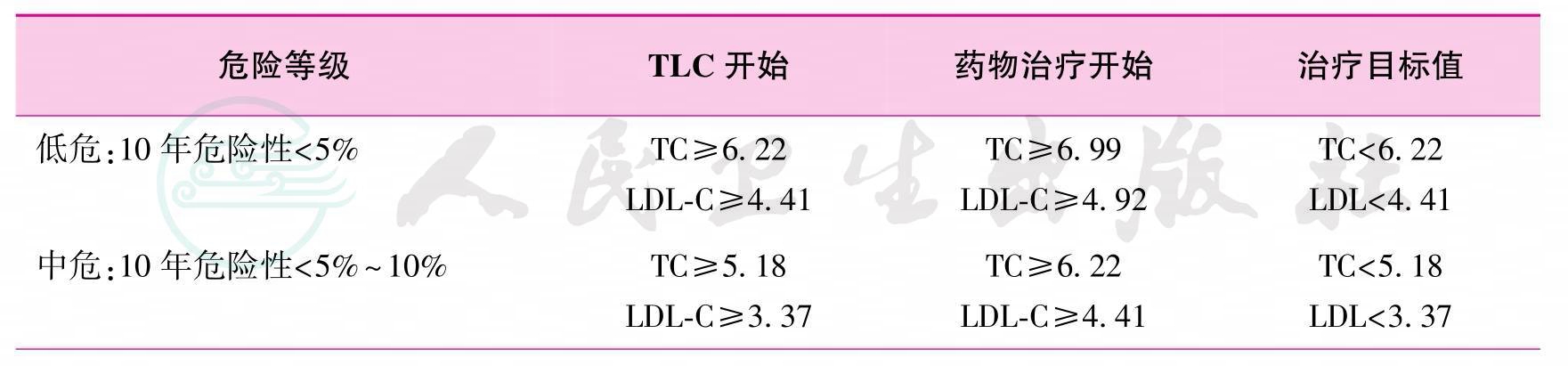
续表
4.2.1 非药物治疗
4.2.1.1 以治疗为目的改变生活方式
器官移植受者血脂代谢异常的非药物治疗主要内容是TLC,包括饮食控制和改变生活方式[1,16,17,29]。TLC是控制血脂异常的基本措施,即使已经开始药物治疗的受者,同时开展TLC也有助于强化和巩固药物治疗效果。
推荐意见:
14.改变饮食习惯,减少饱和脂肪酸和胆固醇的摄入;选择能够降低LDL-C的食物,如植物甾醇(2g/d)、可溶性纤维(10~25g/d)(2-B)。
15.减轻体重,超重或肥胖者减轻体重5%~10%(1-B)。
16.增加有规律的体力锻炼,包括足够的中等强度锻炼,每日至少消耗836.8kJ补换算热量(1-B)。
17.采取针对其他心血管危险因素的措施如戒烟、限盐以降低血压等(1-A)。
4.2.1.2 免疫抑制剂的优化调整
器官移植受者的非药物治疗还包括免疫抑制剂方案调整。
推荐意见:
18.器官移植术前已存在高脂血症,或移植术后发生ASCVD的风险评级为高危,或术后发生高脂血症的受者(未分级):
(1)首先考虑减少和撤除激素。
(2)谨慎使用mTORi;如确认脂代谢异常与mTORi相关,在移植器官功能稳定的前提下,考虑使用其他药物,如霉酚酸(MPA)类药物。
(3)CNI类药物的使用:考虑将环孢素更换为他克莫司,或采用联合MPA类药物的CNI减量方案。
(4)胰肾联合移植受者应撤除激素,使用他克莫司或环孢素联合MPA类药物的免疫抑制方案。
4.2.2 药物治疗
临床常用的调脂药物分为5类:他汀类、贝特类、烟酸类、树脂类和胆固醇吸收抑制剂。他汀类疗效切实、耐受性良好,作为首选药物治疗血脂异常已经有明确的临床证据,中国、欧洲和美国指南中均已进行明确推荐。目前的证据显示,早期使用他汀类药物有助于降低移植术后高脂血症发生率,减少ASCVD的发病风险。他汀类药物可分为强效、中效和弱效3类(见表6)[30]。
此外,既往的指南中提倡治疗目标TC或LDL“越低越好”,但随着调脂药物的广泛使用,他汀类药物的安全性得到重视。2013年美国ACC/AHA指南不再提倡设定特定的治疗目标。而是总结了4类能从他汀类药物治疗中获益的人群,包括:①有明确CVD病史者;②LDL-C≥4.94mmol/L;③年龄40~75岁合并糖尿病;④年龄40~75岁,10年CVD风险≥7.5%(发病风险可通过ACC/AHA网站在线计算)。上述具有患病风险的患者早期使用他汀类药可获益,并平衡药物安全性[30]。
表6 他汀类药物的作用效度分类
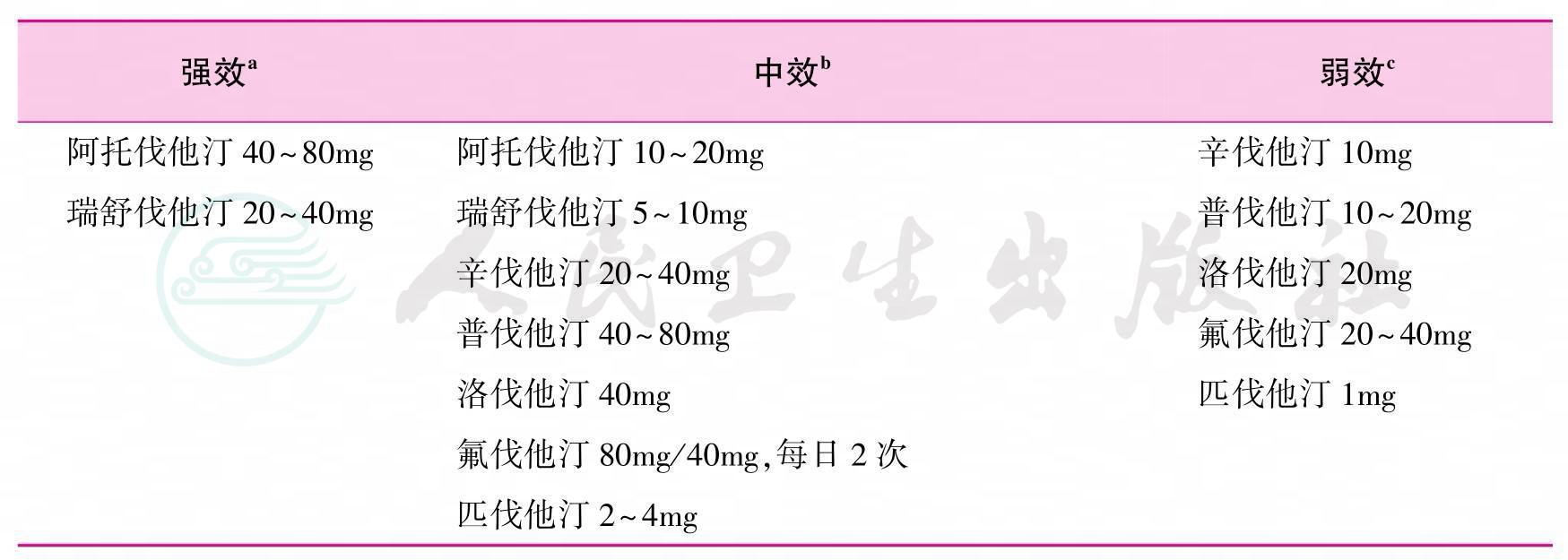
注:强效指日剂量平均降低LDL-C≥50%;中效指日剂量平均降低LDL-C 30%~50%;弱效指日剂量平均降低LDL-C<30%
其他药物总体安全性不如他汀类,或者缺乏相应的证据支持其取代他汀类的治疗地位。仅在患者无法耐受他汀类药物时考虑使用[1,17,30]。虽然联合使用依折麦布等减少肠道胆固醇吸收的药物在普通人群中能进一步降低ASCVD的风险,但在器官移植患者中的效果和安全性仍缺乏证据支持。
推荐意见:
19.器官移植受者的调脂药物首选他汀类药物(1-B)。
20.移植前已经接受他汀类治疗者,应该继续药物治疗(1-B)。
21.他汀类药物主要通过CYP3A4和CYP2C9途径代谢,现有的他汀类药物中,普伐他汀的代谢不经该途径,氟伐他汀的代谢不经CYP3A4途径。与其他通过相同途径代谢的药物联合使用时,需密切关注药物不良反应。如非必要,应避免此类药物的联合使用(表7)[1](1-B)。
表7 与他汀类药物代谢酶(CYP450)有相互作用的主要诱导剂和抑制剂

22.不推荐调脂药物的常规联合使用。患者存在无法耐受他汀类药物的因素时,或者血脂水平显著升高、ASCVD高危的患者,他汀类药物治疗效果不佳时,可考虑换用或者联合使用依折麦布、贝特或烟酸类药物(2-C)。
23.吉非贝齐无降低LDL-C的效果,与他汀类合用时可能出现横纹肌溶解或肌病的并发症。非诺贝特在使用环孢素的患者中可出现肾毒性。胆汁酸螯合剂 (考来烯胺、考来替泊、考来维仑)可降低血浆霉酚酸酯的浓度达35%。因此均不建议使用(1-B)。
4.3 肾移植受者的血脂管理
肾移植受者10年的冠心病死亡或非致命性心肌梗死的风险高达21.5%。他汀类药物能有效降低血脂,并减少ASCVD风险。因此,对存在高血脂及其相关心血管风险的肾移植受者应启动他汀类药物治疗。
然而,他汀类药物治疗不能减少移植肾功能丧失的发生率。因此,对于肾移植受者,启动他汀类药物治疗有助于减少CVD风险,但不能提高移植肾保存率。此外,没有证据支持某一特定他汀类药物的优越性、以及特定的治疗目标[31]。合理的做法是将肾移植受者作为特定的风险人群,参照普通人群的治疗原则,结合药物耐受性,制定个体化的目标。
推荐意见:
24.他汀类药物在肾移植受者中的推荐剂量调整见表8(1-B)。
表8 他汀类药物在肾移植受者中的推荐剂量
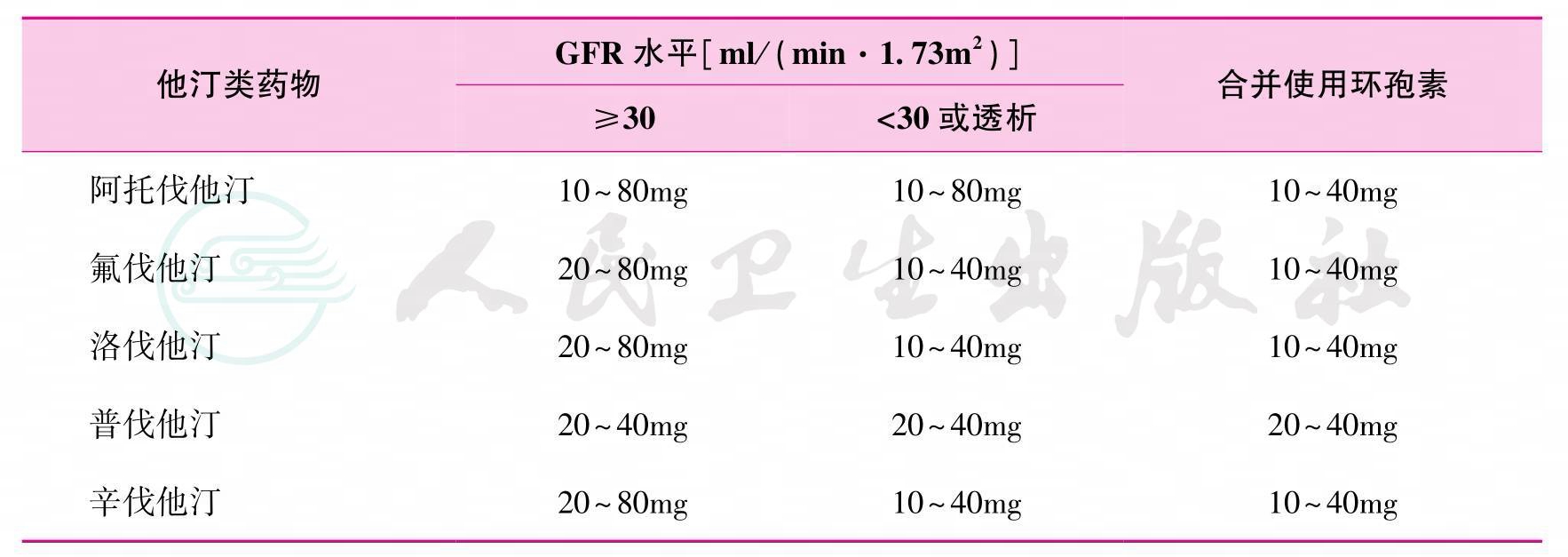
注:GFR为肾小球滤过率
25.不推荐他汀类药物作为以减少急性排斥反应和移植物生存为目的常规应用(1-B)。
26.调脂药物选用时必须考虑其与免疫抑制剂和其他药物的相互作用,以及对移植肾功能的影响。若存在肝肾功能不全,则尽量选用对肝肾功能影响较小或没有影响的药物。必要时应通过计算受者的肾小球滤过率(GFR)调整调脂药物的剂量(表9)[28](1-B)。
表9 调脂药物对肾功能的影响和调整

注:eGFR为肾小球滤过率估算值;Scr为血清肌酐
4.4 心脏移植受者的血脂管理
现有明确的证据显示,心脏移植患者应常规启动他汀类药物治疗[32]。RCT研究显示,心脏移植后1~2周内服用普伐他汀能有效降低胆固醇水平、减少血流动力学损害、CAV的发病率和进展等排斥事件,同时降低病死率[33]。血管腔内超声检查(intravascular ultrasound,IVUS)显示,普伐他汀能缓解CAV进展。另一项比较移植术后4d使用辛伐他汀与饮食治疗的RCT研究得出了类似的结果[34]。此外,这些后续的扩展研究进一步显示,降低病死率和CAV的效果最长可延续至术后10年[35],但临床获益与胆固醇的降低程度不成比例。因此,他汀类可能通过降低炎性介质、减少淋巴细胞增生和活性而发挥作用。
推荐意见:
27.推荐无论心脏移植受者的血脂水平如何,均应在术后1~2周启动他汀类药物治疗。考虑到他汀类药物与CNI类药物的相互作用,及其相关肌炎风险,他汀类药物在心脏移植受者中的起始剂量应低于一般人群调脂治疗的推荐剂量(表10)[32](未分级)。
表10 心脏移植受者的他汀类药物推荐剂量

4.5 肺移植受者的血脂管理
肺移植受者的血脂管理研究报告较少。
肺移植术后免疫抑制剂应用可引起高脂血症等代谢并发症,存活1年患者中高脂血症发生率约20.5%,而存活5年患者中发生率约52.2%[36]。糖皮质激素和CNI类药物引起的高脂血症公认可引起动脉粥样硬化,需要积极处理。术后1年内开始使用他汀类药物可以有效降低胆固醇水平,同时也有少数报告表明该类药物可以减少急性排斥反应发作和预防闭塞性细支气管炎综合征(bronchiolitis obliterans syndrome,BOS)[37],他汀类药物改善肺功能和减少病死率的机制可能与其抗炎机制有关[38-39]。然而,该药对于BOS的预防或治疗目前尚缺乏充分的依据。他汀类药物治疗的目标是TC水平低于5.18mmol/L[40]。
推荐意见:
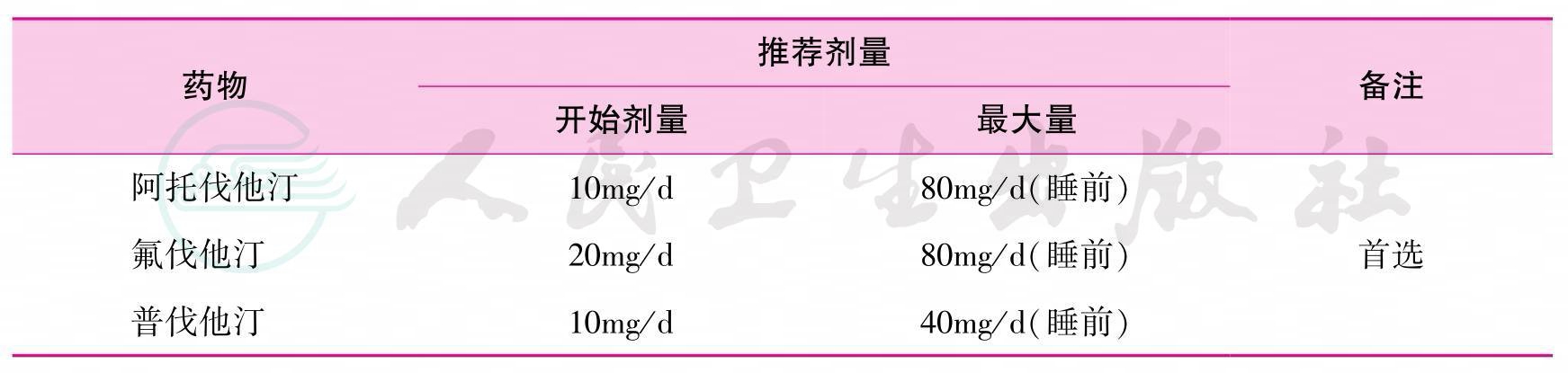
28.所有肺移植患者都需要积极预防高脂血症。一般预防包括控制饮食、锻炼、处理其他心血管病危险因素等,其目的在于降低心血管疾病和肾功能不全的风险。高脂血症的一级预防,一般开始于术后3个月。对于合并有冠状动脉疾病或动脉粥样硬化的患者,应该在术后生命体征稳定即着手高胆固醇血症二级预防,早期治疗目标LDL-C<2mmol/L,同时加用阿司匹林100mg/d。药物和开始剂量(最大推荐量)见表11。
表11 肺移植受者的他汀类药物推荐剂量
29.患者治疗前应常规检查肝酶并规律随访,若肝酶>3倍正常上限,应减少他汀类药物剂量。
30.治疗前还需要检查肌酸激酶(creatine kinase,CK),如果出现肌病症状则需要复查。若停用阿托伐他汀后,肌病消退,可谨慎试用其他他汀类药物如氟伐他汀或普伐他汀。
31.改变治疗后,应该重新随诊血脂水平达3个月。如果患者不能达到目标,增加他汀类药物到治疗剂量或可耐受的最大剂量。
32.严重肌病的风险包括联用他汀类药物和CNI类药物发生横纹肌溶解症。联合应用最大剂量他汀类药物和环孢素时风险最高,因此必须谨慎使用高剂量他汀类药物,特别合并使用环孢素时。
4.6 肝移植受者血脂管理
现有研究结果表明,肝移植术后死亡受者中,63%的死亡原因并非与移植肝功能直接相关,而是与心血管疾病、肾病、感染和新生肿瘤等相关,而肝移植术后高脂血症是受者罹患心血管疾病的重要危险因素之一[41]。研究结果显示,肝移植术后1年高脂血症占40%~66%[42]。而肝移植术后高脂血症与免疫抑制剂密切相关,MPA类对血脂的影响较小[43]。因他汀类调脂药具有肝毒性,肝移植术后高脂血症的治疗至关重要。
推荐意见:
33.肝移植术后高脂血症的非药物治疗,包括改变生活方式和饮食习惯。目标LDL-C水平<2.59mmol/L。
34.肝移植术前已存在高脂血症或术后发生高脂血症的受者。需谨慎使用mTORi,并严密监测血脂指标,对于难治性高脂血症,或确定由免疫抑制剂导致的高脂血症,治疗上应考虑调整免疫抑制方案,可考虑停用mTORi,或将环孢素更换为他克莫司,或采用联合MMF的CNI减量方案[42]。
35.高胆固醇血症药物治疗首选他汀类,而由调脂药导致的肝损伤占7%~10%[44-45],因而该药的使用需从低剂量开始,逐步调整药物剂量,且用药前后需密切监测肝功能变化,明确肝功能异常病因,必要时停用调脂药。
36.他汀类药物(除外普伐他汀)和CNI类药物均经过CYP450代谢,因而在他汀类药物的使用过程中,需监测免疫抑制剂血药浓度,及时调整免疫抑制剂[46]。
37.依折麦布在肝移植术后应用的安全性尚待进一步证实,暂不推荐此药[47]。单纯高甘油三酯血症的治疗,首选鱼油治疗,如果效果不理想,可以加用二甲苯氧庚酸或非诺贝特[42,47-48]。
38.肝移植术后肝功能异常伴高脂血症的管理,目前仍面临挑战。对于肝功能正常的患者,可继续应用调脂药,而对于肝酶>正常3倍的患者,需停用该药,监测肝功能指标,明确肝功能异常病因,再决定是否使用他汀类药物(低剂量)。对于肝酶升高 <正常3倍的患者,先观察肝功能指标,如肝酶继续升高,则需停用该药,并明确肝功能异常原因[46]。< p>
39.肝移植受者需要重视代谢病的监测,根据情况及时进行免疫抑制方案的调整,应至少每6个月评价1次,以减少药物长期毒性,并重视可能继发的心血管事件及肾功能损害,即使尚未发生。肝移植术后需将血糖、血压和血脂等代谢指标作为常规随访监测的项目[48]。 药物推荐剂量见表12[45-47,49-57]。
表12 肝移植受者术后的他汀类药物推荐剂量

5 总结
随着移植技术的成熟和免疫抑制剂研发的长足发展,器官移植的受益人群将不断扩大,随之而来的并发症也逐渐增多。血脂异常及其相关的动脉粥样硬化性疾病在很长一段时间内仍将是移植受者管理的重要内容。目前大多数基于人群的血脂治疗研究仍然将移植受者排除在外,因此在这一治疗领域仍然存在大量的问题尚待明确,包括血脂的合理治疗目标、药物的联合使用、新型药物的影响等。
[1]中国成人血脂异常防治指南制订联合委员会.中国成人血脂异常防治指南[J].中华心血管病杂志,2007,35(5):390-419.
[2]Joint Committee for Developing Chinese Guidelines on Prevention and Treatment of Dyslipidemia in Adults. Chinese guidelines on prevention and treatment of dyslipidemia in adults[J].Chin J Cardiol,2007,35(5):390-419.
[3]中华人民共和国卫生和计划生育委员会.2014中国卫生和计划生育统计年鉴[M].北京:中国协和医科大学出版社,2014.
[4]National Health and Family Planning Commission of the People’s Republic of China.Stistical yearbook of health and family planning of 2014 in China[M].Beijing:China Union Medical University Press,2014.
[5]李莹,陈志红,周北凡,等.血脂和脂蛋白水平对我国中年人群缺血性心血管病事件的预测作用[J].中华心血管病杂志,2004,32(7):643-647.
[6]Li Y,Chen ZH,Zhou BF,et al.The predictive effects of lipids and lipoproteins on the incidence of ischemic cardiovascular disease in middle aged Chinese population[J].Chin J Cardiol,2004,32(7):643-647.
[7]刘静,赵冬,秦兰萍,等.低密度脂蛋白胆固醇与心血管病发病关系的前瞻性研究[J].中华心血管病杂志,2001,29(9):561-565.
[8]Liu J,Zhao D,Qin LP,et al.Association of low density lipoprotein cholesterol with cardiovascular disease in a prospective study[J].Chin J Cardiol,2001,29(9):561-565.
[9]Lentine KL,Costa SP,Weir MR,et al.Cardiac disease evaluation and management among kidney and liver transplantation candidates:a scientific statement from the American Heart Association and the American College of Cardiology Foundation:endorsed by the American Society of Transplant Surgeons,American Society of Transplantation,and National Kidney Foundation[J].Circulation,2012,126(5):617-663.
[10]Gonyea JE,Anderson CF.Weight change and serum lipoproteins in recipients of renal allografts[J].Mayo Clin Proc,1992,67(7):653-657.
[11]Ojo AO.Cardiovascular complications after renal transplantation and their prevention[J].Transplantation,2006,82(5):603-611.
[12]Kasiske BL.Epidemiology of cardiovascular disease after renal transplantation[J].Transplantation,2001,72(6 Suppl):S5-S8.
[13]Dopazo C,Bilbao I,Castells LL,et al.Analysis of adult 20-year survivors after liver transplantation[J]. Hepatol Int,2015,9(3):461-470.
[14]Laryea M,Watt KD,Molinari M,et al.Metabolic syndrome in liver transplant recipients:prevalence and association with major vascular events[J].Liver Transpl,2007,13(8):1109-1114.
[15]Issa DH,Alkhouri N.Long-term management of liver transplant recipients:a review for the internist[J].Cleve Clin J Med,2015,82(6):361-372.
[16]Laish I,Braun M,Mor E,et al.Metabolic syndrome in liver transplant recipients:prevalence,risk factors,and association with cardiovascular events[J].Liver Transpl,2011,17(1):15-22.
[17]Lund LH,Edwards LB,Kucheryavaya AY,et al.The Registry of the International Society for Heart and Lung Transplantation:Thirtieth Official Adult Heart Transplant Report—2013;focus theme:age[J].J Heart Lung Transplant,2013,32(10):951-964.
[18]Clarke B,Khush K.Cardiac allograft vasculopathy:an ongoing challenge in the care of heart transplant recipients[M]//Moffatt-Bruce SD.Cardiac Transplantation.Rijeka:InTech,2012.
[19]Hollis IB,Reed BN,Moranville MP.Medication management of cardiac allograft vasculopathy after heart transplantation[J].Pharmacotherapy,2015,35(5):489-501.
[20]Eckel RH,Jakicic JM,Ard JD,et al.2013 AHA/ACC guideline on lifestyle management to reduce cardiovascular risk:a report of the American College of Cardiology/American Heart Association Task Force on Practice Guidelines[J].J Am Coll Cardiol,2014,63(25 Pt B):2960-2984.
[21]European Association for Cardiovascular Prevention&Rehabilitation,Reiner Z,Catapano AL,et al.ESC/EAS Guidelines for the management of dyslipidaemias:the task force for the management of dyslipidaemias of the European Society of Cardiology(ESC)and the European Atherosclerosis Society(EAS)[J].Eur Heart J,2011,32(14):1769-1818.
[22]Pencina MJ,D′Agostino RB Sr,Larson MG,et al.Predicting the 30-year risk of cardiovascular disease:the framingham heart study[J].Circulation,2009,119(24):3078-3084.
[23]Knight SR,Morris PJ.Steroid avoidance or withdrawal after renal transplantation increases the risk of acute rejection but decreases cardiovascular risk.a Meta-analysis[J].Transplantation,2010,89(1):1-14.
[24]Miller LW.Cardiovascular toxicities of immunosuppressive agents[J].Am J Transplant,2002,2(9):807-818.[25]Vanrenterghem Y,Bresnahan B,Campistol J,et al.Belatacept-based regimens are associated with improved cardiovascular and metabolic risk factors compared with cyclosporine in kidney transplant recipients(BENEFIT and BENEFIT-EXT studies)[J].Transplantation,2011,91(9):976-983.
[26]de Groen PC.Cyclosporine,low-density lipoprotein,and cholesterol[J].Mayo Clin Proc,1988,63(10):1012-1021.
[27]Hricik DE,Mayes JT,Schulak JA.Independent effects of cyclosporine and prednisone on posttransplant hypercholesterolemia[J].Am J Kidney Dis,1991,18(3):353-358.
[28]Kasiske BL,de Mattos A,Flechner SM,et al.Mammalian target of rapamycin inhibitor dyslipidemia in kidney transplant recipients[J].Am J Transplant,2008,8(7):1384-1392.
[29]Kobashigawa JA,Kasiske BL.Hyperlipidemia in solid organ transplantation[J].Transplantation,1997,63(3):331-338.
[30]Jacobson TA,Ito MK,Maki KC,et al.National Lipid Association recommendations for patient-centered management of dyslipidemia:part 1-executive summary[J].J Clin Lipidol,2014,8(5):473-488.
[31]Tonelli M,Wanner C,Kidney Disease:Improving Global Outcomes Lipid Guideline Development Work Group Members.Lipid management in chronic kidney disease:synopsis of the Kidney Disease:Improving Global Outcomes 2013 clinical practice guideline[J].Ann Intern Med,2014,160(3):182.
[32]中华医学会器官移植学分会.临床诊疗指南(器官移植学分册)(2010版)[M].北京:人民卫生出版社,2010.
[33]Branch of Organ Transplantation of Chinese Medical Association.Clinical guidelines(organ implantology volume)(2010 edition)[M].Beijing:People’s Medical Publishing House,2010.
[34]中华人民共和国卫生部疾病控制司.中国成人超重和肥胖症预防控制指南[M].北京:人民卫生出版社,2006.
[35]Disease Control in Ministry of Health of the People’s Republic of China.Prevention and control guidelines on overweight and obesity in Chinese adult[M].Beijing:People’s Medical Publishing House,2006.
[36]Stone NJ,Robinson JG,Lichtenstein AH,et al.2013 ACC/AHA guideline on the treatment of blood cholesterol to reduce atherosclerotic cardiovascular risk in adults:a report of the American College of Cardiology/American Heart Association Task Force on Practice Guidelines[J].Circulation,2014,129(25 Suppl 2):S1-S45.
[37]Palmer SC,Navaneethan SD,Craig JC,et al.HMG CoA reductase inhibitors(statins)for kidney transplant recipients[J].Cochrane Database Syst Rev,2014,1:CD005019.
[38]Costanzo MR,Dipchand A,Starling R,et al.The International Society of Heart and Lung Transplantation Guidelines for the care of heart transplant recipients[J].J Heart Lung Transplant,2010,29(8):914-956.
[39]Kobashigawa JA,Katznelson S,Laks H,et al.Effect of pravastatin on outcomes after cardiac transplantation [J].N Engl J Med,1995,333(10):621-627.
[40]Wenke K,Meiser B,Thiery J,et al.Simvastatin reduces graft vessel disease and mortality after heart transplantation:a four-year randomized trial[J].Circulation,1997,96(5):1398-1402.
[41]Kobashigawa JA,Moriguchi JD,Laks H,et al.Ten-year follow-up of a randomized trial of pravastatin in heart transplant patients[J].J Heart Lung Transplant,2005,24(11):1736-1740.
[42]Trulock EP,Christie JD,Edwards LB,et al.Registry of the International Society for Heart and Lung Transplantation:twenty-fourth official adult lung and heart-lung transplantation report-2007[J].J Heart Lung Transplant,2007,26(8):782-795.
[43]Johnson BA,Iacono AT,Zeevi A,et al.Statin use is associated with improved function and survival of lung allografts[J].Am J Respir Crit Care Med,2003,167(9):1271-1278.
[44]Fessler MB,Young SK,Jeyaseelan S,et al.A role for hydroxy-methylglutaryl coenzyme a reductase in pulmonary inflammation and host defense[J].Am J Respir Crit Care Med,2005,171(6):606-615.
[45]Morimoto K,Janssen WJ,Fessler MB,et al.Lovastatin enhances clearance of apoptotic cells(efferocytosis)with implications for chronic obstructive pulmonary disease[J].J Immunol,2006,176(12):7657-7665.
[46]Chobanian AV,Bakris GL,Black HR,et al.The Seventh Report of the Joint National Committee on Prevention,Detection,Evaluation,and Treatment of High Blood Pressure:the JNC 7 report[J].JAMA,2003,289(19):2560-2572.
[47]Watt KD,Pedersen RA,Kremers WK,et al.Evolution of causes and risk factors for mortality post-liver transplant:results of the NIDDK long-term follow-up study[J].Am J Transplant,2010,10(6):1420-1427.
[48]Lucey MR,Terrault N,Ojo L,et al.Long-term management of the successful adult liver transplant:2012 practice guideline by the American Association for the Study of Liver Diseases and the American Society of Transplantation[J].Liver Transpl,2013,19(1):3-26.
[49]Orlando G,Baiocchi L,Cardillo A,et al.Switch to 1.5 grams MMF monotherapy for CNI-related toxicity in liver transplantation is safe and improves renal function,dyslipidemia,and hypertension[J].Liver Transpl,2007,13(1):46-54.
[50]Sembera S,Lammert C,Talwalkar JA,et al.Frequency,clinical presentation,and outcomes of drug-induced liver injury after liver transplantation[J].Liver Transpl,2012,18(7):803-810.
[51]Perdices EV,Medina-Cáliz I,Hernando S,et al.Hepatotoxicity associated with statin use:analysis of the cases included in the Spanish Hepatotoxicity Registry[J].Rev Esp Enferm Dig,2014,106(4):246-254.
[52]Calderon RM,Cubeddu LX,Goldberg RB,et al.Statins in the treatment of dyslipidemia in the presence of elevated liver aminotransferase levels:a therapeutic dilemma[J].Mayo Clin Proc,2010,85(4):349-356.
[53]Watt KD,Charlton MR.Metabolic syndrome and liver transplantation:a review and guide to management[J]. J Hepatol,2010,53(1):199-206.
[54]中国医师协会器官移植医师分会,中华医学会外科学分会器官移植学组,中华医学会器官移植学分会肝移植学组,等.中国肝移植受者代谢病管理专家共识(2015版)[J].中华肝胆外科杂志,2015,21(9):577-581.
[55]Branch of Organ Transplant Physician of Chinese Medical Doctor Association,Organ Transplantation Group in Branch of Surgery of Chinese Medical Association,Liver Transplantation Group in Branch of Organ Transplantation of Chinese Medical Association,et al.Expert consensus on management of metabolic diseases in Chinese liver transplant recipients(2015 edition)[J].Chin J Hepatobiliary Surg,2015,21(9):577-581.
[56]Newman C,Tsai J,Szarek M,et al.Comparative safety of atorvastatin 80mg versus 10mg derived from analysis of 49 completed trials in 14,236 patients[J].Am J Cardiol,2006,97(1):61-67.
[57]Jose MA,Anandkumar S,Narmadha MP,et al.A comparative effect of atorvastatin with other statins in patients of hyperlipidemia[J].Indian J Pharmacol,2012,44(2):261-263.
[58]Ridker PM,Danielson E,Fonseca FA,et al.Rosuvastatin to prevent vascular events in men and women with elevated C-reactive protein[J].N Engl J Med,2008,359(21):2195-2207.
[59]Barge-Caballero G,Barge-Caballero E,Marzoa-Rivas R,et al.Clinical evaluation of rosuvastatin in heart transplant patients with hypercholesterolemia and therapeutic failure of other statin regimens:short-term and long-term efficacy and safety results[J].Transpl Int,2015,28(9):1034-1041.
[60]Bradford RH,Shear CL,Chremos AN,et al.Expanded Clinical Evaluation of Lovastatin(EXCEL)study results:two-year efficacy and safety follow-up[J].Am J Cardiol,1994,74(7):667-673.
[61]Pek SL,Tavintharan S,Woon K,et al.MicroRNAs as biomarkers of hepatotoxicity in a randomized placebocontrolled study of simvastatin and ubiquinol supplementation[J].Exp Biol Med,2016,241(3):317-330.
[62]Chen YW,Lai HW,Wang TD.Marked elevation of liver transaminases after high-dose fluvastatin unmasks chronic hepatitis C:safety and re-challenge[J].Acta Neurol Taiwan,2007,16(3):163-167.
[63]Russo MW,Hoofnagle JH,Gu J,et al.Spectrum of statin hepatotoxicity:experience of the drug-induced liver injury network[J].Hepatology,2014,60(2):679-686.
[64]Downs JR,O’Malley PG.Management of dyslipidemia for cardiovascular disease risk reduction:synopsis of the 2014 U.S.Department of Veterans Affairs and U.S.Department of Defense clinical practice guideline[J]. Ann Intern Med,2015,163(4):291-297.