 去看看
去看看


疼痛是婴幼儿和儿童均具备的一种主观感受。孕25周,疼痛感受器已经发育。新生儿不仅能感受疼痛,且会因为疼痛治疗不充分,带来日后疼痛反应增强。急性术后疼痛是由于外科手术创伤后引起的一种不愉快的感觉和情绪体验。长期以来,由于儿童不能主诉疼痛造成疼痛评估困难,以及部分镇痛药物在小儿使用受到限制或者对药物副作用的过度担心,小儿术后疼痛被严重忽视,由此给外科手术患儿带来痛苦并影响其康复过程。目前在国外的儿童医院和医学中心,已经建立了专门处理小儿疼痛的医疗小组。我国小儿术后疼痛治疗严重滞后,中华医学会麻醉学分会儿科麻醉学组根据儿科特点集体编写本指南,提供小儿术后疼痛评估和治疗的推荐意见。
一、小儿疼痛评估
由于部分小儿尤其是婴幼儿不会主动主诉疼痛,小儿疼痛评估相对于成人更困难。目前还没有任何一种量表能作为理想的评估手段适用于所有种类的疼痛或者所有年龄阶段的儿童。儿童常用的疼痛评估方法有:①自我评估:患儿根据提供的量表自己评估和描述疼痛的程度。②行为学/观察评估:测量疼痛相关的行为学表现或者对由患儿父母或监护人提供的疼痛的叙述进行评估。手术后应该定时进行行为学评估和记录。这种评估最好与其他常规评估同时进行,以避免对小儿不必要的打扰。③生理学评估:根据疼痛引起的生理学变化进行评估。在定时评估的同时,若有生命体征改变如低血压、心动过速和发热等,应立即评估是否存在严重疼痛。
1.自我评估
自我评估是评价疼痛程度的金标准,与成人疼痛评估的方法相同。
(1)视觉模拟评分法(visual analogue scales,VAS):一条长100mm的标尺,一端标示“无痛”,另一端标示“最剧烈的疼痛”,患者根据疼痛的强度标定相应的位置。一般用于8岁以上儿童。
(2)数字等级评定量表(numerical rating scale,NRS):用0~10数字的刻度标示出不同程度的疼痛强度等级,“0”为无痛,“10”为最剧烈疼痛,4以下为轻度痛,4~7为中度痛,7以上为重度痛(图36-1)。适用于8岁及以上儿童,是临床最常用也是最简单的疼痛评估方法之一。
(3)语言等级评定量表(verbal rating scale,VRS):将描绘疼痛强度的词汇通过口述表达。一般3岁以上的孩子就能较好描述疼痛,但对疼痛强度的判断不一定很准确。当患儿有能力自述疼痛程度时,其口头的描述应作为药物治疗的首要参考依据。
2.面部表情评估
医务工作者或者患儿的看护者根据患儿的面部表情,与六张代表从幸福微笑直至痛苦流泪不同表情的面部表情图比对后进行疼痛评分。
(1)FACES(wong-baker pain rating scale)脸谱疼痛评估法:主要适用于3~18岁儿童,婴幼儿或者交流有困难的患儿也适用,分值为0~10分(图36-2)。但需注意的是患儿可能因为恐惧,饥饿或其他压力失去“笑脸”,疼痛评估时应排除这些因素的影响。
(2)Bieri改良面部表情评分法:可用于4-12岁患儿,分值为0~10分(图36-3)。
(3)Oucher疼痛评分:是将垂直的0~10的数字量表和面部表情结合的一种评分方法,还有专门用不同亚洲儿童面部表情制作的评分尺。其与面部表情评分及VAS评分有很好的相关性(图36-4)。此量表可以较好地评估患儿术后或使用镇痛药物后的疼痛程度变化情况。但一般只适用能数到100的6岁以上儿童。
(4)Manchester 疼痛评分:是在Oucher 评分的基础上用全世界小朋友都钟爱的大熊猫面部表情代替了欧洲或者亚洲儿童的面像,将不同面部表情的大熊猫放在梯子上,越到梯子的上端疼痛越严重,同时孩子的活动也受到影响。分值0~10分,其适用范围同Oucher 评分(图36-5)。
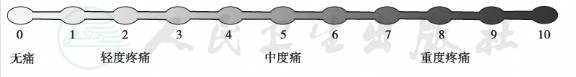
图36-1 数字等级评定量表
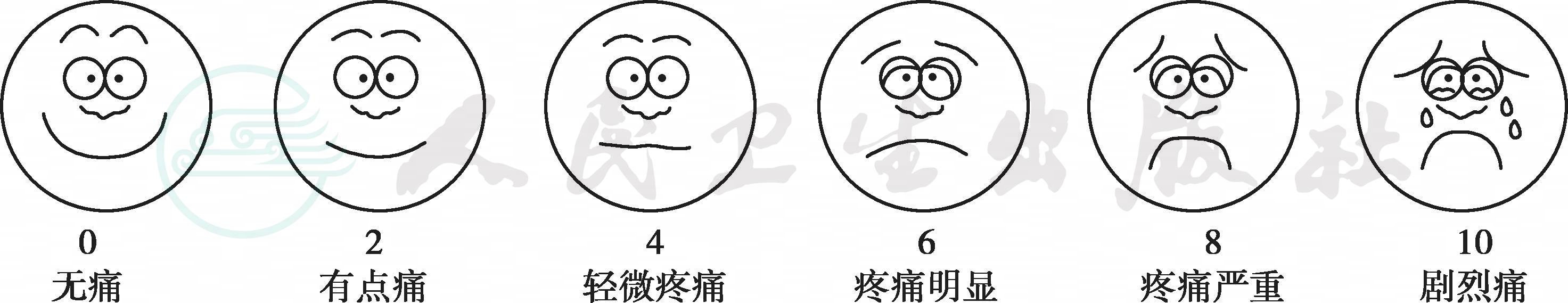
图36-2 Wong-Bakerr脸谱疼痛评分
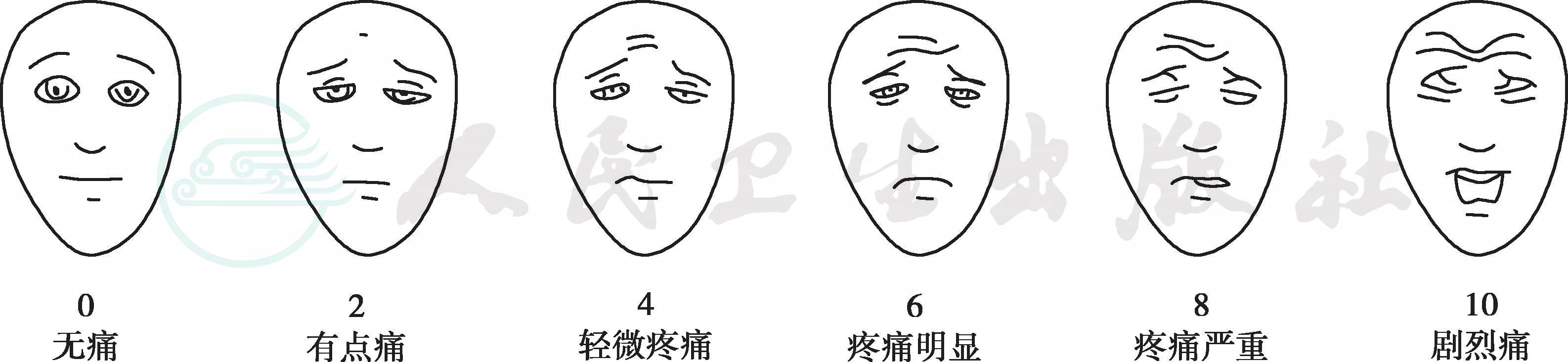
图36-3 Bieri改良面部表情评分

图36-4 Oucher疼痛评分
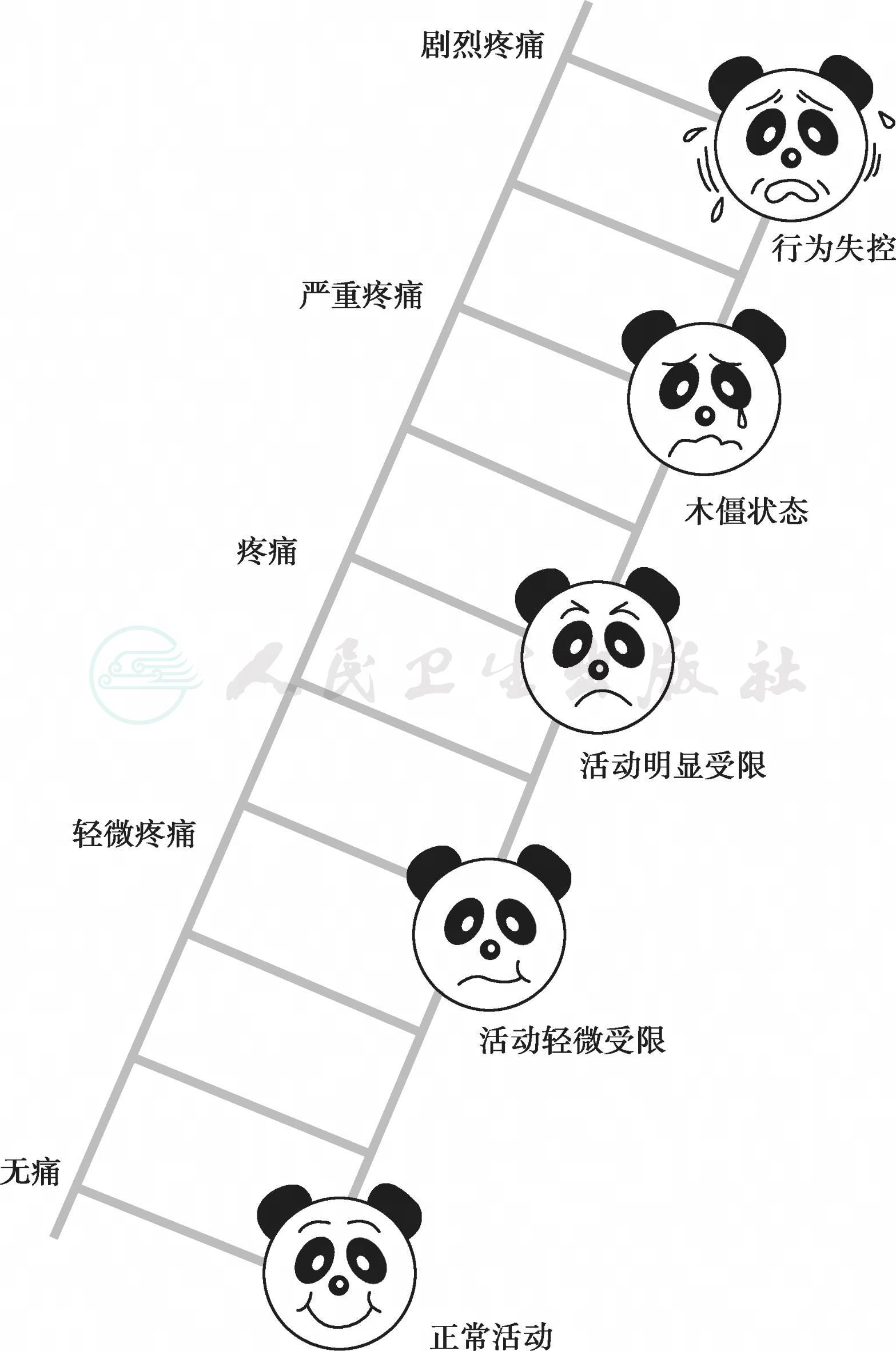
图36-5 Manchester疼痛评分
3.行为学评分
这是一种结合小儿的表情、动作行为等进行评分的方法。
Buttner和Finke发现当预测患者是否有镇痛需求时,五种行为指针较可靠、特异和敏感。这五种行为指针分别是面部表情,呻吟/哭泣,腿的姿势,身体姿势,和是否坐立不安。因此,很多疼痛观察量表都用了这五种行为指针。
(1)CRIES(crying,requires O2 saturation,increased vital signs,expression,sleeplessness)评分:
通过哭泣,呼吸,循环,面部表情和睡眠等进行评估。分值0~10分(表36-1)。分值越高,认为疼痛越严重。推荐用于婴幼儿术后疼痛评估。
(2)FLACC(Face,Legs,Activity,Crying,Consolability)评分:
常用于1~18岁患儿术后疼痛的评估,是住院手术患儿首推的评估方法。分值0~10分(表36-2)。分值越高,认为疼痛越严重。
(3)CHEOPS疼痛评分(cry,facial,child verbal,torso,touch,legs):
表36-1 CRIES评估量表

本疼痛行为评分包含6项疼痛行为类别:哭闹,面部表情,言语,腿部活动,躯体活动,伤口可触摸程度。每个类别的分值为0~2或者是1~3,分值4~13分,总分低于6分认为没有疼痛(表36-3)。因其分值与其他量表的统计方法不同,评估内容较复杂,在繁忙的临床工作中不太实用。推荐用于1~18岁儿童。
表36-2 FLACC评分量表

表36-3 CHEOPS疼痛评分

(4)Comfort评分:
通过观察患儿警觉程度、平静或激动、呼吸反应、体动、血压、肌肉张力、面部紧张程度等了解患儿镇静舒适程度,往往用于辅助上面介绍的各种疼痛评分。主要用于小儿ICU患者的观察,从新生儿到17岁都适用。共包括8个项目,每一个项目评分为1~5分,总分为40分(表36-4)。将镇静程度分为3级:8~16分为深度镇静;17~26分为轻度镇静;27~40分为镇静不足、躁动。其中,Comfort评分17~26分(轻度镇静)为镇静满意。
4.生理学评估
疼痛评估的生理学的参数包括心率,呼吸,血压,心率变异度,皮质醇变化,皮层诱发活动等,但这些参数受行为学的影响较大。在疼痛评估时,生理学指标必须与其他评估手段联合使用。
5.注意问题
(1)不同年龄阶段使用不同的评估方法是准确进行疼痛评估的保障。图36-6显示各种疼痛评估方法的建议使用年龄。在选择合适的疼痛评估方法时,儿童认知水平、语言能力、种族/文化背景、疼痛评估方法特性(如信度和效度)等因素也应考虑在内。
(2)任何一种方法都不能准确有效地评估所有儿童及所有类型的疼痛。多种评估方法的联合使用有助于提高疼痛评估的准确性。疼痛评分不能作为给予止痛药物的唯一指导。
表36-4 Comfort 疼痛评分
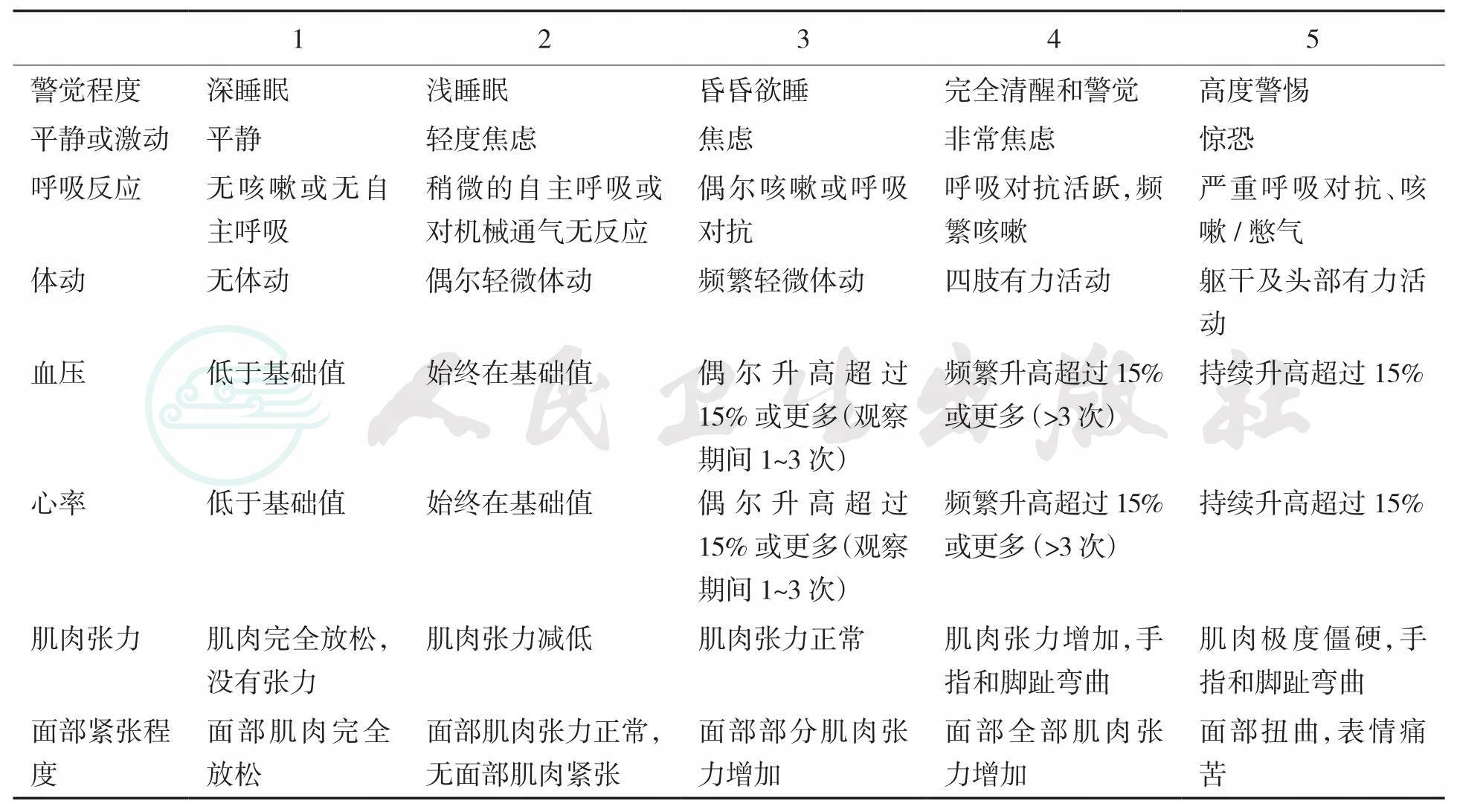

图36-6 各种疼痛评估方法的建议使用年龄
(3)条件允许时,患儿的自我评估应作为首选的疼痛评估方法。但对于3~5岁的儿童,因为自我评估的信度和效度不高,需结合一种观察性的评估方法进行疼痛程度评估。对于不能交流或者不能准确交流的患儿,应考虑充分使用一些非客观的指标(比如动作和表情)、生理参数(比如血压、心率、呼吸频率、流泪、出汗等)以及这些参数在镇痛治疗前后的变化和特殊的疼痛评估方法(比如行为学评分)。
(4)为了有效的评估疼痛,必须与患儿、家长或监护人及疼痛管理的相关人员进行交流。
(5)按时规律地进行疼痛评估和记录才能保证疼痛治疗的有效性和安全性,任何干预治疗后要评估其效果和不良反应。
(6)有些孩子惧怕医生护士,因此当医生护士来到床前实施疼痛评估时,患儿当时的面部表情可能不能反映其疼痛程度,这在临床工作中应引起重视。
(7)需要对进行评估的医务人员进行关于疼痛相关的知识教育和评估方法的学习,提高熟练程度和准确性。
(8)对于有认知功能障碍的患儿,可以选择儿童非交流疼痛清单(non-communicating children’s pain checklist-postoperative version,NCCPC-PV),适用于3~19岁儿童;儿童疼痛概要(the pediatric pain profile,PPP),适用于1~18岁儿童;改良FLACC评分,适用于4~19岁儿童。
二、疼痛治疗
(一)镇痛药物及其应用
1.局麻药物
局部麻醉药可以通过手术切口局部浸润,区域神经丛、外周神经干单次或者持续阻滞,椎管内单次或者持续阻滞方法治疗术后镇痛。血管收缩剂(如肾上腺素)与局麻药一起使用可以减少全身吸收的毒副作用,还可以延长局麻药的作用时间。另外中枢镇痛药物如氯胺酮、可乐定或者阿片类药物(如芬太尼)与局麻药一起使用可以延长中枢神经阻断作用时间。
(1)术后镇痛常用局部麻醉药物
A. 布比卡因:布比卡因是一种起效慢,作用时间较长的酰胺类局麻药。主要用于浸润麻醉、外周神经阻滞和椎管内阻滞。
B. 左旋布比卡因:左布比卡因是布比卡因的左旋对称产物,与其药效相当,用途相同,推荐药物使用剂量也相同,但是毒副作用小于布比卡因。
C. 罗哌卡因:罗哌卡因是一种酰胺类局麻药,起效时间和维持时间和布比卡因类似,但运动神经阻滞的发生和持续时间较短,强度也较弱。
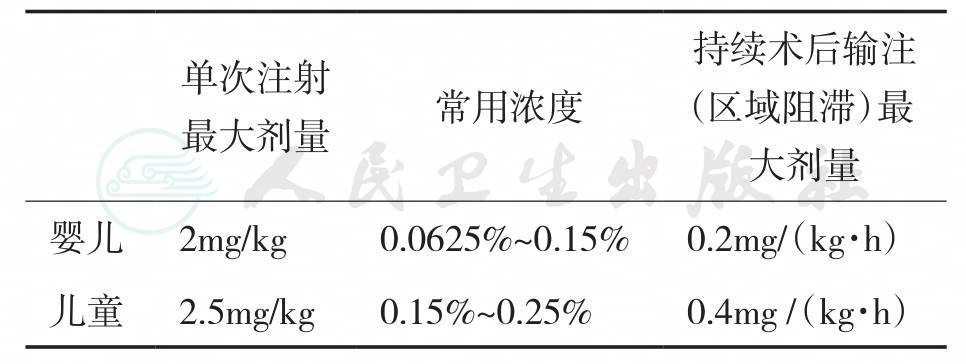
以上局部麻醉药推荐最大用量见表36-5。
表36-5 布比卡因、左旋布比卡因和罗哌卡因的推荐最大用量
(2)局部麻醉药物的术后镇痛方法
A. 局部浸润:局部浸润简单易行,外科手术缝皮前在切口皮下注射长效局麻药浸润。适用于各类小、中和大型手术。还可以局部切口皮下埋管后持续泵注局部麻醉药物。
B. 外周神经阻滞:适用于相应神经丛、神经干支配区域的术后镇痛。例如肋间神经阻滞、上肢神经阻滞(臂丛)、椎旁神经阻滞、下肢神经阻滞(腰丛、股神经、坐骨神经)等。借助于神经电刺激和超声引导的神经精确定位,有助于提高镇痛效果和降低并发症。使用导管留置持续给药,可以获得长时间的镇痛效果。但是,持续外周神经阻滞用于术后镇痛存在的下列问题值得注意如留置管的移位和脱落,运动阻滞后造成患者跌伤等。
C. 硬膜外腔给药:通过经骶裂孔或者棘间留置的硬膜外导管持续给药。适用于胸、腹部及下肢手术后疼痛的控制。其优点是:不影响神志和病情观察,镇痛完善,也可做到不影响运动和其他感觉功能。
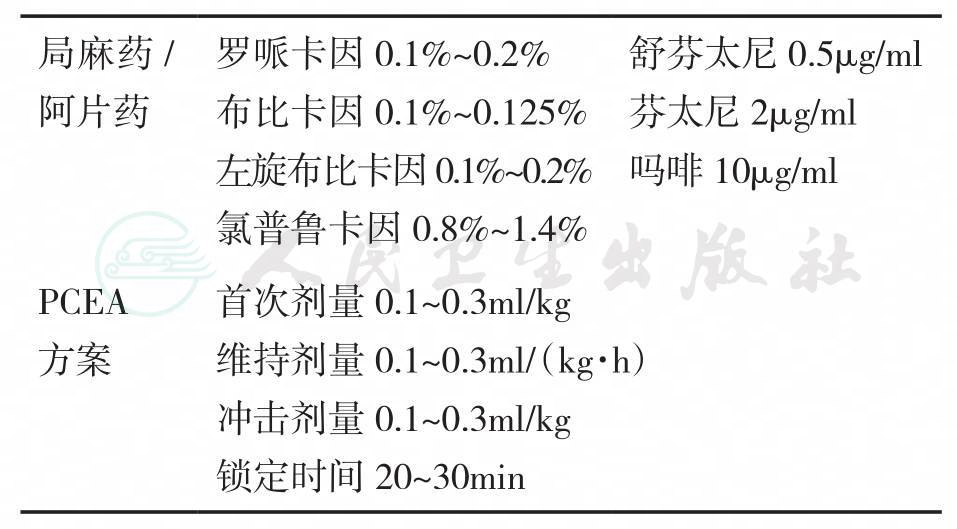
局麻药中加入阿片类药物不仅可达到镇痛的协同作用,还可降低这两类药物的副作用,减轻运动阻滞的发生,是目前最常用的配伍,多以患者自控方式、家长控制或者护士控制方式给药。适用于术后中、重度疼痛。常采用低浓度罗哌卡因或布比卡因等局麻药复合芬太尼、舒芬太尼、吗啡、布托啡诺等药物。
硬膜外术后镇痛(PCEA)为当今公认的最佳术后镇痛方法,但并非万能,仍存在并发症。须全面分析、评估患者的生理功能,尤其是患者痛阈敏感性与既往药物使用情况后使用(表36-6)。
2.阿片类药物和曲马多
阿片类药物是最广泛使用的强效镇痛药,可以通过多种方式给药。常用于术后镇痛的药物有吗啡、芬太尼和舒芬太尼。曲马多为中枢镇痛药,有两种异构体:(+)-曲马多和(-)-曲马多。前者及其代谢产物(+)-O-去甲基曲马多(M1)是μ阿片受体的激动剂,两者又分别抑制中枢5-羟色胺和去甲肾上腺素的再摄取,提高了对脊髓疼痛传导的抑制作用。两种异构体的协同作用增强了镇痛作用并提高了耐受性。
表36-6 硬膜外术后镇痛(PCEA)的局麻药和阿片药物配方
(1)常用阿片类药物
A. 吗啡:吗啡是最被广泛使用和研究的阿片类药物,通过激动μ受体发挥作用。可以采取皮下,口服,硬膜外,鞘内,肌肉内,静脉内,经直肠等给药方式。正确的用药范围内对所有年龄的儿童均安全有效。儿童的药代动力学与成人相似。但是新生儿和2岁以内的婴儿,其蛋白结合率和代谢率降低,半衰期延长,并与孕产龄和出生体重。在用药时,要将这些因素考虑后制定方案。吗啡因肝脏和胃肠道的首过代谢效应,口服生物利用率较低。
使用剂量推荐:
a. 口服
新生儿:80μg/(kg·4~6h);儿童:200~500μg/(kg·4h)
b. 静脉和皮下起始剂量(按照反应滴定)
单次用药:新生儿:25μg/kg开始
儿童:50μg/kg开始
连续输注:10~40μg/(kg·h)
c. 患者自控镇痛(PCA)
冲击剂量:10~20μg/kg 锁定时间:5~10分钟
背景剂量:0~4μg/(kg·h)
d. 护士控制镇痛(NCA)
冲击剂量:10~20μg/kg 锁定时间:20~30分钟
背景剂量:0~20μg/kg·h(小于5kg不使用)
B. 氢吗啡酮:氢吗啡酮强效阿片类镇痛药,常用于中重度疼痛的治疗,因为其水溶性好,可用于皮下注射。其副作用较吗啡轻,目前在西方国家被广泛用于小儿术后镇痛和慢性疼痛治疗。
使用剂量推荐:
a. 口服:40~80μg/(kg·4h)
b. 静脉和皮下起始剂量(按照反应滴定):
单次用药:体重<50kg:10~20μg/kg开始
连续输注:2~8μg/(kg·h)
C. 二乙酰吗啡:比吗啡更强效、脂溶性更高、起效时间更快、持续时间更长的阿片类镇痛药,可以采取皮下,口服,硬膜外,鞘内,肌肉内,静脉内等给药方式。
使用剂量推荐:
a. 口服
>1岁:100~200μg /(kg·4h)
b. 静脉和皮下起始剂量(按照反应滴定):
单次用药:新生儿:10~25μg/kg开始 儿童:25~100μg/kg开始
连续输注:2.5~25μg/(kg·h)
c. 鼻腔内给药:
100μg/kg混于0.2ml无菌生理盐水中注入一侧鼻腔。
D. 可待因和二氢可待因:二者镇痛效果比吗啡稍弱,常用于轻中度疼痛的治疗,并与NSAID或对乙酰氨基酚联合使用。可用于口服、肌内注射或直肠给药,但不能静脉给药,否则会产生严重低血压。可待因和二氢可待因进入体内需转化为吗啡后发挥镇痛作用,基因多肽性导致的代谢酶差异表达可能会影响部分患者的疗效。
a. 可待因使用剂量推荐:
口服、肌内注射或直肠给药
0.5~1mg /(kg·4~6h)(新生儿重复用药时需高度谨慎)
b. 二氢可待因使用剂量推荐:
口服、肌内注射
年龄>1岁:0.5~1mg/(kg·4~6h)
E. 芬太尼:芬太尼是一种强效镇痛药,较吗啡脂溶性更强,起效较快,作用时间较短。因为其亲脂性,芬太尼可以经皮肤和经黏膜使用。在手术后可以小剂量冲击给药(bolus)镇痛,还可以用于PCA镇痛。在新生儿因为药物清除率降低,半衰期延长,应当在严密监测下使用才能保证安全。因为芬太尼这类药物的亲脂性,所以其冲击给药和持续输注的药代动力学有所不同;随着连续输注时间的延长,其半衰期也相应延长。
使用剂量推荐:
a. 单次静脉注射:0.5~1.0μg/kg按镇痛效果滴定,新生儿减量
b. 连续静脉输注:0.5~2.5μg/(kg·h)
c. 经皮肤给药:12.5~100μg/h
d. PCA:负荷剂量:0.5~1.0μg/kg;背景剂量:0.15μg/(kg·h);单次冲击剂量:0.25μg/kg,锁定时间20min;最大量:1~2μg /(kg·h)
F. 舒芬太尼:舒芬太尼是一种较芬太尼镇痛效应更强7~10倍的强效镇痛药。比芬太尼的脂溶性更高,很容易穿过血脑屏障,起效迅速。新生儿肝酶系统不成熟,清除率降低,清除受肝血流的影响很大(PACU 镇痛特佳),代谢经过N-去碱基化和O-去甲基化,代谢产物有 10% 活性。
使用剂量推荐:
单次静脉注射:0.05~0.1μg/kg,按镇痛效果滴定;
连续静脉输注:0.02~0.05μg/(kg·h);
PCA:负荷剂量:0.05~0.1μg/kg,背景剂量:0.03~0.04μg/(kg·h);单次冲击剂量0.01/kg,锁定时间15min;最大量:0.1~0.2μg/(kg·h)。配制时,以按1.5~2μg/kg配制在100ml液体中,使用48小时,背景输注为2ml/h,单次冲击为0.5ml。
注意:阿片药物的毒副作用
阿片类药物在全身各系统可以引起各种作用如恶心呕吐,瘙痒,尿潴留,呼吸抑制。药物的不良反应在每个患者受遗传和发育的影响不尽相同。所以在此类药物术后镇痛的患儿,应适当监护和做好不良反应处理的准备。联合使用非阿片类镇痛药物可以减少阿片类药物的使用剂量及相应严重不良反应。
(2)曲马多:曲马多是一种通过5羟色胺和去甲肾上腺素作用的弱阿片镇痛药。可以通过口服,静脉,直肠,连续输注,也可以作为PCA的一部分给药。曲马多作为轻到中度疼痛的镇痛药物被越来越广泛的使用于所有年龄的儿童。常见的副作用包括恶心呕吐,呼吸抑制(较阿片类药物少见),过度镇静和大小便潴留。曲马多使用过量可能出现癫痫样抽搐。
使用剂量推荐:
口服、直肠或静脉给药:1~2mg/(kg·4~6h)
(3)阿片类药物的相对功效和静脉连续输注剂量比较(表36-7)。
(4)阿片类药物的常见使用方法
A. 患者自控镇痛(patient controlled analgesia,PCA):适合于5岁以上的小儿。研究显示其镇痛效果优于肌内注射或单纯持续静脉输注,也在一定程度上减少过度镇静的发生,患儿和家长的满意度更高。
患者自控静脉镇痛(patient controlled intravenous analgesia,PCIA)被认为是阿片类药物的最佳给药方式。与传统的按需镇痛相比,PCIA能提供更好的术后镇痛效果,提高患者满意度,降低肺部并发症。但也会导致恶心呕吐、镇静过度、低血氧饱和度、静脉炎、静脉通路堵塞等不良反应。镇痛药物中加入一定剂量的抗呕吐药如格拉司琼等可以在一定程度上预防阿片类药物的恶心、呕吐等不良反应。小儿自控静脉镇痛(PCIA)推荐方案见表36-8。
B. 护士或家长控制镇痛(Nurse Controlled Analgesia,NCA):对于年龄小于5 岁及不能合作的患儿,可以采取护士或家长控制镇痛的方法。此时可能需要设置较高的背景输注剂量[如吗啡20μg/(kg·h)]和较长的锁定时间(如30min)。NCA时须更严密监护患儿,防止过度镇静和呼吸抑制的发生。
表36-7 阿片类药物的相对功效和静脉单次和连续输注剂量
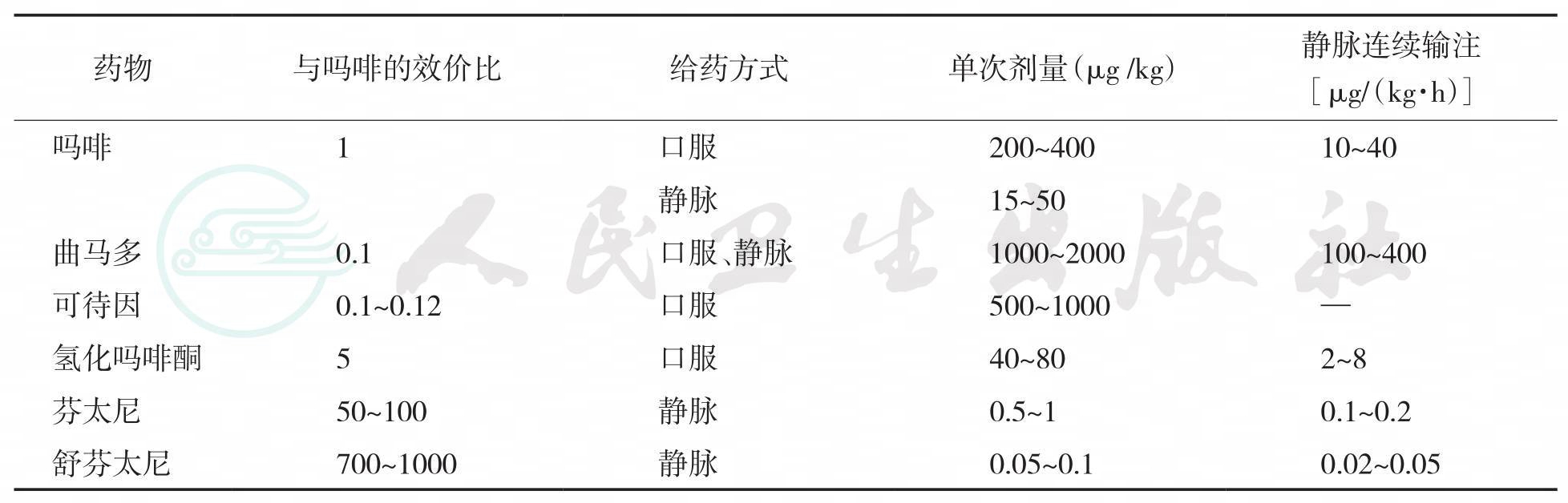
表36-8 PCIA的推荐方案

注意事项:无论是PCA 还是NCA,撤泵的过程应遵循个体化的原则。患儿使用PCA的次数已明显减少,疼痛评分已经足够低才能考虑撤泵。撤泵后可以使用非甾体类抗炎药(NSAID)维持镇痛。
3.非甾体类抗炎药(NSAIDS)
NSAIDS类药物是治疗轻到中度疼痛的有效药物。其通过抑制环氧化酶(COX),减少前列腺素和血栓素的合成而发挥镇痛作用。当与阿片类药物合用时可以增强镇痛效果,并减少阿片类药物的使用剂量,降低其相关不良反应如恶心、嗜睡、呕吐、呼吸抑制、肠蠕动减少以及血液动力学紊乱等。
本类药物在儿童使用的有效性尤其是安全性还没有系统验证,因此药物说明书上不建议在儿童使用。但是,国内外都有大量NSAIDS类药物用于儿童疼痛治疗的报道,但一般不推荐作为镇痛药物用于3个月以下婴儿。阿司匹林可能引起雷尔综合征(Reye’s syndrome)而不用于儿童。在所有现在使用的NSAIDS类药物中,布洛芬是引起副反应最少,是使用安全证据最多的NSAIDS药物,其次是双氯芬酸和塞来昔布,氟比洛芬酯和帕瑞昔布钠均有用于小儿术后镇痛的临床报道(表36-9)。
表36-9 NSAIDS类药物小儿应用的推荐剂量
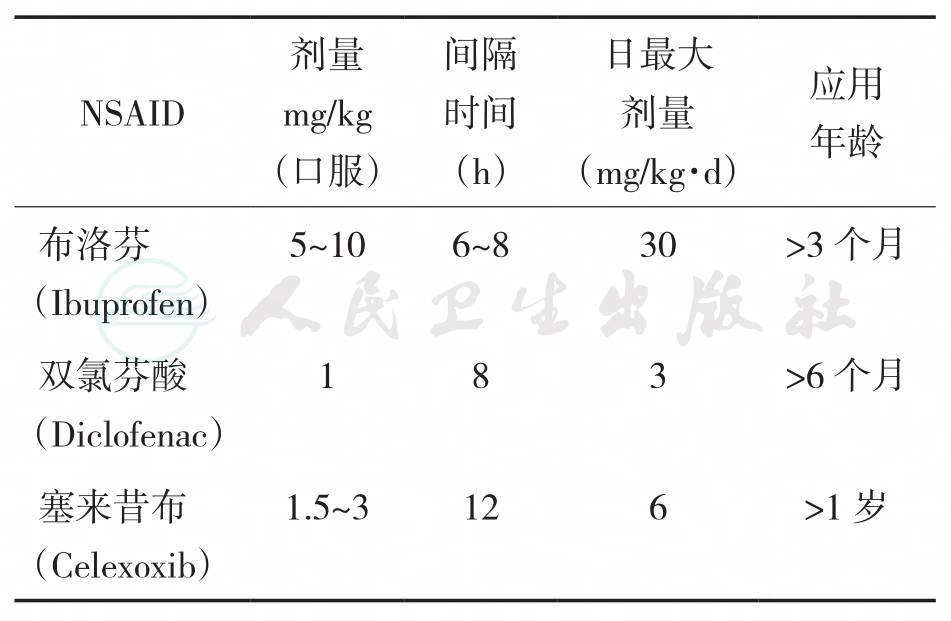
NSAIDS类药物用于术后镇痛的主要指征是:①中小手术后镇痛;②大手术与阿片药物或曲马多联合或多模式镇痛,有显著的阿片节俭作用;③大手术后PCA停用后,残留痛的镇痛;④术前给药,发挥术前抗炎和抑制超敏作用。
使用NSAIDS类药物可能不良反应和注意事项:
(1)NSAIDS影响血小板凝集,延长出血时间。故禁用于有出血性疾病和接受抗凝治疗的儿童。手术范围广泛的大型外科手术后最好不用此类药物。
(2)NSAIDS抑制前列腺素介导的肾功能,特别是在有肾脏疾病和脱水的患者。因此,NSAIDS不能与有肾脏毒性的药物合用。
(3)NSAIDS可以使胃激惹和引起消化道出血。消化道出血高风险的患儿,联用质子泵抑制剂如奥美拉唑和H2受体拮抗剂可以降低风险。
(4)因为NSAIDS可使白三烯增加,故可能加重哮喘。对有哮喘病史的儿童,必须询问以前是否安全地使用过NSAIDS药物,重症哮喘患儿禁用。
(5)动物试验证实大剂量NSAIDS类药物可影响骨发育,因此不建议小儿长时间大剂量使用此类药物。
(6)对于新生儿,NSAIDS药物可能影响脑和肺的血流调节,故不推荐使用。
(7)对NSAIDS过敏的患儿禁用,患有严重湿疹和过敏体质的儿童慎用,肝功能衰竭者禁用。
4.对乙酰氨基酚
对乙酰氨基酚是一种常用的解热镇痛药,抑制中枢的COX-2,尤其对COX-3选择性抑制,还有调节抑制下行的5-HT能通路和抑制中枢NO合成的作用。由于其毒副作用小,可以定时规律用药,几乎可以用于各类术后疼痛的基础用药。轻度疼痛可以单独使用乙酰氨基酚镇痛。中度疼痛可以与NSAIDS或可待因等弱阿片药物联合应用。其镇痛剂量高于解热镇痛剂量,但达到一定剂量后产生封顶效应。一般口服后在30~60分钟后药物浓度达到峰值,直肠给药后需经过1~2.5小时才能达到最大血药浓度,静脉给药起效快但需在15min内缓慢输入。本药物在肝脏代谢,新生儿因肝脏某些酶类未发育成熟而药物清除率低;而对于2~6岁的儿童,因为肝脏的相对比重大而药物代谢快。
表36-10列出对乙酰氨基酚口服和直肠给药剂量推荐,表36-11列出对乙酰氨基酚静脉给药给药剂量推荐。
2010年11月,美国FDA首次批准了对乙酰氨基酚的静脉注射用制剂,但国内目前还没有。
对乙酰氨基酚超过最大日用剂量使用后可能产生肝脏毒性。营养不良和脱水的患者,如果使用剂量成倍增加可能造成药物蓄积。乙酰半胱氨酸和蛋氨酸可以补充体内谷胱甘肽,故可用于对乙酰氨基酚毒副反应的治疗。
5.非药物疗法
小儿术后镇痛除了前述药物治疗外,情感支持、精神抚慰、心理干预等非药物也有很好的治疗作用。这些方法通过调节思想,行为和感受来达到减轻疼痛和疼痛相关应激。治疗儿童疼痛的心理手段包括分散注意力、做游戏、心理教育、催眠、生物反馈、意象导引等,其中意象导引、分散注意力和催眠最有效。
蔗糖溶液可以用于新生儿术后镇痛。目前仍被认为是新生儿时期最主要的非药物镇痛手段。通常使用蔗糖溶液的浓度为12%~24%,口服0.05~2ml在 2分钟内起效。使用容量的上限由孕周来决定:27~31周:0.5ml;32~36周1ml;大于37周;2ml。目前报道的不良反应有:咳嗽、窒息、呕吐和短暂的氧饱和度下降,也有报道短时的神经生物风险评分(‘Neurobiologic Risk’ score)升高,尤其见于孕周<27周和28~31周者。
皮肤接触或其他形式的触觉刺激可以很好的缓解新生儿针刺相关操作所带来的疼痛。
常用的非药物疗法如下:
(1)行为干预;
(2)认知干预,用积极的态度替换焦虑等与疼痛相关的思考模式;
(3)分散注意力,如数数、听音乐、玩游戏、讨论与疼痛或医疗操作无关的话题等;
(4)催眠;
(5)心理准备和心理适应。
6.多模式镇痛
多模式镇痛也称平衡镇痛。将作用于疼痛传导通路不同部位的药物联合应用,多途径镇痛,达到最佳疼痛治疗效果,降低相关不良反应。围手术期多模式镇痛被看作是高效术后康复的快通道。
常用的小儿多模式镇痛方法有:
(1)NSAIDs和其他药物如阿片类药联用;
(2)局部麻醉药复合阿片类药或其他类镇痛药;
(3)外周与中枢联合用药;
(4)不同镇痛方式的联合应用;
(5)超前镇痛与术后镇痛的联合应用。
表36-10 对乙酰氨基酚口服和直肠给药剂量推荐表
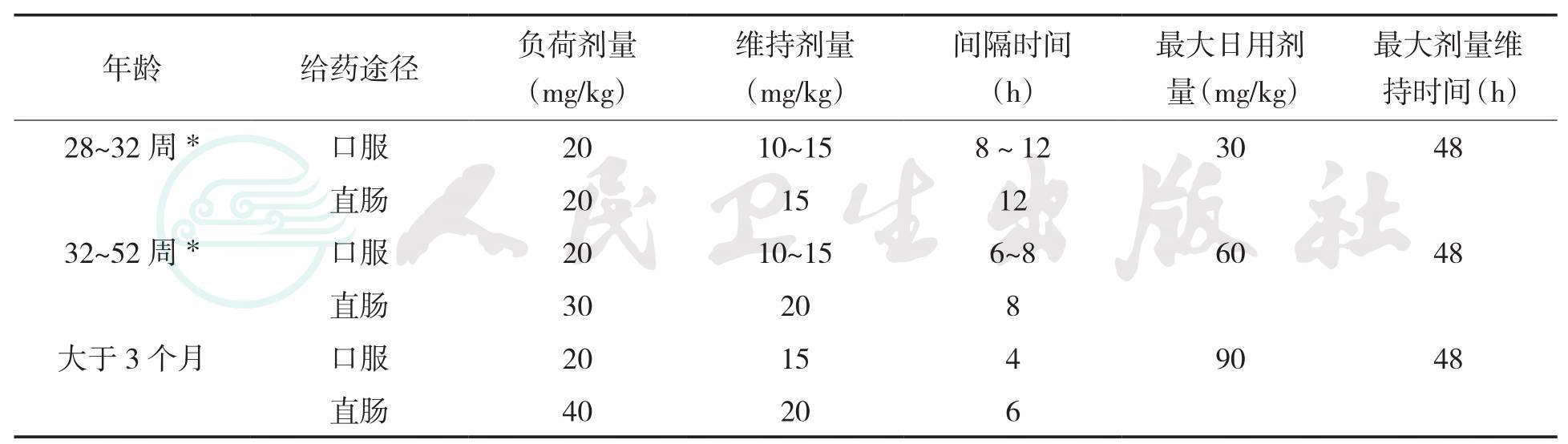
*指孕产龄
表36-11 对乙酰氨基酚静脉给药给药剂量推荐表

三、小儿不同类型手术术后镇痛原则
小儿手术类型不同,创伤程度不一样,术后疼痛的程度也不同。术后镇痛方法的选择与手术部位也有很大的关系。表36-12显示不同部位和不同手术类型的最佳推荐术后镇痛方法。
表36-12 小儿不同类型手术后最佳镇痛方法推荐表
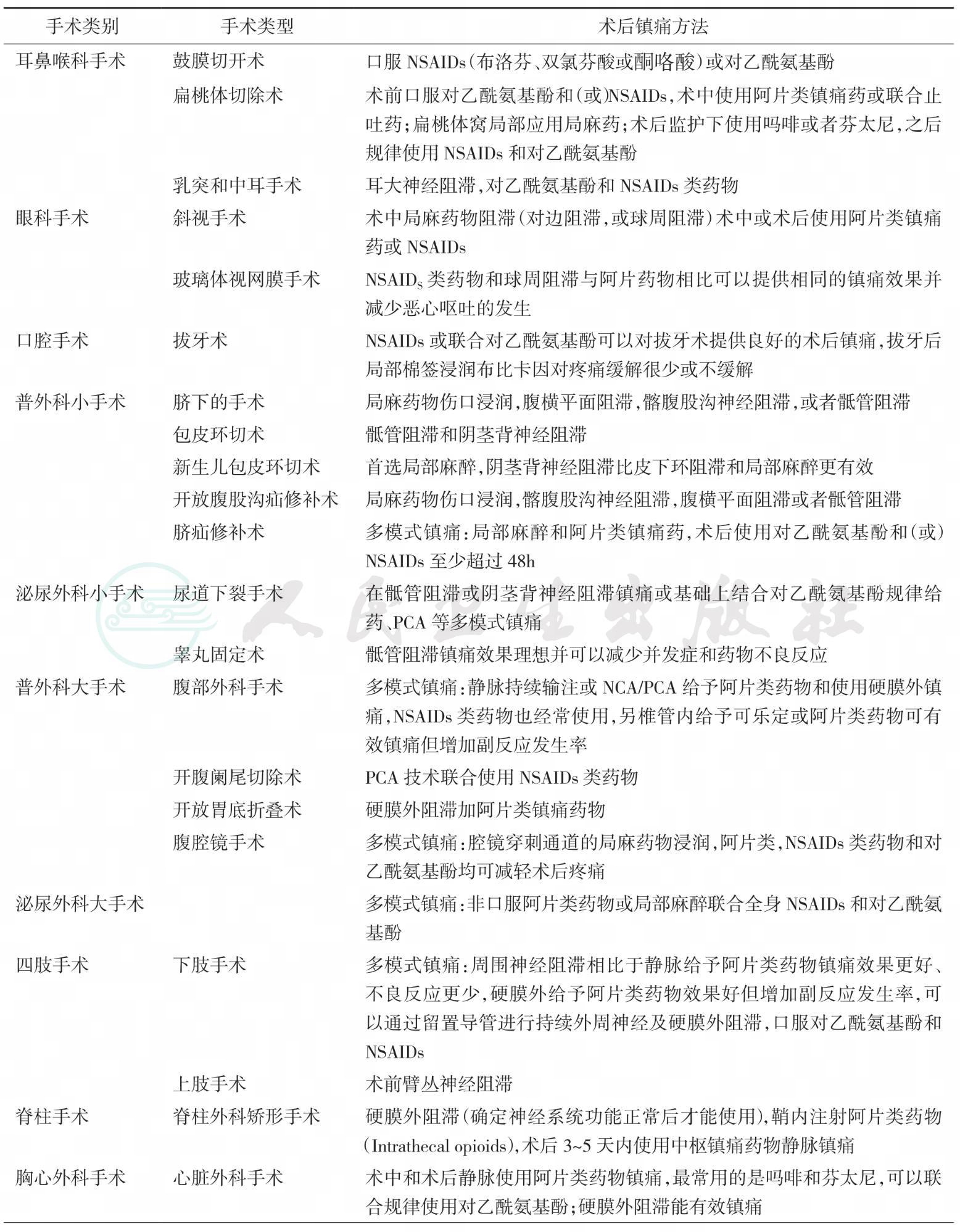
续表

四、小儿术后疼痛治疗注意事项
1.术后镇痛是外科手术麻醉的一部分,所以在麻醉期间,应给予充分的镇痛药物,包括阿片类药物,局麻药和其他药物。术后疼痛治疗应该在PACU(麻醉复苏室)就开始,证实止痛方案安全有效后才能让患儿离开。患儿的麻醉医生有责任制定具体的术后镇痛方案。
2.术前告知家长在手术结束后镇痛药物的药效会逐渐消失,所以患儿需要进一步的镇痛治疗。疼痛在术后24~72小时内最为严重,个别患儿可能持续数日或数周。
3.在术后早期可以按照时间规律给药,而在后期可以根据疼痛评估结果按需给药。
4.在疼痛药物的使用方面,应尽可能联合给药。比如:阿片类药物,局麻药,NSAIDs,对乙酰氨基酚可以联合给药,但每种药物不应超过推荐的最大剂量。
5.不同患儿对镇痛药物的敏感性和药物的需求量不同,因此,镇痛药物的给予应按照个体化原则。
6.必须通过疼痛评估观察药物治疗的效果。同时监测镇痛药物引起的不良反应。使用阿片类药物镇痛的患儿,应定时监测呼吸频率,最好配备SpO2监护。
7.对术后恶心呕吐(PONV),应该使用相应药物进行控制,而不是简单取消镇痛药物的使用。
总之,小儿术后镇痛应根据患儿年龄、手术类型和临床情况合理给药,提供安全,有效,个体化的镇痛方案,并尽可能减少相关不良反应。
1. 杭燕南,王祥瑞,薛张纲,等. 当代麻醉学. 第2版. 上海:上海科学技术出版社,2013.896-905.
2. 李浩,连庆泉. 不同剂量氟比洛芬酯用于小儿扁桃体剥除术后镇痛. 临床麻醉学杂志,2011,27 (2):189-190.
3. 秦培顺,蔡明阳,李军,等. 帕瑞昔布单次静注复合芬太尼用于小儿术后镇痛的临床观察. 中国临床药理学与治疗学,2011,16(9):1021- 1025.
4. 魏丹,刘迎龙,贺彦,等. 不同剂量舒芬太尼对小儿先天性心脏病术后镇痛镇静效果的影响. 实用儿科临床杂志,2012,27(23):1841-1844.
5. 黄德樱,吴江. 舒芬太尼和芬太尼在新生儿术后镇痛的应用. 临床麻醉学杂志,2008,24(2):120.
6. 靳三庆,黄文起,何广芬,等. 硬膜外吗啡持续注入用于小儿术后镇痛的研究. 中华麻醉学杂志,1999,19(2):113-115.
7. Alison T,G. A F,Margot L.Pediatric nurses’ postoperative pain management practices:An observational study. Pediatric Nursing,2013,18:189-201.
8. Ariane S,Gerd FV,Mira F,et al. Original Research Article Postoperative Pain Assessment after Pediatric Otolaryngologic Surgery. Pain Medicine,2013,14:1786-1796.
9. Association of Paediatric Anaesthetists. Good Practice in Postoperative and Procedural Pain Management,2nd Edition. Pediatric Anesthesia,2012,22:1-79.
10. Bai J,Hsu L,Tang Y,et al. Validation of the COMFORT Behavior scale and the FLACC scale for pain assessment in Chinese children after cardiac surgery. Pain Manag Nurs,2012,13(1):18-26.
11. Bieri,D.,Reeve,R. A.,Champion,G. D.,Addicoat,L.,& Ziegler,J. B. The Faces Pain Scale for the self-assessment of the severity of pain experienced children:Development,initial validation,and preliminary investigation for ratio scale properties. Pain,1990,41:139-150.
12. Brasher C,Gafsous B,Dugue S,et al. Postoperative pain management in children and infants:an update. Paediatric Drugs,2014;16(2):129-140.
13. Breau L,Finley G,McGrath P et al. Validation of the noncommunicating children’s pain checklist-postoperative version. Anesthesiology,2002,96:528-535.
14. Ceelie I1,de Wildt SN,van Dijk M,et al. Effect of intravenous paracetamol on postoperative morphine requirements in neonates and infants undergoing major noncardiac surgery:a randomized controlled trial. JAMA,2013,309(2):149-154.
15. CHARLES B,NAVIL F Analgesics For the Treatment of Pain in Children N Engl J Med,2002,347:1542.
16. Dai Y,Lei D,Zuo Y,et al. Estimation of the minimum effective dose of tramadol for postoperative analgesia in infants using the continual reassessment method. Front Med,2012,6(3):288-295.
17. Ecoffey C,Lacroix F,Giaufre E et al. Epidemiology and morbidity of regional anesthesia in children:a followup one-year prospective survey of the French-Language Society of Paediatric Anaesthesiologists (ADARPEF). Paediatr Anaesth,2010,20:1061-9.
18. Edwards TJ,Carty SJ,Carr AS et al. Local anaesthetic wound infiltration following paediatric appendicectomy:a randomised controlled trial:time to stop using local anaesthetic wound infiltration following paediatric appendicectomy? Int J Surg,2011,9:314-317.
19. Fredrickson MJ,Paine C,Hamill J. Improved analgesia with the ilioinguinal block compared to the transversus abdominis plane block after pediatric inguinal surgery:a prospective randomized trial. Paediatr Anaesth,2010,20:1022-1027.
20. Howard RF,Lloyd-Thomas A,Thomas M,Nursecontrolled analgesia (NCA) following major surgery in 10,000 patients in a children’s hospital. Paediatr Anaesth,2010,20(2):126-134.
21. Inanoglu K,Ozcengiz D,Gunes Y et al. Epidural ropivacaine versus ropivacaine plus tramadol in postoperative analgesia in children undergoing major abdominal surgery:a comparison. J Anesth,2010,24:700-704.
22. Krane EJ. Polaner D. e safety and effectiveness of continuous peripheral nerve blockade in children. Anesthesia & Analgesia,2014,118(3):499-500.
23. Krechel,SW and Bildner,J. CRIES:A new neonatal postoperative pain measurement score. Initial testing of validity and reliability. Paediatric Anaesthesia,1995,5:53-61.
24. Martin J,Heymann A,Bäsell K,et al. Evidence and consensus-based German guidelines for the management of analgesia,sedation and delirium in intensive care—short version. German Medical Science,2010,2:8.
25. McHoney M,Wade AM,Eaton S et al. Clinical outcome of a randomized controlled blinded trial of open versus laparoscopic Nissen fundoplication in infants and children. Ann Surg,2011,254:209-216.
26. Messerer B,Meschik J,Gutmann A,et al. Postoperative pain assessment in special patient groups:part Ⅱ. Children with cognitive impairment. Schmerz,2011,25(3):256-265.
27. Merkel SI,Voepel-Lewis T,Shayevitz JR,Malviya S. The FLACC:a behavioral scale for scoring postoperative pain in young children. Pediatric Nursing,1997,23(3):293-297.
28. Messerer B,Gutmann A,Vittinghoff M,et al. Postoperative pain assessment in special patient groups:part I:children without cognitive impairment. Schmerz.,2011,25(3):245-255.
29. Michelet D,Andreu-Gallien J,Bensalah T,et al. A metaanalysis of the use of nonsteroidal antiinflammatory drugs for pediatric postoperative pain. Anesthesia & Analgesia,2012,114(2):393-406.
30. Naja Z,Al-Tannir MA,Faysal W et al. A comparison of pudendal block vs dorsal penile nerve block for circumcision in children:a randomised controlled trial. Anaesthesia,2011,66:802-807.
31. Ong CK,Seymour RA,Lirk P,et al. Combining paracetamol (acetaminophen) with nonsteroidal antiinflammatory drugs:a qualitative systematic review of analgesic efficacy for acute postoperative pain. Anesthesia & Analgesia,2010,110(4):1170-1179.
32. Richard H,Bernadette C,Joe C,et al. Association of Paediatric Anaesthetists:Good Practice in Postoperative and Procedural Pain [EB/OL]. www.britishpainsociety. org/book_apa_part1.html.
33. Shobha Malviya,David M. Polaner,and Charles Berde. Acute pain. In:A practice of anesthesia for infants and children. [edited by] Charles J. Cote,Jerrold Lerman,I Daved,Todres. 4th ed. SAUNDERS ELSEVIER.2009,Philadelphia.
34. Slater R,Cornelissen L,Fabrizi L et al. Oral sucrose as an analgesic drug for procedural pain in newborn infants:a randomized controlled trial. Lancet,2010,376:1225-1232.
35. Sohn VY. Zenger D. Steele SR. Pain management in the pediatric surgical patient. Surgical Clinics of North America,2012,92(3):471-485.
36. Splinter WM,Thomson ME. Somatic paravertebral block decreases opioid requirements in children undergoing appendectomy. Can J Anaesth,2010,57:206-210.
37. Stinson IN,Kavanagh T,Yamada J,Gill N,Stevens B.Systematic review of the psychometric properties,interpretability and feasibility of self-report pain intensity measures for use in clinical trials in children and adolescents. Pain,2006,125:143-157.
38. Taddio A,Katz J,Ilersich AL,et al. Effect of neonatal circumcision on pain response during subsequent routine vaccination. Lancet,1997,349:599-603.
39. Taylor J,Liley A,Anderson BJ. The relationship between age and morphine infusion rate in children. Paediatr Anaesth,2013,23(1):40-4.
40. The Children’s Hospital at Westmead. Pain Management Practice Guideline,2010.
41. Voepel-Lewis T,Wagner D,Burke C,et al. Early adjuvant use of nonopioids associated with reduced odds of serious postoperative opioid adverse events and need for rescue in children. Paediatr Anaesth,2013,23(2):162-169.
42. Walter-Nicolet E,Annequin D,Biran V et al. Pain management in newborns:from prevention to treatment. Paediatr Drugs,2010,12:353-365.
43. Wolf AR,Jackman L. Analgesia and sedation after pediatric cardiac surgery. Paediatr Anaesth,2011,21(5):567-576.
44. Wong,D. and Baker,C. Pain in children:comparison of assessment scales,Pediatric Nursing,1988,14(1):9-17.