 去看看
去看看


一、简介
外阴癌发病率不高,占所有女性恶性肿瘤的1%以下,占女性生殖道原发性恶性肿瘤的3%~5%。多见于老年人,近年来发病有年轻化趋势,< 40岁的患者占40%。约90%的原发性外阴癌为鳞状细胞癌,其他包括恶性黑色素瘤、腺癌、基底细胞癌、疣状癌、肉瘤及其他罕见的外阴恶性肿瘤等。虽然外阴癌位于体表易于早期发现,但传统观念常常拖延了患者就诊的时机。而且由于多数患者伴有长期的外阴良性疾病史或合并其他妇科疾病,临床上也易被误诊。对外阴癌的治疗强调个体化和综合治疗。近年来,随着对外阴癌认识的深入和放、化疗的发展,手术范围趋于缩小,重视保留外阴的生理功能,减轻术后患者生理及心理方面的创伤,综合应用放疗及化疗,在提高疗效的同时,注意改善患者的生活质量。外阴癌患者的5年生存率为52%~85%,预后与腹股沟淋巴结转移密切相关。由于发病率低,病例数较少,临床随机研究很少,对外阴癌的治疗方式需要更进一步的研究。
二、诊断
1.危险因素
流行病学调查发现,外阴癌可以分为与人乳头状瘤病毒(human papillomavirus,HPV)感染相关和不相关两大类:①与HPV感染有关的外阴癌患者:多为年轻妇女,可能有外阴湿疣的病史。并且吸烟可能是这一部分患者发病的危险因素。HPV感染的型别以HPV 16、18、31型多见,所导致的外阴癌的病理类型多为鳞癌。②另一部分与HPV感染无关的外阴癌患者:多为老年妇女,不吸烟,与外阴的慢性营养障碍,如外阴硬化性苔癣、外阴增生性营养障碍等有关,可合并有外阴的上皮内瘤变(vulvar intraepithelial neoplasia,VIN)。肥胖、高血压、糖尿病、免疫功能低下可能与外阴癌发生有一定关系,但不是独立的危险因素。
对有上述危险因素者,特别是有外阴硬化性苔癣或VIN 3,以及生殖道其他部位恶性肿瘤的患者应定期检查外阴,必要时可进行阴道镜检查进一步评估。
2.症状和体征
外阴癌多见于绝经后妇女。一些患者有外阴前驱病变的病史,如外阴硬化萎缩性苔癣、外阴增生性营养障碍等。最常见的症状是外阴瘙痒、局部肿块或溃疡,可伴有疼痛、出血、排尿困难及阴道排液,少部分患者可没有任何症状。
根据病灶部位分为中线型和侧位型,前者包括位于阴道口、尿道口、肛门、会阴后联合及会阴体的病灶,后者包括位于大小阴唇的病灶。可表现为单个或多发结节、菜花样肿物或浸润性溃疡。最多见的部位是大阴唇,其次是小阴唇、阴蒂、会阴体,可累及肛门、尿道和阴道。可出现一侧或双侧腹股沟淋巴结的肿大,甚至溃疡。
妇科检查时应注意外阴肿物的部位、大小、质地、活动度、与周围组织的关系,注意双侧腹股沟区是否有肿大的淋巴结。并应仔细检查阴道、宫颈、子宫及双侧附件区,以排除其他生殖器官的转移瘤。
3.病理诊断
对体检发现的任何外阴病变在治疗前均应行活检病理确诊。活检组织应包括病灶、病灶周围的皮肤和部分皮下组织,推荐在局麻下行病灶切取活检。如果病灶直径≤2cm,必须完整切除病灶(局部广泛切除),进行连续切片以正确评估浸润深度。但对较大的病灶不宜行整个病灶的切除活检,因不利于确定进一步切除的范围。病理报告应包括以下内容:
(1) 肿瘤浸润深度:必要时进行连续切片确定浸润的深度,以协助制订进一步治疗方案。
(2) 病理组织学类型:鳞状细胞癌是外阴癌最常见的类型,其次为恶性黑色素瘤、腺癌、基底细胞癌、疣状癌、肉瘤等。
(3) 组织病理学分级
Gx—分级无法评估
G1—高分化
G2—中分化
G3—低分化
(4) 脉管间隙受累:若肿瘤呈浸润性生长或有淋巴血管间隙受累,则局部复发率较高,预后较差。
(5) 手术后的病理报告应包括转移淋巴结的数量、转移灶大小,及是否有囊外扩散。
4.辅助检查
(1) 宫颈涂片细胞学检查。
(2) 阴道镜检查:了解宫颈和阴道是否同时也有病变,如宫颈上皮内瘤变(CIN)或阴道上皮内瘤变(VAIN)。
(3) 盆腔和腹腔CT/MRI检查:有助于了解相应部位的淋巴结及周围组织器官受累的情况。
(4) 对晚期患者,可通过膀胱镜、直肠镜了解膀胱黏膜或直肠黏膜是否受累。
(5) 对临床可疑转移淋巴结或其他可疑转移病灶必要时可行细针穿刺活检。
(6) 建议常规行宫颈及外阴病灶HPV DNA检测及梅毒抗体检测。
5.分期
1994年修订的外阴癌手术-病理分期存在着一些问题,如仅依据临床检查评估腹股沟淋巴结有无转移的准确性不高;以病灶大小2cm区分Ⅰ期和Ⅱ期预后无差别;而同为Ⅲ期的患者预后差别却甚大,且没有考虑转移淋巴结的数量、大小和淋巴结囊外受累的情况等。2009年5月,FIGO公布了再次修订后的外阴癌新分期(表1)。
新分期的变化有以下几点:
(1) 病灶局限于外阴,无淋巴结转移,不论病灶大小都归为Ⅰ期。而ⅠA和ⅠB期的区别不仅有浸润深度的不同(1.0mm为界),还有肿瘤大小的区别(2cm为界)。
(2) Ⅱ期的标准也要求淋巴结阴性,不论肿瘤大小,如果侵犯了邻近会阴组织,包括下1/3尿道、下1/3阴道或肛门就属于Ⅱ期,而这种情况在旧分期中属于Ⅲ期。
(3) Ⅲ期最基本的诊断标准是有阳性的腹股沟淋巴结,而不论肿瘤大小和有无邻近会阴结构受累。并且,根据淋巴结转移的数量和转移灶的大小,以及有无囊外扩散,Ⅲ期又分出A、B、C三个亚分期。
(4) ⅣA期增加了“上2/3阴道受侵”的情况。此外,重要的改变是依据转移淋巴结的状态(如固定或溃疡形成),而不再是依据侧别(双侧淋巴结转移)诊断ⅣA期。
表1 外阴癌分期(FIGO,2009年)

三、治疗
1.外阴上皮内瘤样病变(VIN)的处理
近年来,VIN的发病率在性生活活跃的年轻妇女中渐趋增加。VIN的自然病史尚不完全确定,有一定的恶变潜能,约2%~4%进展为浸润癌,但约有38%的VIN可以自行消退。在治疗前应通过多点活检确定病变完全为上皮内病变。
(1) VIN 1的处理
1) 定期观察:大多数VIN 1可自行消退,可以定期行阴道镜检查。如果无明显症状且病变未发生变化,可暂不予治疗。
2) 对有症状者,可选择外用药物,如氟尿嘧啶软膏、咪喹莫特软膏等,或激光治疗。
(2) VIN 2和VIN 3的处理:
多采用外阴表浅上皮局部切除术,切缘超过病灶外0.5~1cm即可,注意保存外阴基本的解剖构型。由于阴蒂较少受累,故一般都能保留阴蒂及其正常功能,这对于年轻妇女尤为重要。如果病变累及小阴唇或阴蒂,则更多采用激光汽化或部分切除。如病变较广泛或为多灶性,可考虑行外阴皮肤切除术(skinning vulvectomy)。这种方法切除了病变处的表皮层及真皮层,保留了皮下组织,尽量保留阴蒂,从而保留了外阴的外观和功能。必要时植皮。
应该向患者说明,即使切除了病变,仍有复发的可能,而复发并不一定就是治疗的失败。妇科医师应向患者清楚解释这种疾病的性质特点,以及病变本身的自然病史,并告知随访检查的重要性。
2.外阴浸润癌的处理
(1) 治疗原则
1) 手术治疗:外阴癌的治疗以手术治疗为主,强调个体化、多学科综合治疗。手术为首先考虑的治疗手段,传统的手术方式是广泛的全外阴切除及腹股沟淋巴结清扫术,有时还附加盆腔淋巴结清扫术。长期以来,这种传统的手术方式普遍应用于各种不同期别及不同组织学类型的外阴癌,虽取得了较好的治疗效果,但这种不加选择的广泛切除方式给患者造成的创伤较大,大多数患者手术伤口不能一期愈合,需要长期换药或植皮,伤口愈合后其瘢痕使外阴严重变形,对性生活或心理影响较大。此外,老年患者对这种创伤性较大的手术耐受性差,易发生各种并发症。手术后出现的下肢淋巴水肿也给患者带来很大的困扰,严重影响患者的生活质量。近年来研究发现,手术范围趋于缩小的改良手术方式并不影响早期患者的预后,对晚期患者应重视与放疗、化疗相结合的综合治疗。
2) 放射治疗:一般不作为外阴癌的首选治疗,因为外阴组织对放射线耐受性差。但放疗是外阴癌综合治疗的重要组成部分,是有效的辅助治疗。研究表明,对淋巴结转移患者进行术后腹股沟区及盆腔放射治疗可改善生存,减少复发。外阴肿瘤大或侵及尿道、肛门者,术前放疗可以减小肿瘤体积、降低肿瘤细胞活性、增加手术切除率及保留尿道和肛门括约肌功能。少数由于心、肝、肾功能不全而不宜接受手术治疗的患者,或因肿瘤情况无法手术治疗的患者,可选择全量放疗。
3) 抗癌药物治疗:化疗在外阴癌治疗中的地位尚存在一定争议,其应用主要有以下几个方面:①作为手术前的新辅助治疗,缩小肿瘤以利于后续的治疗;②与放疗联合应用治疗无法手术的患者;③作为术后的补充治疗,可单独使用或与放疗联用;④用于复发患者的治疗。由于外阴癌发病率低,病例数少,化疗对外阴癌的作用尚缺乏高级别循证医学的证据。
(2)外阴微小浸润癌(ⅠA期)的处理:
外阴微小浸润癌定义为肿瘤直径≤2cm及浸润深度≤1mm的单个外阴病灶。应行局部广泛切除术(wide local excision),手术切缘距离肿瘤边缘1cm,深度至少1cm,需达皮下组织。如果局部切除标本显示有神经或血管侵犯,应该考虑更广泛的切除。通常不需要切除腹股沟淋巴结。
(3)早期外阴癌的处理:
早期外阴癌被定义为肿瘤局限于外阴,未侵犯邻近器官,且临床无可疑淋巴结转移者。对早期患者,应先处理原发病灶,然后依据病灶的病理检查情况,决定进一步对淋巴结的处理。
1) 原发病灶的治疗:如果病变局限,推荐采用外阴广泛性局部切除术(radical local excision)。手术切除范围应包括癌灶周围至少1cm宽的外观正常的组织,深度应达尿生殖膈下筋膜。如果癌灶在阴蒂部位或其附近,则应切除阴蒂。与传统手术相比,此保守性术式在预防局部复发方面疗效相当,可减少术后对患者性心理的影响。如果同时存在VIN或硬化性苔癣,应该切除病变部位的表浅皮肤组织以控制症状;若怀疑有潜在的浸润性病灶,则切除深度同浸润癌。
对病灶较大或病灶靠近尿道或肛门的病例,可根据具体情况选择以下治疗:①进行更广泛的手术。例如在估计不会引起尿失禁的情况下可以切除尿道远端1cm。②术前辅助放疗或同期放化疗,以缩小对尿道及肛门部位的切除范围。术前放疗可使病变缩小,增加病变切缘的阴性率,并使保留尿道和肛门成为可能。放射剂量一般为25~30Gy/3~4w,照射时注意保持外阴清洁和干燥,减少感染,放疗结束休息2~3周后行手术治疗。
同期放化疗时常用的化疗药物为顺铂(DDP)、氟尿嘧啶(5-FU)、博来霉素(BLM)、丝裂霉素(MMC)等。用药途径可选择静脉化疗或动脉灌注化疗。可单用顺铂,剂量为每周30~40mg/m2。也可选用铂类为基础的联合化疗,在放疗过程的第1周及第4周给药。
2) 腹股沟淋巴结的切除:腹股沟区复发者死亡率非常高,适当的腹股沟和股淋巴结切除术是减少早期外阴癌死亡率的重要影响因素。其处理原则如下:
A.同侧腹股沟、股淋巴结切除:适用于侧位型肿瘤,包括间质浸润深度> 1mm的T1期和所有T2期。
B.双侧腹股沟、股淋巴结切除:适用于中线型肿瘤,累及小阴唇前部的肿瘤,或一侧病灶较大的侧位型肿瘤,尤其是同侧淋巴结阳性者。
C.术中发现可疑肿大淋巴结并经冷冻病理检查证实淋巴结阳性者,建议仅切除增大的淋巴结,而避免系统的淋巴结切除术,术后给予腹股沟和盆腔放疗。因为系统的腹股沟股淋巴结切除术加上术后放疗可能导致严重的下肢淋巴水肿。
D.推荐同时切除腹股沟淋巴结和股淋巴结。股淋巴结位于卵圆窝内股静脉的内侧,切除股淋巴结时不必去除阔筋膜。
E.对病灶位于阴蒂或阴蒂周围者,可选择传统的外阴和腹股沟整块切除方法,但应保留浅筋膜上方的皮下组织。这种方法术后伤口愈合时间长,常需植皮处理。目前多行三切口切除术,将外阴切除与腹股沟淋巴结清除分开进行,在外阴和腹股沟之间留下皮肤间桥,可明显改善伤口愈合,早期患者皮肤间桥处的复发率也很低。
F.建议行腹股沟淋巴结切除术时保留大隐静脉,有助于减少术后伤口的炎症及下肢水肿。同时行缝匠肌移位有助于保护股管,减少术后可能发生的损伤。
G.对肿瘤直径< 4cm的早期外阴癌,可考虑探索应用前哨淋巴结(sentinel lymph node,SLN)检测技术,以预测腹股沟淋巴结是否转移,可避免对无淋巴结转移的患者进行不必要的腹股沟淋巴结清扫。推荐联合使用蓝染料和放射性核素法。单用蓝染料检测外阴癌SLN方法简单,不需要特殊设备,但SLN检出率比联合两种方法为低。外阴癌SLN检测要求手术医师有足够的训练和经验,并且要对病例进行选择,排除一些可能影响SLN检出率的因素(如中线型肿瘤、肿瘤体积过大、术前曾行放疗或病灶切除活检等)。此外,SLN检测有一定的假阴性率(即SLN无转移,而非SLN的淋巴结出现转移),文献报道外阴癌SLN的假阴性率为0~4%。SLN假阴性的发生可能与肿瘤的部位、分期、患者肥胖、病理检查方法、术者经验等有一定关系。
3) 腹股沟淋巴结转移的补充治疗:手术后病理检查发现腹股沟淋巴结转移的患者,应考虑给予补充盆腔和腹股沟区放疗,区域放疗的效果优于盆腔淋巴结切除术。术后放疗指征包括:①一处大转移(直径> 10mm);②淋巴结囊外扩散或血管淋巴间隙受累;③两处或更多处微转移(< 5mm)。术后病理检查发现仅有1处微转移者不需要辅助放疗。
放疗剂量根据病变范围和残余病灶来确定。腹股沟淋巴结为镜下转移者,放疗剂量为50Gy;如果多个淋巴结阳性,或有囊外扩散,或有血管淋巴间隙受累者,应给予60Gy;如果有大块残余病灶,剂量需增加至60~70Gy。
4) 术后原发病灶的补充治疗:手术切缘阳性或手术切缘距肿瘤边缘太近、脉管有癌栓者,可行术后外照射,剂量为40~50Gy/4~5w。术后放疗开始时间与手术间隔不宜超过6周。
5) 术后的辅助化疗:对早期外阴鳞癌患者,手术后一般不需要加化疗。但对外阴病灶较大(如> 4cm)的非鳞癌(如腺癌或肉瘤)患者,术后应考虑给予3~4个疗程的联合化疗。根据病理类型酌情选择化疗方案。对腺癌可选择铂类为基础的化疗方案,对肉瘤可选择ⅠA(异环磷酰胺+多柔比星)方案等。
(4) 晚期外阴癌的处理:
晚期外阴癌定义为肿瘤为T3、T4期,或者临床体检腹股沟淋巴结有明显阳性表现者。对晚期患者,多种方法的综合治疗非常重要。与早期外阴癌的处理有所不同,对晚期病例在进行任何治疗前应先了解腹股沟淋巴结的状态,原发外阴病灶的处理应在腹股沟淋巴结切除之后进行。
1) 腹股沟淋巴结的处理
A.如果在腹股沟区未触到可疑的淋巴结,应行双侧腹股沟和股淋巴结切除术。如果最后病理检查淋巴结阳性,术后应给予腹股沟区和盆腔区辅助放疗(参考早期外阴癌淋巴结转移的处理)。
B.如果临床检查发现腹股沟淋巴结肿大、可疑有转移者,应考虑先行盆腔CT检查,以确定腹股沟和盆腔淋巴结切除的范围,然后切除所有增大的腹股沟淋巴结,行快速冷冻切片病理检查。对冷冻病理检查淋巴结阴性者,行系统的腹股沟、股淋巴结切除术,如果最后的病理检查淋巴结阳性,术后给予辅助放疗(参考早期外阴癌淋巴结转移的处理)。对冷冻病理检查淋巴结阳性者,建议仅切除增大的淋巴结,而避免系统的淋巴结切除术,术后给予腹股沟和盆腔放疗。
C.如果临床检查发现腹股沟淋巴结阳性者,行盆腔CT检查,然后切除腹股沟和盆腔增大的淋巴结,术后补充放疗。如果腹股沟淋巴结固定或出现溃疡不可手术切除,应取活检进行确诊,然后行放射治疗,并可考虑加同期化疗。部分病例放疗后可再行淋巴结切除术。
D.对腹股沟淋巴结阳性的患者,术后的辅助放疗宜尽早施行。
2) 原发肿瘤的处理
A.如果估计可完整切除原发肿瘤使切缘阴性,且不损伤括约肌造成大小便失禁,可以先考虑手术切除(如全外阴广泛切除或改良外阴广泛切除),病灶较大者切除术后通常需要邻近皮瓣转移或带蒂游离皮瓣移植修复创面。
B.如果手术需行肠造瘘或尿路改道,最好先放疗[和(或)化疗],待肿瘤缩小后再手术。若计划手术治疗,术前放疗剂量不宜超过55Gy。
C.如果无法手术切除,可行根治性放疗加化疗。放射野包括原发病灶、腹股沟及盆腔淋巴结区域。总剂量一般需50~60Gy。对大块外阴病灶,放疗剂量需要60~70Gy才能达到局部控制。少数患者在放疗后密切随访6~12周,如仍有肿瘤残留,可考虑手术切除残留病灶。
D.若手术切缘邻近癌灶(< 5mm),又无法再行扩大切除,术后应补充局部放疗。某些病例可加用近距离放射治疗阳性切缘,但应注意避免组织坏死的出现。
3) 辅助化疗:化疗多作为手术或放疗的辅助治疗,也是对ⅣB期患者常需采用的治疗方法。常用的化疗方案如下:①单药顺铂:30~40mg/m2,每周1次,5~6次,与放疗同期进行。②联合化疗:疗程数视具体情况而定,可选择FP方案(5-FU + DDP)、PMB方案(DDP + BLM + MTX)、FM方案(5-FU + MMC)等,每3~4周重复。可与放疗同期进行,或在手术后、放疗后进行。
(5) 复发性外阴癌的治疗:
外阴浸润性鳞癌复发率为15%~33%。外阴局部为最常见的复发部位(约占70%)。外阴癌局部复发一般需再次行手术治疗,治疗方案及疗效取决于复发的部位和范围。
1) 近半数的复发病灶是外阴的孤立病灶,可以再次手术切除。整形外科手术技术使得复发性外阴癌特别是较大的复发病灶得以切除,各种包括肌肉皮瓣移植在复发性外阴癌的手术中已广泛应用。不能手术者行局部放疗,50~60Gy/5~6w。如果局部皮肤反应明显,可照射30~40Gy后休息2~3周,再继续治疗。必要时可加用组织间插植放疗。
2) 阴道有浸润时,可加用阴道后装放疗。如果既往已接受足量放疗,无法接受再程放疗者,可考虑手术切除。但这类情况手术难度大,需要充分考虑切除后的重建和改道手术。
3) 腹股沟区复发的病例预后差,少有长期生存的病例。放射治疗联合手术治疗可用于腹股沟区复发,应根据以往的治疗情况来权衡利弊,选择治疗手段。
4) 远处复发较难控制,有效的化疗药物为顺铂、氨甲蝶呤、环磷酰胺、博来霉素和丝裂霉素等。然而,化疗的反应率低且疗效只能维持较短时间。若化疗过程肿瘤进展或为铂类化疗后复发者,可考虑用紫杉醇、吉西他滨、拓扑替康、长春瑞滨等。
四、特殊类型的外阴肿瘤
1.外阴黑色素瘤(vulvar melanoma)
(1) 发病居外阴恶性肿瘤的第2位,恶性程度较高,较早出现远处转移,易复发。
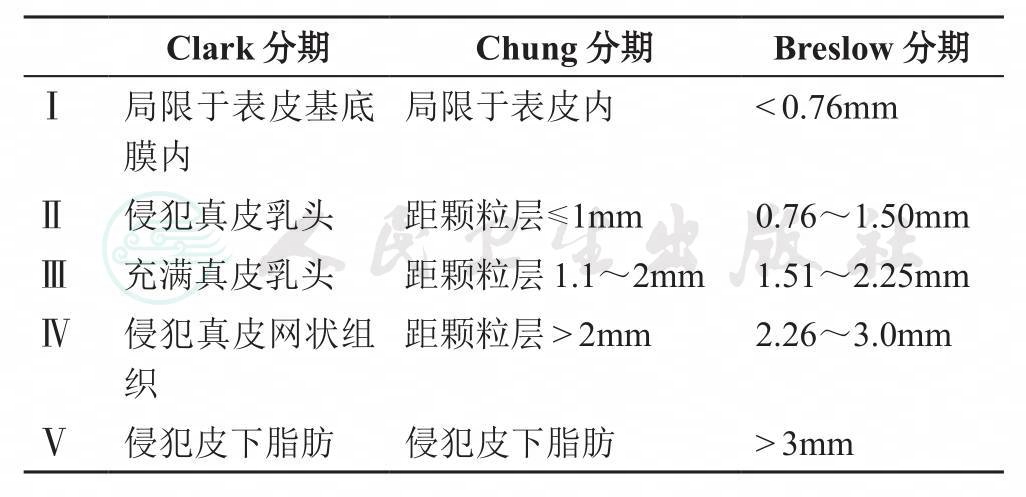
(2) 外阴黑色素瘤分期不用FIGO外阴癌分期,应参考Clark分期(Clark's staging classification by levels)、Chung分期和Breslow分期系统(表2)。
(3) 对外阴色素性病变应行活检(咬取、切取或切除)病理确诊。
表2 外阴恶性黑色素瘤的镜下分期
(4) 外阴黑色素瘤的治疗原则与其他外阴恶性肿瘤相同,手术倾向更为保守。与根治性局部切除手术比较,根治性外阴切除对改善外阴黑色素瘤的预后似乎作用不大。手术切缘应离开病变至少1cm。
(5) 淋巴结切除术的意义还有争议,有研究表明选择性淋巴结切除对生存有益。
(6) 免疫治疗在黑色素瘤的辅助治疗中占有较为重要的地位。根治性手术后的辅助治疗应首选免疫治疗。可选用α-干扰素(术后每天用2000万单位/毫升,静脉注射;4周后改为每天1000万单位/毫升,皮下注射,3次/周,共48周)等。
(7) 黑色素瘤对化疗不敏感,化疗一般用于晚期患者的姑息治疗。常用药物为达卡巴嗪(dacarbazine,DTIC),也可选用替莫唑胺(temozolomide)、沙利度胺(thalidomide)等。
2.前庭大腺癌(bartholin gland cancer)
(1) 发生在前庭大腺的恶性肿瘤可以是移行细胞癌或鳞状细胞癌,也可以是发生于导管或腺体本身的腺癌,囊腺癌、腺鳞癌亦有报道。
(2) 通常在已经有较长病史的前庭大腺囊肿切除后才作出诊断。
(3) 根治性外阴切除术和双侧腹股沟淋巴切除一直是前庭大腺癌的标准治疗方法。早期病灶可采用一侧外阴的根治性切除术和同侧腹股沟淋巴切除。
(4) 对于瘤体较大者,术后放疗可以减少局部复发。如果同侧腹股沟淋巴结阳性,双侧腹股沟和盆腔淋巴结区的放疗可以减少区域复发。
(5) 对于腺样囊性病变,可仅行根治性局部切除术。切缘阳性或神经束膜浸润者术后辅助局部放疗。
(6) 化疗可能有助于减少远处转移。
3.外阴派杰病(Paget's disease)
外阴Paget病分为Ⅰ型、Ⅱ型两类。Ⅰ型外阴Paget病起源于皮肤,又可分为3个亚型:Ⅰa型为原发的上皮内Paget病;Ⅰb型为有潜在侵袭可能的上皮内瘤变;Ⅰc型为皮肤附属器或外阴腺体来源的隐匿性腺癌。Ⅱ型外阴Paget病则为非皮肤起源。
(1) 绝大多数外阴派杰病是上皮内病变,属VIN 3,偶尔会表现为浸润性腺癌。该病主要发生于围绝经或绝经后妇女。大多数患者主诉外阴不适和瘙痒,体检常呈湿疹样外观。确诊需活检。
(2) 上皮内派杰病需要进行表浅局部切除术。由于潜在的组织学改变常超过临床可见的病变范围,确定一个清楚的手术切除范围非常困难。术后再出现症状或病灶明显时可再行手术切除。
(3) 病变侵犯或扩散到尿道或肛门时,处理非常困难,可能需要激光治疗。
(4) 如果是潜在腺癌,对浸润部分必须行根治性局部切除术,切缘至少离开病灶边缘1cm。单侧病变至少应行同侧腹股沟淋巴结切除术,术后是否辅助放疗有争议。
(5) 对复发派杰病的治疗仍以手术切除为主。激光治疗对肛周复发是一种好的选择。
4.外阴肉瘤
肉瘤占外阴恶性肿瘤的1%~2%,包含了一系列异源性的肿瘤类型。平滑肌肉瘤是最常见的组织学类型,其他类型包括纤维肉瘤、神经纤维肉瘤、脂肪肉瘤、横纹肌肉瘤、血管肉瘤、上皮样肉瘤及恶性神经鞘瘤。总的5年生存率约为70%。
(1) 外阴肉瘤首选的治疗为根治性局部切除术,淋巴转移并不常见。辅助性放射治疗可用于高级别肉瘤和局部复发的低级别肉瘤。
(2) 平滑肌肉瘤常表现为肿大、疼痛的肿块,大阴唇为平滑肌肉瘤的好发区。
(3) 发生于外阴的上皮样肉瘤极少。然而,外阴上皮样肉瘤生物学行为比生殖器外的上皮样肉瘤具有更强的侵袭性。早期就呈局部扩张性生长、局部复发、淋巴结转移和远处转移的倾向。治疗方案为根治性肿瘤切除,并至少切除患侧腹股沟淋巴结。可辅助放射治疗,上皮样肉瘤对全身治疗不敏感。
(4) 原发于外阴的横纹肌肉瘤少见,多发生于儿童和少年。组织学亚型包括胚胎型、葡萄状和肺泡/未分化型。治疗方案为化疗(长春新碱/放线菌素D ±环磷酰胺±多柔比星),并在化疗前/后手术治疗,可辅助放射治疗。
女性生殖道横纹肌肉瘤预后好,估计5年生存率为87%。
五、随访
对外阴癌局部复发如能及时发现、及时治疗,预后较好。因此,长期的随访是必要的,建议随访间隔如下:①第1年,每1~3个月1次;②第2、3年,每3~6个月1次;③3年后,每年1次。
[1] Pecorelli S. Revised FIGO staging for carcinoma of the vulva,cervix,and endometrium. FIGO Committee on Gynecologic Oncology. Int J Gynecol Obstet,2009,105(2):103-104
[2] Tabbaa ZM,Gonzalez J,Sznurkowski JJ,et al. Impact of the new FIGO 2009 staging classification for vulvar cancer on prognosis and stage distribution. Gynecol Oncol,2012,127 (1):147-152
[3] Van der Zee AG,Oonk MH,De Hullu JA,et al. Sentinel node dissection is safe in the treatment of early-stage vulvar cancer. J Clin Oncol,2008,26(6):884-889
[4] Levenback CF,Ali S,Coleman RL,et al. Lymphatic mapping and sentinel lymph node biopsy in women with squamous cell carcinoma of the vulva:a gynecologic oncology group study. J Clin Oncol,2012,30(31):3786-3791
[5] Maggioni KN,Gaarenstroom PJ,Baldwin EB,et al. Sentinel node dissection is safe in the treatment of early-stage vulvar cancer. J Clin Oncol,2008,26(6):884-889
[6] Berek JS,Hacker NF. Berek & Hacker's gynecologic oncology. 5th ed. Philadelphia:Wolters Kluwer/Lippincott Williams & Wilkins Health,2010:895
[7] Woelber L,Mahner S,Voelker K,et al. Clinicopathological prognostic factors and patterns of recurrence in vulvar cancer. Anticancer Res,2009,29(2):545-552
[8] Gaarenstroom KN,Kenter GG,Trimbos JB,et al. Postoperative complications after vulvectomy and inguinofemoral lymphadenectomy using separate groin incisions. Int J Gynecol Cancer,2003,13(4):522-527