患者女性,23岁。因“发作性右侧肢体麻木、乏力伴抖动3个月”于2012年6月1日入院。
现病史
患者3个月前无明显诱因出现发作性右侧肢体麻木、乏力伴抖动,每次发作持续3~5分钟,可自行缓解。发作时意识清楚,症状自右下肢开始,可不累及上肢,严重时站立不稳甚至跌倒,发作频率为6~7次/d;无头痛、言语困难,无视力及听力改变,无大小便失禁。入院前1个月无诱因出现意识障碍(持续时间不详),不伴抽搐,当地医院头部CT、脑电图、经颅多普勒超声(TCD)检查未见异常,MRI提示左侧额叶占位性病变,增强后病灶无明显强化。予丙戊酸钠(德巴金)0.5g(2次/d)口服并静脉滴注“红花”等活血化瘀药物,但肢体麻木、无力等症状仍频繁发作。发病以来自觉乏力症状明显,似运动后更易疲劳,记忆力有所下降,否认思维活动及情绪异常,无头痛症状。饮食正常,睡眠、大小便可,体质量无明显改变。好发皮疹,病因不明。病程中无发热,无关节红、肿、痛,无口干、眼干或雷诺现象。
既往史
5年前体格检查发现左肾结石,否认其他重大疾病病史、传染病病史、药物过敏史,否认有毒、有害物质接触史,否认烟酒嗜好。
个人史及家族史
未婚、未育。否认家族遗传性疾病及类似病史。
体格检查
神志清楚、语言流利,高级智能正常;视力、视野粗测正常,视盘无水肿;伸舌偏右,其余脑神经检查无明显异常。四肢肌力5级,右侧肢体轻瘫试验阳性;双侧肌张力对称、正常,右侧肱二头肌、肱三头肌、桡骨膜、膝腱、跟腱反射较左侧活跃,右下肢针刺痛觉、音叉振动觉、关节位置觉减退。双手指鼻试验、双侧跟-膝-胫试验稳准,闭目难立征阴性。双侧病理征未引出。
实验室与辅助检查
血、尿、粪便常规正常。血清病毒感染免疫检测、内分泌学指标、临床免疫学指标、副肿瘤相关抗体均于正常值范围。凝血功能检查未见异常。乳酸运动试验:运动前1.95mmol/L(参考值范围0.50~1.60mmol/L)、运动中2.94mmol/L、运动后2.62mmol/L。腰椎穿刺脑脊液检查压力、各项常规指标正常,寡克隆区带阴性。心脏超声检查未见明显异常。长程视频脑电图监测1小时内有数次发作,表现为右侧肢体无力伴右下肢抖动,持续3~5min/次,同步脑电图未发现背景活动改变。影像学检查:头部MRI提示左侧额顶叶皮质下局部肿胀,且呈脑回样稍长T1、长T2信号;弥散加权成像(DWI)呈高信号;表观弥散系数(ADC)值降低;FLAIR序列呈高信号,周围可见片状水肿样信号(图1)。磁共振波谱(MRS)分析左侧额顶叶交界区病灶谱线呈N-乙酰天冬氨酸(NAA)峰明显下降、胆碱(Cho)峰和肌醇(mI)峰升高。双侧颈总动脉、左侧颈内动脉、左侧椎动脉造影可见左侧顶区局部引流静脉中断,余无明显异常。鉴于临床表现及辅助检查结果,临床疑似短暂性脑缺血发作。予阿司匹林100mg口服(1次/d),发作次数由6~7次/d减至3~4次/d。
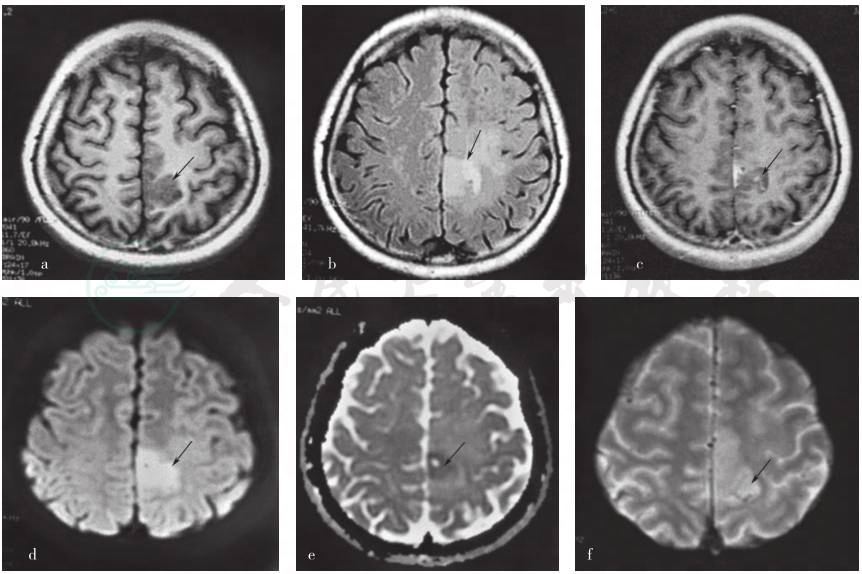
图 1 患者发病4个月头部MRI检查
a.横断面T1WI序列显示皮质下低信号(箭头所示);b.横断面FLAIR序列显示病灶呈高信号(箭头所示);c.横断面T1WI增强扫描病灶无明显强化(箭头所示);d.横断面DWI序列显示病灶呈高信号(箭头所示);e.病灶ADC值降低(箭头所示);f.GRE序列显示病灶及其周围组织无明显低信号表现(箭头所示),提示病灶内无含铁血黄素沉积
入院后1个月余(2012年7月4日)在神经导航引导下施行左侧额顶叶占位性病变探查及病灶部分切除术。术中可见病变主要位于左侧中央后回近大脑纵裂处,累及中央前回和中央后回后部。距中线旁开1cm处切开大脑皮质约1cm,可见其下呈灰红色的肿瘤样组织,质地脆软,血运一般,切取部分病变组织进行病理检查。术后病理检查结果:间变性星形细胞瘤(WHOⅢ~Ⅳ级,图2)。免疫组织化学染色显示,肿瘤细胞CD34、S-100蛋白、少突胶质细胞转录因子-2(Oligo-2)、P53阳性;并散在表达神经元核抗原(NeuN),个别肿瘤细胞突触素(Syn)阳性;神经胶质细胞原纤维酸性蛋白(GFAP)阴性;Ki-67抗原标记指数约为25%。网织纤维染色阴性。
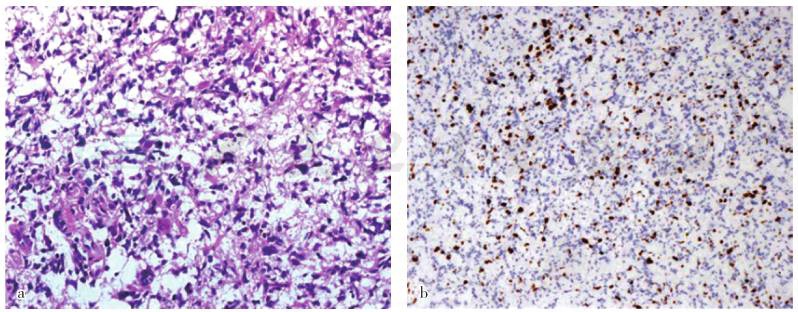
图2 光学显微镜观察所见
a.左侧额叶皮质下1cm脑组织神经胶质细胞呈肿瘤间变性表现,细胞数目增多且呈多形性变,胞核异型性明显HE染色,×300;b.肿瘤细胞Ki-67抗原标记指数约为25%,提示肿瘤组织增生活跃免疫组织化学染色(EnVision 二步法),×150
治疗经过
根据上述检查结果,最终诊断为“间变性星形细胞瘤”。术后患者意识、肌力、深浅感觉、高级智能无明显改善。给予丙戊酸钠500mg(2次/d)、甘油合剂20ml(3次/d)及多种维生素类药物口服。2012年7月21日出院时仍间断存在发作性右下肢乏力、抖动,但频率减至2~3次/d,乏力症状明显改善。出院后接受肿瘤局部放射治疗(总剂量60Gy)及口服替莫唑胺化疗(具体剂量不详)。电话随访至出院后8个月,上述症状无明显变化。
神经科主治医师
患者为年轻女性,发作性右侧肢体无力、麻木伴肢体抽动。症状多从下肢开始,可不累及上肢,每次持续3~5分钟后自行缓解,严重时伴跌倒,但无意识障碍、无大小便失禁,近期发作频率有所增加。既往无特殊病史,自述易发生皮肤过敏。体格检查右侧肢体轻瘫试验阳性,右侧腱反射活跃,右下肢针刺痛觉减退。MRI检查显示左侧额顶叶上部偏内侧稍长T1、长T2信号,沿脑回分布,两次MRI对比病灶范围虽有扩大但无明显强化。定位诊断:右侧肢体无力伴麻木,右侧腱反射活跃,提示感觉传导通路及上运动神经元病变,病变水平较高,但尚不能明确是高颈段、脑干还是以上部位。结合影像学检查定位于左侧大脑皮质运动和感觉功能区。定性诊断:根据病理检查明确诊断为间变性星形细胞瘤。该例患者从发病至术后病理检查明确诊断,经历一段较为复杂的病程,鉴于临床症状和影像学表现,考虑的诊断有:①脑血管病,临床表现为发作性症状,刻板、形式固定,以负性症状(肢体麻木、无力)为主,伴刺激性症状(肢体抽动),每次发作持续时间不超过30分钟,发作间期神经系统无明显异常体征,无头痛、呕吐、视力减退等颅内高压症状,符合短暂性脑缺血发作(TIA)的特点。同时应注意排除部分性癫痫,因为癫痫亦可有类似表现,而且癫痫引起的Todd麻痹亦可解释肢体轻瘫无力。但是其临床症状反复发作时脑电图并未记录到痫样放电,此为排除癫痫的有力证据。患者无脑血管病危险因素,亦无凝血系统疾病或心脏瓣膜病病史,病因应重点考虑血管炎及静脉系统血栓等少见病因,血清自身抗体检测、脑脊液和全脑血管造影检查有助于提高诊断效度和信度。该例患者血清自身抗体和脑脊液检测不支持血管炎的诊断,但全脑血管造影检查提示病灶周围存在静脉系统病变。近年来,越来越多的流行病学调查资料显示,皮质表浅静脉病变亦可引起癫痫、偏瘫、感觉障碍等类似传统脑卒中的表现,值得重视。但入院后期进行的MRI T2WI未发现点状含铁血黄素沉积表现,与典型的皮质静脉血栓不符。②肿瘤性病变,辅助检查提示胶质瘤,有时影像检查也可出现类似缺血性脑血管病的表现,病灶可呈长T1、长T2信号,DWI高信号或ADC值降低,甚至水肿占位效应不明显,但病灶自始至终无强化。提示急诊室因“脑卒中”就诊的中老年人群中可能混有一定比例的瘤卒中病例,而MRI有时可在瘤卒中早期出现误诊和漏诊。因此,对于临床表现不典型的脑血管病患者,肿瘤性病变应作为重点鉴别内容。③线粒体DNA突变引起的脑肌病,也可出现如癫痫、肌阵挛、偏瘫、眼外肌麻痹等表现,MRI检查可见典型的皮质层状坏死。该例患者病灶位于中央后回皮质和皮质下,手术风险较大,因此术前需重点与线粒体脑肌病相鉴别,通过脑脊液乳酸、乳酸运动试验和MRS检查可予以排除。
神经外科医师
间变性星形细胞瘤呈局部或弥漫性间变,细胞数目增加,细胞呈多形性改变,胞核不典型且核分裂象活跃,血管增多。生物学行为似胶质母细胞瘤,且可迅速转变为胶质母细胞瘤。CT检查显示边界不清的低密度病灶,亦可呈高或等混杂密度,鲜见钙化,增强后病灶可不强化或仅局部强化。MRI检查显示病灶边界不清,T2WI呈混杂信号,增强后病灶不强化或仅局部强化。肿瘤占位效应及其对脑脊液循环的影响可引起颅内高压,亦可出现肢体瘫痪、麻木及癫痫发作等表现。低级别胶质瘤患者大多以抽搐为首发症状,患者一般预后较好,其原因可能与早期诊断、早期治疗有关。该例患者临床表现特殊,很难直接排除癫痫和脑血管病。
神经科教授
该例患者经脑组织活检证实为间变性星形细胞瘤。回顾其病程:发作性右侧肢体无力、麻木,伴右下肢抽动,脑电图未发现痫样放电,提示其发病机制与脑血管病变相关。进一步的检测结果不支持系统性凝血功能异常。MRI检查颅内病灶无强化;脑脊液检测未提示炎症性改变,亦不支持血管炎诊断;心脏超声未发现异常,不支持心源性栓塞诊断。全脑血管造影检查无异常,仅显示左侧顶区局部一引流静脉中断,推测可能与肿瘤向外压迫或浸润血管壁有关。考虑血管病变可能,施行抗血小板聚集和改善微循环药物治疗,发作次数有所减少,肢体无力、麻木症状缓解。对于青年反复发作性神经功能缺损表现,还应注意排除线粒体脑肌病和中枢神经系统炎症性疾病。
间变性星形细胞瘤(anaplastic astrocytoma,AA)
以急性脑血管病发病的颅内肿瘤已有文献报道,其中出血性卒中发生率显著高于缺血性卒中,临床表现与短暂性脑缺血发作相似的颅内肿瘤有脑膜瘤、胶质瘤、垂体腺瘤、颅内转移瘤等。近年有学者指出,在急诊室鉴别首发症状为短暂性脑缺血发作的颅内肿瘤十分重要,而对此类脑卒中患者进行溶栓治疗具有一定风险。关于肿瘤相关性短暂性脑缺血发作的发病机制,有以下假说:①盗血假说,Sakatani等通过任务刺激肿瘤及邻近脑区发现,刺激前后肿瘤相关区域脑血流量明显下降,而邻近脑区血流量明显增加,由此认为任务刺激导致的肿瘤邻近脑区可通过皮质支动脉从瘤体盗血。Terada等对包括胶质瘤在内的11例肿瘤患者进行临床观察发现,高血压可使局部肿瘤组织脑血流量增加,并高出邻近正常脑组织30%。肿瘤组织血流量明显增加揭示瘤体向正常脑组织盗血的潜在机制。②凝血机制异常,不仅炎性因子和前凝血物质异常可导致高凝状态,化疗药物也具有促进高凝状态的作用。③肿瘤对脑血管的侵袭破坏,Raizer和DeAngelis对20例肿瘤合并颅内静脉血栓形成患者的影像学观察显示,实体肿瘤可侵袭颅内静脉并造成静脉血栓形成或出血。④肿瘤来源的栓子可造成血管闭塞,栓子可来源于黏液腺等癌性病变,也可能是肿瘤直接侵袭血管壁而继发于颅内动脉瘤所形成。Edoute等和Patchell等分别报告了一系列肿瘤和无菌性心内膜赘生物的病例,并通过尸检等证实此类赘生物可造成颅内多发性动静脉血栓形成。⑤扩散性皮质抑制现象,动物实验结果证实大脑皮质对有害物质的刺激,包括机械、化学和电刺激的反应,经短暂强烈的、扩散性活动后即可自起始部向各个方向产生扩散性抑制,从而引起偏瘫和感觉障碍等表现。该例患者影像学检查肿瘤占位效应不十分明显,入院后经各项检查逐一排除癫痫、血液高凝状态、心源性栓塞、动脉狭窄等,唯有动静脉联合造影检查显示引流静脉中断征,具备静脉系统血管病变的证据。因此推测,频繁的短暂性脑缺血发作可能与静脉阻断有关,但缺乏术后静脉造影的证据。
该例患者术后经病理检查明确诊断为间变性星形细胞瘤,属于恶性胶质瘤。根据2000年世界卫生组织中枢神经系统肿瘤分类,星形细胞瘤共分为4 级:Ⅰ级包括毛细胞型星形细胞瘤、室管膜下巨细胞型星形细胞瘤;Ⅱ级有弥漫性星形细胞瘤、多形性黄色瘤型星形细胞瘤;Ⅲ级为间变性星形细胞瘤;Ⅳ级即胶质母细胞瘤或多形性胶质母细胞瘤。其中Ⅲ~Ⅳ级属恶性星形细胞瘤。根据Ohgaki和Kleihues对星形细胞瘤生存时间的总结,Ⅰ级星形细胞瘤10年生存率约为96%;Ⅱ级中位生存期5~6年;高级别星形细胞瘤中的间变性星形细胞瘤和多形性胶质母细胞瘤的中位生存期分别为1.61年和0.40年。高级别星形细胞瘤患者的平均发病年龄约为46岁,男女之比为3:2。虽然大部分恶性胶质瘤患者无家族遗传史,但仍有一些分子遗传学特点引起关注,如第17号染色体短臂、19号染色体长臂杂合性缺失(TP53基因)与间变性星形细胞瘤发病机制有关。迄今为止,手术治疗仍是恶性星形细胞瘤的主要治疗方法,可缩小肿瘤体积、降低颅内压,亦是辅助性放射治疗和药物化疗的前提。是否接受放射治疗是影响恶性胶质瘤患者预后的重要因素。采用分割技术放射治疗(如5000Gy每周、每日分数次完成)是否较传统的全脑照射治疗更能减少对正常脑组织的损害,目前尚存争议。传统化疗药物包括烷化剂及丙卡巴肼、洛莫司汀和长春新碱(PVC)化疗方案。卡莫司汀为传统烷化剂,可改变细胞内DNA 及蛋白质结构,从而引起DNA分子单链或双链解体及基因编码突变;替莫唑胺为新型烷化剂,于1999 年在美国和欧盟被批准上市,并于2005年被美国食品与药品管理局(FDA)批准作为新明确诊断胶质母细胞瘤患者的一线辅助化疗药物;替尼泊苷(VM26)联合司莫司汀(MeCCNU)方案也是传统高级别脑胶质瘤辅助药物化疗方案。高级别星形细胞瘤患者的预后与病理分级、临床神经功能评分、年龄及放射治疗密切相关。值得注意的是,2005年Pope等发现,肿瘤灶不强化是一项具有统计学意义的预后相关指标,肿瘤灶强化程度与肿瘤细胞侵袭能力和浸润能力有关,并首次提出肿瘤无强化是较强的预后良好标志。
对于伴有短暂性脑缺血发作表现的颅内肿瘤患者,治疗方案仍以处理原发病灶为主,肿瘤切除后短暂性脑缺血发作可明显改善。对于肿瘤合并静脉血栓形成病例,建议采用低分子肝素进行抗凝治疗。在疾病急性期,糖皮质激素治疗可改善脑水肿,对减轻症状亦有一定帮助。对于已经出现狭窄性改变的颅内动静脉,施行支架成形术、内膜切除术等均有成功报道。当然,门诊、急诊对疾病的判断直接影响原发肿瘤是否能够及时得到治疗及患者预后。但某些病例由于肿瘤占位效应不明显、病灶无强化,鉴别诊断较为困难。Morgenstern和Frankowski认为,老年肿瘤患者或多形性胶质母细胞瘤患者易被误诊为脑血管病。因此,对于临床高度怀疑的病例,建议行MRI、MRA和MRV检查以利于进一步明确诊断,另外,CT灌注成像亦有助于鉴别诊断。
[1]Sakatani K,Zuo HC,Wang Y,et al.Neuronal activity alters local blood flow in brain tumour adjacent to the activating cortex.J Neurol Neurosurg Psychiatry,1999,67(4):553-554.
[2]Rogers LR.Cerebrovascular complications in patients with cancer.Semin Neurol,2010,30(3):311-319.
[3]Raizer JJ,DeAngelis LM.Cerebral sinus thrombosis diagnosed by MRI and MR venography in cancer patients. Neurology,2000,54(6):1222-1226.
[4]Edoute Y,Haim N,Rinkevich D,et al.Cardiac valvular vegetations in cancer patients:a prospective echocardiographic study of 200 patients. Am J Med,1997,102(3):252-258.
[5]Ricard D,Idbaih A,Ducray F.Primary brain tumours in adults. Lancet,2012,379(9830):1984-1996.
[6]Behin A,Hoang-Xuan K,Carpentier AF,et al.Primary brain tumours in adults.Lancet,2003,361(9354):323-331.
[7]关鸿志,王长华,郭玉璞,等.脑脊液细胞学检查的特异性发现.中华神经科杂志,2004,37(1):65-67.
[8]Pope WB,Sayre J,Perlina A,et al.MR imaging correlates of survival in patients with high-grade gliomas.AJNR Am J Neuroradiol,2005,26(10):2466-2474.
[9]谭颖,卢强,高晶,等.发作性肢体麻木乏力伴抖动3个月.中国现代神经疾病杂志,2013,13(5):463-467.













