患者男性,46岁。因“睡眠增多、四肢乏力8个月,加重1个月”于2013年11月22日入院。
现病史
8个月前患者出现睡眠增多,往往在谈话过程中即入睡但易叫醒,并伴双下肢发沉;1个月后出现睡眠程度加深且时间延长,每日睡眠时间17~18小时,不易被叫醒,但可自行苏醒,醒后反应迟钝、四肢乏力。当地医院头部CT显示右侧顶叶低密度影、肌电图呈四肢肌源性损害,遂予以活血化瘀、营养神经对症治疗,但其症状仍逐渐加重并日常生活不能完全自理;头部增强扫描显示脑实质内多发异常信号,但无明显强化征象。腰椎穿刺脑脊液压力检测不详,白细胞总数12×106/L、蛋白定量0.73g/L。予营养神经、改善循环治疗,病情如前,予地塞米松治疗约15天,症状有所改善,睡眠时间明显减少,可从事日常活动,但四肢乏力症状无明显改善,遂停用激素。入院前1个月无明显诱因突发四肢抖动、呼之不应伴大小便失禁,持续时间不详。复查头部MRI病灶范围扩大,自此每天睡眠时间约20小时,但可自行苏醒,醒后反应迟钝、缄默伴进食缓慢、行走不稳,偶尔出现饮水呛咳,清醒30分钟后复进入睡眠状态。为求进一步诊断与治疗入我院。
患者自发病以来精神差、食欲尚可,嗜睡,偶有大小便失禁,体重无明显减轻。
既往史
幼时曾罹患黄疸型肝炎,25岁时行“阑尾炎”手术。否认其他重大疾病病史、传染病病史、药物过敏史,否认有毒、有害物质接触史。长期吸烟、饮酒。
个人史及家族史
无特殊。
入院查体
神清,精神差,反应迟钝,注意力涣散。时间、人物定向力减退,地点定向力尚可,记忆力、计算力减退。脑神经检查无异常。双侧上肢肌力5级、双下肢肌力5-级,四肢肌张力正常,腱反射对称引出。双侧Chaddock征、左侧Babinski征阳性。双侧指鼻、跟-膝-胫正常、轮替试验差,偶见左手静止性震颤。行走缓慢,转身有分解,Romberg征可疑阳性,后拉试验阳性。深浅感觉对称引出,脑膜刺激征阴性。
辅助检查
入院后辅助检查,①实验室检查,血、尿、粪便常规,以及肝肾功能试验、血清脂质、凝血功能试验、C反应蛋白(CRP)、乳酸、叶酸、维生素B12、同型半胱氨酸(Hcy)等项指标均于正常值范围。临床感染免疫检测、肿瘤标志物、免疫学指标阴性。血清乳酸脱氢酶(LD)254U/L(参考值范围0~250U/L)、肌酸肌酶(CK)744U/L、红细胞沉降率(ESR)18mm/h。腰椎穿刺脑脊液检测压力正常,寡克隆区带、免疫学指标、病原学指标阴性;白细胞总数36×106/L、单核细胞数35×106/L,蛋白定量1.00g/L、乳酸2.47mmol/L;脑脊液细胞学(自然沉淀法)提示淋巴细胞性炎症,可见异型淋巴细胞。②影像学检查,头部MRI可见脑内多发点片状稍长T1、长T2信号影,FLAIR序列呈高信号影,DWI呈稍高信号;增强后双侧侧脑室周围组织呈多发点片状强化(图1)。磁共振波谱(MRS)分析,左侧额叶、右侧顶叶和右侧基底节区病变谱线显示N-乙酰天冬氨酸(NAA)峰值略降低,胆碱(Cho)、肌酸(Cr)峰值略升高,肌醇(MI)峰值略增高。磁共振动脉成像(MRA)和静脉成像(MRV)均未见明显异常。胸腹盆腔CT扫描未见占位性表现。③神经电生理检查,肌电图未见神经源性或肌源性损害。
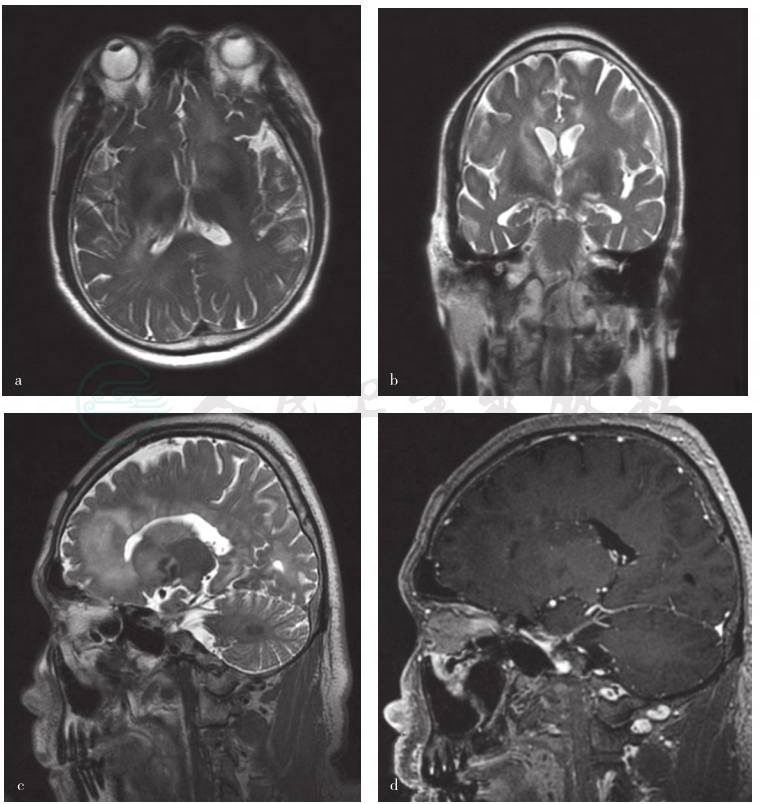
图1 发病8个月时头部MRI检查所见
a.横断面T2WI显示双侧额叶、侧脑室旁、尾状核头、豆状核、胼胝体内高信号;b.冠状位T2WI显示双侧额叶、侧脑室旁、尾状核头、豆状核、胼胝体内高信号;c.矢状位T2WI显示双侧额叶、侧脑室旁、尾状核头、豆状核、胼胝体内高信号;d.矢状位增强T1WI显示侧脑室周围病变呈点状强化
神经科主治医师
患者为中年男性,隐袭发病,病情逐渐进展,表现为嗜睡、双下肢无力。曾于外院行糖皮质激素治疗2周,症状略有好转。既往无特殊病史。体格检查神清、精神差,反应迟钝,高级智能减退;双侧病理征阳性;双侧轮替差,行走缓慢,转身有分解,Romberg征可疑阳性,后拉试验阳性。MRI显示双侧额叶、侧脑室旁、小脑、延髓多发异常信号,多次复查病灶范围逐渐扩大。定位诊断:睡眠增多、高级智能减退、运动障碍,定位于广泛脑部病变,大脑皮层、锥体束、睡眠中枢及锥体外系受累。双下肢无力,肌酶谱水平升高、外院肌电图肌源性损害,我院复查未见明显异常,可进一步核实是否存在肌源性及神经源性损害。定性诊断:该例患者自发病至明确诊断过程中,鉴于临床症状和影像学表现,考虑的诊断有:①肿瘤性病变,颅内肿瘤首先考虑胶质瘤,弥漫性生长可见于高级别胶质瘤和大脑胶质瘤病,前者水肿和占位效应明显,常有增强效应;后者广泛浸润大脑半球,可累及3个或3个以上脑叶,病灶无强化或仅轻微片状结节状强化,邻近脑膜可见强化伴轻度水肿。其次考虑中枢神经系统淋巴瘤,临床表现和影像学表现缺乏特征性,病灶以中线部位为主,增强后病灶呈均匀强化。明确诊断需行脑组织活检。同时可疑肌源性损害,需考虑全身其他肿瘤转移,典型的颅内转移瘤可见占位和肿瘤瘤周围水肿带,伴结节样或花边样强化改变。肿瘤标志物和胸腹盆腔CT检查未发现明确肿瘤占位表现,可排除诊断。②非肿瘤性疾病,感染、免疫、营养筛查和血管筛查可初步排除感染、自身免疫性疾病、营养代谢性疾病、血管性疾病。线粒体脑肌病、肌营养不良造成的脑白质病变均可出现颅内或肌肉病变,但患者生长发育史及影像学改变与这两种病变不相符。
神经科教授
该患者慢性病程,临床表现无特异性,结合MRI幕上、幕下多发病灶,范围逐渐扩大,激素治疗病情改善不明显,应首先考虑肿瘤性疾病。综合其既往史及其他实验室检查,可疑胶质瘤病或淋巴瘤病,脑脊液细胞学检测可见异型的淋巴细胞,初步诊断为淋巴瘤,建议进一步活检。
神经外科医师
同意进行脑组织活检。
诊治经过
入院后睡眠明显增加,予以甘油果糖250ml(1次/12h)治疗。临床疑似颅内恶性病变。入院后12天(2013年12月3日)于立体定向辅助下施行左侧额叶病变脑组织活检术。术后病理检查结果:原发中枢神经系统淋巴瘤(弥漫大B细胞淋巴瘤)。组织活检术后加用地塞米松5mg静脉滴注(1次/d),连续1周后改为1.50mg口服(1次/d),嗜睡症状有所改善,住院20天后出院转回当地医院。
原发中枢神经系统淋巴瘤——弥漫大B细胞型(primary central nervous system lymphoma,PCNSL;diffuse large B cell lymphoma,DLBCL)
原发中枢神经系统淋巴瘤(primary central nervous system lymphoma,PCNSL)为非霍奇金淋巴瘤的结外表现,缺乏系统性淋巴瘤证据。该病为少见的中枢神经系统肿瘤,占颅内肿瘤的1%~3%,好发于免疫系统障碍人群,亦可见于免疫正常人群,发病高峰年龄为45~70岁,男女发病率无明显差异。PCNSL发病率于20世纪60年代至90年代逐渐上升,1995年达高峰,1998年后趋于稳定,归因于此段时间艾滋病的发病率及管理变化。发病率变化主要位于中青年男性,>65岁男性发病率仍稳步上升。PCNSL除获得性免疫缺陷和长期应用免疫抑制剂的患者与EBV密切相关外,免疫系统正常的人群尚无明确的病因。目前具有共识的假说为:①机体免疫系统清除其余部位肿瘤细胞后,因免疫豁免作用,允许其在大脑内增殖;②炎性过程吸引外周淋巴组织通过血-脑屏障,经历单克隆增殖后形成恶性转变;③特异性细胞黏附分子使淋巴细胞和脑组织内皮产生亲和性。
PCNSL的临床表现无特异性,与病灶浸润部位及程度相关。根据病变部位,可分为4种类型:①实质肿块型最为常见;②多发室管膜下病灶,本例患者即属于此型;③原发性脑膜淋巴瘤型;④眼型,但极少有全身受累表现。经典的PCNSL影像学表现病灶位于中线结构,以单灶多见、边缘清楚,T1WI呈等或低信号、T2WI为等或稍高信号、DWI可见高信号,增强后病灶以均匀强化表现为主,强化病灶可呈“缺口征”“尖角征”“握拳征”等;PCNSL影像学表现多样,非典型影像结果不能排除淋巴瘤。MRS可见N-乙酰天冬氨酸(NAA)峰下降、胆碱(Cho)峰升高,肌酸(Cr)峰降低、脂质(Lip)峰高耸。该例患者的影像学表现与之相符。
脑脊液细胞学对PCNSL诊断具有重要价值,肿瘤细胞质/核质比增加,淋巴瘤细胞与正常淋巴细胞间缺少过度形态的淋巴细胞,免疫细胞化学染色、淋巴细胞流式分析和基因重排检查为诊断的重要依据。脑组织活检为确诊之“金标准”,PCNSL组织学分类以弥漫大B细胞淋巴瘤为主。光学显微镜下可见网状纤维围绕肿瘤细胞呈放射状排列,肿瘤细胞弥漫分布、构成紧密,细胞外间隙小,围绕血管呈“袖套”样浸润,瘤体中新生血管数量少。病理学表现可解释患者影像学相关表现。免疫组织化学检测表达B细胞标志物和细胞增殖活性标记。胶质纤维酸性蛋白与肿瘤分化程度有关,高分化者以胶质纤维酸性蛋白表达阳性为佳;Ki-67抗原标记指数为细胞增殖活性标记,其比例越高,肿瘤增殖越活跃;神经丝蛋白主要存在于神经细胞内,为神经内分泌肿瘤的标志物;AE1/AE3用于标记上皮和上皮来源的肿瘤,鉴别和判断颅内转移肿瘤。本例患者免疫组织化学染色胶质纤维酸性蛋白、Ki-67抗原标记指数、神经丝蛋白阳性,AE1/AE3表达阴性,考虑为增殖活跃的原位肿瘤。根据Hans的肿瘤分型方法,以及肿瘤细胞表达CDl0、bcl-6、Mum-1、CDl38的情况将原发中枢神经系统淋巴瘤分为生发中心来源的B细胞型(germinal centre B-cell-like,GCB)和活化的外周B细胞型(activated B-cell-like,ABC),GCB型表达CD10或bcl-6,ABC型表达Mum-1或CD138,GCB型预后较ABC型好。根据本例患者免疫组织化学染色结果,考虑为ABC型,提示预后不良。
PCNSL具有高度侵袭性,未经治疗生存期短,中位生存期约为1.5个月,单纯外科手术治疗效果欠佳,一般以获取组织学标本协助诊断为原则。目前主要采用大剂量甲氨蝶呤为基础化疗方案,一般可提高PCNSL患者生存期至71个月。多中心研究表明,年龄>60岁、美国东部肿瘤协作组(ECOG)评分>1分、血清乳酸脱氢酶(LDH)水平升高、脑脊液蛋白定量升高、深部脑实质受累,为患者预后不良的5项因素。
[1]Olson JE,Janney CA,Rao RD,et al.The continuing increase in the incidence of primary central nervous system non-Hodgkin lymphoma:a surveillance, epidemiology,and end results analysis.Cancer,2002,95(7):1504-1510.
[2]Haldorsen IS,Krossnes BK,Aarseth JH,et al.Increasing incidence and continued dismal outcome of primary central nervous system lymphoma in Norway 1989-2003:time trends in a 15-year national survey. Cancer,2007,110 (8):1803-1814.
[3]Bossolasco S,Cinque P,Ponzoni M,et al.Epstein-Barr virus DNA load in cerebrospinal fluid and plasma of patients with AIDS-related lymphoma.J Neurovirol,2002,8(5):432-438.
[4]关鸿志,陈琳,梁智勇,等.原发中枢神经系统淋巴瘤的脑脊液细胞学诊断.协和医学杂志,2012,3(3):274-278.
[5]Schwingel R,Reis F,Zanardi VA,et al.Central nervous system lymphoma:magnetic resonance imaging features at presentation.Arq Neuropsiquiatr,2012,70(2):97-101.
[6]Ferreri AJ,Blay JY,Reni M,et al.Prognostic scoring system for primary CNS lymphomas:the International Extranodal Lymphoma Study Group experience.J Clin Oncol,2003,21(2):266-272.
[7]Hans CP,Weisenburger DD,Greiner TC,et al.Confirmation of the molecular classification of diffuse large B-cell lymphoma by immunohistochemistry using a tissue microarray. Blood, 2004,103(1):275-282.
[8]孔维泽,刘彩燕,高山,等.睡眠增多四肢乏力八个月加重一个月.中国现代神经疾病杂志,2014,14(9):834-837.













