作 者:刘 洋(主治医师 东南大学附属中大医院消化内科)
指导者:施瑞华(主任医师 东南大学附属中大医院消化内科)
俞 婷(副主任医师 东南大学附属中大医院消化内科)
GT是一种少见的良性软组织肿瘤,占软组织肿瘤的比例<2%。GT是血管周围的血管球细胞肿瘤性增生,属于一种表型转化的特殊平滑肌细胞瘤,电镜下具有平滑肌细胞瘤的特点。GT好发于四肢末端尤其是指(趾)甲下,亦见于手掌、腕部、前臂、足、皮下或浅表软组织内,发生于神经、胃、鼻腔和气管的血管球瘤也有报道。食管血管球瘤罕见。根据肿瘤组织中血管球细胞、血管和平滑肌所占比例,GT的组织学类型可分为实体型、血管瘤型(最常见)、黏液样型、混合型。依据血管球细胞、血管、平滑肌及黏液背景,GT可分为:①经典型(固有球瘤,球细胞瘤),最常见,约占3/4;②球血管瘤:约占1/5;③球血管肌瘤,约占10%;④黏液样型;⑤嗜酸细胞型。GT一般无特异性临床表现。患者早期多无明显不适,一般无明显阳性体征,于体检时发现,随着瘤体逐渐增大,可逐渐出现吞咽困难、恶心、呕吐等症状,故易漏诊。GT的诊断依赖内镜及CT、MR、组织病理及免疫组织化学染色(immunohistochemistry,IHC)等检查。GT在内镜下呈现典型的黏膜下肿瘤形态,瘤体表面光滑,质地一般偏软。超声内镜检查,GT在大多数情况下呈均匀中等回声,少数情况下呈不均匀低回声,彩色多普勒可见瘤体内血供较丰富,多起源于固有肌层,少数起源于黏膜下层。因此,超声内镜对GT的诊断和鉴别诊断具有重要价值(表1)。
表1 血管球瘤等黏膜下肿瘤的超声内镜特点
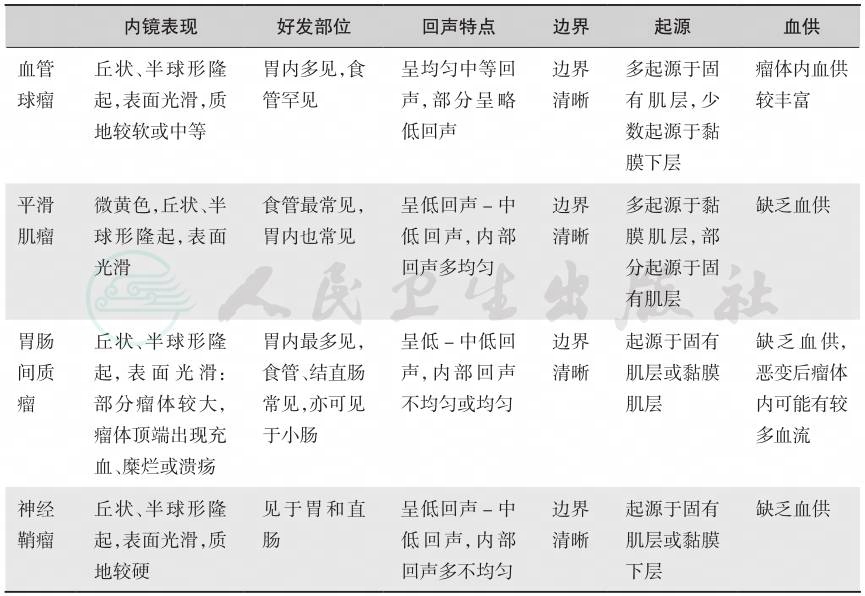
内镜表现 好发部位 回声特点 边界 起源 血供 |
血管 球瘤 丘状、半球形隆 起,表面光滑,质 地较软或中等 胃内多见,食 管罕见 呈均匀中等回 声,部分呈略 低回声 边界 清晰 多起源于固 有肌层,少 数起源于黏 膜下层 瘤体内血供 较丰富 平滑 肌瘤 微黄色,丘状、半 球形隆起,表面 光滑 食管最常见, 胃内也常见 呈低回声-中 低回声,内部 回声多均匀 边界 清晰 多起源于黏 膜肌层,部 分起源于固 有肌层 缺乏血供 胃肠 间质 瘤 丘状、半球形隆 起,表面光滑: 部分瘤体较大, 瘤体顶端出现充 血、糜烂或溃疡 胃内最多见, 食管、结直肠 常见,亦可见 于小肠 呈低-中低回 声,内部回声 不均匀或均匀 边界 清晰 起源于固有 肌层或黏膜 肌层 缺乏血供, 恶变后瘤体 内可能有较 多血流 神经 鞘瘤 丘状、半球形隆 起,表面光滑,质 地较硬 见于胃和直 肠 呈低回声-中 低回声,内部 回声多不均匀 边界 清晰 起源于固有 肌层或黏膜 下层 缺乏血供 |
引自:主编:.消化系统疑难疾病诊疗思维及病例解析.第1版.ISBN:978-7-117-28669-5
病理活检(手术切除)+免疫组织化学染色是血管球瘤诊断的金标准。血管球瘤的病理特点:HE染色后在光镜下观察,肿瘤由球细胞、血管、平滑肌细胞组成。球细胞较小、一致、圆形,核圆、居中,细胞质嗜双染。血管丰富,有大小不等的厚壁血管。间质有少量纤维组织、平滑肌束,无髓神经纤维,可黏液变性。球细胞和平滑肌细胞有相互过渡。血管球瘤的免疫组化特点:SMA和Vimentin 阳性,desmin 阳性、阴性或弱阳性均有报道,c-Kit(CD117)、S-100、CD34、Dog1阴性。免疫组化可以准确判断出血管球瘤和其他黏膜下肿瘤,表2列举了常见的黏膜下肿瘤的免疫组化特点,因此IHC对GT的鉴别诊断具有极其重要的价值。
表2 血管球瘤等黏膜下肿瘤的免疫组织化学染色特点

SMA Desmin CD117 CD34 DOG-1 S-100 Syn CagA Vimentin |
血管球 + -/+ - + 平滑肌瘤 + + - - 胃肠间质瘤 - + + + + 神经鞘瘤 + 类癌 + + |
引自:主编:.消化系统疑难疾病诊疗思维及病例解析.第1版.ISBN:978-7-117-28669-5
由于该患者的GT瘤体直径超过2cm,参考部分文献认为其为恶性,又称血管球肉瘤,极为罕见。恶性GT约占所有GT的1%。依据组织学表现,恶性GT可分为3个亚型:①局部浸润性GT;②源于良性GT的恶性肉瘤;③原发性恶性GT。目前认为,恶性GT发生远处转移极罕见。食管恶性GT在国内外报道极少。国内张晔等报道,恶性GT在内镜下可表现为菜花样肿物,表面糜烂溃疡;上消化道造影表现为食管黏膜皱襞破坏,可见充盈缺损,管腔偏心狭窄;胸部增强CT检查呈软组织肿块影,边界多不清,与周围气管分界不清,增强后明显强化。恶性GT的组织病理示:肿瘤细胞呈巢片状排列伴多灶状肿瘤性坏死,核仁不明显,核分裂象>10/50HP。恶性GT的报道少,诊断标准不统一,目前建议的“诊断标准”为:肿瘤直径大于2cm且位于筋膜下或内脏器官,具有非典型细胞分裂现象(5个/HPF),具有明显的核异质性且存在任何程度的有丝分裂活动。也有一些文献报道了其他“诊断标准”:①肿瘤直径>5cm或肿瘤位置侵犯黏膜下较深;②可见病理性核分裂象,每50个高倍视野中核分裂细胞>3个;③细胞核呈中度以上异型性或伴明显的梭形细胞分化。在这一标准中,符合①+②、①+③或①+②+③即可确诊,若仅符合第①条或肿瘤直径>7cm,则被归为恶性潜能未定的GT。
目前,GT的治疗方法包括:①内镜手术:内镜下黏膜剥离术(ESD)、内镜黏膜下挖除术(endoscopic submucosal excavation,ESE)、黏膜下隧道内镜切除(STER);②腹腔镜或胸腔镜手术;③传统外科手术。对于GT的手术治疗,需要强调的是:没必要在所有手术中行广泛淋巴结清扫,即使已发生转移,不应轻易放弃切除原发肿瘤,并尽可能同时切除转移灶。
1.患者基本情况
患者:男性,32岁。
入院时间:2016年12月4日。
主诉:体检发现食管黏膜下隆起4天。
现病史:入院4天前,患者在我院门诊体检,行胃镜检查示:食管距门齿28~31cm可见一半球形隆起,无吞咽困难;无恶心、呕吐,无反酸、胃灼热,无咳嗽、咳痰。
既往史:有吸烟史,20支/d×1年。
个人史:否认肝炎、结核或其他传染病史,否认过敏史;否认饮酒史,否认滥用药物史;否认其他手术史,否认输血史。
家族史:否认高血压、糖尿病、慢性肾病等家族史,家族中无类似疾病患者。
体格检查:无阳性体征。
2.入院辅助检查
(1)实验室检查
血常规正常;生化全套正常;肿瘤指标 CEA 5.12ng/mL(↑),AFP、CA199均正常;粪便隐血阴性。
(2)辅助检查
X线胸片:正常。
心电图:正常。
胃镜:食管距门齿28~31cm可见一半球形隆起,表面黏膜光滑,活检钳触之感觉稍硬(图1)。
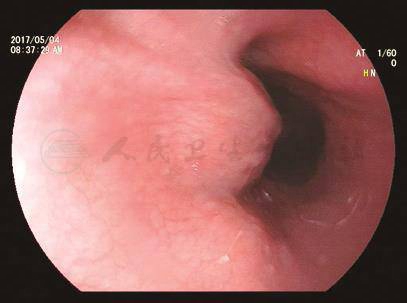
图1 胃镜检查所见
引自:主编:.消化系统疑难疾病诊疗思维及病例解析.第1版.ISBN:978-7-117-28669-5
超声内镜检查:食管隆起处小探头超声(UM-3R,20MHz)示病变为略低回声团块,向腔内突出,内部回声尚均匀,病灶基底较深,底部无法窥清(图2)。
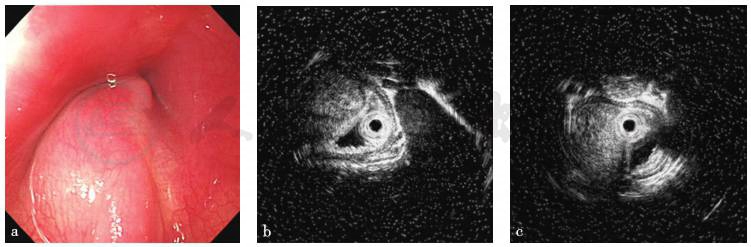
图2 食管隆起处小探头超声检查所见
引自:主编:.消化系统疑难疾病诊疗思维及病例解析.第1版.ISBN:978-7-117-28669-5
超声环扫(型号:Aloka,SSD-ɑ-5)所见:食管隆起处可见一略低回声团块向腔内及腔外突出,横截面约1.22cm×0.85cm,内部回声尚均匀,边界尚清,多普勒显示内部血流丰富。病灶起源于黏膜下层,且与胸主动脉邻近(图3)。
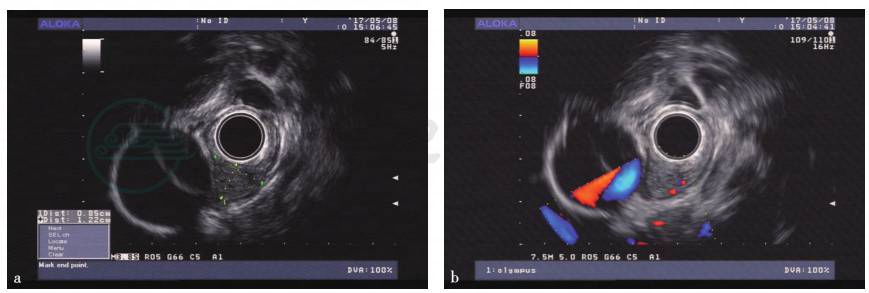
图3 环扫超声检查所见
引自:主编:.消化系统疑难疾病诊疗思维及病例解析.第1版.ISBN:978-7-117-28669-5
3.初步诊断思维过程
(1)入院时病情总结
该患者为青年男性,门诊体检时发现食管肿物,为典型的黏膜下隆起,质地略硬,超声内镜检查提示病灶腔内及腔外突出,内部回声尚均匀,边界清,多普勒提示病灶内血流丰富。此外,病灶与胸主动脉邻近。
(2)入院时诊断思路
患者体检行胃镜检查时发现食管肿物,病灶表面光滑,为典型的黏膜下肿瘤(submucosal tumor,SMT)。SMT的诊断和鉴别诊断非常依赖超声内镜检查,因此了解各种类型SMT的超声内镜特点(图4),对于其诊断和鉴别诊断非常重要。该病例的诊断思路如下:
1)食管SMT以平滑肌瘤最常见,约占1/2以上,一般起源于黏膜肌层或固有肌层,内部呈低回声且回声均匀,质地较硬。该患者的病灶起源于黏膜下层,因此平滑肌瘤可能性较小。患者的瘤体偏大,内部血管较明显,不能完全排除平滑肌肉瘤,但平滑肌肉瘤一般瘤体较大,表面多有糜烂、破溃,且内部回声不均匀,伴有相应的临床症状和(或)体征。该患者瘤体偏大,内部回声均匀,平滑肌肉瘤可能性很低。
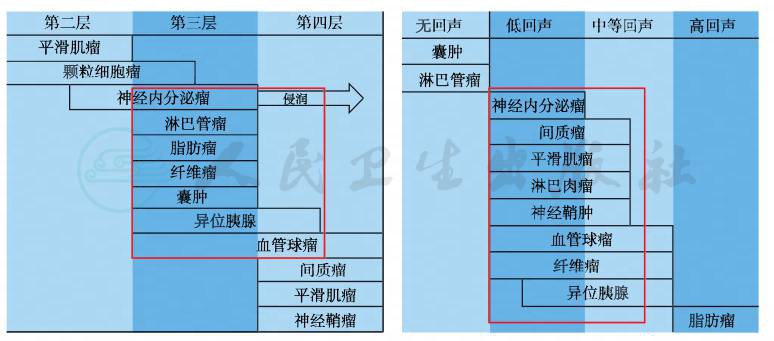
图4 消化道黏膜下肿瘤(SMT)的超声内镜特点
引自:主编:.消化系统疑难疾病诊疗思维及病例解析.第1版.ISBN:978-7-117-28669-5
2)间质瘤在食管也较常见,呈略低回声或低回声团块,一般起源于黏膜肌层或固有肌层。较大的间质瘤内部回声欠均匀。该患者的病灶起源于黏膜下层,因此间质瘤的可能性也较小。恶性间质瘤一般表面多有糜烂、破溃,且内部回声不均匀,也具有相应的临床症状和(或)体征,因此恶性间质瘤的可能性也很小。
3)食管神经鞘瘤罕见,一般来说神经鞘瘤呈略低回声或低回声,内部回声均匀,与平滑肌瘤相似,瘤体起源于固有肌层,与固有肌层的边界不明显,内部缺乏血供,因此与平滑肌瘤的鉴别较困难。该例患者超声内镜特点不符合神经鞘瘤的特点。
4)该患者的瘤体起源于黏膜下层,呈略低回声团块,目前需考虑食管淋巴管瘤、血管瘤、纤维瘤、神经内分泌肿瘤。由于超声内镜多普勒检查发现患者瘤体内部有较丰富的血流,需首先考虑血管瘤(包括毛细血管瘤、海绵状血管瘤、混合型静脉瘤、静脉血管瘤、淋巴管瘤、肉芽肿型血管瘤、血管球瘤等)的可能性。此外,由于瘤体与胸主动脉相邻,需进一步完善CT或MR增强扫描,以进一步评估其内部血流及其与胸主动脉的关系,从而排除胸主动脉瘤。食管神经纤维瘤罕见,超声起源于黏膜下层或肌层,内部回声不均匀,边界不规则,因此神经纤维瘤可能性较小。食管神经内分泌肿瘤发生率低,目前单凭超声内镜检查无法鉴别诊断,需进一步完善相关检查,如病理活检或生长抑素受体闪烁扫描。
5)由于脂肪瘤为高回声,食管囊肿为无回声,两者基本可以排除。
6)充分医患沟通后,如患者家属愿意,可行隧道内镜探查,必要时行黏膜下隧道内镜切除术(submucosal tunneling endoscopic resection,STER)。
(3)入院初步诊断
1)食管黏膜下肿瘤(SMT)
血管瘤?平滑肌瘤?
2)应与如下疾病相鉴别
间质瘤?神经内分泌肿瘤?
4.后续检查及治疗
(1)辅助检查
胸部CT(平扫+增强扫描)示食管后壁有一球状软组织隆起突入食管腔内,边界清,其内密度稍欠均匀,较大截面大小约1.1cm×1.5cm×1.9cm(三维重建),增强扫描后呈渐进性明显强化,瘤体与胸主动脉无连通,局部食管管腔狭窄(图5)。CT诊断:食管中段占位。
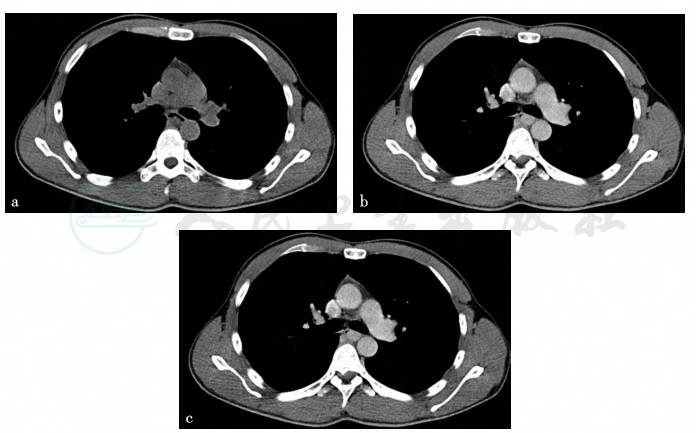
图5 胸部CT(平扫+增强扫描)
引自:主编:.消化系统疑难疾病诊疗思维及病例解析.第1版.ISBN:978-7-117-28669-5
(2)进一步检查及治疗
经充分沟通并签署知情同意后,行黏膜下隧道内镜切除术(STER)(图6)。术中于隧道内见一红色球形瘤体,表面血管丰富,瘤体有搏动,触之质软。病灶起源于固有肌层,瘤体深、血供丰富。术中考虑血管瘤可能性大,因瘤体较大,与胸主动脉相邻,手术难度及风险高,与患者家属沟通,交代内镜手术的巨大风险,并请胸外科手术室会诊,经充分讨论,决定选择继续内镜下剥离,如出现剥离困难,则转换为胸外科开胸手术。经缓慢并仔细地剥离,充分止血,保持术野清晰,直至最终将瘤体完整剥离,切除瘤体大小约3.0cm×2.5cm,隧道内充分止血后,使用金属钛夹夹闭隧道口。
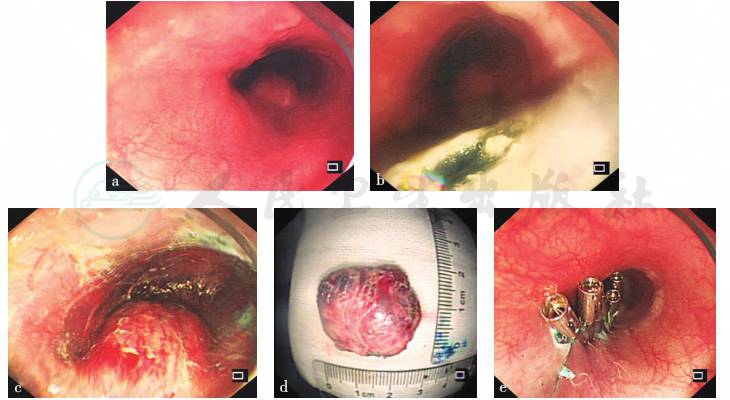
图6 STER过程
建立隧道口,分离隧道后见红色球形瘤体,表面血管丰富,有搏动,缓慢并仔细剥离完整切除瘤体,大小约3.0cm×2.5cm,热活检钳充分止血后关闭隧道口
引自:主编:.消化系统疑难疾病诊疗思维及病例解析.第1版.ISBN:978-7-117-28669-5
(3)术后病理
距门齿30~32cm食管占位内镜黏膜下剥离(ESD)标本。肉眼见食管黏膜组织一块,大小2.5cm×1.8cm×1.2cm,黏膜下见一灰红色类圆形肿块,大小2.5cm×1.8cm×1cm,切面灰白灰红色,质韧,表面包膜完整,界限清楚。HE染色后光镜下观察见图(图7)。病理诊断:食管血管球瘤,最大径2.5cm,肿瘤组织位于食管黏膜下层,标本环周切缘未见肿瘤残留。免疫组化结果:Ki67(约 12%+),CD56(-),CgA(-),Syn(灶 +),Pan CK(-),CK5/6(-),Des(灶 +),S-100(-),Calponin(-),Caldesmon(+),SMA(+),CD34(脉管 +),P63(-),CD117(-),Dog1(-)。
注:文献报道,位于深部,肿瘤直径大于2cm的血管球瘤属于恶性不能确定的肿瘤,建议临床紧密随访。
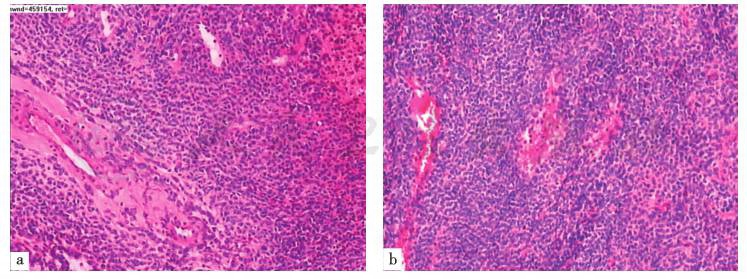
图7 瘤体标本病理(HE染色,200×)
引自:主编:.消化系统疑难疾病诊疗思维及病例解析.第1版.ISBN:978-7-117-28669-5
5.最终诊疗思维过程
食管SMT为临床较常见的疾病。该病例为典型的食管SMT,从常见病、多发病的角度,我们应首先考虑平滑肌瘤、间质瘤、食管囊肿、血管瘤、脂肪瘤等常见黏膜下肿瘤,并结合超声内镜特点进行鉴别诊断。该病例超声内镜检查提示瘤体呈略低回声,且起源于黏膜下层,初步判断平滑肌瘤、平滑肌肉瘤、间质瘤及恶性间质瘤的可能性较小;由于瘤体内血管较丰富,高度怀疑为血管瘤,瘤体紧邻胸主动脉,不能排除胸主动脉瘤外压引起的食管隆起,因此胸部CT平扫+增强扫描具有重要的鉴别诊断价值。瘤体的渐进性强化进一步支持血管瘤的诊断。近年来,消化内镜技术的突飞猛进为我们带来了更多的诊断和治疗手段。STER等内镜下微创技术具有创伤小、恢复快等优点。依赖STER技术,我们观察到瘤体的形态,初步肯定了血管瘤的诊断。在充分与患者家属沟通并与胸外科医师在手术台上讨论后,我们团队最终成功地通过STER技术将瘤体完整剥离。尽管手术过程步步惊心,但是手术过程非常顺利,术中基本没有出血。血管瘤有很多亚型,其诊断需要靠组织病理和免疫组织化学染色。事实上,最终的血管球瘤诊断出乎意料。组织学检查和免疫组织化学染色是血管球瘤(glomus tumor,GT)诊断的金标准,vimentin和desmin阳性是其典型的免疫组织化学染色特征。免疫组织化学染色除了具有极重要的诊断价值外,也有非常重要的鉴别诊断价值。该病例由于瘤体直径>2cm,需要与恶性血管球瘤相鉴别。
6.最终诊断
血管球瘤。
7.后续治疗
术后予以禁食72小时,抑酸、抗感染、补液营养支持治疗,术后5天,患者出院。
8.后续随访
术后3个月复查胃镜,见食管黏膜充血及少量颗粒样充血隆起灶(图8)。
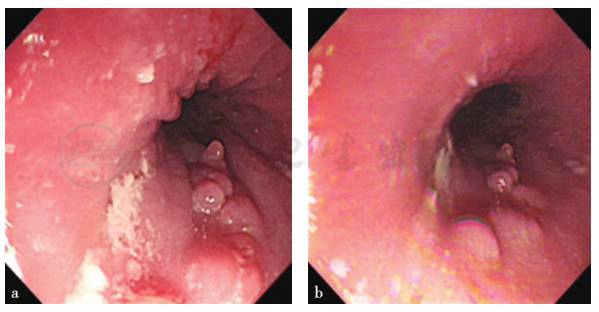
图8 复查胃镜
引自:主编:.消化系统疑难疾病诊疗思维及病例解析.第1版.ISBN:978-7-117-28669-5
1.血管瘤种类较多,血管球瘤(GT)是其中一种特殊的类型。GT在消化道的发病率较低。相对来说,胃的GT较多,而食管GT非常罕见,食管恶性GT更少见。由于GT是血管周围的血管球细胞肿瘤性增生,属于一种表型转化的特殊平滑肌细胞瘤,其组织病理学上含有球细胞、平滑肌细胞、血管等成分,因此与其他类型血管瘤的鉴别比较困难。如果瘤体较小,内部血供较少,与平滑肌瘤、间质瘤也很难鉴别。其鉴别诊断主要依靠组织病理学+免疫组织化学染色。
2.食管的血管瘤在紧邻胸主动脉的情况下,内镜手术难度非常高。在充分与患者本人及家属沟通,并与胸外科医师充分讨论并准备相应预案后,我们最终选择了STER作为最终的治疗方法。该病例在成功建立隧道后发现瘤体并不困难,最大的难点在于瘤体基底部的分离。黏膜下注射可以充分暴露瘤体与周围正常组织的界限,在剥离时应“胆大心细”,充分预止血,保持视野清晰,避免损伤瘤体;黏膜下注射也能很好地显示瘤体与固有肌层之间的关系,根据剥离的具体情况选择IT刀或者Q刀,尽量避免损伤固有肌层,减少穿孔及误伤紧邻的胸主动脉,从而减少术中出血、穿孔,尤其是致命性大出血的发生,为完整剥离瘤体提供前提条件,同时也能有效降低术后并发症的发生。
[1] 张晔,李辉,王洋,等. 食管中下段恶性血管球瘤1例. 中华胸心血管外科杂志,2012,28(7):442.
[2] Baek YH,Choi SR,Lee BE,et al. Gastric glomus tumor analysis of endosonographic characteristics and computed tomographic findings. Dig Endosc,2013,25:80- 83.
[3] 赖日权 . 对 7种软组织肿瘤良、恶性诊断标准的探讨. Diag Pathol,2009,16(4):246-250.
[4] Miettinen M,Paal E,Lasota J,et al. Gastrointestinal glomus tumors:a clinicopathologic,immunohistochemical,and molecular genetic study of 32 cases. Am J Surg Pathol,2002,26(3):301-311.
[5] Nascimento EF,Fonte FP,Mendon a RL,et al. Glomus tumor of the stomach:a rare cause of upper gastrointestinal bleeding. Case Rep Surg,2011:1-5.













