(一)一般资料
女性,21岁,自由职业。
(二)主诉
反复乏力伴性发育不良18年,发现血压升高1个月。
(三)现病史
患者于18年前无明显诱因出现乏力,于当地医院就诊示血钾低,补钾治疗后乏力好转,因反复乏力发作,不能参与体育活动,尚能从事日常活动。无头晕、头痛、意识及认知功能障碍,无肢体偏瘫,无发热、咳嗽、咳痰、呼吸困难,无心悸,无腹痛、腹泻,无听力减退,味觉、嗅觉正常,无视野缺损及重影。
1个月前体检发现血压170/120mmHg,2017年9月5日于当地就诊,血钾2.86mmol/L。肾上腺CT示双侧肾上腺软组织肿块,考虑肾上腺腺瘤。当地就诊时追问其病史,存在闭经、女性第二性征发育不良,当地完善性激素全套:FSH 141.3 IU/L,LH 52.78 IU/L,雌二醇 5pg/ml,睾酮 <0.025ng/ml,PRL 819mIU/L,孕酮4.27ng/mL,肝功能、肾功能、血糖、甲状腺功能未见异常;盆腔、垂体磁共振:①盆腔扫描未见子宫、阴道及双侧附件;②垂体左侧异常信号,垂体瘤可能。染色体核型分析46,XY。
为求进一步诊治,遂于2017年9月25日门诊收住我科,起病来饮食、睡眠可,大小便正常。
(四)既往史及个人史
无特殊。
(五)家族史
为弃婴,无从追述。
(六)月经史
无月经来潮。
(一)体格检查
1.一般检查
体温36.5℃,心率94次/min,呼吸20次/min,血压见表1,体长见表2,体重50kg,体重指数18.4kg/m2。
表1 四肢血压

单位:mmHg |
左上肢 右上肢 左下肢 右下肢 |
血压 161/122 150/120 160/101 168/109 |
表2 体长测量

单位:cm |
身高 上部量 下部量 指间距 |
体长 165 82 83 166 |
2.皮肤黏膜
全身皮肤巩膜无黄染,无发绀,皮肤稍黑、较干燥,牙龈无明显色素沉着。
3.颈部检查
无颈蹼,无喉结,甲状腺无肿大,颈静脉无充盈。
4.胸腹部检查
胸廓外形正常,双侧乳腺未发育,乳晕淡,未见乳丘生长;腹股沟未触及明显包块。
5.外生殖器检查
无阴毛及腋毛,女性外阴,Tanner分期1期,阴道口存在,阴道为盲端,棉签探查大约2cm。
(二)实验室检查
1.尿常规+尿液沉渣分析白细胞(+++),500个/HP,白细胞总数40.92个/μl。
2.ESR 39.0mm/h。
3.AKP 272.4IU/L。
4.肝肾功能、血脂、乙肝三对、凝血功能、心肌酶、甲状腺功能、甲状腺受体抗体、甲状旁腺激素、25-羟维生素D、糖化血红蛋白、糖耐量实验无明显异常。
5.血气分析示 pH 7.45,BE -5mmol/L。
(三)入院后进一步检查
1.血压、血钾及肾上腺皮质激素测定结果见表3~表7。
表3 血压及血钾测定结果
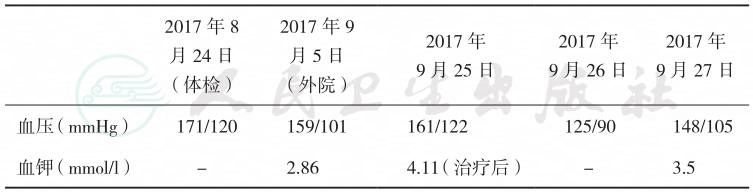
2017年8 月24日 (体检) 2017年9 月5日 (外院) 2017年 9月25日 2017年 9月26日 2017年 9月27日 |
血压(mmHg) 171/120 159/101 161/122 125/90 148/105 血钾(mmol/l) - 2.86 4.11(治疗后) - 3.5 |
表4 糖皮质激素节律
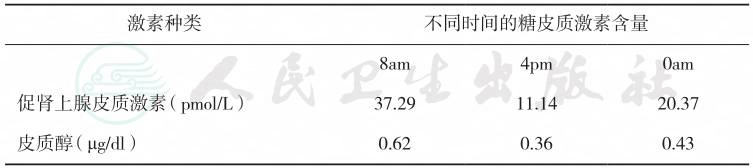
激素种类 不同时间的糖皮质激素含量 |
8am 4pm 0am 促肾上腺皮质激素(pmol/L) 37.29 11.14 20.37 皮质醇(μg/dl) 0.62 0.36 0.43 |
表5 24h尿肾上腺激素代谢产物测定结果

激素种类 外院测定值 本院测定值 参考值 |
24h尿17-羟皮质类固醇(μmol/d) 6.1 13.4 5.5~19.4 24h尿17-酮类固醇(μmol/d) <12 28.7 13.9~65.5 24h尿香草扁桃酸(μmol/L) 20 38 10~30 |
表6 盐皮质激素测定结果

激素种类 测定值 参考值范围 |
血钾4.11mmol/L,服用螺内酯 20mg,每日3次 肾素(IU/ml) 1.29 卧位2.8~39.9 立位4.4~46 醛固酮(pg/ml) <9.70 卧位30~236 立位30~353 停用螺内酯3天后,血钾3.5mmol/L 肾素(μIU/ml) 1.35 卧位2.8~39 立位4.4~46 醛固酮(pg/ml) 10.8 卧位30~236 立位30~353 醛固酮/肾素 8.0 |
表7 性激素测定结果
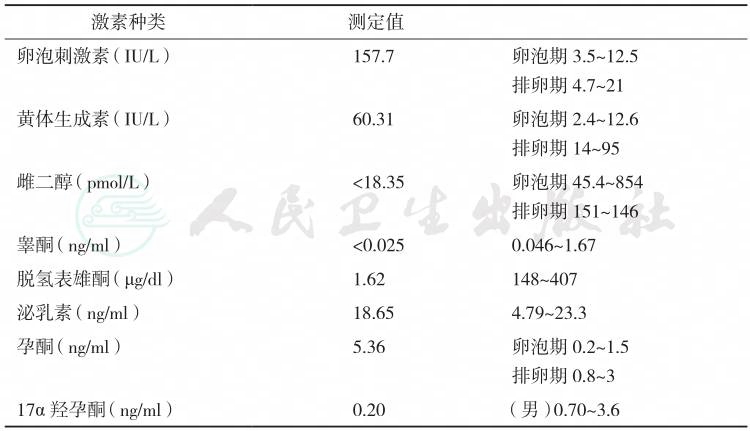
激素种类 测定值 |
卵泡刺激素(IU/L) 157.7 卵泡期 3.5~12.5 排卵期 4.7~21 黄体生成素(IU/L) 60.31 卵泡期 2.4~12.6 排卵期 14~95 雌二醇(pmol/L) <18.35 卵泡期 45.4~854 排卵期 151~146 睾酮(ng/ml) <0.025 0.046~1.67 脱氢表雄酮(μg/dl) 1.62 148~407 泌乳素(ng/ml) 18.65 4.79~23.3 孕酮(ng/ml) 5.36 卵泡期 0.2~1.5 排卵期 0.8~3 17α羟孕酮(ng/ml) 0.20 (男)0.70~3.6 |
2.腹部CT 增强CT提示双侧肾上腺改变,结合病史符合先天性肾上腺增生,左侧肾上腺区占位性病变,外侧嗜铬细胞瘤可能,不排除结节状增生(图1)。
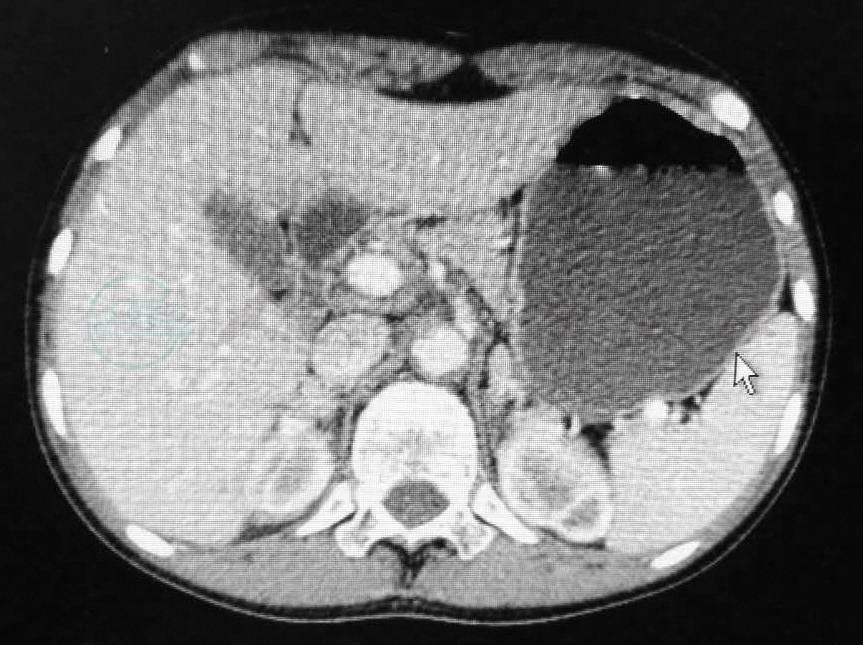
图1 双侧肾上腺CT
3.经腹及体表超声 考虑患者遗传性别为男性,进一步行彩超探查隐睾,发现双侧腹股沟区发育不良的性腺组织(图2)。
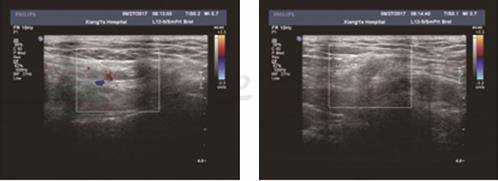
图2 盐皮质激素测定结果
4.手术病理检查 因患者强烈要求维持其女性第二性征,并且隐睾位于异常部位有恶变可能,所以患者于2017年10月17日,在我院泌尿外科行腹腔镜双侧隐睾摘除并腹壁修复,切除标本如图3。
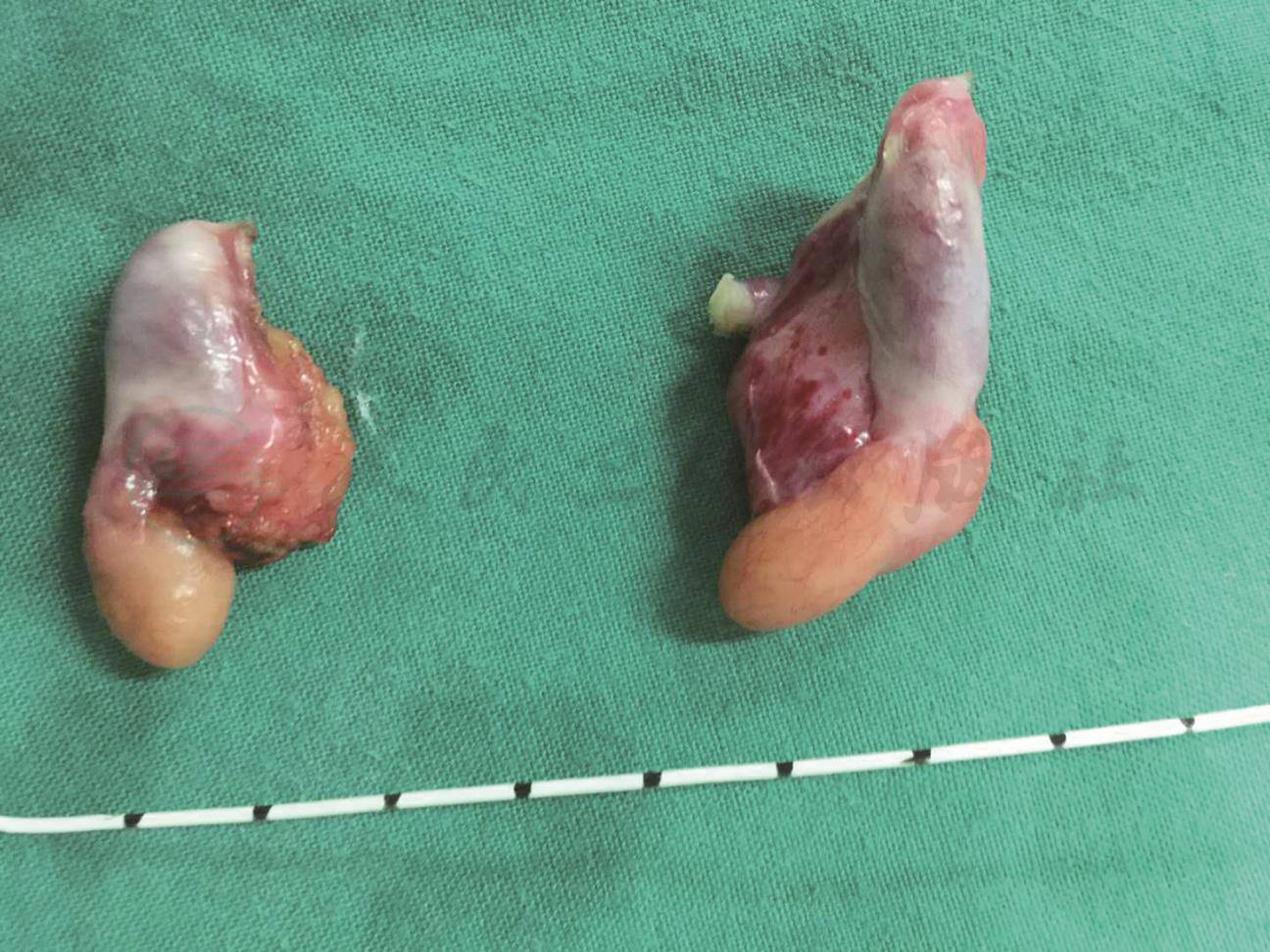
图3 手术摘除双侧隐睾
检查所见:
腹腔内未见明显睾丸声像。
双侧腹股沟区分别探及一大小为13mm×3.5mm×6mm、14mm×3.5mm×8mm梭状低回声结节,形态欠规则,边界欠清,内光点粗,分布欠均匀,CDFI:结节内未见明显血流信号。
检查提示:
双侧腹股沟区低回声结节:发育不良性腺组织?
(一)病例特点回顾
1.起病时间及特征
从小起病,高血压、低血钾。
2.第二性征发育情况
闭经,第二性征发育不良,无喉结,乳房未发育,皮肤偏黑,无阴毛及腋毛,女性幼稚外阴,阴道口盲端。
3.激素水平变化
ACTH增高,皮质醇降低;FSH、LH高,雌激素、睾酮水平低下。
4.染色体核型分析
46,XY。
5.影像学检查
双侧肾上腺结节样增生,子宫、卵巢、输卵管缺如,腹股沟区发育不良的性腺组织。
(二)诊断分析
1.与其他继发性高血压鉴别
结合患者从小起病的低钾伴高血压、性发育障碍及影像学改变,同时患者无特殊体貌,实验室检测结果如皮质醇、醛固酮和儿茶酚胺代谢产物均降低,不支持常见的肾上腺疾病,包括库欣病、原发性醛固酮增多症、嗜铬细胞瘤。
2.初步诊断
考虑为CAH,CAH多为常染色体隐性遗传疾病,原因为编码肾上腺皮质激素合成代谢过程中关键酶(CYP21,11β,17α,3β等)的基因突变,导致肾上腺皮质醇合成受损,性激素和盐皮质激素分泌增多或减少。
3.CAH酶缺陷类型分析
考虑患者长期存在高血压及低血钾,可引起血压增高及血钾降低的CAH可能为11β-羟化酶缺陷症或17α-羟化酶缺陷症。11β-羟化酶缺陷症患者性激素及其产物合成增多,应表现为性早熟或外生殖器畸形。该患者染色质核型分析为46,XY,第二性征发育不良,性激素及其中间产物明显减少,结合该患者临床特点及实验室检查结果考虑为17α-羟化酶缺陷症,不同类型CAH的临床特征见表8。
表8 不同类型先天性肾上腺皮质增生症的临床特征
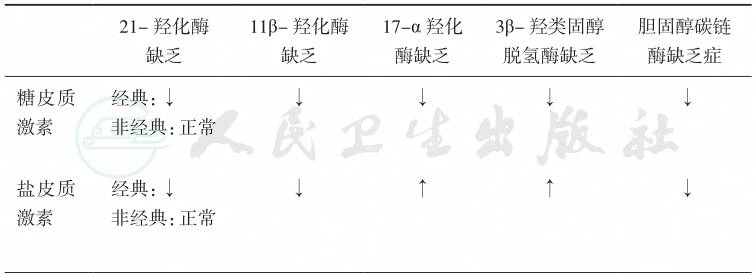
续表
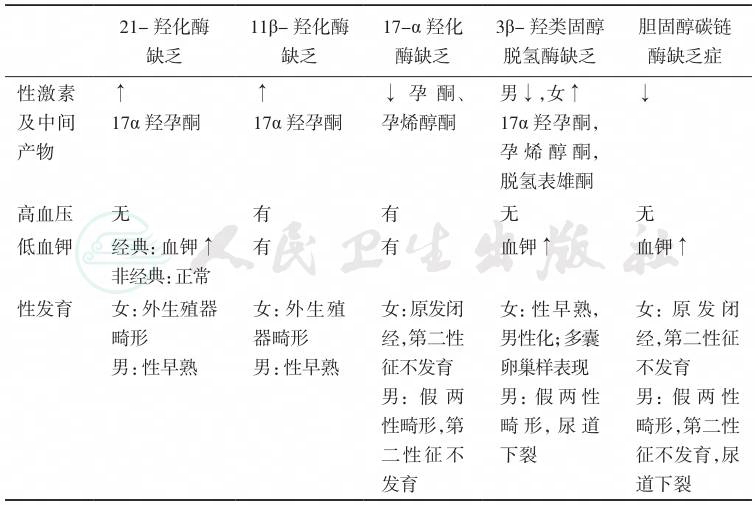
1.基因诊断分析
为进一步明确病因,抽血送基因检测,结果如图4。发现17α-羟化酶相关基因(CYP17A1基因,位于10号染色体)两个位点纯合子变异,与临床特征相符合。
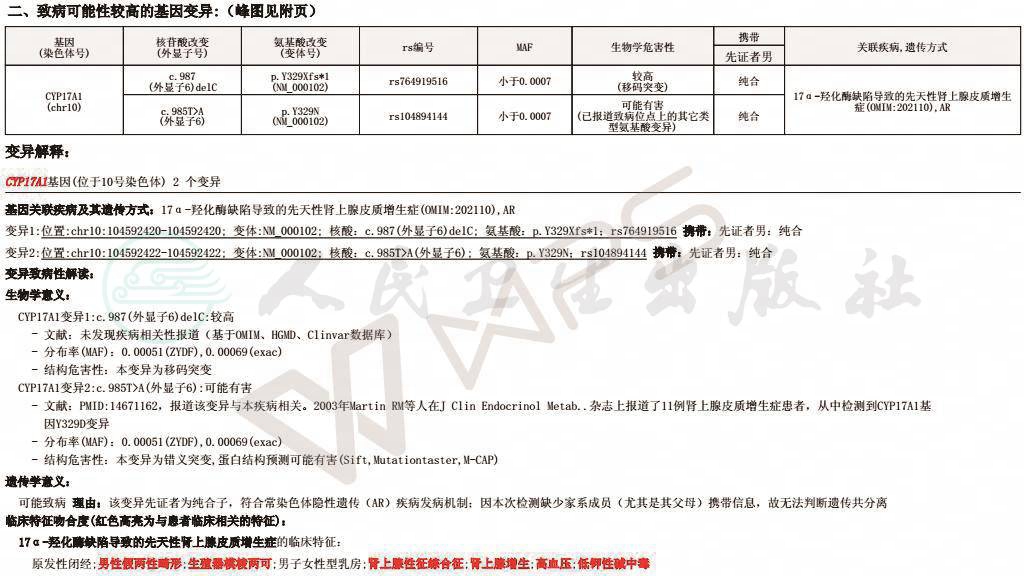
图4 基因检测结果
2.药物治疗
患者按CAH常规皮质激素替代治疗,并经与患者沟通,患者希望维持其女性第二性征,促进乳腺发育,予以小剂量雌激素和孕激素补充治疗,同时补钙预防骨质疏松。
3.治疗后随访
患者1年随访,其血压和血钾均维持正常,ACTH、肾素、ALD和孕酮等指标恢复正常,具体随访结果见表9。
表9 药物治疗及随访
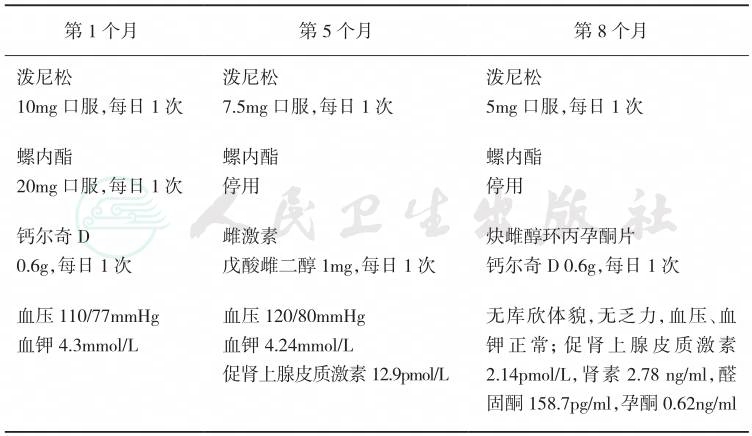
第1个月 第5个月 第8个月 |
泼尼松 10mg口服,每日1次 泼尼松 7.5mg 口服,每日 1 次 泼尼松 5mg口服,每日1次 螺内酯 20mg 口服,每日 1 次 螺内酯 停用 钙尔奇D 0.6g,每日 1 次 螺内酯 停用 雌激素 戊酸雌二醇1mg,每日1次 炔雌醇环丙孕酮片 钙尔奇 D 0.6g,每日 1 次 血压110/77mmHg 血钾4.3mmol/L 血压120/80mmHg 血钾4.24mmol/L 促肾上腺皮质激素12.9pmol/L 无库欣体貌,无乏力,血压、血 钾正常;促肾上腺皮质激素 2.14pmol/L,肾素 2.78 ng/ml,醛 固酮158.7pg/ml,孕酮0.62ng/ml |
复查肾上腺CT提示:与2017年9月27日CT片对比,双侧肾上腺结节样增生较前减轻,左侧肾上腺外侧肢结节灶较前明显缩小(图5),同时发现患者骨骺仍未闭合(图6),嘱患者继续补钙、维生素D剂和雌激素,定期复查。
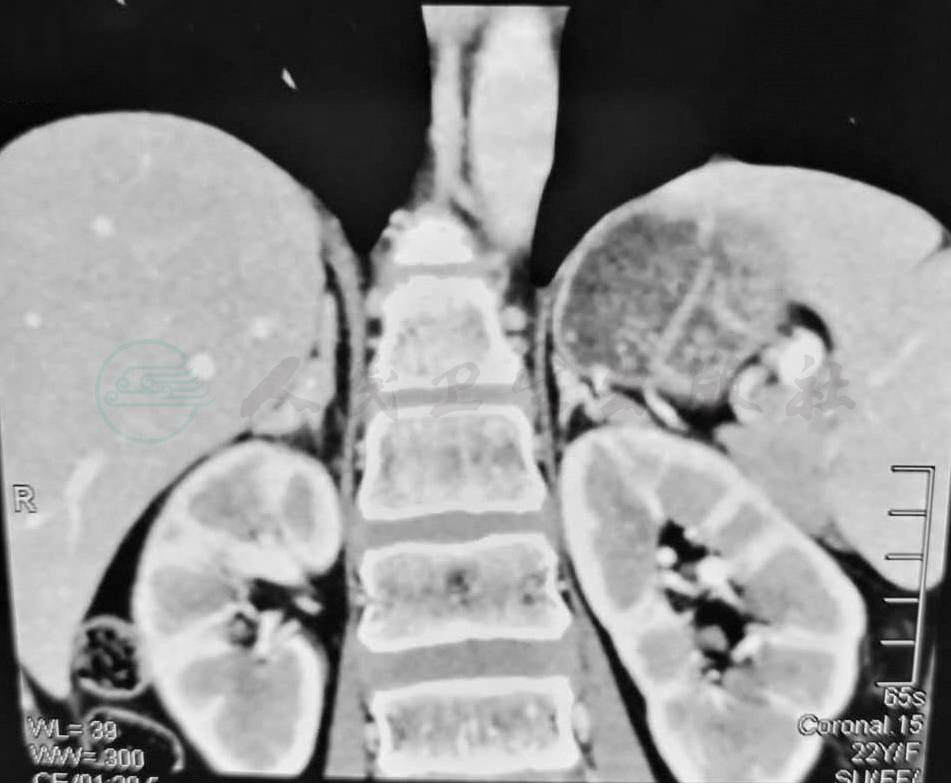
图5 出院后1年复查肾上腺CT
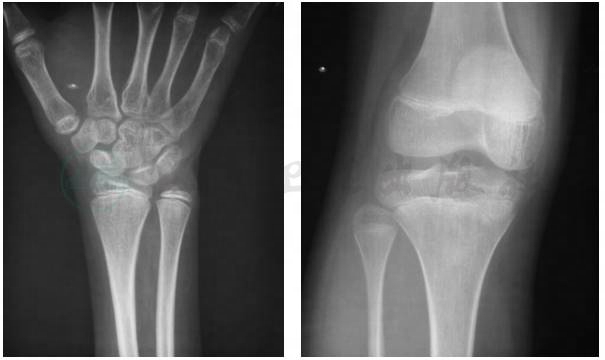
图6 患者关节X线片
(一)最后诊断
1.CAH
2.17α-羟化酶缺陷症
(二)诊断依据
该患者遗传学表型为男性,外生殖器为幼稚女性型,有盲端阴道,而内生殖器为男性型,彩超探查发现发育不良的睾丸,位于腹股沟区。17α-羟化酶缺乏导致17α-羟化类固醇(雄激素、雌激素、皮质醇、17α羟孕酮)极低,24h尿17-KS和17-OHCS排泄量减少,血ACTH反馈增高,但因为增多的盐皮质激素有类糖皮质激素作用,患者一般无肾上腺皮质功能减退的表现。盐皮质激素过度引起钠潴留、血容量增加及高血压,抑制肾素活性,使肾上腺皮质球状态ALD的分泌减少,因此该患者表现为高血压伴低血钾。
CAH是一组由编码皮质激素合成必需酶基因突变致肾上腺皮质类固醇类激素合成障碍所引起的疾病,为常染色体隐性遗传[1-2]。其主要病因为在皮质醇合成过程中,由于酶缺陷引起皮质醇合成不足,继发下丘脑CRH和ACTH代偿性分泌增加,导致肾上腺皮质增生。
临床上,以21-羟化酶缺陷症最常见,约占90%以上,而17α-羟化酶缺陷症比较罕见。男性性发育障碍或女性第二性征发育不良伴高血压、低血钾,需考虑17α-羟化酶缺陷症可能[2-4]。该疾病高血压、低钾血症发展缓慢,女性患者最早可表现为第二性征发育迟缓,男性因外生殖器模糊被当成女性抚养,患儿及家属重视不够,未及时就诊,往往成年后才被确诊,错过最佳治疗时间,遗留严重社会和心理问题。
本病临床罕见,表现多样,临床医生对其认识不足,极易误诊和漏诊,所以对确诊或疑诊病例的长期随访、密切追踪是非常重要的。
(郭 敏 吴 静)
[1]SELMA FW. Congenital ahyperplasia. J Pediatr Adolesc Gynecol,2017,30(5): 520-534.
[2]ELISABETH D,KRISTIN BF,INGRID N,et al. Psychological adjustment,quality of life,and self-perceptions of reproductive health in males with congenital adrenal hyperplasia: a systematic review. Endocrine,2018,62(1): 3-13.
[3]AGRONS MM,COREY TJ,MOUHAMMED AH,et al. Adrenal cortical hyperplasia: diagnostic workup,subtypes,imaging features and mimics. Br J Radiol,2017,90(1079): 20170330.
[4]EI-MAOUCHE D,ALT W,MERKE DP. Congenital adrenal hyperplasia. Lancet,2017,390(10108):2094-2210.













