患儿,男,8个月。
主诉:间断发热伴咳嗽7天。
现病史:入院7天前患儿无明显诱因出现发热,最高39.9℃,不伴寒战及抽搐,约1~2次/d,口服退热药后患儿热可退至正常,伴有咳嗽,喉部闻及“呼噜声”,无明显喘息,偶尔打喷嚏,无流涕,就诊于新民当地医院静脉滴注氨曲南2天,发热无缓解,咳嗽渐加重,转至黑山县第一人民医院,静脉滴注头孢呋辛钠3天,患儿体温逐渐降至正常。入院当天凌晨2点,患儿再次出现发热,体温最高达39.2℃,口服美林后患儿体温不能退至正常,现为求进一步诊治收入笔者医院,门诊以“肺炎”为诊断收入院。患儿病来有精神状态尚可,食欲和睡眠不佳,大、小便正常。
既往史:患儿生后19天因“新生儿肺炎、新生儿败血症”在笔者医院新生儿住院33天痊愈出院。无湿疹,无药物过敏史。
过敏及接触史:无食物及药物过敏史。无肝炎、结核等传染病接触史。
个人及家族史:G1P1,足月顺产,出生体重3.2kg,生后母乳喂养,生长发育与同龄儿相仿。
入院查体及相关检查:体温39.2℃;脉搏142次/min;呼吸36次/min;体重8.4kg。神志清楚,状态反应可,浅表淋巴结未触及肿大,咽红,呼吸略增快,鼻翼扇动阴性,口周无发绀。双肺听诊呼吸音粗,双肺可闻及散在中小水泡音及痰鸣音。心音有力、律齐。腹软无压痛,肝脏位于肋下2cm,质软,脾脏肋下未触及,四肢末梢温,活动自如,毛细血管充盈时间<3秒,神经系统查体未及异常。
辅助检查:(外院)血常规:WBC 28.5×109/L,NE%85.4,RBC 4.3×1012/L,HGB 116g/L,PLT 338×109/L。胸片(2011-03-21,当地医院):双肺散在大片斑片影,右肺为重。
入院后因诊断相对明确,根据病情分析完善相关检查,同时给予对症支持治疗:①通畅呼吸道;②入院后发热伴有咳嗽,头孢吡肟和红霉素静脉滴注控制感染,给予祛痰止咳药物。
检查及结果分析:
1.入院后完善各项检查 血常规:WBC 28.5×109/L,N 72.7%,HGB 114g/L,PLT 316×109/L;尿常规正常;便常规正常,潜血阴性;肝肾功能正常,血清胆红素正常。血气分析正常。
2.血CRP 158mg/L(0~8mg/L);ESR 38mm/h,此两项明显增高;ASO<25.0(0~200U/ml),均正常;病原学检测肺炎支原体抗体(MPAb),肺炎支原体抗体-IgM(MPAbIgM)阴性、咽拭子肺炎支原体DNA测定阴性,肺炎衣原体抗体-IgM、结核抗体(TBAb)、常见呼吸道、肠道病毒及肝炎病毒检测均阴性,血细菌培养未见致病菌,结核菌素试验阴性,结核斑点试验阴性提示无肺炎支原体及结核菌等其他感染迹象。
3.免疫球蛋白:IgG 12.3g/L(正常 6.95~15.15g/L),IgA 1.76g/L(正常 0.97~3.2g/L),IgM 1.84g/L(正常 0.4~1.59g/L);淋巴细胞亚群:总T细胞(%)60(55~84),T辅助细胞(%)27(31~60),NK细胞(%)3(7~36),总B细胞(%)35(5~20)均正常。总 IgE 12.47U/ml正常。
4.心电图正常,心脏彩超未发现异常。
5.入院后做肺部CT(图1),表现为双肺多发炎症,靠近胸膜处,血源性感染可能性大。
患儿入院后完善血常规、CRP、血细菌培养、肺CT等辅助检查,血常规回报:WBC 28.5×109/L,N 62.7%,CRP 158mg/L,肺CT表现为双肺多发炎症,靠近胸膜处,血源性感染可能性大。故予头孢吡肟联合万古霉素抗炎,并加用丙种球蛋白3天增强机体免疫功能。治疗5天后复查血常规回报:WBC 37.8×109/L,N 72.1%,CRP 140mg/L,患儿仍有频繁高热,血细菌培养回报阴性。这时回顾患儿病史,患儿在新生儿期即患重症肺炎及败血症共住院治疗33天,且当时肺CT上显示为多发类圆形高密度影,新生儿期间多次化验血常规均为白细胞明显增高,以中性粒细胞增高为主,伴随CRP的明显增高,以上病史提示我们患儿是否有先天性免疫缺陷病的可能。我们予患儿行免疫球蛋白(输注丙种球蛋白前)、淋巴细胞亚群、补体、总IgE的检查,结果均正常,予患儿行呼吸爆发实验,结果是阳性的。这时我们有理由高度怀疑患儿为“慢性肉芽肿病”。进一步予患儿及其家长进行相关基因检测。在头孢吡肟与万古霉素联合抗感染5天效果不佳的情况下,结合慢性肉芽肿病的常见致病菌谱,我们予患儿加用了伏立康唑静脉滴注,同时口服复方新诺明防治非典型菌感染。加用伏立康唑静脉滴注3天后患儿发热明显好转,复查血常规:WBC 19.3×109/L,N 41.8%,CRP 24mg/L,予其停用万古霉素,且头孢吡肟降级为头孢呋辛,继续静脉滴注伏立康唑。1周后患儿体温平稳5天,复查血常规回报:WBC 11.6×109/L,N 26.6%,CRP 7.8mg/L。复查肺CT示双肺多发高密度片影有的吸收、缩小,有的形成厚壁空洞。患儿入院15天后,无发热,临床症状及体征明显好转,体温平稳已达5天,复查血常规及CRP基本恢复至正常,复查肺CT炎症明显吸收,符合出院指征,予患儿出院。出院后嘱患儿口服伏立康唑片及复方新诺明治疗。患儿出院后2个月门诊复查,无发热,无咳喘,复查血常规、CRP及肝肾功能均正常,同时患儿及其家长基因结果回报:患儿为X连锁慢性肉芽肿病(CYBB基因突变),其母亲为该基因携带者,其父该基因正常。
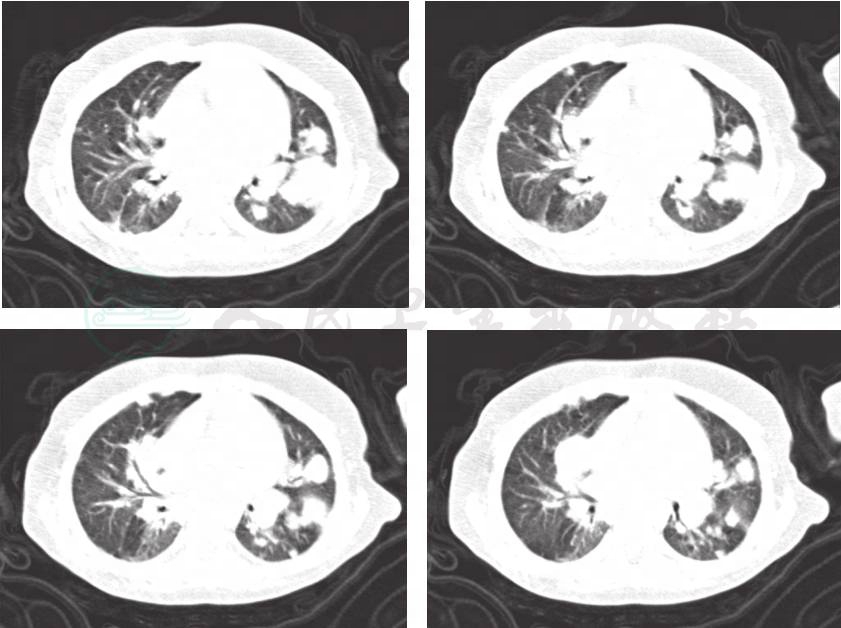
图1 入院后完善肺CT检查提示:双肺多发炎症,靠近胸膜处,血源性感染可能性大
1.X连锁慢性肉芽肿病。
2.急性重症支气管肺炎。
3.脓毒症。
诊断依据:患儿8个月大,共患2次重症肺炎,且肺CT均表现为大片实变影,局部呈团块样改变;化验仍表现为白细胞及CRP明显增高,行呼吸爆发实验结果为阳性;提取患儿及其父母血样进行基因检测,结果证实患儿为CYBB基因突变,其母亲为该致病基因的携带者。
慢性肉芽肿病是一种由于吞噬细胞功能障碍引起的原发性免疫缺陷病。最近报道在欧洲发病率约为1/250 000,在英国和爱尔兰的发病率约为1/120 000。我国CGD的发病率尚不清楚。典型的临床表现为反复感染,易形成局部化脓性炎症,且难以治愈。目前治疗以对症治疗为主,免疫重建可作为根治方法。
CGD的发病机制通常认为与中性粒细胞功能障碍有关。CGD患者男性多见,男女比例6:1。85%的X-CGD患者5岁前获得诊断。主要临床表现是反复感染,尤其在生后第1年内明显。皮肤、淋巴结、肺部、肝脏是CGD最常见的感染部位。前3位易患疾病分别是:肺炎(79%)、脓肿(68%)、化脓性淋巴结炎(53%)。病原主要为过氧化氢酶阳性的细菌和真菌。在北美,CGD患者感染最主要的5种病原菌为:金黄色葡萄球菌、洋葱伯克霍尔德杆菌、黏质沙雷菌、诺卡尔菌属和烟曲霉菌。据报道近半数的慢性肉芽肿病患者死亡由曲霉菌感染引起。曲霉菌感染的患者通常无感染的典型症状和体征。在我国,结核感染较常见。卡介苗接种可引起严重的局部反应,甚至结核播散,故患者禁忌接种卡介苗。CGD感染后诱发持续炎症,最常累及胃肠道和泌尿系统。胃肠道肉芽肿可见于整个消化道。较大肉芽肿易引起消化道梗阻,胃梗阻常见。患者顽固性呕吐易误诊为幽门狭窄或食物过敏。结肠炎也是CGD常见的胃肠道表现。在泌尿系统,CGD患者泌尿生殖系统肉芽肿,如膀胱肉芽肿可引起输尿管梗阻和尿路感染。
目前针对慢性肉芽肿病较特异的诊断方法包括:①四氮唑蓝还原试验:四氮唑蓝还原试验是最早应用的CGD 的筛查方法。NBT试验主观性强。部分患者会表现假阴性。因此,正常的NBT结果不能除外CGD。目前多作为筛查试验,大多数情况已被以下几种方法代替。②二氢罗丹明流式细胞分析,CGD患者由于呼吸爆发缺失,与正常患者相比,中性粒细胞在流式细胞分布图中移位不明显,从而得以诊断。DHRl23流式细胞分析是X-CGD诊断及携带者筛查既敏感又特异的方法。实验室条件不同,结果会有轻微出入。③蛋白表达用Western印迹方法或流式细胞分析方法可检测gp91phox、p22phox、p47phox、p47phox的蛋白表达。若蛋白表达减低或正常表达的缺陷蛋白,需结合基因突变分析来确诊。④基因序列分析:基因序列分析可从分子水平明确CGD诊断,是CGD的确诊方法。
造血干细胞移植治疗(hematopoietic stem cell transplantation,HSCT):免疫重建包括HSCT和基因治疗。HSCT是 CGD目前唯一的根治手段。HSCT包括骨髓、外周血和脐血来源的HSCT。根据供者的不同,又分为同种异体同型合子HSCT、同种异体半合子HSCT(家庭成员父母或兄弟姐妹提供供体)、无关供体HSCT 和宫内HSCT。重庆医科大学附属儿童医院于2012年成功完成2例CGD患者的HSCT。移植后24天,检测 NBT及呼吸爆发功能均恢复正常,移植后2个月复查CT提示肺部感染明显减轻,患者远期疗效还在继续随访中。一些新的抗感染药物和免疫调节药物的应用,可更有效地控制CGD患者的感染,延长生命,但HST 仍是大多数CGD患者目前最有效的治疗手段。
基因治疗技术是通过一定方式,将正常基因或有治疗作用的DNA序列导入靶细胞,以纠正基因缺陷,从而达到治疗疾病的目的。基因治疗修复 NADPH氧化酶是最终的治疗目标。
(王 佳 韩晓华)













