患儿,女,4个月。
主诉:间断发热伴咳嗽13天。
现病史:患儿13天前无明显诱因出现发热,体温最高达39.0℃,口服美林后热可退,4~6小时后复升,无寒战、抽搐,伴咳嗽,为阵咳,有痰咳不出,咳嗽剧烈时喉部可闻及“咝咝”声,无呼吸困难,无低热、盗汗,无明显消瘦。于当地医院胸片检查(图1)提示“双肺纹理增粗、模糊”,诊断“肺炎”,予“头孢、红霉素”静脉滴注共8天,静脉滴注4天后体温平稳,仍有咳嗽,复查胸片(图2)提示肺炎加重。来笔者医院就诊,门诊肺CT(图3)提示左肺上叶占位性病变,遂于小儿外科住院治疗,胸腔彩超提示左侧胸腔液性暗区,内可见点片状回声;诊断“肺炎,肺结核不除外,肺内占位性病变不除外”予二代头孢抗炎及化痰治疗。请胸科医院会诊考虑“左肺上叶炎症性病变可能性大,不除外‘占位性病变’或‘结核’可能;建议完善磁共振及增强CT检查”。2天前于外院就诊,考虑“细菌或真菌感染,不除外结核及先天性肿瘤”未接受治疗返回。2天前患儿再次发热,体温波动于38~39℃,仍咳嗽,至笔者科室进一步诊治。
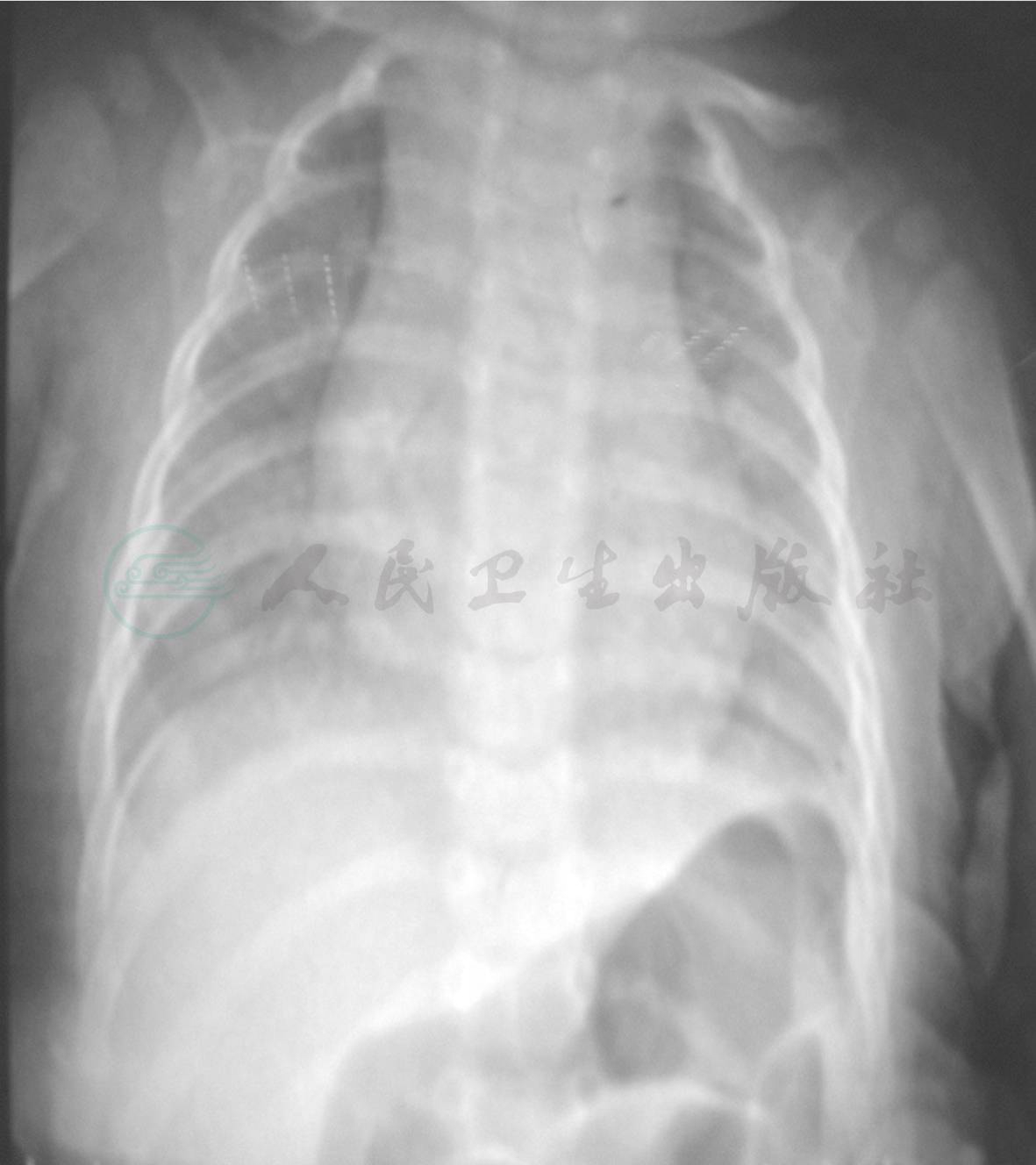
图1 入院前当地胸片
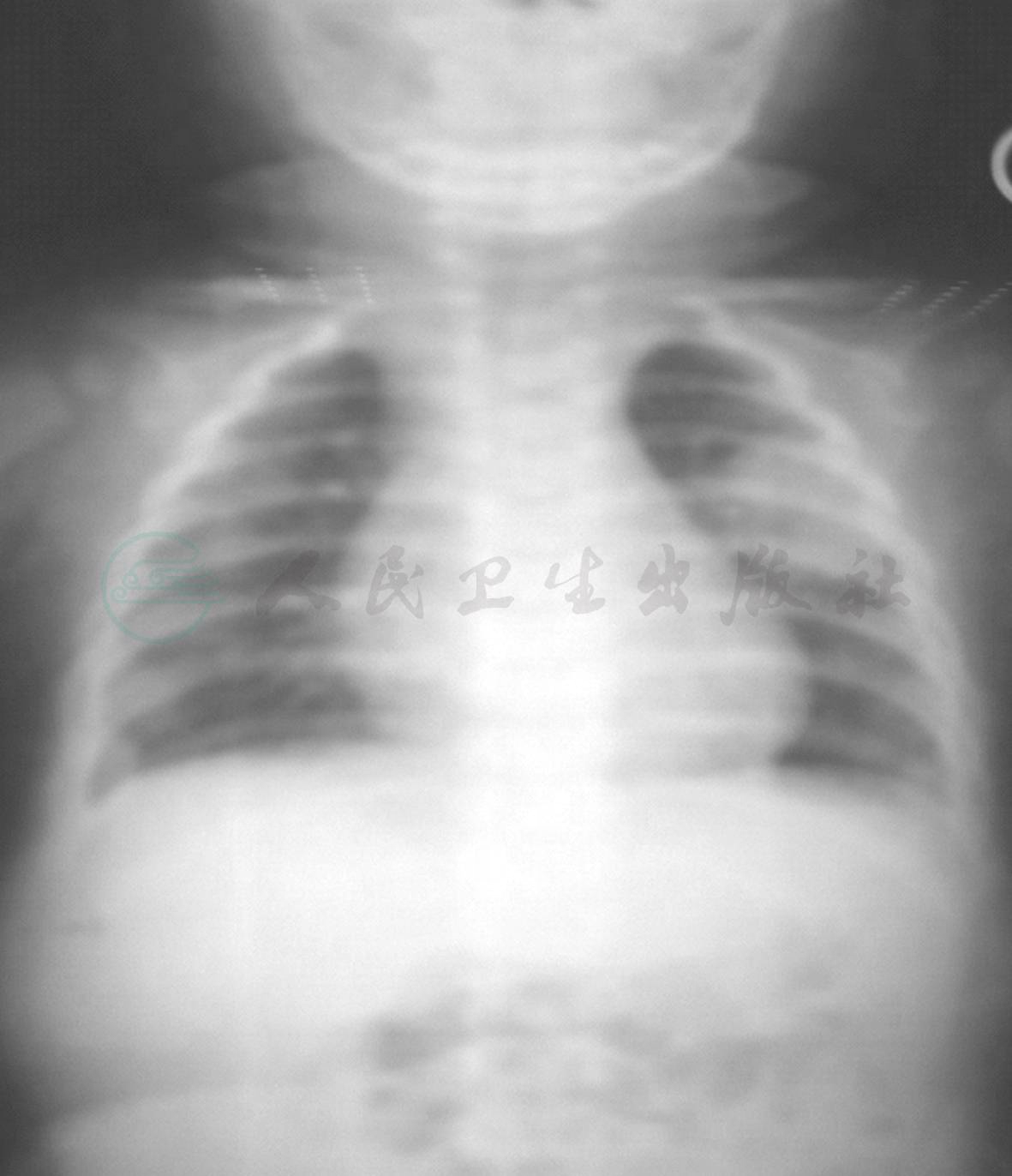
图2 经治疗4天后于当地复查胸片
病来精神欠佳,吃奶稍差,无黑便,无血尿,少尿。
既往史:既往体健。否认心脏病、异物吸入等其他疾病史。否认湿疹史。
过敏及接触史:否认食物及药物过敏史。否认肝炎、结核等传染病接触史。
个人及家族史:G1P1,足月顺产,出生体重3 750g,无窒息史,生后母乳喂养,生长发育同同龄儿,按时进行预防接种。否认家族遗传代谢性疾病史。
入院查体及相关检查:神志清楚,精神尚可,周身皮肤黏膜无黄染、无皮疹及出血点,浅表淋巴结未触及。口唇红润,呼吸稍促,约36次/min,无鼻翼扇动及三凹征,口周无发绀,咽红。颈软,胸廓对称,双肺叩诊清音,听诊呼吸音粗,双肺偶可闻及散在少许喘鸣音,左肺可闻及散在中小水泡音。心前区无隆起,心界不大,心音有力、律齐,各瓣膜听诊区未及杂音。腹软不胀,无压痛、反跳痛及肌紧张,肝脾未触及,未及包块,肠鸣音活跃5次/min。四肢活动自如,无杵状指/趾,肢端温暖,双下肢无水肿,CRT<3秒,神经系统查体未见阳性体征。
辅助检查:门诊血常规:WBC 12.1×109/L,NE 70%;RBC 3.9×1012/L,HGB 110g/L;PLT 206×109/L。门诊肺 CT(图3):双肺纹理增粗模糊,左肺上叶占位性病变。胸腔彩超:左侧胸腔腋后线第2、3肋间可见2.4cm×2.7cm液性暗区,内可见点片状回声。
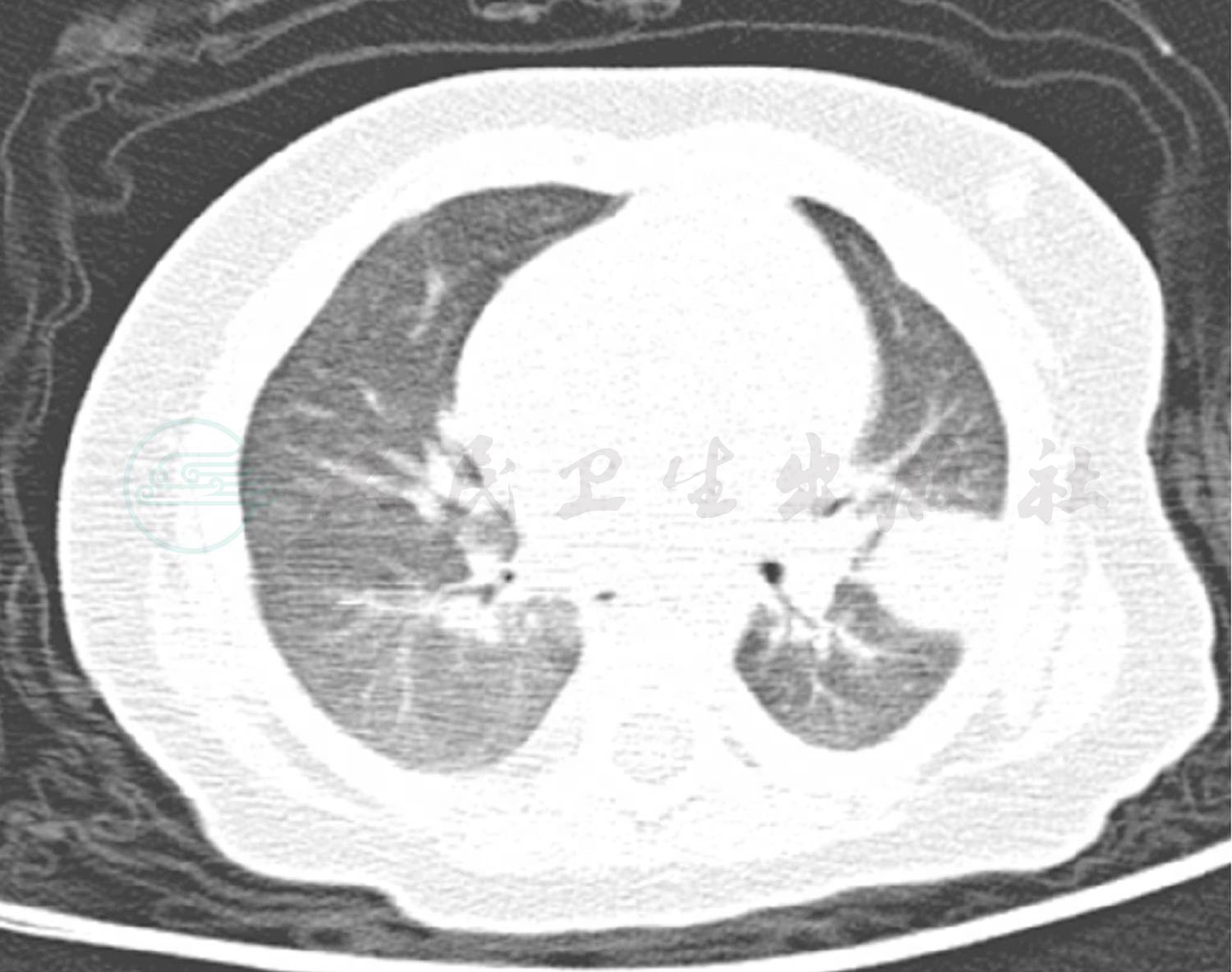
图3 笔者医院门诊肺CT结果
入院后完善相关检查:血常规:WBC 12.1×109/L,提示白细胞升高,以中性粒细胞为主;CRP 11.5mg/L(0~8mg/L);PCT 0.45ng/L(<0.05ng/L),ASO<25.0(0~200U/ml);ESR 12mm/h,均正常;病原学检测除肺炎支原体抗体(MPAb)1:40外,肺炎支原体抗体-IgM(MPAbIgM)阴性、鼻咽拭子肺炎支原体DNA测定阴性,肺炎衣原体抗体-IgM、常见呼吸道、肠道病毒及肝炎病毒检测均阴性。免疫球蛋白及淋巴细胞亚群均正常,除外免疫缺陷病。总IgE 38U/ml正常。尿便常规、肝肾功能、血气分析均正常。心电图正常,心脏、肝胆脾及肾脏彩超未发现异常。胸片(图4):双肺纹理增粗模糊,左肺上叶实变影,结合原有肺CT结果诊断急性支气管肺炎,左肺占位性质待定。考虑存在细菌感染,给予静脉滴注头孢呋辛钠100mg/(kg·d)抗感染,予祛痰止咳药物对症治疗。随后继续完善相关检查:血细菌培养未见细菌生长,痰细菌涂片及细菌培养为呼吸道正常菌群,真菌涂片及培养均阴性。结核抗体(TBAb)、结核菌素试验阴性,T-spot阴性,无结核感染依据。仅1,3-β葡聚糖23pg/ml略高,不除外真菌感染。头孢呋辛抗炎3天体温未见明显下降,升级抗生素至头孢吡肟后体温逐渐下降,咳嗽、喘息症状及肺部湿啰音及喘鸣音逐渐减轻,入院第10天体温恢复正常,仍有咳嗽及间断喘息;入院第15天,行肺CT+三维重建(图5)提示原有肺实变区液化、坏死,出现空腔阴影形成“新月形空气征”。入院第17天行纤维支气管镜检查(图6),结果:左、右肺各叶、段、亚段开口位置正常,黏膜充血、少许浆液性分泌物。除外先天性气道发育异常。BALF检查:一般细菌、结核菌及真菌涂片检查均未找到相应阳性菌,细菌培养未见细菌生长,PCR-TB阴性,真菌培养:25℃黑曲霉生长。追问病史:患儿有长期潮湿生霉环境接触史。诊断为曲霉菌肺炎(侵袭性肺曲霉菌病)。加用伊曲康唑口服[6~8mg/(kg·d)]、两性霉素B雾化吸入(2.5mg/次,2次/d)1周,咳嗽逐渐减轻,喘息症状及肺部喘鸣音消失后出院。
出院医嘱:继续口服伊曲康唑口服液30mg/次,2周后复查血常规、肝肾功及胸片。
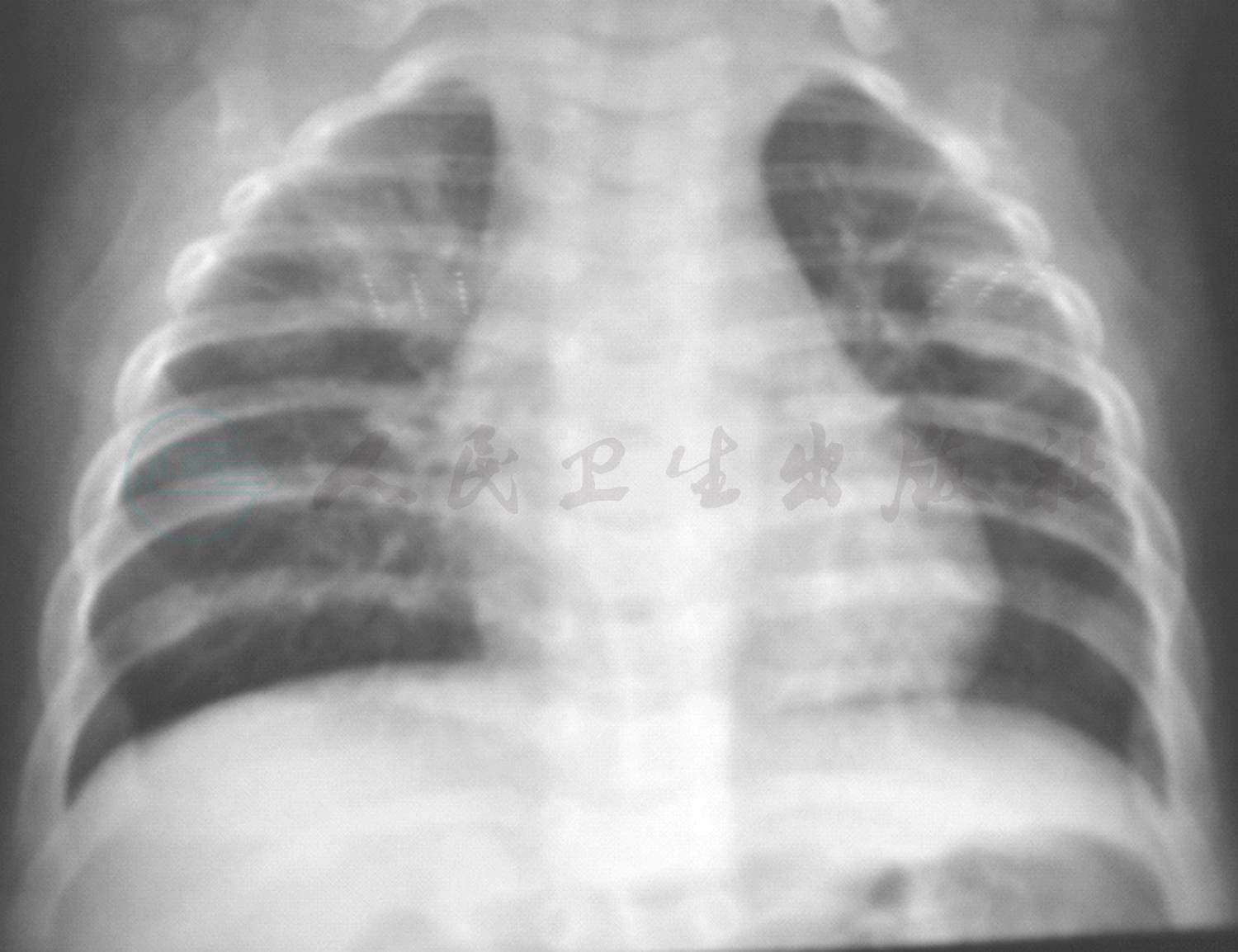
图4 入院后胸片检查
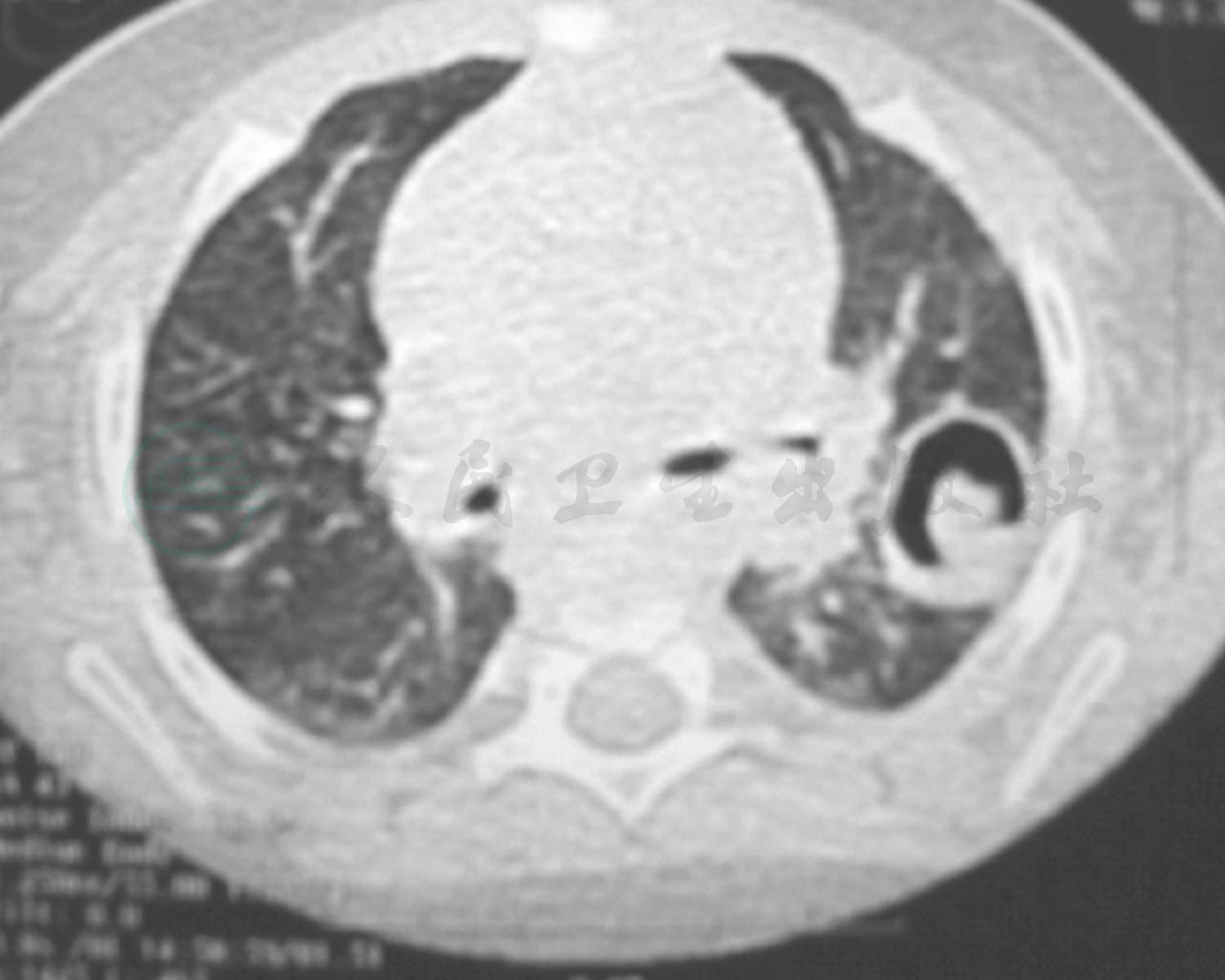
图5 入院2周复查肺CT
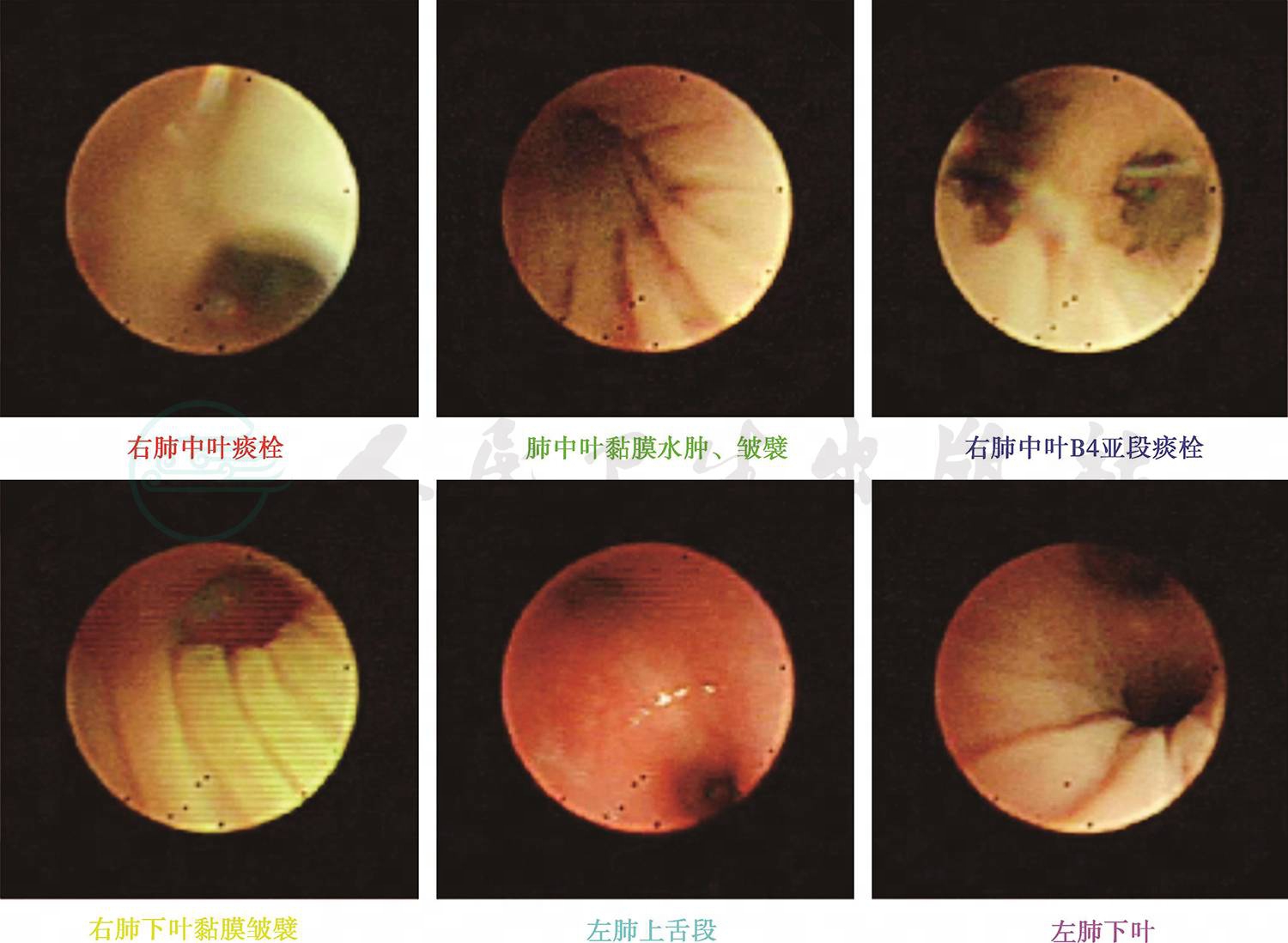
图6 入院17天行纤维支气管镜检查
目前随诊4个月。出院后2周复查胸片(图7)示双肺纹理略增粗,左肺上叶实变影较前缩小,周围可见空腔。出院2个月后复查肺部CT(图8):左肺上叶纹理略增粗紊乱,实变及周围空腔消失。出院3个月后患儿再次发热咳嗽,血常规:WBC 13.65×109/L;中性粒细胞比率62%;Hb 122g/L;PLT 122×109/L;MP-IgG 1:320;MP-IgM阴性。复查肺部CT示双肺纹理增粗模糊,考虑细菌感染,不除外支原体感染,予噻吗灵联合红霉素抗炎,继续口服伊曲康唑治疗曲霉菌肺炎。建议患儿复查支气管镜检查,患儿家属未同意。建议出院后择期行支气管镜提取肺泡灌洗液进行真菌培养,明确伊曲康唑用药时间。出院4个月后复查肺部CT基本正常(图9)。
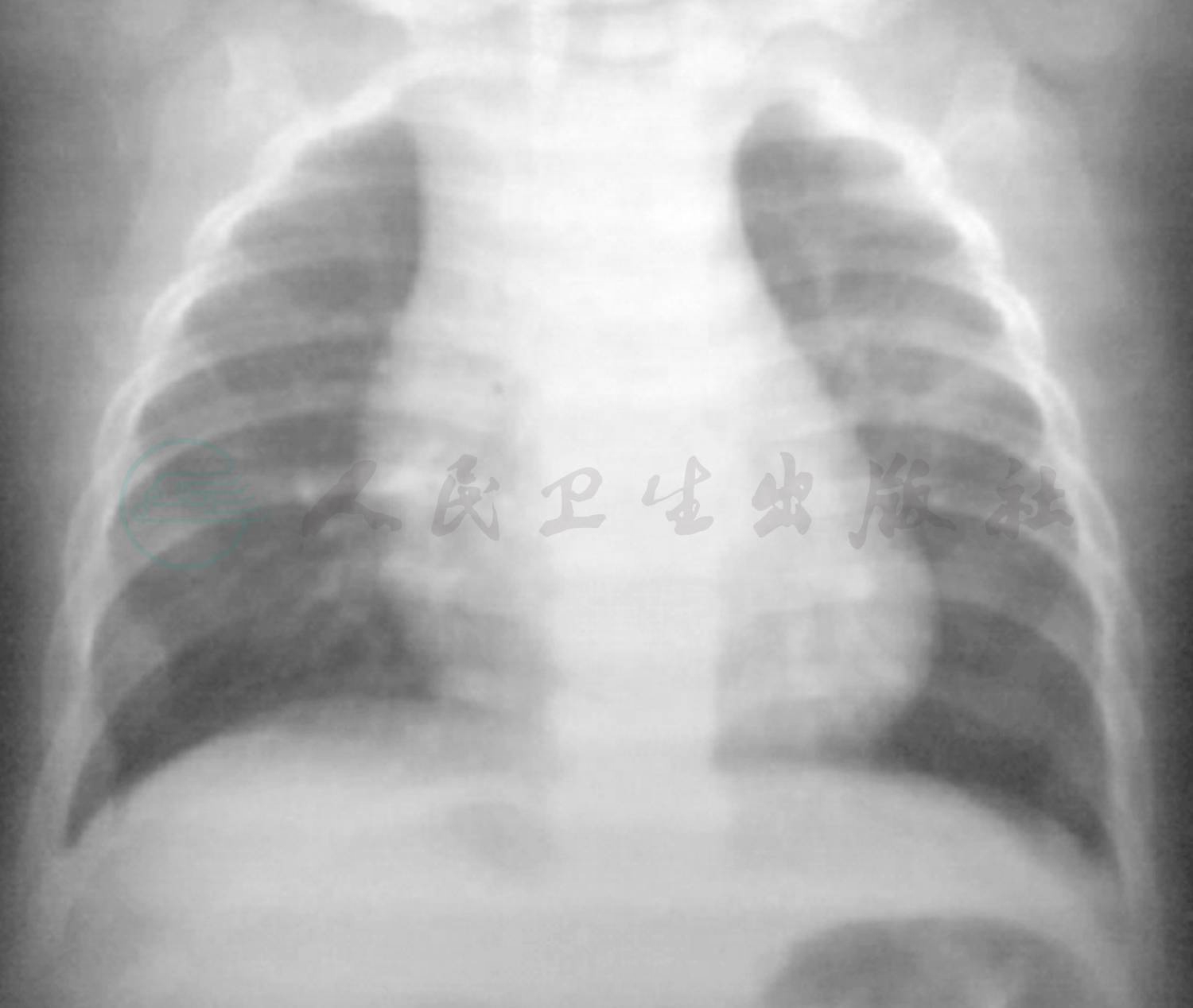
图7 出院2周后复查胸片
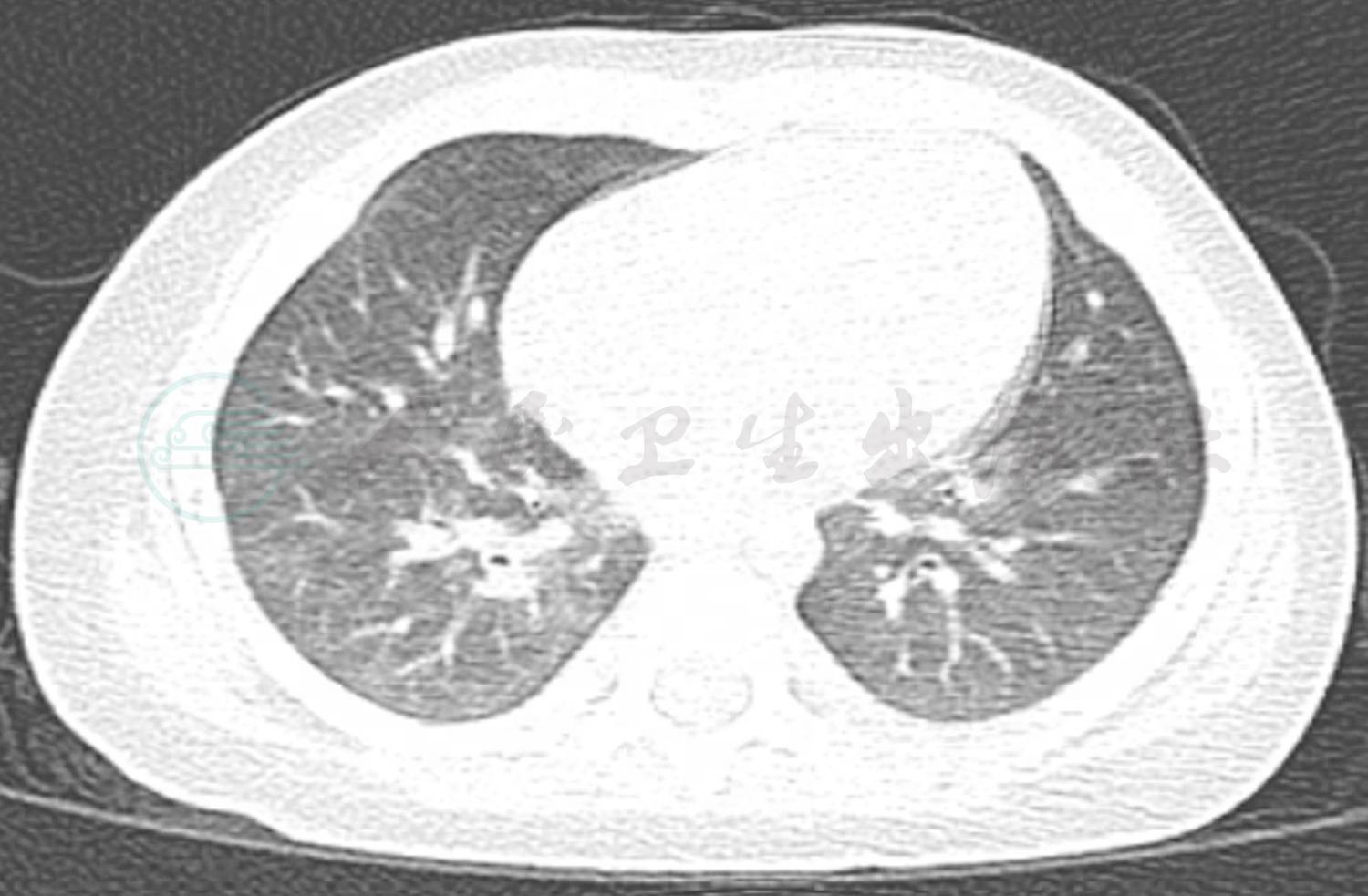
图8 出院2个月后复查肺CT
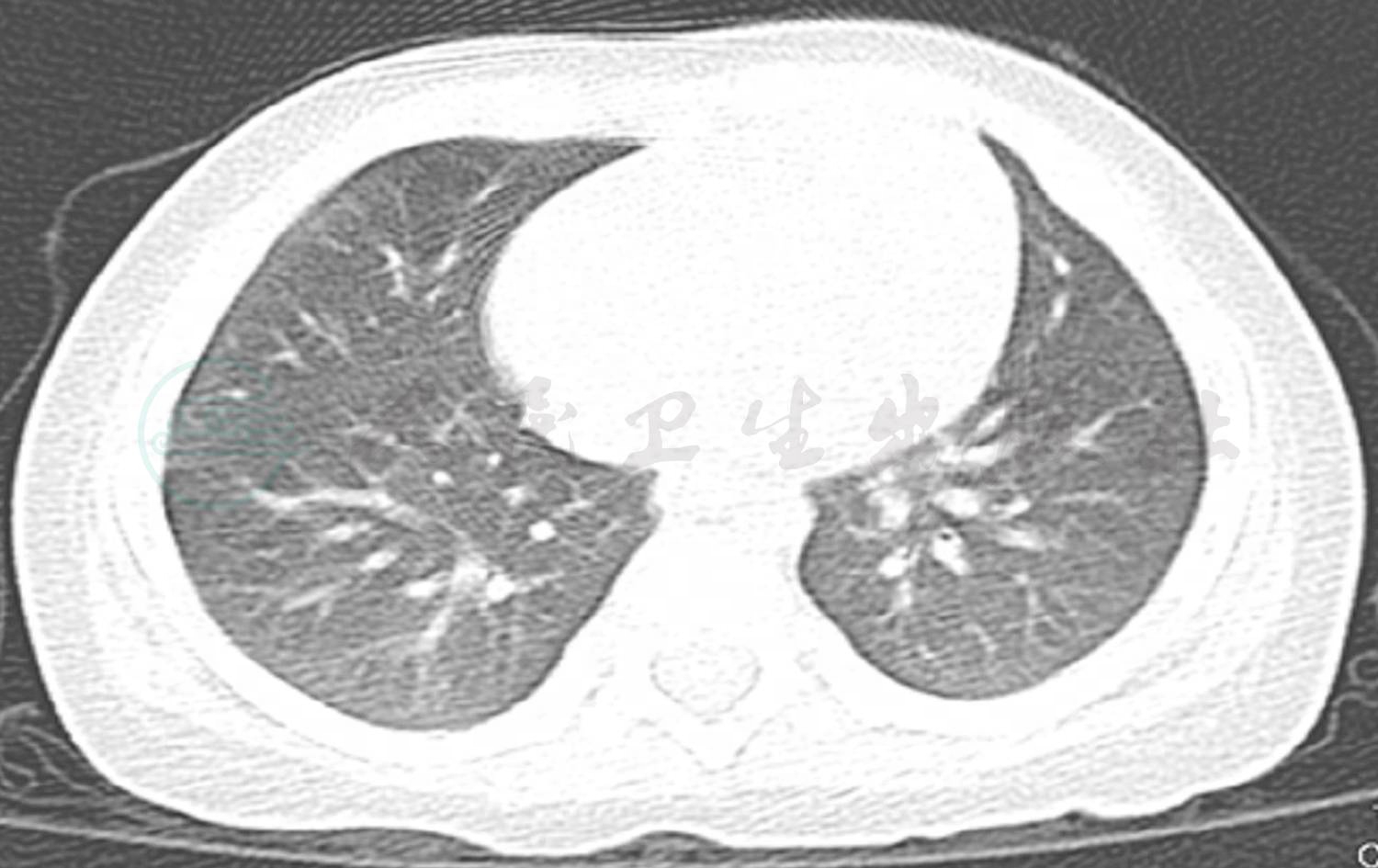
图9 出院4个月复查肺CT
侵袭性肺曲霉菌病。
诊断依据:小婴儿,长期潮湿生霉环境接触史;发热、咳嗽症状,经抗菌治疗好转后再次出现发热、咳嗽症状,肺部听诊水泡音及喘鸣音,肺部影像学表现出肺部炎症、早期出现胸膜下密度增高的结节实变影,数天后肺实变区液化、坏死,出现空腔阴影或“新月形空气征”;支气管肺泡灌洗液真菌培养:25℃黑曲霉生长;1,3-β葡聚糖抗原检查阳性;伊曲康唑、两性霉素B抗真菌治疗有效;除外肺脓肿、肺结核及肿瘤性疾病。
侵袭性肺曲霉菌病为肺曲霉菌病(pulmonary aspergillosis)临床分型之一,肺曲霉菌病是一种由曲菌引起的感染性、进展性、变态反应性疾病。曲霉菌病是真菌感染中最常见的一种,人体各器官几乎均可受累,但以肺和鼻窦常见。肺曲霉菌病临床可以分为4型:①曲菌球;②慢性坏死型曲菌病;③侵袭性肺曲菌病;④变应性支气管肺部曲菌病。
侵袭性肺曲菌病(invasive pulmonary aspergillosis,IPA)多发生于有免疫缺陷的患者,曲菌球可以转归为侵袭性曲菌病。临床症状更严重,死亡率较高。随着广谱抗菌药物、免疫抑制剂和抗肿瘤药物的广泛应用、各种导管的留置以及呼吸机的普及,加之对免疫缺陷病和真菌感染诊断水平的提高,临床上儿童侵袭性真菌感染的患病率呈上升趋势。
自然界有200多种曲菌,但是仅有10种左右可以致病,常见的致病菌株是烟曲霉菌(aspergillus fumigatus)、黄曲霉菌(aspergillus flavus)和黑曲霉菌(aspergillus niger)。其中烟曲霉菌最为重要,这种真菌生长快,其微小的芽胞可深入侵犯肺部,耐受性强。还可通过释放蛋白酶,造成严重的肺部病变。在秋冬和阴雨季节,当储藏物品或谷草发热霉烂时,大量吸入可引起本病的急性发作。
曲菌属为有菌丝的微生物,它们以有隔膜的菌丝形式存在于自然界和受感染的哺乳动物组织中,其菌丝直径为5μm,呈锐角形双分支结构,分支结构常为手指状,导致感染的结构为分生孢子,它们一旦进入下呼吸道便变成曲菌,如果局部条件允许,就会变成侵入型菌丝。
人体内巨噬细胞可杀灭分生孢子,中性粒细胞可清除菌丝体。体液免疫在防御真菌中作用不显著。曲霉菌通过呼吸道侵入机体,其病变类型取决于机体的免疫状态,肺部的侵犯是通过支气管树和肺泡直接侵入,以后者更常见;血管的感染导致血源性播散,引发血管炎和血管栓塞,导致肺梗死、出血和坏死。
侵袭性肺曲菌病通常是由于曲菌孢子的大量吸入,菌丝在支气管黏膜上生长,引起急性气管-支气管炎。少数感染方式为肺外感染经血行播散至肺部。病理改变主要为局部肺血管被菌丝堵塞,造成局部肺梗死,导致肺实质受累,发生梗死、坏死,形成空洞。此外,侵袭性曲菌病感染亦可导致心脏、脑等多个器官或组织的感染。
曲霉菌病的高危人群包括癌症、艾滋病、白血病的患者,以及器官移植者、大剂量的皮质甾体激素应用者、接受化疗的患者等。肺曲菌病的组织学、临床和影像学表现与该菌的毒力和宿主的免疫反应有关。
侵袭性肺曲菌病患者常有支气管炎的表现,如干咳、黏液痰或血痰、呼吸困难、发热、关节痛以及体重减轻等,胸部听诊可见湿啰音或胸膜摩擦音。此外,胸痛和咯血也是IPA侵犯肺血管的一个典型征象。在艾滋病患者和器官移植患者中经常出现气道阻塞和局部肺膨胀不良,如曲菌侵犯血管则出现大面积的梗死和出血。IPA的诊断比较困难,除了具备高危因素外,经多途径多次痰培养分离出同一种菌种,结合临床表现后才可作出诊断。对于手术切除或活检组织作病理检查发现曲菌时,可以作出肯定的诊断。
1.实验室检查
(1)微生物学检查
血培养对于IPA并无诊断价值,因为极少能从其中分离得到曲霉菌。呼吸系统培养尚有些作用。可获得的呼吸系统标本从痰到支气管镜所取标本(支气管肺泡灌洗液、支气管抽取物或保护性毛刷)。下呼吸道标本的培养对于分离曲霉菌阳性率为60%。尽管直接检查标本因敏感性低而仍存在争议,但可提高早期诊断水平;应用荧光增白剂染色可使准确率达到70%。在易感个体的下呼吸道中分离到该病菌,可能是真菌侵入性感染的证据。
(2)血清学检查
需要正常的宿主免疫应答,而免疫抑制患者中,免疫应答常常缺失,导致该方法的使用价值受到限制。文献报道检测循环的半乳甘露聚糖抗原更有应用前景。最近研制开发的1,3-β-D-葡聚糖(G检查)检测,敏感性较高,但缺乏特异性。目前,聚合酶链反应(PCR)已被试验用于检查IPA患者。在血液标本中,PCR的敏感性和特异性约为70%。
2.影像学表现
(1)X线平片
胸部平片表现无特异性。早期常表现为两肺多发边缘模糊的结节影,大小为1~2cm,多位于两肺外带,随着病变进展,结节影逐渐清晰,且有融合趋势。病变中晚期常表现为两肺中下叶散在的片状、类圆形或团块状阴影,部分可见空洞形成。此型曲霉菌病胸膜渗出比较少见。
(2)CT表现
IPA是常见的曲霉菌感染类型,其影像学表现特点是多种病变性质共存。既有渗出性病变,也可以有小结节、中结节病变,还可以出现细支气管病变,或者合并出现空洞性病变。其分布特点没有特别的规律可循。如果肺内表现为多种病变性质,加之有曲菌感染的高危因素时,应该考虑到本病的可能。CT尤其是高分辨率CT扫描对本病的早期诊断有很大的帮助。HRCT可以提供更多更详细的病变信息。典型的CT表现是肺内多发的结节影,并围绕结节周围的略低于结节密度而又高于肺实质密度环行带状区,该密度类似于毛玻璃样,称之为“晕征”。其病理基础是出血性肺梗死引起结节中心的凝固性坏死,相邻肺泡出血使结节周围可见出血性边缘。结节合并晕征见于40%~69%的早期病例,虽然也可见于念珠菌病、巨细胞病毒肺炎、毛霉菌感染和肺转移瘤,但最常见于IPA早期,而且随着病变时间的推移而逐渐减少。在CT上不典型时表现为结节边缘模糊毛糙。楔形影可见于毛霉菌病、细菌性肺炎或肺出血等疾病,但主要见于IPA早期。表现为以胸膜面为基底的实变影,边缘模糊,与栓塞性肺梗死相似。病理基础为出血性肺梗死。楔形实变可单独出现,也可合并结节影和/或晕征。此外,IPA早期尚可呈现小斑片状、片状毛玻璃致密影,这是IPA气道播散的表现。但常常表现为非特异性的,与支气管肺炎、病毒性肺炎等的CT表现相似。
3.诊断标准
该病诊断较为困难,病死率高达85%。临床上如果高危患者出现发热、咯血、肺部浸润伴特征性影像学改变时,应高度怀疑侵袭性肺曲菌病的可能。儿童侵袭性真菌感染的诊断采用分级诊断模式,诊断依据:由宿主(危险)因素、临床证据、微生物学证据和组织病理学4部分组成,分为确诊、临床诊断和拟诊三个级别。
4.诊断依据
(1)宿主和/或环境(危险)因素
①基础疾病:早产儿、低体重儿、先天发育异常、慢性疾病和重度营养不良等。②原发性免疫缺陷病:各类原发性免疫缺陷病,尤其是联合免疫缺陷病、细胞免疫缺陷病和慢性肉芽肿病(CGD)等。③继发性免疫功能低下:抗肿瘤药物导致外周血中性粒细胞减少;长期应用广谱抗菌药物、糖皮质激素以及其他免疫抑制剂;骨髓移植和器官移植后以及HIV感染和其他严重病毒感染等。④侵入性操作:包括血管内留置导管、留置导尿管、气管插管或气管切开、机械通气、腹膜透析、血液净化和胃肠外营养等。⑤环境危险因素:免疫功能基本正常的儿童,由于吸入大量真菌孢子,如空调污染、密切接触鸽类以及接触有真菌存在的环境,超过机体抵抗力而发病,多见于肺隐球菌病,其次是侵袭性肺曲霉病。
(2)临床证据
①发热、咳嗽和肺部体征经抗菌药物治疗无好转或好转后再次出现发热、咳嗽和肺部体征。②影像学提示肺部病变经抗菌药物治疗无好转或肺部出现新的非原发病的浸润影。提示侵袭性肺曲霉病的影像学征象:早期出现胸膜下密度增高的结节实变影和/或楔形实变影、团块状阴影,病灶周围可有晕轮征(halo sign),数天后肺实变区液化、坏死,出现空腔阴影或新月形空气征(air crescent sign)。曲霉可引起侵袭性支气管感染,影像学主要表现为沿支气管分布的结节阴影、树芽征和细支气管壁增厚等,可单独出现,但常与肺部病变并存。
(3)微生物学证据
有临床诊断意义的微生物学证据:①合格痰标本直接镜检发现菌丝,且培养连续2次以上分离到同种真菌;②支气管肺泡灌洗液经直接镜检发现菌丝,真菌培养阳性;③血液标本曲霉半乳甘露聚糖(GM)实验(ELISA)连续2次吸光度指数(GM I)值>0.8或单次GM I值>1.5;④血液标本真菌细胞壁成分l,3-β-D葡聚糖抗原(G试验)连续2次阳性。
有确诊意义的微生物学证据:①肺组织真菌培养阳性;②胸腔积液真菌培养阳性;③血液真菌培养阳性(曲霉和除马尼菲青霉以外的青霉需排除污染)。
(4)组织病理学证据
肺组织标本进行组织病理学检查发现真菌感染的病理改变以及菌丝或孢子等真菌成分。
诊断标准:①确诊(proven):宿主因素+临床证据+肺组织病理学和/或有确诊意义的微生物学证据。②临床诊断(probable):宿主因素+临床证据+有临床诊断意义的微生物学证据。③拟诊(possible):宿主因素+临床证据。
5.治疗
(1)一般预防
包括医院感染控制技术措施和抗真菌药物预防。目前儿科公认的抗真菌药物预防适应证为:粒细胞减少的血液系统疾病患儿、造血干细胞移植以及慢性肉芽肿患儿。抗真菌药物的耐药问题已引起国内外重视,应避免滥用抗真菌药物预防真菌感染。
(2)靶向预防
在高危患者预防某种特定的真菌感染,如在血液肿瘤和艾滋病患者应用甲氧苄啶-磺胺甲𫫇唑(TMP-SMZ)预防肺孢子菌肺炎。
(3)拟诊治疗
即经验性治疗,由于侵袭性真菌感染病死率高,延误治疗则常导致死亡。为此,经验性抗真菌治疗尤为重要。高危真菌感染患儿,临床和影像学表现提示真菌感染(拟诊)时,在积极寻找病因同时,应开始经验性抗真菌治疗。常用药物为氟康唑、伏立康唑、伊曲康唑,以及卡泊芬净。
(4)临床诊断治疗
即先发治疗,患儿符合临床诊断,其抗真菌治疗已有较强的选择性用药指征,应依据真菌种类、药敏结果、病情轻重以及患儿的耐受性选择用药。
(5)确诊治疗
即靶向治疗,针对确诊患儿,应依据真菌种类、药敏结果、病情轻重以及患儿的耐受性选择用药。侵袭性肺曲霉病:可选择伏立康唑、伊曲康唑、卡泊芬净、两性霉素B,病情重者可联合两种抗真菌药物治疗。氟康唑对肺曲霉感染无效。可参考病情的轻重、原发病、免疫功能状态以及药物的安全性和价格等选择药物。两性霉素B是治疗侵袭性肺曲霉病的传统药物。目前认为病情较重者,可首选伏立康唑。卡泊芬净适用于患者不能耐受其他药物或其他药物无效时的治疗。
6.儿科应用抗真菌药物的种类和剂量
新的抗真菌药物,有的说明书没有明确规范儿科的用药剂量,有的还明确指出“尚无用于儿童的资料,除非用药益处大于潜在危险时,不得用于儿童”。以下所列部分药物的剂量,是儿科临床医生为挽救患儿生命,在家属签署知情同意书后,经临床实践探索的经验剂量或说明书推荐的剂量:①伊曲康唑:6mg/(kg·次),前2天每天2次,以后改为每天1次,静脉滴注。口服制剂6~8mg/(kg·d),分2次服用。②伏立康唑:2~12岁,7mg/(kg·次),每12小时1次,静脉滴注;或第1天 6mg/(kg·次),每12小时1次,随后4mg/(kg·次),每12小时1次,静脉滴注。口服剂量:体重<40kg,100mg/次,每12小时1次;体重≥40kg,200mg/次,每12小时1次。③卡泊芬净:儿童第1天3mg/(kg·d),之后1mg/(kg·d),必要时,可增加剂量至2mg/(kg·d),静脉滴注。④两性霉素B:儿童剂量为0.5~1mg/(kg·d),静脉滴注。两性霉素B脂质复合物3~5mg/(kg·d),静脉滴注。抗真菌治疗的时间长短,因病情而异,侵袭性肺部真菌病的患儿一般均在免疫功能低下的情况下发病,给药时间不宜过短,一般要6~12周,甚至更长,一般治疗至临床症候消失,影像学示病变基本吸收。总之,要对病情进行综合分析,要追踪观察,治疗应个体化。
(张琴珍 陈 宁)













