 去看看
去看看


按照胃切除范围的不同,胃癌手术可分为全胃切除、远端胃大部切除和近端胃切除术;按照淋巴结清扫范围的不同,分为未彻底清扫第一站淋巴结的D0根治术,彻底清扫第一站淋巴结的D1根治术,彻底清扫第一、二站淋巴结的D2根治术,以及彻底清扫第一、二、三站淋巴结的D3根治术。目前日本胃癌治疗指南对于标准根治术定义如下:主要以根治性切除为目的及标准所进行的手术称为标准手术,其要求切除2/3以上胃及D2淋巴结清扫术(淋巴结清扫的定义见图)。理论上标准根治术应符合以下要求:①完全切除原发癌灶;②彻底清除胃周围转移淋巴结;③消除腹腔微小转移灶。
胃切除和(或)淋巴结清扫范围小于标准根治术的手术定义为缩小手术,反之则定义为扩大手术。缩小手术的术式包括:内镜下黏膜切除术(EMR)、内镜黏膜下切除术(ESD)、经腹腔镜胃局部切除术、腹腔镜辅助胃部分切除术以及剖腹局限性手术。其中剖腹局限性手术涵盖保留幽门的胃部分切除术、保留大网膜和网膜囊的远端胃切除术、胃楔形切除术、节段胃切除术、远端半胃切除术以及近端半胃切除术等多种术式。扩大手术则包括淋巴结清扫范围超过第二站的D2+~D3根治术,以及各种类型的联合脏器切除术。
凡胃癌诊断明确,术前检查无明显侵犯邻近脏器以及远处转移征象,估计局部病灶可以完全切除,各重要脏器无严重器质性病变,全身状况许可,估计能耐受手术者均应积极争取手术。
1.全身情况差,重要脏器存在严重器质性病变,估计难以耐受手术者。
2.存在肝转移、腹膜种植转移、腹膜后淋巴结转移或者其他部位远处转移等不可治愈性切除的因素。目前对存在不可根治性切除因素的病灶并不主张施行减瘤术,但是对于存在出血、穿孔、梗阻等并发症的病灶,切除原发病灶(不施行标准的淋巴结清扫)可以改善症状,提高生活质量,仍可以根据患者情况实施。
胃癌患者一般情况多较差,手术前应争取在短时间内予以改善,以提高对手术的耐受能力。对于进展期胃癌可以考虑新辅助化(放)疗,以达到降期的目的,提高手术切除率。
1.少量多次输少浆血、白蛋白等,以纠正贫血和低蛋白血症。
2.胃癌伴幽门梗阻者,术前3日应以3%高渗盐水洗胃;若有水、电解质紊乱,应予以纠正。
3.术前一日进流质,术前晚肥皂水灌肠,或以20%甘露醇500ml,生理盐水1000ml口服作肠道准备。
4.手术晨禁食,术前放置胃管,静脉预防性应用抗生素。
宜采用全身麻醉联合硬脊膜外腔阻滞麻醉。
1.适应证
主要适用于胃窦癌和部分胃体癌。进展期胃癌,局限型(Borrmann Ⅰ型、Ⅱ型)肉眼判断肿瘤边缘距离贲门4cm以上,浸润型(Borrmann Ⅲ型、Ⅳ型)6cm以上可以选择远端胃切除术。胃体大弯侧癌存在脾门淋巴结转移需行脾切除时,或者肿瘤侵犯胰腺需联合脾胰体尾切除时,即使施行远端胃大部切除手术可以切除原发肿瘤病灶,也要施行全胃切除联合脾(胰体尾)切除术。切除范围包括远端2/3~4/5的胃及部分十二指肠,全部大、小网膜,横结肠系膜前叶和胰腺被膜,根据 D2 根治术要求彻底清扫第 No.1、3、4、5、6、7、8a、9、11p、12a淋巴结。但是对于No.6淋巴结转移的远端胃癌患者,尚不能否认14v淋巴结的清扫效果,因此清扫了No.14v的情况可记录为D2+No.14v。
2.切口
通常选择上腹正中切口,自剑突至脐下3cm,并切除剑突,经镰状韧带左侧进腹(图1)。以塑料切口保护膜或纱布垫保护切口,以免肿瘤细胞切口种植。
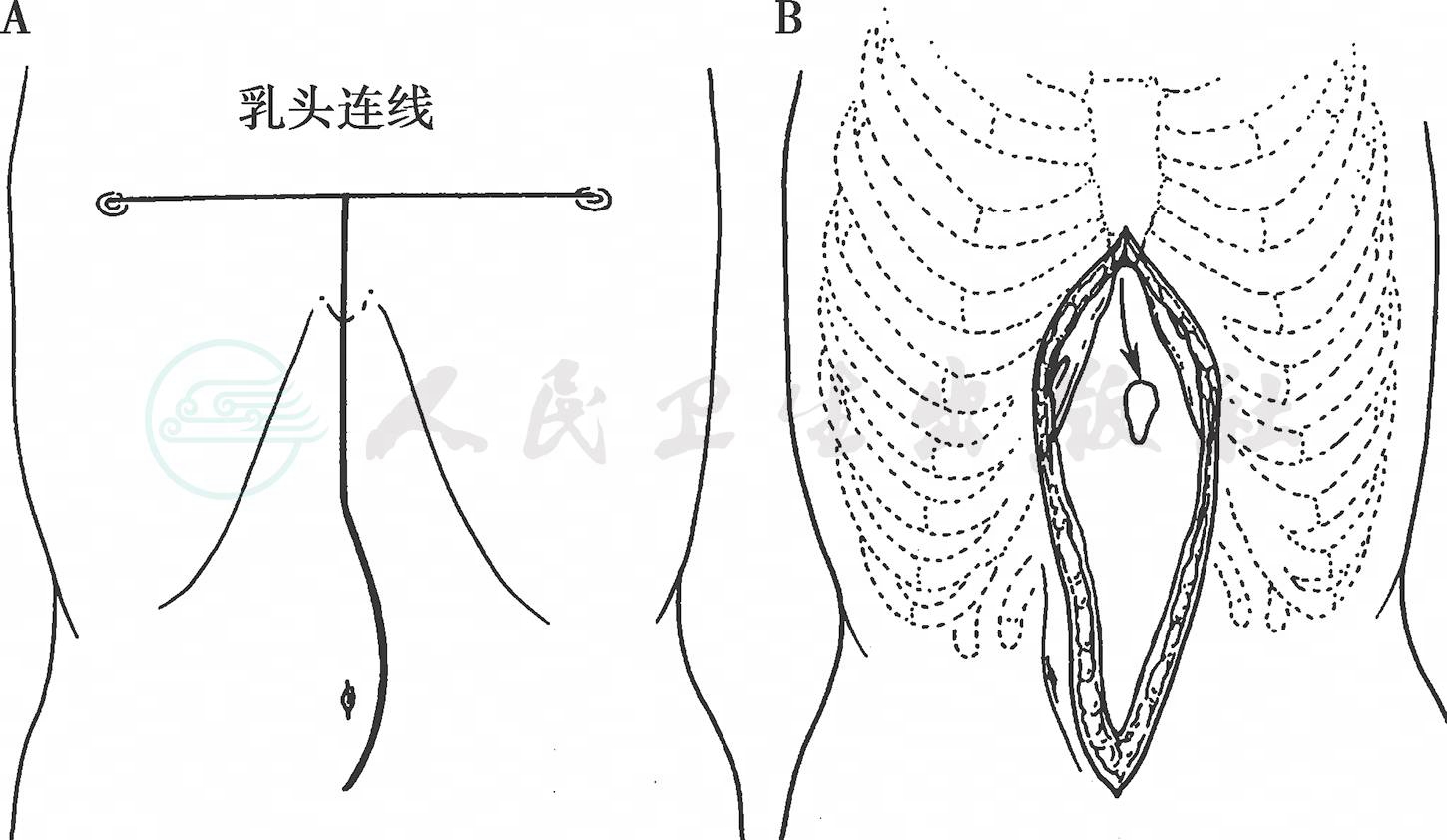
图1 上腹正中切口
3.探查
开腹后如有腹水应记录腹水量及性状并吸取,做脱落细胞检查。无腹水的病例可用生理盐水50ml冲洗直肠膀胱陷凹后吸净,留作脱落细胞检查。探查应由远及近进行,先扪摸直肠膀胱陷凹注意有无种植结节。女性还需探查卵巢有无转移。随后沿主动脉、肠系膜根部上行探查腹膜、大网膜有无转移灶,肠系膜根部有无肿大淋巴结。再探查上腹腔的肝脏、脾脏、横结肠有无浸润和转移。最后探查肿瘤的部位、大小、浆膜是否受累及、累及面积及胃周淋巴结转移情况。探查胰腺受侵情况需打开胃结肠韧带后进行。探查主动脉旁淋巴结需作Kocher切口,切开十二指肠右侧腹膜,沿着十二指肠后面、胰头后面进行钝、锐剥离,翻起十二指肠及胰头,完全显露下腔静脉及腹主动脉。如发现No.13、No.16淋巴结肿大,需切除送冷冻切片检查(图2)。
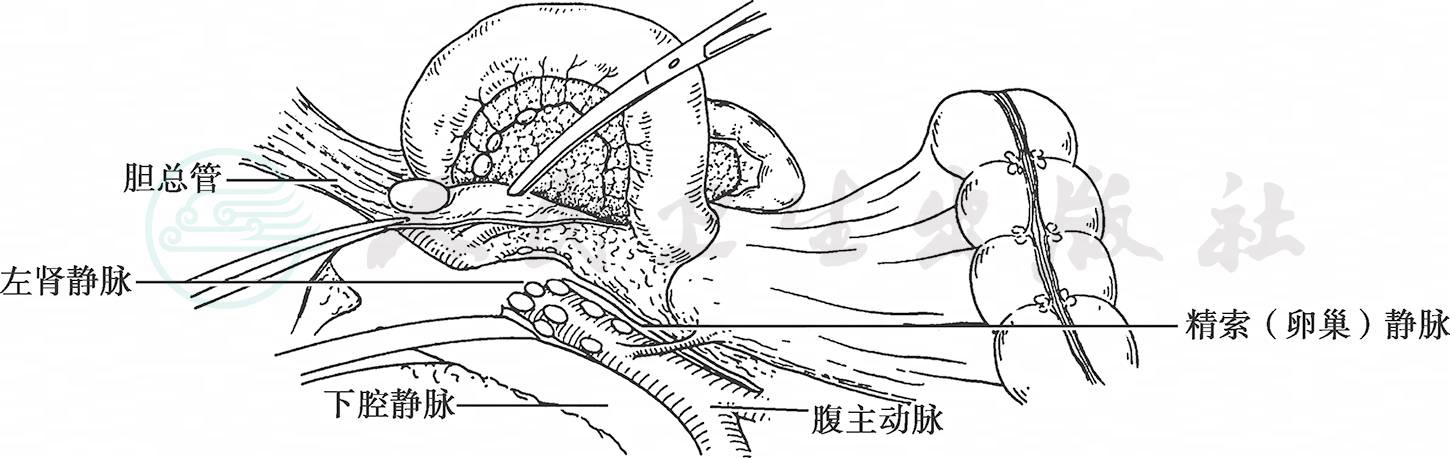
图2 游离十二指肠
4.切除前准备
(1)松解结肠及大网膜附着于脾脏处和大网膜与腹壁的融合处。
(2) 垫托脾脏:用纱布垫置于脾脏后方将脾脏托起,此举一来可以避免因过度牵拉而撕裂脾脏,二来使脾脏处于直视下,便于靠近脾脏处理脾胃韧带。对于部分脾脏被膜与侧腹膜有融合的患者,先剪开融合的侧腹膜后脾脏更易被充分托起。
(3) 防止癌细胞脱落:对癌侵及浆膜面者,用生物蛋白胶涂抹封闭浆膜面或干纱布缝于浆膜面,可以防止癌细胞脱落造成术后腹腔种植。
5.游离与切除
(1)术者和助手分别提起大网膜和横结肠,使两者间保持一定的张力,用电刀从胃结肠韧带结肠缘的无血管区开始切除大网膜(图3)。
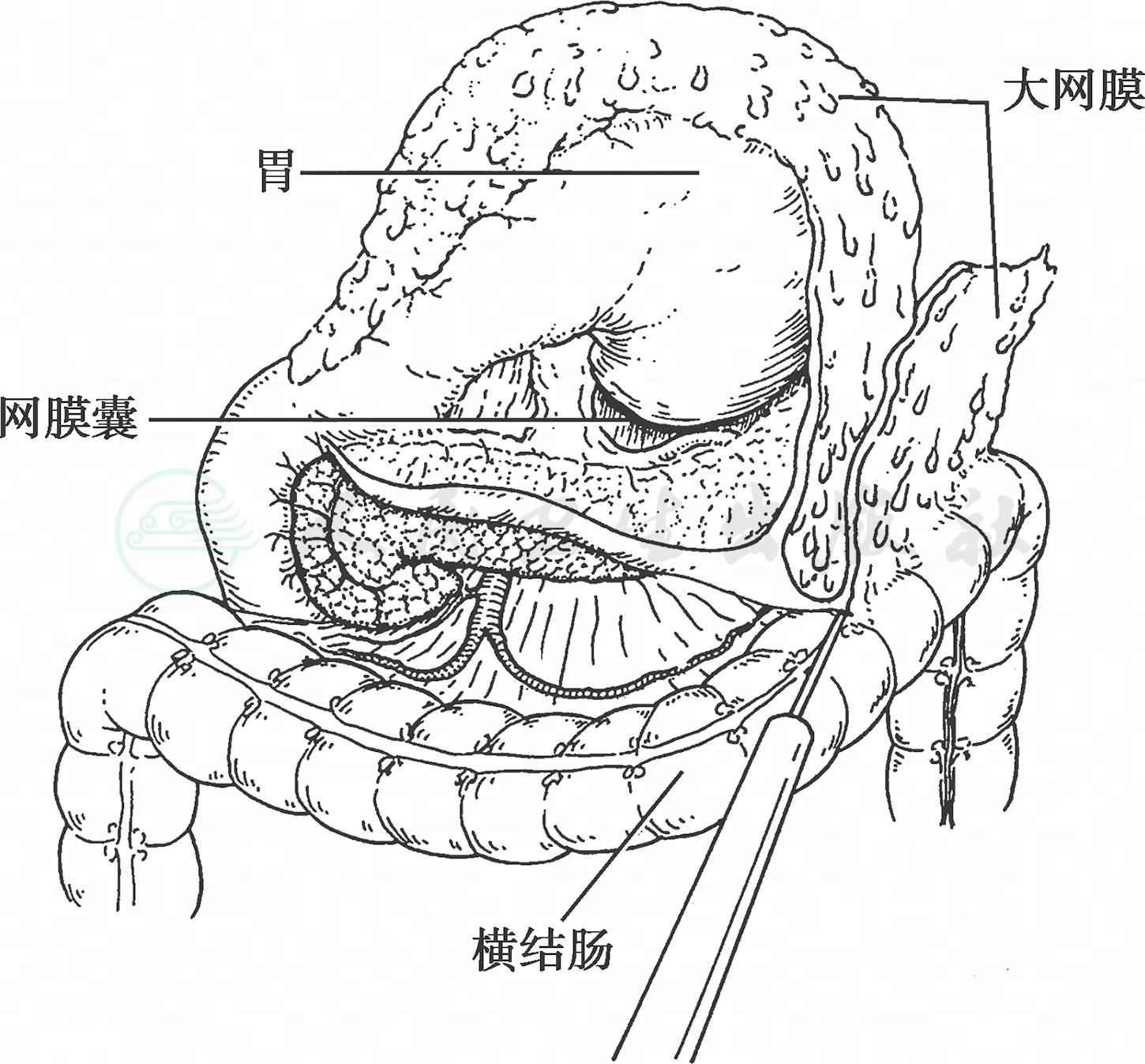
图3 剥离横结肠系膜前叶(右侧)
横结肠右侧系膜前后两叶之间有疏松的结缔组织间隙,沿此间隙很容易将前后叶分离,因此剥除横结肠系膜前叶往往由结肠肝曲开始。将大网膜、横结肠系膜前叶和胰腺包膜一并剥离,一般是切除到胰腺体尾部的被膜,在远端胃切除手术中不可能做到完全切除网膜囊。切开左侧脾结肠韧带到达脾脏下极附近部位,寻找、结扎、切断胃网膜左动静脉。可以把胃短动脉最下分支与胃网膜左动脉第一分支之间的无血管区作为淋巴结清扫的左侧缘(图4)。
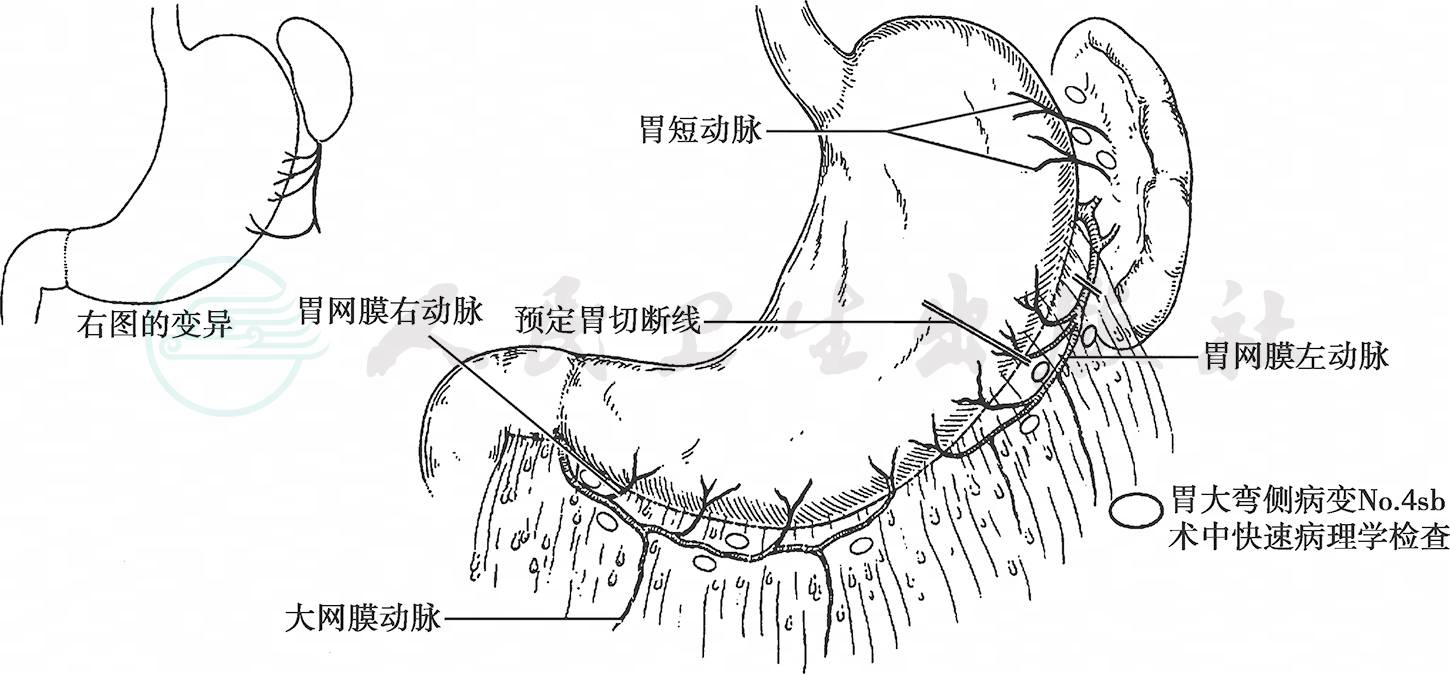
图4 处理脾脏下段附近
肿瘤位于胃体中部大弯侧时,要取多个No.4sb淋巴结进行快速冷冻病理学检查,如阳性时需行全胃联合脾切除术以清扫No.10淋巴结。胃的切断线根据肿瘤的部位而定,贴近胃壁剥除大网膜直至大弯侧胃切断平面以下,清除No.4sa、No.4sb淋巴结。
(2) 当横结肠系膜前叶剥离到胰腺下缘时显露出胃网膜右静脉与副结肠静脉汇合而成的共同干(Henle’s surgical trunk),于胰十二指肠前上静脉汇入部以上切断胃网膜右静脉(图5)。
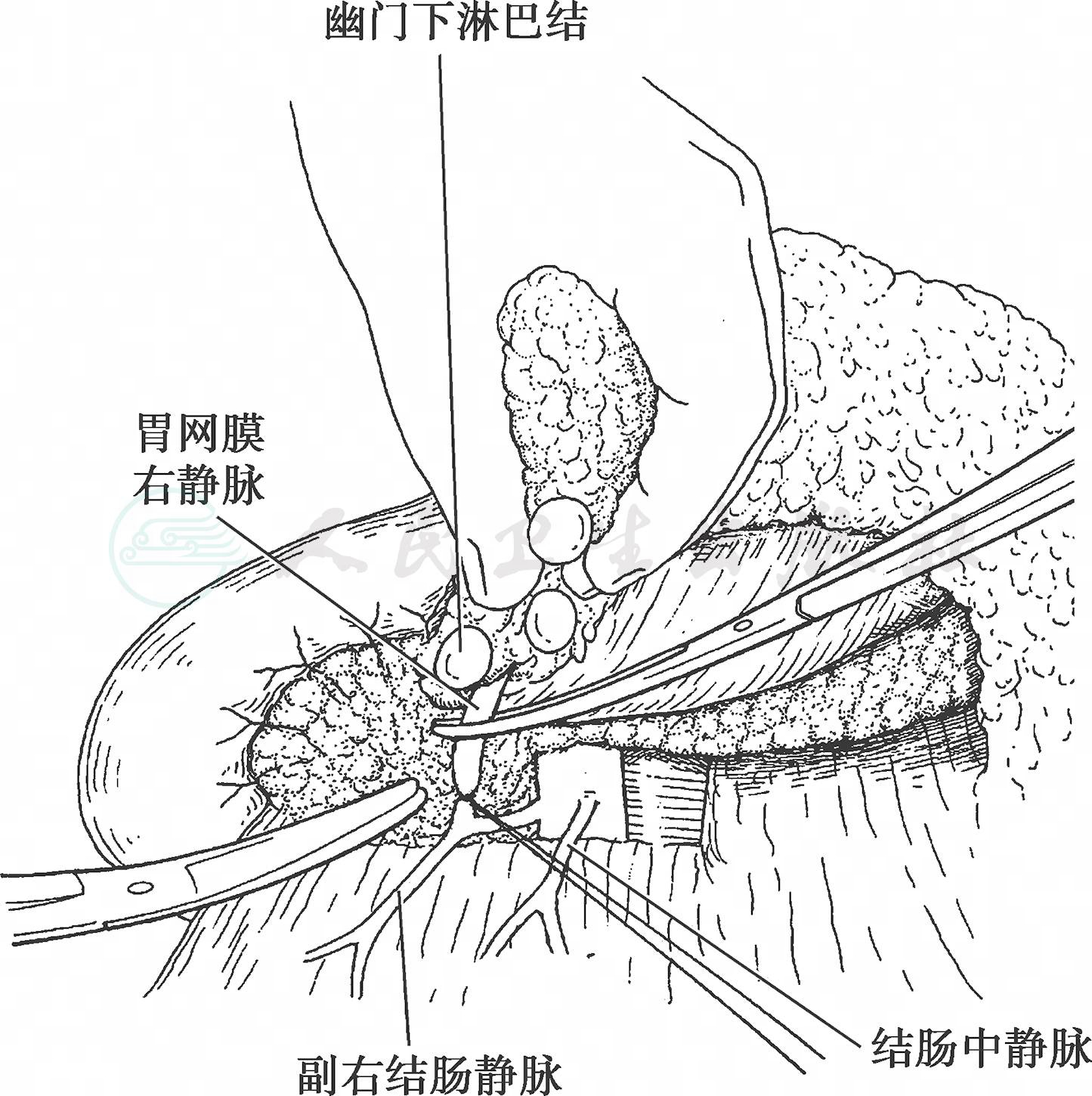
图5 清扫幽门下淋巴结
沿胰头前方向继续清扫幽门下淋巴脂肪组织,清扫时需结扎处理由胰腺实质穿出的小血管。于幽门下方十二指肠胰腺形成的沟中先找到胃十二指肠动脉,进而找到胃网膜右动脉起始处,根部切断胃网膜右动脉,清扫No.6淋巴结(图6)。进而切断从胃十二指肠动脉向十二指肠后壁发出的幽门下动脉以及小动脉分支,游离十二指肠。在进行胃小弯操作前,将胃十二指肠动脉游离到肝总动脉分叉处。
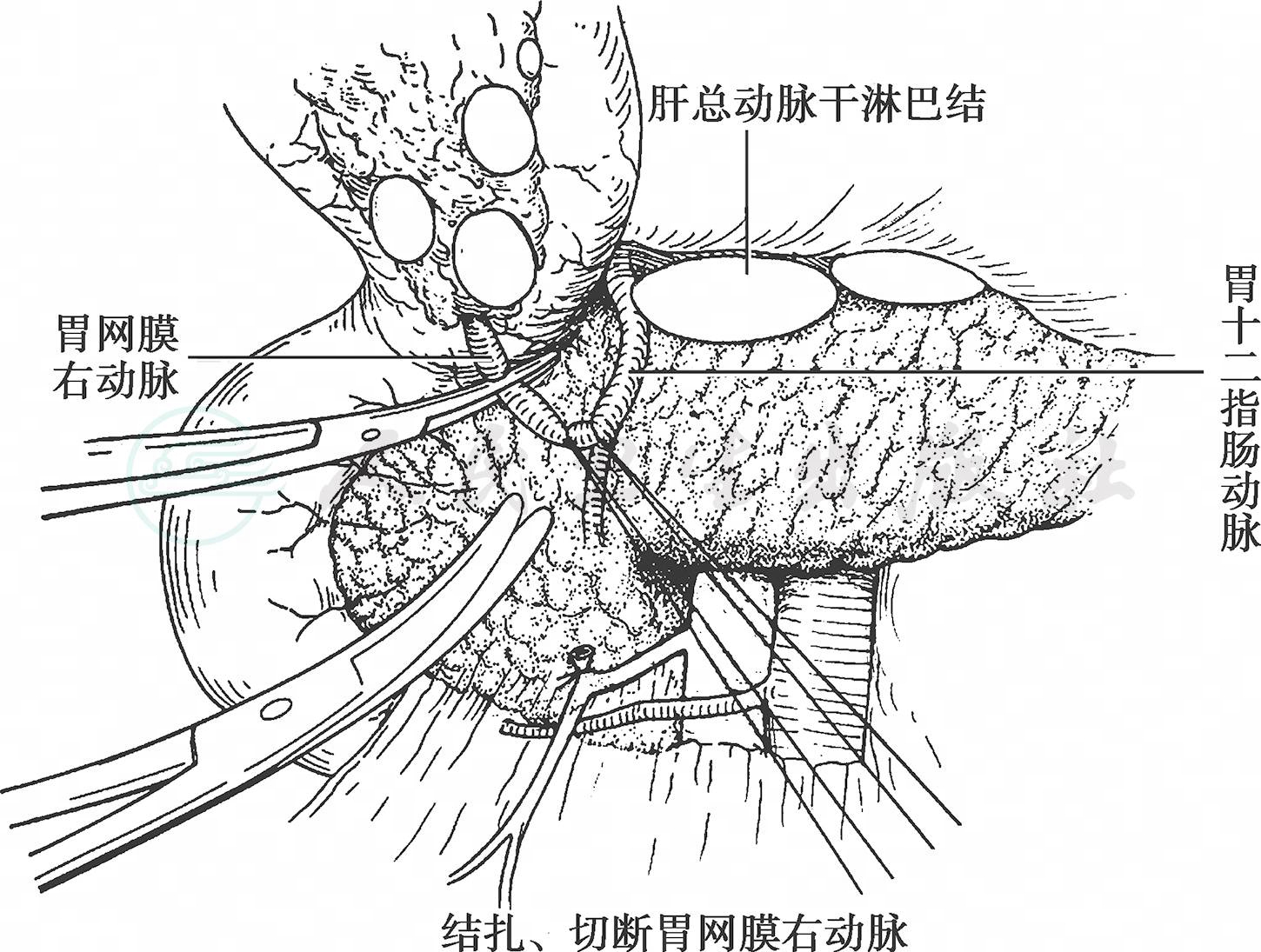
图6 结扎、切断胃网膜右动脉
(3) 胃大弯侧清扫完毕后,将胃复归原位并向下牵拉,显露肝胃韧带。紧贴肝脏下缘选择无血管区打开,向贲门右侧方向切开小网膜。许多病例可遇副肝左动脉,除特别粗的副肝动脉外均可结扎。肝下切线向右延伸至肝十二指肠韧带。
剥离肝十二指肠韧带前面的腹膜,自上而下显露肝固有动脉,由肝固有动脉分叉处向十二指肠清扫动脉前方及右侧的淋巴脂肪组织。沿肝固有动脉剥离时,可见胃右动脉自该动脉发出,自胃右动脉根部切断,清扫No.5淋巴结。为了游离十二指肠,需要结扎切断数支由胃十二指肠动脉发出的十二指肠上动脉(图7)。
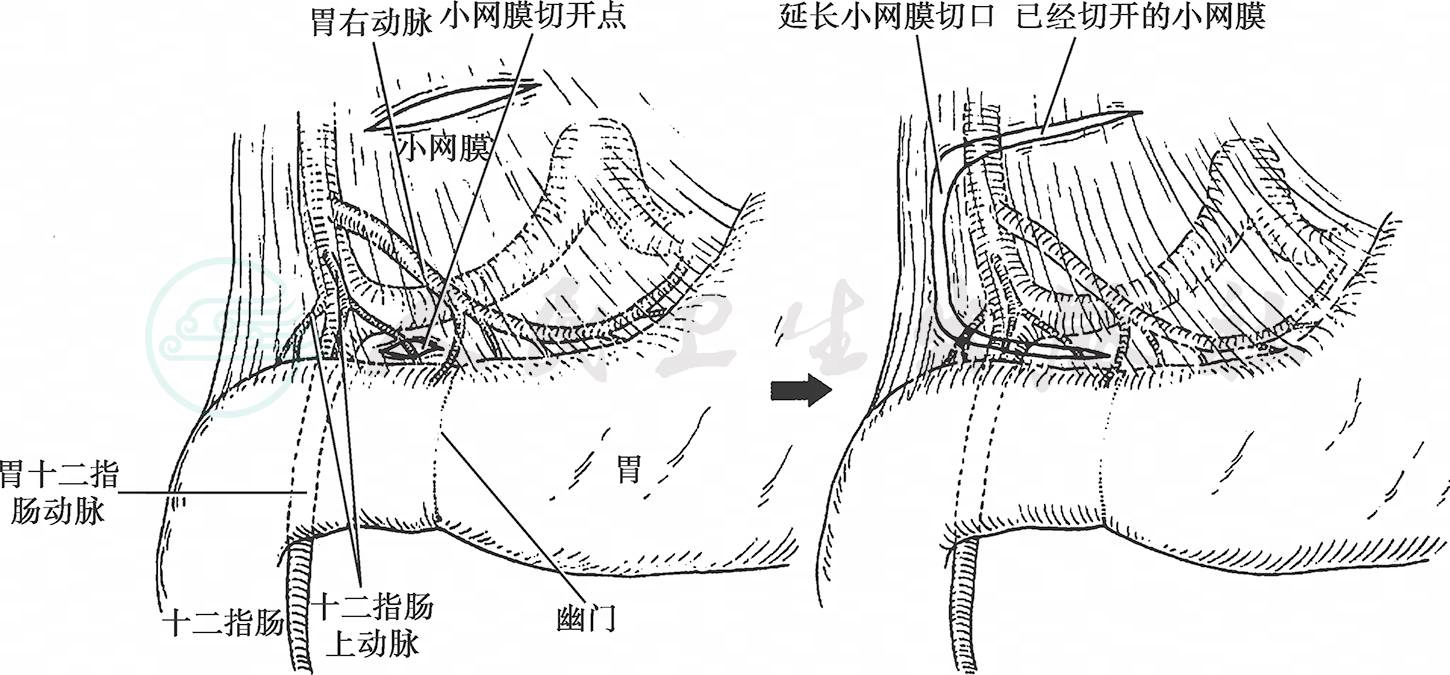
图7 幽门上操作
(4) 当幽门上下方的淋巴清扫完成后,胃下部及十二指肠已充分游离。根据肿瘤所处的位置、大体类型决定十二指肠的切除范围。在十二指肠预定切断线切断十二指肠。如行Billroth Ⅱ式吻合,则将十二指肠残端用钳闭器钳闭,并作浆肌层缝合包埋。
(5) 将切断的十二指肠及胃向上方翻转,向下轻压胰腺,展开胰腺上缘。沿肝总动脉向左解剖直至腹腔动脉根部,沿途结扎切断胃左静脉,清除肝总动脉上缘和前方的脂肪淋巴组织(图8)。
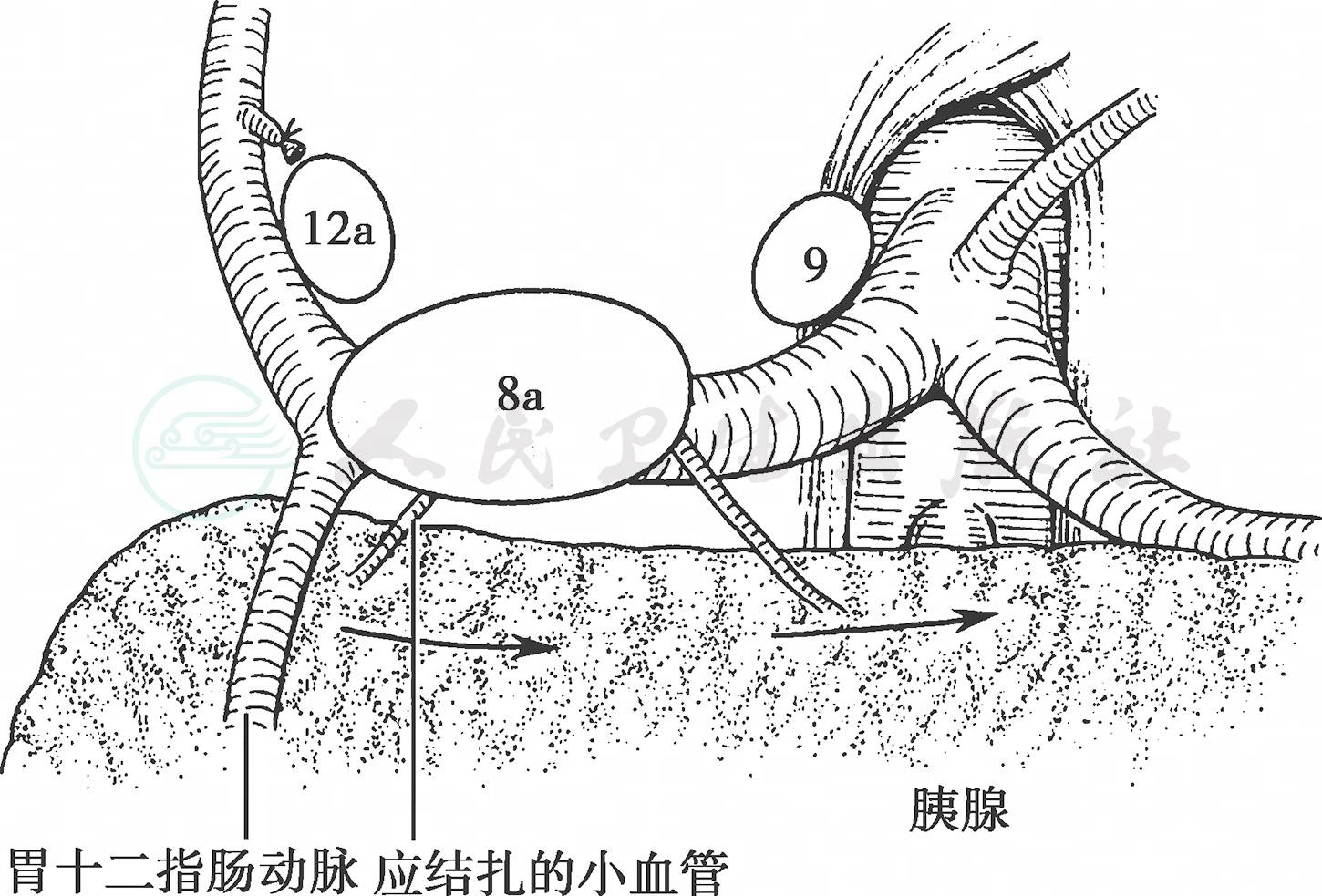
图8 清扫胰腺上缘No.8a淋巴结
其间胰腺实质中有1~2支小动脉分布到No.8a 淋巴结,要确实止血。沿着胰腺上缘向左剥离浅层筋膜,最后可以到达脾动脉隐藏到胰腺后面的部分,暂时停止剥离该部位胰腺上缘的浅筋膜层。切开小网膜,在右膈脚附着部之红黄相间处直至贲门水平,清除腹腔动脉右侧淋巴结。再次开始从胰腺上缘向胰体尾部剥离,这里也有许多小血管从胰腺实质走向No.11p 淋巴结,隐藏到胰腺后面弯曲走行的脾动脉将再次出现在胰腺上缘。弯曲的脾动脉上方有淋巴结连着腹腔动脉左侧淋巴结,应注意清扫(图9)。
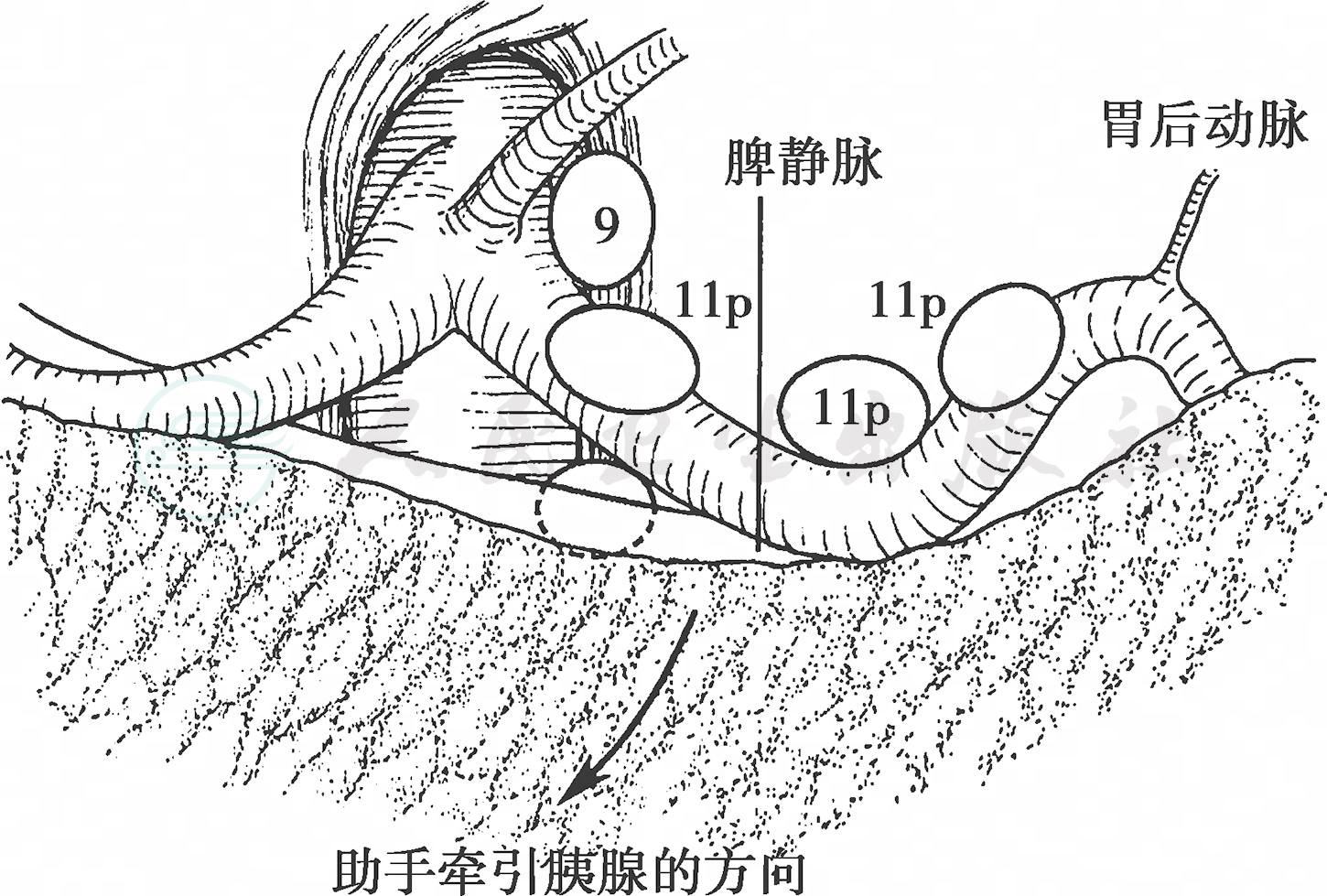
图9 清扫脾动脉近端淋巴结
从脾动脉中段发出胃后动脉,通常远端胃切除手术时可以保留。在肿瘤侵犯胃体中部后壁的情况下,需要清扫胃后动脉周围淋巴结。
通过以上手术步骤显露了胃左动脉根部。迷走神经后干发出的腹腔支神经束紧贴胃左动脉根部,与胃左动脉一起结扎、切断(图10)。于胃左动脉根部上方,沿膈肌脚表面向着食管裂孔方向游离胃体、胃小弯及胃后壁组织。
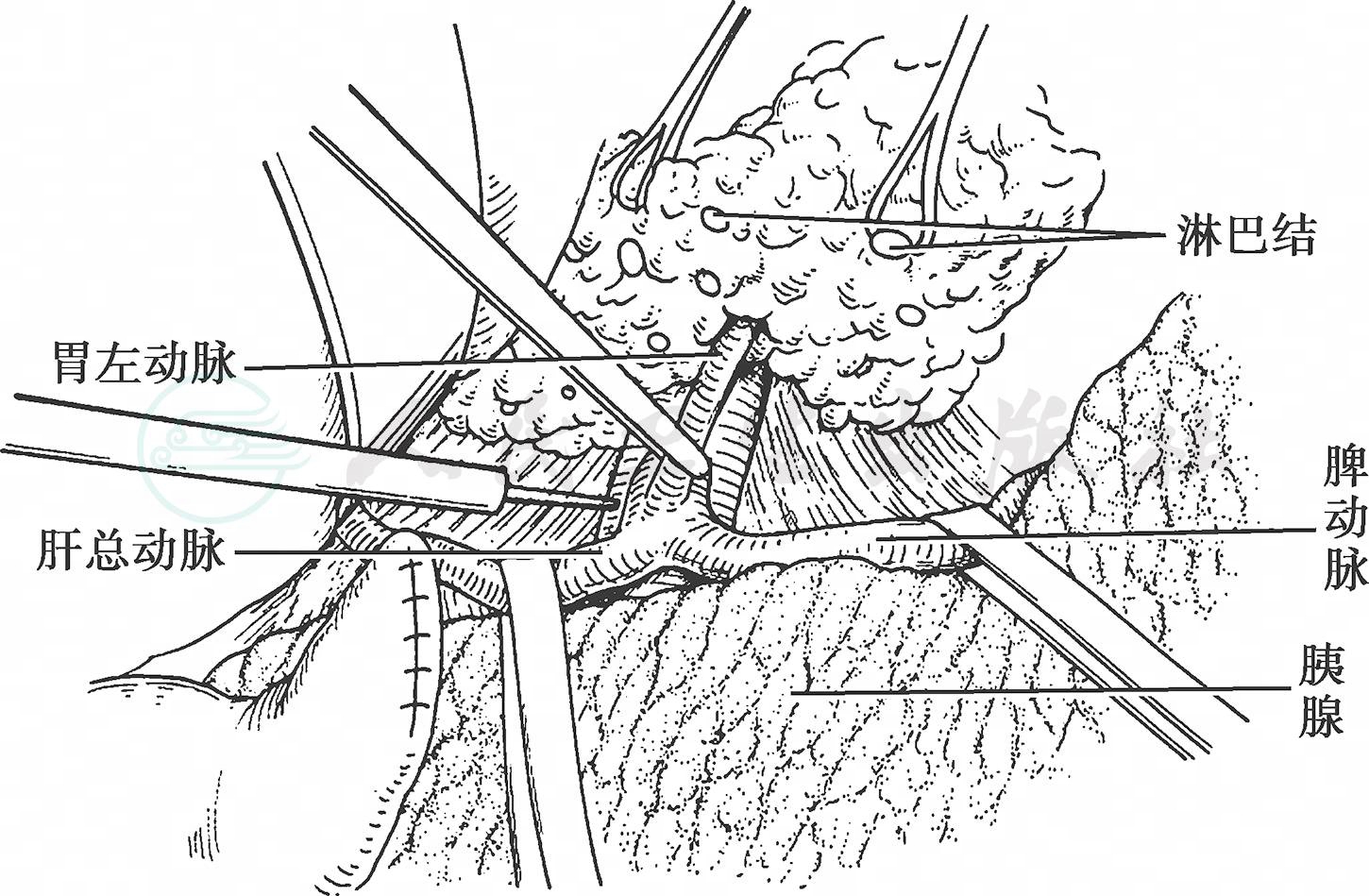
图10 显露胃左动脉
解剖肝固有动脉、肝总动脉、腹腔干、胃左动脉时不必将血管鞘打开将动脉骨骼化,保留血管鞘将之脉络化即可。如无明显肿大的淋巴结,动脉周围的神经组织及双侧腹腔神经节应予保留。
(6) 清扫No.1、No.3淋巴结:把胃放回原来的位置,并向下牵引,使胃上部小弯侧呈紧张状态。确定小弯侧胃的切断部位,从这里开始向贲门方向清除小网膜,清扫 No.1、No.3淋巴结(图47-106)。
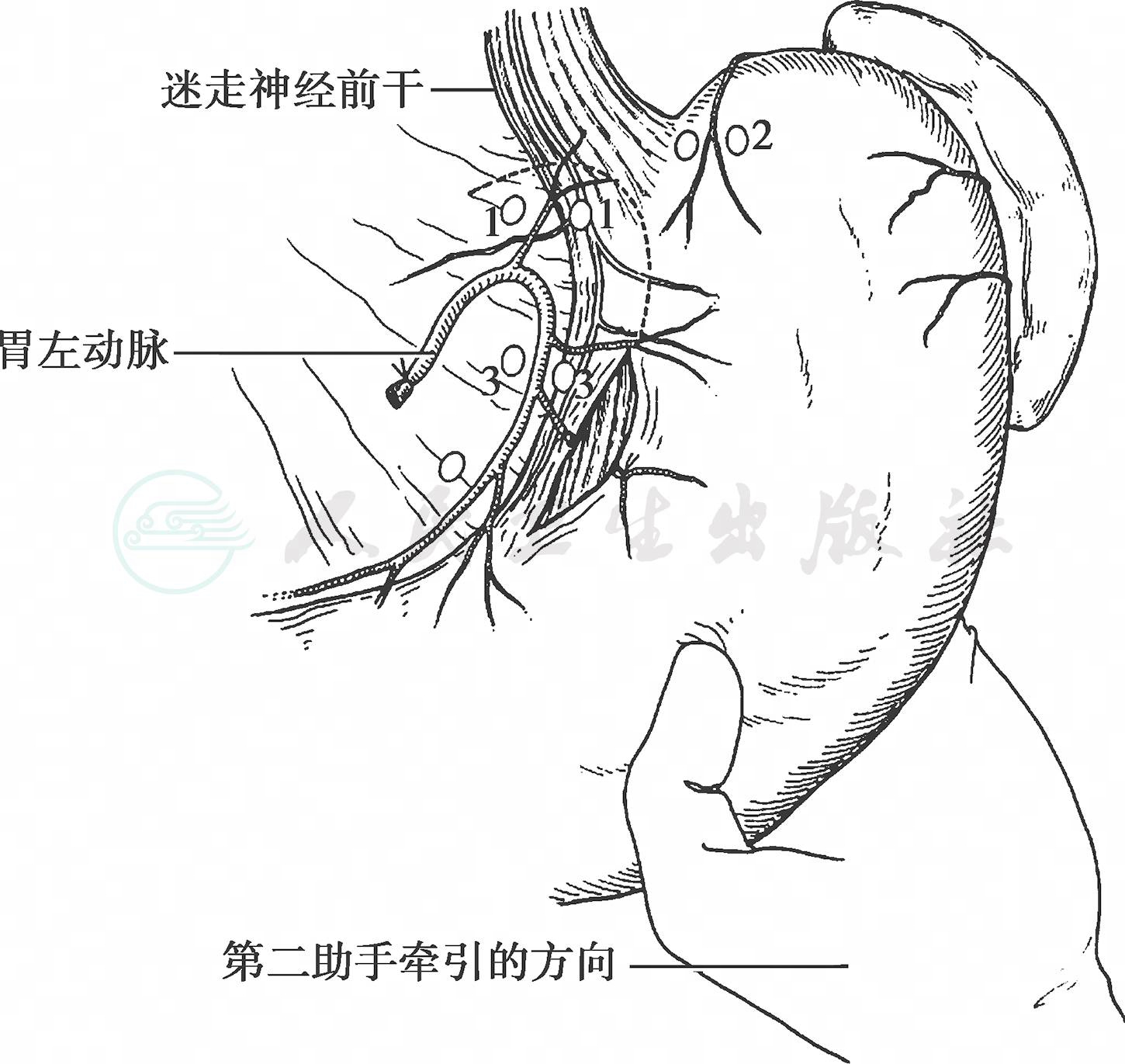
图47-106 处理胃小弯上部
(7) 切除胃:局限型胃癌距离肿瘤上缘3cm,浸润型距离5cm以上切断胃。小弯侧用钳闭器关闭,大弯侧留4~5cm与十二指肠或空肠吻合。对切下的标本应即刻进行检查,确认病变与切缘的距离。切缘有疑问时应行冷冻病理切片检查。
6.消化道重建
首选Billroth Ⅰ式吻合重建消化道,Billroth Ⅰ式吻合有张力或肿瘤下缘十分接近幽门十二指肠时,宜选择Roux-en-Y式或者Billroth Ⅱ式重建消化道。
7.冲洗、引流
以无菌温水冲洗腹腔,检查有无活动性出血。胃癌根治手术创面大、渗出多,尤其是术后胰液渗出在某种程度上不可避免,需常规放置引流管。引流管可选用粗乳胶管或者负压球,自右上腹经Winslow孔放至胰腺上缘。
1.手术适应证
按照第14版《日本胃癌处理规约》的约定,标准的根治性近端胃切除术D2淋巴结清扫范围应包括 No.1、No.2、No.3、No.4sa、No.4sb、No.7、No.8a、No.9、No.10和No.11。目前标准近端胃手术无论在日韩抑或在国内均极少采用,普遍采用淋巴结清扫范围不包括No.10、No.11d的近端胃切除术,该术式原则上仅适用于贲门、胃底和胃体上部的早期或者局限型胃癌。
2.游离与切除
原则上仍首选上腹部正中切口,切除剑突后多能提供良好的暴露。肿瘤累及食管下端时宜选择胸腹联合切口,此切口虽然创伤较大,但能提供更好的暴露,有利于食管下段的充分切除,减少食管下端癌残留的危险。
(1) 垫托脾脏并切断左三角韧带游离肝左叶,以利食管贲门区的显露。
(2) 处理大网膜和清扫胃网膜左动脉:贴近横结肠,打开胃结肠韧带,离断大网膜左侧半。于脾下极水平切开从胰腺被膜上向前凸起的网膜囊左侧壁的浆膜,在胰尾部找到胃网膜左动脉根部,结扎和切断。如果怀疑根部淋巴结有转移,需施行切除脾脏的近端胃切除术。
(3) 在脾门部位向上方延长胃网膜左动脉附近的胰腺包膜切开线,根部结扎、切断胃短血管。肥胖的患者,处理最上一支胃短动脉发生困难的情况下,可先处理胃小弯侧,切断胃以后再处理胃短动脉更为方便。手术操作困难的病例,则不要求根部结扎切断胃短血管(图12)。
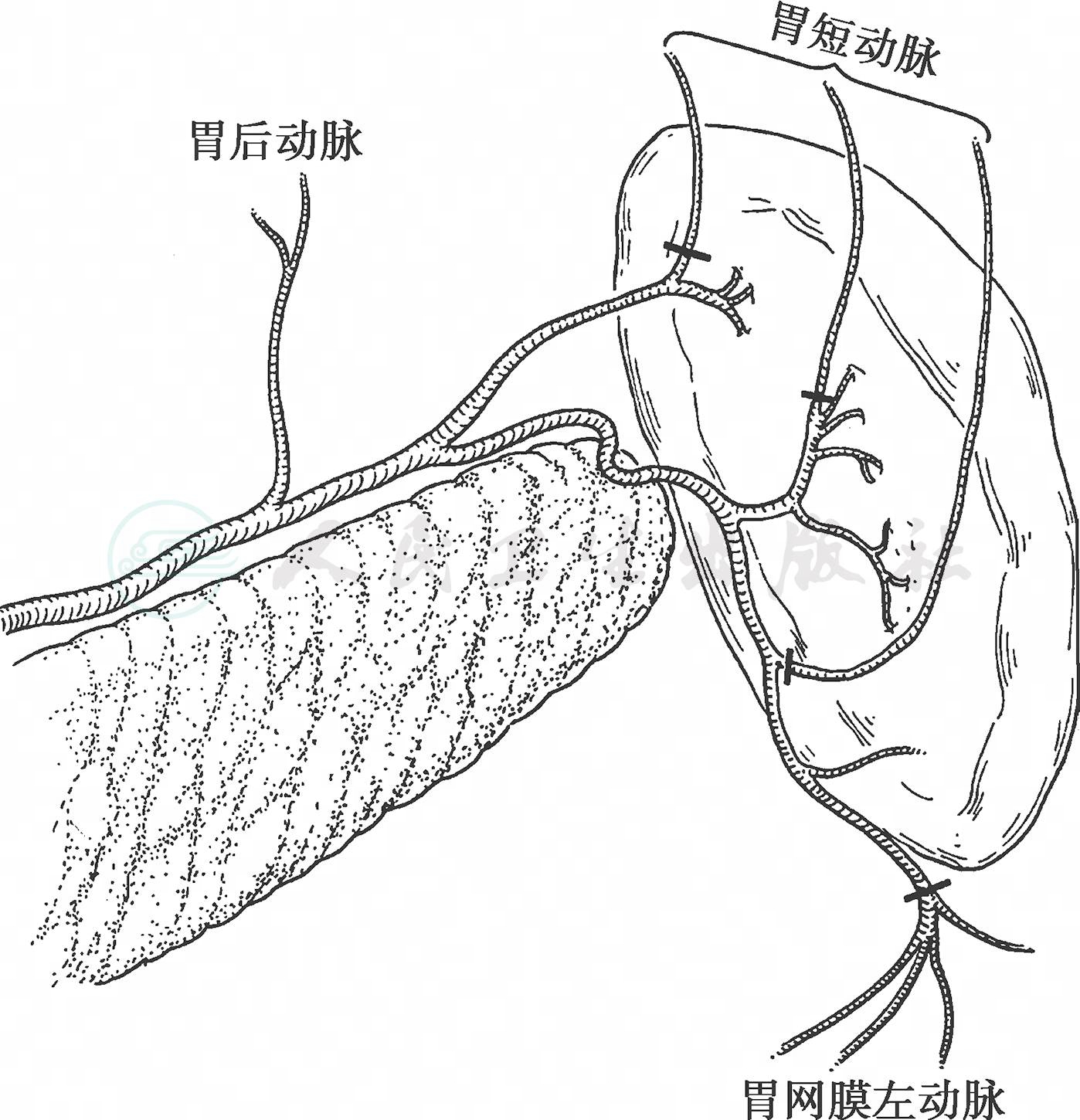
图12 胃短动脉根部结扎、切断
(4) 打开肝胃韧带,结扎副肝动脉,向左侧打开至膈肌脚。于肝十二指肠韧带左侧打开小网膜至胃小弯,紧靠胃壁由右向左处理胃右、胃左动脉进入胃壁的分支。
(5) 观察肿瘤的近侧端决定切断线,原则上残胃容量不应小于全胃的1/2,否则术后易致严重的胃食管反流。切断胃后把切断侧向上方翻转举起,开始沿着胰腺上缘清扫第二站淋巴结。淋巴结清扫范围的右侧缘为肝固有动脉根部,由右向左依次清扫No.8a、No.9、No.11p、No.11d淋巴结,脾门附近清扫范围仅限于血管前面淋巴结。清扫过程中结扎胃左静脉、胃后血管,显露出胃左动脉主干根部,结扎、切断胃左动脉。从胃左动脉上方剥离后腹膜以及膈肌脚表面的淋巴脂肪组织,充分游离胃小弯以及胃体后壁。
(6) 清扫贲门左侧淋巴结:从脾上极开始向食管裂孔方向显露左侧膈肌脚,确认左膈下动静脉,多数情况下发出食管贲门支分布到贲门左侧,根部结扎、切断食管贲门支,清扫No.2淋巴结(图13)。
(7) 充分游离食管,通常应在贲门上4~5cm处切断食管。
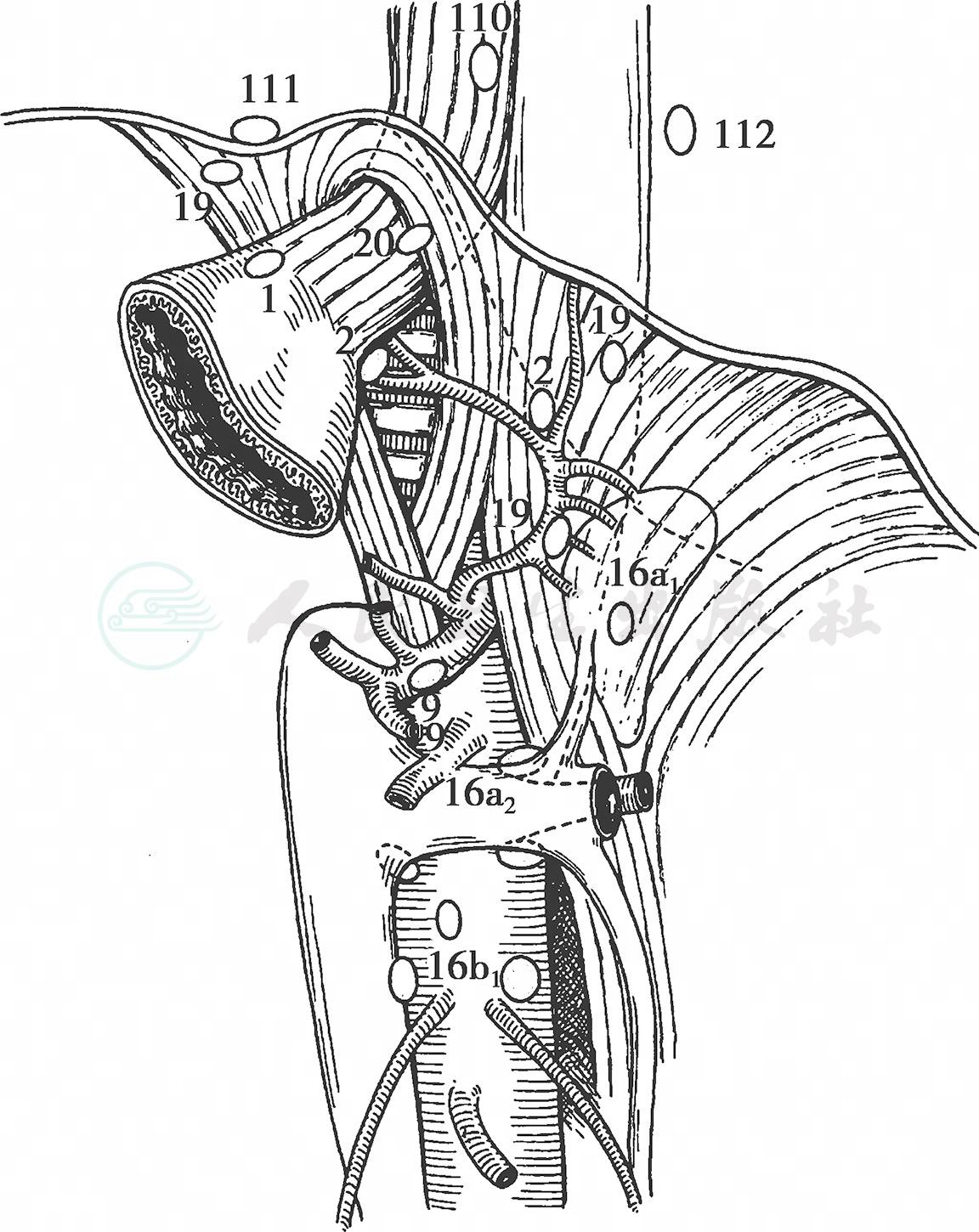
图13 左膈下动脉的解剖与No.2淋巴结
3.消化道重建
以25mm的管状吻合器作食管胃端-侧吻合,为防止胃食管反流可在食管与残胃之间间置一段长约10cm的顺蠕动空肠(图14、图15)。
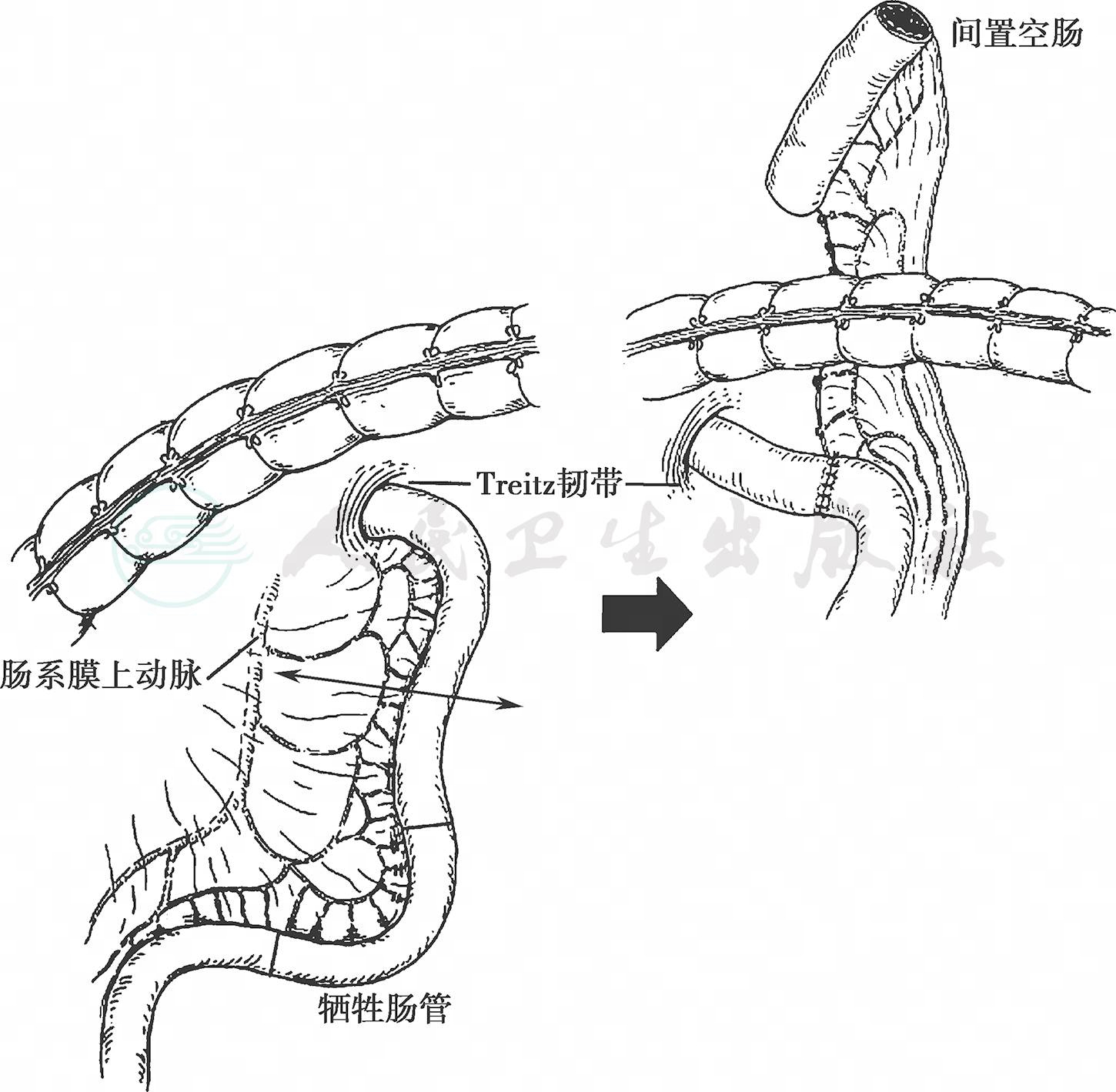
图14 牺牲一段肠管,保持血运有蒂的间置空肠
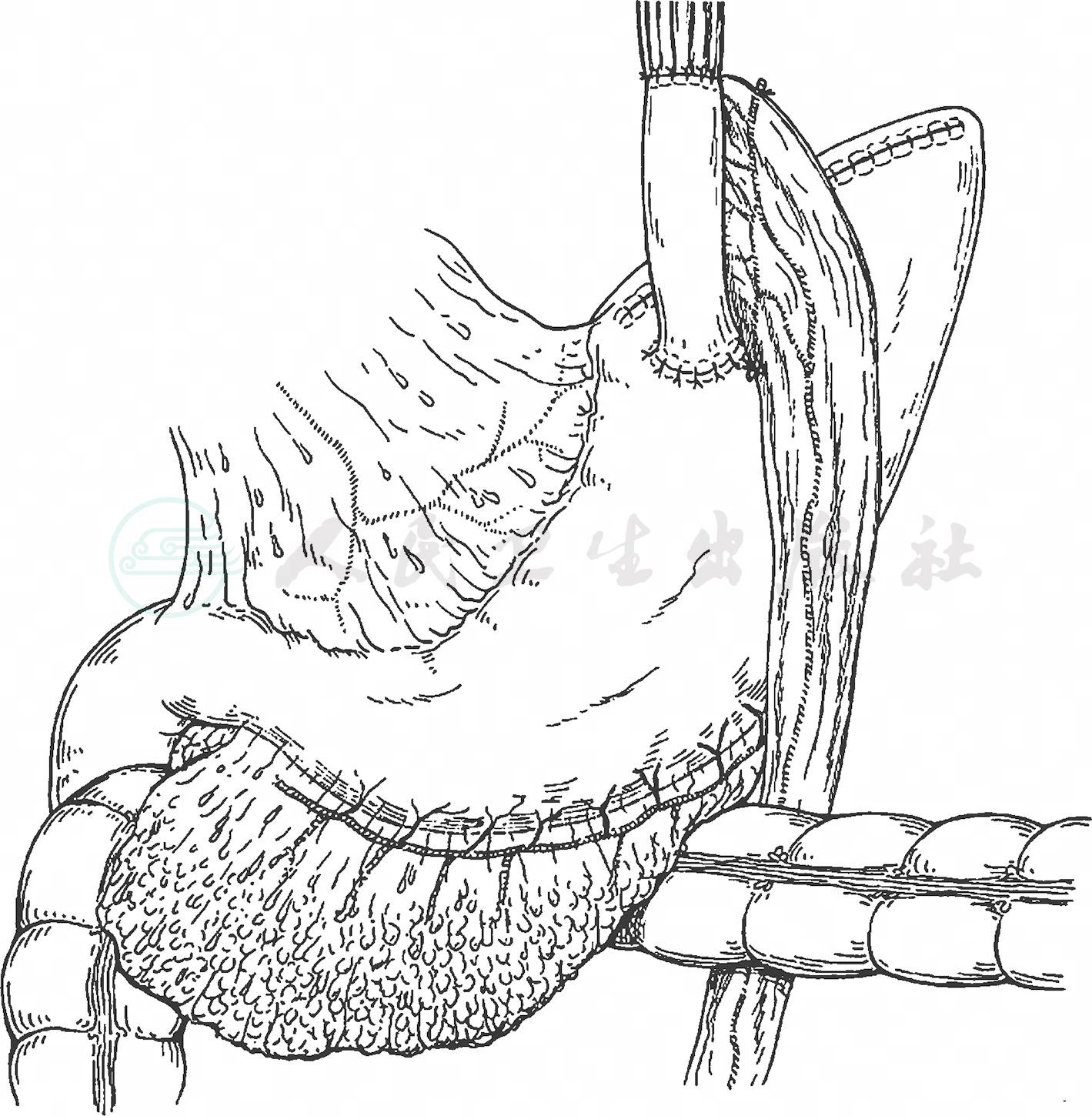
图15 完成重建
4.引流
同全胃切除术。
1.手术适应证 对于不符合上述胃大部切除适应证的U区、M区、UM区、LM区进展期癌、全胃癌、弥漫浸润型癌、多中心癌、残胃癌以及L区癌伴贲门区淋巴结转移者,宜选择全胃切除术。标准的D2全胃根治术要求彻底清扫No.1~No.7、No.8a、No.9、No.10、No.11p、No.11d和No.12a淋巴结。另外,对于食管浸润癌,D2清扫包括No.19、No.20、No.110和No.111淋巴结。
2.体位、切口、探查及切除前准备一般与根治性胃次全切除相同。对于贲门癌伴食管下段浸润者可考虑行左胸腹联合切口。切断左肝三角韧带,将肝左叶向右侧折叠、牵开,能够完全显露贲门及食管下段。
3.游离与切除
(1) 游离、翻转胰腺和脾脏:游离结肠脾曲,从横结肠的左侧开始剥离大网膜以便进入胰腺后方。把胰腺充分向上方翻转以后,轻轻托住脾脏,助手将左侧肾脏向下方牵引,切开脾脏外层腹膜,沿Toldt筋膜表面翻转胰腺和脾脏。于脾静脉深面剥离进入正确的解剖层次,可以不出血完成操作。在翻转过程中可以确认胰腺周围有无浸润、转移,以决定保留或切除胰腺。向上进一步显露后腹膜,确认左膈下动脉食管贲门支,在其根部结扎、切断(图16)。
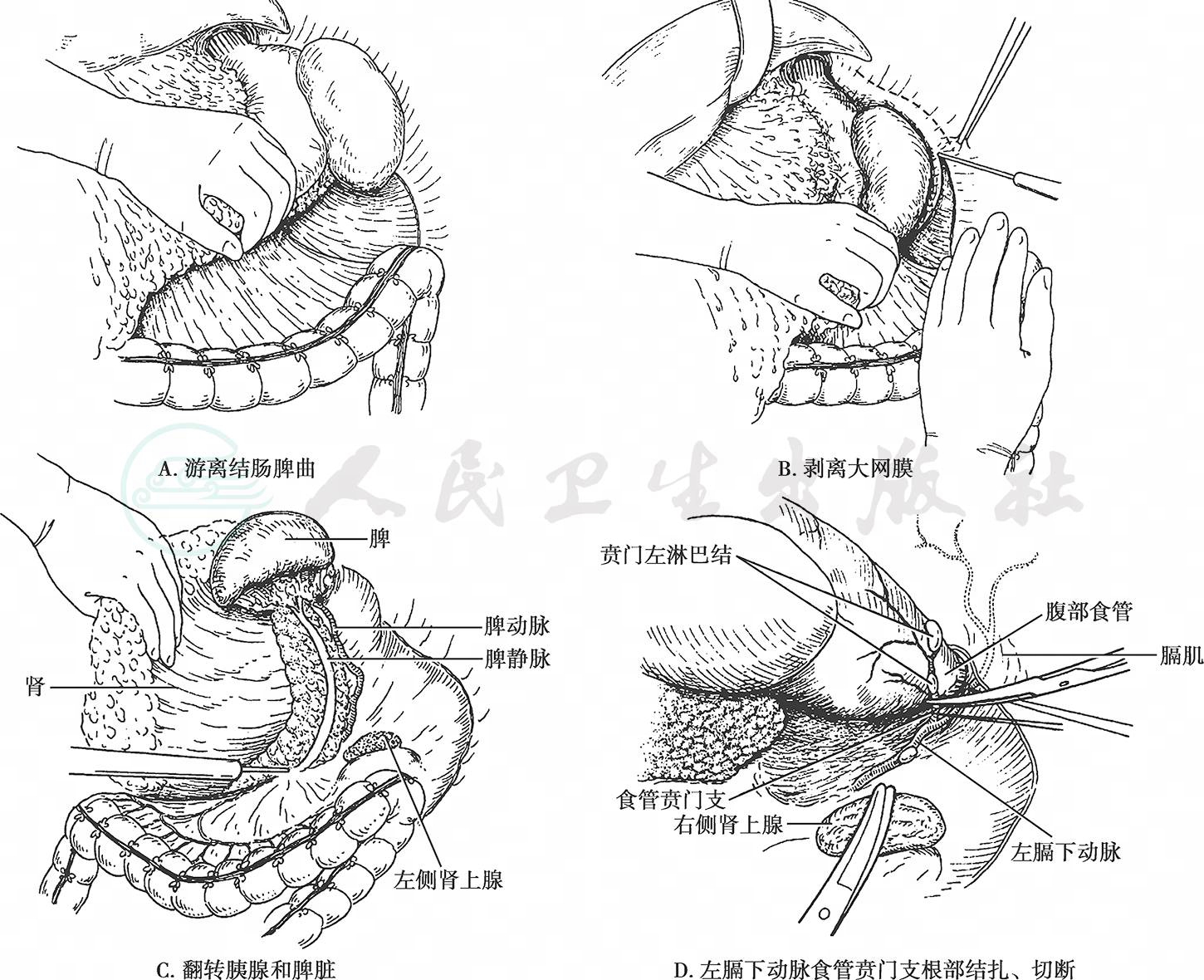
图16 翻转脾脏及胰腺体尾部
(2) 胃大弯侧游离及淋巴结清扫:切除大网膜、横结肠系膜前叶、胰包膜及处理胃网膜右动静脉同远端胃切除手术。剥除横结肠系膜前叶时,由左右两侧开始向中间操作较为方便。从胃十二指肠动脉左侧开始剥除胰腺包膜,先向胰头部,再向胰体尾部循序渐进,小心、仔细地完成整个胰腺包膜的剥除。操作中要做到既要完整切除,又不可伤及胰腺,胰腺上缘的剥离越过肝总动脉、脾动脉以后,胰腺上缘的清扫变得容易。若非肿瘤巨大累及L区,无需清扫No.14v淋巴结。
(3) 紧贴肝脏下缘切断肝胃韧带,右侧比较薄的部分可以直接切开,左侧白色腱状部分的右侧缘通常有副肝动脉,需要结扎切断。切开小网膜可达膈肌脚。随后切开肝十二指肠韧带前叶,显露胃右动脉和胃十二指肠动脉。根部结扎、切断胃右动、静脉,清除No.5淋巴结。同时清扫肝固有动脉左侧的No.12a淋巴结。
(4) 切断十二指肠,将十二指肠残端用钳闭器钳闭后再作浆肌层缝合包埋。
(5) 把胃向上翻起,沿肝总动脉自右向左分离其前方和上缘的淋巴脂肪组织,解剖显露胃左静脉,并于根部结扎、切断。解剖腹腔动脉及其分支,在根部结扎、切断胃左动脉,并切除腹腔干周围之脂肪淋巴组织,清除No.7、No.8a、No.9淋巴结。于胃左动脉根部向左清扫胰腺上缘近段脾动脉前方的No.11p淋巴结,直至胃后动脉从脾动脉发出,根部切断胃后动静脉。
(6) 沿膈肌脚表面向着食管裂孔方向游离胃体、胃小弯及胃后壁组织。打开食管前方的腹膜,分别切断迷走神经前后干,游离食管周围。于预定食管切断线处上荷包钳,穿荷包线,然后在近胃侧上直角钳,两者之间切断食管。如对食管切缘状况有疑问,需要行术中快速病理学诊断(图17)。
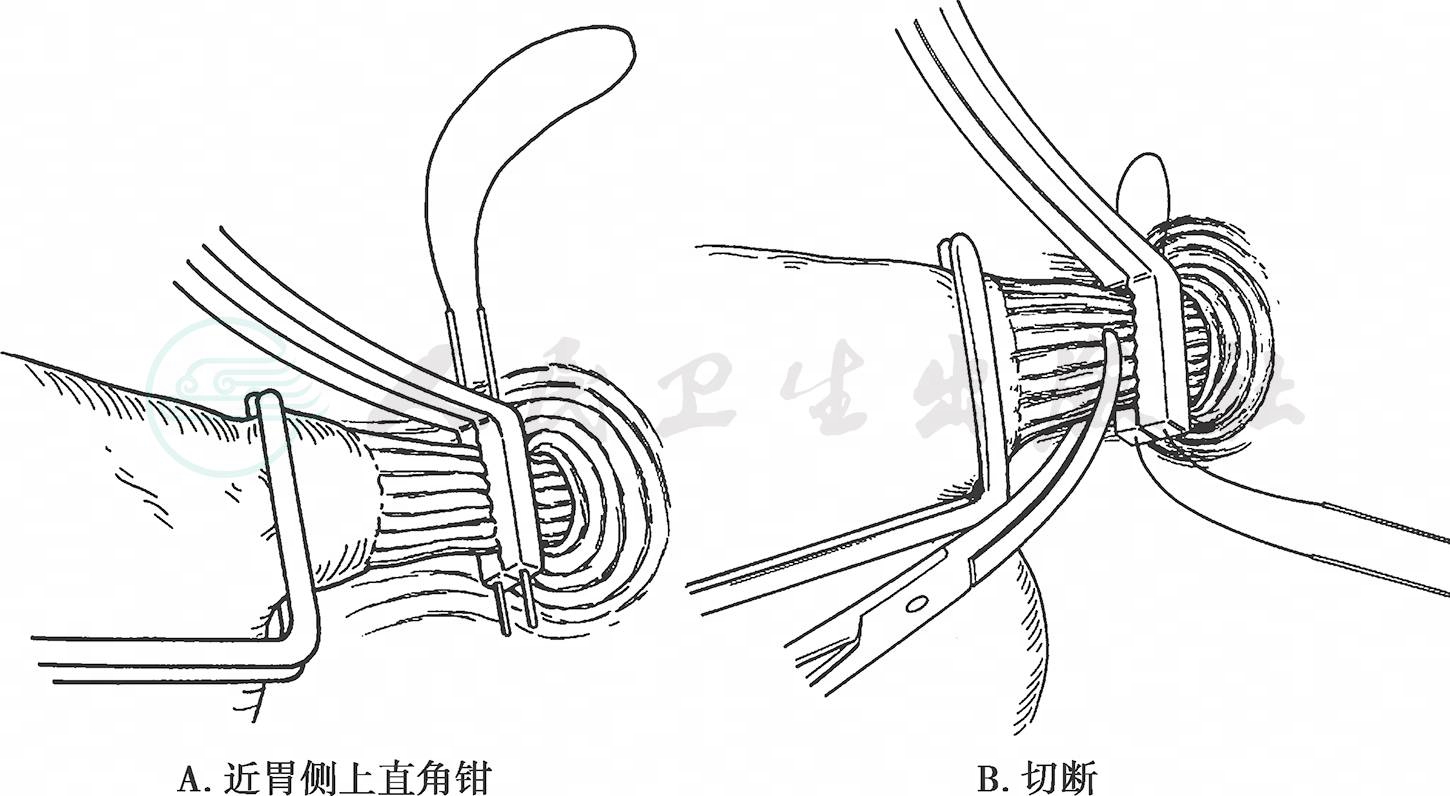
图17 切断食管
(7) 清扫 No.11d、No.10 淋巴结:将胃连同脾、胰体尾一同托出腹腔外。这样操作显露佳,清扫更加方便。首先游离并阻断近端脾动脉,用塑料带结扎一道,既阻断了脾动脉的动脉血流,又不至于损伤动脉内膜引起血栓形成。再打开脾胃韧带,处理胃短血管,显露脾门。沿脾动脉清扫胃后动脉左侧No.11d淋巴结。清扫No.10淋巴结时,通常先进行血管背侧的清扫再进行腹侧的清扫。由远心端向近心端打开脾静脉表面的被膜,显露脾静脉,向胰腺上缘剥除淋巴脂肪组织。贴近脾脏切开脾门前淋巴脂肪组织,显露脾动、静脉进出脾门的分支,循血管分支找到动静脉主干,仔细清扫脾门部的淋巴脂肪组织。清扫脾门淋巴结对于医生和患者均有一定要求。医生必须熟悉脾门的解剖,脾动脉在脾门附近分出终末支,在脾外以二支最为常见(脾上叶和下叶动脉),也有一支或者三支型。脾静脉与动脉伴行。过于肥胖的患者不适合该种术式,由于脾门脂肪组织过多,血管深埋其中,清扫淋巴结时非常容易损伤血管,最后不得不再切除脾脏。
(8) 完成清扫将脾胰体尾放回腹腔后,将脾脏与侧腹壁固定2针可避免脾扭转梗死。如无法固定时可让患者术后保持左侧卧位,避免下床活动,一周后脾脏即与腹壁形成粘连。
4.消化道重建 全胃切除术后理想的消化道重建方式应满足以下要求:①重建消化道接近正常生理通道,以保持胃肠道神经内分泌的稳态;②代胃能有较好的储存功能,以避免无胃状态下食糜排空过快;③最大限度地减少碱性反流性食管炎等术后并发症的发生;④手术操作简便,容易推广。已有的60多种全胃切除术后消化道重建方式,没有一种手术能很好满足上述要求。目前以经典的Roux-en-Y食管空肠吻合(R-Y吻合)和间置空肠代胃术最为常用。R-Y吻合的优点是手术简便,术后反流性食管炎发生率低。缺点是旷置了十二指肠,术后生理改变较大,同时代胃的单腔空肠容量小,食后易饱胀且排空较快,不利于消化吸收。间置空肠代胃术的优点是保留了十二指肠通道,术后食物仍流经十二指肠,使食糜与胆汁、胰液充分混合,较符合生理,有利于食物的消化和吸收,且反流性食管炎发生的机会少。缺点是手术操作较复杂,代胃空肠容量较小。传统的食管空肠襻式吻合术常伴有严重的反流性食管炎,原则上不宜采用。
(1) 食管空肠Roux-en-Y型吻合术:此法最为常用。通常采用结肠后途径吻合,如果横结肠系膜附近有局部复发可能,可选用横结肠前途径上提空肠。距Treitz带约15~20cm处理空肠系膜,切断边缘血管,上两把Koch钳切断空肠。切开结肠中动脉左侧横结肠系膜无血管区,上提远端空肠,从空肠断端置入管型吻合器,进行食管空肠端-侧吻合。采用食管空肠端-侧吻合,吻合口血液循环较好,对减少术后吻合口漏和狭窄的发生均较对端吻合为佳。空肠断端用钳闭器闭合,注意盲襻不要过长。由于该部位承受压力较大,要用3-0线加固缝合。再将近端空肠与远侧段作端-侧吻合,两吻合口间的距离不应少于45cm,以防肠液反流(图18、图19)
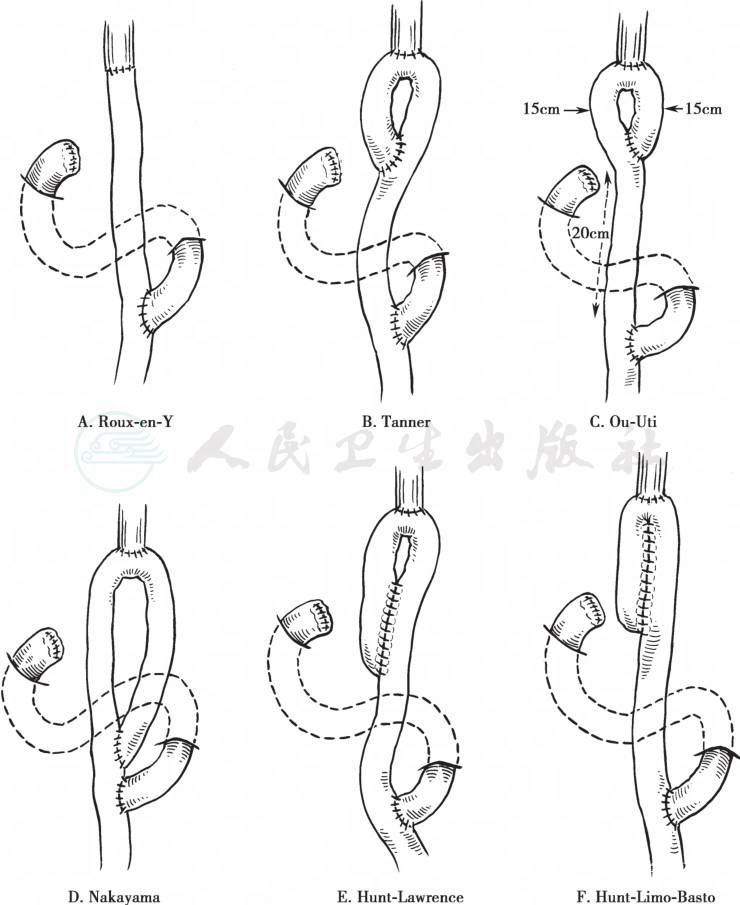
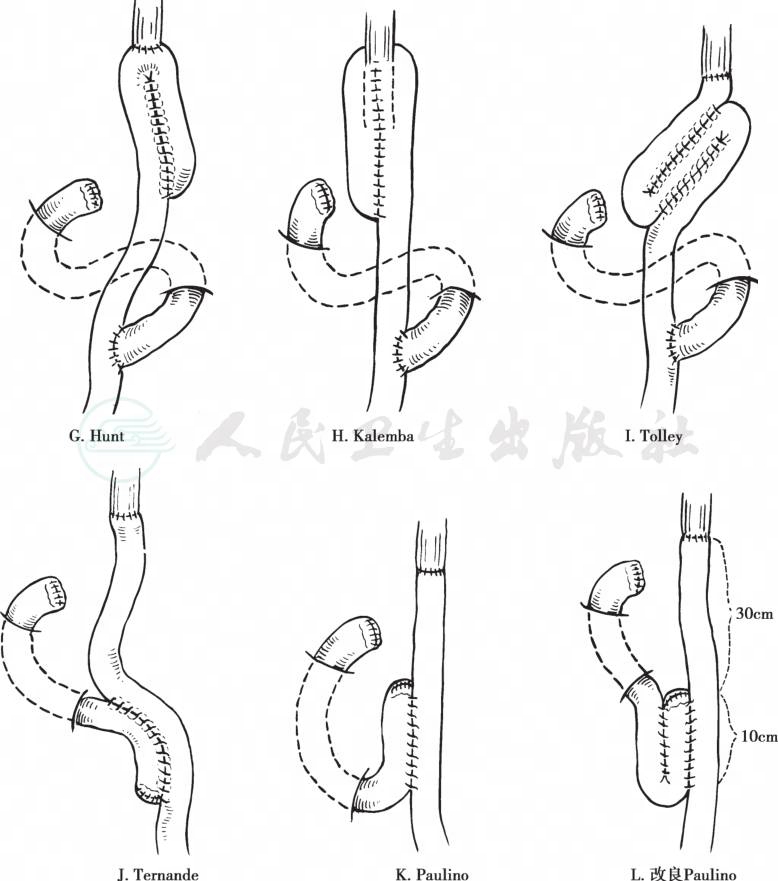
图18 各种改良的Y形食管空肠吻合术
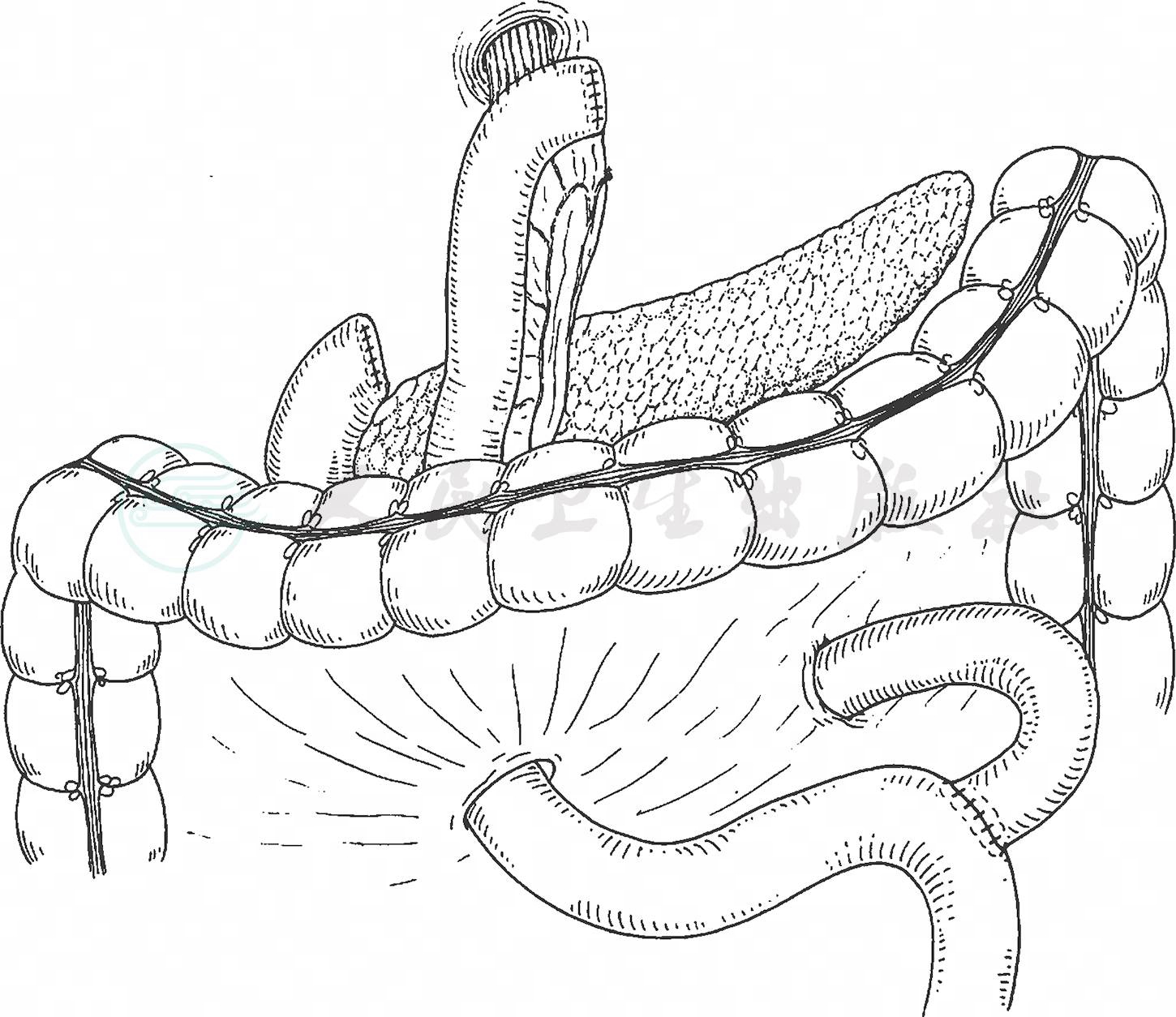
图19 Y形食管空肠吻合加空肠十二指肠吻合
(2) 空肠代胃术:距十二指肠悬韧带15~20cm处,根据空肠系膜的长度和血管走行,选用一种方式处理空肠系膜血管,游离切断一段长约25~40cm的空肠,经横结肠后方上提,顺蠕动方向进行食管肠道的重建。与Roux-en-Y重建方式相同,用25mm管状吻合器进行食管空肠端-侧吻合。手工完成游离空肠远端与十二指肠对端吻合,再将被切断的空肠远、近端做对端吻合(图20)。
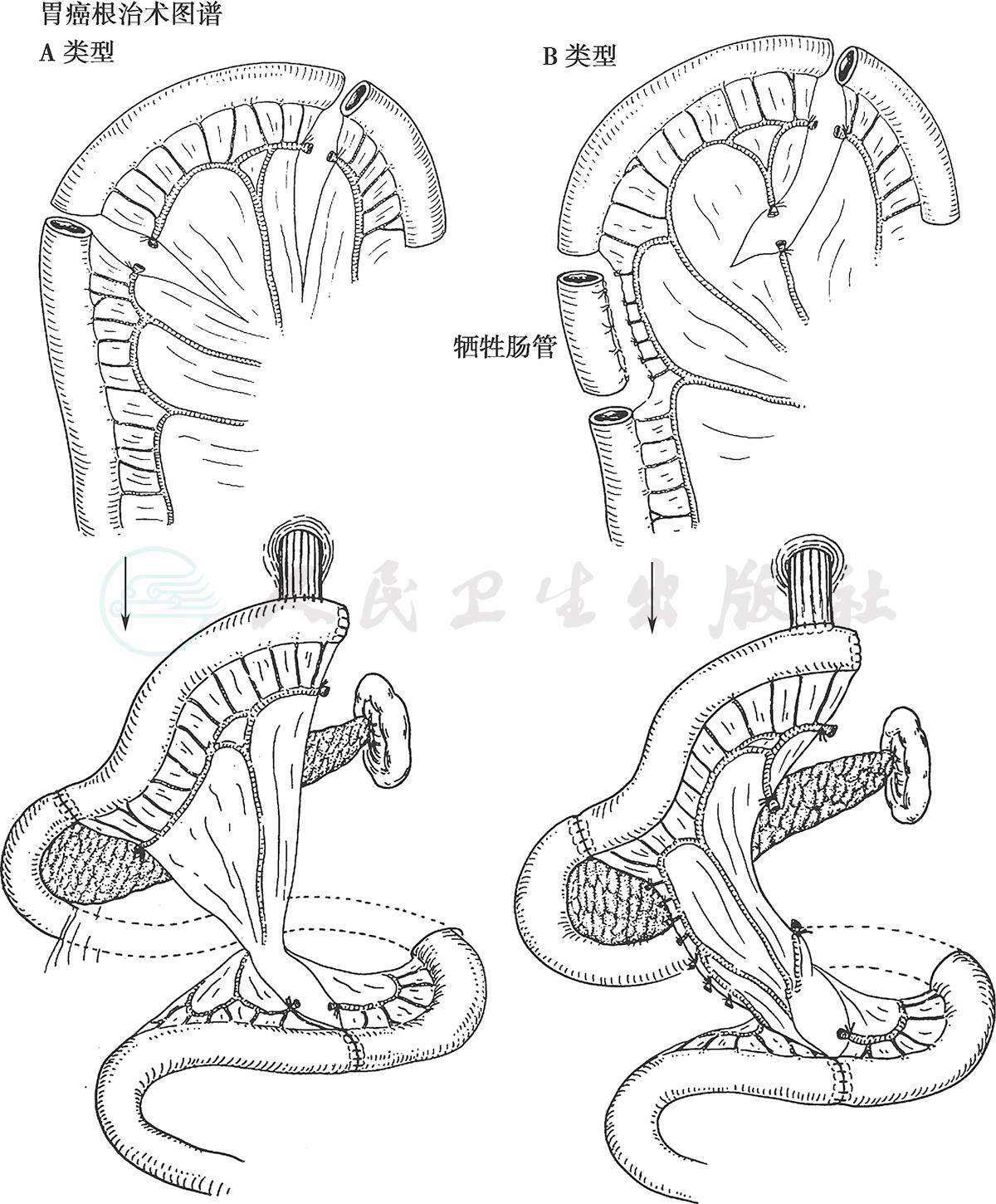
图20 各种空肠代胃术
5.冲洗、引流 以无菌温水冲洗腹腔,检查有无活动性出血。通常放置两根引流管,右上腹引流管经Winslow孔放至胰腺上缘,左上腹引流管置于左膈下吻合口附近。缝合切口。若取胸腹联合切口应放置胸腔引流。
1.手术原则
尽管手术切除为治疗胃癌的主要手段,但是随着胃癌治疗模式的转变以及对生活质量的追求,胃癌的所有治疗措施包括手术必须建立在对全身状况以及病灶充分评估的基础上,遵循因期施治的原则:①早期胃癌按照指征可以行内镜治疗或者缩小手术,既可保证治疗效果,又能提高生活质量;②病灶可根治性切除时,手术在根治的基础上力求标准。无视高级别循证医学证据,盲目地缩小或者扩大手术范围都不足取;③有不能根治切除因素且不存在梗阻、出血和穿孔时,仅仅切除原发灶除个别病例以外目前尚无证据证明能够延长患者生命或者提高生活的质量,在新的证据出现以前不应积极采用。
2.切除范围
切缘无肿瘤残余是胃癌根治术的基本要求。切缘是否有癌累及与患者的预后密切相关,切缘阳性意味着更差的预后。无论采用何种手术方式,都应以保证上下切缘无肿瘤残留为首要原则。有研究显示,胃癌术后吻合口复发患者上切缘距肿瘤平均3.5cm,无吻合口复发者为6.5cm。因此胃癌根治术中切缘通常应距肿瘤边缘5~6cm以上。然而肿瘤沿胃壁浸润的距离与肿瘤部位、病理类型以及生物学行为有关。幽门对胃癌的扩展可能具有屏障作用,因此幽门下3cm切断十二指肠通常能保证下切缘阴性,若肿瘤浸润或突破幽门,则应切除十二指肠4~5cm;BorrmannⅠ、Ⅱ型癌沿胃壁的浸润多较局限,通常上切缘距肿瘤边缘4~5cm即可;而BorrmannⅢ、Ⅳ型癌、印戒细胞癌、未分化癌上切缘距肿瘤边缘应在6~8cm以上;伴食管浸润的贲门癌食管切缘应距肿瘤边缘6cm以上。
胃切除的范围原则上应按肿瘤的部位、生物学特性以及需要清扫的淋巴结的范围而定。肿瘤位于胃窦部时,施行根治性全胃切除或根治性胃大部切除术后生存率无显著性差异。源自欧洲的两项多中心、前瞻性、随机对照研究证明了这个观点。意大利的Bozzetti等将618名胃窦癌患者随机分组,315名接受胃大部切除术,303名接受全胃切除术,5年生存率分别为65%和62%。两组的差别仅在于胃大部切除组的切缘阳性率稍高于全胃切除组。与全胃切除相比,远端胃大部切除不仅相对安全,且通常具有更好的术后营养状况及生活质量。因此在保证上切缘阴性的前提下,L区癌更适合行远端胃大部切除。对于U区癌以及食管胃结合部癌行全胃切除或者近端胃大部切除术的争论不断,现有的大型回顾性研究并未发现全胃或近端胃切除对胃底贲门癌预后存在影响。但韩国Kim的前瞻性研究发现虽然早期病例行全胃切除和近端胃切除术后5年生存率无显著差别,但是Ⅲ、Ⅳ期病例选择近端胃大部切除会影响术后生存率。U区癌以及食管胃结合部癌行全胃切除抑或近端胃大部切除还需根据残胃大小进行选择,近端胃切除后至少要保留远端1/3~1/2胃,才能保证残胃的功能。当残余胃不足时,单纯胃食管吻合会带来碱性反流性食管炎等不利影响,严重者明显影响生活质量。因此U区癌以及食管胃结合部癌原则上选择全胃切除术,早期病变选择近端胃大部切除时保留1/3以上胃,将10~15cm空肠间置于食管胃之间可以有效减少胃食管反流。对于进展期癌,凡施行远端胃大部切除上切缘距离不能达到所要求的5cm时,需行全胃切除术。肿瘤浸润范围达两个分区以上,有胃周围远隔淋巴结转移者,如贲门癌幽门上淋巴结转移,胃窦癌贲门旁淋巴结转移均为全胃切除之指征。
3.淋巴结清除范围
胃壁有极丰富的淋巴网,淋巴循环是癌细胞栓子最主要的转移途径。一般根据胃癌发生的部位,沿所属淋巴引流区域转移至胃周围的淋巴结。但也不完全取决于癌肿的部位,如幽门窦部癌易向幽门下、肝动脉及胃左动脉附近的淋巴结转移,但也可转移至贲门旁及脾动脉周围淋巴结;胃底贲门癌易向贲门旁、胃左动脉及脾动脉周围的淋巴结转移,但也可转移至幽门窦附近的淋巴结。所有胃的淋巴引流均汇集在腹腔动脉周围淋巴结,因此,一般认为腹腔动脉周围淋巴结的转移是胃癌晚期的表现。胃周围淋巴结转移的程度随肿瘤增大和癌浸润的深度而递增,早期胃癌(限于黏膜和黏膜下层)的淋巴结转移率为7%~20%,而中晚期则为75%~80%。彻底清除转移淋巴结是提高生存率的关键。
有关进展期胃癌根治术中广泛淋巴结清扫的价值,东西方国家的观点分歧明显。早在1981年日本学者Kodama发表了D2手术生存优于D1手术的报道,这一结论受到众多日本学者的支持。大样本的回顾性研究也表明,根治性淋巴结清扫有助于提高进展期胃癌的无病生存率和总生存率,治愈率高达50%~60%。目前在日本D2手术作为胃癌根治性切除的标准术式已广为接受。然而日本关于D2手术优于D1手术的结论完全建立在回顾性研究基础之上,研究结果不可避免地受分期偏倚的影响。从循证医学的角度来看,日本研究的证据强度显然不足,因而备受西方学者的质疑。
在西方国家,比较D1、D2手术的一些小型前瞻性研究并不支持D2手术优于D1手术的观点,研究病例数较少,加之参与研究的外科医生D2手术经验相对不足影响了这些研究的可信度。为此在英国和荷兰开展了两项大型多中心前瞻性临床对照研究,比较D2和D1手术的效果。两项研究均显示,D2手术组术后并发症率、手术死亡率显著高于D1手术组,而术后5年生存率无显著差异(表1)。由于荷兰和英国的研究都存在以下两个缺陷:①参与研究的外科医生缺乏足够的D2手术经验;②D2手术的死亡率过高影响了结果的判断。考虑到以上因素,这两项研究也不足以作出D1、D2手术孰优孰劣的结论。随着随访资料的不断积累,当平均随访时间超过15年时,荷兰研究发现D2组术后局部复发率以及胃癌相关死亡率显著低于D1组。
表1 欧洲两项比较D1和D2手术的前瞻性随机对照临床试验结果
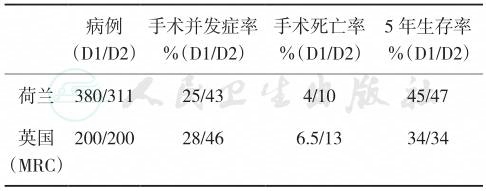
| 病例 (D1/D2) 手术并发症率 %(D1/D2) 手术死亡率 %(D1/D2) 5年生存率 %(D1/D2) |
| 荷兰 380/311 25/43 4/10 45/47 英国 (MRC) 200/200 28/46 6.5/13 34/34 |
虽然目前尚无有力的证据结束争论,目前比较一致的观点认为,东西方之间存在的人种、体态与技术差异影响了治疗结果。在有经验的中心,D2手术的死亡率为3.9%,总5年生存率为57.3%,T3期的5年生存率为35.3%;而在非专业中心即使是D1手术也有较高的手术死亡率和较低的生存率。 随着手术方式的改进,保留脾胰的根治手术成为主流以及围术期处理的进步、D2手术的进一步推广,使手术并发症和死亡率将会明显下降,来自中国、日本和韩国的经验均证明了这一点。根据日本全国性的调查,75%的患者接受D2或D3手术,手术死亡率低于1%。欧洲有经验的中心,D2手术死亡率也接近日本水平。意大利进行的多中心临床研究中D2的手术死亡率甚至是0。D2淋巴结清扫作为进展期胃癌根治手术的标准术式目前已趋向共识,并已经写入了2011版的NCCN胃癌治疗指南之中。有关D2以上淋巴结清扫(D2+和D3)的价值争议已久。日本JCOG9501研究证实,对于有经验的专家包括16组淋巴结清扫在内的扩大根治术是安全的,但与标准D2术相比,D2+和D3术并不能进一步提高进展期胃癌的生存率。因此,对于进展期胃癌不再推荐预防性清扫腹主动脉旁淋巴结。
对于上部进展期胃癌,为了达到日本胃癌治疗指南所规定的D2清扫要求,必须清扫No10、No.11d淋巴结。尽管可以采用游离脾、胰体尾并托出腹腔外进行清扫的方式,事实上保留胰脾并彻底清扫No10、No.11d淋巴结是相当困难的,通常需要联合脾切除。一直存在是否有必要为了完全清扫No.10、No.11d淋巴结而行脾联合切除的争论。目前JCOG0110试验正在对其进行探索,尚未有最后的研究结论。我国专家目前达成的共识是:脾或胰脾切除不应作为根治性手术的常规实施,对于肉眼可见脾门淋巴结转移或者胃上部大弯侧的进展期胃癌最好行切除脾的完全清扫术。
4.全胃切除术后消化道重建术式的选择
全胃切除后理想的消化道重建应达到以下要求:①保持食物从十二指肠通过;②代胃袋有储存作用和有较好的消化吸收功能;③较少或不发生无胃综合征;④保持较好营养状况和生活质量;⑤手术安全、简便、手术死亡率低。消化道重建术式有数十种之多,且仍在不断增加。学者们常引用不同资料来证实自己术式的优越性,然而迄今为止尚无一种术式能满足上述全部要求,Roux-en-Y重建仍为最常用术式。各种襻式吻合的缺点太多,一般不宜采用。现仅就以下两个核心问题进行讨论:①是否必须行贮袋重建;②有无必要保持十二指肠通道连续性。
研究表明,与经典的R-Y吻合相比,Roux-en-Y加袋术(P-Y)不仅可以增加患者饮食量,而且术后倾倒综合征和反流性食管炎发生率较低。Mauri等发现,与R-Y组相比,P-Y组代胃空肠排空显著减慢,而且患者进食量大,早饱、倾倒综合征发生率低。Tadahiro等的研究还证实加袋术有益于改善患者术后早期营养状态。Iivonen等在一项长达8年的随访研究中发现,无贮袋者餐后饱胀及倾倒综合征发生率较高,进食量减少及体重下降更明显。由此可见,加袋术既能增加患者进食量,延长食物排空时间,改善术后营养状况,也可以减少术后并发症的发生,提高患者的生活质量,临床上值得推荐。1952年Hunt在Roux-en-Y术基础上将远侧段空肠自身折叠吻合成双腔后与食管吻合,现将这类手术通称为Hunt-Lawrence-Radino术。该术式由于食管空肠端-侧吻合口还具有假幽门作用,建立的储袋可减少无胃综合征的发生率。1981年Lygidakis对Hunt-Lawrence-Radino术的改革,其主要优点是储袋有两个开口以外的两段肠管保持完整,具有正常收缩功能,使食物逐渐排空,而又不致排空延迟,从而避免了代胃袋扩张、潴留、反流及倾倒综合征等弊端,被认为是一种较好的代胃袋。
理论上保留十二指肠通道可使食物通过十二指肠刺激胆汁和胰液分泌,使胆汁和胰液与食糜充分混合,有利于消化吸收和胃肠激素的调节。有研究表明保留十二指肠通道的患者术后6个月生活质量明显提高,术后12个月体重恢复情况显著比R-Y吻合术好。具有代表性的Henley空肠段间置术,观察到其术后患者的体重增加或维持不变者占84%,而行Rouxen-Y术者仅为61%;Miholic等亦有类似报道,两种术式相比,体重恢复达病前水平者分别为89%和78%,有统计学差异。空肠间置术后食物通过小肠的时间较Roux-en-Y术组短,倾倒综合征发生率较高。然而前瞻性研究表明,虽然对手术时间、出血量和死亡率无显著影响,保留十二指肠通道未能在维持营养状况及避免远期并发症等方面表现出明显积极的作用。Shinya等发现,与Roux-en-Y加袋术组相比,空肠加袋间置术组营养状况较佳,胆汁反流程度较低,但差异无显著性;体重恢复、胸骨后灼热感和倾倒综合征两组之间无差异。Nakane等研究发现Roux-en-Y加袋术组单餐进食量、体重恢复和排空时间等指标反而优于空肠加袋间置术组。Fuchs等对比了Roux-en-Y加袋术与空肠加袋间置术的疗效,两组各53例,随访3年结果两组显示症状和生活质量的指数均无差异,提示患者并不能从保留十二指肠通道中受益。
综上所述,尽管从理论上讲保持十二指肠通道为好,但是许多学者认为并非必要。且肠段间置术较复杂,较简单的Roux-en-Y术可同样取得较好效果。一般认为代胃组患者的术后生活质量以及营养状况较单纯的Roux-en-Y术为优,而代胃方法上Lygidakis法较Lawrence法为优。然而另一些学者认为建立代胃袋并非必不可少,其观点的不同可能是因为各自都缺乏大宗的前瞻性随机对照研究。学者们仍在不断设计新的代胃袋,其疗效也尚需进一步研究。