 去看看
去看看


神经影像技术是癫痫病因诊断、外科治疗的重要工具,在癫痫领域主要用于确定病因、评估病变性质、评估致痫灶(或致痫区)、评估脑功能区。根据其成像原理及使用目的,大致分为结构影像学和功能影像学两大类,其中计算机断层扫描(computed tomography,CT)、磁共振成像(magnetic resonance imaging,MRI)可以提供脑结构信息,称为结构性神经影像学,而血氧水平依赖的磁共振成像(blood oxygenation level dependent-fMRI,BOLD-fMRI)、正电子发射断层成像(positron emission computed tomography,PET)、单光子发射计算机断层成像(single photon emission computed tomography,SPECT)等对脑的功能情况进行描绘,则称为功能性神经影像学。计算方法、定量采集新技术和后处理技术在神经解剖方面的应用,产生了越来越成熟的、体现组织微结构的标记物,癫痫病学已逐步转变为多学科的研究。
不同的影像学检查技术满足的是不同的临床需求。在临床工作中需要根据患者个体情况,选择恰当的检查技术,既满足临床诊断的需要,又避免过度的检查,加重患者经济负担。例如,应避免在尚未进行充分细致的MRI等常规结构性影像检查的前提下,盲目为患者开展各种功能性影像检查;而在术前评估阶段,只有在仔细评估了患者症状学、脑电图和MRI结构性影像之后,才可依据病情考虑行PET、fMRI等检查。
一、头颅磁共振成像(MRI)
MRI可以提供脑结构的高分辨率诊断信息,并且可以多方位、多序列成像,能够发现很多头颅CT所不能发现的细微结构性异常,如海马硬化、局灶性皮质发育不良(FCD)、海绵状血管瘤、低级别肿瘤等,因此对于癫痫病因诊断、术前评估具有特别重要的作用,是癫痫患者影像学检查的首选项目。
1.检查与复查指征
当患者为首次发作或新诊断癫痫时,在设备条件允许的情况下,推荐行头颅MRI扫描,这将有助于发现前述病因、指导治疗以及判断预后。在疾病早期阶段,MRI上显示海马硬化的颞叶内侧癫痫患者,发展为药物难治性癫痫的概率是无病变患者的3倍;而对于MRI显示明确病变的患者,其术后癫痫无发作的概率比MRI无病变患者要高2.5倍。
定期重复检查MRI对于很多患者都是必要的。由于MRI诊断结果在很大程度上取决于诸多因素,包括设备磁场强度、相控阵线圈数量、扫描参数、图像的分辨率及阅片者的专业能力等,有时一次扫描并不能确保检测出病灶。因此,优化MRI方案重复检查非常重要,尤其是药物难治性癫痫且先前MRI呈阴性的患者。再次MRI检查可能在30%~65%的上述病例中发现病灶;而当MRI与特定的影像后处理技术相结合时,对FCD的检测灵敏度可高达74%,这将让医师改善临床决策。若患者短期内癫痫发作加重或出现明显神经功能障碍,应及时复查MRI。而对于进展性疾病,更应定期复查MRI以进行动态比较。对于低龄婴幼儿应注意其正处于大脑髓鞘化阶段,MRI扫描结果在不同阶段可有不同的表现,因此也要定期复查。
2.检查参数
选择何种扫描参数需要结合患者具体情况而定。既要获取充分、可靠的结构图像信息以满足临床诊断需求,又要避免过度检查。结合我国国情,推荐对新诊断癫痫患者、癫痫详细扫描或术前评估患者采取以下两种不同的标准:
(1)推荐新诊断癫痫患者MRI扫描要求(癫痫MRI检查的常规要求、最低要求):
场强1.5T及以上,扫描范围覆盖全脑。①2D轴位T1加权成像,快速自旋回波序列,层厚/层间距5mm/1mm;②2D轴位T2加权成像,快速自旋回波序列,层厚/层间距5mm/1mm;③2D轴位T2液体衰减反转恢复序列(FLAIR),快速自旋回波序列,层厚/层间距5mm/1mm;④2D冠位T2液体衰减反转恢复序列(FLAIR),快速自旋回波序列,扫描方向垂直于AC-PC线或垂直于海马长轴,层厚/层间距5mm/1mm。
(2)推荐用于癫痫专科门诊或癫痫中心的癫痫MRI详细扫描或术前评估扫描要求:
场强推荐3.0T及以上,扫描范围覆盖全脑。①3D T1加权成像,梯度回波序列,体素分辨率大小1mm×1mm×1mm;②3D T2液体衰减反转恢复序列(FLAIR),快速自旋回波序列,体素分辨率大小1mm×1mm×1mm;③2D冠位T2加权成像,快速自旋回波序列,扫描方向垂直于海马长轴,层厚2mm,间距0mm,像素分辨率0.4mm×0.4mm。
T1加权成像尤其是毫米级体素分辨率扫描最适合评估解剖、形态学,包括体积、厚度、脑沟-脑回形态、灰白质交界完整性等。T2 FLAIR序列最适合评估异常信号,尤其是与胶质增生和细胞外间隙增加的高信号。与T2加权成像相比,FLAIR序列消除了脑脊液的信号,更加突显皮质病变高信号。上述2D冠位T2加权成像为选择性项目,垂直于海马长轴的T2加权成像最适合评估海马内部结构(区别CA亚区、齿状回)以及杏仁核、海马旁回等,在怀疑内侧颞叶癫痫时可以检查。具体实践中,可结合设备条件、患者个体情况对上述方案推荐参数作出一定调整。
此外,当怀疑存在肿瘤、感染、血管畸形或Sturge-Weber综合征时,应酌情选择加做钆增强的T1 MRI扫描,看是否出现造影剂强化;以及对静脉血、出血、铁沉积和钙化敏感的敏感加权成像和T2增强成像。
3.图像解读
临床医师应亲自逐层阅片,尤其提倡根据患者癫痫电-临床特征对影像学资料进行针对性地检视与解读。即使有符合标准的MRI检查图像,对癫痫影像学的解读也在很大程度上取决于阅片者对癫痫影像专业知识的掌握程度。相较于传统的阅读影像胶片而言,临床图像存档和传输系统(PACS)以及某些免费的影像浏览平台,允许在三个正交平面(轴位、冠位和矢状位)上同时高效地审阅图像,从而极大地有利于三维MRI的阅图。这些平台软件还允许并排观察不同的MRI图像并进行比对、评估其形态学和信号的异常,对诊断大有裨益。
海马硬化是药物难治性癫痫最常见的病因之一,其在MRI上的表现是T2加权或T2 FLAIR序列上信号增高,T1加权成像上见海马萎缩、体积缩小。其他间接特征还可包括:同侧侧脑室颞角扩大、同侧穹窿萎缩、乳头体萎缩、颞叶萎缩等。可以在冠状位并排比较左右海马的对称性、形状和信号。
皮质发育畸形是一组局灶性或者弥漫性皮质结构异常病变的总称,过去认为是隐源性癫痫的患者,越来越多的发现证明其病因就是皮质发育畸形。对怀疑皮质发育畸形的患者,应观察脑沟的形态、灰质、灰白质交界、白质及脑室是否异常。在50%~90%的FCDⅡ型病例中,T1加权成像表现为皮质厚度增加、灰白质分界模糊。高达100%的病例在T2 FLAIR序列病变灰质经分析呈高信号。FCD病变可能好发于脑沟底部。脑白质穿通征(transmantle sign)是一种漏斗状的信号,从脑室壁延伸到隐藏病变的新皮质,这是FCDⅡ型的特征性改变。
对于年龄小于2岁的婴儿,因髓鞘形成不完全,白质与灰质对比度差,确定皮质异常十分困难,这些病例应在1~2年后行MRI复查。
当癫痫MRI阅片未见异常,有时不应将视线一直局限在皮质,而去查看有无被漏诊的深部病变,例如下丘脑错构瘤或室管膜下灰质异位结节。
二、头颅CT
CT作为传统的结构影像学检测手段,其整体敏感性及特异性均不如MRI,且孕产期妇女禁用,因此,CT不作为癫痫患者影像学检查的首选,但在以下几种情况下,CT检查具有独特的应用价值,是对MRI的补充:
1.对于有钙化的病变,如神经节细胞胶质瘤、Sturge-Weber综合征、结节性硬化、囊虫结节等。
2.评价颅骨相关异常,如外伤性颅骨缺损、凹陷性骨折、脑膜脑膨出等。
3.颅内电极置入术前,CT扫描评价颅骨厚度;颅内电极置入术后,CT扫描获取每一个电极触点的空间位置,并可与电极置入术前MRI影像进行精准融合。
4.对于MRI禁忌证的患者,如体内有心脏起搏器、金属植入物的患者,以及MRI幽闭综合征患者,只能进行CT检查。
一、单光子发射计算机断层成像(SPECT)
SPECT原理是静脉注入含放射性核素的示踪剂后,通过血脑屏障进入脑组织,由于脑代谢改变和血流灌注改变往往是同时发生的,可以比较敏感地反映局部脑组织的血流灌注情况。SPECT显像的优势在于可以观察发作期及发作间期的血流灌注变化,发作期致痫区的脑血流量增加呈现放射性浓聚区域,表现为高灌注,发作间期呈现放射性减低区域,表现为低灌注。
由于SPECT显像的空间分辨率较低,目前提倡发作期SPECT减影MRI融合技术(subtraction ictal SPECT co-register to MRI,SISCOM)技术,是将发作期与发作间期SPECT图像相减后得到的图像,与MRI图像进行融合,弥补了SPECT空间分辨率较低的不足,同时还增加了致痫区定位的敏感性。
二、正电子发射断层成像(PET)
PET是一种探测放射性示踪剂在体内分布及动态变化情况的先进分子影像检查技术。在功能神经影像学检查方法中,PET被认为是癫痫外科术前评估的最佳无创性功能性影像检查方法,它能够利用不同的示踪剂从脑组织葡萄糖代谢、氧代谢、脑血流灌注、神经受体分布、生化和蛋白质合成等方面的改变对致痫区进行定位及定量分析,还能对癫痫的发生机制进行深入研究。目前,最常用于癫痫代谢显像的示踪剂为18氟标记脱氧葡萄糖(18F-FDG),其含量及分布反映了脑组织的葡萄糖代谢情况。致痫区在癫痫发作期,神经元兴奋性异常增高,致痫灶局部能量的消耗明显增加,局部血流和葡萄糖代谢明显增加,18F-FDG摄取增高,PET显像上表现为局部脑皮质代谢增高;发作间期,致痫区可能存在大脑皮质萎缩、神经细胞数量减少、突触活动减少及神经元的活性下降等,导致葡萄糖代谢减低、血流灌注减少,18F-FDG摄取减低,PET显像上表现为低代谢。在局灶耐药癫痫患者术前评估中,FDG PET与MRI、VEEG及症状学等临床特征一起成为重要的术前评估手段,特别是MRI初步诊断为阴性的患者,在PET引导下病灶(如细微结构改变的FCD)的检出,MRI与发作期脑电图结果不一致及广泛结构病变时提出致痫灶假说以指导SEEG置入方面有重要的帮助。目前研究表明:PET结果阳性而MRI阴性的颞叶内侧癫痫患者的预后与MRI上显示海马硬化的患者没有显著的统计学差异;颞叶癫痫术后效果良好的患者比效果不好的患者有更大比例的低代谢切除范围;颞叶癫痫患者孤立的颞叶内低代谢病灶是患者术后良好结果的预测指标。以上结果表明PET能作为癫痫患者术后疗效预测的一个重要因素。但PET检出的葡萄糖代谢减低范围通常比致痫灶的范围更广,且常常累及功能区,故其指导癫痫手术切除范围的价值仍有待进一步研究。目前同机的PET/MRI检查已逐步在临床投入使用,同机的PET/MRI反应实时的功能与结构异常,并使功能影像与结构影像更好的配准。文献表明同机的PET/MRI比单独的PET/CT、MRI或PET/CT与异机MRI的共注册有更高的病灶检出率。同机的PET/MRI的动脉自旋标记(ASL)序列还能得到同时的葡萄糖代谢与血流灌注的改变,对研究癫痫患者大脑的病理生理改变有更大的帮助。
三、磁共振波谱成像(MRS)
MRS是一种可以反映活体脑组织生化代谢的无创性检查方法,通过外加磁场激发活体组织内部的原子核,产生磁共振信号,再转换成波谱。有多种原子核可以用于MRS检查,但是以质子MRS(1H-MRS)最为常用。癫痫患者的主要病理学改变为神经元细胞数减少伴功能紊乱和神经胶质细胞的增生,1H-MRS表现与病理学改变相关,典型病例的MRS表现为N-乙酰天门冬氨酸(NAA)减少,胆碱(Cho)、肌酸(Cr)和肌醇(myo-inositol,mI)增加,NAA/(Cr+Cho)比值降低,后者被认为是定量诊断癫痫的最敏感指标之一。
四、弥散张量成像(DTI)
弥散张量成像(diffusion tensor imaging,DTI)是一种近年来在弥散加权成像基础上在6~55个线性方向上施加弥散敏感梯度而获取的图像,它反映水分子的弥散运动,在活体内可以反映水分子在组织内的弥散特征。因此,一方面,可以通过平均弥散系数(average diffusion coefficient,ADC)及各向异性分数(fraction anisotropy,FA)的改变,定位致痫区;另一方面,通过纤维束示踪技术能够清楚显示语言传导束、锥体束、视辐射等功能性传导束的形态、走行、移位及与邻近病灶的空间毗邻。
五、磁共振灌注成像(PWI)
灌注是指血液通过毛细血管床与组织进行氧、养分及代谢物的交换,进以维持组织器官活性和功能的过程。定义为单位时间内对单位质量的组织的血液输送量,单位为ml/(min·100g)。磁共振灌注成像作为一种功能性成像方法,可以提供常规影像检查方法所无法获得的疾病的血流动力学信息,在脑肿瘤、脑缺血疾病中已得到广泛应用,而血流灌注的下降或异常也是癫痫的主要病症和诊断依据。较SPECT、PET相比,具有更高的空间分辨率、无辐射、成本较低等优点。
目前主要有两种磁共振灌注方法,一种是使用外源性对比剂,主要是通过静脉内团注顺磁性对比剂后采用快速扫描序列,获得对比剂首次通过感兴趣区的一系列动态影像;另一种是使用水质子作为内源性对比剂,即动脉自旋标记(ASL)技术显示组织的灌注情况。
ASL的原理是将水质子作为自由扩散的内源性示踪剂,利用翻转脉冲标记成像层面流入侧的动脉血,经过一个从标记区域到成像层面的通过时间之后,血中已经标记的质子在成像层面毛细血管区与组织水中的质子进行交换,引起局部组织纵向弛豫时间T1的变换,将所得的图像与未经标记的图像相减得到灌注图像,通过应用一定的动力学模式,可以定量测量脑血流量。
六、血氧水平依赖的磁共振成像(BOLD-fMRI)
BOLD-fMRI是基于大脑神经元活动对局部的耗氧量和CBF影响程度不匹配,从而引起局部血液中氧合血红蛋白与脱氧血红蛋白比例变化,导致局部磁场性质变化来间接反映神经元活动。该技术利用局部脑组织的血流动力学变化可以间接反映脑组织局部的灌注改变情况。
BOLD-fMRI的研究设计根据扫描时所处的状态分为刺激或任务相关(task-related)和静息状态(resting-state)的fMRI。任务相关的fMRI是在特定的任务下进行脑功能成像分析,可以用来检测与任务相关的局部脑区活动;静息状态下的fMRI是指受试者在扫描时不需要施予任务或者接受外来的刺激,可反映基础状态大脑功能的病理生理改变,具有良好的稳定性、准确性和患者依从性。
目前在癫痫领域,fMRI主要用于运动、语言皮质功能区的识别定位,其次是致痫区的定位。任务相关的fMRI可在术前确认语言半球优势,用于优势半球颞叶切除术。美国神经病学学会推荐使用言语记忆或言语编码的fMRI来预测术后语言记忆结果(B级),非言语记忆编码的fMRI来预测术后视觉空间记忆结果(C级)。功能性磁共振成像也可用于绘制初级运动皮质、躯体感觉皮质或视觉皮质,尤其是当癫痫灶(肿瘤、胶质增生或FCD)位于或接近运动性语言中枢时。
上述功能性神经影像学总结见表9-1。
表9-1 功能性神经影像学的原理特点及主要应用场景
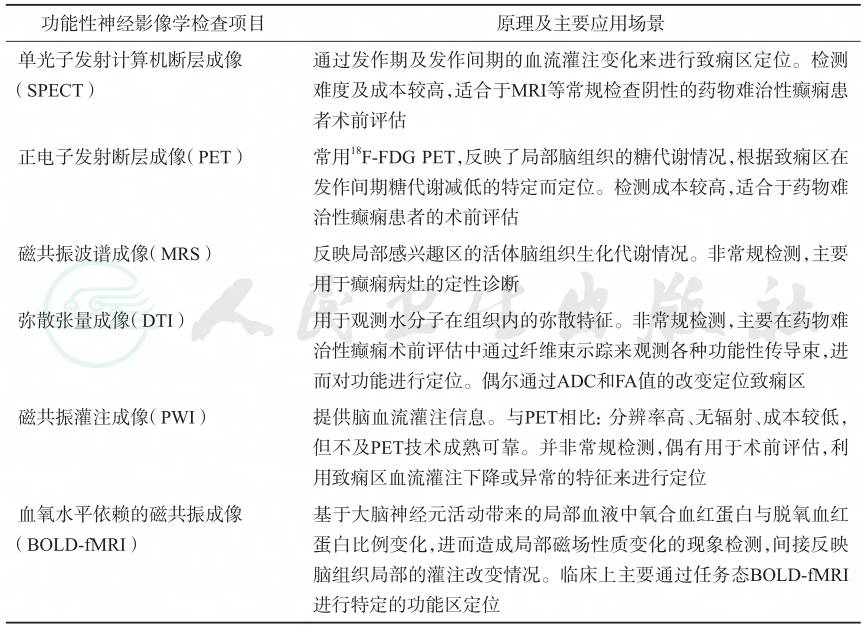
| 功能性神经影像学检查项目 原理及主要应用场景 |
| 单光子发射计算机断层成像 (SPECT) 通过发作期及发作间期的血流灌注变化来进行致痫区定位。检测 难度及成本较高,适合于MRI等常规检查阴性的药物难治性癫痫患 者术前评估 正电子发射断层成像(PET) 常用18F-FDG PET,反映了局部脑组织的糖代谢情况,根据致痫区在 发作间期糖代谢减低的特定而定位。检测成本较高,适合于药物难 治性癫痫患者的术前评估 磁共振波谱成像(MRS) 反映局部感兴趣区的活体脑组织生化代谢情况。非常规检测,主要 用于癫痫病灶的定性诊断 弥散张量成像(DTI) 用于观测水分子在组织内的弥散特征。非常规检测,主要在药物难 治性癫痫术前评估中通过纤维束示踪来观测各种功能性传导束,进 而对功能进行定位。偶尔通过ADC和FA值的改变定位致痫区 磁共振灌注成像(PWI) 提供脑血流灌注信息。与PET相比:分辨率高、无辐射、成本较低, 但不及PET技术成熟可靠。并非常规检测,偶有用于术前评估,利 用致痫区血流灌注下降或异常的特征来进行定位 血氧水平依赖的磁共振成像 (BOLD-fMRI) 基于大脑神经元活动带来的局部血液中氧合血红蛋白与脱氧血红 蛋白比例变化,进而造成局部磁场性质变化的现象检测,间接反映 脑组织局部的灌注改变情况。临床上主要通过任务态BOLD-fMRI 进行特定的功能区定位 |
引自:临床诊疗指南——癫痫病分册(2023修订版).第1版.ISBN:978-7-117-34579-8
医学影像后处理技术在近些年快速发展并应用于临床。通过计算机处理将原始医疗影像如CT、MRI、DSA、SPECT、PET和超声等产生的数字化影像进行深度分析,经处理后可得到多模态、多观察面、立体、仿真、多彩、动态、直观的图像信息,提高了MRI阴性病灶的检出率,并有助于提高癫痫外科的术前评估效率及手术预后。目前主要分为以下三类。
一、影像数据测量技术
临床获得的影像资料均是由相同大小的体素构成的(二维空间称像素;三维空间称为体素)。每一体素均有对应的数值,即灰度值。不同大小的灰度值形成了图像的明暗对比,如MRI影像中脑白质、灰质以及脑脊液信号的差异。利用体素灰度值的大小进行数学运算,可以对MRI影像进行皮质厚度测量、脑组织分割和体积测量等工作,例如可以依据不同皮质厚度进行脑区划分,而海马体积测量或表面形态学分析,则有助于MRI阴性的颞叶癫痫的诊断。
基于体素的形态学测量分析(VBM)通过将结构像进行分割生成灰质/白质体积指标图、灰质/白质密度指标图、灰质总体积、白质总体积等综合指标;基于表面的形态学测量分析(SBM)在分割的基础上进一步重建皮质,能计算皮质厚度、曲率、局部回指数、脑沟深度等指标。
VBM-MAP基于高分辨率MRI脑部扫描图像进行预处理生成连接图和延展图,以强化显示灰质-白质交界处异常,可显著提高MRI阴性的FCD的检出率并确定FCD异常分布范围,而人工阅片结合VBM-MAP技术,更能将两者优势最大化。
二、影像数据融合技术
医学影像融合就是把同一患者不同模式的影像在空间上进行配准,获得在同一空间下呈现多模态图像信息的一种技术。不同的结构性影像或功能性影像满足的是不同的临床需求,之间无法相互取代,而融合技术则可使各影像数据达到优势互补。
目前用于癫痫术前应用较多的是PET/MRI融合,很好地发挥了PET对功能缺失区的高敏感性和MRI对脑结构的高空间分辨率的优势。PET/MRI为FCD检测、颅内电极设计和病灶切除提供了补充信息,尤其是对颞叶以外MRI阴性FCD的检出率有很高的价值。此外,在颅内电极监测病例,电极置入术前MRI与电极置入术后CT融合,可以精确、清晰地显示电极触点在大脑内的位置。
三、影像数据三维重建技术
为了更立体、直观的观察,可对医学影像进行三维重建。三维重建是指将基于一个或多个视图获得的二维图像重建为三维模型,是一种逆向的还原过程,最常用的算法有两类:一类是基于构建物体表面的面绘制算法;一类是直接绘制物体三维体素的体绘制算法。
通过把多种影像学数据,甚至电生理数据实施融合、重建,得到的三维立体图像可以精确地显示出各脑区的空间位置,利用旋转可以从不同角度观察大脑情况,进一步将特殊信息(灰质厚度、沟回褶皱、沟回深度)添加在脑表面上,显著提高诊断的准确性。目前临床多用于患者电极置入手术的术前计划、评估手术风险与预后、术前宣教、术中指导切除等。
[1]WANG I,BERNASCONI A,BERNHARDT B,et al.MRI essentials in epileptology:a review from the ILAE Imaging Taskforce[J].Epileptic disorders,2020,22(4):421-437.
[2]BERNASCONI A,CENDES F,THEODORE W H.Recommendations for the use of structural magnetic resonance imaging in the care of patients with epilepsy:a consensus report from the International League Against Epilepsy Neuroimaging Task Force[J].Epilepsia,2019,60(6):1054-1068.
[3]SZAFLARSKI J P,GLOSS D,BINDER J.Practice guideline summary:use of fMRI in the presurgical evaluation of patients with epilepsy:report of the Guideline DevelopmentDisseminationand Implementation Subcommittee of the American Academy of Neurology[J].Neurology,2017,88(4):395-402.
[4]PYATIGORSKAYA N,HABERT M O,ROZENBLUM L.Contribution of PET-MRI in brain diseases in clinical practice[J].Curr Opin Neurol,2020,33(4):430-438.
[5]SIDHU M K,DUNCAN J S,SANDER J W.Neuroimaging in epilepsy[J].Curr Opin Neurol,2018,31(4):371-378.
[6]MIDDLEBROOKS E H,VER HOEF L,SZAFLARSKI J P.Neuroimaging in Epilepsy[J].Curr Neurol Neurosci Rep,2017,17(4):32.
[7]RÜBER T,DAVID B,ELGER C E.MRI in epilepsy:clinical standard and evolution[J].CurrOpin Neurol,2018,31(2):223-231.
[8]KINI L G,GEE J C,LITT B.Computational analysis in epilepsy neuroimaging:A survey of features and methods[J].Neuroimage Clin,2016,11:515-529.
[9]ELSON L,SO P R.MRI Negative Epilepsy:Evaluation and Surgical Management[M].Cambridge:Cambridge Universily Press,2015.
[10]MUHLHOFER W,TAN Y L,MUELLER S G,et al.MRI-negative temporal lobe epilepsy- What do we know?[J].Epilepsia,2017,58(5):727-742.