 去看看
去看看


1 范围
本标准提供了新生儿贫血、血小板减少症、溶血病和儿童血液病、造血干细胞移植、重症与大出血、心脏手术的输血阈值或适应证,儿童用血需求、血液输注与监护及输血后评价方面的指导和建议, 并给出了相关信息。
本标准适用于开展儿科输血治疗的医疗机构和向其供应血液的血站。
2 规范性引用文件
下列文件中的内容通过文中的规范性引用而构成本标准必不可少的条款。其中,注日期的引用文件,仅该日期对应的版本适用于本标准;不注日期的引用文件,其最新版本(包括所有的修改单)适用于本标准。
WS/T 624 输血反应分类
3 术语和定义
下列术语和定义适用于本标准。
3.1
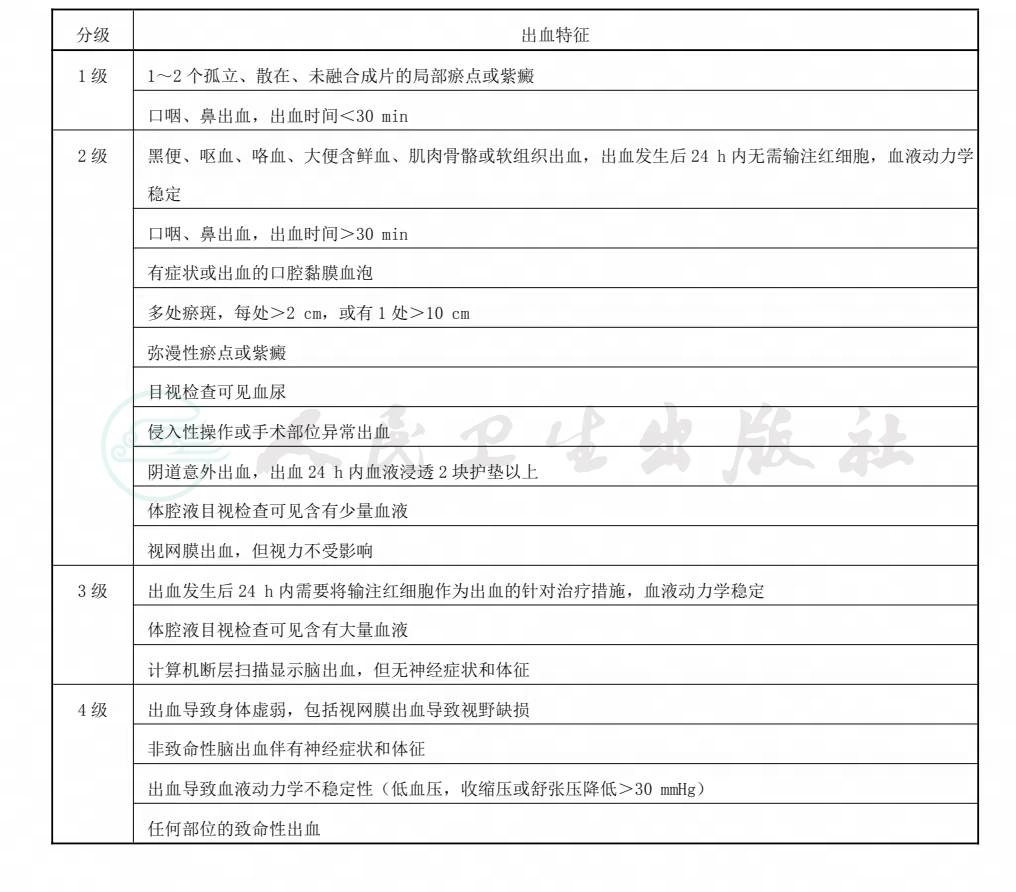
明显出血 significant bleeding
按照附录A提供的出血程度分级标准判断为2级以上(含2级)的出血。
3.2
输血阈值 transfusion threshold
经过临床研究验证,提示患者需要输血的血液成分临界水平。
注1:患者的血红蛋白、血细胞比容、血小板计数或纤维蛋白原检测结果高于输血阈值时,一般能安全地避免输血;低于输血阈值时,输血利大于弊的可能性较大。
注2:输血阈值可以是一个范围,较低的输血阈值称为严紧输血阈值,较高的输血阈值称为宽松输血阈值。
4 缩略词
下列缩略词适用于本标准。
AIHA:自身免疫性溶血性贫血(Autoimmune Hemolytic Anemia)
APTT:活化部分凝血活酶时间(Activated Partial Thromboplastin Time)
ECMO:体外膜氧合(Extracorporeal Membrane Oxygenation)
FFP:新鲜冰冻血浆(Fresh Frozen Plasma) Fib:纤维蛋白原(Fibrinogen)
Hb:血红蛋白(Hemoglobin) Hct:血细胞比容(Hematocrit) HLA:人类白细胞抗原(Human Leukocyte Antigen) HSC:造血干细胞(Hemopoietic Stem Cell) INR:国际标准化比值(International Normalized Ratio)
PLT: 血小板(Platelet)
PT:凝血酶原时间(Prothrombin Time)
SpO2:经皮动脉血氧饱和度(Percutaneous Arterial Oxygen Saturation)
TSB:血清总胆红素(Total Serum Bilirubin) WHO:世界卫生组织(World Health Organization)
5总则
5.1儿童患者是一类异质性群体,处在生长发育的不同阶段,在血容量、血液组成成分水平、免疫系统成熟度以及机体对低血容量和缺氧的生理反应等方面均存在很大差异,对输血要求高,容易发生输血不良反应。因此儿科疾病的输血实践不仅不同于成人患者,而且更加错综复杂。
5.2应科学、全面地评估儿童患者的病情和输血需求、获益及风险,坚持非必要不输血和非必要不多输血的原则,采取措施避免或减少输血,审慎选用严紧或者宽松的输血阈值和适宜的血液成分,适时评估输血疗效。
5.3儿童患者输血不良反应的临床表现比成人患者更加隐匿,不易发现,应注意防范,密切观察,及时处理。
6新生儿输血
6.1新生儿贫血
6.1.1早产儿尤其是低出生体重早产儿贫血很常见。除了早产儿自身的原因外,医源性失血是导致其贫血的重要原因。应采取积极措施,减少医源性失血,记录和监控医源性失血量。
6.1.2宜根据早产儿的健康状况,包括胎龄、出生日(周)龄、心肺功能、大脑和内脏血液循环的血氧状态、失血(包括医源性失血)状态、其他疾病等,综合分析和权衡贫血的危害、输血的益处及潜在风险,审慎选用严紧或者宽松的红细胞输血阈值。
6.1.3对于超低出生体重儿贫血,宜遵守本标准第6.1.2条提出的输血指导原则,结合表1建议的红细胞输血阈值,选用严紧或者宽松的红细胞输血阈值。对于接受大手术或存在大出血(估计失血量超过自身血容量的10%)、原因不明的乳酸酸中毒(动脉血乳酸≥4mmol/L)等危急病情的患儿,可采用更加宽松的输血阈值。
表1 超低出生体重贫血患儿红细胞输血阈值
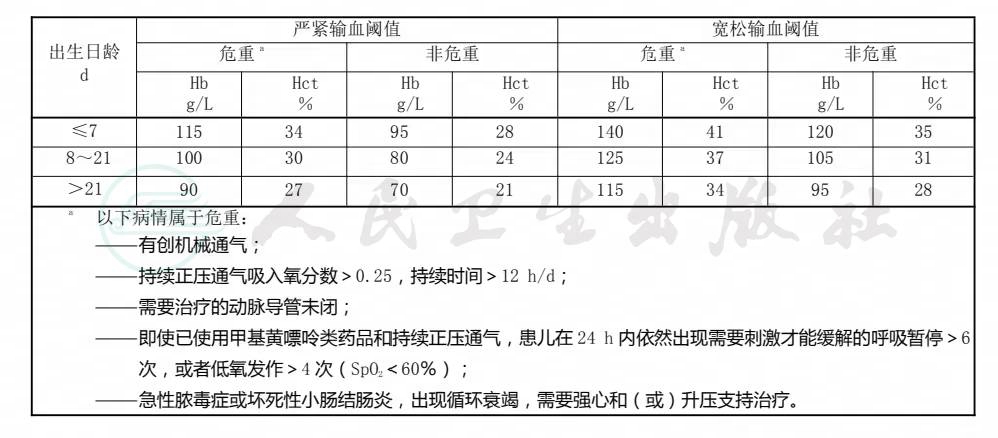
6.1.4对于其他新生儿贫血,宜遵守本标准第6.1.2条提出的输血指导原则,采用比超低出生体重儿贫血更为严紧的红细胞输血阈值。
6.2新生儿血小板减少症
6.2.1对于极重度血小板减少症(PLT<25×109/L)的早产儿,在针对病因治疗的同时,宜给予输注血小板。
6.2.2对于PLT≥25×109/L、无出血表现的新生儿,不宜常规给予输注血小板。
6.3新生儿溶血病
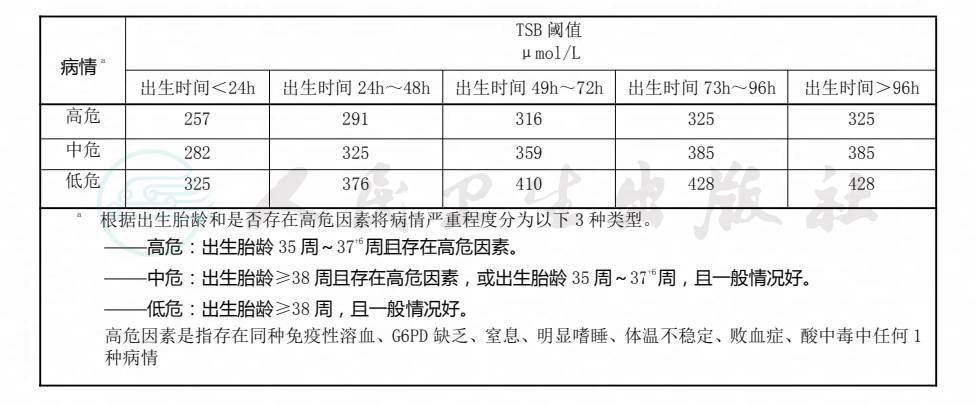
6.3.1对于晚期早产(出生胎龄≥35周)和足月产的溶血病患儿,宜根据患儿具体病情,结合表2 建议的换血血清总胆红素(TSB)阈值,作出是否需要换血的判断。
表2 晚期早产(出生胎龄≥35 周)或足月产溶血病患儿换血 TSB 阈值
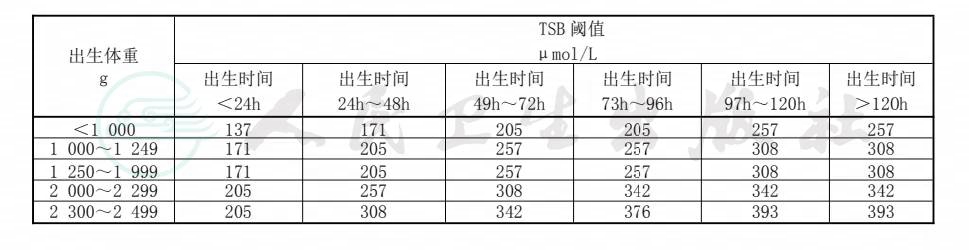
6.3.2对于低出生体重(<2500g)的溶血病患儿,宜根据患儿具体病情,结合表3建议的换血TSB阈值,作出是否需要换血的判断。
表3 低出生体重溶血病患儿换血 TSB 阈值
6.3.3对于已出现急性胆红素脑病临床表现的患儿,即使其TSB水平未达到换血阈值,或者在准备换血期间其TSB水平已明显下降,也宜尽快为其实施换血。
6.3.4在准备换血的同时,宜先给予患儿强光疗4h~6h,如果患儿TSB水平未下降甚至持续上升,宜尽快为其实施换血。
6.3.5宜采用符合本标准第11.2条建议的组合血液为患儿实施换血。
6.3.6换血量宜为患儿自身血容量的2倍(约为150mL/kg~180mL/kg)。
7血液病患儿输血
7.1再生障碍性贫血
7.1.1对于病情稳定的患儿,红细胞输血阈值宜为Hb<70g/L。
7.1.2对于存在氧耗增加的病情(如感染、发热、疼痛等)的患儿,红细胞输血阈值宜适当提高。
7.1.3宜根据患儿具体病情选用相应的血小板输血阈值:
a)对于病情稳定的患儿,血小板输血阈值宜为PLT<10×109/L;
b)对于存在发热、感染、明显出血或正在接受抗胸腺细胞球蛋白治疗的患儿,血小板输血阈值宜为PLT<20×109/L。
7.2地中海贫血
7.2.1输血依赖型地中海贫血
7.2.1.1宜对输血依赖型地中海贫血患儿进行全面的血型鉴定和抗体筛查,为其专门制订输血方案,将输血方案纳入整体诊疗计划,并根据患儿健康状况和治疗效果适时调整。
7.2.1.2对于出现以下任何1种病情的患儿,宜为其启动输血方案。
a)间隔2周以上的2次血常规均为Hb<70g/L,且排除存在引起Hb下降的其他病情(如感染等)。
b)出现以下任何1种临床表现:
1)严重的贫血症状;
2)生长发育迟缓;
3)过度骨髓内造血引起的并发症(如病理性骨折和面容改变);
4)明显的髓外造血。
7.2.1.3启动输血方案后,患儿通常需要每2周~5周输血1次。宜根据患儿Hb水平的下降趋势、本次输血后和下次输血前宜达到或维持的Hb水平,估算所需输血量。
本次输血后的Hb水平宜达到130g/L~150g/L。
下次输血前的Hb水平宜维持在95g/L~105g/L。
7.2.1.4宜为患儿选用与其ABO、RhD同型,且与其C、c、E、e抗原表型匹配的红细胞输注,以避免患儿产生针对这些抗原的同种免疫。
7.2.2非输血依赖型地中海贫血
7.2.2.1对于非输血依赖性地中海贫血患儿,宜对患儿的生长发育、并发症和输血利弊等情况综合分析,决定是否给予输注红细胞。不宜单纯以Hb水平作为输血的决定依据,除非患儿Hb<50g/L。
7.2.2.2对于出现Hb可能快速下降的病情(如感染、手术)的患儿,宜给予输注红细胞。
7.2.2.3对于出现以下病情的患儿,宜考虑为其增加输血频次,并在取得稳定的临床疗效后再次评估可否逐渐减少直至停止输血:
a)脾脏迅速增大(每年脾脏增大超过3cm)伴Hb下降;
b)生长发育迟缓;c)运动耐量下降;
d)继发性性发育迟缓,与骨龄不同步;
e)骨骼改变;
f)溶血危象频发;
g)生活质量差。
7.2.2.4对于可能出现或已经出现以下并发症的患儿,可考虑给予输注红细胞:
a)血栓或脑血管疾病;
b)肺动脉高压伴或不伴继发性心力衰竭;
c)髓外造血性假瘤;
d)腿部溃疡。
7.2.3宜为患儿选择与其ABO、RhD同型,且与其C、c、E、e抗原表型匹配的红细胞输注,以避免患儿产生针对这些抗原的同种免疫。
7.3自身免疫性溶血性贫血(AIHA)
7.3.1AIHA患儿存在自身抗体,其输血相容性检测和适合输注血液选择的难度和耗时大幅增加。
宜根据患儿输血相容性检测情况、贫血及其临床表现的严重程度和病情进展速度等综合分析,确定具体输血时机。
如果在不能排除存在同种抗体或不能明确同种抗体特异性的情况下给予输血,可能增加同种抗体引发患儿发生溶血性输血反应的风险。因此在这种情况下时宜避免或减少输血。
如果已排除患儿存在同种抗体或已明确同种抗体特异性,输血适应证可适当放宽。
7.3.2对于急性AIHA且出现严重贫血症状的患儿,宜给予输注红细胞。
7.3.3对于慢性AIHA患儿,红细胞输注适应证如下:
a)Hb>70g/L,不宜给予输注红细胞;
b)Hb50g/L~70g/L,且具有不能耐受的贫血症状,宜考虑给予输注红细胞;
c)Hb<50g/L,宜给予输注红细胞。
7.3.4宜根据AIHA患儿输血相容性检测情况和输血需求的紧急程度,选用适宜的红细胞输注:
a)对于血型检测尚未完成,需要紧急输血的患儿,可选用O型洗涤红细胞;
b)对于血型已确定,同种和(或)自身抗体检测尚未完成,需要紧急输血的患儿,输注红细胞血型选择的最低要求是ABO、RhD血型与患儿相容;其他血型宜为C、c、E、e、Jka和Jkb抗原表型匹配,也可为C、c、E和e抗原表型匹配;
c)对于不具有同种抗体,且自身抗体不具特异性的患儿,宜选用与患儿ABO、RhD同型的红细胞;
d)对于具有1种或数种特异性同种抗体的患儿,宜选用与患儿ABO、RhD同型且患儿所具有的同种抗体对应抗原为阴性的红细胞;
e)对于具有特异性自身抗体且有进行性溶血的患儿,宜输注与患儿ABO、RhD同型且自身抗体对应抗原为阴性的红细胞。
7.3.5给予AIHA患儿输注红细胞时,宜选用较小剂量(3mL/kg~5mL/kg),缓慢输注,密切观察患儿反应情况,注意防范发生循环超负荷和溶血性输血反应等输血不良反应的风险。
7.3.6对于极严重的AIHA患儿,如果药品和输血治疗无效,宜为其实施血浆置换。
7.4葡萄糖-6-磷酸脱氢酶缺乏症
患儿出现下列任何1种病情时,宜给予输注红细胞:
a)Hb<60g/L;
b)持续血红蛋白尿,溶血的临床症状严重;
c)出现脑部缺氧或脑细胞水肿症状。
7.5急性白血病和骨髓增生异常综合征
7.5.1患儿Hb<70g/L时,宜给予输注红细胞。
7.5.2患儿的血小板输血阈值如下:
a)PLT<10×109/L,宜给予预防性输注血小板;存在明显出血、发热、高白细胞血症、PLT快速下降、凝血功能异常(如急性早幼粒细胞白血病)等病情时宜适当提高血小板输血阈值;
b)对于拟接受大型侵入性操作或手术的患儿,血小板输血阈值宜为PLT40×109/L~50×109/L;
c)对于拟接受小型侵入性操作(如骨髓穿刺活检和中心静脉置管拔除)的患儿,宜维持其PLT>20×109/L。
7.6免疫性血小板减少症
7.6.1不宜给予预防性输注血小板。患儿出现明显出血和(或)急需侵入性操作或手术且其他治疗方法无效时,宜根据具体病情评估决定是否给予输注血小板。
7.6.2出现严重出血(如内脏出血、颅内出血)时,宜给予输注血小板。
7.7血栓性血小板减少性紫癜
7.7.1宜尽快为患儿实施血浆置换。无法为其实施血浆置换时,可给予输注FFP。
7.7.2不宜给予输注血小板。在发生危及生命的出血时可考虑给予输注血小板。
7.8血友病
7.8.1对于血友病A型患儿,宜首选凝血因子Ⅷ药品。无该类药品可用时,可选用冷沉淀凝血因子或FFP。
7.8.2对于血友病B型患儿,宜首选凝血因子Ⅸ药品或凝血酶原复合物药品。无该类药品可用时,可选用FFP。
7.8.3对于在确诊前急需治疗的疑似血友病患儿,可给予输注FFP。
8造血干细胞(HSC)移植患儿输血
8.1红细胞输血阈值
对于病情稳定、非手术的患儿,红细胞输血阈值宜为Hb<70g/L。如果患儿存在终末期器官损伤或感染的风险,宜考虑将红细胞输血阈值提高为Hb<80g/L。
8.2血小板输血阈值
患儿PLT<10×109/L时,即使没有存在出血危险因素,也宜给予预防性输注血小板。存在其他出血危险因素(如感染、使用抗生素或存在其他止凝血功能异常)时,宜适当提高血小板输血阈值。
8.3血液成分的选择
8.3.1在HSC移植前或植活后,宜根据患儿当前的血型鉴定结果选择与其ABO同型的血液成分输注。
8.3.2在HSC移植的血型转变期间,宜监测患儿血型抗原和抗体的变化状态,并根据ABO血型抗体效价,权衡输注所选血型的血液对造血重建和输血效果的影响,实时调整输血方案。
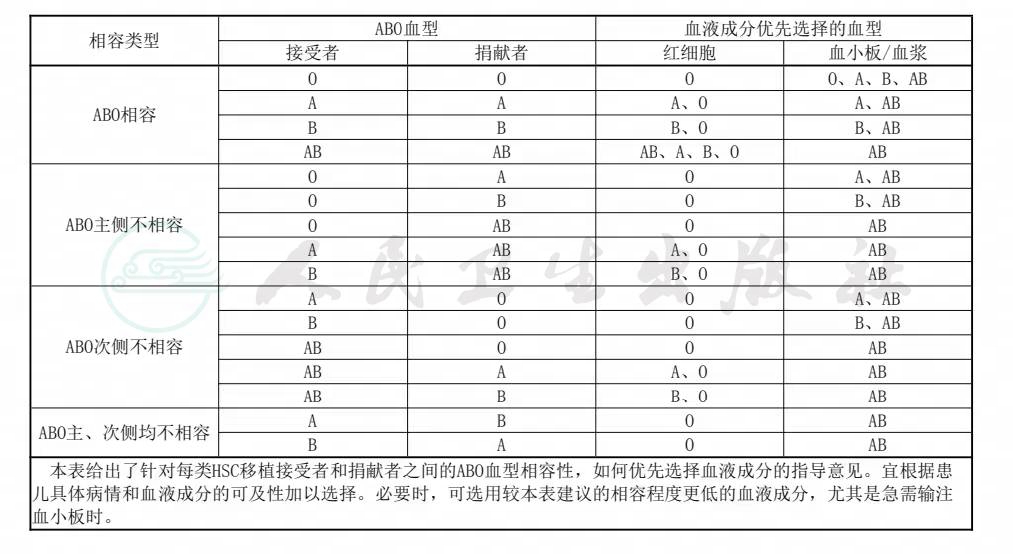
可优先选择表4列出的血液成分血型。如果患儿或捐献者含有ABO血型之外的其他同种抗体,宜为患儿选择相应抗原为阴性的红细胞输注。
表4 HSC 移植接受者与捐献者 ABO 血型相容性类型及移植期间优先选择输注的血液成分血型
8.3.3宜根据11.3中给出的推荐为患儿提供辐照血液。
9重症及大出血患儿输血
9.1一般重症
9.1.1对于危重症和有出现危重症风险的患儿,Hb<50g/L时应给予输注红细胞,Hb50g/L~70g/L时宜结合具体病情考虑是否给予输注红细胞。
9.1.2对于血流动力学不稳定的患儿,宜适当提高红细胞输血阈值。
9.2脓毒症休克
9.2.1对于血流动力学稳定的患儿,红细胞输血阈值宜为Hb<70g/L。
9.2.2对于无出血表现的患儿,不宜给予预防性输注血小板。
9.3急性脑创伤重症
9.3.1红细胞输血阈值宜为Hb70g/L~100g/L。
9.3.2关于拟接受神经外科手术患儿的血小板输血阈值,新生儿宜为PLT<100×109/L,其他儿童宜为PLT75×109/L~100×109/L。
9.4体外膜氧合(ECMO)
宜将患儿血液指标维持在以下水平:
a)Hct30%~40%;
b)PLT>80×109/L;
c)Fib1.0g/L~1.5g/L。
9.5无生命危险的出血及失血性休克
9.5.1无生命危险的出血
9.5.1.1患儿Hb<50g/L,应给予输注红细胞。
9.5.1.2患儿Hb50g/L~70g/L,宜结合其具体病情考虑给予输注红细胞。
9.5.2失血性休克
9.5.2.1宜根据儿童患者失血性休克的救治需求,制订失血性休克儿童患者血液管理方案。
9.5.2.2对于失血性休克患儿,在获得实验室检测结果前宜考虑早期输注FFP和血小板。
对于非创伤性失血性休克患儿,红细胞和FFP的输注容量比例宜为2∶1,例如红细胞40mL/kg,FFP20mL/kg。
对于创伤性失血性休克患儿,红细胞和FFP的输注容量比例宜为1∶1,例如红细胞20mL/kg,FFP20mL/kg。
患儿初始复苏后如果仍然持续存在活动性出血,宜考虑输注血小板和冷沉淀凝血因子,其剂量为每输注40mL/kg红细胞后,输注血小板15mL/kg~20mL/kg和冷沉淀凝血因子10mL/kg。如有必要,可按照该比例重复输注血液成分,直至出血得到控制为止。
一旦获得患儿实验室检测结果,宜根据检测结果调整血液成分输注比例。输血治疗目标为Hb>80g/L、Fib>1.5g/L、PT<参考区间中点值的1.5倍、PLT>75×109/L。
在复苏过程中宜密切监测复苏是否适宜和是否存在循环超负荷。
10心脏手术患儿输血
10.1术前患者血液管理措施
10.1.1术前宜详细询问患儿病史和做体格检查,评估患儿止凝血功能障碍和贫血风险。
10.1.2宜积极治疗术前缺铁性贫血。不宜常规使用促红细胞生成素纠正术前贫血。
10.1.3对出血风险高及体外循环时间较长的患儿,宜行血管性血友病检测。必要时加做凝血因子水平检测或血栓弹力图检测等。
10.1.4宜详细了解患儿术前用药情况,对术前服用抗凝药品、抗血小板药品和其他可能影响止凝血功能药品的患儿,宜根据具体情况采取相应管理措施。
10.2术中患者血液管理措施
10.2.1外科精细止血是有效减少失血和输血的关键因素。
10.2.2对于需要体外循环的患儿,宜预防性使用抗纤溶药品,但不宜使用大剂量方案。
10.2.3减轻体外循环过程的血液稀释程度对减少异体输血至关重要。在体外循环过程中宜采取以下患者血液管理措施:
a)宜优化体外循环管路,避免血液过度稀释;在体外循环过程中,新生儿Hct宜>25%,其他 患儿Hct宜>21%;体外循环停机前,新生儿Hct宜>33%,其他患儿Hct宜>25%;
b)体外循环不宜常规预充FFP;
c)对于术前存在凝血因子缺乏的患儿,如果无相应凝血因子药品可用,且患儿抗凝血酶水平严重低下,体外循环宜预充FFP;
d)采用无血液预充时,宜使用胶体液,有助于维持患儿胶体渗透压和减少异体输血;
e)宜在体外循环中行传统超滤,或在体外循环后行5min以上的改良超滤,以提升患儿Hb水平。
10.2.4宜使用术中回收式自体输血。宜用无菌生理盐水将体外循环管路中的存留血液进行冲洗、回收,经血液回收机洗涤后回输给患儿。
10.2.5术中宜采取以下抗凝及监测措施:
a)充分的抗凝对保证体外循环期间患儿安全和避免消耗性凝血至关重要。肝素初始剂量宜为400U/kg,在体外循环过程中宜维持激活全血凝固时间>480s。对于非抗凝血酶缺乏的肝素耐药患儿,宜追加肝素100U/kg;对抗凝血酶缺乏的肝素耐药患儿,宜输注抗凝血酶药品或FFP10mL/kg;
b)在体外循环结束中和肝素时,鱼精蛋白用量与肝素总用量的比例不宜超过1∶1,首次鱼精蛋白剂量宜为总量的50%,防止过量的鱼精蛋白抑制患儿凝血和血小板功能。
10.2.6经使用鱼精蛋白拮抗后仍出血较多时,宜使用血栓弹力图评估止凝血状态,以指导治疗。
10.3术后患者血液管理措施
10.3.1红细胞输注适应证
10.3.1.1宜结合患儿疾病类型、术后临床症状和体征、实验室检查结果等综合评估是否需要输注红细胞。
10.3.1.2对于接受先天性心脏病手术的新生儿,当其术后Hb<110g/L时,宜给予输注红细胞。
10.3.1.3对于接受简单畸形心脏病手术的除新生儿以外的其他患儿,当其术后Hb<80g/L时,宜给予输注红细胞。
10.3.1.4对于接受复杂畸形心脏病(包括合并心功能不全及肺动脉高压)手术,或者接受姑息性心脏病手术的除新生儿以外的其他患儿,当其术后Hb≤100g/L时,宜给予输注红细胞。
10.3.2血小板输注适应证
体外循环结束中和肝素后,患儿出血较多,PLT<100×109/L时,宜给予输注血小板。宜及时评估患儿的血小板功能,当血小板功能低下时,宜适当提高血小板输血阈值。
10.3.3FFP输注适应证
患儿发生出血,且PT和(或)APTT>参考区间中点值的1.5倍,或INR值>1.5,或血栓弹力图提示患儿存在凝血因子缺乏时,宜给予输注FFP。
10.3.4纤维蛋白原补充适应证
患儿发生出血,且血浆Fib<1.5g/L和(或)存在纤维蛋白原功能低下时,宜给予输注冷沉淀凝血因子或纤维蛋白原药品。无冷沉淀凝血因子或纤维蛋白原药品可用时,可给予输注FFP。
10.3.5减少医源性失血
宜减少采集患儿血液标本的量和频率,采用小容量采血管、合并检测管及床旁检测。
11儿童用血需求
11.1总体需求
11.1.1为儿童患者选择更加适用的血液成分,对于输血更加安全有效是十分必要的。需要注意的是,其应用前提是不存在输血延误引发的风险,应权衡所需血液的可及性和输血的紧迫性。
11.1.2宜使用抗体筛查阴性的血液成分。
11.1.3宜使用去白细胞的血液。
11.1.4宜有儿童用血规格血液成分(例如0.5U红细胞、1U~2U浓缩血小板或0.2治疗量单采血小板、50mL血浆类成分血)可供选用。
11.1.5宜根据临床需要,附有关于血液成分的实际容量(mL)、红细胞成分血的Hb浓度和Hct、血小板成分血的血小板计数等的补充说明。
11.1.6宜提供联袋血液,为近期内需要多次输血的患儿提供来源于单个献血者的红细胞。
11.2用于换血的血液
除了符合11.1的建议以外,用于患儿换血的血液还宜符合以下建议:
a)对于ABO血型不合导致的新生儿溶血病,宜选用以O型红细胞和AB型FFP组合的血液;b)对于Rh血型不合导致的新生儿溶血病,宜选用以ABO血型与新生儿相同、Rh血型与患儿生母相同的红细胞和AB型FFP组合的血液;
c)组合血液的Hct宜为50%~60%。
11.3辐照血液
11.3.1对于具有以下任何1种病情的患儿,宜使用辐照血液。
a)接受亲属来源血液成分。
b)无输血延误风险的新生儿换血。
c)接受过宫内输血的早产儿或足月儿。
d)疑似或确诊先天性T淋巴细胞免疫缺陷的患儿。
e)接受人类白细胞抗原(HLA)配型血小板的患儿。
f)异基因HSC移植的以下情况:
1)从化放疗预处理开始至移植后6个月且淋巴细胞计数>1×109/L;
2)存在慢性移植物抗宿主病;
3)需要继续给予免疫抑制治疗。
g)自体骨髓或外周血HSC移植,从化放疗预处理开始至移植后3个月。
h)任何临床分期的霍奇金氏淋巴瘤患儿。
i)使用嘌呤类似物(氟达拉滨、克拉屈滨和脱氧助间型霉素)治疗的患儿。
11.3.2宜使用辐照后24h内的辐照血液。
11.4洗涤红细胞
11.4.1对于具有以下病情的患儿,宜使用洗涤红细胞:
a)对血浆成分过敏;
b)IgA缺乏;
c)接受者和捐献者ABO血型不相容HSC移植的血型转换期;
d)新生儿换血。
11.4.2宜选用以0.9%氯化钠溶液悬浮的洗涤红细胞。不宜选用以红细胞保存液悬浮的红细胞。
11.5新鲜红细胞
对于具有以下病情的患儿,宜使用保存时间小于7d的新鲜红细胞:
a)新生儿换血;
b)大量输血;c)存在高钾血症风险;d)地中海贫血患儿长期输血。
12血液输注与监护
12.1静脉通路
12.1.1儿科输血宜根据患儿血管条件和输注速度选择合适管径的输血导管,选择患儿表浅粗大的静脉置管。
12.1.2对于刚出生的新生儿,宜选择脐静脉置管,用于输液、输血和监测中心静脉压。当不能使用患儿脐静脉置管时,宜选用其小隐静脉置管。
12.1.3对于新生儿溶血病患儿,宜采用外周动静脉同步换血或脐静脉置管换血。
12.2过滤器和输血器
12.2.1所有血液成分输注均宜使用标准过滤器(170μm~260μm)。
12.2.2输血器的塑料管路为无效腔容量,在计算输血量时宜包括该部分容量。
12.2.3当使用生理盐水冲洗输血管路时,宜在生理盐水进入患儿体内前即停止,以减少血液稀释。
12.3输注速度与微量输血泵的使用
12.3.1宜根据患儿的耐受程度、病情需要和血液成分类型选择适宜的输注速度。在患儿发生休克、严重出血等救治需要快速输血时,应严密监护和评估患儿的心肺功能。对于存在严重贫血、心肺功能不全及循环超负荷高危患儿,应少量多次缓慢输注。
12.3.2一般情况下,红细胞输注速度为5mL/(kg·h),最大输注速度≤150mL/h,血浆、血小板和冷沉淀凝血因子的输注速度为10mL/(kg·h)~20mL/(kg·h)。输血开始15min内宜采用更加缓慢的输注速度。输注开始15min后如未出现输血不良反应,可将输注速度提高至推荐输注速度。
注:本条给出的推荐输注速度不适用于为紧急抢救、大出血、新生儿换血和接受ECMO治疗的患儿提供输血治疗等情况。
12.3.3宜使用微量输血泵控制输血量和输血速度。
12.3.4如果1袋血液的输注时间已长达4h但仍未输注完毕,此时宜停止输注并将该袋血液废弃。
12.4血液加温
新生儿换血、大量输血时宜使用血液加温仪对输注血液加温。需要注意的是,使用血液加温仪时,宜注意避免输注不畅引起血液加热过度而造成的物理溶血问题。
12.5输血监护与输血不良反应处理
12.5.1实施输血的医护人员应接受过血液成分输注和输血不良反应处理的培训,掌握WS/T624所述的输血不良反应,能发现和处理可能出现的输血不良反应。
12.5.2宜保证所有输血患儿都能受到直接观察。对不能或者难以对输血不良反应症状做沟通的新生儿和婴幼儿宜加强输血过程监护。
12.5.3对于新生儿,宜在输血前、中、后监测其血糖,必要时给予葡萄糖输注,以防止发生低血糖;宜监测血钙、血钾水平,防止发生低血钙、高血钾或低血钾。
12.5.4输血前不宜常规给患儿用药预防输血不良反应。
12.5.5对于出现轻度反应的患儿,如发热(体温≥38℃且升高1℃~2℃)和(或)瘙痒或皮疹而没有其他表现,宜暂停输血并给予适当对症治疗,如情况好转继续输血。
12.5.6对于出现严重反应的患儿应停止输血,迅速给予治疗,不应等待调查结果。
12.5.7输血依赖型地中海贫血患儿容易发生铁超载,宜予密切关注,制定和实施铁螯合治疗方案,以避免出现因铁沉积导致肝功能或心功能损害。
13输血后评价
13.1输血后,应适时综合评价输血的合理性、有效性和安全性。
13.2宜对输血决策的合理性进行回顾性评价,内容包括输血适应证、血液成分选择、输注剂量和速度等。
13.3宜评价输血是否取得预期疗效,内容包括临床评价和实验室评价两个方面。
临床评价内容主要是作为输血决策依据的临床表现是否改善。
实验室评价内容主要是作为输血决策和血液成分与剂量选择依据的血液检测指标是否改善,输注目标是否达到预期(见表5)。宜权衡实验室评价需求和患儿对医源性失血的耐受程度。
如果输血后未取得预期疗效,宜对可能影响输血疗效的因素进行全面分析和评估,内容包括输血适应证、血液成分品种、输注剂量和速度、病情变化、进一步诊疗措施(包括再次输血)等。对于疑难病例,宜组织多学科(包括输血科)专家会诊。
13.4宜对患儿输血前、中、后的生命体征变化情况,有无新的临床表现等进行分析和判断,确认患儿是否出现急性输血不良反应。
13.5宜密切关注患儿是否出现疑似迟发性输血不良反应的临床表现,以及时发现和处理。
13.6宜关注并嘱患儿监护人关注输血传播感染风险,宜在输血后3~6个月进行输血传播感染的随访检测。
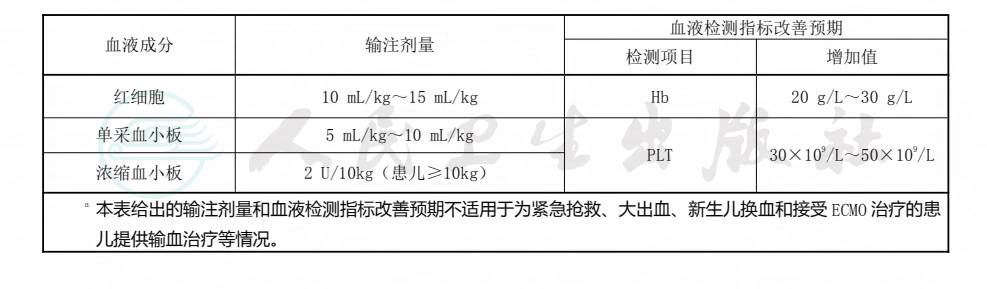
表5 一般情况患儿血液成分输注剂量及血液检测指标改善预期
WHO 出血程度分级标准(修改版)
表A.1提供了WHO出血程度分级标准(修改版)的具体内容。
表A.1 WHO 出血程度分级标准(修改版)
[1] 中华医学会儿科学分会新生儿学组,《中华儿科杂志》编辑委员会. 新生儿高胆红素血症诊
断和治疗专家共识[J]. 中华儿科杂志, 2014, 52(10): 745-748
[2] 中华医学会血液学分会血栓与止血学组. 成人原发免疫性血小板减少症诊断与治疗中国指南
(2020年版)[J]. 中华血液学杂志, 2020, 41(8): 617-623
[3] 中华医学会血液学分会血栓与止血学组. 血栓性血小板减少性紫癜诊断与治疗中国专家共识
(2012年版)[J]. 中华血液学杂志, 2012, 33(11): 983-984
[4] 中华医学会血液学分会红细胞疾病(贫血)学组.自身免疫性溶血性贫血诊断与治疗中国专家
共识(2017年版)[J].中华血液学杂志,2017,38(4): 265-267
[5] 中华医学会血液学分会血栓与止血学组, 中国血友病协作组. 血友病治疗中国指南(2020年
版)[J]. 中华血液学杂志, 2020, 41(4): 265-271
[6] 中国心胸血管麻醉学会血液管理分会. 心血管手术患者血液管理专家共识[J]. 中国输血杂
志, 2018, 31(4): 321-325
[7] 中华预防医学会出生缺陷预防与控制专业委员会新生儿筛查学组, 中国医师协会医学遗传医
师分会临床生化遗传专业委员会,中国医师协会青春期医学专业委员会临床遗传学组.葡萄糖-6-磷酸 脱氢酶缺乏症新生儿筛查、诊断和治疗专家共识[J]. 中华儿科杂志, 2017, 55(6): 411-414
[8] New HV, Berryman J, Bolton-Maggs PH, et al. Guidelines on transfusion for
fetuses, neonates and older children[J]. Br J Haematol. 2016, 175(5): 784-828
[9] New HV, Stanworth SJ, Gottstein R, et al. British Society for Haematology
Guidelines on transfusion for fetuses, neonates and older children (Br J Haematol. 2016; 175: 784-828). Addendum August 2020 [J]. Br J Haematol, 2020, 191(5):725-727
[10] Killick SB, Bown N, Cavenagh J, et al. Guidelines for the diagnosis and
management of adult aplastic anaemia[J]. Br J Haematol, 2016, 172(2): 187-207
[11] Schiffer CA, Bohlke K, Anderson KC. Platelet Transfusion for Patients with
Cancer: American Society of Clinical Oncology Clinical Practice Guideline Update
Summary[J]. J Oncol Pract, 2018, 14(2): 129-133
[12] Estcourt LJ, Birchall J, Allard S, et al. Guidelines for the use of platelet
transfusions[J]. Br J Haematol, 2017, 176(3): 365-394
[13] Padmanabhan A, Connelly-Smith L, Aqui N, et al. Guidelines on the Use of
Therapeutic Apheresis in Clinical Practice - Evidence-Based Approach from the Writing Committee of the American Society for Apheresis: The Eighth Special Issue[J]. J Clin
Apher, 2019;34(3): 171-354
[14] Valentine SL, Bembea MM, Muszynski JA, et al. Consensus recommendations for RBC
transfusion practice in critically ill children from the pediatric critical care transfusion and anemia expertise initiative[J]. Pediatr Crit Care Med, 2018, 19(9): 884-
898
[15] Faraoni D, Meier J, New HV, et al. Patient Blood Management for Neonates and
Children Undergoing Cardiac Surgery: 2019 NATA Guidelines [J]. J Cardiothor Vasc An, 2019, 33(12):3249-3263
[16] Foukaneli T, Kerr P, Bolton-Maggs PH, et al. Guidelines on the use of
irradiated blood components[J]. Br J Haematol, 2020, 191(5): 704-724
[17] Kirpalani H, Bell EF, Hintz SR, et al. Higher or Lower Hemoglobin Transfusion
Thresholds for Preterm Infants[J]. New Engl J Med, 2020, 383(27): 2639-2651
[18] Franz AR, Engel C, Bassler D, et al. Effects of Liberal vs Restrictive Transfusion Thresholds on Survival and Neurocognitive Outcomes in Extremely Low-Birth-
Weight Infants: The ETTNO Randomized Clinical Trial[J]. JAMA, 2020, 324(6): 560-570
13
[19] Curley A, Stanworth SJ, Willoughby K, et al. Randomized trial of platelet
transfusion thresholds in neonates[J]. New Engl J Med, 2019, 380(3): 242-251
[20] Karam O , Nellis ME. Transfusion management for children supported by
extracorporeal membrane oxygenation[J]. Transfusion, 2021, 61(3): 660-664
[21] Cohn CS, Delaney M, Johnson ST, et al. Technical Manual (AABB), 20th Edition[M].
Bethesda: American Association of Blood Banks, 2020: 771
[22] Cappellini MD, Farmakis D, Porter J, et al. 2021 Guidelines for the management of transfusion dependent thalassaemia (TDT). 4th ed. [M/OL]. Cyprus: Thalassaemia
International Federation, 2021: 51. [2021-08-06]. https://thalassaemia.org.cy/wp- content/uploads/2021/06/GUIDELINE-4th-DIGITAL-BY-PAGE.pdf
[23] Taher A, Musallam K, Cappellini MD. Guidelines for the Management of Non Transfusion Dependent Thalassaemia (NTDT). 2nd ed. [M/OL]. Cyprus: Thalassaemia
International Federation, 2017: 17-18. [2021-08-06].https://thalassaemia.org.cy/wp- content/uploads/2017/10/NTDT-final-combined-1.pdf
[24] The C17 Guidelines Committee. Guideline for platelet transfusion thresholds for pediatric hematology/oncology patients[M/OL]. Edmonton: C17 Council, 2011: 4. [2021-08-06]. http://www.c17.ca/application/files/6916/2006/0819/C17_Platelet_Guideline_English_Complete_2011.pdf