 去看看
去看看


一、概述
胸膜肺母细胞瘤(pleuropulmonary blastoma,PPB)是一种罕见的、具有侵袭性的儿童肺部恶性肿瘤,常累及胸膜和肺,有家族发病倾向。PPB发病率为0.35/10万~0.65/10万,约占儿童原发肺肿瘤的15%,绝大多数患儿发病年龄均<6岁,>12岁的儿童发病较为少见。PPB的发病率低,临床表现缺乏特异性,影像学表现不典型,难以与先天性肺囊性病区分,PPB的漏诊率、误诊率均较高。按病理类型PPB可分为3种,分别是Ⅰ型(囊性)、Ⅱ型(囊实性)和Ⅲ型(实性),Ⅰr型为Ⅰ型PPB的一种特殊类型。近年来研究发现并证实,PPB的发生与DICER1基因突变有关,PPB是DICER1胸膜肺母细胞瘤家族性肿瘤易感综合征的标志性疾病之一。PPB的治疗方法包括手术、化疗和(或)放射治疗。PPB的预后与病理类型、是否转移或播散、肿瘤能否完全切除有关。
二、适用范围
根据临床表现、影像学检查及病理检查确诊为胸膜肺母细胞瘤的初诊患儿。
三、诊断
胸膜肺母细胞瘤诊治需要具备儿童肿瘤诊断能力的影像科、病理科、胸外科、肿瘤内科多学科协作。
(一)临床表现
PPB的临床表现无特异性,患儿绝大多数6岁以内发病,平均3.2岁,男女发病率无明显差异。
1. 患儿表现为乏力、咳嗽、气促、发热、胸痛等症状,抗感染治疗效果差。伴或不伴气胸、胸腔积脓或胸腔积液。PPB多发生在肺周边或胸膜,较晚出现呼吸困难等肿瘤压迫症状。晚期可有食欲不振,不明原因体重减轻表现。
2. 约25%的PPB患儿及家族有肿瘤或发育异常,囊性肾瘤最常见,其他PPB相关肿瘤还有家族肺囊肿、甲状腺肿瘤、胚胎性肿瘤(肉瘤、髓母细胞瘤、恶性生殖细胞瘤)、肾母细胞瘤等。
3. PPB在确诊时发生远处转移比较罕见,通常是在复发时合并有远处转移,I型发生远处转移罕见,大脑和骨骼是Ⅱ、Ⅲ型经血转移常见部位,发生转移的概率达30%,可出现头痛,骨痛等表现。
(二)辅助检查
1. 常规及脏器功能检查
(1) 血常规检查:了解有无贫血及血小板减少。
(2) 生化检查:肝肾功能、乳酸脱氢酶(LDH)、电解质是必查项目。肿瘤负荷大的患儿可出现血尿酸及LDH增高。
(3) 心电图及心脏彩超检查:评估心脏功能情况。
(4) 凝血功能:治疗前了解患儿出凝血功能,了解有无出血及血栓。
2. 影像学检查
(1) 原发部位:包括胸片、胸部增强CT,有条件可以做PET-CT,其他检查包括支气管镜和胸腔镜检查。肿瘤多位于肺的周边,胸膜,也可以位于心脏、主动脉、肺动脉或隔膜间的肺组织。CT表现为肺部单发的巨大单囊或多囊性肿物,也可表现囊实性混合性肿物或实性肿物,与肿瘤病理类型有关。囊实性肿瘤表现为巨大多囊肿物,壁厚,形态与先天性肺囊肿相似。肿物密度多均匀,边缘较清楚,体积较大,可有假包膜,肿物一般不与支气管相通,少数有肺不张,肺门淋巴结肿大者少见。少数表现为单个结节或小肿块迅速增大,肿块巨大时可侵占半侧胸部。常伴有中心坏死引起的低密度区,有些巨大肿瘤形似脓胸,但钙化少见。有的向纵隔内生长易误诊为纵隔肿瘤。
(2) 转移病变:Ⅱ、Ⅲ型PPB可以远处转移至脑和骨骼。头颅MRI检查了解有无颅内转移;若患儿全身肢体疼痛症状明显,有条件者可行放射性核素骨扫描以评估全身骨骼是否存在骨骼转移。
3. DICER1基因检测
本病存在家族性遗传基因缺陷,部分患者可以检测到DICER1基因突变。检测DICER1基因突变有利于提高家族DICER1基因综合症以及PPB诊断的准确性。有DICER1基因突变的患儿或有家族癌症综合征者需要高度警惕,并坚持长期随访。
4. 其他
(1) 脑脊液检查:对于怀疑有中枢神经系统转移的患儿应做脑脊液检查,行脑脊液组织病理检测了解有无肿瘤细胞。
(2) 骨髓检查:当患儿出现血细胞改变,和/或影像学检查提示骨髓侵犯时,建议行骨髓常规、骨髓活检及染色体核型分析检查协诊。
(三)病理
通过穿刺或切除活检、根治术等方法获得病理组织标本。病理检查的方法有冰冻切片、印片、石蜡包埋切片HE染色。基本组织病理学检查主要包括组织形态、免疫细胞化学、光学和电子显微镜、细胞遗传学、分子生物学等检查。
1. 组织形态学
肿块病理或活检组织结构见分化较差的小圆细胞、梭形细胞,间质成分含横纹肌母细胞、成熟或不成熟软骨小岛,腺管分化良好。根据大体标本和镜下特点将PPB分为3型。Ⅰ型PPB为囊肿型,纯囊性病变。肿瘤大体观囊性,壁薄,部分囊壁区域可增厚,镜下病变区与正常肺实质的分界是由末端细支气管或肺泡管扩张为囊状而形成。有透明变性的纤维间隔构成“隔膜”为其病变的特征,囊壁内衬良性立方上皮或假复层纤毛柱状上皮,上皮下可见原始间叶细胞,部分区域仍可见分化良好或正在分化的软骨结节。PPB国际研究组织的病理学家发现还有一种新的类型Ir型,即I型退化型或静止型,指囊样变有自然退化倾向。Ⅱ型PPB为囊、实性病变。镜下囊性表现同Ⅰ型,实性同Ⅲ型,肿瘤有原始胚芽,或梭形恶性细胞在囊壁上斑片状或结节状增生,或上皮内存在横纹肌肉瘤样细胞。Ⅲ型为实性病变。显微镜下全部为胚胎性间叶成分。
2. 免疫组织化学染色
PPB目前无特异性免疫组化指标,代表间叶组织或细胞分化的标记物波形蛋白(vimentin)大部分阳性,并根据分化不同免疫组化表达不同,向横纹肌分化的区域肌原调节蛋白(MyoD1)、肌特异性肌动蛋白(MSA)、平滑肌肌动蛋白(SMA)、肌细胞生成素(MyoG)可表达阳性。上皮膜抗原(EMA)、突触素(Syn)、嗜铬素(CgA)、甲胎蛋白(AFP)阴性。
(四)鉴别诊断
Ⅰ型PPB需与支气管源性囊肿、IV型肺先天性囊性腺瘤样畸形(CPAM)相鉴别;Ⅱ型和Ⅲ型胸膜肺母细胞瘤由于有恶性梭形细胞成分存在,鉴别诊断包括横纹肌肉瘤,尤文肉瘤,畸胎瘤,滑膜肉瘤,其他的梭形细胞/未分化细胞肉瘤,以及肺母细胞瘤;由于存在原始胚芽,鉴别诊断包括转移的肾母细胞瘤。原发于胸腔的横纹肌肉瘤需要和PPB相鉴别,PAX3-FOXO1是由染色体易位t(2;13)(q35;q14)产生的特征性融合基因,存在于约60%的腺泡型横纹肌肉瘤患者中,可以用于和PPB的鉴别诊断。
四、治疗
胸膜肺母细胞瘤是一种恶性程度高的高侵袭性肿瘤,目前国际上治疗PPB为手术、化疗和(或)放疗综合治疗。
本规范重点参考COG、SIOP方案和CCCG方案,提供的以下治疗方案各医院根据各自情况选择应用,部分病人可结合所在医院实际情况适当改良。特殊治疗措施的选择以及适应证建议参考《中国儿童胸膜肺母细胞瘤诊疗建议》相关细则(中国小儿血液与肿瘤杂志2018年第23卷第5期)。
(一)治疗原则
1.肿瘤能基本完全切除者先手术;完全切除困难者仅活检,明确诊断后先化疗再手术。I型以手术为主,如果化疗,建议方案VAC(长春新碱+放线菌素D+环磷酰胺)。II型和III型应用国际胸膜肺母细胞瘤推荐方案,II和III型术后需要化疗,化疗方案以IVADo(异环磷酰胺+长春新碱+放线菌素D+阿霉素)为主,必要时需要二次或三次手术探查。
2.如诊断初没有手术,争取第2~4疗程后手术治疗。如果9~10个疗程后局部仍然有残留病灶,建议二次手术或局部放疗;如30周评估无影像学残留,即处于CR(完全缓解、无瘤状态),可停化疗。总疗程数不超过12个。
(二)手术
外科手术是治疗PPB的重要方法。PPB是一种高侵袭性恶性肿瘤,一旦确诊应早期切除肿瘤。最好能做完整的肿瘤切除或仅有镜下残留,对于肿瘤巨大无法完整切除的患儿,可行穿刺活检或手术活检,明确病理后可经化疗2~4疗程后使肿瘤缩小,再进行根治性手术。
术中需要保护好肿瘤周围重要组织、血管及神经,注意周围肺、胸膜、膈肌处是否有转移瘤组织。目前手术方式仍然有一定的争议,常见的手术方式有根据病变范围,选择囊切除、肺段切除、肺叶切除或全肺切除等。但并没有这些手术方式与预后的相关研究。因术前Ⅰ型或II型PPB易与先天性肺囊性病相混淆,如先天性肺气道畸形、隔离肺、肺囊肿等,所以有些PPB术前容易误诊,故手术过程中一般不会选择肿瘤的扩大手术切除原则。目前没有术前误诊的PPB,待病理回归后需做二次根治性手术的报道。但术前即怀疑PPB病例,手术时应尽量选择病变肺叶的完整切除。
(三)化疗
1. 化疗药物
常用的化疗药物主要有长春新碱、环磷酰胺、异环磷酰胺、放线菌素D、阿霉素等。
2. 初始化疗前准备
(1) 病史需包括:过去健康状况、家族中肿瘤性疾病史等。
(2) 专科体检:如呼吸次数节律、皮肤、黏膜、骨骼、肝、脾、淋巴结大小,胸部异常体征等。
(3) 实验室检查:诊断时的血常规,包括白细胞及血小板计数,血红蛋白,骨髓检查,血液生化检查:肝功能(丙氨酸转氨酶、直接胆红素)及输血前检查:乙肝五项、丙肝抗体、梅毒、艾滋病病毒检查;肾功能(尿素氮、肌酐、尿酸);电解质;乳酸脱氢酶;凝血功能;心脏功能检查:心电图、心脏彩超、心肌酶测定;PPD。
(4) 影像学检查:胸部X正侧位片、CT、MRI,腹部B超、颈部B超及瘤灶部位区域淋巴结B超检查,头颅MRI等。怀疑有骨转移的行骨扫描检查。有条件的单位可做PET-CT 评估瘤灶情况。
(5) 其他:对患儿进行营养状态及体能状态评估,积极改善机体状况。化疗前行PICC置管或植入输液港。积极清除感染和潜伏感染灶如龋齿等。病情解释及心理疏导。
3. 化疗方案
(1) Ⅰ型PPB治疗方案。VAC(长春新碱+放线菌素D+环磷酰胺):长春新碱1.5mg/m2(最大剂量2mg),第1、8、15天;放线菌素D 1.5mg/m2(最大剂量2.5mg),第1天;环磷酰胺1.2 g/m2,第1天(美司纳360mg/(m2·次),CTX 0、3、6、9h)。
(2) Ⅱ和Ⅲ型PPB治疗方案。
IVADo(异环磷酰胺+长春新碱+放线菌素D+阿霉素):长春新碱1.5mg/m2(最大剂量2mg),第1、8、15天;放线菌素D1.5mg/m2(最大剂量2.5mg),第1天;阿霉素30mg/(m2·d),第1~2天;异环磷酰胺3g/(m2·d),第1~2天(美司纳600mg/(m2·次),IFO 0、3、6、9 h)。
IVA(异环磷酰胺+长春新碱+放线菌素 D):长春新碱1.5 mg/m2(最大剂量2mg),第1天;放线菌素D1.5mg/m²(最大剂量2.5mg),第1天;异环磷酰胺3g/(m2·d),第1天(美司纳600mg/(m2·次),IFO 0、3、6、9h)。
(四)放疗
目前没有针对性的临床研究或较大宗的病例报告支持PPB放射治疗的有效性。但如果化疗和手术切除后仍然有无法切除的残余原发瘤灶,建议遵循肺实质辐射的参考剂量,可局部放疗。病灶局部调强剂量一般为25Gy。建议放疗时间在化疗后8疗程后,放疗期间停用放线菌素D。
五、药物毒性及辅助治疗
化疗药物毒性主要表现在血液、心、肺、肝、肾和神经系统等,联合用药时应注意加强对肿瘤细胞的杀伤力而不增加药物的毒性作用。在用药过程中,除注意防治水和电解质紊乱,纠正贫血,控制和避免交叉感染外,并根据化疗药物急性及亚急性毒性反应,如骨髓抑制及胃肠道反应等,加强支持和对症治疗。有的药物还有特异性副作用,如长春新碱可引起肠麻痹和便秘,阿霉素可引起心脏损害,均须注意监测和预防。
(一)肾脏毒性
出血性膀胱炎(hemorrhagic cystitis,HC):可由放疗、化疗以及感染引起。化疗药物中IFO、CTX均可引起出血性膀胱炎。其特征为弥漫性膀胱黏膜炎症伴出血,累及整个膀胱。出血量可从极少(尿液显微镜检查中发现每高倍镜视野可见5~50个红细胞)至大量(需要输血以维持血红蛋白水平),患儿可能出现尿急、尿频及尿少,以及排尿时烧灼痛。常见耻骨弓上疼痛。HC患儿膀胱的容量受影响。化疗期间必须每天监测尿常规(有无血尿)。美司钠对于预防发生HC非常有效,同时应用IFO或CTX期间充分给予水化碱化液静点,以预防破碎红细胞堵塞肾小管而造成肾脏不可逆的损害。然而,一旦确定为出血性膀胱炎,治疗方式取决于血尿的严重程度(表1)。
(二)心脏毒性
主要指蒽环类药物的心脏毒性,包括急性心肌损伤和慢性心功能损害。前者为短暂而可逆的心肌局部缺血,可表现为心慌、气短、胸闷、心前区不适等;后者为不可逆的充血性心力衰竭,与药物累积剂量相关。一旦心功能检测提示心脏射血分数<55%或轴缩短分数<28%,若能证明左心功能异常和细菌感染有关,可以继续使用蒽环类药物,否则应该暂停,直到射血分数≥55%或轴缩短分数≥28%。根据蒽环类药物使用剂量或心肌损伤程度选择右丙亚胺(Zinecard),左旋肉碱、能量合剂等药物。
(三)肝脏毒性
治疗过程中根据临床情况检查肝功能,不宜过度频繁。每个疗程前一般需要检查肝功能以确定是否可以按时化疗。ALT、AST 达正常高限10 倍或以上时可延缓化疗,一周后仍有异常者可以在严密观察下化疗。
(四)神经毒性
1. 长春新碱:单次剂量不得超过2mg。常见的轻度毒性有肢体疼痛、便秘、深反射减弱。如果有持续存在的腹绞痛、步态不稳、严重的疼痛或抗利尿激素尿激素异常分泌(SIADH)等明显的中毒表现者应停药或减量应用。
2. 异环磷酰胺:可出现中枢神经系统毒性,主要表现为感觉异常、振动感减弱、肢体麻木、刺痛、步态失调、共济失调、嗜睡、精神异常等。
(五)复方新诺明(SMZco)
预防卡氏肺囊虫感染。建议长期服用SMZco预防卡氏肺囊虫感染,25mg/(kg·d),分两次,最大剂量每次0.5g,bid,每周3d。直至化疗结束后3个月。
(六)血液副作用
1. 贫血:一般可以通过输注红细胞缓解贫血,血红蛋白60g/L以下必须输注。
2. 血小板减少:血小板计数<20×109/L时应输注血小板,伴有明显出血症状或感染表现时输注指征可适当放宽。
3. 中性粒细胞缺乏:对预期会出现较长时间粒细胞缺乏者可以使用粒细胞集落刺激因子。
以上化疗药物毒性分级标准详见附表2。
六、疗效评价标准和随访
(一)治疗中评估时间
治疗中间隔2~4疗程评估,评估内容为原发瘤灶及转移瘤灶大小,复查局部B超和增强CT。治疗结束前也要评估瘤灶局部B超和增强CT或磁共振。
(二)瘤灶评估标准
1. 完全有效(complete response,CR):肿瘤完全消失。根据治疗情况,CR可以通过5种方式实现:①辅助化疗后(少见);②辅助化疗和延迟初次手术后(常见);③辅助化疗、手术后需要辅助化疗(最常见);④诊断初手术完全切除(少见);⑤诊断初手术完全切除和辅助化疗(常见)。
2. 部分有效(partial response,PR):肿瘤平均体积缩小65%,没有新的病灶。
3. 肿瘤进展(progressive disease,PD):出现新的病灶或原肿瘤增大。与治疗始相比肿瘤体积至少增加40%。4.肿瘤稳定(stable disease,SD):介于PR和PD之间。符合此标准的须相隔6周再评价。
(三)治疗结束后随访时间点
第1年,间隔3个月体格检查、血常规、血生化以及原发瘤灶的影像学检查。第2~4年,间隔4~6个月体格检查、血常规、血生化以及原发瘤灶的影像学检查。第5~10年,每年进行体格检查、血常规、血生化和生长发育状况调查。10年后,尽可能每年复诊或电话随访患儿结婚生育、第二肿瘤状况等。
七、转诊条件
(一)适用对象
1. 存在以下可疑胸膜肺母细胞瘤的初诊患儿:对于年龄<6岁,胸部CT表现为肺部巨大团块,伴有胸水,抗感染治疗无效。
2. 病理确诊的胸膜肺母细胞瘤。
(二)转诊标准
1. Ⅰ级转诊:症状及影像学怀疑胸膜肺母细胞瘤,如具有以下条件之一,则建议由县级医院转至上级医院或肿瘤专科医院。
(1) 医院不具备进行B超、核磁、CT等影像检查条件者。
(2) 初步检查高度怀疑此类诊断,但医院不具备进行肿物穿刺、手术活检条件者。
(3) 医院不具备病理诊断条件者。
(4) 医院无儿童肿瘤治疗经验者。
2. Ⅱ级转诊:符合以下条件之一者建议转诊至具有儿童肿瘤专科的省或有条件的地市级医院。
(1) 经就诊医院完成影像检查、活检等进一步检查仍无法明确诊断者(如当地多家医院病理会诊不一致或当地病理科无法确定诊断)。
(2) 当地医院无法完成肿瘤切除复杂手术者。
(3) 出现肿瘤或治疗相关严重并发症,而当地医院无相关治疗经验者。
3. 如具有以下条件之一,则建议由省、市级医院转诊至具有儿童肿瘤诊疗条件的当地医院或肿瘤专科医院。
(1) 已在省市级医院明确诊断、分型,及制定出治疗方案患者,但是,因无儿童患者化疗或手术等条件,不能实施后续治疗,可转诊至具有儿童肿瘤诊疗条件的当地医院继续完成后续治疗、评估、随访。
(2) 已在省市级医院完成复杂肿瘤切除手术、放疗、严重并发症得到控制,但是,因无儿童患者化疗条件,不能实施后续治疗,可转诊至具有儿童肿瘤诊疗条件的当地医院继续完成后续治疗、评估、随访。
(三)不纳入转诊标准
(1) 已明确诊断,且符合转诊标准,但已参加胸膜肺母细胞瘤相关临床研究者。
(2) 患儿符合转诊标准,但已因肿瘤进展、复发、肿瘤和(或)治疗相关并发症等原因出现生命体征不稳定,长途转运存在生命危险者。
(3) 就诊的医院不具备影像检查、病理诊断、手术、化疗或放疗等技术条件,但同级其他医院可进行者。
(4) 经转诊的双方医院评估,无法接受转诊患儿进一步诊疗者。
八、附表
表1.出血性膀胱炎的分级与治疗
表2.化疗药物(血液、胃肠肝、肾肺心、脑、神经、听力)毒性反应分级标准
表1 出血性膀胱炎的分级与治疗
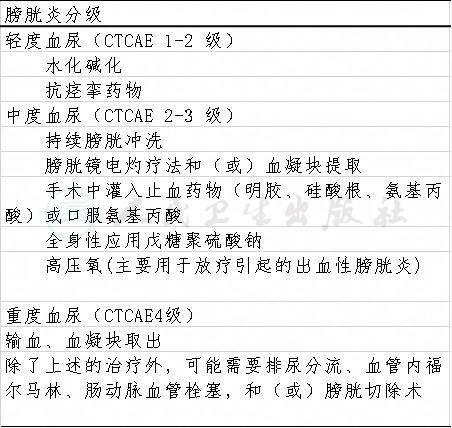
CTCAE:Common Terminology Criteria for Adverse Events
表2 化疗药物(血液、胃肠肝、肾肺心、脑、神经、听力)毒性反应分级标准
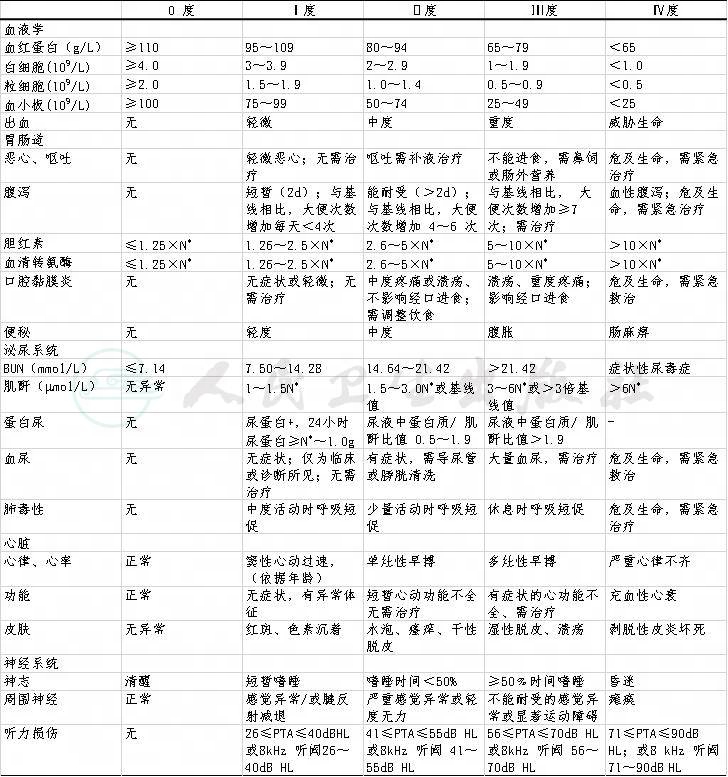
注:以CTCAE5.0版为参考标准;N*=正常值上限;PTA:(0.5~4 kHz);平均听阈(dB HL)