 去看看
去看看


手术部位感染作为外科手术的主要并发症之一,亦是院内感染的常见类型,其发病率仅次于下呼吸道感染、上呼吸道感染及泌尿系感染[1]。随着微创医学的进展,腹腔镜手术已逐渐成为胃肠道、肝胆胰腺等消化系统疾病的主要外科干预措施,手术部位感染也因切口缩小而获得良好控制,然而手术本身对机体造成的损伤无可避免,仍将受到肠道黏膜屏障通透性改变与微生态环境紊乱等内源性因素负面影响[2-3]。本研究旨在探讨肝胆胰腺手术部位感染患者病原谱,并筛选出影响其易感性的高危因素,现报道如下。
1 资料与方法
1.1 临床资料 选择2017年1—12月在本院做肝胆胰腺外科手术的128例患者临床资料进行回顾性分析。纳入标准:①符合肝胆胰腺疾病相关诊断标准和腹腔镜手术相关治疗指征[4];②年龄≥18岁;③临床资料完整。排除标准:①术后伴发呼吸道、泌尿系等其他部位院内感染;②合并凝血功能障碍、导管过敏及上腔静脉压迫综合征;③切口出现积液、裂开等愈合不良表现;④病原学检测诊断为真菌、病毒、寄生虫等其他病原体引发手术部位感染。根据是否存在感染分为感染组34例与对照组94例。
1.2 方法 术后3d内采集患者血液与引流液,接种培养基后应用全自动培养仪处理24h,所得菌落涂片镜检确认为细菌标本后,转入全自动微生物鉴定仪进行菌种鉴别,同时有2份体液样品检出同一种病原菌阳性方可予以确诊。对下列资料进行回顾统计:①基线资料:性别、年龄、体重指数、合并糖尿病、腹部手术史;②围术期基本情况:术前贫血、术前感染、术前肝功能异常、手术部位、切口类型、手术时间、术中失血量、引流管留置时间、除感染外并发症;③护理因素:术前预用抗生素、术后营养干预、术后换敷料时间。
1.3 统计学处理 通过统计学软件SPSS19.0进行相关数据录入与分析,分类变量以百分率(%)描述,组间比较采取χ2检验,检验结果作为单因素分析初筛结论,变量筛选检验水准设置为α=0.05,将符合条件(P<0.05)的变量纳入多因素logistic多元回归分析,均以P<0.05为差异有显著性。
2 结果
2.1 肝胆胰腺手术部位感染病原菌分布特点 感染组34例患者经体液标本培养共检测出44株病原菌,其中革兰氏阴性菌29株(65.91%):包括大肠埃希菌10株(22.73%),铜绿假单胞菌8株(18.18%),肺炎克雷伯菌7株(15.91%),阴沟肠杆菌3株(6.82%),嗜麦芽寡养单胞菌1株(2.27%);革兰氏阳性菌15株(34.09%):溶血葡萄球菌5株(11.36%),表皮葡萄球菌3株(6.82%)。
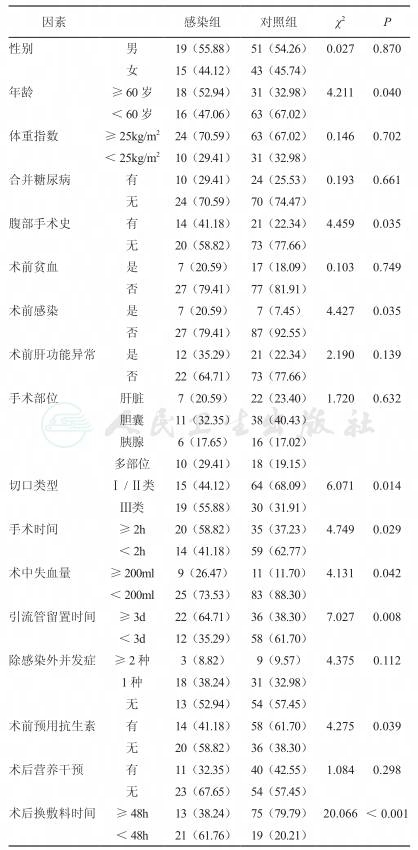
2.2 影响肝胆胰腺手术部位感染的单因素比较 两组性别、体重指数、合并糖尿病、术前贫血、术前肝功能异常、手术部位、除感染外并发症、术后营养干预比较,差异均无显著性(P>0.05);而年龄、腹部手术史、术前感染、切口类型、手术时间、术中失血量、引流管留置时间、术前预用抗生素及术后换敷料时间差异有显著性(P<0.05),见表1。
表1 影响肝胆胰腺手术部位感染的单因素比较[例(%)]
2.3 影响肝胆胰腺手术部位感染的logistic多元回归分析 logistic多元回归分析结果显示,有腹部手术史、有术前感染、手术时间≥2h及术后换敷料时间≥48h均是导致肝胆胰腺手术部位感染的独立危险因素(P<0.05),见表2。
表2 影响肝胆胰腺手术部位感染的logistic多元回归分析

3 讨论
因解剖位置特殊,肝胆胰腺疾病的外科治疗极易对胃肠道造成不良影响,造成定植的内源性条件致病菌发生移位而触发感染[5-7]。据相关文献报道,Ⅰ类切口感染多为病房空气、物体表面及医护人员手接触等外源性因素导致的浅表组织感染,其病原菌主要为凝固酶阴性葡萄球菌,而Ⅱ、Ⅲ类切口感染则多因消化道手术中保护措施失效而致使胃肠内容物或腹腔脓性渗液污染引起,其病原菌则以革兰氏阴性菌为主[8-9]。本研究肝胆胰腺手术感染病原菌分布特征与多数研究结论相符,主要由大肠埃希菌、铜绿假单胞菌、肺炎克雷伯菌等革兰氏阴性菌构成,可能与肝胆胰腺手术引起患者机体免疫功能异常与肠道定植菌群分布与位置紊乱有关,此外还囊括少量以金黄色葡萄球菌为主的革兰氏阳性菌,可能与引流顺畅度欠佳或无菌措施不到位引起的外源性逆行感染有关。
术前感染是独立于手术过程或术后引流操作的外源性病原菌感染因素,既可作为肝胆胰腺疾病的诱因,又能为术后二次感染提供病原菌来源[10]。相关研究表明,既往存在腹部手术史患者多伴有腹腔粘连,增大手术难度,不仅可扩大创伤面积,还将显著延长切口暴露时间,甚至阻碍术后引流液排出,可为病原菌移位于感染受累部位扩大创造有利条件[11]。本研究结果显示,腹部手术史与术前感染情况均能对肝胆胰腺手术部位感染产生独立影响,提示临床不应局限于研讨原发疾病的治疗策略而忽视患者术前的病原菌检测工作,针对有腹腔手术史的患者需尽可能通过科内会诊优化手术操作细节,减少对术区的损害,并缩短手术时间,可一定程度降低手术部位感染风险。
手术期间切口附近组织因张力增大显著而更易受到缺血缺氧性损伤,术后愈合效果可受到影响[12]。人工气腹导致脏器与皮肤血液循环效率下降,可导致机体大量丢失补体、抗体等具备免疫功能的物质,抗感染与自我修复能力骤减,且肝胆外科手术多涉及胆道或上消化道切开、切除或重建,随手术持续时间增加,切口暴露于污染物机会增大,对其洁净度可造成极大负面影响[13]。本研究中,手术时间≥2h是引起肝胆胰腺手术部位感染的高危因素,表明尽量提升术者熟练度、缩短手术时间能有效避免术后发生手术部位感染。
手术切口在缝合后24h内开始形成上皮组织,由于该时期同属细菌定植感染的高危窗口期,以无菌敷料覆盖是临床公认减少感染风险的必要措施[14]。密切观察手术切口,确保切口及其周围组织的干燥与清洁,不仅能及时发现早期感染症状,更便于采取相应处理措施加以控制,还能通过维持对切口愈合有利环境,加快患者术后恢复[15-17]。
综上所述,肝胆胰腺手术部位感染病原菌主要是由大肠埃希菌为代表的革兰氏阴性菌,有腹部手术史、有术前感染、手术时间≥2h及术后换敷料时间≥48h均是促使其发生的独立危险因素。
[1]侯铁英,姚亚男,刘胜男,等.手术部位感染预防与控制研究进展[J].中国感染控制杂志,2015,14(8):561-564.
[2]刘庆滨,孟祥彩,陈艳昕.胃肠外科患者手术切口感染因素分析及预防对策[J].解放军预防医学杂志,2018,36(5):595-597.
[3]郭世洲,黄贵儒,陈兵.腹腔镜胃癌根治术患者术后感染的危险因素分析[J].癌症进展,2019,17(2):190-193.
[4]黄志强,黄晓强.肝胆胰外科聚焦[M].北京:人民军医出版社,2005:13-22.
[5]吴兰梅.肝胆胰腺外科手术部位感染相关危险因素分析[J].医学临床研究,2017,34(10):2034-2035.
[6]刘驰,曾峰,倪猛,等.肝胆外科患者手术部位感染的危险因素分析与预防[J].中华医院感染学杂志,2016,26(14):3258-3260.
[7]鲍继锋,鲍星,吴哲高.肝胆外科患者术后感染的病原菌分布与耐药性分析[J].中华医院感染学杂志,2015,25(15):3431-3433.
[8]彭祥旺,曹繁,谢辉.急诊外科手术创口感染的临床病因及预防措施[J].中国医刊,2014,49(12):88-89.
[9]兰戴天,李茂德,安崇贵,等.肝胆胰外科大肠埃希菌感染的临床特征与耐药性分析[J].中华医院感染学杂志,2016,26(17):4011-4013.
[10]冯爱军,刘艳芹.肝胆胰腺手术患者术后发生手术部位感染相关危险因素的多因素logistic回归分析[J].中国普外基础与临床杂志,2016,23(6):706-709.
[11]黄天从,王高雄,李新丰,等.肝胆外科患者手术部位感染病原菌分布与危险因素分析[J].中华医院感染学杂志,2015,25(22):5114-5116.
[12]马锐,陈建常,张春浩,等.手术部位感染主要相关因素研究进展[J].中华医院感染学杂志,2014,24(9):2338-2340.
[13]吴康,鲁信军,阮英俊.头孢替安在直肠癌根治术后切口感染预防中的应用效果分析[J].中国临床医生杂志,2019,47(1):76-78.
[14]林晨曦,赵心懋,吴华,等.肝胆胰腺外科手术部位感染相关危险因素研究[J].中国感染控制杂志,2014,13(10):584-587.
[15]肖衡,谭立新,陈荣,等.头孢西丁不同输注方案预防复杂性肛瘘术后感染临床效果的对比研究[J].中国医药,2019,14(10):1535-1538.
[16]郝东侠,王彦宏,王旭东.医院获得性耐碳青霉烯肺炎克雷伯杆菌感染的特点、危险因素分析及预后[J].中国临床医生杂志,2019,47(5):522-525.
[17]王娟,刘珍,郑翠芬,等.肝胆胰腺患者手术部位感染的危险因素分析[J].中华医院感染学杂志,2016,26(15):3470-3472.