 去看看
去看看


神经系统具有通过电化学活动传递信息的独特功能,意识状态改变时(例如昏迷、麻醉),可以通过监测电化学活动评估神经系统的功能状态。然而,传统的生理监测(例如血压和血氧)仅能作为反映神经系统功能状态的间接参数。术中神经生理学监测虽然不能取代唤醒试验,但可以发现那些改变神经功能的手术操作或生理学内环境变化,监测处于危险状态的神经系统功能,了解神经传递过程中电生理信号的变化,从而帮助手术医师及时、全面的判断麻醉状态下患者神经功能的完整性,提高手术操作者的术中决策力并最终降低手术致残率。除了手术因素,生理学管理和麻醉药物的选择也会影响神经元功能。我们应当重视所有团队成员(例如外科医师,麻醉医师和神经电生理监测医师)的努力。
目前,神经外科手术中常见的电生理监测技术包括:躯体感觉诱发电位(somatosensory evoked potentials,SSEP),运动诱发电位(motor evoked potentials, MEP),脑干听觉诱发电位(auditory brainstem responses,ABRs),肌电图(electromyography,EMG)和脑电图(electroencephalogram, EEG)等。
一、躯体感觉诱发电位
刺激外周神经引发的感觉冲动经脊髓上传至大脑,在整个传导通路上的不同部位放置记录电极,所记录的神经传导信号经监测仪信号放大器放大后的波形就是SSEP。SSEP头皮记录电极的放置基于10-20国际脑电图电极放置系统进行定位(见附图7-1)。
(一)SSEP监测在神经外科术中的应用
术中SSEP监测被广泛应用于多种手术中:
1.脊柱融合术;
2.脊髓肿瘤切除术;
3.动静脉畸形切除术;
4.胸腹动脉瘤修补;
5.颅内肿瘤切除术;
6.颈动脉内膜剥脱术;
7.颅内动脉瘤夹毕术;
8.术中感觉皮层的定位。
(二)术中SSEP波形释义和监测预警
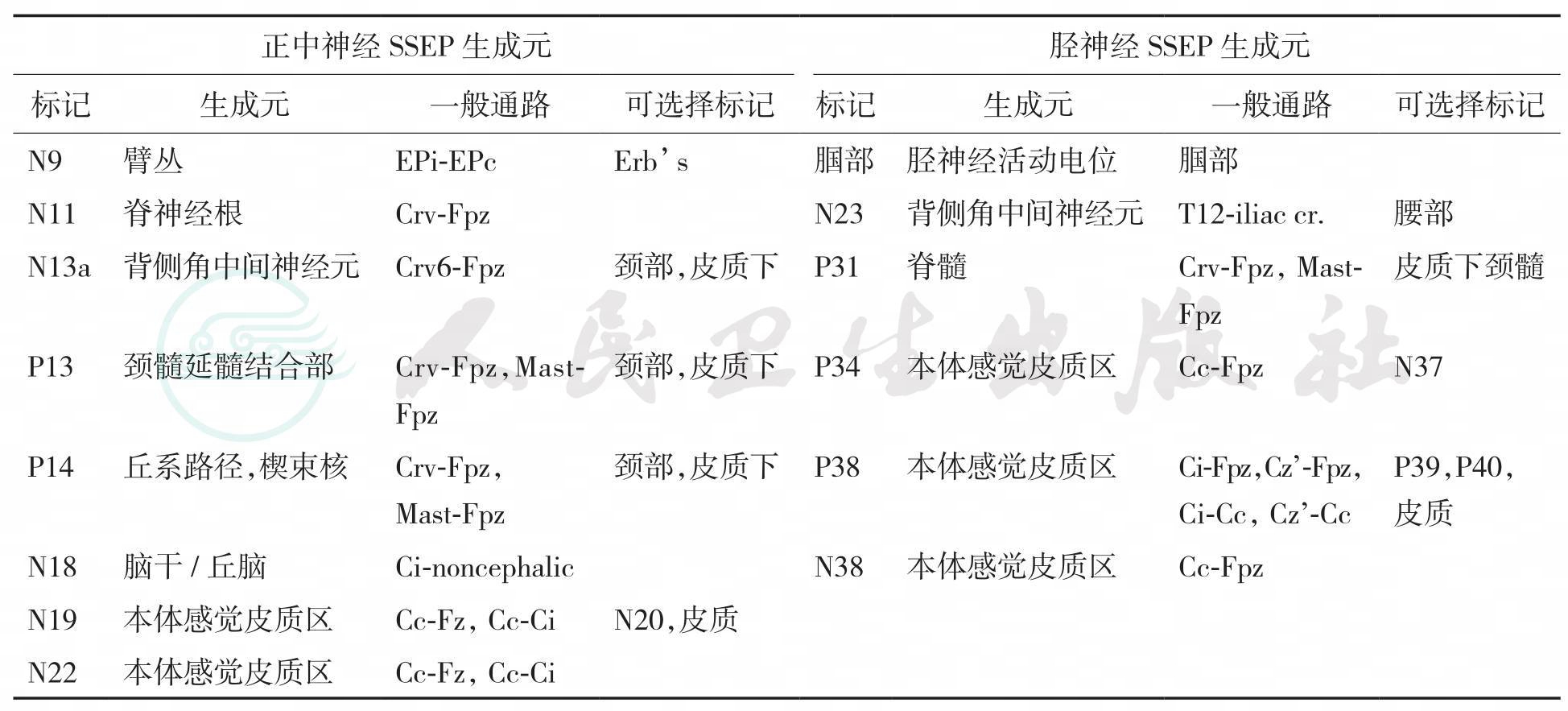
刺激特定外周神经时,特定记录组合记录到的特定波形以波幅(微伏)和潜伏期(毫秒)进行测量,并以电压(微伏) -时间(毫秒)曲线图表示SSEP。通常,不同波形来源于神经通路上不同位点的突触,这些位点就被称为波形的生成元(见表7-1)。在正常成人中,波形的极性以“N”和“P”表示,“N”(Negative)表示向上的波形,“P”(Positive)表示向下的波形,波形之前的距离表示刺激后至波形产生的潜伏期。例如,皮层记录到的刺激正中神经后产生的特征波峰N20(负极波,向上,刺激后20ms可记录到),P22(正极波,向下,刺激后22ms可记录到)定义了波形的波幅(图7-1,图7-2)。
获取可识别的,可重复的SSEP基线波形是成功的术中SSEP监测的基础,也是辨别术中SSEP变化的基础。包括外科和麻醉影响在内,术中患者内外环境的变化使得SSEP监测过程极具挑战性,也使得解释SSEP显著变化变得非常复杂。因此,为术中波幅和潜伏期变化提供有依据的预警标准很困难。有研究认为,术中SSEP波幅降低45%~50%,潜伏期延长7%~10%不会引起术后神经功能的变化[1~7]。然而,就经验而言,在不考虑麻醉和生理学因素的情况下,波幅降低50%或更多,潜伏期延长10%或更多被认为是需要预警并干预的显著性变化[1,7~9]。
(三)影响SSEP的生理学因素
1.体温
轻度低温延长皮层SSEP潜伏期,对皮层波幅和皮层下或外周反应的影响很小[9,10]。深低温会导致皮层SSEP消失,皮层下、脊髓和外周反应的潜伏期延长,随着温度的进一步降低这些反应也会消失[9,11]。
复温可以改善潜伏期但不能完全逆转低温导致的负面反应[1,9]。
轻度高温与皮层和皮层下SSEP潜伏期延长有关,不会影响波幅[1,12]。
局部温度变化也会影响SSEP,例如,由手术暴露或术野低温冲洗引起的手术部位温度变化会影响SSEP。
此外,无论是否输注低温液体,手术室温度过低都会影响SSEP[13]。
2.组织灌注
血压及与其相关的组织灌注变化会影响SSEP。如果低灌注不能满足组织基本的代谢需求,皮层SSEP将会减弱。
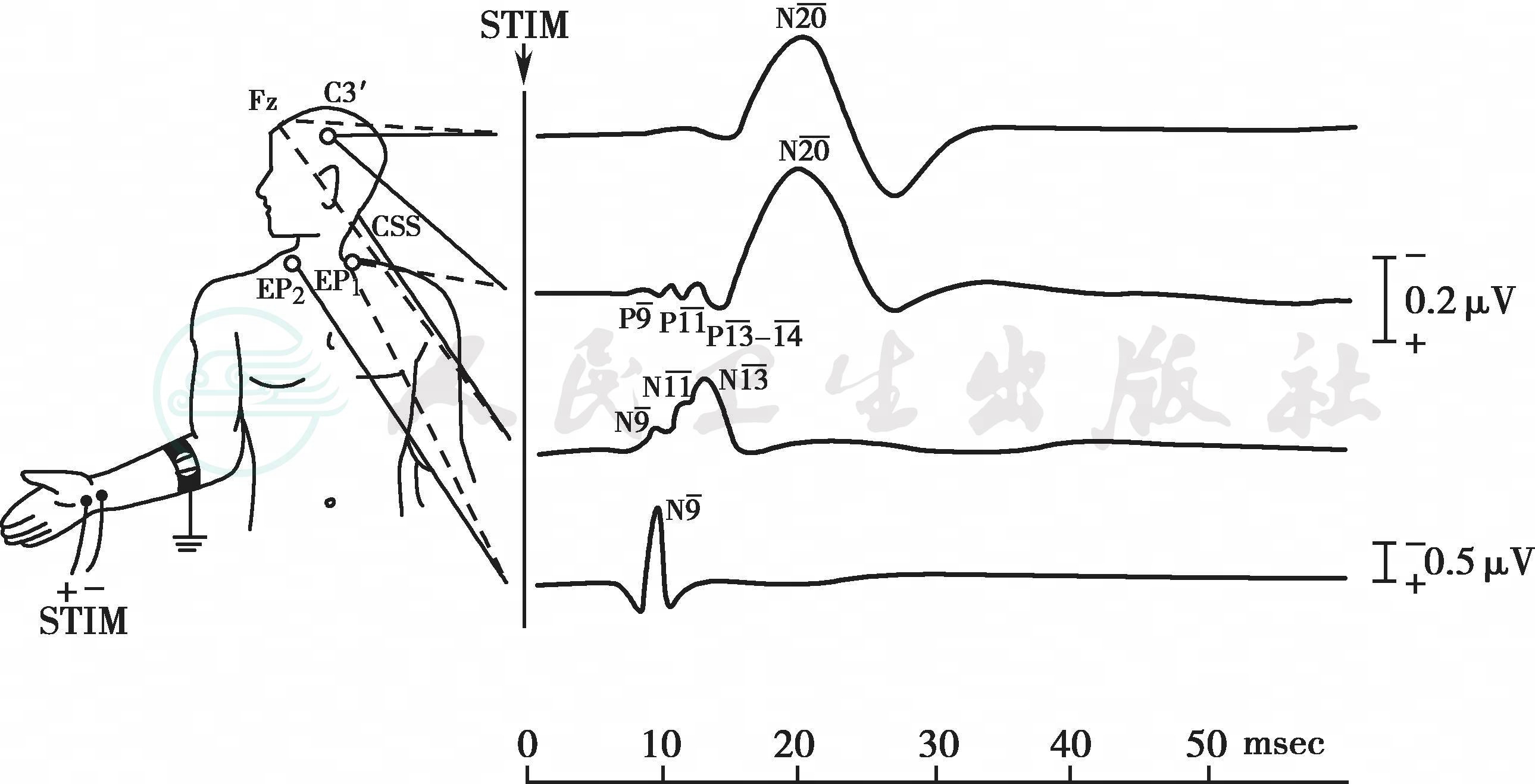
图7-1 正常正中神经SSEP示意图路径来自于解剖学模型的局部定位
正常体温下,当脑灌注低至18ml·min-1·100g-1时SSEP反应减弱[9,13~16],当进一步低至大约15ml·min-1·100g-1时皮层SSEP消失[9,13,16]。皮层下反应对组织灌注不足不如皮层敏感。
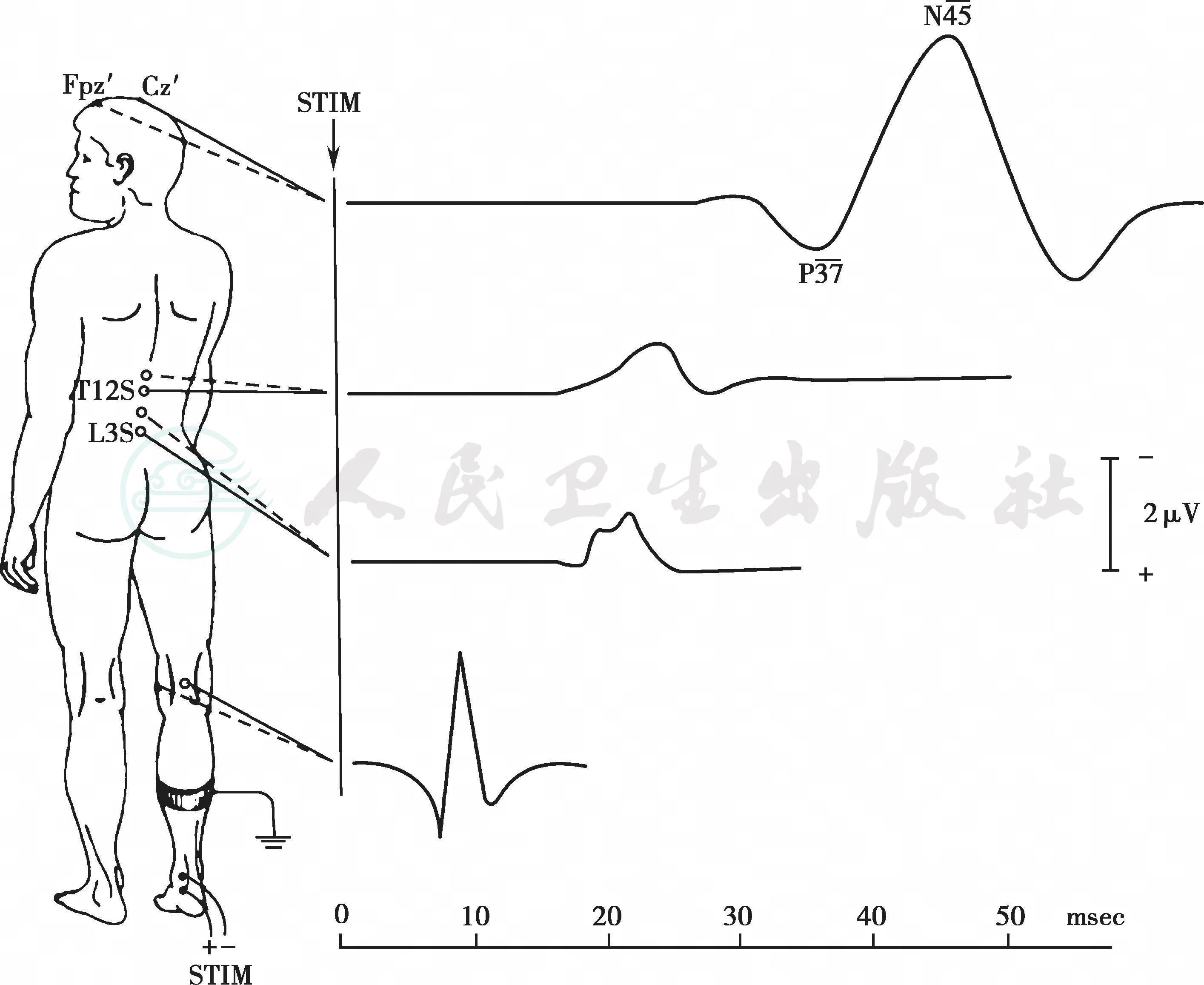
图7-2 正常胫后神经SSEP波形示意图。从下至上的路径分别为腘窝电位,腰椎、低胸椎电位和头皮电位
局部因素导致的局部缺血也会影响SSEP。例如,脊髓牵拉,牵引器导致的缺血,体位性缺血,止血带导致的缺血,血管损伤以及血管夹(无论暂时性或永久性)引起的缺血[13,17~19]。
血细胞比容的变化会改变血液的携氧能力和粘稠度从而影响氧的输送。通常情况下轻度贫血会引起SSEP波幅增加,但当血细胞比容低至10%~15%时SSEP潜伏期会显著延长,血细胞比容低于10%则会导致波幅降低和潜伏期的进一步延长[1,13,20~21]。
3.血氧水平与通气
PaO2和PaCO2的变化会影响SSEP。轻度低氧不影响SSEP[13,22]。术中明显的低氧会引起SSEP波幅的降低[23]。当PaCO2升至50mmHg时,高碳酸血症并不会影响SSEP[1,2]。过度通气会增加SSEP波幅并轻度延长潜伏期[1,22]。
表7-1 正中神经和胫神经SSEP的神经生成元
颅内压
颅内压升高会导致皮层SSEP波幅降低,潜伏期延长[11,13]。随着颅内压的升高,皮层SSEP会发生压力相关性衰减,颞叶沟回疝形成时会发生皮层下反应的消失[13]。
5.其他生理学变量
包括电解质和葡萄糖,总血容量以及中心静脉压在内的其他大量生理学因素也会影响SSEP[13]。
(四)影响SSEP的麻醉学因素
麻醉药物对SSEP有多种影响,各种麻醉药物对SSEP影响的机制差异很大(例如,有些麻醉药物增强SSEP,而绝大多数抑制SSEP),但是所有麻醉药物均是通过改变突触或轴突传导功能从而改变神经元兴奋性这一机制发挥作用 [13,24]。
1.吸入麻醉药
卤族类吸入麻醉药剂量依赖性的降低SSEP波幅并延长其潜伏期。与皮层下、脊髓或外周神经相比,这种对SSEP的抑制作用在皮层更加显著[9,13,25]。
氧化亚氮降低皮层SSEP波幅并延长其潜伏期[26],这种作用与卤族类吸入麻醉药和大多数静脉麻醉药有协同作用[9, 13, 25]。
2.静脉麻醉药
一般情况下,静脉麻醉药对SSEP的影响较吸入麻醉药轻。除依托咪酯和氯胺酮外,低剂量的静脉麻醉药对皮层SSEP影响很小,大剂量重复使用时会轻度降低波幅,延长潜伏期。绝大多数静脉麻醉药对皮层下SSEP的影响均可忽略不计。
单次诱导剂量的丙泊酚不影响刺激正中神经后的皮层和皮层下SSEP波幅,但是会轻度延长皮层SSEP潜伏期[1]。丙泊酚诱导和持续输注导致的皮层波幅降低会在输注停止后恢复[2,13]。丙泊酚对硬膜外诱发电位没有影响[13]。与等效计量的卤族类吸入麻醉药[9]或氧化亚氮[27]比较,丙泊酚对波幅的影响更小。作为全凭静脉麻醉的一部分,丙泊酚适合于SSEP的术中监测[ 1,9,13]。
依托咪酯会明显增加皮层SSEP波幅并轻度延长其潜伏期[9,13,25]。依托咪酯对皮层下SSEP波幅无影响或轻度抑制[9,13]。依托咪酯已经应用于那些无法进行术中SSEP监测的病例,以改善皮层SSEP[13,28],但是依托咪酯具有抑制肾上腺功能的缺点。
氯胺酮增强皮层SSEP波幅,对皮层和皮层下点位的潜伏期没有影响[1,9,13]。在SSEP监测过程中氯胺酮已成为全凭静脉麻醉的组成部分[9,29],但应注意氯胺酮的副作用,包括致幻,半衰期长,次生代谢物的长期存在,拟交感神经效应以及在颅内病理状态下增加颅内压。
右旋美托咪啶[1]是α2受体兴奋性麻醉药物,对术中SSEP监测的影响轻微。
3.阿片类药物
一般情况下,全身应用阿片类药物会轻度降低皮层SSEP波幅,延长其潜伏期,但是对皮层下和外周电位的影响轻微[1,9,13]。单次剂量的阿片类药物较持续静脉输注对SSEP的影响大[9]。因此,阿片类药物的持续输注是术中SSEP监测时麻醉的重要组成部分。瑞芬太尼具有时量半衰期短,起效快的特点,因此经常得以应用。除了哌替啶,椎管内使用阿片类药物对SSEP没有影响[1,13,25]。
4.苯二氮䓬类
苯二氮䓬类药物轻微抑制皮层SSEP[1,9,13]。单独使用咪达唑仑对皮层SSEP影响轻微或无影响,N20潜伏期中度延长,对皮层下和外周SSEP影响轻微或无影响[9,13]。间断给予或持续静脉输注50~90μg·kg-1·h-1咪达唑仑可以增强全凭静脉麻醉期间的遗忘作用并可改善氯胺酮引起的致幻作用,从而利于术中SSEP监测[25]。
5.肌松药
全身麻醉过程中使用神经肌肉阻滞药物通常不会直接影响SSEP。但是,神经肌肉阻滞药可以抑制自由肌电和(或)记录点附近肌肉群的干扰,增加信噪比,改善SSEP波形的质量[1,9]。
(五)推荐麻醉方法
鉴于麻醉药物的药理学作用特点,静脉麻醉药较吸入麻醉药更适合于术中SSEP监测,也可以考虑低浓度的吸入麻醉药与静脉麻醉药联合应用,但是对于SSEP波幅较小的患者,全凭静脉麻醉更适合于术中连续SSEP监测。另外,由于运动诱发电位监测通常与SSEP联合使用,运动诱发电位对吸入麻醉药非常敏感,因此通常需要全凭静脉麻醉。典型的药物组合是丙泊酚和瑞芬太尼,术中不使用肌松药。
二、运动诱发电位
MEP是指用电或磁刺激中枢运动神经(脑功能区或脊髓),在刺激点下方的传出路径或效应器、肌肉记录到的电反应。刺激中枢运动神经主要有经脊髓和经颅刺激两种方法。电刺激脊髓或运动皮质后,在外周肌肉记录到的电位称为复合肌肉动作电位(compound muscular activity potentials,CMAP),CAMP是广泛使用的测量MEP的方法。MEP是最新引入的术中神经生理监测(intraoperative neurophysiologic monitoring,IOM)项目,与SSEP通路定位于不同的区域,不同的皮层血供区,不同的脑干和脊髓部位。运动功能通路较SSEP通路对缺血更为敏感[30]。
(一)MEP监测在神经外科术中的应用
MEP监测的敏感性为100%,特异性为90%[31,32]。相对来讲,MEP发生变化并不常见,但是与SSEP相比,MEP与术后运动功能的预后具有更好的相关性,因此强烈推荐在下列手术中都应该进行MEP监测:
1.骨骼畸形矫形术
2.髓内外肿瘤切除术
3.颅内肿瘤切除术
4.中枢神经血管损伤手术
5.卒中和胸腹主动脉瘤修补术预后的评估
但这并不意味着进行MEP监测就不必采取其他监测技术,对于不同患者,其他监测技术是MEP监测必要补充。
(二)术中MEP监测的预警
制定CAMP变化标准很困难,因为即使是在清醒状态下也有大量的变量需要考虑[33],全麻时需要考虑的变量更多[34]。最常用的评估MEP反应标准是在固定刺激参数的(刺激数量和强度)情况下诱发相似的肌肉反应。一般认为需要增加刺激强度超过50V,增加刺激次数,或与初始波形比较波幅下降大于80%是显著性改变[35]。有关变化范围的研究是目前的热点问题,无论如何,当CAMP反应消失时需要提醒外科和麻醉医师纠正影响MEP变化的生理学因素。
(三)MEP监测的并发症
MEP监测并非没有风险,并发症包括:皮层灼伤[36],舌裂伤,心律失常,颌骨骨折和术中知晓 [37]。放置牙垫可以减少舌裂伤的发生。
(四)MEP监测的相对禁忌证
MEP监测的相对禁忌证包括癫痫,皮层损伤,颅骨缺损,高颅压,颅内装置(电极,血管夹和分流管),心脏起搏器或其他植入泵。肌肉酸痛是最易被发现,也是最普通的并发症[36]。放置针状电极可能会引起出血和插入点的擦伤,也有可能感染。这些轻微并发症的发生率非常低[38]。实施运动诱发电位监测时会引起患者的体动,因此诱发MEP前需要与外科医师进行紧密的沟通。目前采用的多脉冲刺激减少了体动的发生,并且有可能在不干扰手术操作的情况下进行MEP监测。
(五)影响MEP监测的生理学因素
1.体温
体温的降低可以引起MEP潜伏期延长,刺激阈值增加,但是其对振幅的影响呈双向性,随着体温下降,振幅增加,在29℃使达到峰值,随后开始下降,在22℃时消失[39]。中度低温(31~34℃)时会出现MEP波形的改变,32℃以下会出现潜伏期延长,复温至正常体温后MEP恢复正常。
2.缺氧
吸入氧浓度降至10%时,27%MEP波形消失,潜伏期延长,波幅下降。吸入氧浓度降至5.25%时MEP波形消失[40]。
3.低血压
轻度和中度的低血压对MEP没有影响,对于行控制性降压的患者平均动脉压降至50mmHg时MEP波幅降低[41]。
4.缺血
脑血流降至16 ml·min-1·100g-1以下时会引起MEP波形的变化[42]。主动脉或股动脉夹闭30分钟后可以引起下肢缺血,MEP波幅降低,潜伏期延长。完全的主动脉夹闭2分钟后即可引起脊髓缺血,进而影响MEP[43]。
5.高二氧化碳和低二氧化碳血症
除非呼气末二氧化碳水平极度升高,否则MEP波形变化甚微。当PaCO2达到100mmHg时经颅刺激运动诱发电位会发生变化[44]。呼气末二氧化碳水平13~30mmHg之间MEP不会发生变化[45]。
(六)影响MEP的麻醉学因素
1.吸入麻醉药
卤族类吸入麻醉药会对CMAP的波幅产生剂量依赖性抑制,临床使用剂量会增加监测的失败。当七氟烷浓度为0.75MAC时,tcMEPs的波幅受到显著影响[46]。
2.静脉麻醉药
丙泊酚对CMAP的影响呈剂量依赖性抑制。进行运动诱发电位监测时,应当使用成串刺激技术并限制丙泊酚的血浆浓度。成串刺激诱发CMAP时,维持1μg/mL (20~25μg·kg-1·min-1)的丙泊酚血浆浓度并复合阿片类药物或50%N2O不会影响CMAP反应,但是当丙泊酚血浆浓度为1μg/ml~2μg/ml (25μg·kg-1·min-1~50μg·kg-1·min-1)时,CMAP的波幅会被抑制30%~60%[47]。
依托咪酯对经颅刺激诱发的CMAPs的抑制作用很小,0.3 mg/kg的常规诱导剂量静注会导致CMAP波幅降低35%,潜伏期没有变化,但是这种抑制是短暂的,仅在单次给药后持续2min~5min[48]。持续输注依托咪酯维持麻醉可以为运动诱发电位监测提供一个良好的条件,有以10μg·kg-1·min-1~30μg·kg-1·min-1持续输注依托咪酯维持麻醉而不影响运动诱发电位监测的报道[49]。
3.阿片类药物
虽然芬太尼、阿芬太尼、舒芬太尼对MEPs均有抑制作用,使MEP波幅下降,潜伏期延长,抑制作用大小依次为芬太尼>阿芬太尼>舒芬太尼,但是低剂量或持续输注阿片类药物对运动诱发电位的影响很小,维持外科麻醉的血药浓度就可以进行有效的MEP监测,当血药浓度为外科麻醉的血药浓度的2倍时,诱发电位反应将消失[50]。
4.肌松药
肌松药会导致CMAP波幅大幅降低,在进行运动诱发电位监测时应尽量避免使用肌松药。
(七)推荐麻醉方法
丙泊酚和瑞芬太尼的全凭静脉麻醉适合于MEP监测的麻醉维持。
三、脑干听觉诱发电位
ABRs是通过声音刺激听神经,听觉传入冲动经耳蜗毛细胞、螺旋神经节、第八对颅神经听觉部分进入耳蜗核,再经上橄榄核、外侧丘系、下丘和内侧膝状体到达大脑听觉皮质途中产生的各种反应电位。
(一)脑干听觉诱发电位监测的适应证
1.听神经瘤;
2.第五对颅神经受压:三叉神经痛
3.第七对颅神经受压:面痉挛
4.后颅凹手术
5.颞叶或顶叶皮质损伤
6.椎基底动脉瘤
(二)脑干听觉诱发电位的解释及预警
根据潜伏期和波幅的不同,ABRs可分为三种类型:短潜伏期脑干听觉诱发电位,中潜伏期脑干听觉诱发电位和长潜伏期脑干听觉诱发电位。手术监测中常用的短潜伏期脑干听觉诱发电位根据其起源不同分为Ⅰ~Ⅴ波[51]。
正常的ABRs监测应该最少有三个清晰可辨的波形或波峰,虽然ABRs一般包括七个波形(图7-3),但是只有Ⅰ波、Ⅲ波和Ⅴ波常用于术中监测。术中ABRs监测最常见的改变,是在后颅凹置入牵引器后,波Ⅴ潜伏期的延长以及波Ⅰ到波Ⅴ峰间潜伏期的延长。ABRs很多改变(如果变化轻微)是可逆,并被视为常规手术操作的一部分。如果波Ⅰ完全消失就可能缘于血管阻塞、痉挛导致耳蜗丧失血供,或是由于外科医生切断了神经所致,继而引起有效听力的丧失。波Ⅴ的改变与预后的关系就不那么明确,传导途径中的去同步化也可能导致波Ⅴ的消失,此时听力可能并不受损害[52]。一般情况下,如果波Ⅰ和波Ⅴ都存在,听力一般不受损,但是如果二者都消失,术后听力得以保存的机会很小。

图7-3 正常的听(性)脑干反应的示踪图和产生反应峰(惯用罗马数字标记)相对应的脑干部位Ⅰ. 柯替(氏)器与颅外Ⅶ脑神经;Ⅱ. 耳蜗神经核;Ⅲ. 上橄榄核群;Ⅳ. 外侧丘系;Ⅴ. 下丘;Ⅵ. 内侧膝状体;Ⅶ. 听辐射线[53]
牵拉神经或脑干会导致听神经颅内部分受到影响,从而引起Ⅰ波和Ⅲ波潜伏期延长,这种变化只在受损神经的同侧发生,Ⅲ波去同步化的程度可以反映损伤的严重性。对听神经的冷盐水灌洗,热烧灼,干燥[54,55]或使用罂粟碱缓解血管痉挛[56]也可以引起同样的变化。
无论是对脑干的直接损伤还是影响脑干的血流供应或血流量的操作都可以通过ABRs反映听觉通路受损的情况。持续的ABRs波形改变可以预测脑干功能障碍,但即使ABRs的波形没有变化脑干功能也有可能受损,因此推荐采取ABRs与其他监测方法如SSEP,MEP联合监测的方法来监测脑干功能的完整性。多模式监测具有很好的特异性,但在评估脑干功能完整性方面敏感性有限。
(三)脑干听觉诱发电位的影响因素
影响ABR的生理因素包括耳蜗动脉的中断或痉挛,内外耳道听神经远端的撕脱。Ⅰ波或其他波的减少和消失分别可以导致听觉减弱和耳聋。体温对脑干听觉诱发电位的影响十分明显。体温降低可造成反应潜伏期和反应间期明显延长。此外,它同样受到手术室内各种电设备的电干扰。
ABRs一般不容易受全身麻醉药物的影响[57],因此进行ABRs监测时并不需要改变麻醉方法。麻醉药物所引起的潜伏期的短暂延长并不具有临床意义,很容易与技术或生理原因导致的ABRs波形变化加以区分。
四、肌电图
EMG是通过放置针状记录电极到特定的肌肉或其附近,持续评估颅神经和外周神经。EMG不同于其他诱发电位监测,原因在于EMG信号不是通过故意刺激神经传导通路某一特定点而产生的,相反,它是记录手术区域内的神经根所支配的肌肉群的自发EMG活动。其目的是探查手术区域内的神经根是否有损伤。当手术器械触碰到神经根时,很容易观察到其所支配肌肉的EMG活动。小的神经激惹会导致暂时性肌电活动,但很快会消失,强烈的神经刺激会产生持续性肌电活动。
(一)术中肌电图监测的适应证
1.颈椎和腰椎等脊柱手术
2.听神经瘤、桥小脑角区和颅底肿瘤手术
(二)肌电图监测的一般原则
通常情况下神经没有受到刺激时肌电图应该保持平直或安静,对神经的机械操作可能会导致神经活动。神经活动时间的长度取决于刺激的程度[58,59]。短时间的刺激一般不会引起永久性损伤,频繁的或持续的刺激可能或导致术后神经功能损伤[60]。
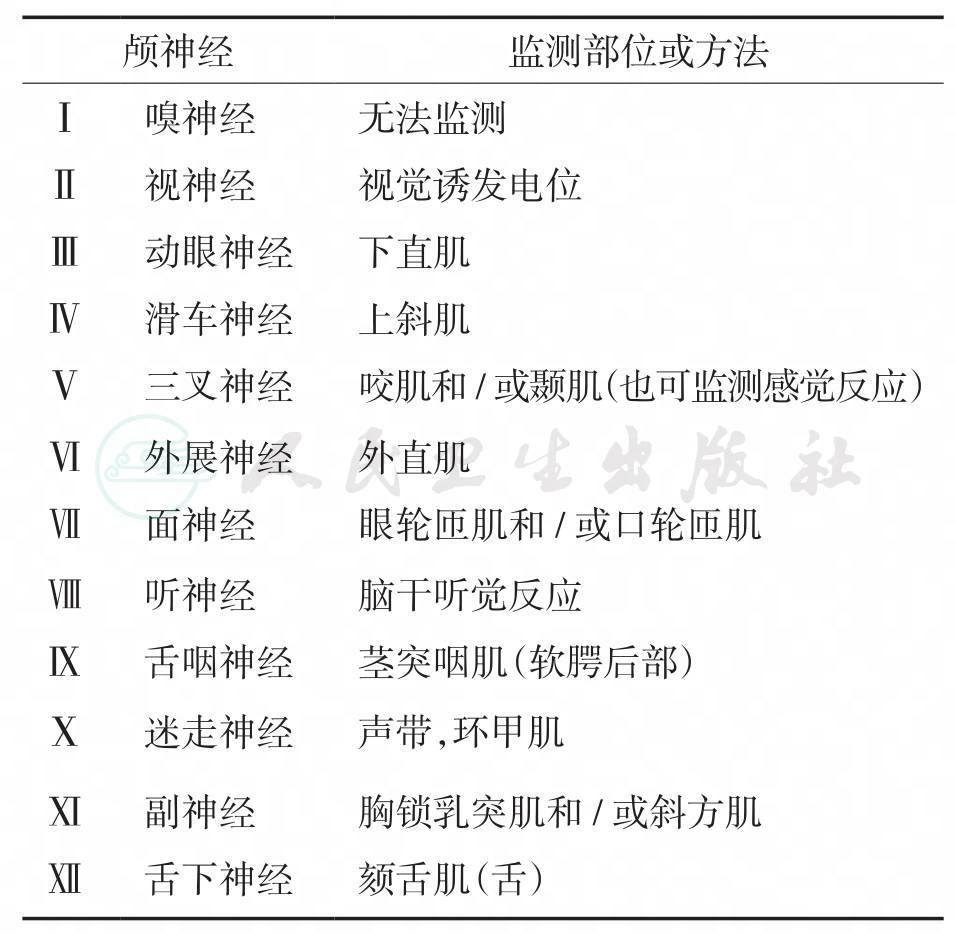
术中使用手持式单极电刺激器探测手术区域,或者使用单极或成对的电刺激器从可能受累的肌群记录肌电活动[61]可以判断颅神经的功能(见表7-2)。
表7-2 颅神经监测
(三)特殊神经功能的监测
1.第Ⅴ和第Ⅶ颅神经
面神经支配眼轮匝肌和口轮匝肌,三叉神经支配咀嚼肌(如咬肌和颞肌)。因此如果在这些肌肉中置入电极,就可以在肿瘤切除的过程中记录肌电图。对三叉神经的电刺激可以形成一个小于6ms的峰值潜伏期,而对面神经的刺激则会形成一个大于8ms的峰值潜伏期,根据这一点也可以判断哪条神经受到刺激。
2.第Ⅲ、第Ⅳ和第Ⅵ颅神经
第Ⅲ、第Ⅳ和第Ⅵ颅神经主要支配眼外肌。因此,在监测面神经和三叉神经功能时,如果监测电极置于或接近这些肌肉的部位,将会监测到支配这些肌肉的神经传导的肌电图[60,61]。通过监测眼内直肌的功能可以监测第Ⅲ颅神经,监测眼外直肌的功能可以监测第Ⅳ颅神经,第Ⅵ颅神经的功能则主要依靠眼上斜肌的监测。由于空间有限,这些肌肉中只能置于单个的刺激电极,在未手术的另一侧置入参考电极。
3.第Ⅸ、第Ⅹ、第Ⅺ和第Ⅻ颅神经
第Ⅸ颅神经的运动支功能监测主要依靠使用电极记录软腭的肌电活动[60,62]。将电极置入声带可以监测第Ⅹ颅神经(迷走神经)的运动支的功能,但是电极的置入方法非常困难[9]。因此,监测迷走神经的功能主要依靠在气管插管上贴附刺激电极与声带相联系,从而获得肌电活动。副神经或第Ⅺ颅神经的功能监测相对非常简单,将电极置入斜方肌获得肌电图即可。将电极置入舌头就可以监测舌下神经或第Ⅻ颅神经的功能[61,62]。舌下神经非常小但是很重要,因此一旦有任何因素影响了其功能,舌头处的刺激电极引出的肌电活动就会发生变化。进行所有颅神经功能监测时,必须注意肌电刺激的强度,如果强度过大,结果可能过度或造成损伤。
(四)影响肌电图监测的因素
除神经肌肉阻滞剂(neuromuscular blockade,NMB)外,麻醉药物及术中其他生理学变化(体温、血压)对EMG几无影响[63]。
(五)推荐麻醉方法
麻醉药物不干扰肌电活动的反应,但在肌电图描记时应避免使用肌松药。
五、脑电图
EEG是监测脑功能最基本方法,是将脑自发性生物电放大记录而获得的波形图,它反映了大脑皮层锥体细胞产生的突触后电位和树突电位的整合,包括原始脑电图、计算机处理后脑电图和双频谱分析。术中脑电图是一个非常有效的评估脑功能活动的手段,给神经外科医师和麻醉医师以极大的帮助。通常麻醉前记录的是患者清醒、焦虑、睁眼状态的脑电图,有肌肉紧张和眼球运动干扰,实施全麻诱导后,脑电图迅速改变,由快波形转为慢波形,并表现为维持在特定的麻醉状态下的形态。
(一)术中脑电图监测的适应证
术中正确使用脑电图监测,可及时地了解大脑皮层功能和脑血流的状况,尽量减少脑功能的损伤,其主要适应证包括:
1.颅内动脉瘤暂时夹闭载瘤动脉
2.脑血管畸形手术
3.颈动脉内膜剥脱术
4.癫痫手术中判断癫痫灶部位
5.心肺转流术
6.颅内外旁路手术操作
7.指导滴定麻醉药物引发的暴发性抑制
(二)脑电图的基本组成
在人类,脑电波根据频率及波幅的不同,可分为α波、β波、θ波和δ波(见表7-3),一般来讲兴奋时脑电波快而波幅小,睡眠时脑电波较慢而波幅大,常见状态下的脑电图波形态如图7-4。正常成年人脑电波通常只有α波和β波,而θ波和δ波多为病理波形。
(三)影响脑电图监测的生理学因素
1.脑血流和缺血缺氧
缺血缺氧早期β波短暂活性升高,随后出现高幅低频的θ波和δ波,β波逐渐消失,最后出现低幅的δ波。缺血进展期引起脑电活动抑制,偶发暴发性抑制。术中阻断血管时突然出现的δ波提示手术医师和麻醉医师有脑损害的危险。缺血半影区不足以产生电活动,因此脑电图对该区脑损伤的预示作用差。缺血性脑电图发生越快,不可逆损伤可能性越大。
2.血压
低血压会影响脑代谢,所导致的脑电图的改变通常为全脑性的,即两侧半球的脑电图均呈减慢节律,低电压变化。但应注意,出现阻断一侧颈总或颈内动脉导致一侧供血障碍时,对侧供血不充分,即使血压正常,也可造成局部或一侧脑缺血。特别应注意一侧性的局部变化。
3.体温
脑电图在低温时呈特征性演变,随温度的降低,开始为暴发性高幅慢波,进一步降温时,波幅和频率也进一步降低,然后进入相对静止期。
(四)影响脑电图监测的麻醉因素
1.术前药
绝大多数术前使用的镇静药在一定量时对脑电图的影响是相似的。低剂量时对脑电活动抑制较小,脑电波以快波为主;镇静剂量时,脑电图与嗜睡状态下相似;中度睡眠时可见到典型的睡眠纺锤波;患者深睡状态时,脑电图以深大慢波为主。
表7-3 脑电图波形及临床意义

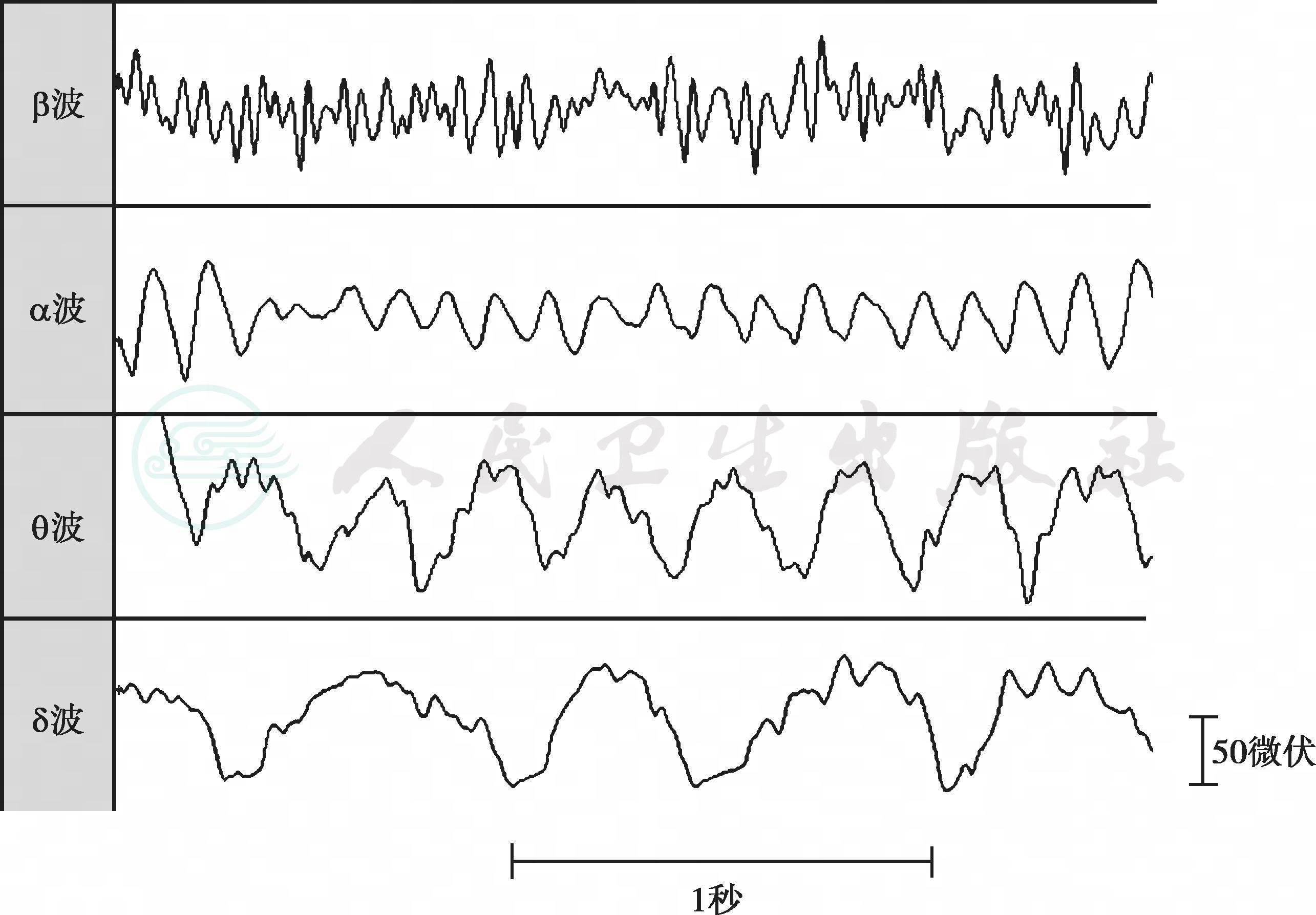
图7-4 常见状态下的脑电波波形示意图
2.吸入麻醉药
吸入性麻醉药可使脑电图呈全脑慢波状态,在各类麻醉气体中,N2O对波形影响最大,应避免使用。术中监测脑电图通常采用异氟烷或七氟烷。
3.静脉麻醉药
除了氯胺酮外,多数静脉麻醉药对脑电图都呈剂量依赖性抑制,并可引起暴发性抑制。
(五)麻醉考虑
如前所述,多数麻醉药物均对脑电图有抑制作用,但一般不影响脑电图监测。临床麻醉中应注意到麻醉药对脑电图抑制的剂量依赖性表现,避免暴发性抑制。
附录:
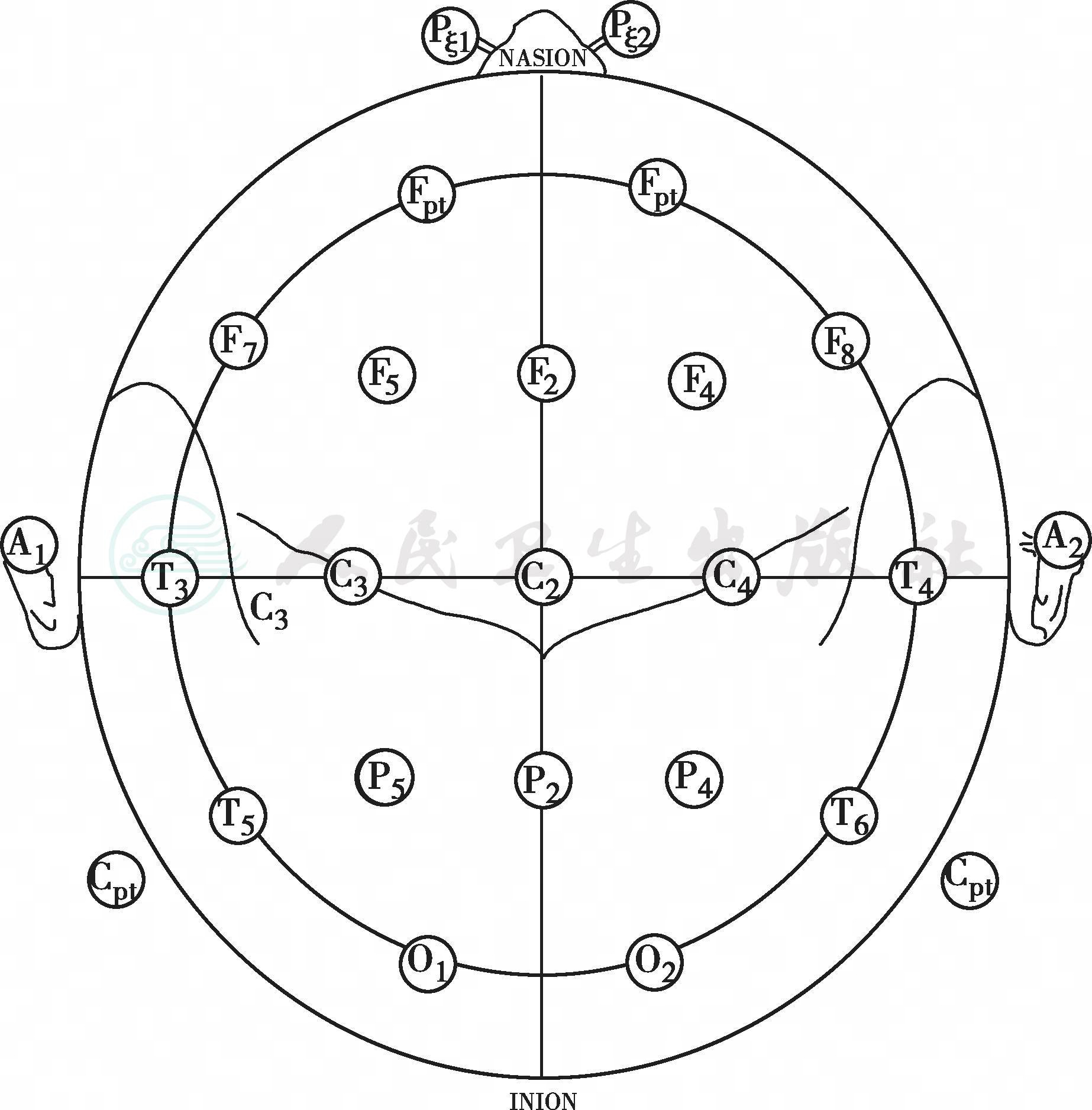
附图7-1 10—20国际EEG电极放置系统
简单的头部平面投射图,显示所有罗兰多和大脑外侧裂的标准位置和定位。外圈轮廓沿鼻根和枕外隆突水平。简图标记了常规记录点的位置。CP和FP分别定位于C和P,C和F的中线。c和i分别指示刺激点同侧或对侧相应位点
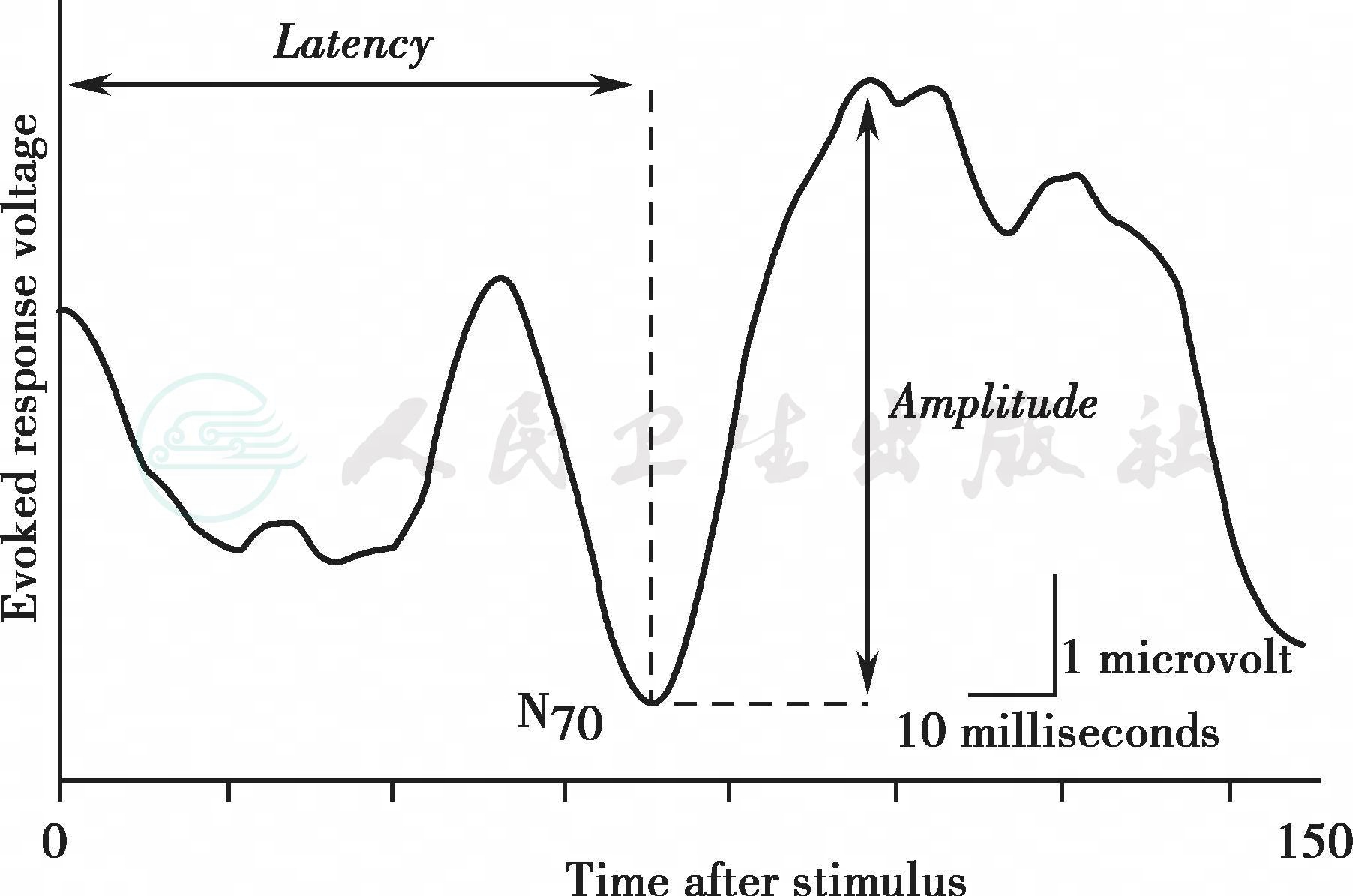
附图7-2 诱发电位的波幅—潜伏期示意图
显示负相波峰在70毫秒时(N70)的波幅(amplitude)和潜伏期(latency)。横坐标,刺激后时间;纵坐标,诱发反应电压
附表 神经外科术中监测模式和麻醉方案
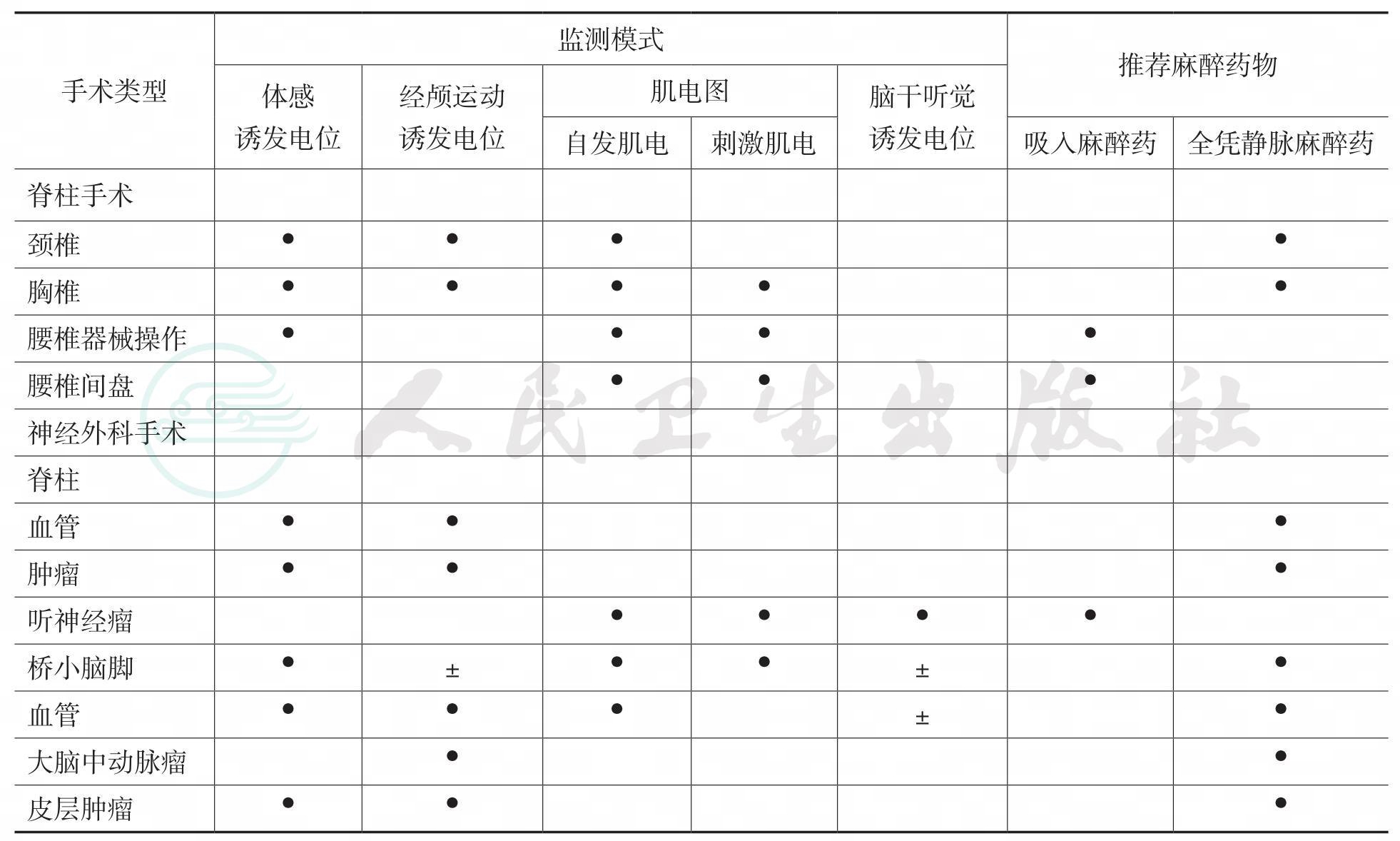
● 适用于绝大多数手术, ± 适用于部分手术 (取决于病变部位)。(引自 Jameson LC, Sloan TB, Jameson LC, et al: Monitoring of the brain and spinal cord. Anesthesiol Clin 2006; 24:777)
1. Banoub M,Tetzlaff JE,Schubert A. Pharmacologic and physiologic influences affecting sensory evoked potentials:implications for perioperative monitoring. Anesthesiology. 2003;99:716-737.
2. Kalkman CJ,Boezeman EH,Ribberink AA,et al. Influence of changes in arterial carbon dioxide tension on the electroencephalogram and posterior tibial nerve somatosensory cortical evoked potentials during alfentanil/ nitrous oxide anesthesia. Anesthesiology. 1991;75:68-74.
3. Schubert A,Drummond JC. The effect of acute hypocapnia on human median nerve somatosensory evoked responses. Anesth Analg. 1986;65:240-244.
4. Mackey-Hargadine JR,Hall Ⅲ JW. Sensory evoked responses in head injury. Central Nerv Syst Trauma. 1985;2:187-206.
5. LaMont RL,Wasson SI,Green MA. Spinal cord monitoring during spinal surgery using somatosensory spinal evoked potentials. J Pediatr Orthop. 1983;3:31-36.
6. Lubicky JP,Spadaro JA,Yuan HA,et al. Variability of somatosensory cortical evoked potential monitoring during spinal surgery. Spine. 1989;14:790-798.
7. York DH,Chabot RJ,Gaines RW. Response variability of somatosensory evoked potentials during scoliosis surgery. Spine. 1987;12:864-876.
8. Brown RH,Nash CL,Berilla JA,et al. Cortical evoked potential monitoring. A system for intraoperative monitoring of spinal cord function. Spine. 1984;9:256-261.
9. Tolekis JR. Intraoperative monitoring using somatosensory evoked potentials:a position statement by the American Society of Neurophysiological Monitoring. J Clin Monit Comput. 2005;19:241-258.
10. Nuwer MR. Evoked potential monitoring in the operating room. New York,NY:Raven Press;1986.
11. Stecker MM,Cheung AT,Pochettino A,et al. Deep hypothermic circulator arrest:I effects of cooling on electroencephalogram and evoked potentials. Ann Thorac Surg. 2001;71(1):22-28.
12. Oro J,Haghighi SS. Effects of altering core body temperature on somatosensory and motor evoked potentials in rats. Spine. 1992;17:498-503.
13. Sloan TB,Heyer EJ. Anesthesia for intraoperative neurophysiologic monitoring of the spinal cord. J Clin Neurophysiol. 2002;19(5):430-443.
14. Branston NM,Symon L,Cortical EP. Blood flow,and potassium changes in experimental ischemia. In:Barber C,editor. Evoked potentials. Baltimore,MD:University Park Press;1980.p. 527-530.
15. Nuwer MR. Intraoperative electroencephalography. J Clin Neurophysiol. 1993;10:437-444.
16. Prior PF. EEG monitoring and evoked potentials in brain ischemia. Br J Anaeth. 1985;57:63-81.
17. Brodkey JS,Richards DE,Blasingame JP,et al. Reversible spinal cord trauma in cats:additive effects of direct pressure and ischemia. J Neurosurg. 1972;37:591-593.
18. Dolan EJ,Transfeld EE,Tator CH,et al. The effect of spinal distraction on regional blood flow in cats. J Neurosurg. 1980;53:756-764.
19. Gregory PC,McGeorge AP,Fitch W,et al. Effects of hemorrhagic hypotension on the cerebral circulation. Ⅱ. Electrocortical function. Stroke. 1979;10:719-723.
20. Nagao S,Roccaforte P,Moody RA. The effects of isovolemic hemodilution and reinfusion of packed erythrocytes on somatosensory and visual evoked potentials. J Surg Res. 1978;25:530-537.
21. Dong WK,Bledsoe SW,Chadwick HS,et al. Electrical correlates of brain injury resulting from severe hypotension and hemodilution in monkeys. Anesthesiology. 1986;65:617-625.
22. Ledsome JR,Cole C,Sharp-Kehl JM. Somatosensory evoked potentials during hypoxia and hypocapnia in conscious humans. Can J Anasth. 1996;43:1025-1029.
23. Grundy BL,Heros RC,Tung AS,Doyle E. Intraoperative hypoxia detected by evoked potential monitoring. Anesth Analg. 1981;60:437-439.
24. Sloan T. Anesthetics and the brain. Anesthesiol Clin North Am. 2002;20:1-27.
25. Sloan T. Evoked potentials. In:Albin MS,editor. A textbook of neuroanes- thesia with neurosurgical and neuroscience perspectives. New York,NY:McGraw-Hill;1997.221-276.
26. Sloan TB,Koht A. The effects of nitrous oxide on intraoperative recordings of somatosensory evoked potentials. Br J Anaesth. 1985;57:849-852.
27. Boisseau N,Madany M,Staccini P,et al. Comparison of the effects of sevoflurane and propofol on cortical somatosensory evoked potentials. Br J Anaesth. 2002;88:785-789.
28. Sloan TB,Ronai AK,Toleikis JR,et al. Improvement of intraoperative soma-tosensory evoked potentials by etomidate. Anesth Analg. 1988;67:582-585.
29. Cruccu G,Aminoff MJ,Curio G,et al. Recommendations for the clinical use of somatosensory-evoked potentials. Clin Neurophysiol. 2008;119:1705-1719.
30. Hickey R,Sloan TB,Roger JN. Functional organization and physiology of the spinal cord. In:Porter SS,editor. Anesthesia for surgery of the spine. New York:McGraw-Hill;1995.15–39.
31. Kim DH,Zaremski J,Kwon B,et al. Risk factors for false positive transcra- nial motor evoked potential monitoring alerts during surgical treatment of cervical myelopathy. Spine. 2007;32(6):3041-3046.
32. Bednarik J,Kadanka Z,Vohanka S,et al. The value of somatosensory-and motor-evoked potentials in predicting and moni-toring the effect of therapy in spondylotic cervical myelopathy. Prospective randomized study. Spine. 1999;24(15):1593-1598.
33. Wassermann E. Variation in the response to trascranial magnetic brain stimuation in the general population. Clin Neurophysiol. 2002;113(2002):1165-1171.
34. Sloan T. Evoked potentials. Anesthesia and motor evoked potentials monitor- ing. San Diego:Academic;2002.
35. Langeloo DD,Lelivelt A,Louis Journee H,et al. Transcranial electrical motor-evoked potential monitoring during surgery for spinal deformity:a study of 145 patients. Spine. 2003;28(10):1043-1050.
36. Macdonald DB. Intraoperative motor evoked potential monitoring:overview and update. J Clin Monit Comput. 2006;20(5):347-377.
37. Legatt A. Current practice of motor evoked potential monitoring:results of a survey. J Clin Neurophysiol. 2002;19(5):454-460.
38. MacDonald D. Safety of intraoperative transcranial electrical stimulation motor evoked potential monitoring. J Clin Neuroshysiol. 2002;19(5):416-429.
39. Meylaerts SA,de Haan P,Kalkman CJ,et al. The influence of regional spinal cord hypothermia on transcranial myogenic motor-evoked potential monitoring and the efficacy of spinal cord ischemia detection. J Thorac Cardiovasc Surg. 1999;118:1038-1045.
40. Haghighi SS,Keller BP,Oro JJ,et al. Motor-evoked potential changes during hypoxic hypoxia. Surg Neurol. 1993;39:399–402.
41. Short LH,Peterson RE,Monagan PD. Physiologic and anesthetic alterations on spinal-sciatic evoked responses in swine. Anesth Analg. 1993;76:259-265.
42. Branstron NM,Syman L,Crockard HA,et al. Relationship between cortical evoked potentials and local cortical bloodflow following acute middle cerebral artery occlusion in the baboon. Exp Neurol. 1974;45:195-208.
43. de Haan P,Kalkman CJ,Ubags LH,et al. A comparison of the sensitivity of epidural and myogenic transcranial motor- evoked responses in the detection of acute spinal cord ischemia in the rabbit. Anesth Analg. 1996;83:1022-1027.
44. Browning JL,Heizer ML,Baskin DS. Variations in corticomotor and somatosensory evoked potentials:effects of temperature,halothane anesthesia,and arterial partial pressure of CO2. Anesth Analg. 1992;74:643-648.
45. King BS,Rampil IJ. Anesthetic depression of spinal motor neurons may contribute to lack of movement in response to noxious stimuli. Anesthesiology. 1994;81:1484-1492.
46. Tárnok A,Hambsch J,Emmrich F,et al.Complement activation,cytokines,and adhesion molecules in children undergoing cardiac surgery with or without cardiopulmonary bypass. Pediatr Cardiol. 1999,20(2):113-125.
47. Van Dongen EP,ter Beek HT,Aarts LP,et al. The effect of two low-dose propofol infusions on the relationship between sixpulse transcranial electrical stimulation and the evoked lower extremity muscle response. Acta Anaesthesiol Scand. 2000;44:799-803.
48. Kalkman CJ,Drummond JC,Ribberink AA,et al. Effects of propofol,etomidate,midazolam,and fentanyl on motor evoked responses to transcranial electrical or magnetic stimulation in humans. Anesthesiology. 1999;76:502-509.
49. Ubags LH,Kalkman CJ,Been HD,et al. The use of ketamine or etomidate to supplement sufentanil/N2O anesthesia does not disrupt monitoring of myogenic transcranial motor evoked responses. J Neurosurg Anesthesiol. 1997;9:228-233.
50. Martín Burcio S,Valiño González J,Domínguez F,et al. Use of aprotinin during pediatric heart surgery. Rev Esp Anestesiol Reanim. 2001 May;48(5):212-216.
51. Moller A.R.:Intraoperative neurophysiologic monitoring. 2rd ed. Totowa,NJ,Humana Press,2006.
52. Yingling C.D.:Intraoperative monitoring of cranial nerves in skull base surgery. In:Jackler R.K.,Brackman D.E.,ed. Neurotology,St. Louis:Mosby;1994:967.
53. Aravabhumi S,Izzo KL,Bakst BL,et al,.Brainstem auditory evoked potentials:Intraoperative monitoring technique in surgery of posterior fossa tumors. Arch Phys Med Rehabil 1987;68:142.
54. Rowed D.W.,Nedzelski J.M.,Cashman M.Z.:Intraoperative monitoring of cochlear and auditory nerve potentials in operations in the cerebellopontine angle:an aid to hearing preservation. In:Schramm J.,Moller A.R.,ed. Intraoperative neurophysiological monitoring,Berlin:Springer-Verlag;1991:p 214.
55. Silverstein H.,McDaniel A.,Norrell H.,et al:Hearing preservation after acoustic neuroma surgery with intraoperative direct eighth cranial nerve monitoring. PartⅡ:A classification of results. Otolaryngol Head Neck Surg 1986;95:285.
56. Symon L.,Jellinek D.:Monitoring of auditory function in acoustic neuroma surgery. In:Schramm J.,Moller A.R.,ed. Intraoperative neurophysiological monitoring,Berlin:Springer-Verlag;1991:173.
57. Yingling C.D.:Intraoperative monitoring of cranial nerves in skull base surgery. In:Jackler R.K.,Brackman D.E.,ed. Neurotology,St. Louis:Mosby;1994:967.
58. Deletis V.:Intraoperative monitoring of the functional integrity of the motor pathways. Adv Neurol 1993;63:201.
59. Emerson R.G.,Turner C.A. Monitoring during supratentorial surgery. J Clin Neurophysiol 1993;10:404.
60. King BS,Rampil IJ. Anesthetic depression of spinal motor neurons may contribute to lack of movement in response to noxious stimuli. Anesthesiology. 1994;81:1484-1492.
61. Zhou HH,Mehta M,Leis AA. Spinal cord motoneuron excitability during isoflurane and nitrous oxide anesthesia. Anesthesiology. 1997;86:302-307.
62. Sebel PS,Lang E,Rampil IJ,White PF,Cork R,Jopling MW,et al. A multi- center study of the bispectral electroencephalogram analysis for monitoring anesthetic effect. Anesth Analg. 1997;84:891-899.
63. Rampil IJ,Weiskopf RB,Brown JG,Eger II EI,Johnson BH,Holmes MA,et al. I653 and isoflurane produce similar dose-related changes in the electro- encephalogram of pigs. Anesthesiology. 1988;69:298-302.