 去看看
去看看


1 男性不育症的定义
男性不育症是指育龄夫妻,有正常性生活且未采取避孕措施,由男方因素导致女方在一年内未能自然受孕。
男性不育症分为原发性不育和继发性不育。原发性不育是指男子从未使女性受孕;继发性不育是指男子曾有使女性受孕史。
不孕不育的发病率约15%,男女因素各占一半。
2 男性不育症的病因
男性不育症是由多种疾病和(或)因素造成的结果,通常根据疾病和因素干扰或影响生殖环节的不同,分为睾丸前、睾丸和睾丸后三个因素,病因不明的称为特发性男性不育。
2.1 睾丸前因素
该类患者生育功能的损害主要系下丘脑、垂体疾病等因素所致。
2.1.1 下丘脑疾病
2.1.1.1 原发性低促性腺激素型性腺功能减退综合征
由于下丘脑促性腺激素释放激素(GnRH)分泌障碍,导致促性腺激素分泌减少而继发性腺功能减退,导致睾丸生精功能障碍。常见的如卡尔曼氏综合征(Kallmannssyndrome),本病于1944年由Kallmann报告,病变部位在下丘脑伴嗅觉障碍或减退。
2.1.1.2 选择性黄体生成素(LH)缺乏症
该病又称生殖性无睾症,罕见,临床表现为不同程度的雄性化和男乳女性化的类无睾体征,患者睾丸大小正常或略大,精液量少,偶见少许精子。镜下可见成熟的生精上皮,但间质细胞(Leydig cell)少见,血清激素检查LH缺乏。
2.1.1.3 选择性卵泡刺激素(FSH)缺乏症
该病极为罕见,垂体FSH分泌不足,而LH正常,患者临床表现为有正常的男性性征和睾丸体积,但表现为无精子症或重度少精子症。
2.1.1.4 先天性低促性腺激素综合征
继发于数种综合征的性腺功能低下,如Prader-Willi综合征和Laurence-Moon-Bardet-Biedl综合征。
2.1.2 垂体疾病
2.1.2.1 垂体功能不足
由于肿瘤、感染、梗死、手术、放射、浸润和肉芽肿性病变等影响垂体功能所致,表现为血睾酮水平低下伴促性腺激素低下或正常偏低。全垂体功能障碍者,同时还伴有血清皮质类固醇低下,血FSH和生长激素水平低下。
2.1.2.2 高泌乳素血症
原发性高泌乳素血症常见于垂体腺瘤。泌乳素过高会引起FSH、LH和睾酮降低,导致生精障碍和性欲丧失、ED、溢乳、男性乳腺增生,有时还伴有其他激素代谢紊乱。
2.1.3 内源性或外源性激素异常
2.1.3.1 雄激素和(或)雌激素过多
雄激素过多见于口服类固醇激素、先天性肾上腺增生、有内分泌功能的肾上腺肿瘤或睾丸间质细胞肿瘤。而雌激素过多常见于过度肥胖、肝功能不全等。此外,还与一些能分泌雌激素的肿瘤如肾上腺皮质肿瘤等有关。
2.1.3.2 糖皮质激素过多
过多的糖皮质激素能抑制LH的分泌,导致精子发生、成熟障碍。多见于库欣综合征(Cushings syndrome)或医源性摄入增加。
2.1.3.3 甲状腺功能亢进或减退
甲状腺功能的异常主要通过垂体影响生精,甲亢或甲低可改变下丘脑激素的分泌和雌/雄激素比值,影响精子的发生与成熟。
2.2 睾丸因素
2.2.1 先天性异常
2.2.1.1 染色体或基因异常
遗传学异常是临床上导致男性不育症的重要因素。包括染色体核型异常、Y染色体微缺失、基因突变异常以及精子染色质异常等。
2.2.1.1.1 Klinefelter综合征,也称克氏综合征,常见核型为47,XXY,占80%~85%,嵌合体(47,XXY/46,XY)约占15%,其余为48,XXXY、49,XXXXY等,其表型随着X染色体数目的增加而加重。患者通常身材高大(与父母相比),第二性征发育异常、睾丸体积小、激素检查FSH、LH明显升高,睾酮稍低或者正常,伴有不育。
2.2.1.1.2 Y染色体微缺失。Y染色体长臂上存在控制精子发生的基因,称为无精子因子(azoospermia factor,AZF);在无精子症和少精子症的患者中,AZF缺失者约占3%~29%,发生率仅次于Klinefelter综合征,是居于第二位的遗传因素。
2.2.1.1.3 XYY综合征。患者通常身材高大,智力正常或轻度低下,性格孤僻,易发生攻击行为,生育力正常至无精子症均可发生。47,XYY理论上可形成4种类型的精子(X、Y、YY、XY),但实际上异常核型精子比例很低。
2.2.1.1.4 XX男性综合征(又称性倒错综合征)。该病是由于Y染色体上睾丸决定区基因(SRY)在减数分裂时易位到了X染色体或其他染色体,但控制生精的基因(AZF)仍在Y染色体,因此导致无精子症。
2.2.1.1.5 Noonan综合征(Noonan syndrome)。又称男性Turner综合征,染色体核型大部分为正常46,XY,少数为45,X0或嵌合型(45,X0/46,XY)。
2.2.1.2 隐睾
隐睾是小儿常见的泌尿生殖系统先天性畸形,早产儿隐睾发病率约30%,新生儿为3.4%~5.8%,1岁时约0.66%,成人为0.3%。
2.2.2 睾丸炎
青春期后的流行性腮腺炎30%合并睾丸炎,常为单侧,双侧发病率为10%~30%,睾丸萎缩是病毒性睾丸炎最常见的严重后果,但它较少见于细菌感染。
2.2.3 睾丸损伤
睾丸损伤,除导致睾丸萎缩外,还可激发异常免疫反应,两者均可导致不育;睾丸血管的医源性损伤也会导致不育。睾丸扭转可引起睾丸缺血性损伤。
2.2.4 精索静脉曲张
在不育症患者中的发病率近40%。精索静脉曲张引起不育往往包含多种因素综合作用的结果。
2.3 睾丸后因素
睾丸后因素造成的不育症可以分为梗阻因素、性功能相关因素以及精子成熟相关因素。
2.3.1 梗阻因素
输精管道梗阻是男性不育的重要病因之一,梗阻性无精子症在男性不育患者中约7%~10%。梗阻的分类通常是根据患者梗阻的部位来分类。常见的包括附睾梗阻、输精管梗阻、射精管梗阻。还有比较难以诊断的睾丸内梗阻。
2.3.1.1 附睾梗阻
附睾梗阻是造成梗阻性无精子症的最常见病因,30%~67%的无精子症由附睾梗阻造成。多数附睾梗阻病因不清,少数病因明确,包括先天性因素和继发性因素。引起附睾梗阻的先天性因素主要为囊性纤维化(Cystic fibrosis,CF)、扬氏综合征(Young syndrome,慢性鼻窦炎、支气管扩张和梗阻性无精子症)等。此类患者常由于浓缩物质阻塞附睾而表现为无精子症,外科重建效果差,不建议手术治疗。附睾炎是造成继发附睾梗阻的常见原因。输精管梗阻引起的继发附睾梗阻也较常见,如输精管结扎后附睾梗阻。
2.3.1.2 输精管梗阻(缺如)
输精管梗阻常见于输精管结扎术后、儿时双侧腹股沟处手术(疝修补、鞘膜积液手术等)。少部分也可能继发于各类感染。输精管缺如是一类特殊的输精管梗阻,目前的研究认为与CFTR基因突变相关。
2.3.1.3 射精管梗阻
约占无精子症病因的5%,可以由先天性的沃尔夫管囊肿(Wolffian duct cyst)、苗勒管囊肿(Mullerian duct cyst)或炎症导致射精管口阻塞。还有部分医源性因素。
2.3.2 性功能相关因素
性欲减退、ED、射精功能障碍是不育症的原因,除部分器质性原因外,大部分通过性咨询和药物治疗可以治愈;尿道下裂等解剖学异常由于射出精液距宫颈过远可导致不育;糖尿病、膀胱尿道炎症、膀胱颈部肌肉异常、尿道下裂、手术或外伤损伤神经也可导致不射精或逆行射精;不良的性习惯如性交过频繁、应用兴奋剂、润滑剂等也会影响生育。
2.3.3 精子成熟相关因素
2.3.3.1 纤毛不动综合征
该病是由于精子运动器或轴突异常而导致其运动力的降低或丧失,从而导致生育障碍。
2.3.3.2 成熟障碍
常见于输精管结扎再通后。由于结扎后附睾管内长期高压损伤了附睾功能,再通后精子通过附睾时未获得正常的成熟和运动能力,因此活力低下,但精子数目可以正常。
2.4 特发性病因
特发性不育是指男性不育症找不到明确病因者,其影响生殖的环节可能涉及睾丸前、睾丸本身、睾丸后的一个或多个环节。目前倾向与遗传或环境等因素相关。
3 男性不育症的诊断
3.1 诊断方法
3.1.1 病史
病史采集和病历书写应当客观、真实、准确、及时、完整,符合《病历书写基本规范》。
3.1.1.1 主诉及现病史
3.1.1.1.1 男性不育症主诉主要包括
未避孕未育XX年(月)。
3.1.1.1.2 婚育史
需要了解结婚或同居时间,尝试妊娠的时间;应详细了解配偶的既往生育史。
3.1.1.1.3 性生活史
需要了解性生活频率、勃起功能、射精情况。初步了解是否为性功能障碍导致的不育。
3.1.1.1.4 生育力检测及治疗史
要详细询问既往不育相关的检查和治疗情况,尤其是精液的情况。了解患者曾经的治疗手段、治疗时间以及治疗效果。
3.1.1.2 既往史
主要包括生长发育史、过去疾病史、传染病史、用药史等。要重点询问与生育相关的疾病和因素,主要包括腮腺炎、附睾炎、睾丸炎等泌尿生殖器官感染史、手术外伤史、内分泌病史等可能影响睾丸生精功能、性功能和附属性腺功能的疾病、因素。同时要了解有无化疗、放疗以及应用影响生育的药物等情况。
3.1.1.3 家族史、遗传性疾病史
父母有无近亲结婚,有无遗传性疾病史,母亲生育情况以及兄妹健康、生育情况等。应充分了解有无影响优生优育的家族性遗传因素;必要时描绘出家族系图。
3.1.2 体格检查
3.1.2.1 全身检查
重点应注意体型及第二性征。
重点了解体毛分布情况以及有无男性乳房发育等表现,应特别注意腹股沟区域是否有瘢痕。
3.1.2.2 生殖系统检查
应注意有无阴茎畸形,阴茎检查时应注意有无尿道下裂、尿道上裂、尿道外口狭窄等可能妨碍性交或阴道内射精的疾病。
检查阴囊时应注意睾丸及附睾的位置、质地、大小,有无压痛、肿块及鞘膜积液。输精管检查时应注意有无缺如、增粗、结节或者触痛。有无精索静脉曲张及其程度。
3.1.2.3 其他检查
射精功能障碍的患者,可进行以下检查以排除神经系统疾病:球海绵体肌反射等。必要时参考ED、PE指南。
3.1.3 辅助检查
3.1.3.1 推荐检查项目
3.1.3.1.1 精液分析
精液检查结果的分析推荐参照《WHO人类精液及精子-宫颈黏液相互作用实验室检验手册》第5版(或第4版)进行(表2-1,表2-2),如第一次精液分析结果正常,通常不需要进行第二次分析,精液分析结果必须与临床检查相印证。如再次精液分析结果与第一次相差显著,则需进行第三次精液分析。无精子症诊断要特别慎重,至少要进行3次以上严格的精液采集和检查,且所有显微镜检查未见精子的精液标本都应离心确定沉渣中无精子。
表2-1 精液特性的参考值下限(第5百分位数,95%可信区间)根据《WHO人类精液及精子-宫颈黏液相互作用实验室检验手册》第5版
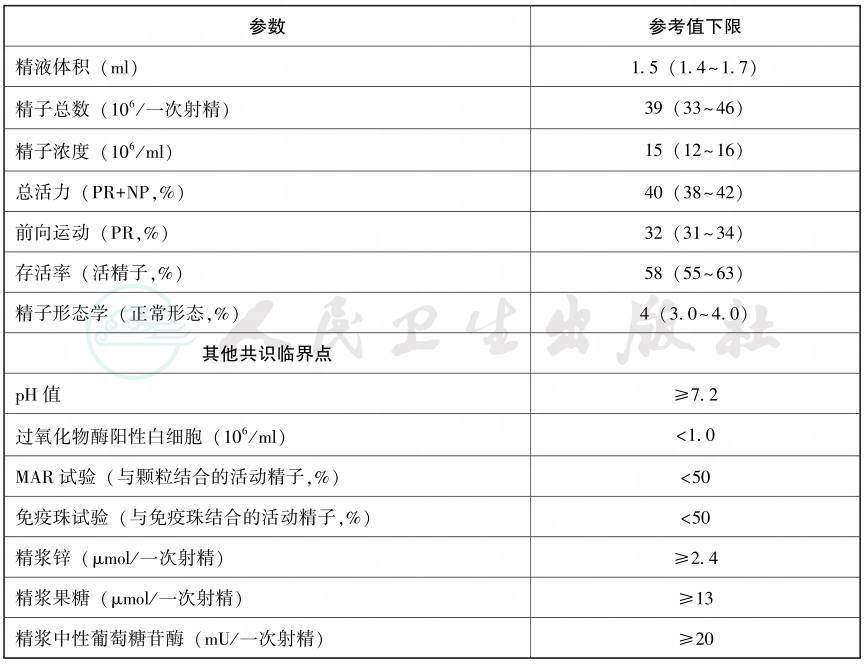
表2-2 各种精液状态的诊断名称
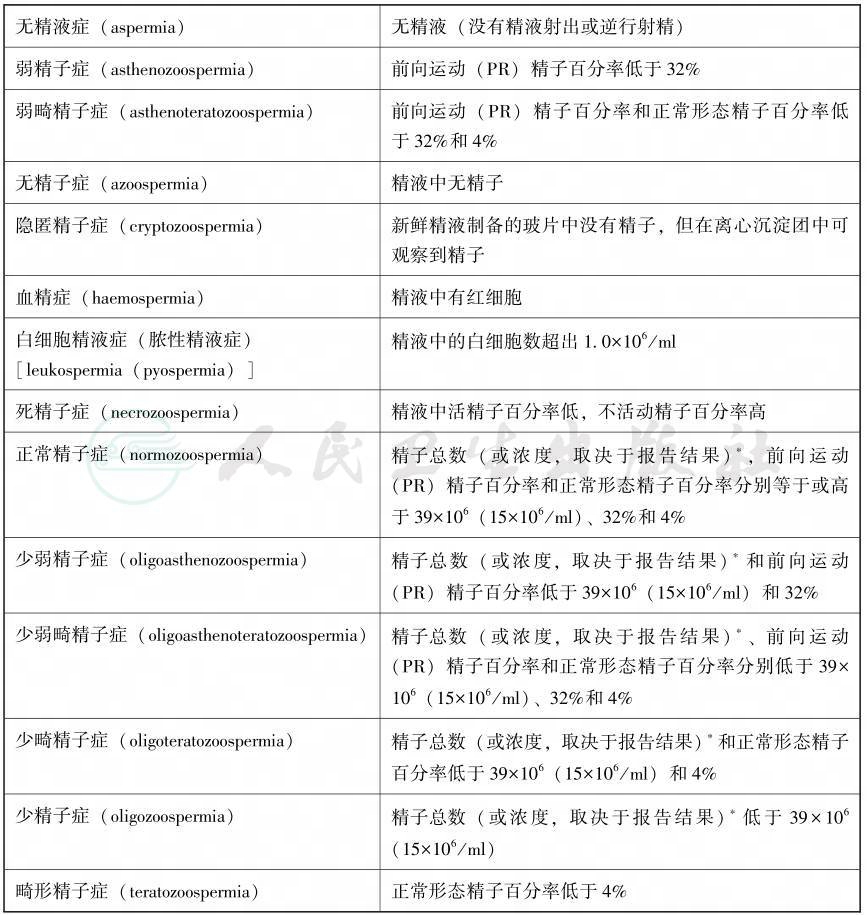
∗应该总是优先考虑精子总数,因为精子总数优于精子浓度
3.1.3.1.2 生殖内分泌激素检查
建议上午10点前空腹血液检测。常用的生殖内分泌激素指标有睾酮(T)、雌二醇(E2)、泌乳素(PRL)、黄体生成素(LH)、卵泡刺激素(FSH)等。
3.1.3.1.3 生殖系统超声检查
生殖系统超声检测包括阴囊超声及经直肠超声。
阴囊超声主要检测双侧睾丸、附睾、精索静脉及近端输精管。通过测量睾丸上下径、左右径、前后径,并使用公式校正后计算睾丸体积(体积=睾丸上下径×左右径×前后径×0.71)。
经直肠超声主要针对前列腺、精囊、输精管和射精管进行检查。
3.1.3.2 可选择检查项目
根据病史、体格检查以及精液分析等检查结果,可选择下列有关检查:
3.1.3.2.1 精浆生化检查
精浆生化常用指标包括果糖、中性α-葡糖苷酶、酸性磷酸酶、锌和弹性蛋白酶等,重点了解果糖、中性α-葡糖苷酶的含量,对不育的诊断及外科治疗有指导意义。果糖浓度的测定可以反映精囊腺的分泌功能,果糖浓度降低时亦可见于射精管梗阻、双侧输精管先天性缺如、精囊发育不全、不完全逆行射精和雄激素缺乏等。中性α-葡糖苷酶活性高低反映附睾分泌功能,附睾管梗阻时可出现降低。
3.1.3.2.2 男性生殖遗传学检查
与男性不育相关的遗传学检查主要包括染色体核型、Y染色体微缺失、基因突变、基因多态性、基因芯片等方法。其中Y染色体微缺失推荐以下8个位点,包含位点AZFa:sY84,sY86、AZFb:sY127,sY134、AZFc:sY254,sY255、AZFd:sY145,sY152,不同位点的缺失其临床意义不同。
3.1.3.2.3 精子DNA完整性检查
精子DNA的完整性是父系遗传信息传递给子代的前提。精子DNA完整性异常会严重影响到精子受精、受精后原核形成,并可能导致流产。临床常用精子DNA碎片指数(DNA Fragment Index,DFI)来评价精子DNA的完整性。精子DFI升高可造成配偶不孕、反复流产、胎停育等,也是宫腔内人工授精(IUI)、IVF/ICSI成功率的影响因素,对上述患者建议常规筛查。目前常用的为基于流式细胞术的染色质结构分析方法来检测DFI。
3.1.3.2.4 生殖道相关支原体、衣原体等病原微生物检测
对于精液参数异常患者及不明原因不育者,尤其是精液白细胞增多、合并尿道分泌物的患者应进行支原体、衣原体等病原微生物检测。RNA检测技术因其灵敏度高、特异性强、更准确地判定疗效等特点,更适于生殖道常见病原微生物的检测。
3.1.3.2.5 精子存活率检测
主要用于反映不活动精子中活精子所占比例,可用染色排除法或低渗肿胀实验来鉴定。前者多为伊红染色,后者主要是精子低渗肿胀试验。
3.1.3.2.6 射精后尿液离心检查
主要针对无精液或精液量少者,根据射精后尿液离心检查是否找到精子,可以辅助诊断逆行射精或部分逆行射精。
3.1.3.2.7 抗精子抗体(AsAb)检测
对于不明原因不育、精子大量特异性凝集、性交后试验异常等情况,可进行抗精子抗体检测。临床上检测精子表面结合抗体是诊断自身免疫性不育的特异性方法。
3.1.3.2.8 睾丸活检
睾丸活检是无精子症中常用的诊断方法。对于条件具备的单位可以同时冷冻保存精子或睾丸组织,以备将来应用于辅助生殖技术。拟行输精管附睾吻合手术的患者,术前不推荐睾丸/附睾活检。常用的睾丸活检方法:睾丸切开活检术(testicular sperm extraction,TESE)、经皮睾丸穿刺活检术(testicular sperm aspiration,TESA)、睾丸细针精子抽吸术(fine-needle aspiration,FNA)。目前不推荐附睾穿刺活检(epididymal sperm aspiration, PESA)。
3.1.3.2.9 其他
包括:精子-宫颈黏液体内(外)试验、盆腔MRI影像学检查等。
3.2 诊断流程
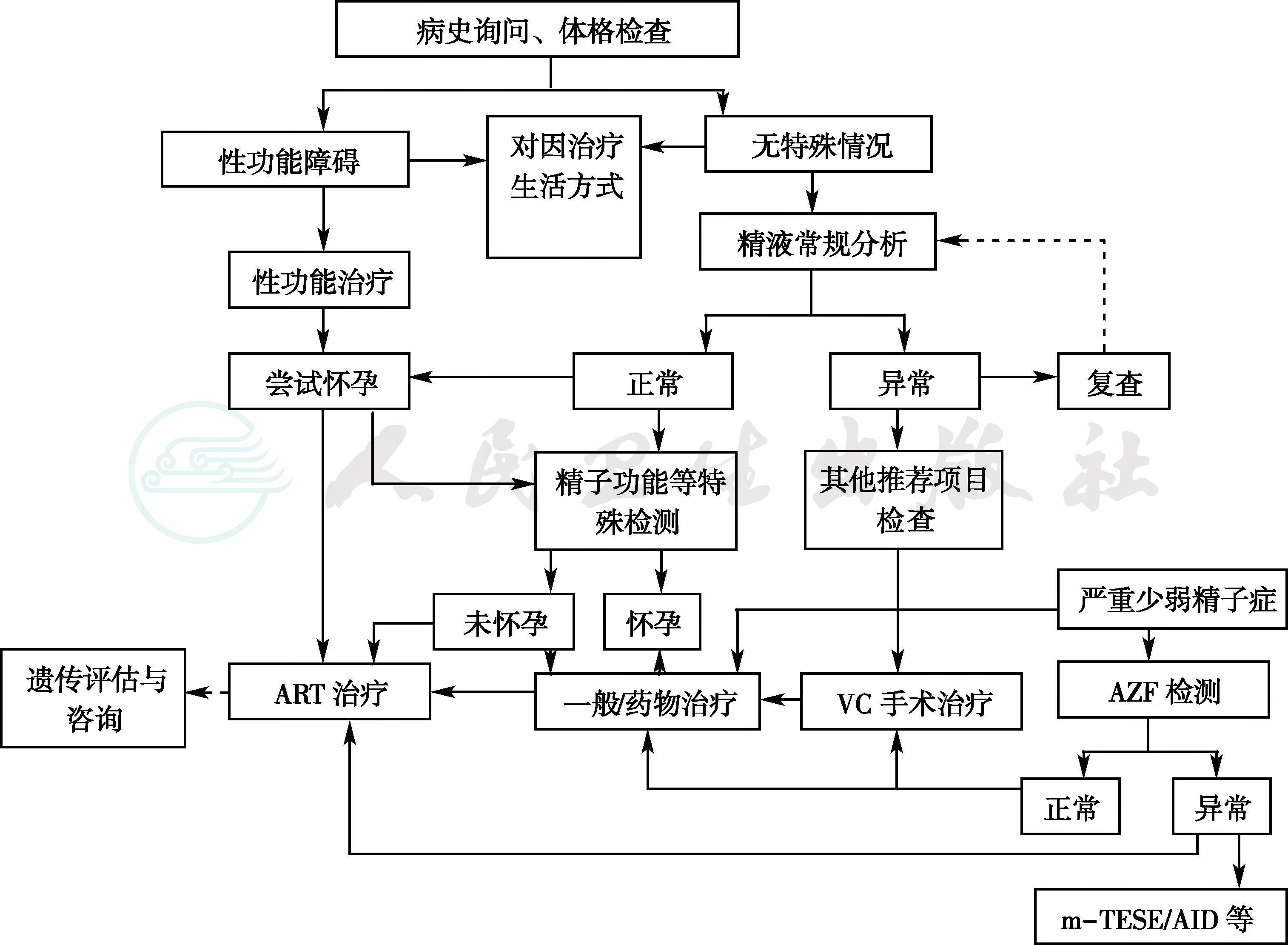
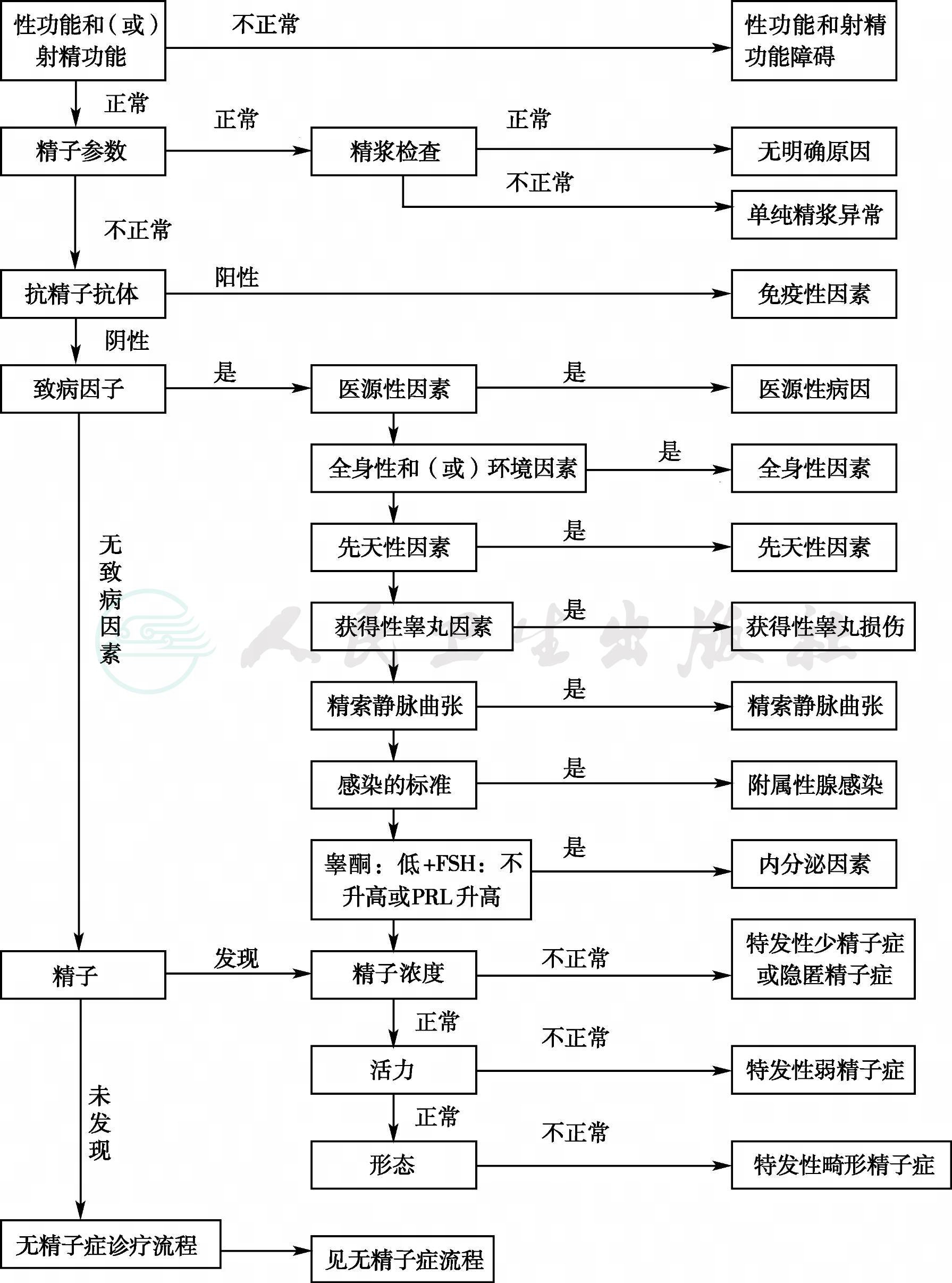
根据患者的病史、生殖腺毒素接触情况、体格检查以及辅助检查结果等,明确发病部位(睾丸前、睾丸、睾丸后),按照诊断流程可以得出初步诊断(详见附录一、附录二、附录三)。
4 男性不育症的治疗
对于不育患者,首先应根据生活习惯、工作环境等进行有针对性的生殖健康宣教,然后根据患者及配偶的具体情况,推荐选择药物治疗、手术治疗或辅助生殖技术。药物治疗在临床上广泛使用,创伤和费用较小,患者易于接受。进行药物治疗应该至少覆盖1~2个生精周期(即3~6个月),同时进一步评价药物治疗的适应证和疗效。
4.1 药物治疗
4.1.1 基础性治疗
适合少精子症、弱精子症、畸形精子症以及同时存在上述几种情况的患者,同时也适用于拟行自精辅助生殖助孕前的患者。基础性治疗包括三大类:抗氧化治疗、改善细胞能量代谢的治疗以及改善全身和生殖系统(睾丸、附睾等)微循环的治疗。
4.1.1.1 抗氧化治疗
抗氧化治疗可改善全身或局部的微环境,对精子生成以及保护精子的结构和功能都有积极意义。每一种抗氧化药物都具有特定的作用机制,其作用不能互相替代,且具有协同作用,从而达到对细胞的全面保护。维生素E是最主要的抗氧化剂之一,在体内可通过对抗ROS所导致的膜脂质过氧化损伤,保护精子的结构与功能,提高男性精子的浓度、活力以及形态正常精子百分率。大量研究发现,使用药品级(含量大于90%)天然维生素E治疗由少弱精子症、畸形精子症、精子DNA损伤以及精索静脉曲张导致的男性不育是安全有效的。目前市场上常用的天然维生素E有来益®天然维生素E软胶囊等,其他抗氧化治疗药物有硫辛酸、谷胱甘肽以及乙酰半胱氨酸等。
4.1.1.2 改善细胞能量代谢的治疗
该类药物可在提高细胞线粒体氧化功能等多个方面改善全身组织和细胞代谢能力,并且多兼具抗氧化作用,进而调节睾丸支持细胞功能、改善精子的形成和成熟过程。附睾内精子主要依靠长链脂肪酸和磷脂等物质在线粒体内通过β-氧化供能,但脂肪酸不能直接透过线粒体内膜,必须由卡尼汀转运完成。卡尼汀不但将脂肪酸和磷脂转运进入线粒体内,同时也可以将脂肪酸转运至附睾上皮,再经附睾上皮转运至附睾管腔和精子细胞内。常用的药物有左卡尼汀(东维力)等。
4.1.1.3 改善全身和生殖系统微循环的治疗
此类药物通过提高血管的弹性及收缩功能、改善血流状态、增加组织血流量来改善全身或局部组织的微循环功能,通过改善睾丸与附睾血液循环,提供睾丸生成和成熟的理想微环境,进而促进睾丸的生精作用以及附睾内的精子成熟,此外,还可促进精子ATP酶的活性,增加精子活力,改善顶体功能,有利于顶体反应顺利进行,促进精子穿透透明带,常用的药物有七叶皂苷类、胰激肽原酶等。
4.1.2 病因治疗
病因治疗主要指针对男性不育病因明确或影响男性生育的高危因素,进行针对性的药物治疗,其使用机制相对明确。
4.1.2.1 抗感染治疗
附属性腺感染对降低男性生育力有潜在的影响。男性附属性腺感染可根据其临床症状和细菌学检查确诊,使用敏感的抗生素治疗。
4.1.2.2 内分泌治疗
促性腺激素类,包括促性腺激素释放激素(Gonadotropin-releasing hormone,GnRH)、人绒毛膜促性腺激素(human chorionic gonadotropin,hCG)和人绝经期促性腺激素 (human menopausal gonadotropin,hMG)。
hCG和hMG适用于各种诊断明确的原发性或继发性促性腺激素低下性性腺功能减退症,效果较为确切。治疗前需排除高泌乳素血症,对于怀疑垂体肿瘤者应行MRI检查。常用剂量hCG 2000-5000IU,肌注,2~3次/周。对于原发性(先天性)促性腺激素分泌不足的,在上述基础上加用hMG75~150IU,肌注,2~3次/周。有报道微量泵脉冲式皮下注射GnRH治疗用于Kallmann综合征和特发性促性腺激素低下性性腺功能减退症的患者,但使用不方便、治疗费用较高,临床应用较少。对于临床考虑由于FSH对于生精小管刺激不足而导致生精功能障碍的患者,可以考虑使用FSH的治疗,常用剂量FSH 75IU,肌注,每3天一次。
4.1.2.3 免疫抑制剂治疗
继发于先天性肾上腺皮质增生的男性不育可用糖皮质激素治疗。对于抗精子抗体阳性的患者,系统回顾和Meta分析显示抗精子抗体并未对精子数量、活力、前向运动能力和精子形态造成显著影响,使用免疫抑制剂治疗可能出现一系列的副作用,建议慎重使用。
4.1.2.4 多巴胺受体激动剂
排除需手术治疗垂体肿瘤的高泌乳素血症可采用多巴胺受体激动剂-溴隐亭(Bromocriptine)等治疗。
4.1.2.5 甲状腺素片
对于甲状腺功能减退者补充甲状腺素可能改善生育力。
4.1.3 其他治疗
此类治疗方法尽管作用的机制不是十分明确,但是在国内外均有文献报道,确实存在一定疗效,有待临床进一步研究。
4.1.3.1 调控雌激素作用类药物
4.1.3.1.1 雌激素受体拮抗剂
此类药物通过阻断雌激素的负反馈抑制效应而促进垂体分泌促性腺激素,继而提高血清中LH和FSH水平,以刺激睾丸间质细胞产生睾酮和促进精子生成。临床常用的有氯米芬和他莫昔芬。
4.1.3.1.2 芳香化酶抑制剂
此类药物通过阻断睾酮转化为E2所需的芳香化酶的作用来抑制睾酮转化为E2,从而增加睾酮水平,降低雌激素水平,以促进精子成熟和精子数量的增加。临床常用的有来曲唑和阿那曲唑。
4.1.3.2 其他
重组人生长激素、非甾体抗炎药物、锌、硒、氨基酸、维生素A、维生素D、α受体阻滞剂等也均有文献报道,可能改善精液质量、提高受孕率,但缺乏大规模临床研究证实。
4.2 性功能障碍的综合治疗策略
参照中华医学会男科学分会ED指南、PE指南。
4.3 手术外科治疗
4.3.1 精索静脉曲张
精索静脉曲张手术治疗包括传统经腹股沟途径/经腹膜后途径精索静脉结扎术、显微腹股沟途径/腹股沟下途径精索静脉结扎术及腹腔镜精索静脉结扎术等。多项荟萃分析显示显微手术在效果和并发症等方面略优于其他方式。
适应证:临床型精索静脉曲张伴精液质量异常的不育患者,可选择手术。亚临床型精索静脉曲张一般不推荐手术。
并发症:主要有鞘膜积液、睾丸动脉损伤、精索静脉曲张持续存在或复发等(可见中华医学会男科学分会《精索静脉曲张诊疗共识》相关部分)。
4.3.2 梗阻性无精子症
对无精子症有效治疗的前提是准确判断病因,针对病因进行相应的治疗。绝大多数梗阻性无精子症都可以通过外科手术得到治疗,根据梗阻部位,选择不同的手术方式,最常见的梗阻部位在附睾和射精管开口。手术前应该评估睾丸的生精功能,同时要考虑女性的生育力及年龄。
4.3.2.1 附睾梗阻的治疗
显微输精管附睾吻合术用于治疗由附睾炎、输精管结扎术后和不明原因的继发性附睾梗阻性无精子症。手术复通率60%~87%,受孕率10%~43%。吻合技术和疾病情况(附睾精子活动与否、吻合部位等)是手术复通成功率的关键。
4.3.2.2 输精管梗阻的治疗
输精管结扎复通、外伤或医源性损伤输精管远端(睾丸侧)的患者可行输精管吻合术,显微输精管吻合术效果好,复通率可达90%以上。因为输精管梗阻可能继发附睾梗阻,准备进行输精管吻合手术的术者必须具备显微输精管附睾吻合的技术。
对于输精管梗阻部位在近端(输精管腹侧,如输精管壶腹处等)或输精管多节段梗阻的情况,吻合困难,建议睾丸穿刺取精通过辅助生殖技术生育。
4.3.2.3 射精管开口梗阻
手术方式包括:精囊镜手术、经尿道射精管区囊肿开窗术、经尿道射精管口切开术。精囊镜手术效果更好,并发症更少。
适应证:①射精管开口梗阻的无精子症患者;②射精管开口不全梗阻造成的严重弱精症、严重少精子症患者。
4.4 非梗阻性无精子症的外科处理
是一种通过外科手段获取精子进行辅助生殖技术为目的的治疗方法,包括睾丸穿刺/切开取精术以及显微镜下睾丸切开取精术。
睾丸(穿刺/切开)取精术适应证:①考虑非梗阻性无精子症患者。②睾丸体积大于6ml。
显微取精术(m-TESE)是通过显微外科的技术在手术显微镜下从非梗阻性无精子症患者的睾丸中提取精子进行辅助生殖的手术。不仅需要男性生殖手术设备和技术力量,还需要生殖中心的实验室和辅助生殖的配合。而且要与患者和家属充分沟通和告知,包括成功率和遗传(如Y染色体c区缺失在男性胚胎会遗传)等事宜。
显微取精适应证:①克氏综合征患者(Klinifelter’s Syndrome);②隐睾术后患者;③Y染色体缺失(c区或c+d区)患者;④睾丸体积过小不宜睾丸活检的非梗阻性无精子症患者;⑤睾丸活检未找到精子的患者。
4.5 中医药治疗
中医药治疗男性不育症有着悠久的历史。对于特发性不育症,在现阶段中医药治疗具有明显优势,可以以中医药为主进行治疗;对于因精索静脉曲张、性腺功能低下、性功能障碍、免疫因素、全身和系统性疾病等其他因素导致的不育症,可以用中医药辅助治疗。
中医药治疗不育症,辨证论治是核心。纵览古今文献,补肾法贯穿不育症诊疗的始终。临床上常见的证候有肾阴不足、肾阳虚衰、气滞血瘀、湿热下注、脾气亏虚、肝气郁结等,2种以上的兼挟证候居多,脾肾亏虚挟湿热瘀毒较为常见。临床可以选用具有补肾、滋阴、温阳、健脾、益气、活血、疏肝、清利等功效的中药进行治疗。
中医药治疗不育症,亦可辨病论治或辨病与辨证相结合,常用药物包括麒麟丸、生精胶囊、连生生生精片等。
4.6 辅助生殖技术
辅助生殖技术指运用各种医疗措施,使患者受孕方法的统称,包括人工授精、试管婴儿和供精辅助生育。试管婴儿技术包括:体外受精-胚胎移植(IVFET)、卵胞浆内单精子注射(ICSI)、移植前遗传学诊断(PGD)/移植前遗传学筛查(PGS)。
4.7 辅助生殖治疗中男科诊疗注意事项
男科医师应该对不育患者进行规范的检查和正确的诊断,进而制订合理的治疗方案,首选药物治疗或手术治疗等常规治疗,以期改善精液质量,增加自然妊娠率,必要时再运用ART。基本原则:①优先选择简单、便宜、创伤小的方法和技术,再选择复杂、昂贵、创伤大的方法。②优先考虑自然生育、再依次考虑IUI、IVF、ICSI和PGD等辅助生殖技术。根据不同的适应证,选择针对性的辅助生殖技术。③注意女方生育力。④降低子代治疗风险、降低夫妇及社会治疗成本。
5 男性不育症患者宣教要点及预后
5.1 影响男性生育力的夫妻因素
5.1.1 在夫妇之间,生育力强的一方可以弥补生育力弱的一方。因此,精液参数异常并不代表一定无法生育。
5.1.2 女方的年龄因素也是影响生育的重要因素。当女方大于34岁时,尝试妊娠6个月未使女方妊娠就可以进行检查和治疗。因为35岁、38岁和40岁女性的生育能力分别是25岁女性生育力的50%、25%和5%。
5.1.3 性生活的时机、频率、是否存在性功能障碍都将影响受孕。性交时间应该选择在排卵期间,但不应仅限于预测排卵当天。非排卵期间也应有适当频率的性生活。
5.1.4 自然不育的时间对于预测其未来生育能力是重要的。那些不育病史不到3年的不育夫妇,有较好的自然受孕机会。如果自然不育时间越长,存在的问题越严重。
5.2 影响男性生育力的几种因素
5.2.1 不良生活习惯
吸烟、酗酒、吸毒、穿紧身裤、桑拿浴等对生育有明确的影响;久坐、缺乏运动也会影响生育;
5.2.2 环境因素是男性生育能力不断下降的重要原因
暴露因素:长期暴露在有毒的装饰材料和油漆涂料、香烟烟雾、二硫化碳、二溴氯丙烷、甲基乙基酮、甲醛、家用煤气,汽车废气、电磁波(如雷达、移动发射基站、长期不当使用电脑、微波炉、电视、洗衣机、充电器等),放射线以及高温工作均可降低生育能力。
环境雌激素:快速增肥的动物饲料、各种塑料器皿、化学稀释剂、多氯联苯、双酚A、烷基苯酚、邻苯二甲酸盐等70多种内分泌干扰物源,在环境中产生类雌激素成分,进入男性机体后,干扰内分泌系统,影响生育。
其他:如重金属(如铅、镉、汞、铝、铜、锰等)、化学物质(如杀虫剂、除草剂)。
5.2.3 药物
化疗药、激素类药物、利尿药、治疗消化道溃疡的药物西咪替丁、抗高血压的钙离子拮抗剂可影响精子的数量和活力。对以上药物尽量寻找不影响生精功能的替代药物,若必须使用可以考虑在在治疗前冷冻保存精液。
5.3 精液检查的宣教要点
精液分析的结果只能说明生育可能性的大小,它的波动性较大,可能会受到身体情况、各种外界环境的影响。因此,精液检查前的注意事项尤为重要。
5.3.1 精液标本采集前对禁欲时间的要求
禁欲时间的长短会影响精液分析的参数。因此,应向受检者充分告知,精液标本采集前应禁欲至少48小时,但不超过7天。
5.3.2 精液标本采集方法
手淫法:为推荐的取精方法。手淫前先清洗双手和阴茎,通过手淫的方法把全部精液射入容器中。取精过程不得使用润滑油或者唾液,精液标本不要被尿液、水、肥皂等污染。
5.4 男性不育症的预后因素
不育持续时间:正常情况下,生育力正常的夫妇单月妊娠率为20%~25%,半年妊娠率为75%,1年妊娠率为90%。当正常同房未采取避孕措施而不能生育的时间超过4年时,则每月的妊娠率仅约1.5%。
附录一 男性不育症诊疗策略流程图1
附录二 男性不育症诊疗策略流程图2
附录三 无精子症诊疗策略流程图
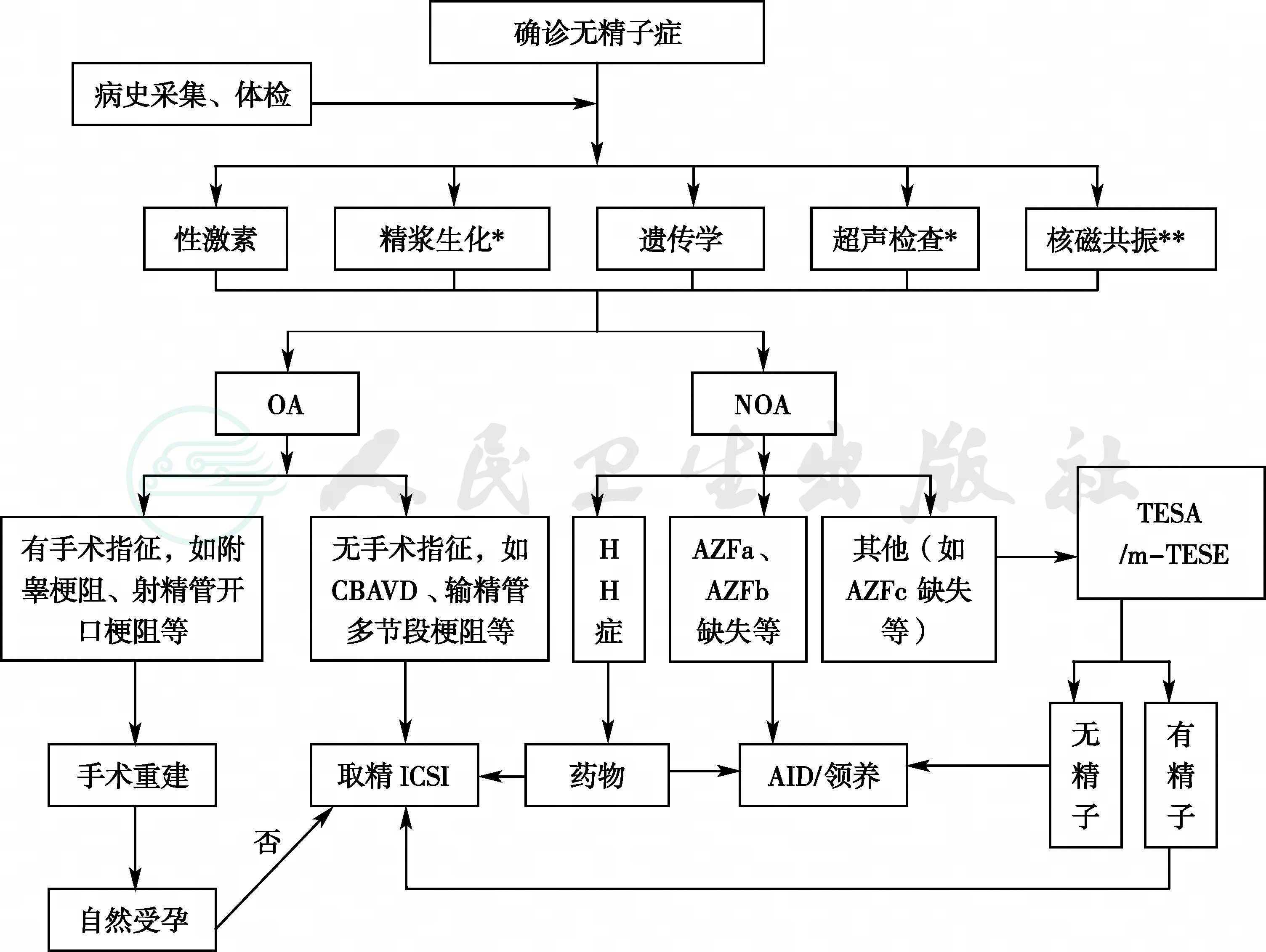
∗精浆生化和超声检查:根据患者情况可选。
∗∗磁共振检查对部分患者在鉴别有无射精管开口梗阻时选择,并非全部患者需要检查。
1.WHO, Manual for the Standardized Investigation and Diagnosis of the infertile Couple.2000, Cambridge University Press:Cambridge.
2.Greenhall, E, et al.The prevalence of subfertility: a review of the current confusion and a report of two new studies.Fertil Steril, 1990.54: 978.
3.郭应禄,胡礼泉.男科学 [M].第1版,北京,人民卫生出版社2004,937-967.
4.Dohle GR,Colpi GM,Hargreave TB, et al.EAU guidelines on male infertility, Eur urol JT-European urology.48 (5).Switzerland, 2005.730-11.
5.Dohle GR, WeidenerW, Jungwrith S, et al.Guidelines on Male nfertility.Europear Association of Urology,Mar 2004;1-63.
6.郭应禄,胡礼泉主编,男科学 [M],第一版,北京:人民卫生出版社,2004,942-967.
7.吴阶平,吴阶平泌尿外科学 [M].济南:山东科学技术出版社,2004,1491-1511.
8.中华医学会男科学分会男性生殖遗传学检查专家共识.中华男科学杂志2016.
9.Comhaire, F., and A.Mahmoud.The Consensus-Based Approach to Standardized Diagnosis and Management of the Infertile Male.Andrology for the Clinician.Springer Berlin Heidelberg, 2006: 77-81.
10.Anne M Jequier MB BS FRCS FRCOG FRACOG Clinical Associate Professor and Head of Fertility Service."WHO Manual for the Standardized Investigation, Diagnosis and Management of the Infertile Male."? Urology? 57.1 (2001): 55-55.
11.Sabanegh E AA.Male infertility.In: Wein AJKL, Novick AC, editor.10th ed.Campbell-Walsh urology. Philadelphia:Saunders2012.p.636-637.
12.世界卫生组织编著,WHO人类精液及精子-宫颈黏液相互作用实验室检验手册.第五版,北京:人民卫生出版社,2010.
13.Jungwirth A, Giwercman A, Tournaye H, Diemer T, Kopa Z, Dohle G, Krausz C; European Association of Urology Working Group on Male Infertility.European Association of Urology guidelines on Male Infertility:the 2012 update.Eur Urol.2012 Aug; 62 (2): 324-32.
14.Jarow, J., Kolettis, P.N., Lipshultz, L.R., Mcclure, R.D., Nangia, A.K., &Naughton, C.K.,et al. (2010).The optimal evaluation of the infertilemale: AUA best practice statement.
15.Sigman, M., Kolettis, P.N., Lipshultz, L.R., Mcclure, R.D., Nangia, A.K., &Naughton, C. K., et al. (2010).The evaluation of the azoospermicmale: AUA best practice statement.
16.中华医学会编著.临床诊疗指南:辅助生殖技术与精子库分册.北京:人民卫生出版社,2009.
17.Tournaye H, Krausz C, Oates RD.Concepts in diagnosis and therapy formale reproductive impairment.Lancet Diabetes Endocrinol.2016 Jul 6.pii: S2213-8587 (16) 30043-2.
18.Kathrins M,Niederberger C.Diagnosis and treatment of infertility-related male hormonal dysfunction.Nat Rev Urol.2016 Jun; 13 (6): 309-23.
19.Modgil V, Rai S, Ralph DJ, Muneer A.An update on the diagnosis and management of ejaculatory duct obstruction.Nat Rev Urol.2016 Jan; 13 (1): 13-20.
20.Morrison CD,Brannigan RE.Metabolic syndrome and infertility in men.Best Pract Res Clin Obstet Gynaecol.2015 May; 29 (4): 507-15.
21.Oehninger S, Franken DR, Ombelet W.Sperm functional tests.Fertil Steril.2014 Dec; 102 (6):1528-33.
22.Gimenes F, Souza RP, Bento JC, Teixeira JJ, Maria-Engler SS, BoniniMG, Consolaro ME.Male infertility: a public health issue caused by sexually transmitted pathogens.Nat Rev Urol.2014 Dec; 11 (12):672-87.
23.Lotti F,MaggiM.Ultrasound of the male genital tract in relation to male reproductive health.Hum Reprod Update.2015 Jan-Feb; 21 (1): 56-83.
24.Wright C, Milne S, Leeson H.Sperm DNA damage caused by oxidative stress: modifiable clinical, lifestyle and nutritional factors inmale infertility.Reprod Biomed Online.2014 Jun; 28 (6): 684-703.
25.Drabovich AP, Saraon P, Jarvi K, Diamandis EP.Seminal plasma as a diagnostic fluid formale reproductive system disorders.Nat Rev Urol.2014 May; 11 (5): 278-88.
26.罗丽兰,不孕与不育 [M],第2版,人民卫生出版社,2009,829-842.
27.吴敏,抗精子抗体在不孕不育患者诊断中的临床应用价值,实验与检验医学,2016,34(1):76-79.
28.崔胜利,刘春玲,董洁.泌尿生殖道感染不育男性与精子活率、抗精子抗体的关系研究,中国性科学, 2015, 24 (8): 90-92.
29.Zhao Y, Zhao E, Zhang C, et al.Study of the Changes of Acrosomal Enzyme, Nitric Oxide Synthase, and Superoxide Dismutase of Infertile Patientswith Positive Antisperm Antibody in Seminal Plasma.Cell Biolchem Biolphys[J].2015; 73 (3): 639-42.
30.Pochernikov DG, Vinokurov EIu, Strel'nikov AI, et al.Experience in the treatment of autoimmunemale infertility in patientswith category 4 chronic prostatitis[J], Urologia, 2014; (6): 75-80.
31.Bieniek JM,Drabovich AP,Lo KC.Seminal biomarkers for the evaluation ofmale infertility.Asian JAndrol [J].2016; 18 (3): 426-33.
32.Cui D, Han G, Shang Y, et al.Antisperm antibodies in infertilemen and their effect on semen parameters:a systematic review and meta-analysis.Clin Chim Acta[J], 2015, 15; 444: 29-36.
33. Showell MG, Mackenzie-Proctor R, Brown J, et al.Cochrane Database Syst Rev.2014;(12): CD007411.
34.Cui D, Han G, Shang Y, etal.Antisperm antibodies in infertilemen and their effect on semen parameters:a systematic review and meta-analysis.Clin Chim Acta.2015, 444: 29-36.
35.Kathrins M,Niederberger C.Diagnosis and treatment of infertility-related male hormonal dysfunction.Nat Rev Urol.2016, 13 (6): 309-23.
36.Nadjarzadeh A, Shidfar F, AmirjannatiN, etal.EffectofCoenzyme Q10 supplementation on antioxidantenzymes activity and oxidative stress of seminal plasma:a double-blind randomised clinical trial.Andrologia. 2014, 46 (2): 177-83.
37.Garg H, Kumar R.Empirical Drug Therapy for Idiopathic Male Infertility: What is the New Evidence? Urology.2015, 86 (6): 1065-75.
38.Hadwan MH,Almashhedy LA,Alsalman AR.Oral Zinc Supplementation Restores Superoxide Radical Scavengers to Normal Levels in Spermatozoa of Iraqi Asthenospermic Patients.Int JVitam Nutr Res.2015,85(3-4): 165-73.
39.Li HJ.More attention should be paid to the treatment ofmale infertility with drugs--testosterone:to use it or not? Asian JAndrol.2014, 16 (2): 270-3.
40.R, González-Comadrán M, SolàI, et al.Coenzyme Q10 and male infertility: a meta-analysis.Lafuente J Assist Reprod Genet.2013, 30 (9): 1147-56.
41.Zhao J, Dong X, Hu X, et al.Zinc levels in seminal plasma and their correlation withmale infertility: A systematic review and meta-analysis.Sci Rep.2016, 2; 6: 22386.
42.Mongioi L, Calogero AE, Vicari E, et al.The role of carnitine in male infertility.Andrology.2016, 4(5): 800-7.
43.邓春华,商学军.精索静脉曲张诊断与治疗中国专家共识.中华男科学杂志,2015,21(11):1035-42.
44.姜辉,邓春华,商学军.等.左卡尼汀在男性不育中临床应用专家共识.中华男科学杂志,2015,21(1): 82-5.
45.姜辉,邓春华,商学军.等.维生素E在男性不育中临床应用专家共识.中华男科学杂志,2015,21(3): 277-79.
46.Kalantari P, Sepehri H, Behjati F, et al.Chromosomal studies of male infertility.Genetika, 2003, 39(3): 423-426.
47.Vogt PH, Edelmann A, Kirsch S, et al.Human Y chromosome azoospermia factors(AZF) mapped to different subregions in Yq11.Hum Mol Genet, 1996, 5 (7): 933-943.
48.Kent-First M,Muallem A, Shultz J,et al.Defining regions of the Y-chromosome responsible formale infertility and indentification of a forth AZF region (AZFd) by Y chromosome m icrodeletion detection.Mol Reprod Dev, 1999, 53 (1): 27-41.
49.Kuo PL, Wang ST, Lin YM, et al.Expression profiles of the DAZ gene family in human testis with and without spermatogenic failure.Fertil Steril, 2004, 81 (4): 1034-1140.
50.朱晓斌,郭安亮,曹小蓉,等.改良多重聚合酶链反应检测Y染色体AZF微缺失.中华男科学杂志,2006, 12 (3): 199-201.
51.Hussein AA, Vasudevan R, Patimah I, et al.Association of azoospermia factor region microdeletions in infertilemale subjects among Malay-sians.Andrologia, 2015 Mar; 47 (2): 168-77.
52.史轶超,崔英霞,魏莉,等.不育男性无精子症因子微缺失的分子与临床特征:5年研究回顾.中华男科学杂志,2010,16(4):314-319.
53.Peng J, Yuan Y, Zhang Z, et al.Patency rates ofmicrosurgical vasoepididymostomy for patients with idiopathic obstructive azoospermia:a prospective analysis of factors associated with patency--single-center experience.Urology.2012 Jan; 79 (1): 119-22.
54.Zhao L, Tu XA, Zhuang JT, et al.Retrospective analysis of early outcomes after a single-armed suture technique formicrosurgical intussusception vasoepididymostomy.Andrology.2015 Nov; 3 (6): 1150-3.
55.Hong K,Zhao LM, Xu SX,et al.Multiple factors affecting surgical outcomes and patency rates in use of single-armed two-suture microsurgical vasoepididymostomy: a single surgeon′s experience with 81 patients. Asian JAndrol.2016 Jan-Feb; 18 (1): 129-33.
56.Ramasamy R, Mata DA, Jain L, et al.Microscopic visualization of intravasal spermatozoa is positively associated with patency after bilateralmicrosurgical vasovasostomy.Andrology.2015 May; 3 (3): 532-5.
57.Herrel LA,Goodman M,Goldstein M,et al.Outcomes ofm icrosurgical vasovasostomy for vasectomy reversal: ameta-analysis and systematic review.Urology.2015 Apr; 85 (4): 819-25.
58.Wosnitzer MS, Goldstein M.Obstructive azoospermia.Urol Clin North Am.2014 Feb; 41 (1): 83-95.
59.Schauer I, Madersbacher S, Jost R, etal.The impactof varicocelectomy on sperm parameters: ameta-analysis.JUrol.2012 May; 187 (5): 1540-7.
60.Liu XH, Qiao J, Li R, et al.Y chromosome AZFcmicrodeletionmay not affect the outcomes of ICSI for infertilemaleswith fresh ejaculated sperm.JAssist Reprod Genet.2013 Jun; 30 (6): 813-9.
61.吴畏,周作民,林敏,等.Y染色体微缺失患者与无精子或严重少弱精子症患者ICSI治疗结局比较.中华男科学杂志,2011,17:771-774.
62.Schwarzer JU1, Steinfatt H1, Schleyer M, etal.Microdissection TESE is superior to conventional TESE in patientswith nonobstructive azoospermia caused by Y chromosomemicrodeletions.Andrologia.2016May;48(4): 402-405.
63.Ramasamy R, Schlegel PN.Microdissection testicular sperm extraction: effect of prior biopsy on success of sperm retrieval.JUrol 2007; 177: 1447-9.
64.Morris JK, A lberman E, Scott C, et al.Is the prevalence of Klinefelter syndrome increasing? Eur J Hum Genet.2008, 16 (2): 163-170.
65.Koga M,Tsujimura A,Takeyama M,etal.Clinical Comparison of Successful and failedmicrodissection testicular sperm extraction in Patientswith nonmosaic Klinefelter syndrome.Urology 2007, 70 (2): 341-345.
66.Amedo N,Temp lado C, Sanchez-Blaoque X,et al.Sperm aneuploidy in fathers of Klinefeher syndrome offspring assessed bymuhicolour fluorescence in situ hybridization using probe for chmmoflome 6, 13, 18, 21,22, X and Y.Hum Reprod.2006, 21: 524-528.
67.Aksglaede L, Jorgensen N, Skakkebaek NE, et al.Low semen volume in 47 adolescents and adultswith 47,XXY Klinefelter or 46, XX male syndrome.Int JAndrol 2009, 32 (4): 376-384.
68.时锦桓.测定血清 FSH与 LH含量对诊断男性不育症的探讨.中国实验诊断学2007,11(3):342-345.
69.杨麦贵,郝晓柯,郑善銮等.精液FSH、LH、PRL和T水平与精子质量关系的研究.中国男科学杂志.2007, 21 (5): 11-14.
70.陈荣安,张益康,许良余.Klinefelter综合征患者的FSH、LH、T水平的研究及其应用.南华大学学报·医学版.2004, 10, 32 (4): 459-462.
71.Schiff JD, Palmirro GD, Veeck LL, et al.Success of testicular sperm injection and intracytoplasmic sperm injection in men with Klinefelter syndrome.JClin Endocrinol Metab, 2005, 90: 6263-6267.
72.Okada H,Goda K Yamamoto Y,et al.Age as a limiting factor for successful sperm retrieval in patientswith nonmosaic Klinefelter’ s syndrome.Fertil Steril 2005, 84 (6): 1662-1664.
73.Ferhi K, Avakian R, Griveau JF, et al.Age as only predictive factor for successful sperm recovery in patientswith Klinefelter’ s syndrome.Andrologia, 2009, 41 (2): 84-87.
74.Emre Bakireioglu M, Erden HF, Kaplancan T, etal.Agingmay adversely affect testicular sperm recovery in patientswith Klinefeler syndrome.Urology 2006, 68 (5): 1082-1086.