 去看看
去看看


一 影像和分期诊断
影像和分期诊断
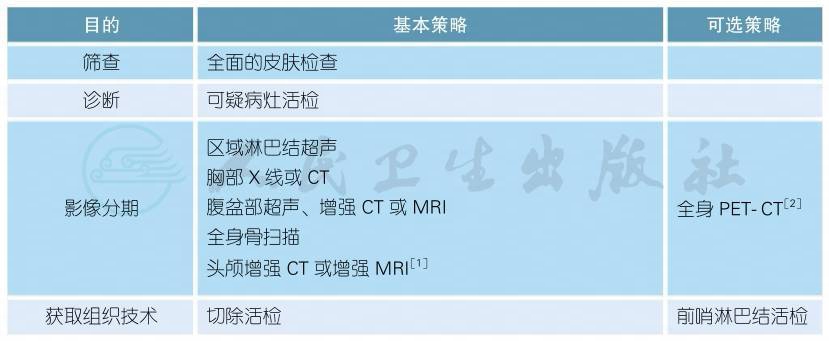
上述证据级别全部为2A类证据
注释
对于临床初步判断无远处转移的黑色素瘤患者,活检一般建议完整切除,不建议穿刺活检或局部切除,部分切取活检不利于组织学诊断和厚度测量,增加了误诊和错误分期风险。如病灶面积过大或已有远处转移需要确诊的,可行局部切取活检。
前哨淋巴结活检是病理分期评估区域淋巴结是否转移的手段。肿瘤厚度>1mm推荐行前哨淋巴结活检。通常不推荐对原发肿瘤厚度≤0.75mm的患者行前哨淋巴结活检,传统的危险因素例如溃疡、高有丝分裂率及淋巴血管侵犯在这些患者前哨淋巴结活检中的指导意义有限。这些危险因素一旦出现,是否行前哨淋巴结活检需考虑患者的个人意愿。病灶厚度为0.76~1mm的可结合临床考虑行前哨淋巴结活检[3-6]。
如临床怀疑区域淋巴结转移,建议首选淋巴结超声,淋巴结转移的超声表现特征:淋巴结呈类圆形,髓质消失,边缘型血流[7]。
二 病理学诊断和分子分型
病理学诊断和分子分型

上述证据级别全部为2A类证据
注释
1.送检标本处理:标本需完整送检,手术外科医生做好标记切缘,10%甲醛溶液固定标本达6~48h。
2.专家组建议病理报告中必须包括的内容为肿瘤厚度、是否溃疡和有丝分裂率,这三个指标与T分期直接相关,也是判断预后的3个最重要的特征[1-4]。
3.有丝分裂率(mitotic rate,MR)是肿瘤增殖的指标,记为每平方毫米的有丝分裂细胞数。最新的AJCC分期指南建议运用“热点”技术推算有丝分裂率[4,5]。Barnhill等比较了MR与溃疡作为局限期黑色素瘤预后的重要性,对MR和溃疡、肿瘤厚度进行多因素分析,发现MR(<1、1~6、>6)是最重要的独立预后因素。另外还有很多研究也证实了MR是皮肤黑色素瘤的重要预后因子[6-9]。MR≥1的患者疾病特异生存期(DSS较差)是预后的独立不良因素,在浸润厚度≤1mm的患者中尤为显著。在该组患者中,MR可以代替Clark分级,以区分ⅠA期和ⅠB期[10,11]。
4.对切缘阳性的,需描述范围(如是原位还是浸润性);切缘阴性的,美国病理学家协会(CAP)指南要求以毫米为单位报告显微镜下测量的肿瘤与切缘的横向或纵向距离。
5.微卫星灶指直径大于0.05mm,距离原发灶至少0.3mm的真皮网状层、脂膜或脉管中的瘤巢,与区域淋巴结转移相关性高。初次活检或扩大切除标本中出现局部微卫星灶分期归为N2c(ⅢB期);出现微卫星灶的患者需要做前哨淋巴结活检,若前哨淋巴结阳性,则分期为N3(ⅢC期)[12,13]。
6.建议所有患者治疗前都做基因检测,目前成熟的靶点是BRAF、CKIT和NRAS,与预后、分子分型和晚期治疗有关。黑色素瘤依基因变异可分为4种基本类型:①肢端型;②黏膜型;③慢性日光损伤型(CSD);④非慢性日光损伤型(non-CSD,包括原发病灶不明型)。其中日光损伤型主要包括头颈部和四肢黑色素瘤,日光暴露较多,高倍镜下可观察到慢性日光晒伤小体。肢端型和黏膜型发生KIT基因变异较多,其次为BRAF突变;非慢性日光损伤型,如躯干黑色素瘤,大部分发生BRAF基因V600E突变(60%)或NRAS突变(20%)[14-17]。我国502例原发黑色素瘤标本KIT基因检测结果显示总体突变率为10.8%,基因扩增率为7.4%;其中肢端型、黏膜型、慢性日光损伤型、非慢性日光损伤型和原发灶不明型分别为11.9%和7.3%,9.6%和10.2%,20.7%和3.4%,8.1%和3.2%及7.8%和5.9%。我国468例原发黑色素瘤标本BRAF突变率为25.9%,肢端和黏膜黑色素瘤的突变率分别为17.9%和12.5%,其中15号外显子的V600E是最常见的突变位点(87.3%)。多因素分析显示KIT基因和BRAF基因突变均是黑色素瘤的独立预后因素,危险系数分别为1.989(95%CI 1.263~3.131)和1.536(95%CI 1.110~2.124),P分别为0.003和0.01[18,19]。、
三 基于原发部位、分期和分子分型的综合治疗(皮肤来源)
(一)0期、ⅠA、ⅠB期恶性黑色素瘤的治疗
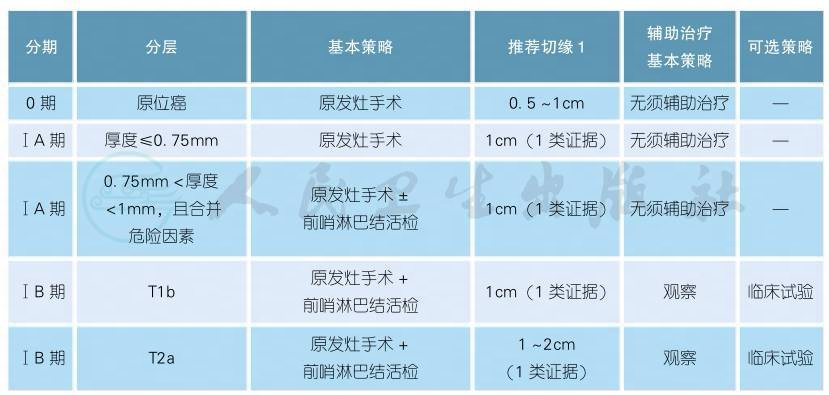
注释
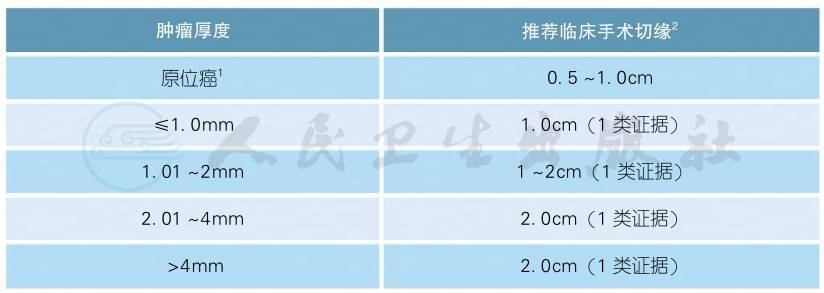
1.外科切缘是指外科医生进行手术时测量到的临床切缘,而不是病理医生测量的大体或病理切缘。可根据患者具体的原发病灶解剖结构和功能对切缘进行调整。参看附表6手术切缘[1-6]。通常需要根据活检病理报告的厚度来决定进一步扩大切除的切缘。对于活检病理未能报告明确深度或病灶巨大的患者,可考虑直接扩切2cm。
2.原位癌:对于面积较大的原位癌,如雀斑痣样黑色素瘤,可能需要大于0.5cm的切缘才能保证完整切除。对于部分切缘阳性无法手术的患者,可行咪喹莫特外敷或局部放疗(2类证据)。
3.外科手术标准:皮肤恶性黑色素瘤的切除要求完整切除皮肤以及深达肌筋膜的皮下组织。通常无须切除筋膜,但对浸润较深的原发灶(>4mm)可考虑切除筋膜[7]。
4.危险因素:包括溃疡、高有丝分裂率及淋巴血管侵犯等[8-9]。
5.厚度>1mm的患者可考虑进行前哨淋巴结活检,可于完整切除的同时进行亦可分次进行。鉴于我国皮肤黑色素瘤的溃疡比例发生率高达60%以上[10],且伴有溃疡发生的皮肤黑色素瘤预后较差,故当活检技术或病理检测技术受限从而无法获得可靠的浸润深度时,合并溃疡的患者均推荐前哨淋巴结活检。前哨淋巴结活检有助于准确获得N分期,提高患者的无复发生存率,但对总生存期无影响[11]。如果发现前哨淋巴结阳性,一般应及时进行淋巴结清扫。前哨淋巴结内低肿瘤负荷(前哨淋巴结的转移灶直径<0.1mm)的患者无须接受扩大淋巴结清扫[12]。
(二)ⅡA、ⅡB期恶性黑色素瘤的治疗
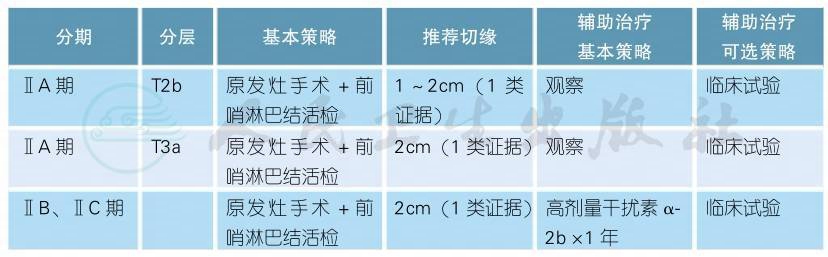
注释
对于ⅡB~Ⅲ期的高危黑色素瘤,推荐大剂量干扰素辅助治疗。多项临床研究证实大剂量干扰素α-2b能延长患者的无复发生存期,但对总生存的影响尚不明确[1-3]。meta分析亦证实上述观点[4]。关于干扰素的最优剂量和给药时间一直在探讨中[5-11]。针对我国患者,推荐采用改良的干扰素剂量1500万IU/m2,d1-5×4w+900万IU,tiw×48w治疗1年[10],亦可遵循NCCN指南推荐的标准剂量(2000万IU/m2,d1-5×4w,1000万IU/m2,tiw×48w。对于高龄、有合并症或无法耐受的患者,亦可选用1个月大剂量干扰素代替1年干扰素[5]。
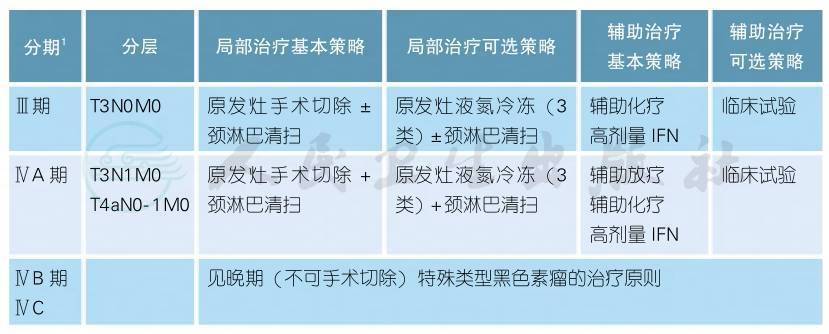
(三)ⅢA、ⅢB、ⅢC期恶性黑色素瘤的治疗
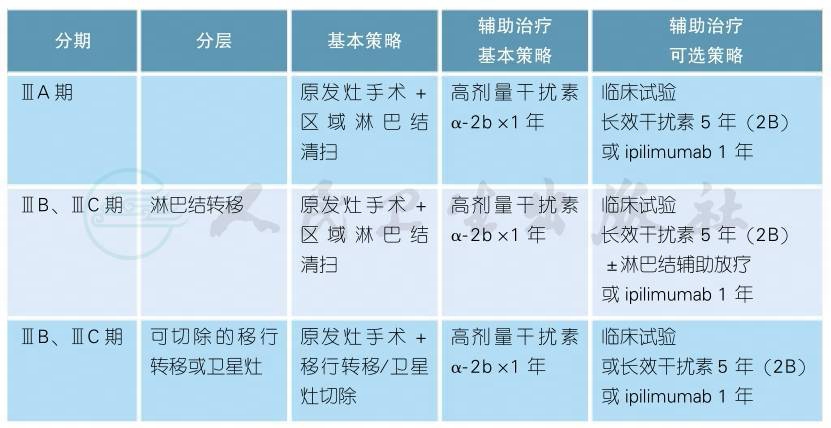
ⅢA、ⅢB、ⅢC期恶性黑色素瘤的治疗(续表)

注释
1.淋巴结清扫原则[1]
1)区域淋巴结须充分清扫。
2)受累淋巴结基部须完全切除。
3)通常来说,切除并检出的淋巴结个数如下:腹股沟≥10个,腋窝≥15个,颈部≥15个。
4)在腹股沟区,如临床发现股浅淋巴结或转移淋巴结数≥3个,选择性行髂窝和闭孔区淋巴结清扫。
5)如果盆腔影像学检查提示有盆腔淋巴结转移,或术中Cloquet(股管)淋巴结活检病理阳性,需行髂窝和闭孔区淋巴结清扫。
6)头颈部皮肤原发的患者,如超声怀疑有区域淋巴结转移,推荐引流区颈部淋巴结清扫。如受客观条件所限仅行转移淋巴结切除,需采用淋巴结超声或CT、MRI严密监测淋巴结复发情况。
2.淋巴结辅助放疗原则[2-4](2B类证据)
1)LDH<1.5倍正常值上限和
2)淋巴结转移情况
a)淋巴结结外侵犯。
b)腮腺受累淋巴结≥1个,无论大小。
c)颈部受累淋巴结≥2个,和(或)受累淋巴结大小≥3cm。
d)腋窝受累淋巴结≥2个,和(或)受累淋巴结大小≥4cm。
e)腹股沟受累淋巴结≥3个,和(或)受累淋巴结大小≥4cm。
需同时满足第1)条和第2)条中的任意一条。辅助放疗可提高局部控制力,但未能改善无复发生存时间或总生存时间,可能增加不良反应(水肿、皮肤、皮下组织纤维化、疼痛等)。仅推荐用于以控制局部复发为首要目的的患者,或在无法进行全身性辅助治疗的患者中作为备选。目前缺乏中国循证医学证据。
3.2015年美国FDA批准ipilimumab用于Ⅲ期黑色素瘤术后的辅助治疗,国内尚未上市,且缺乏与干扰素的直接对照[5]。
4.移行转移(in-transit metastasis)指原发病灶(周围直径2cm以外)与区域淋巴结之间,通过淋巴管转移的皮肤、皮下或软组织转移结节。
5.卫星灶(satellite)指在原发病灶周围直径2cm内发生的转移结节。
6.隔离热灌注化疗(ILP)和隔离热输注化疗(ILI) (2A类证据)主要用于肢体移行转移的治疗。ILI是一种无氧合、低流量输注化疗药物的局部治疗手段,通过介入动静脉插管来建立化疗通路输注美法仑(马法兰)。有研究称,Ⅲ期MM有效率约80%,CR率达31%~63%[6-8]。
7.瘤体内药物注射:其作用机制为局部消融肿瘤和诱导全身抗肿瘤免疫,目前可选用的药物包括干扰素、白介素、BCG(2B类证据)。T-VEC为HSV-1衍生的溶瘤免疫治疗药物,已被美国FDA批准用于治疗黑色素瘤,并可诱导远处部位肿瘤细胞死亡[9]。另一种瘤体内注射的药物PV-10,尚在临床试验中[10]。
8.全身治疗参见Ⅳ期。
(四)可完全切除的Ⅳ期恶性黑色素瘤的治疗

注释
1.转移灶切除应符合R0切除的原则[1-2]。如有残余病灶,则应按不可切除的Ⅳ期对待。
2.缺乏有效的辅助治疗证据。
(五)不可手术切除的Ⅳ期黑色素瘤的治疗
皮肤播散性(不可手术切除)Ⅳ期黑色素瘤患者的治疗原则
(1)存在脑转移患者的治疗

a见黑色素瘤放疗原则
注释
1.脑转移灶的治疗:
对于存在脑转移的患者,应优先处理中枢神经系统(CNS)的病灶,以延迟或防止出现瘤内出血、癫痫或神经相关功能障碍。黑色素瘤脑转移的治疗应基于症状、脑转移灶的数目和部位来综合考虑。立体定向放疗(SRS)[1-5]和(或)全脑放疗(WBRT)[6-8]均可作为一线治疗或术后辅助治疗应用于临床。与WBRT相比,SRS可能具有更好的长期安全性,能更早地使CNS病灶达到稳定,因此能使患者更早地接受全身系统性抗肿瘤治疗或参加临床研究。对于携带BRAF突变、同时存在颅外和颅内转移的患者,初始治疗有时采用BRAF或BRAF+MEK抑制剂,必要时联合放疗(作为巩固治疗)。在针对颅内病灶的治疗结束后,针对颅外病灶的处理同不伴有颅内转移的患者。ipilimumab可能能够长期地控制颅外转移灶。
若患者同时存在颅内和颅外病灶,可在对CNS病灶进行处理期间或之后予除大剂量IL-2(在既往未经治疗的脑转移中有效率低,并可能加重病灶周围的水肿)以外的全身系统性抗肿瘤治疗。由于联合或序贯应用放疗和系统性抗肿瘤治疗(尤其是BRAF靶向治疗)可能增加治疗相关毒性,因此务必谨慎考虑。
2.晚期黑色素瘤的放疗原则[9-15]:
对于脑转移灶而言,立体定向放疗可作为一线治疗或辅助治疗。全脑放疗可作为一线治疗,也可考虑作为辅助治疗(3类推荐),但作为辅助治疗时疗效不确切,需结合患者个体情况综合选择。
对于其他有症状或即将出现症状的软组织转移灶和(或)骨转移灶而言,可选择放疗,具体剂量和分次没有统一规定。
(2)无脑转移患者的治疗
1)携带BRAF V600突变患者的治疗原则
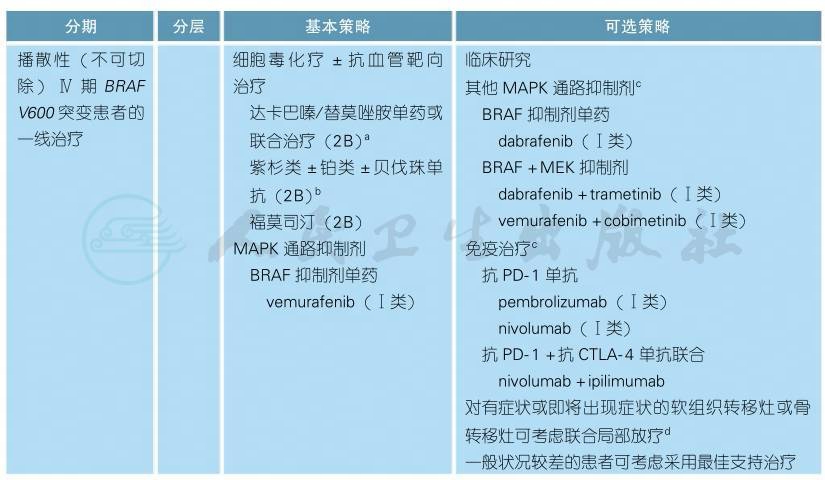
携带BRAF V600突变患者的治疗原则(续表)

a达卡巴嗪单药方案:DTIC 250mg/m
2,d1~5,q4w;替莫唑胺单药方案:TMZ 200mg/m
2,d1~5,q4w;达卡巴嗪+顺铂+恩度方案:DTIC 250mg/m
2,d1~5,DDP 40mg,d1~3,恩度7.5mg/m
2,d1~14,q4w。
替莫唑胺+顺铂+恩度方案:TMZ 200mg/m2,d1~5,DDP 40mg/d,d1~3,恩度7.5mg/m2,d1~14,q4w。
b紫杉醇+卡铂+贝伐珠单抗方案:紫杉醇175mg/m2,d1,卡铂AUC=5,贝伐5mg/kg,d1,d15,q4w;白蛋白结合型紫杉醇+卡铂+贝伐珠单抗方案:白蛋白结合型紫杉醇260mg/m2,d1,卡铂AUC=5,贝伐5mg/kg,d1,d15,q4w。
c国内尚未上市,供参考,均有Ⅲ期临床研究结果支持。
d见黑色素瘤放疗原则
注释
转移性黑色素瘤预后差,据统计,M1a期中位生存期为15个月,M1b期为8个月,骨转移为6个月,肝、脑转移为4个月,总体中位生存时间为7.5个月,2年生存率为15%,5年生存率约5%[1]。不能手术切除的Ⅲ期或转移性黑色素瘤一般建议内科治疗为主的全身治疗或者推荐参加临床试验。全身治疗选择包括PD-1单抗、CTLA-4单抗、BRAFV600抑制剂、CKIT抑制剂、MEK抑制剂、大剂量IL-2和化疗等。近年来,晚期黑色素瘤的治疗取得了突破性进展,个体化靶向治疗和免疫靶向治疗是目前的治疗热点方向,在我国现阶段化疗药物仍然是重要的治疗手段。
对于存在BRAF V600突变的患者而言,系统性抗肿瘤治疗的选择如下:
1.细胞毒化疗
达卡巴嗪(dacarbazine,DTIC)
自1972年以来,达卡巴嗪一直是经FDA批准用于进展期黑色素瘤治疗唯一的化疗药物。达卡巴嗪是一种烷化剂,通过连接DNA的特殊部位,抑制细胞分裂,进而导致细胞死亡。达卡巴嗪是药物前体,在肝脏内转换为活性复合物5-(3-methyl-1-triazeno)imidazole-4-carboxamide(MTIC)。其给药方式是静脉给药。自1992年起,多项随机临床试验[2-7]将达卡巴嗪作为对照组,超过1000名患者接受了达卡巴嗪的治疗,总体有效率13.4%,完全缓解罕见(≤5%),中位生存时间为5.6~11个月。常用方案包括:200~250mg/m2,d1~5,每3周重复,或者800~1000mg/m2,d1,每3周重复。
替莫唑胺(temozolomide,TMZ)
是一种达卡巴嗪类似物的小分子口服制剂,在体内亦转换为MTIC,与达卡巴嗪不同的是,替莫唑胺不需经肝脏代谢。替莫唑胺可穿透血-脑脊液屏障,在脑脊液中的浓度是血浆中浓度的28%~30%。对于尸检脑转移率超过50%的黑色素瘤来说,这一特点尤为宝贵。替莫唑胺首先被批准用于高级别恶性胶质瘤,但对黑色素瘤也具有疗效。欧洲一项大型Ⅲ期临床研究在晚期初治黑色素瘤患者中对照了替莫唑胺[250mg/(m2•d),连用5d,每4周重复]和达卡巴嗪[200mg/(m2•d),连用5天,每3周重复],该研究共入组305例晚期初治黑色素瘤患者,结果显示前者有效率较高(分别为12.2%与9.4%,P=0.43),PFS也超过后者(分别为1.74个月和1.38个月,P=0.002),而总生存两者相当(分别为7.7个月与6.4个月,P=0.2)。该研究虽未达到预期设想,但表明TMZ的疗效至少与DTIC相当。最常见的不良反应为恶心(52%)、呕吐(34%)、疼痛(34%)、便秘(30%)、头痛(22%)及乏力(20%)。大多数不良反应为轻到中度,可控制。两组均有9%的患者发生血小板下降,3/4度血小板下降见于7%的替莫唑胺组患者和8%的达卡巴嗪组患者。替莫唑胺组中3%的患者因骨髓抑制中断治疗,而达卡巴嗪组中的比例是5%。替莫唑胺组患者的生活质量更佳。入组859例的Ⅲ期临床研究E18032试验[8]发现,改变TMZ服用方法后(150mg/m2,d1~7,q2w)与DTIC(1000mg/m2,q21d)比较,前者有效率明显提高(分别为14.5%和9.8%,P=0.05),但PFS和OS无显著性差异。由于TMZ能透过血-脑脊液屏障,有多项临床试验评价了TMZ治疗脑转移的作用。2007年发表的一项研究[9]共入组179例初治的晚期患者,其中52例脑转移患者,发现如果TMZ全身治疗有效,脑部病灶中位进展时间7个月(2~15个月),脑转移中位生存时间5.6个月。因此,该试验表明TMZ对脑部病灶的控制作用持久有效,多数脑部小转移灶的患者可以延期放疗或不需要放疗。2006年发表了一项TMZ一线治疗117例脑转移患者的Ⅱ期临床研究[10],200mg/m2连用5d,28d重复,口服1年或不能耐受,其中25%的患者转移灶超过4个,结果总有效率7%(1例CR,7例PR),SD29%,中位生存时间3.5个月。还有多项关于TMZ联合治疗的研究,多集中于联合干扰素和沙利度胺(反应停)等药物上[11]。值得一提的是,联合沙利度胺的多项临床试验因增加了血栓的机会而被提前终止。目前已停止使用替莫唑胺联合沙利度胺治疗黑色素瘤脑转移伴有血栓高危风险的患者。
铂类
铂类药物对黑色素瘤也具有一定的疗效。顺铂单药的有效率为10%~20%,但有效持续时间短,约3个月。通常认为剂量低于80mg/m2会降低有效率,但剂量≥150mg/m2并不能提高有效率。常见毒性包括肾脏毒性、耳毒性、神经毒性、呕吐以及骨髓毒性。有3项Ⅱ期临床研究[12-14]探讨了卡铂在转移性黑色素瘤中的疗效,结果显示有效率与顺铂相似。卡铂的主要毒性为骨髓抑制,剂量限制性毒性为血小板下降。
紫杉类
紫杉类复合物包括紫杉醇,以红豆杉属植物为主要原料提取的一种双萜类化合物,以及多西紫杉醇,从欧洲紫杉树针叶中提取合成的复合物。紫杉醇是新型抗微管药物,通过促进微管蛋白聚合抑制解聚,保持微管蛋白稳定,抑制细胞有丝分裂。多个Ⅰ/Ⅱ期临床研究探索了紫杉类在治疗晚期黑色素瘤中的作用[15-20]。结果显示紫杉醇单药有效率在12%~30%。常用方案包括:175mg/m2,每3周重复,或是90mg/m2,每周给药。常见的毒性包括中性粒细胞下降、神经毒性、乏力等。
白蛋白结合型紫杉醇(nab-paclitaxel)
是一种纳米微粒大小的抗肿瘤复合物。采用可溶型人白蛋白包被活性药物,并携带药物进入肿瘤细胞,肿瘤细胞会分泌一种SPARC蛋白汲取细胞间质中的蛋白质。白蛋白结合紫杉醇纳米微粒通过SPARC蛋白吸附在肿瘤细胞上,并最终进入肿瘤细胞,释放出细胞毒药物,杀死肿瘤细胞。这样不但避免了传统紫杉醇以聚氧乙烯蓖麻油为溶剂带来的在使用及安全性方面的问题,还改善了紫杉醇在体内的分布,增强了药物对肿瘤组织独特的靶向性和穿透性作用,使药物高度浓集于肿瘤组织内,减少了其在血液中的存留,因而白蛋白紫杉醇的疗效更好、对正常组织影响更小。白蛋白紫杉醇的标准用法为260mg/m2,每3周重复;优化方案为100~150mg/m2,每周给药一次。一项Ⅲ期随机多中心临床试验[21]评估了白蛋白紫杉醇(ABRAXANE)对照化疗药物达卡巴嗪在初治的Ⅳ期转移性黑色素瘤患者中的安全性和有效性。529例患者随机接受ABRAXANE(150mg/m2,每周1次,连用3周,每4周重复)(264例)或达卡巴嗪(1000mg/m2,每3周用药1次)(265例)。结果显示,初治的转移性黑色素瘤患者,白蛋白紫杉醇明显提高了中位PFS(4.8个月vs2.5个月,HR 0.792;95%CI 0.631~0.992;P=0.044),但总生存时间没有显著性差异(12.8个月vs10.7个月,P=0.09)。在白蛋白紫杉醇组中发生率≥10%的毒性包括神经毒性(25%vs0)和中性粒细胞下降(20%vs10%)。白蛋白紫杉醇组神经病变改善的中位时间是28d。
亚硝基脲类
具有β-氯乙基亚硝基脲的结构,具有广谱的抗肿瘤活性。该类药物具有较强的亲脂性,易通过血-脑脊液屏障进入脑脊液中,因此广泛用于脑瘤和其他中枢神经系统肿瘤的治疗,其主要的副作用为迟发性和累积性的骨髓抑制。其中应用最多的是福莫司汀,它在欧洲被批准用于转移性黑色素瘤的治疗,多个临床研究显示其有效率约为22%。此外,脂溶性的福莫司汀还被证实对25%的脑转移灶有效。在一项福莫司汀(每周100mg/m2,共3周)对照达卡巴嗪(每天250mg/m2×5d,每4周重复)的Ⅲ期临床研究中[4],229例晚期患者入组,福莫司汀组的有效率为15.2%,而达卡巴嗪组为6.8%(P=0.053)。福莫司汀组的中位脑转移控制时间为22.7个月,而达卡巴嗪组仅为7.2个月。毒性主要包括延迟的骨髓抑制以及胃肠道毒性。
2.MAPK通路抑制剂
对于携带BRAF活化突变(包括V600E、V600K、V600R、V600D等)的转移性黑色素瘤患者而言,一线治疗的选择包括针对BRAF的靶向治疗,主要包括BRAF+MEK抑制剂联合治疗(dabrafenib+trametinib或vemurafenib+cobimetinib)[22,23]和BRAF抑制剂单药治疗(vemurafenib[24]或dabrafenib[25])。以上方案均为Ⅰ类推荐。
白种人中约一半的转移性黑色素瘤具有细胞内BRAF基因突变[26]。vemurafenib是一种特定的BRAF基因突变抑制剂[27]。一项Ⅲ期随机临床试验将675例未经治疗的,伴有BRAF V600E基因突变的转移性黑色素瘤患者随机分为两组,比较vemurafenib与达卡巴嗪的治疗效果[28]。试验证实vemurafenib较达卡巴嗪可延长总生存期(OS)及无进展生存期(PFS)(死亡风险比=0.37;死亡或进展风险比=0.26;P<0.001)。两组的半年存活率分别为84%及64%。皮肤并发症是vemurafenib最常见的不良反应,其中18%的患者发展为皮肤鳞状细胞癌或角化棘皮瘤,需要手术切除;另外12%的患者发生2~3级的皮肤光敏反应。关节疼痛是最常见的非皮肤不良反应(21%)。基于这项研究,2011年8月FDA批准vemurafenib可用于治疗BRAF V600E基因突变的转移性或不可切除的黑色素瘤。另据一项由132例非初治患者参与的临床试验报道,vemurafenib有53%的总反应率和15.9个月的中位生存期[29]。26%的患者继发皮肤损害。
继vemurafenib后,又有一种BRAF抑制剂dabrafenib被FDA所批准。一项Ⅲ期临床研究[30]比较了dabrafenib与达卡巴嗪在BRAF V600E突变患者中的作用。共入组250例Ⅳ期或不可切除的Ⅲ期患者,主要终点为无进展生存期。结果显示dabrafenib组的PFS时间为5.1个月,而对照组达卡巴嗪组为2.7个月(HR 0.3;95%CI 0.18~0.51;P<0.001)。在接受dabrafenib治疗的患者中,2级以上(含2级)的副反应发生率为53%,3~4级副反应不常见。最常见的不良反应为皮肤不良反应、发热、乏力、关节痛和头痛。相比vemurafenib,dabrafenib相关的皮肤鳞状细胞癌或角化棘皮瘤较为罕见。发热往往更为常见(11%)。在对172名BRAF突变的伴随脑转移的黑色素瘤患者的治疗中[31],脑转移治疗反应率在初治患者中为39%,非初治患者中为31%。
在MAPK信号传导通路中,MEK1及MEK2位于 BRAF基因下游。trametinib是一种口服的MEK1及MEK2抑制剂。一项Ⅲ期随机临床试验将322名具有BRAF V600E/K基因突变转移性黑色素瘤患者随机分为两组,比较trametinib与化疗的治疗效果[32]。相比于化疗组,trametinib组的无进展生存期(4.8个月vs1.5个月;HR 0.45;95%CI 0.33~0.63;P<0.001)及6个月总生存(81%vs67%;HR 0.54;95%CI 0.32~0.92;P<0.01)均有显著提高。最常见的不良反应为皮肤不良反应、腹泻和周围水肿。与BRAF抑制剂不同,继发皮肤损害在trametinib中不常见。在一项Ⅱ期临床试验中,trametinib的客观缓解率较BRAF抑制剂低[33]。相比于BRAF抑制剂,trametinib在初治患者中反应率较低(22%vs48%~50%)[34-36]。
联合靶向治疗
尽管BRAF V600E抑制剂的初始反应率较高,但约半数使用单药BRAF V600E抑制剂的患者在6个月内进展。一项Ⅲ期临床研究纳入了247例BRAF V600E基因突变的晚期患者,评价联合治疗(BRAF抑制剂+MEK抑制剂)的安全性和疗效[37]。该研究随机分为两组:dabrafenib单药与dabrafenib联合trametinib。结果显示,联合用药组的反应率(76%vs54%;P=0.03)及无进展生存(9.4个月vs5.8个月;HR 0.39;95%CI 0.25~0.62;P<0.001)明显提高。继发皮肤鳞状细胞癌的概率明显减低(7%vs19%)。但发热比例增加(71%vs26%)。2015年ASCO会议报道了vemurafenib联合MEK抑制剂(cobimetinib)的coBRIM研究最新结果[38],截至2015年1月,中位随访时间14个月,vemurafenib+安慰剂组的PFS时间为7.2个月,联合治疗组的为12.3个月,联合治疗组显著降低进展风险。vemurafenib、dabrafenib和trametinib在国内都未上市,但中国黑色素瘤中BRAF V600E变异率接近26%[39],虽然不如白种人约50%的变异率高,但对于我国黑色素瘤的治疗也有着十分重要的意义,故在本指南中也将这些药物作为BRAF V600E突变患者的1类证据推荐。
安全性
对于采用BRAF抑制剂治疗的患者,推荐常规于皮肤科进行相关检查以监测皮肤相关不良反应情况。尽管dabrafenib并不会导致明显的光毒性,但由于可能出现继发性皮肤反应,仍推荐定期到皮肤科就诊。接受dabrafenib治疗的患者中发热较为常见,一旦出现需暂时停药,并予对乙酰氨基酚和(或)NSAID类药物退热治疗。在体温恢复正常后可考虑减量恢复dabrafenib或dabrafenib+trametinib治疗。
3.免疫治疗
PD-1单抗(pembrolizumab和nivolumab)
美国FDA批准PD-1单抗用于一线治疗。专家组认为pembrolizumab和nivolumab有着比ipililumab更高的反应率及更少的副作用,这两个药物应该被考虑用作一线治疗。在一项大型的Ⅰ期临床试验中,pembrolizumab的总反应率为38%,其中位持续时间尚未达到[40]。ipilimumab治疗进展后,使用pembrolizuma的总反应率为38%,其中位持续时间尚未达到[41]。另一项针对BRAF野生型的初治患者的大型Ⅲ期临床研究显示,nivolumab的1年生存率(73%vs42%)、中位无进展生存期(5.1个月vs2.2个月)及ORR(40%vs14%)较达卡巴嗪有着明显的提高[42]。pembrolizumab和nivolumab均会导致免疫介导的毒副反应,虽3~4级的毒副反应较ipilimumab少,但仍需密切关注。常见的不良事件(发生概率>20%)包括恶心、皮疹、瘙痒、咳嗽、腹泻、食欲下降、便秘和关节痛。当出现严重的免疫介导肺炎、结肠炎、肝炎、垂体炎、肾炎及甲状腺功能紊乱时,需考虑使用类固醇激素治疗。对于既往使用ipilimumab而导致垂体炎的患者,应先使用激素替代治疗后再开始pembrolizumab治疗。
CTLA-4单抗(ipilimumab,ipi)
在对初治患者的Ⅲ期临床研究中,ipilimumab单药及ipilimumab联合达卡巴嗪组的OS较对照组均有显著提高。在既往治疗过的患者中,ipilimumab组的总生存为10.1个月,而对照组gp100疫苗仅为6.5个月(P=0.003)[43]。在初治患者中,ipilimumab组的总生存相比于对照组达卡巴嗪也有明显提高(11.2个月vs9.1个月,P<0.001)[44]。值得注意的是,ipilimumab会导致严重的免疫介导的毒副反应。使用过程中需格外注意,密切观察其毒副作用,ipilimumab在国内尚未上市。
CTLA-4单抗联合PD-1单抗
2015美国ASCO会议上报道了一项PD-1单抗(nivolumab)联合CTLA-4单抗(ipilimumab)的临床研究结果。该项研究入组了142例晚期或无法切除的黑色素瘤患者,以2:1的比例分别入组Ipi 3mg/kg,q3w,×4+Nivo 1mg/kg后Nivo 3mg/kg, 每两周维持或ipilimumab 3mg/kg,q3w,×4+安慰剂每2周维持,研究终点为ORR,次要终点为PFS。结果显示联合组的有效率为60%,单药组仅为11%,其中完全缓解率分别为12%和0,PFS分别为8.9个月和4.7个月(P=0.0012)。亚组分析显示预后越差的患者从联合组中越更获益:LDH升高患者和M1c期患者的有效率分别为53%vs0%和62%vs25%,遗憾的是,联合组的G3/4副反应明显升高(51%vs20%),除外内分泌疾病需要额外替代治疗后,其余83%均可通过泼尼松等免疫抑制剂好转。从PD-L1的表达与疗效关系来看,PD-L1高表达的患者,联合组和单药组疗效相近;而低表达的患者,联合组疗效则远高于单药组。
给药
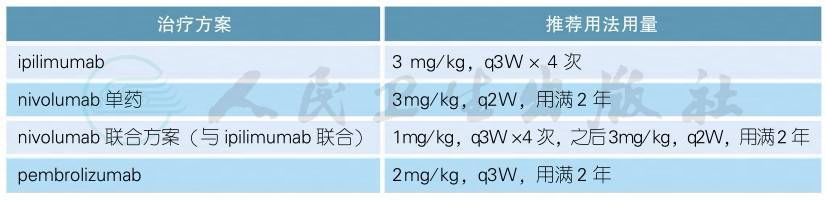
ipilimumab已获得FDA批准用于不可切除或转移性黑色素瘤的治疗,用药剂量为3mg/kg,每3周用药一次,共计4次[45]。FDA推荐的三种包含PD-1单抗的治疗方案(nivolumab、pembrolizumab和nivolumab+ipilimumab联合方案)的用药方式为在未出现疾病进展或毒性不可耐受的情况下,持续给药。由于缺乏长期应用PD-1单抗的相关数据,目前用药的最佳持续时间尚不清楚。目前在没有出现无法耐受毒性的情况下,一般会持续给药直至出现最佳疗效。最佳疗效目前没有标准定义,通常指在间隔至少12周的至少连续2次评效中未再出现肿瘤继续缩小。在达到最佳疗效后是否继续PD-1单抗的治疗目前仍存争议。临床实际操作中常在达到最佳疗效后继续PD-1治疗12周。下表为指南推荐的免疫检查点抑制剂用法用量。
免疫检查点抑制剂用法用量
安全性
免疫相关不良反应(irAE)的处理
irAE的处理目前主要依据经验进行。
接受抗CTLA-4或抗PD-1药物治疗患者的用药相关不良反应发生率高,单药治疗的3~4级不良反应发生率在20%左右,接受ipilimumab单药或nivolumab+ipilimumab联合治疗的发生率在50%左右。因此对于拟接受上述治疗的患者而言,均需接受严格的筛选和针对不良反应的密切监控和处理,以保证用药的安全性。除此以外,对患者的年龄、合并症(如症状易和免疫相关不良反应相混淆的疾病)、合并用药(如免疫抑制剂)以及患者的一般情况均需加以综合考虑。患有自身免疫疾病的患者一般不推荐接受免疫检查点抑制剂治疗。
ipilimumab、nivolumab和pembrolizumab导致的免疫相关不良反应的监控和处理详见药物说明书[46]。免疫检查点抑制剂相关irAE的监控和处理方法在包含ipilimumab的治疗方案和仅含抗PD-1单抗的治疗方案中有所不同。
(1)包含ipilimumab治疗方案:接受ipilimumab治疗的患者均需针对治疗相关潜在致死性irAE进行严密的监控[47]。除了对相关症状进行有针对性的问询以外,需对患者和护士进行宣教,并鼓励患者与医护人员进行密切交流,以及时识别免疫相关不良反应并对其进行有效处理。
对中重度irAE的推荐处理方案包括暂时或永久性停药以及全身给予皮质类固醇治疗。免疫检查点抑制剂最常见的3~4级irAE为腹泻,严重病例应采用大剂量皮质类固醇治疗。对于出现严重小肠结肠炎、经系统性皮质类固醇治疗无效(1周以内)的患者而言,推荐予英夫利昔单抗5mg/kg治疗[48-54]。布地奈德不推荐用于小肠结肠炎的预防性治疗。英夫利昔单抗可用于其他类型的严重类固醇耐药性irAE的二线治疗。对大剂量皮质类固醇耐药的严重肝脏不良反应,由于英夫利昔单抗存在潜在肝毒性[55],二线推荐应用霉酚酸酯治疗。接受免疫抑制剂(如泼尼松+霉酚酸酯)治疗的患者可能出现机会性感染,应考虑进行针对肺囊虫的预防性治疗。免疫相关性皮炎有时对局部皮质类固醇治疗敏感,对局部用药无效的患者可采用系统性皮质类固醇治疗(nivolumab)。推荐前往皮肤科或具有处理皮肤相关irAE经验的中心进行诊疗。
免疫相关内分泌不良反应在皮质类固醇逐渐减量之后也常需采用激素替代治疗[56-59]。临床医生需警惕垂体炎相关症状(常表现为轻微头痛或乏力)。
(2)抗PD-1单抗单药方案:AE的监控和处理基本同包含ipilimumab的治疗方案。如前所述,PD-1单抗单药治疗3~4级AE的发生率低于包含ipilimumab的治疗方案。既往应用ipilimumab导致出现垂体炎的患者在经适当的生理性内分泌替代治疗后,可采用抗PD-1单抗治疗。
4.二线治疗选择
对于携带BRAF V600突变的患者,由于缺乏Ⅲ期临床研究的相关证据,一二线治疗究竟选择免疫检查点抑制剂序贯BRAF靶向治疗还是BRAF靶向治疗序贯免疫检查点抑制剂目前尚不清楚。目前正在进行相关临床研究以明确免疫治疗和靶向治疗的最佳用药顺序和(或)联合用药方案。鉴于免疫检查点抑制剂起效慢,对于存在症状或快速进展或一般情况迅速恶化的患者而言,优选BRAF靶向治疗。对于肿瘤负荷小、无症状的Ⅳ期患者而言,优选免疫检查点抑制剂。免疫检查点抑制剂和BRAF靶向治疗的不良反应及处理方式迥异,因此在选择治疗方案时应考虑到患者的一般情况、既往病史、合并用药、合并症以及依从性。
既往接受BRAF抑制剂后进展或达到最大治疗获益的患者基本不能从BRAF抑制剂+MEK抑制剂联合方案中获益。同样,在接受BRAF+MEK抑制剂联合方案治疗后进展或达到最大获益的患者,也基本不能从BRAF抑制剂单药或另一种BRAF+MEK抑制剂联合方案治疗中获益。对于免疫检查点抑制剂治疗后进展的患者(携带BRAF突变、BRAF抑制剂治疗后进展)而言,二线之后的后续治疗的其他选择可考虑细胞毒化疗、MAPK通路抑制剂靶向治疗。由于上述治疗选择的相关临床研究多在靶向和免疫治疗出现前进行,目前上述方案用于后续治疗中的获益情况尚不明确。
一般状况较差(PS评分3~4)的患者应采用最佳支持治疗。
2)BRAF V600野生型、无脑转移患者的治疗
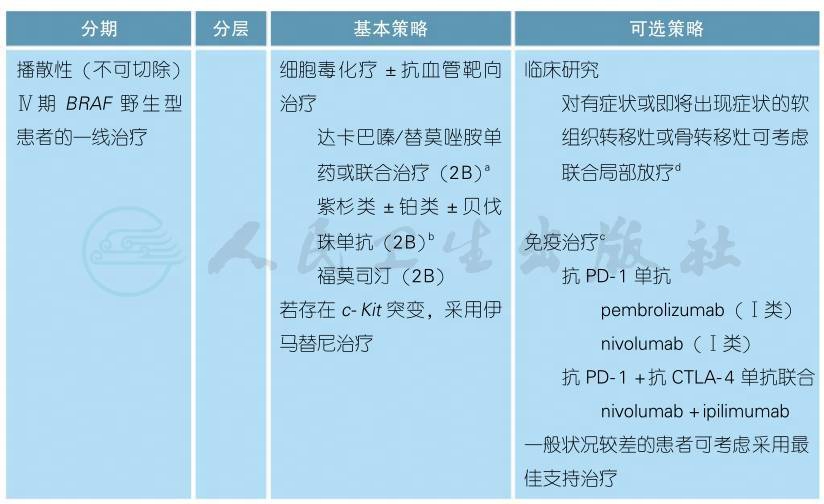
BRAF V600野生型、无脑转移患者的治疗 (续表)

a~d参见1)携带BRAF V600突变患者的治疗原则
注释
1.一线治疗:
细胞毒化疗±抗血管靶向治疗及免疫治疗相关情况同前述。现将携带c-Kit基因突变的患者可选择的伊马替尼详述如下:
伊马替尼(KIT抑制剂)
针对Kit变异药物的临床研究中规模最大的是来自中国的一项Ⅱ期临床研究[1]。43例来自全国多个中心的Kit基因突变或扩增的晚期黑色素瘤患者接受了伊马替尼治疗,结果显示6个月的PFS率为36.6%,中位PFS为3.5个月。相比其他外显子突变的患者,11号或13号外显子突变患者的中位PFS更长,另外多发c-Kit变异的患者较单发的PFS长(但无显著性差异)。10例患者(23.3%)获得PR,13例患者(30.2%)获得SD,20例患者获得PD。虽然有效率不如BRAF V600E抑制剂,但与目前大部分治疗缺乏明确预测疗效的因子相比,本项研究还是非常有希望的:1年生存率达到了51.0%,中位OS达到了14个月;并且获得PR或SD患者的OS为15个月,与疾病进展的患者相比,有明显的统计学意义(P=0.036)。故本指南也将伊马替尼作为c-Kit突变或扩增的晚期黑色素瘤患者的2类证据推荐。
2.二线治疗:
无法手术切除或转移性黑色素瘤的二线治疗推荐方案包括与一线方案不同的细胞毒化疗±抗血管靶向治疗,对于一线未使用免疫治疗者,二线治疗选择包括免疫治疗pembrolizumab(2A类)、nivolumab(1类)或nivolumab+ipilimumab联合治疗(2A类)。
PD-L1可能对于PD-1单抗的疗效具有预测价值,但目前尚不能用于指导临床用药。
尽管ipilimumab已获得FDA批准用于初治和复治的无法手术切除或转移性黑色素瘤,但由于临床研究结果提示PD-1单药以及nivolumab+ipilimumab联合用药与ipilimumab单药相比可改善患者预后,因此本指南并不推荐ipilimumab单药用于二线治疗。
关于究竟选择抗PD-1单抗单药治疗还是nivolumab+ipilimumab联合方案治疗,应结合不良反应综合考虑:尽管联合方案能在一定程度上改善PFS,但其会使严重免疫相关不良反应发生率明显升高。治疗方案的选择需结合患者的一般情况、既往病史、合并用药、合并症、对不良反应相关监测和治疗的依从性等方面加以综合考虑。
对于二线之后的后续治疗,目前不推荐使用与既往治疗相同的药物,但可考虑选用与既往治疗同一类的其他药物。对于接受12周ipilimumab诱导治疗后病情稳定3个月及以上、评效PR或CR的患者而言,在后续出现病情进展后,可考虑再次接受ipilimumab的诱导治疗(3mg/mg,q3w, ×4周期)。尽管抗CTLA-4单抗(ipilimumab)和抗PD-1单抗(nivolumab、pembrolizumab)均为免疫检查点抑制剂,但由于二者的作用分子不同,目前认为二者不属于同一类药物。对既往接受过ipilimumab治疗的患者而言,后续推荐抗PD-1单抗治疗;或者反之。
四 特殊类型黑色素瘤的综合治疗
(一)黏膜来源局限期恶性黑色素瘤的治疗
1.鼻咽黏膜黑色素瘤
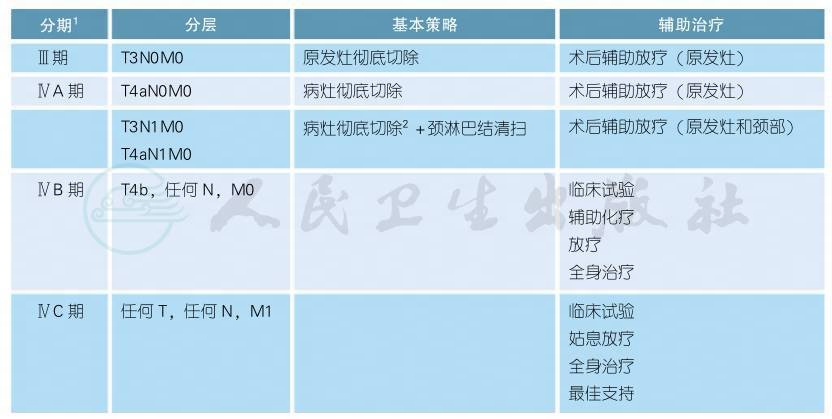
注释
1.头颈部来源的黏膜恶性黑色素瘤分期参考AJCC分期。
2.早期鼻腔、鼻窦及鼻咽黏膜黑色素瘤原发灶的切除,手术方法包括鼻侧切开进路和内镜手术,具体要根据肿瘤范围大小和外科医生的内镜技术水平。总的治疗原则为尽量整块切除,禁忌局部挤压和力求切缘阴性。病灶的黏膜切除范围包括肿瘤边界外1.5~2cm外观正常黏膜(包括卫星灶)。部分黏膜黑色素瘤患者伴有色素沉着斑,如沉着斑局限则一并切除;无法切除者,需要密切随访局部变化。病灶的深部切除范围根据病灶不同而各异,一般对深部切缘进行术中冰冻来确定是否切净;对于鼻腔、鼻窦及鼻咽恶性黑色素瘤,瘤床多为骨质,无法在术中经冰冻了解切缘,切除到肿瘤组织周边影像正常毗邻解剖区的组织间隔即可。肿瘤累及下颌骨骨膜时行下颌骨部分、水平或垂直切除[1],通常距肿瘤边缘的距离为2cm以上。术中冰冻对于微小瘤灶有时诊断难以确定,可依据外科医生经验灵活把握,根据术后病理确定是否二次手术。
3.鼻腔、鼻窦及鼻咽黑色素瘤的颈部淋巴结转移率低,原则上不做预防性清扫[2-4],建议密切随访。原发口腔、口咽和下咽食道的黏膜黑色素瘤淋巴结转移率高,对于临床或影像学检查提示有转移的,常规进行区域性或根治性淋巴结清扫;对于局部复发的患者,如果局部再分期未达R-T4b,仍然可以考虑手术切除;区域性复发,即局部淋巴结复发,如果原发灶无复发且没有远处转移时,可以考虑功能性或根治性颈淋巴结清扫术。由于头颈部黏膜淋巴引流复杂,特别是上颈部有咽淋巴环,淋巴结组织非常丰富,因此鼻腔、鼻窦和鼻咽黏膜黑色素前哨淋巴结的定位困难,前哨淋巴结活检不作为常规检查推荐[4,5]。
4.术后辅助放疗能够改善肿瘤的局部控制率,但尚无高级别循证医学证据提示术后放疗能延长生存期。放疗时间建议在术后6周之内,给予瘤床及颈部淋巴引流区域放疗,60Gy/6周。
5.术后辅助化疗:转移性黏膜黑色素瘤对传统化疗相对不敏感。北京大学肿瘤医院开展了一项针对Ⅱ/Ⅲ期黏膜黑色素瘤患者术后辅助治疗的随机对照Ⅱ期研究[8],结果提示辅助化疗优于干扰素(TMZ 200mg/m2,d1~5+DDP 75mg/m2,分d1~2),Ⅲ期临床研究正在进行中。韩国一项回顾性研究分析中,总有效率为26.3% (黏膜型为20%),总生存期为12.1个月[18]。高加索人的有效率与此相仿[19,20]。紫杉醇联合卡铂可为既往经过多程治疗的转移性黏膜黑色素瘤患者的合理选择[21]。新的化疗药物如白蛋白紫杉醇联合卡铂在转移性黏膜黑色素瘤中的疗效有待进一步研究。化疗联合抗血管靶向药物可能是晚期黏膜黑色素瘤的一种合理的治疗选择。
6.对于无法手术的ⅣB和ⅣC期患者,应以全身综合治疗为主,参见皮肤黑色素瘤。
7.姑息放疗原则
(1)原发灶姑息放疗:主要目的为减轻症状,提高生活质量。对于ⅣB/C期的头颈部黏膜黑色素瘤首选临床研究或者原发灶局部姑息放疗,原发灶和转移淋巴结66~70Gy/6~7周,应该考虑放疗为姑息治疗而调整剂量和方案。
(2)远处转移脏器的姑息放疗:骨转移的放疗:姑息止痛,或预防病理性骨折,30Gy/10f或者6~8Gy/1f。脑转移的放疗(参见皮肤恶性黑色素瘤脑转移章节)。
8.随访制度
(1)门诊复查频度:术后第1年半内,每3个月一次;术后第1年半内到3年,每6个月一次;术后第3~5年内,每12个月复查一次;5年之后,每12个月一次。复查目的排除局部复发、区域性淋巴结复发和远处转移(重点)。
(2)检测项目:包含三方面内容。
A.局部复发监测:鼻内镜检查。每6个月复查鼻腔、鼻窦及鼻咽影像学,尽量做增强MRI监测局部复发。
B.区域性复发监测:颈部超声,必要时做增强CT或增强MRI了解淋巴结转移情况。远处转移监测:每年一次头胸部CT、骨扫描和腹部超声/CT,必要时行全身PET-CT检查判断。
C.患者全身转移情况。如果患者随访期间,出现可疑任何远处转移的症状,则随时针对局部深入检查,或全身PET-CT。
2.口腔黏膜黑色素瘤
注释
1.黏膜黑色素瘤目前无统一分期,本文参照AJCC头颈部黏膜黑色素瘤分期标准。
2.总的原则是广泛切除并获取阴性切缘。切除的边界包括黏膜切缘和深部切缘。黏膜边界通常指包括肿瘤边界外1.5~2cm外观正常黏膜,深部边界根据肿瘤的原发部位的变异要求不同,由于口腔内解剖空间有限,应考虑到邻近重要组织器官的保留,因此对切除的边界不必片面追求宽度和深度,此时可通过送检冰冻切片确定切除的安全性;肿瘤累及下颌骨骨膜时,通常切除骨质与肿瘤的距离为2cm[1]。
3.由于头颈部淋巴循环解剖复杂,不建议以前哨淋巴结活检作为颈淋巴清扫的依据。对于cN0的患者是否采用同期淋巴清扫还有争议,通常建议观察或延期进行颈淋巴清扫[3]。
4.冷冻治疗口腔黏膜黑色素瘤争议比较大,缺乏高级别临床证据,只有在手术不适用或者范围过大无法手术时方可考虑冷冻治疗[2]。
5.口腔黏膜黑色素瘤通常对放疗不敏感。术后辅助放疗能够改善肿瘤的局部控制率,但尚无高级别循证医学证据提示术后放疗能延长生存期[4-7]。口腔原发灶放疗仅限于局部极晚期或为了保护功能无法达到阴性切缘者,颈部高危区域(转移淋巴结数目≥2个,直径≥3cm,淋巴结结外侵犯,淋巴清扫后局部再次复发)可辅助行颈部淋巴引流区域放疗。放疗时间建议在术后6周之内。
3.直肠黑色素瘤

注释
1.直肠黑色素瘤按照有无肌层侵犯分为Ⅰ期和Ⅱ期,出现区域淋巴结转移的为Ⅲ期,远处转移的为Ⅳ期[1-3]。
2.R0切除是外科切除的主要目标。建议手术方法为经腹会阴直肠切除(APR)。APR局部控制更好,可获得阴性切缘并清扫肠系膜淋巴结,但手术范围大、不保留肛门括约肌影响患者的生活质量。APR也可用于梗阻患者以及需要补救手术者。WLE要求切缘≥10mm。两种手术方式预后无显著差别。目前推荐以APR作为标准。对于外科切除方式的选择需权衡能否获得R0切除、局部复发风险以及患者生活质量等因素[4]。
3.国内一项Ⅱ期临床研究结果提示辅助化疗优于干扰素(TMZ 200mg/m2,d1~5+DDP 75mg/m2,分d1~2)[5],Ⅲ期临床研究正在进行中。
4.生殖系统(女性)黑色素瘤

注释
1.妇科黑色素瘤可参照妇科肿瘤AJCC分期或FIGO分期。
2.在保证阴性切缘的前提下,不推荐预防性全子宫和双附件切除,除非有明确受侵[1]。
3.国内一项Ⅱ期临床研究结果提示辅助化疗优于干扰素(TMZ 200mg/m2,d1~5+DDP 75mg/m2,分d1~2)[2],Ⅲ期临床研究正在进行中。
(二)眼部葡萄膜黑色素瘤 (uveal melanoma,UM)

注释
1.参见AJCC的UM分期。
2.应根据肿瘤大小及部位来选择治疗方法,在不影响生存率的前提下尽量保存眼球或有用视力。COMS研究结果显示:中型UM患者随机接受敷贴放射治疗或眼球摘除,非校正5年生存率分别为81%和82%,结果无统计学差异[1]。
3.巩膜表面敷贴器放射治疗:国外大多数眼科中心的首选疗法,这属于一种近距离放疗,具体方法是在局部巩膜表面放置一个含125I或106Ru放射性粒子的金属盘。建议小型和中型肿瘤采用敷贴放射治疗。
4.眼球摘除术:建议大型肿瘤、疼痛无视力的或无光感的眼球采用眼球摘除。
5.眶内容剜除术:适宜于较大范围的肿瘤穿出眼球扩散至眼眶的病例。
6.目前尚无证据显示辅助治疗可降低转移风险,但是有一些联合细胞毒化疗和免疫治疗药物的新方法正在研究之中,对于经转移风险评估为高风险的患者可考虑入组新方法的临床试验,评估为低风险的患者建议观察[2-6]。
7.转移监测:UM较易于发生肿瘤血行转移,最多见的转移部位为肝脏,多发生于发现原发肿瘤后的5年内。建议患者在眼肿瘤局部治疗后,定期检查腹部MRI、肝功能、胸部CT,对于经转移风险评估为高风险的患者建议每半年检查一次,评估为低风险的患者建议每年检查一次[2-6]。
眼部葡萄膜黑色素瘤Ⅳ期患者的治疗

注释
1.参见AJCC的UM分期。
2.UM最常见转移部位为肝脏。尚无证据显示UM的全身治疗可以提高转移患者的OS,目前入组临床试验是治疗UM转移的首选[1-3]。
3.肝转移灶局部治疗:对于局限肝脏转移的患者可考虑,包括局部手术切除、肝动脉化疗、肝动脉栓塞化疗等[4-8]。
4.ipilimumab:目前有2个Ⅱ期临床试验结果可参考。2015年DeCOG报道的多中心Ⅱ期临床试验中,中位OS为6.8个月(95%CI 3.7~8.1),中位PFS为2.8个月(95%CI 2.5~2.9)。1年和2年OS分别为22%和7%。结论是:ipilimumab对于转移UM的临床疗效非常有限[9]。2014年GEM报道OS为10个月,1年和2年OS分别为48%和25%。这两个研究的区别在于前者的剂量为3mg/kg,85%的患者曾用过其他治疗,后者用了10mg/kg的更高剂量,所有患者均未经治疗。结论是:ipilimumab对UM的一线治疗效果与皮肤黑色素瘤相近[10]。英国UM指南推荐ipilimumab治疗转移UM[3]。
5.MEK抑制剂:2014年Carvajal等报道一项随机、开放的多中心(美国和加拿大共15个临床肿瘤中心)Ⅱ期临床试验在120例转移的UM患者中比较了selumetinib与dacarbazine的治疗效果。结果显示:中位PFS在Dacarbazine组为7周,在selumetinib组为15.9周。中位OS在dacarbazine组为9.1个月,在selumetinib组为11.8个月。dacarbazine组无客观反应,selumetinib组客观反应率为49%。结论是:selumetinib与dacarbazine相比,在提高PFS和反应率方面有一定的作用,但并没有提高OS[11]。进一步评价selumetinib联合dacarbazine治疗转移UM的多中心、随机、双盲Ⅲ期临床试验正在进行中[12,13]。
6.抗PD-1或抗PD-L1单抗:尽管某些初步的很有限的临床报道结果不甚乐观[14],但从免疫机制方面考虑它仍属于有希望的药物,目前有3个正在进行的临床试验,结果值得期待[3,15]。
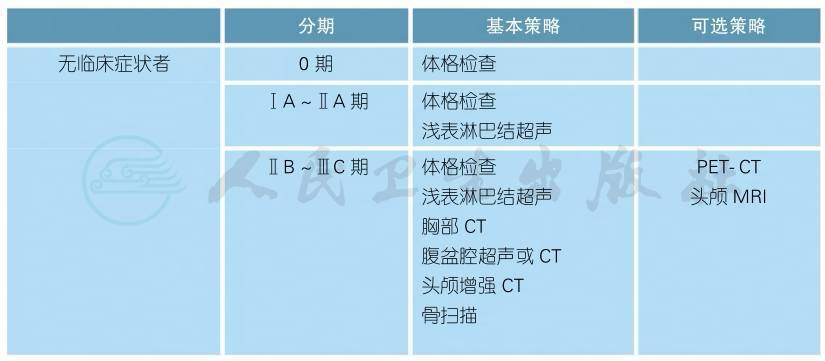
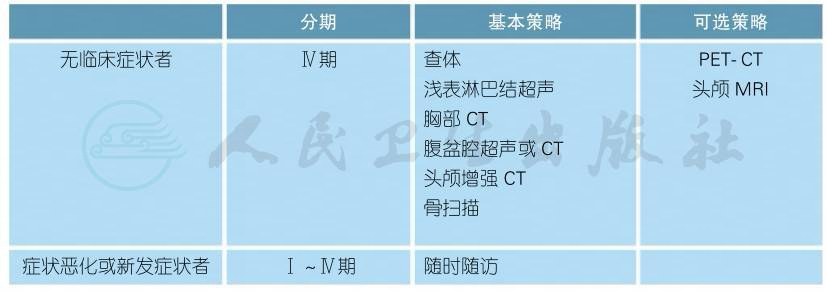
五 随访
(一)皮肤黑色素瘤

皮肤黑色素瘤(续表)

∗常规随访包括:
●终生每年至少行1次皮肤检查;
●教育患者行皮肤和淋巴结自检;
●不推荐行常规血液学检查;
●体检时发现性质不确定的淋巴结,需行区域淋巴结超声检查;
●对未行前哨淋巴结活检、无法行前哨淋巴结活检、前哨淋巴结阳性但未行淋巴结清扫术的患者,根据淋巴结复发的风险,在确诊后的前2~3年每3~12个月行区域淋巴结超声检查。
随访内容
随访内容(续表)
六 附录
1 CSCO证据级别
1类证据:基于高水平证据(严谨的meta分析或RCT结果),专家组有统一共识或有小争议;
2A类证据:基于低水平证据,专家组有统一共识或有小争议;
2B类证据:基于低水平证据,专家组有争议;
3类证据:基于任何水平的证据,专家组存在较大争议。
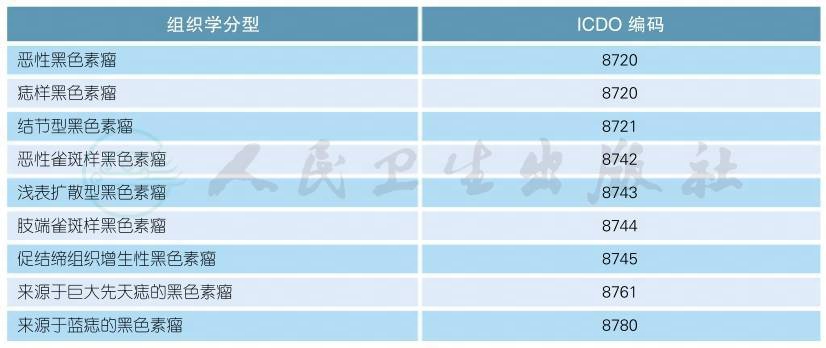
2 恶性黑色素瘤(WHO)病理分类
3 AJCC第8版皮肤恶性黑色素瘤分期
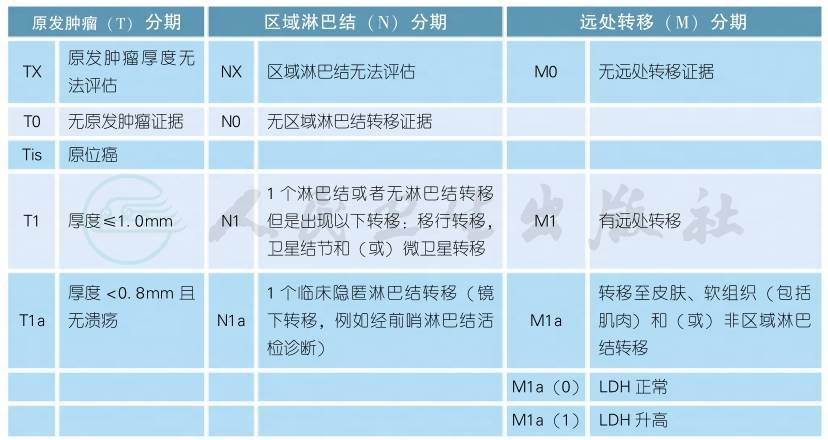
AJCC第8版皮肤恶性黑色素瘤分期(续表)
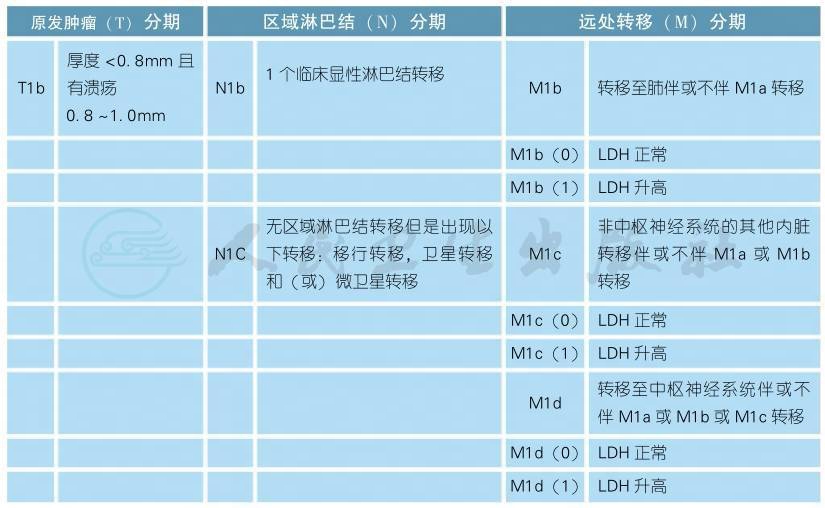
AJCC第8版皮肤恶性黑色素瘤分期(续表)
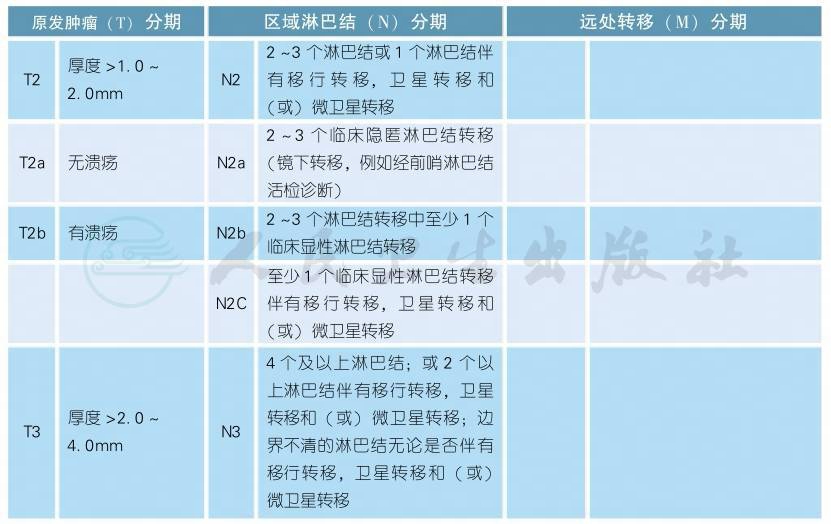
AJCC第8版皮肤恶性黑色素瘤分期(续表)
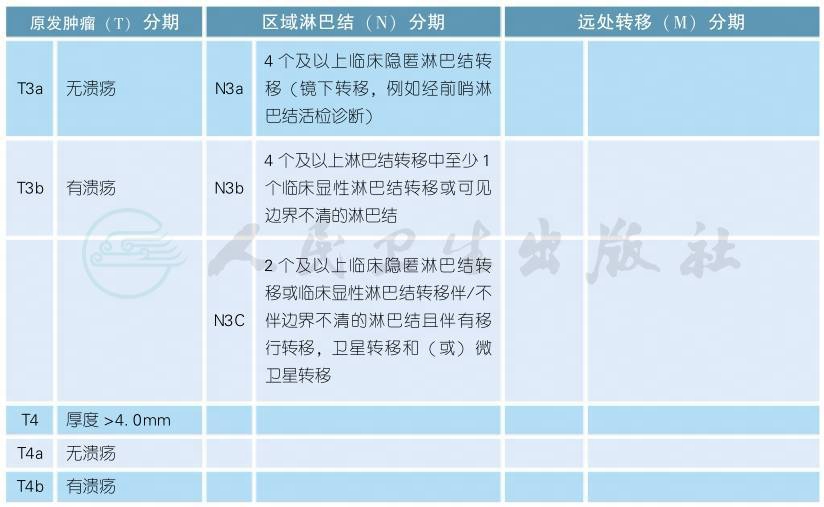
AJCC第8版临床分期(cTNM)
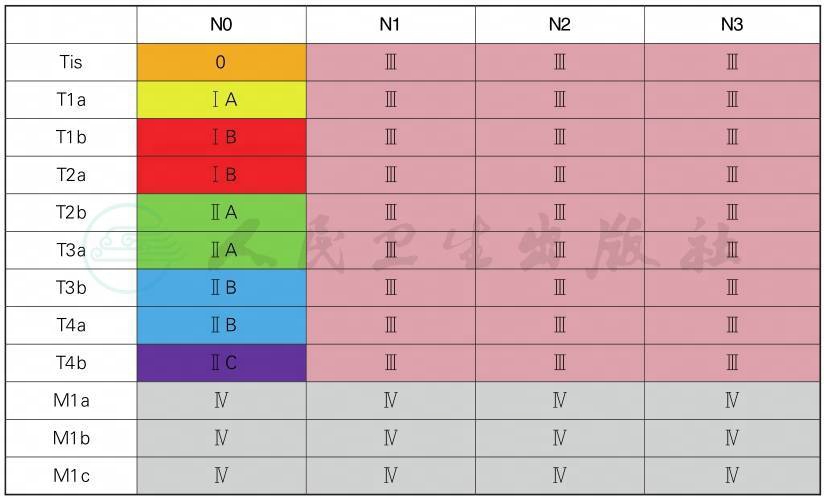
AJCC第8版病理分期
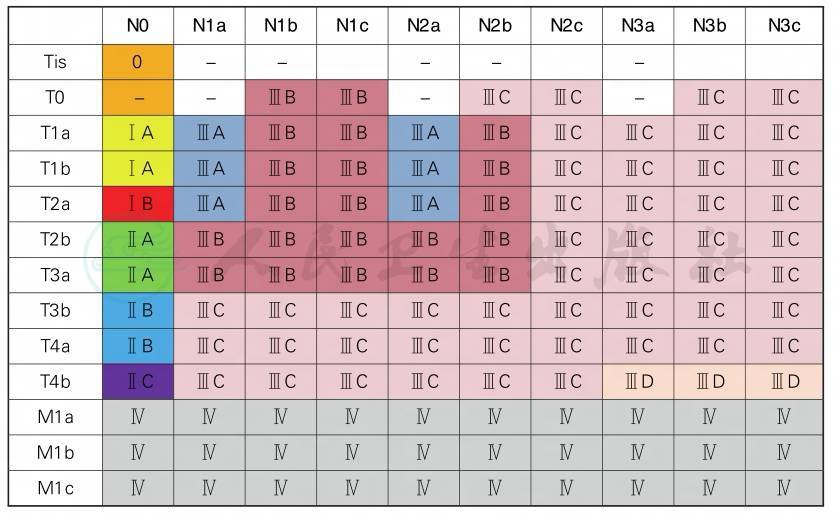
4 头颈部黏膜黑色素瘤分期
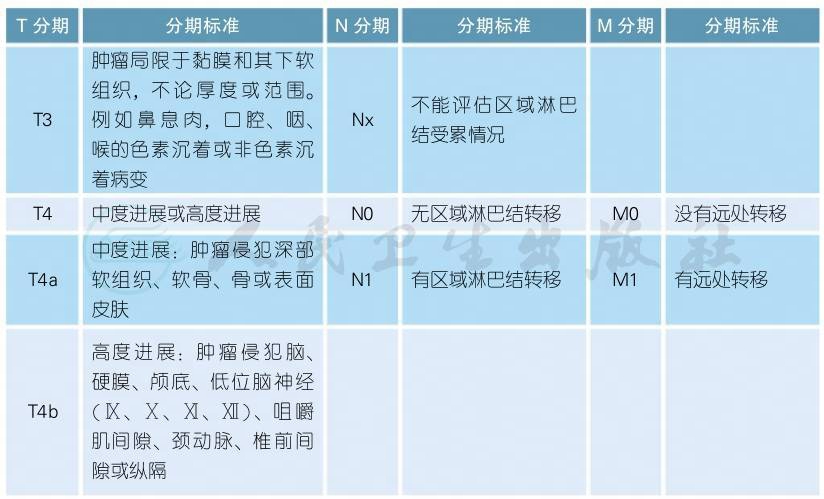
5 AJCC第8版虹膜黑色素瘤分期
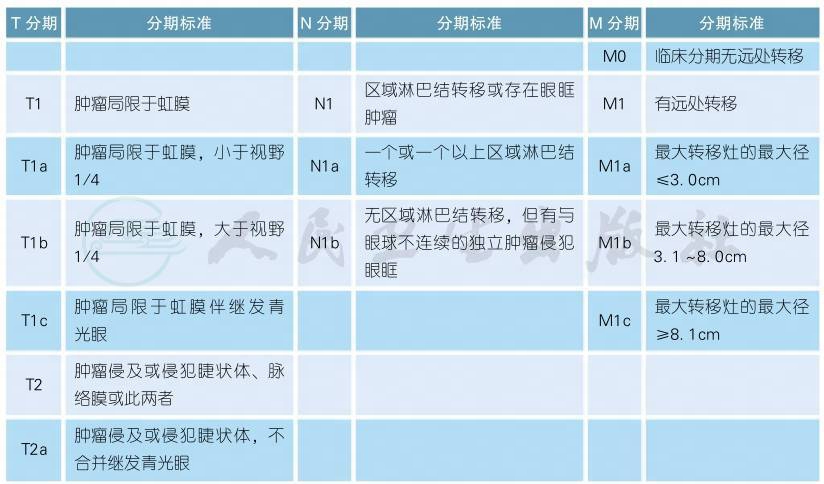
AJCC第8版虹膜黑色素瘤分期(续表)
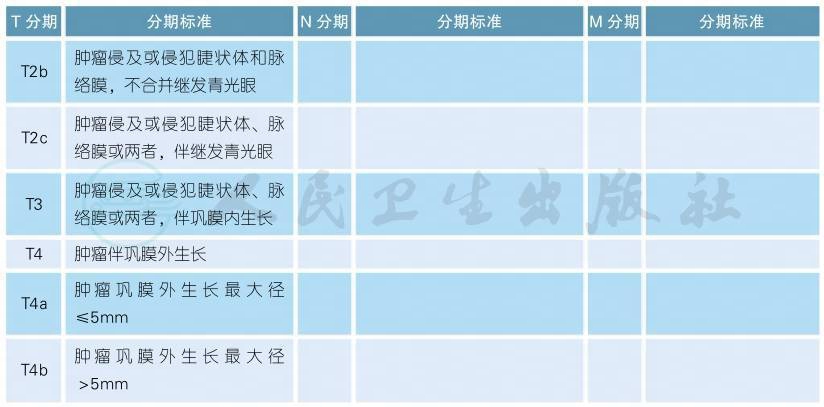
注:虹膜黑色素瘤常起源于且主要位于虹膜,如果虹膜部分的肿瘤负荷小于全部肿瘤的1/2,则应考虑肿瘤起源于睫状体的可能性,并对应睫状体黑色素瘤的分期标准
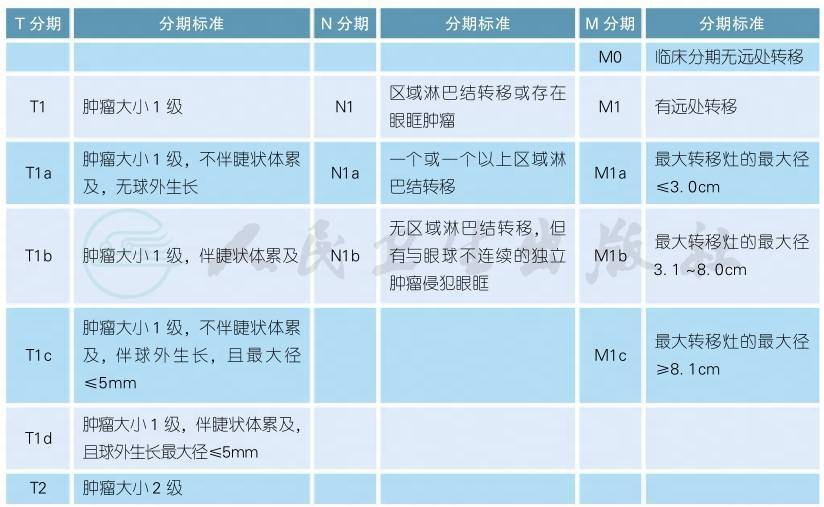
6 AJCC第8版脉络膜、睫状体黑色素瘤分期

AJCC第8版脉络膜、睫状体黑色素瘤分期(续表)
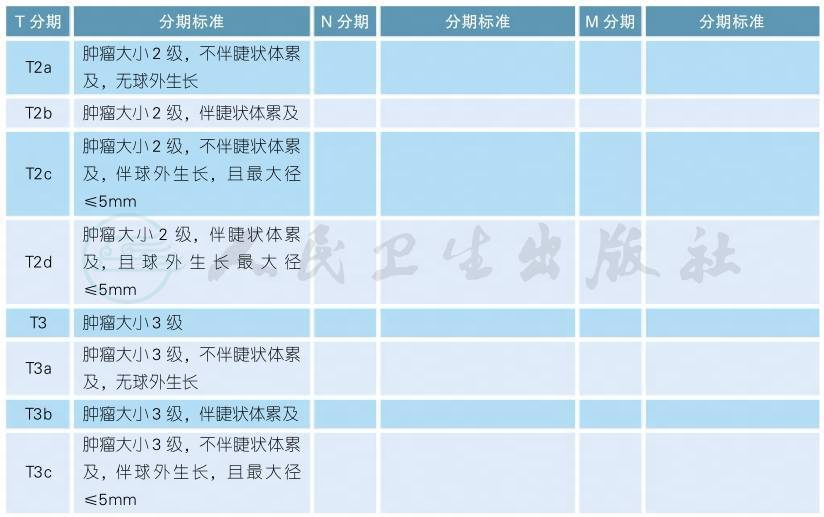
AJCC第8版脉络膜、睫状体黑色素瘤分期(续表)
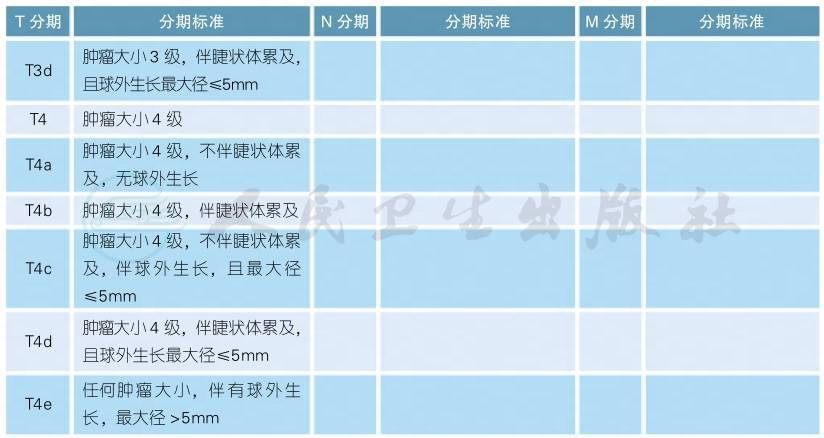
注:
1.原发睫状体和脉络膜黑色素瘤的肿瘤大小分级请参照下图
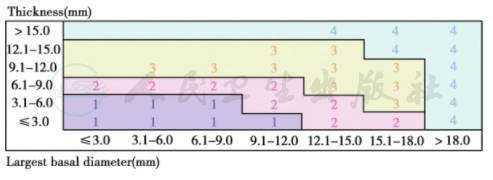
2.在临床工作中,肿瘤的最大基底半径可由视盘半径估测(disc diameters,DD;平均1DD=1.5mm),肿瘤厚度可由屈光度估测(平均2.5diopters=1mm)。使用超声和检眼镜测量结果更加准确。
3.在病理组织固定后测量肿瘤半径和厚度时,可因组织收缩而低估肿瘤大小。
区域淋巴结(N分期)

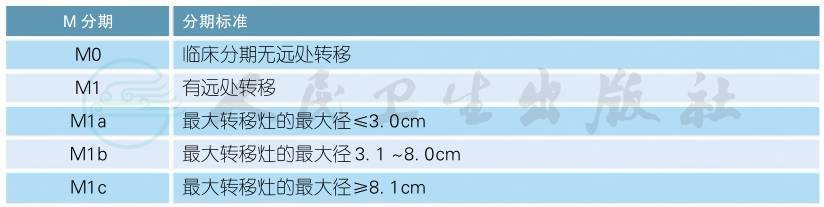
远处转移(M分期)
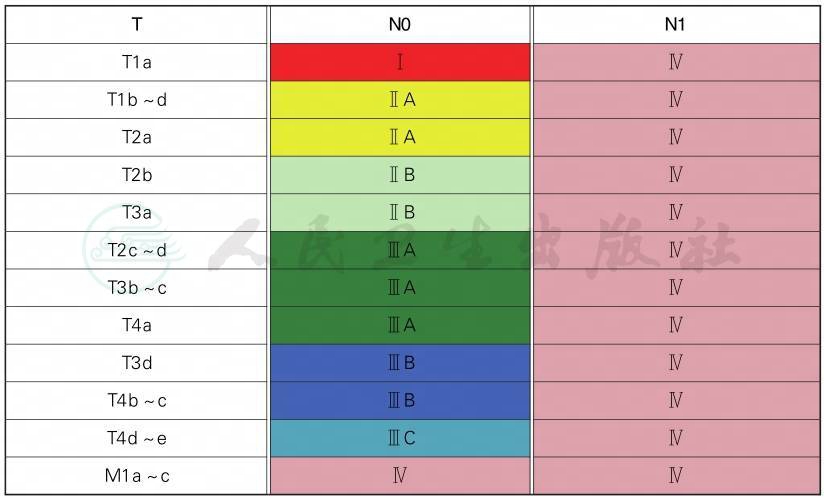
AJCC第8版病理分期
组织学分级(G分级)
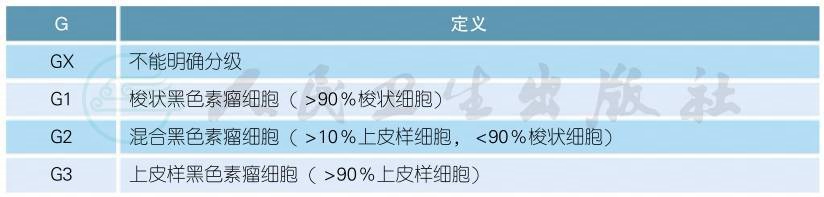
注:目前缺乏明确的上皮样细胞比例作为标准,用以区分混合和上皮样黑色素瘤,有些眼病理学家目前将G2和G3分类合并(非梭状细胞,如见上皮样细胞),而区别于G1(梭状细胞,如未见上皮样细胞)。

续表
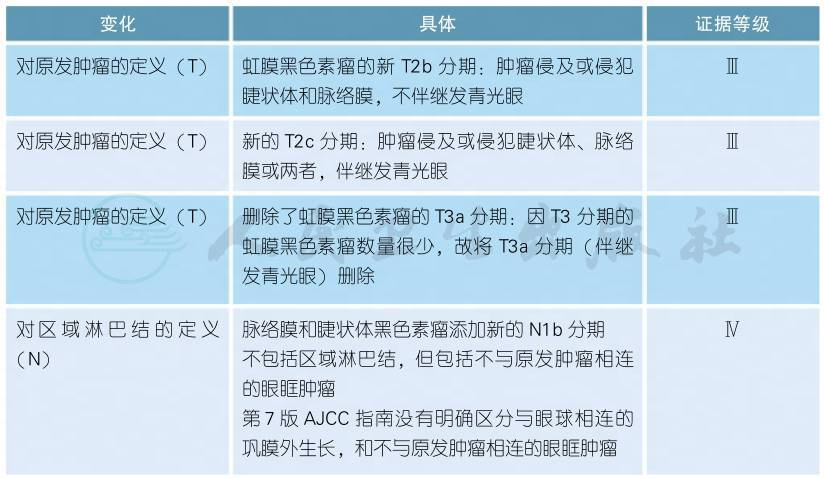
7 AJCC第8版结膜黑色素瘤分期
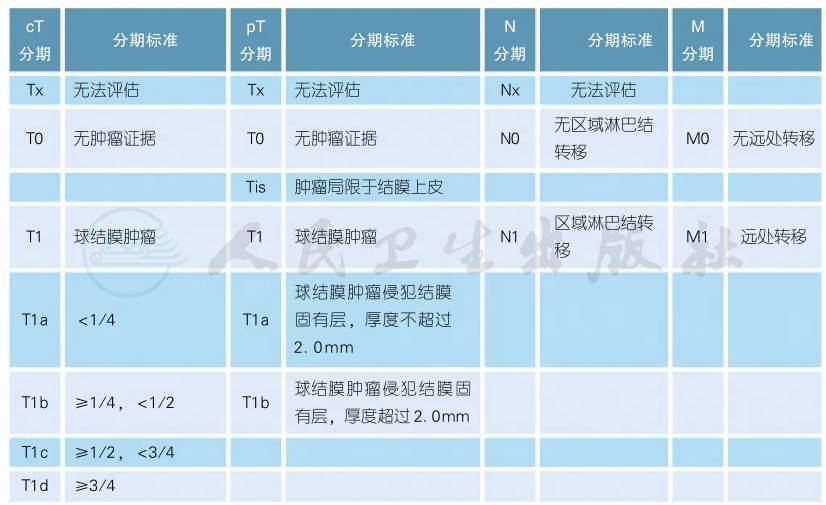
AJCC第8版结膜黑色素瘤分期(续表)
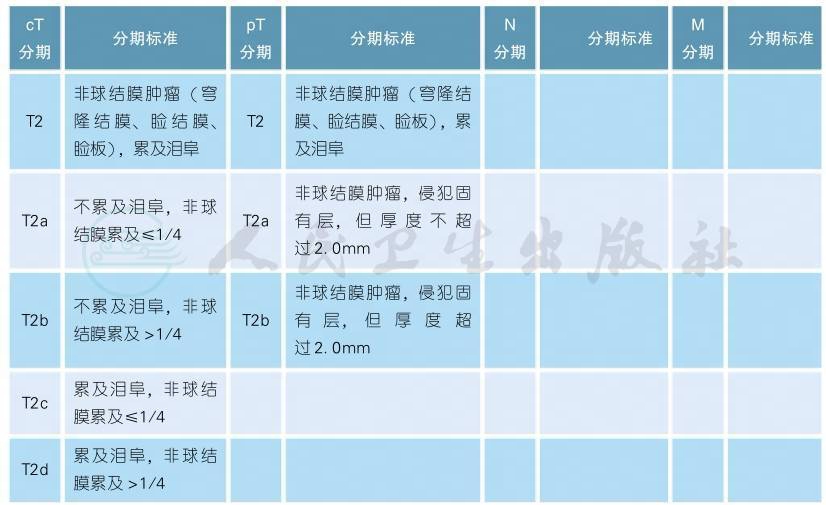
AJCC第8版结膜黑色素瘤分期(续表)
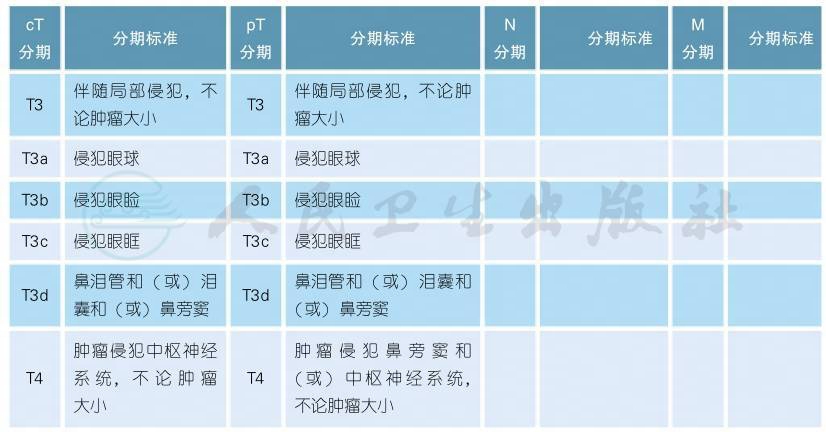
8 原发性恶性黑色素瘤外科扩大切除原则
注:切缘可以根据患者个体的解剖学或功能性需要进行调整
一 影像和分期诊断
1.Xing Y, Bronstein Y, Ross MI, et al.Contemporary diagnostic imaging modalities for the staging and surveillance of melanoma patients: a meta-analysis.J Natl Cancer Inst, 2011, 103(2): 129-142.
2.Clark PB, Soo V, Kraas J, et al.Futility of fluorodeoxy F-18 positron emission tomography in initial evaluation of patients with T2 to T4 melanoma.Arch Surg, 2006, 141(3): 284-288.
3.Testori A, Mozziuo N.Surgical techniques of melanoma and sentinel node biopsy.Semin Oncol, 2002,29(4):325-328.
4.Mocellin S, Hoon DS, Pilati P, et al.Sentinel lymph node molecular ultrastaging in patients with melanoma: asystematicreview and meta-analysisofprognosis.JClin Oncol, 2007, 25 (12):1588-1595.
5.Donald L.M, Thompson JF, Alistair JC, et al.Sentinel-node biopsy or nodal observation in melanoma.New Engl Journal Med, 2006, 355: 1307-1317.
6.Morton DL, Thompson JF, Cochran AJ, et al.Final trial report of sentinel-node biopsy versus nodal observation in melanoma.N Engl J Med, 2014, 370: 599-609.
7.Voit C, Van Akkooi AC, Schafer-Heserberg G, et al.Ultrasound morphology criteria predict metastatic disease of the sentinel nodes in patients with melanoma.J Clin Oncol, 2010, 28(5): 847-852.
二 病理学诊断和分子分型
1.Balch CM, Gershenwald JE, Soong SJ, et al.Final version of 2009 AJCC melanoma staging and classification.J Clin Oncol, 2009, 27(36): 6199-6206.
2.Thompson JF, Soong SJ, Balch CM, et al.Prognostic significance of mitotic rate in localized primary cutaneous melanoma:an analysis of patients in the multi-institutional American Joint Committee on Cancer melanoma staging database.J Clin Oncol, 2011, 29(16): 2199-2205.
3.Balch CM, Gershenwald JE, Soong SJ, et al.Multivariate analysis of prognostic factors among 2313 patients with stageⅢmelanoma: comparison of nodal micrometastases versus macrometastases.J Clin Oncol, 2010, 28(14): 2452-2459.
4.Edge SB, Carducci M, Byrd DR.AJCC Cancer Staging Manual.7th ed.New York: Springer-Verlag New York, LLC, 2009.
5.Piris A, Mihm MC, Duncan LM.AJCC melanoma staging update: impact on dermatopathology practice and patient management.J Cutan Pathol, 2011, 38(5): 394-400.
6.Azzola MF, Shaw HM, Thompson JF, et al.Tumor mitotic rate is a more powerful prognostic indicator than ulceration in patients with primary cutaneous melanoma:an analysis of 3661 patients from a single center.Cancer, 2003, 97(6): 1488-1498.
7.Francken AB, Shaw HM, Thompson JF, et al.The prognostic importance of tumor mitotic rate confirmed in 1317 patients with primary cutaneous melanoma and long follow-up.Ann Surg Oncol, 2004,11(4):426-433.
8.Gimotty PA, Elder DE, Fraker DL, et al.Identification of high-risk patients among those diagnosed with thin cutaneous melanomas.J Clin Oncol, 2007, 25(9): 1129-1134.
9.Thompson JF, Soong SJ, Balch CM, et al.Prognostic significance of mitotic rate in localized primary cutaneous melanoma:an analysis of patients in the multi-institutional American Joint Committee on Cancer melanoma staging database.J Clin Oncol, 2011, 29(16): 2199-2205.
10.Paek SC, Griffith KA,Johnson TM, et al.The impact of factors beyond Breslow depth on predicting sentinel lymph node positivity in melanoma.Cancer, 2007, 109(1): 100-108.
11.Sondak VK, Taylor JM, Sabel MS, et al.Mitotic rate and younger age are predictors of sentinel lymph node positivity: lessons learned from the generation of a probabilistic model.Ann Surg Oncol, 2004,11(3):247-258.
12.College of American Pathologists.Protocol for the examination of specimens from patients with melanoma of the skin.2013.
13.Harrist TJ, Rigel DS, Day CL Jr, et al. “Microscopic satellites” are more highly associated with regional lymph node metastases than is primary melanoma thickness.Cancer, 1984, 53(10):2183-2187.
14.Cancer Genome Atlas Network.Genomic Classification of Cutaneous Melanoma.Cancer Genome Atlas Network.Cell, 2015, 161(7): 1681-1696.
15.High WA, Robinson WA.Genetic mutations involved in melanoma: a summary of our current understanding.Adv Dermatol, 2007, 23: 61-79.
16.Curtin JA, Busam K, Pinkel D, et al.Somatic activation of KIT in distinct subtypes of melanoma.J Clin Oncol, 2006, 24(26): 4340-4346.
17.Curtin JA, Fridlyand J, Kageshita T, et al.Distinct sets of genetic alterations in melanoma.N Engl J Med, 2005, 353(20): 2135-2147.
18.Kong Y, Si L, Zhu Y, et al.Large-scale analysis of KIT aberrations in Chinese patients with Melanoma.Clin Cancer Res, 2011, 17(7): 1684-1691.
19.Si L, Kong Y, Xu X, et al.Prevalence of BRAF V600E mutation in Chinese melanoma patients:large scale analysis of BRAF and NRAS mutations in a 432-case cohort.Eur J Cancer, 2012, 48(1):94-100.
三 基于原发部位、分期和分子分型的综合治疗(皮肤来源)
1.Cascinelli N.Margin of resection in the management of primary melanoma.Semin Surg Oncol, 1998,14(4):272-275.
2.Cohn-Cedermark G, Rutqvist LE, Andersson R, et al.Long term results of a randomized study by the Swedish Melanoma Study Group on 2-cm versus 5-cm resection margins for patients with cutaneous melanoma with a tumor thickness of 0.8-2.0mm.Cancer, 2000, 89(7): 1495-1501.
3.Khayat D, Rixe O, Martin G, et al.Surgical margins in cutaneous melanoma(2 cm versus 5 cm for lesions measuring less than 2.1-mm thick).Cancer, 2003, 97(8): 1941-1946.
4.Balch CM, Soong SJ, Smith T, et al.Long-term results of a prospective surgical trial comparing 2 cm vs.4 cm excision margins for 740 patients with 1-4 mm melanomas.Ann Surg Oncol, 2001, 8(2):101-108.
5.Thomas JM,Newton-Bishop J,A’ Hern R, et al.Excision margins in high-risk malignant melanoma.N Engl J Med, 2004, 350(8): 757-766.
6.Gillgren P, Drzewiecki KT,Niin M,et al.2-cm versus 4-cm surgical excision margins for primary cutaneous melanoma thicker than 2 mm: a randomised, multicentre trial.Lancet, 2011, 378(9803):1635-1642.
7.Kimbrough CW,McMasters KM,Davis EG.Principles of surgical treatment of malignant melanoma.Surg Clin North Am, 2014, 94(5): 973-988, vii.
8.Mitteldorf C, Bertsch HP, Jung K, et al.Sentinel Node Biopsy Improves Prognostic Stratification in Patients with Thin(pT1)Melanomas and an Additional Risk Factor.Ann Surg Oncol, 2014, 21(7):2252-2258.
9.Wong SL, Brady MS, Busam KJ, et al.Results of sentinel lymph node biopsy in patients with thin melanoma.Ann Surg Oncol, 2006, 13(3): 302-309.
10.Chi Z, Li S, Sheng X, et al.Clinical presentation, histology, and prognoses of malignant melanoma in ethnic Chinese: A study of 522 consecutive cases.BMC Cancer, 2011, 11: 85.
11.Morton DL, Thompson JF, Cochran AJ, et al.Final trial report of sentinel-node biopsy versus nodal observation in melanoma.N Engl J Med, 2014, 370(7): 599-609.
12.Van der Ploeg AP, Van Akkooi AC, Rutkowski P, et al.Prognosis in patients with sentinel node-positive melanoma is accurately defined by the combined Rotterdam tumor load and Dewar topography criteria.J Clin Oncol, 2011, 29(16): 2206-2214.
(二)ⅡA、ⅡB期恶性黑色素瘤的治疗
1.Kirkwood JM, Strawderman MH, Ernstoff MS, Smith TJ, Borden EC, Blum RH.Interferon alfa-2b adjuvant therapy of high-risk resected cutaneous melanoma:the Eastern Cooperative Oncology Group Trial EST 1684.J Clin Oncol, 1996, 14(1): 7-17.
2.Kirkwood JM,Ibrahim JG, Sondak VK, et al.High-and low-dose interferon alfa-2b in high-risk melanoma: first analysis of intergroup trial E1690/S9111/C9190.J Clin Oncol, 2000, 18 (12):2444-2458.
3.Kimbrough CW,McMasters KM,Davis EG.High-dose interferon alfa-2b significantly prolongs relapsefree and overall survival compared with the GM2-KLH/QS-21 vaccine in patients with resected stageⅡB-Ⅲ melanoma: results of intergroup trial E1694/S9512/C509801.Surg Clin North Am, 2014, 94(5):973-988,vii.
4.Mocellin S, Pasquali S, Rossi CR, et al.Interferon alpha adjuvant therapy in patients with high-risk melanoma:a systematic review and meta-analysis.J Natl Cancer Inst, 2010, 102(7): 493-501.
5.Pectasides D,Dafni U,Bafaloukos D,et al.Randomized phaseⅢ study of 1 month versus 1 year of adjuvant high-dose interferon alfa-2b in patients with resected high-risk melanoma.J Clin Oncol, 2009,20; 27(6): 939-944.
6.Cascinelli N, Bufalino R, Morabito A, et al.Results of adjuvant interferon study in WHO melanoma programme.Lancet, 1994, 343: 913-914.
7.Hauschild A,Weichenthal M,rass K,et al.efficacy of lowdose interferon{alpha}2a 18 versus 60 months of treatment inpatients with primary melanoma of≥1.5mm tumor thickness: results of a randomized phase Ⅲ DecoG trial.J Clin Oncol, 2010, 28: 841-846.
8.Eggermont AM, Suciu S, MacKier, et al.Post-surgery adjuvant therapy with intermediate doses of interferon alfa 2b versusobservation in patients with stageⅡb/Ⅲ melanoma(eortc18952): randomised controlled trial.Lancet, 2005, 366: 1189-1196.
9.Eggermont AM, Suciu S,Santinami M, et al.Adjuvant therapy with pegylated interferon alfa-2b versus observation alone inresected stageⅢmelanoma: final results of eortc 18991,a randomised phaseⅢtrial.Lancet, 2008, 372: 117-126.
10.Mao L,Si L,Chi Z,et al.A randomised phaseⅡ trial of 1 month versus 1 year of adjuvant high-dose interferon α-2b in high risk acral melanoma patients.Eur J Cancer, 2011, 47(10): 1498-1503.
11.Agarwala SS,Lee SJ, Yip W, et al.PhaseⅢ Randomized Study of 4 Weeks of High-Dose Interferonα-2b in Stage T2bNO, T3a-bNO, T4a-bNO, and T1-4N1a-2a(microscopic)Melanoma: A Trial of the Eastern Cooperative Oncology Group-American College of Radiology Imaging Network Cancer Research Group(E1697).J Clin Oncol, 2017, 35(8): 885-892.
(三)ⅢA、ⅢB、ⅢC期恶性黑色素瘤的治疗
1.Kimbrough CW,McMasters KM,Davis EG.Principles of surgical treatment of malignant melanoma.Surg Clin North Am,2014,94(5): 973-988, vii.
2.Burmeister BH, Henderson MA, Ainslie J, et al.Adjuvant radiotherapy versus observation alone for patients at risk of lymph-node field relapse after therapeutic lymphadenectomy for melanoma:a randomised trial.Lancet Oncol, 2012, 13(6): 589-597.
3.Henderson MA, Burmeister BH, Ainslie J, et al.Adjuvant lymph-node field radiotherapy versus observation only in patients with melanoma at high risk of further lymph-node field relapse after lymphadenectomy(ANZMTG 01.02/TROG 02.01):6-year follow-up of a phase
4.Randomised controlled trial.Lancet Oncol, 2015, 16(9): 1049-1060.
5.Eggermont AM, Chiarion-Sileni V, Grob JJ, et al.Adjuvant ipilimumab versus placebo after complete resection of high-risk stageⅢ melanoma(EORTC 18071): a randomised, double-blind, phase 3 trial.Lancet Oncol, 2015, 16(5): 522-530.
6.Thompson JF, Hunt JA, Shannon KF, et al.Frequency and duration of remission after isolated limb perfusion for melanoma.Arch Surg, 1998, 132(8): 903-907.
7.Beasley GM, Caudle A, Petersen RP, et al.A multi-institutional experience of solated limb infusion:defining response and toxicity in the US.J Am Coll Surg, 2009, 208(5): 706-715; discussion 715-717.
8.Boesch CE, Meyer T, Waschke L, et al.Long-term outcome of hyperthermic isolated limb perfusion(HILP)in the treatment of locoregionally metastasized malignant melanoma of the extremities.Int J Hyperthermia, 2010, 26(1): 16-20.
9.Andtbacka RH, Kaufman HL, Collichio F, et al.Talimogene Laherparepvec Improves durable response rate in patients with advanced melanoma.J Clin Oocol, 2015, 33(25): 2780-2788.
10.Thompson JF, Agarwala SS, Smithers BM, et al.Phase 2 study of intralesional PV-10 in refractory metastatic melanoma.Ann Surg Oncol, 2015, 22(7): 2135-2142.
(四)可完全切除的Ⅳ期恶性黑色素瘤的治疗
1.Kimbrough CW,McMasters KM,Davis EG.Principles of surgical treatment of malignant melanoma.Surg Clin North Am,2014,94(5): 973-988, vii.
2.Wei IH,Healy MA,Wong SL.Surgical treatment options for stageⅣ melanoma.Surg Clin North Am,2014, 94(5): 1075-1089, ix.
(五)不可手术切除的Ⅳ期黑色素瘤的治疗
皮肤播散性(不可手术切除)Ⅳ期黑色素瘤患者的治疗原则
1.Liew DN,Kano H,Kondziolka D,et al.Outcome predictors of Gamma knife surgery for melanoma brain metastases.Clinical article.J Neurosurg, 2011, 114: 769-779.
2.Frakes JM,Figura ND,Ahmed KA,et al.Potential role for LINAC-based stereotactic radiosurgery for the treatment of 5 or more radioresistant melanoma brain metastases.J Neurosurg, 2015, 123(5):1261-1267.
3.Selek U, Chang EL, Hassenbusch SJ, et al.Stereotactic radiosurgical treatment in 103 patients for 153 cerebral melanoma metastases.Int J Radiat Oncol Biol Phys, 2014, 59: 1097-1106.
4.Bernard ME, Wegner RE, Reineman K, et al.Linear accelerator based stereotactic radiosurgery for melanoma brain metastases.J Cancer Res Ther, 2012, 8: 215-221.
5.Rades D, Sehmisch L, Huttenlocher S, et al.Radiosurgery alone for 1-3 newly-diagnosed brain metastases from melanoma: impact of dose on treatment outcomes. Anticancer Res, 2014, 34:5079-5082.
6.Atkins MB, Sosman JA, Agarwala S, et al.Temozolomide, thalidomide, and whole brain radiation therapy for patients with brain metastasis from metastatic melanoma:a phaseⅡ cytokine working group study.Cancer, 2008, 113: 2139-2145.
7.Fogarty G, Morton RL, Vardy J, et al.Whole brain radiotherapy after local treatment of brain metastases in melanoma patients-a randomized phaseⅢ trial.BMC Cancer, 2011, 11: 142.
8.Chang EL, Wefel JS, Hess KR, et al.Neurocognition in patients with brain metastases treated with radiosurgery or radiosurgery plus whole-brain irradiation: a randomized controlled trial.Lancet Oncol,2009, 10: 1037-1044.
9.Huguenin PU, Kieser S, Glanzmann C, et al.Radiotherapy for metastatic carcinomas of the kidney or melanomas: an analysis using palliative end points.Int J Radiat Oncol Biol Phys, 1998, 41:401-405.
10.Oliver KR, Schild SE, Morris CG, et al.A higher radiotherapy dose is associated with more durable palliation and longer survivalin patients with metastatic melanoma. Cancer, 2007, 110:1791-1795.
11.Overgaard J, von der Maase H, Overgaard M.A randomized study comparing two high-dose per fraction radiation schedules in recurrent or metastatic malignant melanoma.Int J Radiat Oncol Biol Phys,1985, 11: 1837-1839.
12.Sause WT, Cooper JS, Rush S, et al.Fraction size in external beam radiation therapy in the treatment of melanoma.Int J Radiat Oncol Bio Phys, 1991, 20: 429-432.
13.Anker CJ, Ribas A, Grossmann AH, et al.Severe liver and skin toxicity after radiation and vemurafenib in metastatic melanoma.J Clin Oncol, 2013, 31: e283-287.
14.Peuvrel L, Ruellan AL, Thillays F, et al.Severe radiotherapy-induced extracutaneous toxicity under vemurafenib.Eur J Dermatol, 2013, 23: 879-881.
15.Jahanshahi P, Nasr N, Unger K, et al.Malignant melanoma and radiotherapy: past myths, excellent local control in 146 studied lesions at Georgetown University,and improving future management.Front Oncol, 2012, 2: 167.
(五)不可手术切除的Ⅳ期黑色素瘤的治疗
1.Garbe C, Eigentler TK, Keilholz U, et al.Systematic review of medical treatment in melanoma: current status and future prospects.Oncologist, 2011, 16: 5-24.
2.Falkson CI, Ibrahim J, Kirkwood JM, et al.PhaseⅢ trial of dacarbazine versus dacarbazine with tamoxifen versus dacarbazine with interferon alfa-2b and tamoxifen in patients with metastatic malignant melanoma: an Eastern Cooperative Oncology Group study.J Clin Oncol, 1998, 16: 1743-1751.
3.Middleton M,Grob J,Aaronson N,et al.Randomized phaseⅢ study of temozolomide versus dacarbazine in the treatment of patients with advanced metastatic malignant melanoma.J Clin Oncol, 2000, 18:158-166.
4.Avril MF, Aamdal S, Grob JJ, et al.Fotemustine compared with dacarbazine in patients with disseminated malignant melanoma: a phaseⅢ study.J Clin Oncol, 2004, 22: 1118-1125.
5.Bedikian AY,Millward M,Pehamberger H,et al.Bcl-2 antisense(oblimersen sodium)plus dacarbazine in patients with advanced melanoma: the Oblimersen Melanoma Study Group.J Clin Oncol, 2006,24:4738-4745.
6.Legha SS, Ring S, Eton O, et al.Development of a biochemotherapy regimen with concurrent administration of cisplatin, vinblastine, dacarbazine, interferon alfa, and interleukin-2 for patients with metastatic melanoma.J Clin Oncol, 1993, 16(5): 1752-1759.
7.Chapman PB,Einhorn LH,Meyers ML,et al.PhaseⅢ multicenter randomized trial of the Dartmouth regimen versus dacarbazine in patients with metastatic melanoma.J Clin Oncol, 1999, 17(9):2745-2751.
8.Tentori L,Graziani G.Recent approaches to improve the antitumor efficacy of temozolomide.Curr Med Chem, 2009, 16(2): 245-257.
9.Boogerd W,de Gast GC,Dalesio O.Temozolomide in advanced malignant melanoma with small brain metastases: can we withhold cranial irradiation?Cancer, 2007, 109(2): 306-312.
10.Schadendorf D, Hauschild A, Ugurel S, et al.Dose-intensified bi-weekly temozolomide in patients with asymptomatic brain metastases from malignant melanoma: a phase Ⅱ DeCOG/ADO study.Ann Oncol,2006, 17(10): 1592-1597.
11.Krown SE, Niedzwiecki D, Hwu WJ, et al.PhaseⅡ study of temozolomide and thalidomide in patients with metastatic melanoma in the brain: high rate of thromboembolic events(CALGB 500102).Cancer,2006, 107(8): 1883-1890.
12.Rao RD, Holtan SG, Ingle JN,et al.Combination of paclitaxel and carboplatin as second-line therapy for patients with metastatic melanoma.Cancer, 2006, 106(2): 375-382.
13.Agarwala SS,Keilholz U,Hogg D,et al.Randomized phaseⅢ study of paclitaxel plus carboplatin with or without sorafenib as second-line treatment in patients with advanced melanoma.J Clin Oncol, 2007,25(18 suppl):8510.
14.Hauschild A,Agarwala SS,Trefzer U,et al.Results of a phaseⅢ,randomized,placebo-controlled study of sorafenib in combination with carboplatin and paclitaxel as second-line treatment in patients with unresectable stageⅢ or stageⅣ melanoma.J Clin Oncol, 2009, 27:2823-2830.
15.Wiernik PH, Einzig AI.Taxol in malignant melanoma.J Natl Cancer Inst Monogr, 1993, 15:185-187.
16.Wiernik PH, Schwartz EL, Einzig A, et al.Phase I trial of taxol given as a 24-hour infusion every 21 days: responses observed in metastatic melanoma.J Clin Oncol, 1987, 5: 1232-1239.
17.Legha SS, Ring S, Papadopoulos N, et al.A phaseⅡtrial of taxol in metastatic melanoma.Cancer,1990, 65: 2478-2481.
18.Einzig AI,Hochster H,Wiernik PH,et al.A phaseⅡ study of taxol in patients with malignant melanoma.Invest New Drugs, 1991, 9: 59-64.
19.Walker L,Schalch H,King DM,et al.PhaseⅡ trial of weekly paclitaxel in patients with advanced melanoma.Melanoma Res, 2005, 15: 453-459.
20.Bedikian AY,Plager C,Papadopoulos N,et al.PhaseⅡ evaluation of paclitaxel by short intravenous infusion in metastatic melanoma.Melanoma Res, 2004, 14: 63-66.
21.Hersh E, Del Vecchio M, Brown M, et al.Phase 3, randomized, open-label, multicenter trial of nab-paclitaxel(nab-P)versus dacarbazine(DTIC)in previously untreated patients with metastatic malignant melanoma(MMM).Pigment Cell Melanoma Res, 2012, 25(6): 863.
22.Genentech, Inc.Prescribing information: COTELLIC(cobimetinib)tablets, for oral use.2015.
23.GlaxoSmithKline.Prescribing information: MEKINIST(trametinib)tablets, for oral use.2015.
24.Genentech, Inc.Prescribing information: ZELBORAF® (vemurafenib)tablet for oral use.2015.
25.GlaxoSmithKline.Prescribing information: TAFINLAR(dabrafenib)capsules, for oral use.2015.
26.Long GV,Menzies AM,Nagrial AM,et al.Prognostic and Clinicopathologic Associations of Oncogenic BRAF in metastatic Melanoma.J Clin Oncol,2011.
27.Flaherty KT, Puzanov I, Kim KB, et al.Inhibition of mutated, activated BRAF in metastatic melanoma.N Engl J Med, 2010, 363: 809-819.
28.Chapman PB, Hauschild A, Robert C, et al.Improved survival with vemurafenib in melanoma with BRAF V600E mutation.N Engl J Med, 2011, 2507-2516.
29.Sosman JA, Kim KB, Schuchter L, et al.Survival in BRAF V600-mutant advanced melanoma treated with vemurafenib.N Engl J Med, 2012, 366: 707-714.
30.Hauschild A, Grob JJ, Demidov LV, et al.Phase Ⅲ, randomized, open-label, multicenter trial(BREAK-3)comparing the BRAF kinase inhibitor dabrafenib(GSK2118436)with dacarbazine(DTIC)in patients with BRAFV600E-mutated melanoma[abstract].J Clin Oncol, 2012, 30(Suppl 18):LBA8500.
31.Long GV, Trefzer U, Davies MA, et al.Dabrafenib in patients with Val600Glu or Val600Lys BRAF-mutant melanoma metastatic to the brain(BREAK-MB): a multicentre, open-label, phase 2 trial.Lancet Oncol, 2012, 13: 1087-1095.
32.Flaherty KT, Robert C, Hersey P, et al.Improved survival with MEK inhibition in BRAF-mutated melanoma.N Engl J Med, 2012, 367: 107-114.
33.Kim KB,Kefford R,Pavlick AC,et al.PhaseⅡ study of the MEK1/MEK2 inhibitor Trametinib in patients with metastatic BRAF-mutant cutaneous melanoma previously treated with or without a BRAF inhibitor.J Clin Oncol, 2013, 31: 482-489.
34.Chapman PB, Hauschild A, Robert C, et al.Improved survival with vemurafenib in melanoma with BRAF V600E mutation.N Engl J Med, 2011, 2507-2516.
35.Kim KB,Kefford R,Pavlick AC,et al.PhaseⅡ study of the MEK1/MEK2 inhibitor Trametinib in patients with metastatic BRAF-mutant cutaneous melanoma previously treated with or without a BRAF inhibitor.J Clin Oncol, 2013, 31: 482-489.
36.Hauschild A, Grob JJ, Demidov LV, et al.Dabrafenib in BRAFmutated metastatic melanoma: a multicentre, open-label, phase 3 randomised controlled trial.Lancet, 2012, 380: 358-365.
37.Flaherty KT, Infante JR, Daud A, et al.Combined BRAF and MEK Inhibition in Melanoma with BRAF V600 Mutations.N Eng J Med, 2012, 367: 1694-1703.
38.Anna C.Pavlick.Extended follow-up results of phase Ib study(BRIM7)of vemurafenib(VEM)with cobimetinib(COBI) in BRAF-mutantmelanoma.J Clin Oncol, 2015, 33 (Suppl15):Abstract 9020.
39.Si L, Kong Y, Xu X, et al.Prevalence of BRAF V600E mutation in Chinese melanoma patients: large scale analysis of BRAF and NRAS mutations in a 432-case cohort.Eur J Cancer, 2012(48): 94-100.
40.Hamid O, Robert C, Daud A, et al.Safety and tumor responses with lambrolizumab(anti-PD-1)in melanoma.N Engl J Med, 2013, 369(2): 134-144.
41.Robert C, Ribas A, Wolchok JD, et al.Anti-programmed-death-receptor-1 treatment with pembrolizumab in ipilimumabrefractory advanced melanoma:a randomised dose-comparison cohort of a phase 1 trial.Lancet, 2014, 384(9948): 1109-1117.
42.Robert C, Long GV,Brady B,et al.Nivolumab in previously untreated melanoma without BRAF mutation.N Engl J Med, 2015, 372(4): 320-330.
43.Hodi FS, O′Day SJ, McDermott DF, et al.Improved survival with ipilimumab in patients with metastatic melanoma.N Engl J Med, 2010, 363(8): 7117-23.
44.Robert C, Thomas L, BondarenkoI, et al.Ipilimumab plus dacarbazine for previously untreated metastatic melanoma.N Engl J Med, 2011, 364(26): 2517-2526.
45.E.R.Squibb&Sons, LLC.Prescribing information: YERVOY® (ipilimumab)injection, for intravenous use.2015.
46.Merck&CO., Inc.Prescribing information: KEYTRUDA® (pembrolizumab)injection, for intravenous use.2015.
47.Weber JS, Kahler KC, Hauschild A.Management of immune-related adverse events and kinetics of response with ipilimumab.J Clin Oncol, 2012, 30: 2691-2697.
48.Bristol-Myers Squibb Company.Prescribing information: OPDIVO(nivolumab)infection, for intravenous use.2016.
49.Pages C, Gornet JM, Monsel G, et al.Ipilimumab-induced acute severe colitis treated by infliximab.Melanoma Res, 2013, 23: 227-230.
50.Beniwal-Patel P, Matkowskyj K, Caldera F.Infliximab therapy for corticosteroid-resistant ipilimumabinduced colitis.J Gastrointestin Liver Dis, 2015, 24: 274.
51.Arriola E, Wheater M,Krishnan R, et al.Immunosuppression for ipilimumab-related toxicity can cause pneumonia but spare antitumor immune control.Oncoimmunology, 2015, 4: e1040218.
52.Beck KE, Blansfield JA, Tran KQ, et al.Enterocolitis in patients with cancer after antibody blockade of cytotoxic T-lymphocyte-associated antigen 4.J Clin Oncol, 2006, 24: 2283-2289.
53.Minor DR,Chin K,Kashani-Sabet M.Infliximab in the treatment of anti-CTLA4 antibody(ipilimumab)induced immune-related colitis.Cancer BiotherRadiopharm, 2009, 24: 321-325.
54.Johnston RL, Lutzky J, Chodhry A, Barkin JS.Cytotoxic T-lymphocyte-associated antigen 4 antibodyinduced colitis and its management with infliximab.Dig Dis Sci, 2009, 54: 2538-2540.
55.Janssen Biotech, Inc.Prescribing information: REMICADE(infliximab)lyophilized concentrate for injection,for intravenous use.2015.
56.Eggermont AM, Chiarion-Sileni V, Grob JJ, et al.Adjuvant ipilimumab versus placebo after complete resection of high-risk stageⅢ melanoma(EORTC 18071): a randomised, double-blind, phase 3 trial.Lancet Oncol, 2015, 16: 522-530.
57.Bertrand A,Kostine M,Barnetche T,et al.Immune related adverse events associated with anti-CTLA-4 antibodies: systematic review and meta-analysis.BMC Med, 2015, 13: 211.
58.Postow MA, Chesney J, Pavlick AC, et al.Nivolumab and ipilimumab versus ipilimumab in untreated melanoma.N Engl J Med, 2015, 372: 2006-2017.
59.Sarnaik AA, Yu B, Yu D, et al.Extended dose ipilimumab with a peptide vaccine: immune correlates associated with clinical benefit in patients with resected high-risk stageⅢc/Ⅳ melanoma.Clin Cancer Res, 2011, 17: 896-906.
2)BRAF V600野生型、无脑转移患者的治疗
J Guo, L Si, Y Kong, et al.A Phase Ⅱ, Open Label, Single-arm Trial of ImatinibMesylate in Patients with MetastaticMelanomaHarboring c-KitMutation orAmplification.JClin Oncol, 2011, 29:2904-2909.
黏膜来源局限期恶性黑色素瘤的治疗
1.de Graeff A, de Leeuw JR, Ros WJ, et al.Pretreatment factors predicting quality of life aftertreatment for head and neck cancer.Head Neck, 2000, 22: 398-407.
2.Meleti M, Vescovi P, Mooi WJ, et al.Pigmented lesions of the oral mucosa and perioral tissues: a flowchart for the diagnosis and some recommendations for the management.Oral Surg Oral Med Oral Pathol O-ral Radiol Endod, 2008, 105(5): 606-616.
3.Prasad ML, Patel SG, Huvos AG, et al.Primary mucosal melanoma of the head and neck: a proposal for microstaging localized, Stage I(lymph node-negative)tumors.Cancer, 2004, 100: 1657-1664.
4.Starek I, Koranda P, Benes P.Sentinel lymph node biopsy: a new perspective in head and neck mucosal melanoma?Melanoma research, 2006, 16: 423-427.
5.Christopherson K,Malyapa RS,Werning JW,et al.Radiation therapy for mucosal melanoma of the head and neck.Am J Clin Oncol, 2013, Apr 3.
6.Dirix P, Vanstraelen B, Jorissen M, et al.Intensity-modulated radiotherapy for sinonasal cancer: improved outcome compared to conventional radiotherapy.Int J Radiat Oncol Biol Phys, 2010, 78:998-1004.
7.Wu AJ, Gomez J, Zhung JE, et al.Radiotherapy after surgical resection for head and neck mucosal melanoma.Am J Clin Oncol, 2010, 33: 281-285.
8.Lian B,Si L,Cui C,et al.PhaseⅡ Randomized Trial Comparing High-dose Interferon Alfa-2b with Temozolomide plus Cisplatin as Systemic Adjuvant Therapy for Resected Mucosal Melanoma.Clin Cancer Res, 2013, 19(16): 4488-4498.
9.Linsley PS, Bradshaw J, Greene J, et al.Intracellular traffiking of CTLA-4 and focal localization towards sites of TCR engagement.Immunity, 1996, 4: 535-543.
10.Postow MA, Luke JJ, Bluth MJ, et al.Ipilimumab for patients with advanced mucosal melanoma.Oncologist, 2013, 18: 726-732.
11.Del Vecchio M,Di Guardo L,Ascierto PA,et al.Effiacy and safety of ipilimumab 3mg/kg in patients with pretreated, metastatic, mucosal melanoma.Eur J Cancer, 2014, 50: 121-127.
12.Taube JM,Anders RA,Young GD,et al.Colocalization of inflmmatory response with B7-h1 expression in human melanocytic lesions supports an adaptive resistance mechanism of immune escape.Sci Transl Med, 2012, 4: 127-137.
13.Hamid O, Robert C, Daud A, et al.Safety and tumor responses with lambrolizumab(anti-PD-1)in melanoma.N Engl J Med, 2013, 369: 134-144.
14.Topalian SL, Sznol M, McDermott DF, et al.Survival, durable tumor remission, and long-term safety in patients with advanced melanoma receiving nivolumab.J Clin Oncol, 2014, 32: 1020-1030.
15.Kim KB,Sosman JA,Fruehauf JP,et al.BEAM:a randomized phaseⅡ study evaluating the activity of bevacizumab in combination with carboplatin plus paclitaxel in patients with previously untreated advanced melanoma.J Clin Oncol, 2012, 30: 34-41.
16.Grignol VP, Olencki T, Relekar K, et al.A phase 2 trial of bevacizumab and high-dose interferon alpha 2B in metastatic melanoma.J Immunother, 2011, 34: 509-515.
17.von Moos R,Seifert B, Simcock M, et al.First-line temozolomide combined with bevacizumab in metastatic melanoma: a multicentre phase Ⅱ trial(SAKK 50/07).Ann Oncol, 2012, 23: 531-536.
18.Vihinen PP,Hernberg M,Vuoristo MS,et al.A phaseⅡ trial of bevacizumab with dacarbazine and daily low-dose interferon-alpha2a as first line treatment in metastatic melanoma.Melanoma Res, 2010,20:318-325.
19.Cui C, Mao L, Chi Z, et al.A phase Ⅱ, randomized, double-blind, placebo-controlled multicenter trial of Endostar in patients with metastatic melanoma.Mol Ther, 2013, 21: 1456-1463.
20.Yi JH, Yi SY, Lee HR, et al.Dacarbazine-based chemotherapy as fist-line treatment in noncutaneous metastatic melanoma: multicenter, retrospective analysis in Asia.Melanoma Res, 2011, 21:223-227.
21.Harting MS,Kim KB.Biochemotherapy in patients with advanced vulvovaginal mucosal melanoma.Melanoma Res, 2004, 14: 517-520.
22.Bartell HL, Bedikian AY, Papadopoulos NE, et al.Biochemotherapy in patients with advanced head and neck mucosal melanoma.Head Neck, 2008, 30: 1592-1598.
2.口腔黏膜黑色素瘤
1.De Graeff A, de Leeuw JR, Ros WJ, et al.Pretreatment factors predicting quality of life after treatment for head and neck cancer.Head Neck, 2000, 22(4): 398-407.
2.Xin Wang, He-Ming Wu, Guo-Xin Ren, et al.Primary oral mucosal melanoma: advocate a wait-andsee policy in the clinically N0 patient.J Oral Maxillofac Surg, 2012, 70(5): 1192-1198.
3.Zhou Guoyu, Qiu Weiliu, Zhang Zhiyuan, et al.Evaluation of cryosurgery for the management of oral malignant mucomembranous melanoma-A survey of 107 cases reports.Shanghai Kou Qiang Yi Xue,1999, 8(2): 92-93.
4.Christopherson K, Malyapa RS, Werning JW, et al.Radiation therapy for mucosal melanoma of the head and neck.Am J Clin Oncol, 2013, 38(1): 87-89.
5.Dirix P, Vanstraelen B, Jorissen M, et al.Intensity-modulated radiotherapy for sinonasal cancer: improved outcome compared to conventional radiotherapy.Int J Radiat Oncol Biol Phys.2010, 78(4):998-1004.
6.Wu AJ, Gomez J, Zhung JE, et al.Radiotherapy after surgical resection for head and neck mucosal melanoma.Am J Clin Oncol, 2010, 33(3): 281-285.
7.Dauer EH, Lewis JE, Rohlinger AL, et al.Sinonasal melanoma: a clinicopathologic review of 61 cases.Otolaryngol Head Neck Surg, 2008, 138(3): 347-352.
3.直肠黑色素瘤
1.Iddings DM, Fleisig AJ, Chen SL, et al.Practice patterns and outcomes for anorectal melanoma in the USA, reviewing three decades of treatment: is more extensive surgical resection beneficial in all patients.Ann Surg Oncol, 2010, 17(1): 40-44.
2.Nilsson PJ,Ragnarsson-Olding BK.Importance of clear resection margins in anorectal malignant melanoma.Br J Surg, 2010, 97(1): 98-103.
3.Falch C, Stojadinovic A, Hann-von-Weyhern C, et al.Anorectal malignant melanoma: extensive 45-year review and proposal for a novel staging classification.J Am Coll Surg, 2013, 217(2): 324-335.
4.Heeney A, Mulsow J, Hyland JM.Treatment and outcomes of anorectal melanoma.Surgeon, 2011, 9(1):27-32.
5.Lian B, Si L, Cui C, et al.Phase Ⅱ randomized trial comparing high-dose IFN-α2b with temozolomide plus cisplatin as systemic adjuvant therapy for resected mucosal melanoma.Clin Cancer Res, 2013, 19(16): 4488-4498.
4.生殖系统(女性)黑色素瘤
1.Piura B.Management of primary melanoma of the female urogenital tract.The Lancet Oncology, 2008, 9:973-981.
2.Lian B, Si L, Cui C, et al.PhaseⅡ randomized trial comparing high-dose IFN-α 2b with temozolomide plus cisplatin as systemic adjuvant therapy for resected mucosal melanoma.Clin Cancer Res, 2013, 19(16): 4488-4498.
眼部葡萄膜黑色素瘤(uveal melanoma,UM)
1.Diener-West M,Earle JD,Fine SL,et al.Collaborative Ocular Melanoma Study Group.The COMS randomized trial of iodine125 brachytherapy for choroidal melanoma,Ⅲ:initial mortality findings.COMS Report No.18.Arch Ophthalmol, 2001, 119(7): 969-982.
2.Nathan P, Cohen V,Coupland S,et al.United Kingdom Uveal Melanoma Guideline Development Working Group.Uveal Melanoma UK National Guidelines.Eur J Cancer, 2015 , 51(16): 2404-2412.
3.Weis E, Salopek TG, McKinnon JG, et al.Management of uveal melanoma:a consensus-based provincial clinical practice guideline.Curr Oncol, 2016, 23(1): e57-64.
4.Choudhary MM, Triozzi PL, Singh AD.Uveal melanoma:evidence for adjuvant therapy.Int Ophthalmol Clin, 2015, 55(1): 45-51.
5.Blum ES, Yang J, Komatsubara KM, et al.Clinical Management of Uveal and Conjunctival Melanoma.Oncology(Williston Park), 2016, 30(1): 29-32, 34-43, 48.
6.Krantz BA, Dave N, Komatsubara KM, et al.Uveal melanoma: epidemiology, etiology, and treatment of primary disease.Clin Ophthalmol, 2017, 11: 279-289.
眼部葡萄膜黑色素瘤Ⅳ期患者的治疗
1.Carvajal RD, Schwartz GK, Tezel T, et al.Metastatic disease from uveal melanoma: treatment options and future prospects.Br J Ophthalmol, 2017, 101(1): 38-44.
2.Nathan P, Cohen V, Coupland S, et al.United Kingdom Uveal Melanoma Guideline Development Working Group.UvealMelanomaUK NationalGuidelines.EurJCancer, 2015, 51(16):2404-2412.
3.Oliva M, Rullan AJ, Piulats JM.Uveal melanoma as a target for immune-therapy.Ann Transl Med,2016, 4(9): 172.
4.Sato T.Locoregional management of hepatic metastasis from primary uveal melanoma.Semin Oncol,2010, 37(2): 127-138.
5.Shibayama Y, Namikawa K,Sone M, et al.Efficacy and toxicity of transarterial chemoembolization therapy using cisplatin and gelatin sponge in patients with liver metastases from uveal melanoma in an Asian population.Int J Clin Oncol, 2017 Jan 31.doi: 10.1007/s10147-017-1095-0.
6.Valsecchi ME,Terai M,Eschelman DJ,et al.Double-blinded,randomized phaseⅡ study using embolization with or without granulocyte-macrophage colony-stimulating factor in uveal melanoma with hepatic metastases.J Vasc Interv Radiol, 2015 , 26(4): 523-532.e2.
7.Edelhauser G, Schicher N, Berzaczy D, et al.Fotemustine chemoembolization of hepatic metastases from uveal melanoma: a retrospective single-center analysis.AJR Am J Roentgenol, 2012, 199(6):1387-1392.
8.Gonsalves CF, Eschelman DJ, Sullivan KL, et al.Radioembolization as salvage therapy for hepatic metastasis of uveal melanoma: a single-institution experience.AJR Am J Roentgenol, 2011, 196(2):468-473.
9.Zimmer L, Vaubel J, Mohr P, et al.PhaseⅡDeCOG-study of ipilimumab in pretreated and treatmentnaïve patients with metastatic uveal melanoma.PLoS One, 2015, 10: e0118564.
10.Piulats Rodriguez J,Ochoa de Olza M,Codes M,et al.PhaseⅡ study evaluating ipilimumab as a single agent in the first-line treatment of adult patients(Pts)with metastatic uveal melanoma(MUM):The GEM-1 trial.J Clin Oncol, 2014, 32: abstr 9033.
11.Carvajal RD,Sosman JA, Quevedo JF,et al.Effect of selumetinibvs chemotherapy on progression-free survival in uveal melanoma: a randomized clinical trial.JAMA, 2014, 311: 2397-2405.
12.Carvajal RD, Schwartz GK, Mann H, Smith I, Nathan PD.Study design and rationale for a randomised, placebo-controlled, double-blind study to assess the efficacy of selumetinib(AZD6244; ARRY-142886)in combination with dacarbazine in patients with metastatic uveal melanoma(SUMIT).BMC Cancer, 2015, 15: 467.
13.Komatsubara KM,Manson DK,Carvajal RD.Selumetinib for the treatment of metastatic uveal melanoma: past and future perspectives.Future Oncol, 2016, 12(11): 1331-1344.
14.Algazi AP, Tsai KK, Shoushtari AN, et al.Clinical outcomes in metastatic uveal melanoma treated with PD-1 and PD-L1 antibodies.Cancer, 2016, 122(21): 3344-3353.
15.Karydis I, Chan PY, Wheater M, et al.Clinical activity and safety of Pembrolizumab in Ipilimumab pre-treated patients with uveal melanoma.Oncoimmunology, 2016, 5(5): e1143997.
(二)黏膜和眼黑色素瘤随访
1.Mathews JD, Forsythe AV, Brady Z, et al.Cancer risk in 680, 000 people exposed to computed tomography scans in childhood or adolescence: data linkage study of 11 million Australians.BMJ, 2013,346:f2360.
2.Basseres N, Grob JJ, Richard MA, et al.Cost-effectiveness of surveillance of stage I melanoma.A retrospective appraisal based on a 10-year experience in a dermatology department in France.Dermatology, 1995, 191(3): 199-203.
3.Salama AK, de Rosa N, Scheri RP, et al.Hazard-rate analysis and patterns of recurrence in early stage melanoma: moving towards a rationally designed surveillance strategy.PLoS One, 2013, 8(3):e57665.
4.Leiter U,Buettner PG,Eigentler TK,et al.Is detection of melanoma metastasis during surveillance in an early phase of development associated with a survival benefit?Melanoma Res, 2010, 20(3):240-246.
5.Geller AC,Swetter SM,Oliveria S, et al.Reducing mortality in individuals at high risk for advanced melanoma through education and screening.J Am Acad Dermatol, 2011, 65(5 Suppl 1): S87-94.
6.Baker JJ, Meyers MO, Frank J, et al.Routine restaging PET/CT and detection of initial recurrence in sentinel lymph node positive stageⅢ melanoma.Am J Surg,2014,207(4):549-554.
7.Nelson HD, Pappas M, Cantor A, et al.Harms of Breast Cancer Screening: Systematic Review to Update the 2009 U.S.Preventive Services Task Force Recommendation.Ann Intern Med, 2016, 164(4):256-267.
8.Osella-Abate S, Ribero S, Sanlorenzo M, et al.Risk factors related to late metastases in 1, 372 melanoma patients disease free more than 10 years.Int J Cancer, 2015, 136(10): 2453-2457.