 去看看
去看看


1 HCC的筛查和诊断
1.1 HCC的筛查

【注释】
a. 原发性肝癌是我国第4 位的常见恶性肿瘤和第3 位的肿瘤致死病因,严重地威胁我国人民的生命和健康[1,2]。原发性肝癌的病理类型,主要是肝细胞癌(hepatocellular carcinoma,HCC),占到85%~90%;还有少数为肝内胆管癌(intrahepatic cholangiocarcinoma,ICC) 和HCC-ICC 混合型等,三者在发病机制、生物学行为、分子特征、临床表现、病理组织学形态、治疗方法以及预后等方面差异较大。本指南所讲的“肝癌”特指HCC。
b. 在我国,HCC 的高危人群主要有乙型肝炎病毒(hepatitis B virus,HBV) 和/ 或丙型肝炎病毒(hepatitis C virus,HCV) 感染、长期酗酒(酒精性肝病)、非酒精脂肪性肝炎、食用黄曲霉毒素污染的食物、多种原因引起的肝硬化以及有肝癌家族史的人群,同时,年龄40 岁以上的男性风险较大[3]。近年的研究提示糖尿病、肥胖和吸烟等也是HCC 的危险因素,值得关注[4]。
c. 血清甲胎蛋白(alpha-fetoprotein,AFP)阳性,是指AFP ≥ 400μg/L,且排除慢性或活动性肝炎、肝硬化、睾丸或卵巢胚胎源性肿瘤以及妊娠等,高度怀疑肝癌。AFP 低度升高者,应进行动态观察,并与肝功能变化对比分析。约30% 的肝癌患者AFP 水平正常,应检测甲胎蛋白异质体[11],可联合α-L- 岩藻糖苷酶、异常凝血酶原等。
d. 超声影像检查是简便、实时、无创、敏感的方法,可以显示肝脏占位的部位、大小和形态,协助诊断和鉴别诊断。其中,超声造影技术(ultrasonic contrast,或者contrast-enhancedultrasound,CEUS)[11],利用超声造影剂使后散射回声增强,明显提高超声诊断的分辨力、敏感性和特异性的技术,在肝脏肿瘤的检出和定性诊断中具有重要价值。
e. 多期动态增强CT 扫描和/ 或动态对比增强MRI 扫描,显示肝脏占位在动脉期快速不均质血管强化(arterial hypervascularity),而静脉期或延迟期快速洗脱(venous or delayed phase washout)。参见1.2 HCC 的病理诊断中的注释a。
f. 肝血管造影(digital substraction angiography,DSA)[11],是利用介入手段将导管插入相应的肝血管内进行血管造影的X 线诊断方法;主要有选择性腹腔动脉、肝动脉造影和门脉造影,不仅可作准确的定位诊断,且有鉴别诊断的价值,为诊断和指导手术或介入治疗的重要手段。参见4.5 肝动脉介入治疗b(1) 注释。
1.2 HCC 的病理诊断
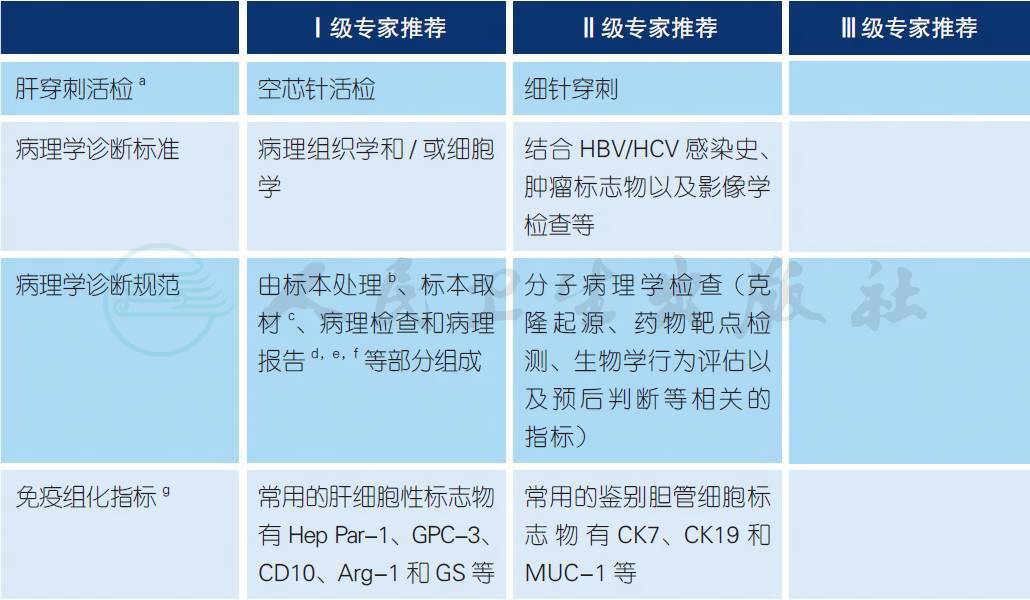
【注释】
a.典型HCC 的影像学特征[1]:在MRI 或CT 增强扫描动脉期(主要在动脉晚期),肝占位呈不均匀明显强化,偶可呈均匀明显强化,尤其是≤ 5.0cm 的肝占位,门脉期和/ 或实质平衡期扫描肿瘤强化明显减弱或降低,这种“快进快出”的增强方式是HCC 诊断的特点。对于缺乏典型的影像学特征的肝内占位性病变,肝穿刺活检可获得病理诊断,对于HCC 的确诊、指导治疗以及预后判断非常重要。一般采用18G 或16G 肝穿刺空芯针活检(core needle biopsy)。细针穿刺(fine needle biopsy) 虽然也可获得病理细胞学诊断,但是存在一定的假阴性率,而阴性结果不能完全排除HCC,且不能进行分子病理学检查。
b.标本处理要点:① 手术医师应在病理检查申请单上明确标注送检标本的部位、种类和数量,对于手术切缘和重要病变可用染料染色或缝线加以标记;② 尽可能将肿瘤标本在离体30min 以内完整送达病理科,及时切开、固定;③ 采用10% 中性福尔马林溶液固定12~24 小时。
c.标本取材要点:癌肿周边区域是肿瘤生物学行为的代表性区域。为此,应采用“7 点”基线取材法,在肿瘤的12 点、3 点、6 点和9 点位置上,于癌与癌旁肝组织交界处按1∶1 取材;在肿瘤内部至少取材1 块;对距肿瘤边缘≤ 1cm(近癌旁) 和> 1cm(远癌旁) 范围内的肝组织分别取材1 块。鉴于多结节性HCC 具有单中心和多中心两种起源方式,在不能除外由肝内转移引起的卫星结节的情况下,单个肿瘤最大直径≤ 3cm 者,应全部取材检查。实际取材的部位和数量还须根据肿瘤的直径和数量等情况综合考虑(2A 类)。
d. 大体标本描述[4]:重点描述肿瘤的部位、大小、数量、颜色、质地、与血管和胆管的关系、包膜状况、周围肝组织病变、卫星结节、肝硬化类型、肿瘤至切缘的距离以及切缘受累情况等。
e. 显微镜下观察描述[4]:参照WHO 标准2010 版,重点描述以下内容:分化程度:可采用国际上常用的Edmondson-Steiner 四级(Ⅰ ~ Ⅳ)分级法;组织学类型:常见有细梁型、粗梁型、假腺管型和团片型等;特殊细胞类型:如透明细胞型、富脂型、梭形细胞型和未分化型等;肿瘤坏死(如肝动脉化疗栓塞治疗后)、淋巴细胞浸润及间质纤维化的范围和程度;生长方式:癌周浸润、包膜侵犯或突破、微血管侵犯和卫星结节等;慢性肝病评估:肝癌常伴随不同程度的慢性病毒性肝炎或肝硬化,推荐采用较为简便的Scheuer 评分系统和中国慢性病毒性肝炎组织学分级和分期标准[2,3]。
f. 微血管侵犯(microvascular invasion,MVI),是指在显微镜下于内皮细胞衬覆的脉管腔内见到癌细胞巢团,以门静脉分支为主(含包膜内血管)[4](1A 类);病理分级方法:M0:未发现MVI;M1(低危组):≤ 5 个MVI,且发生于近癌旁肝组织;M2(高危组):> 5 个MVI,或MVI 发生于远癌旁肝组织[5]。MVI 是评估肝癌复发风险和选择治疗方案的重要参考依据,应作为常规病理检查指标[6-8](2A 类)。
g. 需要合理地组合应用免疫组化标志物,必要时检测基因组学相关指标,对原发性肝癌与转移性肝癌,HCC 与ICC 等进行鉴别诊断[2,5]。
1.3 HCC 的临床诊断


【注释】
a. 在慢性肝病背景下,对于肝内实性病灶的定性,推荐采用MRI 肝胆特异性对比剂(如Gd-EOB-DTPA,钆塞酸二钠注射液) 增强扫描,增加小病灶甚至小癌栓的检出率,且鉴别治疗后坏死灶、出血灶、再生结节以及HCC 复发,是目前国际上公认的准确的影像学检查方法[1-3]。
b. 动态增强MRI/ 动态增强CT/ Gd-EOB-DTPA 增强MRI(EOB-MRI)/ 超声造影(CEUS),四种影像学检查中,至少有2 项显示有动脉期病灶明显强化、门脉或延迟期强化下降的“快进快出”的肝癌典型特征,则可做出肝癌的临床诊断。
c. 四种影像学检查中,如果无或者只有1 项检查有典型的肝癌特征,可每2~3 个月密切的影像学随访。若肝脏结节保持不变,继续密切随访;若结节增大,应按病灶大小,根据诊断流程进行相应的检查。
d. 四种影像学检查中,无或只有一项检查有典型的肝癌特征,可进行肝穿刺活检;若活检仍无法明确诊断,密切的影像学随访,每2~3 个月1 次。
e. 四种影像学检查中只要有1 项有典型的肝癌特征,即可临床诊断为肝癌。
f. 四种影像学检查中无典型的肝癌特征,则需进行肝穿刺活检以确立诊断。若进行活检仍无法明确诊断,密切的影像学随访,每2~3 个月1 次。
g. 四种影像学检查中,只要有1 项有典型的肝癌特征,即可临床诊断为肝癌。
h. 四种影像学检查中,如果无典型的肝癌特征,可密切的AFP+ 影像学随访,每2~3 个月1 次。如果随访过程中出现肝脏结节,按结节大小,根据诊断流程进行相应检查,必要时可行肝穿刺活检。
2 HCC 的分期
我国学者主要根据肝脏肿瘤的数目、大小、血管侵犯、肝外转移、Child-Pugh 分级* 以及体力状况(PS)* 评分6 大因素判定肿瘤分期,包括Ⅰ a 期、Ⅰ b 期、Ⅱ a 期、Ⅱ b 期、Ⅲ a 期、Ⅲ b 期、Ⅳ期,适用于HCC[1,2]。
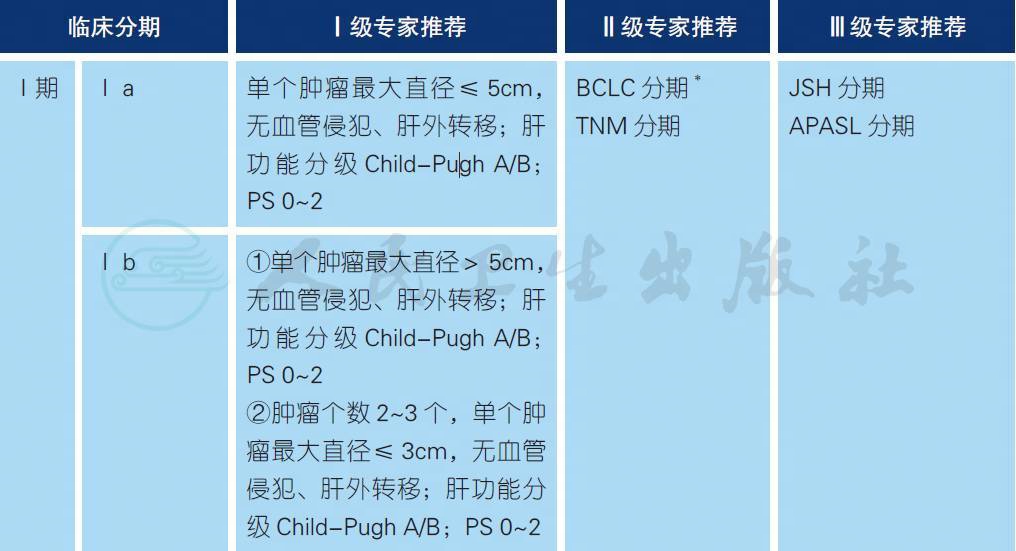
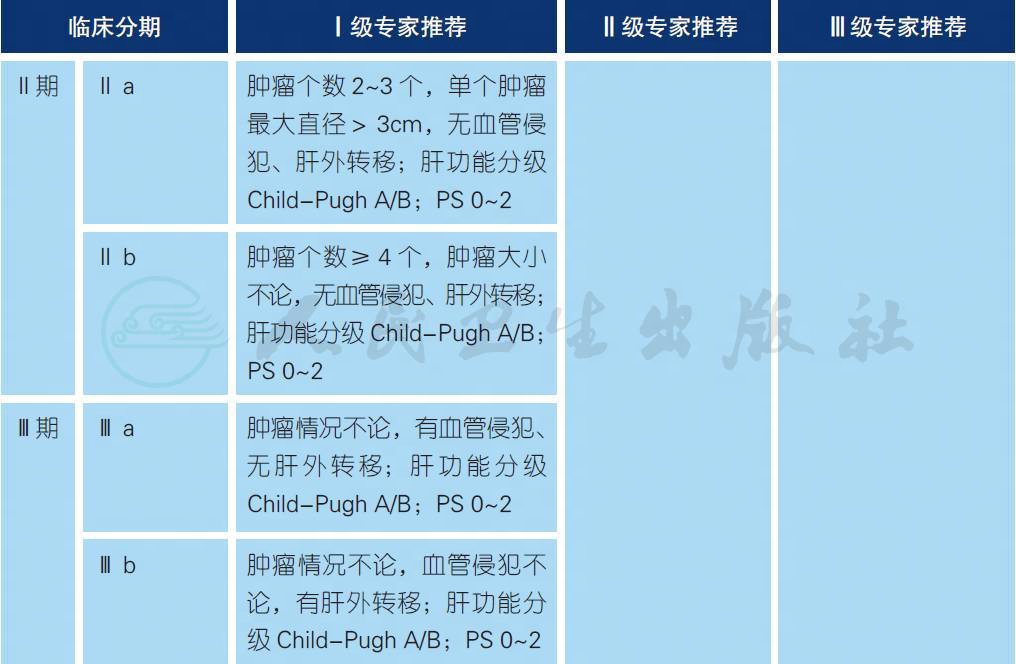

* 详见附录7
【注释】
肝癌的分期对于预后的评估、合理治疗方案的选择至关重要。影响肝癌患者预后的因素较多,包括肿瘤因素、患者一般情况及肝功能情况等。据此,国内、外有多种分期方案,包括巴塞罗那分期(BCLC)、TNM 分期、日本肝病学会(JSH) 分期以及亚太肝脏研究协会(APASL)分期等。本指南依据我国的具体国情、临床研究、实践经验以及国家规范,推荐采用上述肝癌的分期方案。
3 HCC 的MDT 模式a
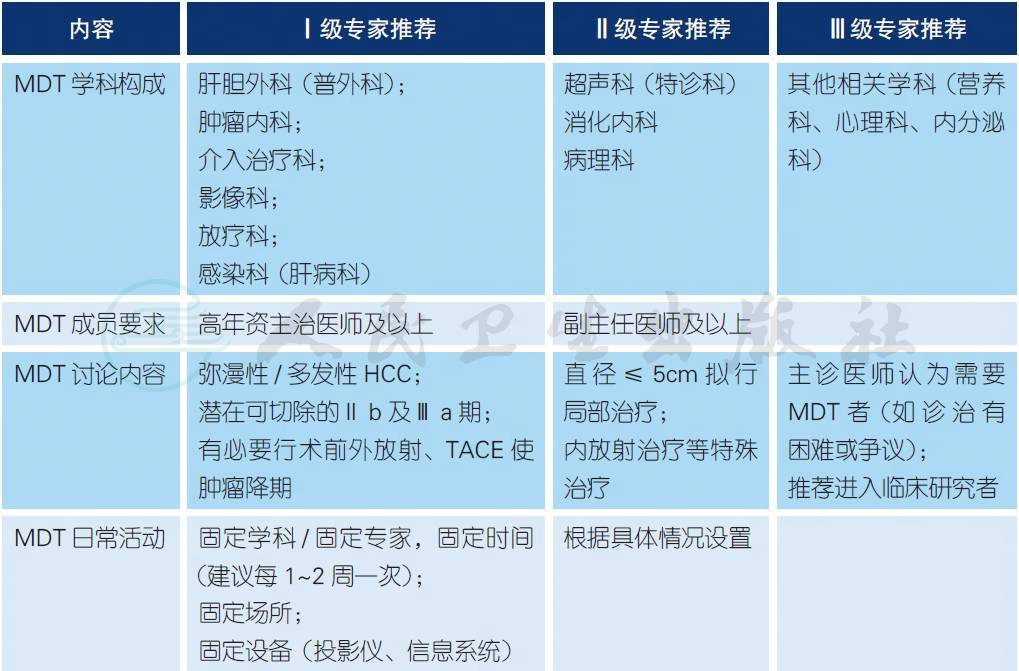
【注释】
a. HCC 治疗领域的特点是多个学科、多种方法共存,而现有的以治疗手段的分科诊疗体制与实现有序规范的治疗之间存在一定的矛盾[1-3]。因此,对于HCC 的诊疗,必须重视多学科诊疗团队(multidisciplinary team,MDT) 模式,避免单科治疗的局限性,为患者提供一站式全套医疗服务、促进学科间交流,并促进建立在多学科共识基础上的治疗原则和临床实践指南。对于合理治疗方法的选择需要有高级别的循证医学证据支持,但也需要同时考虑地区和经济水平的差异。
4 HCC 的局部治疗
4.1 肝切除术a,b,c,e,f

【注释】
a. 肝切除术的基本原则[1-4]
(1)彻底性:①单发肝癌,周围界限较清楚或有假包膜形成,受肿瘤破坏的肝体积<30%;或虽受肿瘤破坏的肝体积>30%,但无瘤侧肝脏有明显代偿性增大,>50%全肝体积。②多发性肿瘤,肿瘤结节数目<3 个,且局限于肝脏一段或一叶内。③影像学检查无肝段以上的脉管受侵犯。④无肝外转移性肿瘤,或仅有可切除的单个转移肿瘤。
(2)安全性:保留有足够功能肝组织(具有良好血供以及良好的血液和胆汁回流) 以便术后肝功能代偿,降低手术死亡率及手术并发症。
b. 术前全面评价
通常采用ECOG PS 评分来评估患者的全身情况;采用Child-Pugh 评分、吲哚氰绿(ICG) 清除试验或瞬时弹性成像测定肝脏硬度评价肝功能储备情况。如预期保留肝组织体积较小,则采用CT和/ 或MRI 测定剩余肝的体积,并计算剩余肝体积占标准化肝脏体积的百分比。一般认为Child-Pugh A 级、ICG15 < 20%~30% 是实施手术切除的必要条件[5];余肝体积须占标准肝体积的40% 以上(肝硬化患者),或30% 以上(无肝硬化患者),也是实施手术切除的必要条件。
c. 肝癌根治术后判断标准
①术后2 个月进行超声、CT 和/ 或MRI 扫描(必须有其中两项) 检查,未发现肿瘤病灶。
②如术前血清AFP 水平增高,则要求术后2 个月内行AFP 定量检测,其水平降至正常范围内(极少数患者AFP 降至正常的时间>2 个月)。
d. Ⅲ a/ Ⅲ b 可能切除的情况
①肿瘤数目> 3 枚,但是局限在同一段或同侧半肝者,或可同时行术中射频消融处理切除范围外的病灶;
②合并门静脉主干或分支癌栓者,若肿瘤局限于半肝,且预期术中癌栓可完整地切除或取净,可考虑手术切除肿瘤并经门静脉取栓,术后再结合TACE、门静脉化疗或其他全身治疗措施;
③如合并胆管癌栓且伴有梗阻性黄疸,肝内病灶亦可切除的患者;
④伴肝门部淋巴结转移者,切除肿瘤的同时行淋巴结清扫或术后治疗;
⑤周围脏器受侵犯,但是可以一并切除者。
e. 降期后二次手术切除的情况
对于不可切除肝癌,通过肝动脉结扎插管、TACE 以及外放射疗等治疗可能导致肿瘤降期,从
而使部分患者获得手术切除的机会,降期后切除的肝癌患者也可能获得较好的长期生存效果[6]。经门静脉栓塞(portal vein thrombosis,PVE)或门静脉结扎(portal vein ligation,PVL)主瘤所在的半肝,使余肝代偿性增大后再切除。临床报告其并发症不多,但是需要4~6 周时间,等待对侧肝组织体积增大,为了减少等待期间肿瘤进展的风险,可考虑与TACE 治疗联合[7]。联合肝脏分隔和门静脉结扎的二步肝切除术(associating liver partition and portal vein ligation for staged hepatectomy,ALPPS) 是近年发展的新技术[8],适合于预期残余肝脏体积占标准肝体积不足30%~40% 的患者,经过Ⅰ期的肝脏分隔或离断和患侧门静脉分支结扎后,健侧剩余肝脏体积(future liver reserve,FLR) 一般在1~2 周后增生30%~70%以上,FLR 占标准肝脏体积至少30% 以上,可接受安全的Ⅱ期切除。术前评估非常重要,需要考虑肝硬化的程度、患者年龄、短期承受两次手术的能力和肿瘤快速进展等风险[9]。此外,可借助腹腔镜技术或消融技术等降低二次手术的创伤[10];对于开腹后探查发现肝硬化较重、肿瘤位置深在和多结节的肿瘤,术中消融治疗可降低手术风险;解剖性切除与非解剖性切除均为常用的手术技术。对于巨大肿瘤,可采用不游离肝周韧带的前径路
肝切除法[11]。
对于多发性肿瘤,可采用手术切除结合术中消融(如术中射频等)方式治疗,切除肝脏边缘肿瘤,消融深部肿瘤。对于门静脉癌栓者,行门静脉取栓术时应暂时阻断健侧门静脉血流,防止癌栓播散[12]。对于肝静脉癌栓或腔静脉癌栓者,可行全肝血流阻断,尽可能整块去除癌栓[13]。合并右心房癌栓者,可开胸切开右心房取出癌栓,同时切除肝肿瘤。合并腔静脉或右心房癌栓时手术风险较大,应慎重选择。
对于肝癌伴胆管癌栓者,在去除癌栓的同时,若肿瘤已部分侵犯胆管壁,则应同时切除受累胆管并重建胆道,以降低局部复发率[14]。对于可切除肝癌,术前TACE 并不能改善患者生存[15,16]。
f. 对于术中探查不适宜切除的患者
可以考虑术中肝动脉结扎(已少用,有时用于肝癌破裂出血时的手术止血) 和/ 或肝动脉、门静脉插管化疗或术中其他的局部治疗措施等。
4.2 肝切除术后辅助治疗策略a
【注释】
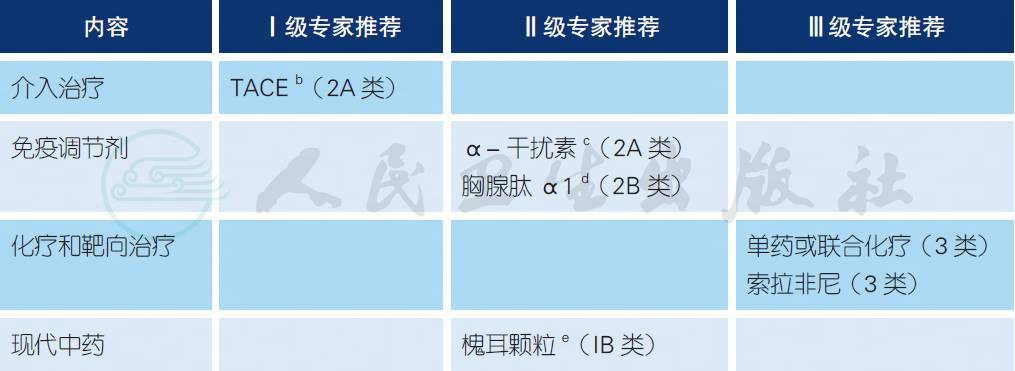
a. 临床上将根治性切除术后肝内再次出现的肝癌统称为“复发”,降低肝癌术后的复发率是提高肝癌整体疗效的关键。临床资料表明,肝癌术后5 年复发率为60%~70%,甚至更高,最早的可在术后2 个月复发,复发高峰在术后1~2 年,是阻碍肝癌患者获得长期生存的重要原因,但是目前肝癌术后尚无公认的辅助治疗方案,需要研究建立全面、准确的抗复发综合治疗措施。对伴有复发高危因素患者,可以酌情选择以下治疗,包括TACE、抗病毒治疗、胸腺肽α1 或α-干扰素的免疫调理治疗以及索拉非尼治疗,还可考虑选择单药或联合化疗等[1-12]。
b. 多项国际、国内研究表明,对有残余病灶和早期复发风险、多结节、肿瘤直径>5 cm 以及有血管侵犯的HCC 患者,切除术后在规范化抗病毒、保肝的基础上进行TACE 辅助治疗,可以降低术后复发率,具有生存获益[2-6,10]。
c. 由于我国的肝癌患者多数存在明确的HBV 或者少数有HCV 感染背景,术后复发也与病毒的持续感染有关,而α- 干扰素对HBV 和HCV 以及肿瘤细胞均具有抑制作用,因此,在肝癌抗复发治疗中可能具有一定的意义。已有若干研究表明:HBV/HCV 相关性肝细胞癌切除术后,采用α- 干扰素辅助治疗具有提高长期生存率的趋向,尤其是对于pTNM Ⅲ / Ⅳ A 期患者,但尚需大规模的随机对照、多中心的临床试验证实,并且针对不同分期的患者进行分层研究[7-9]。
d. 多项研究[10-12]业已提示,胸腺肽α1 用于防治HCC 切除术后的复发转移,具有一定的有益作用。
e. 随机对照、全国多中心临床试验[13]表明,HCC 切除术后服用槐耳颗粒,可使复发风险降低26%。
4.3 肝移植术a,b

【注释】
a. 国内、外各家肝移植适应证的标准对于无大血管侵犯、淋巴结转移及肝外转移的要求基本一致,但是对于肿瘤大小和数目的要求却不尽相同。国内标准(包括上海复旦标准、杭州标准、华西标准和三亚共识等) 均不同程度地扩大了肝癌肝移植的适用范围,可能使更多的肝癌患者因肝移植手术受益,且并未明显降低术后总体生存率和无瘤生存率,但是需要高级别的循证医学证据充分支持。
b. 肝癌肝移植术后肿瘤复发明显减低了移植后生存率,其危险因素包括肿瘤分期、血管侵犯、血清AFP 水平以及免疫抑制剂累积用药剂量等。减少移植后早期钙调磷酸酶抑制剂的用量,可能降低肿瘤复发率[1](2A 类)。肝癌肝移植采用mTOR 抑制剂的免疫抑制方案亦可能预防肿瘤复发,提高生存率[2,3](2A 类),但是需要随机对照、多中心的临床研究进行确证。
c. 在等待肝移植期间,患者的肿瘤可能发生进展,导致失去手术机会,或使得术后预后变差。因此,在恰当的时间进行局部桥接治疗,有助于降低肿瘤分期,提高预后。常用的局部桥接治疗有射频消融(RFA) 和TACE 等。一项纳入了3601 例患者的多中心临床研究表明,符合米兰标准且在等待肝移植期间行局部区域桥接治疗,除非治疗后获得了病理学完全缓解(pCR),否则局部区域桥接治疗并不能改善移植术后存活率及肿瘤复发率[4]。但是,Lee 等[5]对肝移植术前行RFA 治疗对移植术后结局的影响进行了长达10 年的随访,发现术后5 年和10 年受体存活率分别为75.8% 和42.2%,相应的无瘤存活率分别为71.1% 和39.6%,提示RFA 应用于肝癌患者行肝移植术前治疗可提高移植术后的疗效。
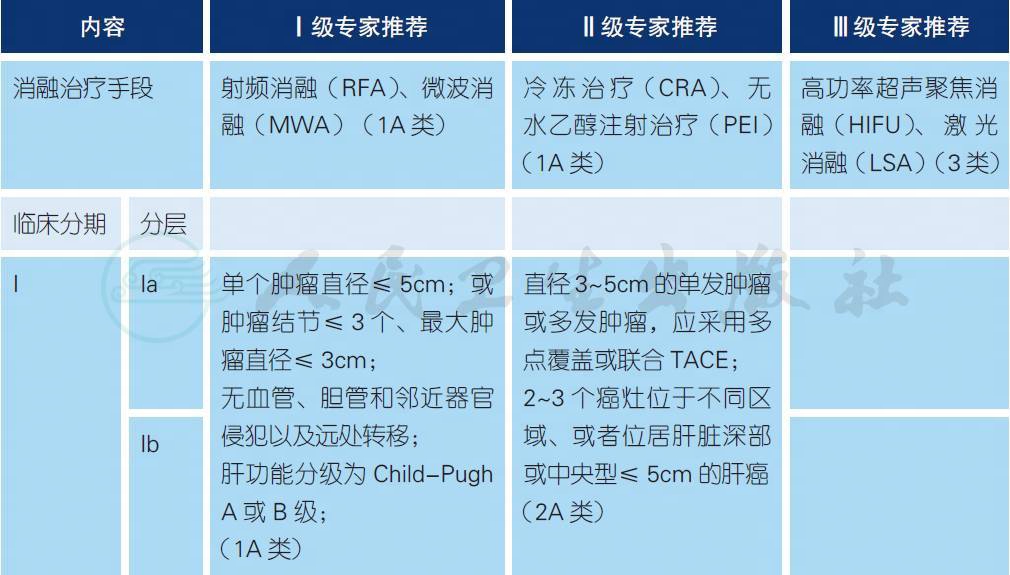
4.4 局部消融治疗a-e
【注释】
a. 操作医师必须经过严格培训和积累足够的实践经验,治疗前应全面而充分地评估患者的全身状况、肝功能状态和肿瘤情况(位置、大小、数目等)。
b. 对于直径≤ 5cm 病灶的治疗,通常将手术切除作为首选[1,6],而局部消融作为另一种重要选择。对于2~3 个癌灶位于不同区域、或者位居肝脏深部或中央型≤ 3cm 的肝癌,局部消融能够达到手术切除的疗效,可以作为一线治疗[1-3]。
c. 不推荐对> 5cm 的病灶单纯实施消融治疗。有研究[4-5]表明,对于多个病灶或更大的肿瘤,根据患者肝功能状况,可以采取TACE+ 消融联合治疗,效果优于单纯的消融治疗。
d. 微波消融(MWA) 是我国常用的热消融方法,在局部疗效、并发症发生率以及远期生存方面与RFA 相比都无显著差异[7](证据等级1);其特点是消融效率高,避免RFA 所存在的“热沉效应”。MWA 技术已有显著进步,能够一次性灭活肿瘤;对于血供丰富的肿瘤,可先凝固阻断肿瘤主要滋养血管,再灭活肿瘤,可以提高疗效。建立温度监控系统可以调控有效热场范围,保证凝固效果。对于MWA 和RFA,可根据肿瘤的位置、大小,选择更适宜的消融方式[8,9]。与MWA 和RFA 相比,HIFU 和LSA 的完全消融率欠佳。
e. 消融治疗后评估局部疗效的规范方法[10]是在术后1 个月左右,复查肝脏动态增强CT/MRI,或者进行超声造影。完全消融后应定期随访,通常情况下每隔2~3 个月复查,以便及时发现可能的局部复发病灶和肝内新发病灶。首次评价有肿瘤残留者,可以进行再次消融治疗;若2 次消融后仍有肿瘤残留,应视为消融治疗失败,宜改用其他疗法。疗效评价:完全消融(complete response,CR):经动态增强CT 或MRI 扫描,或者超声造影随访,肿瘤所在区域为低密度(超声表现为高回声),动脉期未见强化;不完全消融(in-complete response,ICR):经动态增强CT 或MRI 扫描,或者超声造影随访,肿瘤病灶内局部动脉期有强化,提示有肿瘤残留。
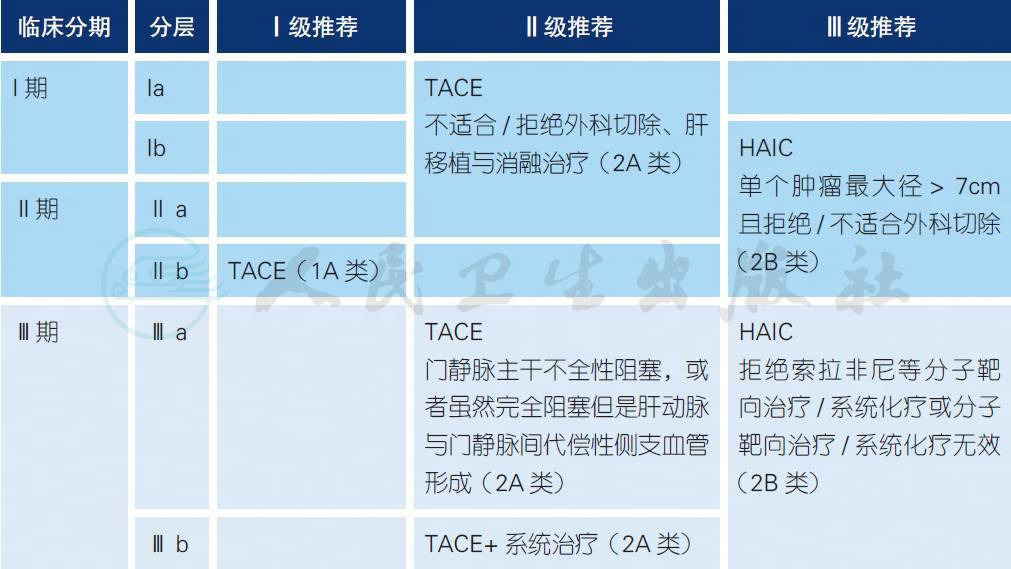
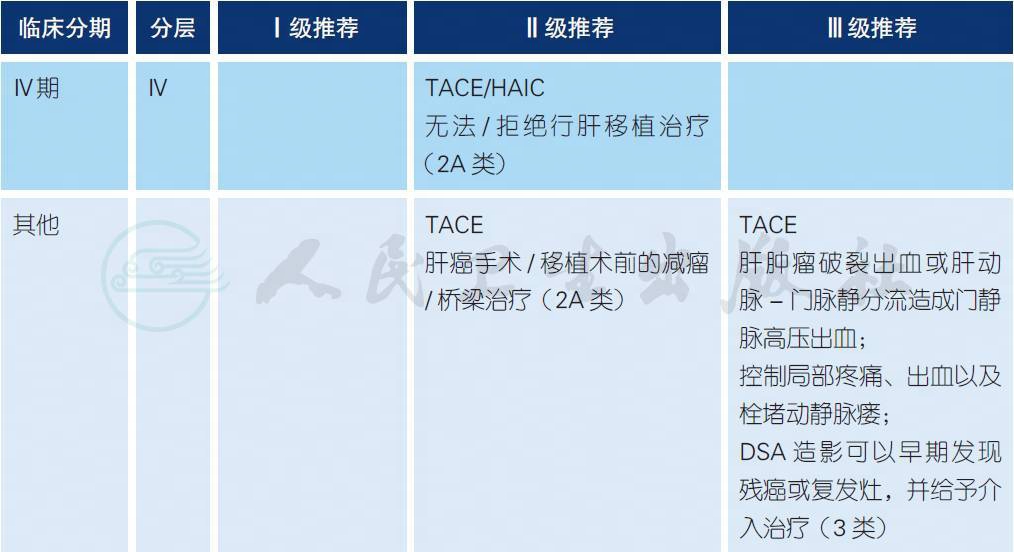
4.5 肝动脉介入治疗a-g
【注释】
a. 经肝动脉介入治疗主要包括肝动脉栓塞化疗(transarterial chemoembolization ,TACE)和肝动脉灌注化疗(hepatic arterial infusion chemotherapy,HAIC)。TACE 是公认的肝癌非手术治疗中最常用的方法之一[4-6,8,15,16];HAIC 亦已有多项临床研究证明有效[3,9-12]。
b. 操作程序要点和分类[17]
(1) 肝动脉造影:通常采用Seldinger 方法,经皮穿刺股动脉插管,导管置于腹腔干或肝总动脉行DSA 造影,造影图像采集应包括动脉期、实质期及静脉期;应行肠系膜上动脉造影,注意寻找侧枝供血。仔细分析造影表现,明确肿瘤的部位、大小、数目以及供血动脉。
(2) 根据肝动脉插管化疗、栓塞操作和材料的不同,通常分为[18]:① HAIC:经肿瘤供血动脉灌注化疗药物,常用药物有铂类、抗代谢药等;②肝动脉栓塞(TAE):单纯用栓塞剂堵塞肝肿瘤的供血动脉;③ TACE:把化疗药物与栓塞剂混合在一起或使用药物洗脱微球(drug-eluting beads,DEB),经肿瘤的供血动脉支注入。④肝动脉放疗栓塞(TARE):将钇-90 放射性微球,经肿瘤的供血动脉支注入。
(3)TACE 治疗时常用的栓塞剂包括标准化明胶海绵颗粒、聚乙烯醇颗粒、微球和DEB 等。我国医师常规采用碘油乳剂和标准化明胶海绵颗粒,碘油用量一般为5~20ml,不超过30ml。在透视监视下依据肿瘤区碘油沉积是否浓密和瘤周是否已出现门静脉小分支影为界限。在碘油乳剂栓塞后加用颗粒性栓塞剂(如:标准化明胶海绵颗粒、微球、聚乙烯醇颗粒等)。提倡使用超液化乙碘油与化疗药物充分混合成的乳剂[19],尽量避免栓塞剂返流栓塞正常肝组织或进入非靶器官。国外医师认为用碘油乳剂作为栓塞剂效果不理想,多主张采用微球或者DEB,近年来我国临床上也越来越多地应用后者。栓塞时应尽量栓塞肿瘤的所有供养血管,以尽量使肿瘤去血管化,提高疗效。
c. 肝动脉介入治疗常见不良反应[9,10,20-23]:TACE 术后以栓塞后综合症最常见,主要表现为发热、疼痛、恶心和呕吐等。此外,还有穿刺部位出血、白细胞下降、一过性肝功能异常、肾功能损害以及排尿困难等其他常见不良反应。HAIC 术后以化疗相关不良反应为常见,如骨髓抑制、凝血功能异常、肝功能异常、消化道反应等。介入治疗术后的不良反应会持续5~7 天,经对症治疗后大多数患者可以完全恢复。
d. 疗效评价[24]
(1) 技术成功标准:导管超选择地插至肿瘤供血动脉内,化疗栓塞后肿瘤供养血管被封闭,肿瘤染色明显减少或消失。
(2) 介入治疗的近期疗效可以参考实体瘤RECIST1.1 版、mRECIST 标准以及EASL 标准[25-27]等综合评估;评价指标为肿瘤的客观应答(objective response,ORR)和至疾病进展时间(time to progression,TTP)。长期疗效指标为患者总生存期(overall survival,OS)。
e. 影响远期疗效的主要因素[1,2,15]:① 肝硬化程度、肝功能状态;②血清AFP 水平;③肿瘤的容积和负荷量;④肿瘤包膜是否完整;⑤门静脉有无癌栓;⑥肿瘤血供情况;⑦肿瘤的病理类型。
f. 随访及间隔期间治疗:建议第一次TACE 治疗后3~6 周时复查CT 和/ 或MRI、肿瘤相关标志物、肝肾功能和血常规等。若影像学检查显示肝脏的瘤灶内碘油沉积浓密、瘤组织坏死明显并且无增大和无新病灶,暂时可不考虑再次TACE 治疗。至于后续TACE 治疗的频率应依随访结
果而定,主要包括患者对上一次治疗的反应(有效性和安全性)、肝功能和体能状况的变化。随
访时间可间隔1~3 个月或更长时间。若出现无法治疗的进展,则停止TACE 治疗[28]。目前主张TACE 联合其他治疗方法,目的是控制肿瘤、提高患者生活质量和延长带瘤生存时间。
g. 治疗时注意点
(1) 提倡用微导管超选择性插管;插入肿瘤的供血动脉支,精准地注入化疗药物、碘油乳剂和
颗粒性栓塞剂,提高疗效和保护肝功能[29]。
(2) 可使用门静脉内支架置放术和125I 粒子条或125I 粒子门静脉支架置入术,有效处理门静脉主干癌栓[30]。
(3)TACE 联合消融治疗:目前常用两种TACE 联合热消融治疗方式。①序贯消融:先行TACE治疗,术后1~4 周内加用射频或微波消融。②同步消融:在TACE 治疗时,同时给予射频或微波消融,可以提高临床疗效,并减轻肝功能损伤[31]。
(4) 重视局部加局部治疗和局部联合全身治疗[15]:① TACE 联合消融(RFA、MWA 等)治疗[31];② TACE 联合放射治疗[32,33]:主要用于门静脉主干癌栓、下腔静脉癌栓和局限性大肝癌介入治疗后的治疗;③ TACE 联合Ⅱ期外科手术切除:大肝癌或巨块型肝癌在TACE 治疗后缩小并获得手术机会时,推荐外科手术切除[13,14];④ TACE 联合全身治疗[34-38]:包括联合分子靶向药物、三氧化二砷、放射免疫靶向药物、基因治疗、免疫治疗及全身化疗等。
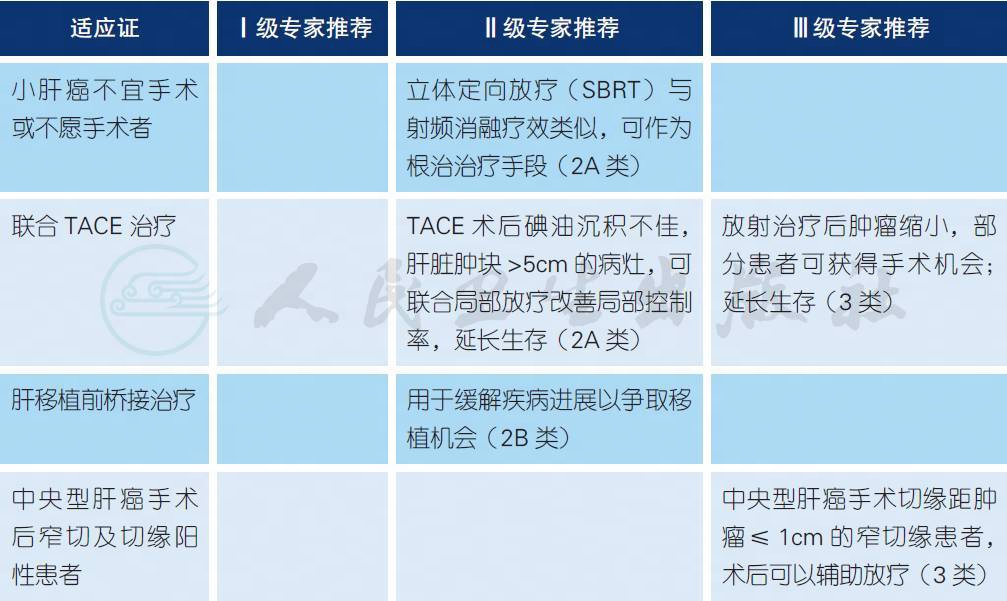
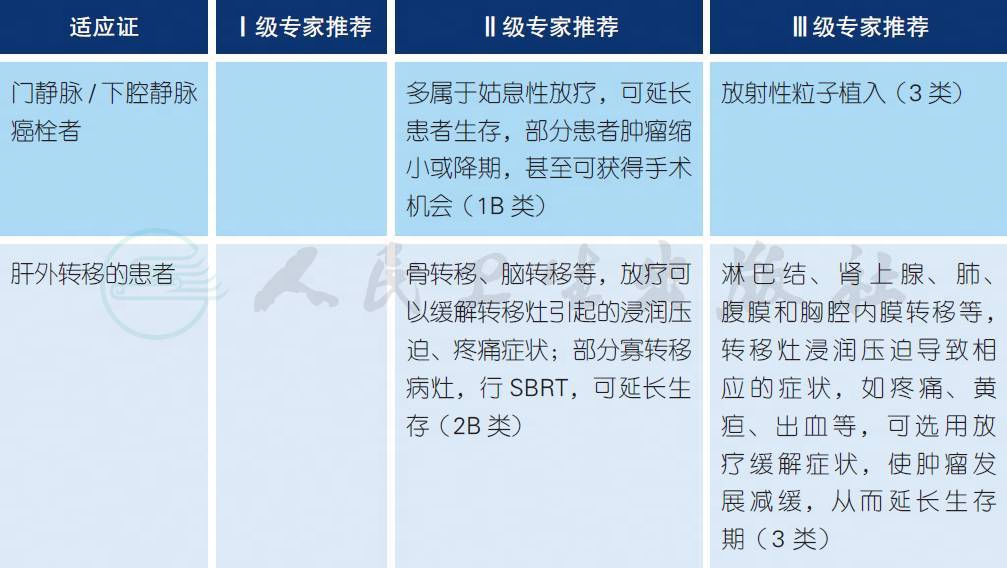
4.6 放射治疗a-e
【注释】
a. 放疗目的与技术
肝癌的放疗,主要是立体定向放疗(stereotactic body radiation therapy,SBRT) 对于小肝癌可以作为根治性治疗手段[1-3,6];而对于中晚期肝癌,大多属于姑息性治疗手段。姑息性放疗的目的是缓解症状、减轻痛苦和延长生存期等[7-10]。对局限于肝内的大的肝癌病灶,有少数可以通过SBRT转化为可手术切除,从而可能获得根治[4,5]。
肝癌的常用放疗技术,包括三维适形放疗(3D-conformal radiotherapy,3D-CRT)、调强放疗(intensity modulated radiation therapy,IMRT)、图像引导放疗(image guided radiation therapy,IGRT)和SBRT。IGRT 放疗技术优于三维适形放疗[11],螺旋断层放疗设备作为图像引导下的调强放疗,适合多发病灶的肝癌患者。肝癌的SBRT 治疗必须满足以下条件:有四维CT 的影像设备引导或肿瘤追踪系统,非常精确的患者体位固定,放射治疗前的个体化图像校正,放射治疗设备能聚焦到肿瘤以及肿瘤之外的射线梯度下降快。目前尚缺乏高级别的临床循证医学证据充分支持采用质子加速器放疗肝癌患者的生存获益更优[2]。
呼吸运动是导致肝肿瘤在放疗过程中运动和形变的主要原因[2]。应该采取多种技术减少呼吸运动带来的影响,如门控技术、实时追踪技术、呼吸控制技术以及根据四维CT 确定内靶区(internal target volume,ITV) 等。腹部加压简单易行,压腹部位在剑突与脐连线上半部,可以最大程度减小肝脏呼吸动度。
b. 外放射治疗照射靶区
宜在多种影像学资料互相参考下,确定靶区:
大体肿瘤体积(gross tumor volume,GTV),在增强CT 中定义,参考动脉相与静脉相表现;而MRI 显示肝内病灶较清楚,必要时也需参考;PET/CT 扫描有助于了解肝外病灶情况。
临床靶体积(clinical target volume,CTV),由GTV(影像可见病灶,如肝内原发灶、血管癌栓、淋巴结/ 骨/ 肾上腺/ 脑等部位转移灶) 外扩2~4mm[12];由于HCC 出现淋巴引流区转移较少见,CTV 一般不包括淋巴引流区,但对于已经出现淋巴结转移的,建议CTV 包括其下一站的淋巴引流区。
计划靶体积(planning target volume,PTV),在常规放疗技术情况下,一般在CTV 基础上外放5~15 mm;肝内原发灶、肾上腺/ 肺转移灶等必须考虑肿瘤移动度(ITV),ITV 大小可通过透视评估,4D 模拟CT 技术更为准确。肝癌放疗野设计的一个重要原则是要充分利用和保护“正常”肝组织所具有的强大再生能力,在设计放射野时,尤其是大肝癌,最好能保留一部分正常肝不受照射,使得部分正常肝组织能获得再生。
c. 放疗剂量及危及器官(organs at risk,OAR) 限量
肿瘤放疗剂量:
(1)SBRT 放疗时,一般推荐≥ 30~60 Gy/3~6 次[13]。
(2) 常规分割剂量放疗时,大部分的报道为50~70Gy,其基本上取决于全肝和/ 或周围胃肠道
的耐受量。非SBRT 的低大分割外放疗,可利用LQ 模式将其放疗剂量换算为BED,有乙肝感染患者的肝细胞α/β 比值取8Gy,肿瘤细胞α/β 比值取12~15Gy,作为剂量换算参考[9]。
OARs 剂量限量:
(1)SBRT 放疗:
① 正常肝(liver-GTV) 剂量限量:肝功能Child-Pugh A 级,正常肝体积超过700ml,放疗分次数为3~5 次,liver-GTV 平均剂量< 15Gy;而当正常肝体积> 800ml,放疗分次数为3~5 次,liver-GTV 平均剂量< 18Gy;放疗分次数为6 次,liver-GTV 平均剂量< 20Gy[14,15]。
② 胃和小肠:亚洲HCC 患者常伴有肝硬化和脾功能亢进导致的胃肠道瘀血和凝血功能差,胃肠道放射耐受剂量低于RTOG 推荐的剂量。有文献认为,放疗分次数为3~5 次,胃和小肠最大剂量均应< 22.2~35Gy,最佳< 30Gy[16]。
③ 肾脏与脊髓:放疗分次数为3~5 次,双肾Dmean 最佳小于10Gy,脊髓(部分脊髓平面受照射)Dmax < 21.9~30Gy,最佳< 18~23Gy[16]或< 20Gy[14]。
(2) 常规分割放疗:
① 正常肝(liver-GTV) 剂量限量:肝功能Child-Pugh A 级,liver-GTV 平均剂量限量为28~30 Gy,V30 ≤ 60%;非常规大分割放疗(每次分割剂量4~8 Gy),liver-GTV 平均剂量限量为23 Gy;肝功能为Child-Pugh B 级,肝脏对射线的耐受量明显下降,正常肝平均剂量最好< 6 Gy,应该避免对Child-Pugh C 级患者进行肝区放疗[9,15]。
② 胃和小肠:最大剂量均< 54Gy,胃V45 < 45%,小肠V50 ≤ 5%(RTOG-0418),V15 ≤ 120ml[14]。
③ 肾脏和脊髓:双肾Dmean ≤ 15Gy 且V20 ≤ 33%,如一侧肾脏平均剂量大于19Gy,则另一侧肾脏尽量避开;脊髓Dmax ﹤ 45Gy(RTOG-0623)。
d. 放射性肝病、放疗合并用药与随访注意点
放射性肝病(radiation-induced liver diseases,RILDs):对肝内肿瘤进行放疗,可能诱发不同程度的放射性肝损伤。RILD 是肝脏放疗的剂量限制性并发症,分典型性和非典型性两种:①典型RILD:碱性磷酸酶(AKP) 升高> 2 倍、无黄疸性腹水、肝肿大。②非典型RILD:转氨酶超过正常最高值或治疗前水平的5 倍。诊断RILD 时,必须注意排除肿瘤进展、病毒性或药物性肝炎所致的临床症状和肝功能损害[9]。
虽然索拉非尼可以延长晚期HCC 患者的生存期,但是已有Ⅱ期临床研究显示,索拉非尼联合外
放疗的客观疗效并未提高,而不良反应却增加,因此肝内病灶放疗时必须谨慎联合使用索拉非尼[17]。另外,为了防止放疗后乙肝病毒复制活跃,对于HBV-DNA 阳性的肝癌患者,建议放疗时注意抗病毒和保肝治疗。
放疗后随访:需观察受照射肝肿瘤的局部控制情况和正常组织不良反应等。HCC 放疗疗效,常以RECIST1.1、mRECIST 或EASL 标准等综合评价[2];放疗结束时肿瘤多为SD,肿瘤明显缩小约出现于放疗结束后3~9 个月。RILD 的CT 表现多为边界清楚肝内低密度区,增强时门脉期或延迟期强化;该影像改变开始的中位时间为治疗后3 个月,高峰期为6 个月,9 个月后开始消失,随访时必须与局部复发相鉴别[9]。
e. 内放射治疗
放射性粒子植入是利用核素射线局部治疗肝癌的方法,包括90Y(钇-90) 微球疗法、131I 单克隆抗体(详见4.7 节)、放射性碘化油以及125I 粒子植入等。放射性粒子可持续产生γ 射线或β 射线,在肿瘤组织内或在受肿瘤侵犯的管腔(门静脉、下腔静脉或胆道) 内植入放射性粒子后,可以通过局部持续低剂量辐射,最大程度地杀伤肿瘤细胞[2]。
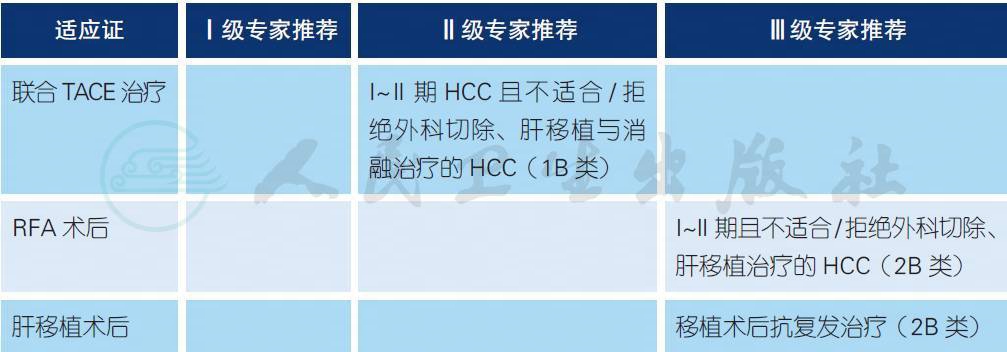
4.7 放射性核素免疫治疗(radioimmunotherapy,RAIT)a-d
【注释】
a. 131I- 美妥昔单抗注射液(利卡汀),以单克隆抗体为载体的放射性同位素免疫药物,特异性结合肝癌细胞表面HAbl8G/CDl47 抗原,封闭抗原引发的信号转导途径,发挥抑制HCC 复发、转移的作用,是具有自主知识产权的全球首个131I- 单抗靶向药物[1-4]。
b. TACE 联合灌注131I- 美妥昔单克隆抗体有助于放射性同位素靶向性聚集于瘤内,使肿瘤内呈高浓度而血浆中呈低浓度,实现了正常组织的辐射安全,延长了同位素在瘤内滞留时间,保证了射线吸收剂量的最大化,且化疗药物兼有放射增敏作用,提高了内照射疗效,从而实现了免疫治疗、放射治疗及介入治疗的三结合。Ⅱ期临床研究显示[5-11],TACE 联合131I- 美妥昔单克隆抗体治疗中晚期HCC 介入术后复发有一定疗效,临床应用安全可行。多中心Ⅳ期临床研究显示[12](利卡汀联合TACE 组167 例,TACE 组174 例),利卡汀的组织分布主要集中在肝脏;1年生存率显著提高(79.47% vs. 65.59%,HR=0.598,P=0.041),TTP 显著改善(6.82±1.28 个月vs. 4.7±1.14 个月,P=0.037);毒性方面,淋巴细胞减少、血小板减少和总胆红素升高较对照组发生率高,但SAE 没有差别。
c. 单中心随机对照研究显示[13],RFA 联合131I- 美妥昔单克隆抗体对比单独RFA,1 和2 年复发率分别为31.8% 和58.5% vs.56.3% 和70.9%,mTTP 为17 个月对比10 个月(P =0 .03)。
d. 肝癌肝移植后抗复发治疗的随机对照研究[14]显示,131I- 美妥昔单克隆抗体治疗组与对照组相比,一年复发率降低了30.4%,生存率提高了20.6%,AFP 阴性维持率达到87.82%。因此,在肝癌肝移植术后抗复发和转移方面的疗效得到了业内的认可,并写入《中国肝癌肝移植临床实践指南(2014 版)》[15]。
5 全身治疗a-m
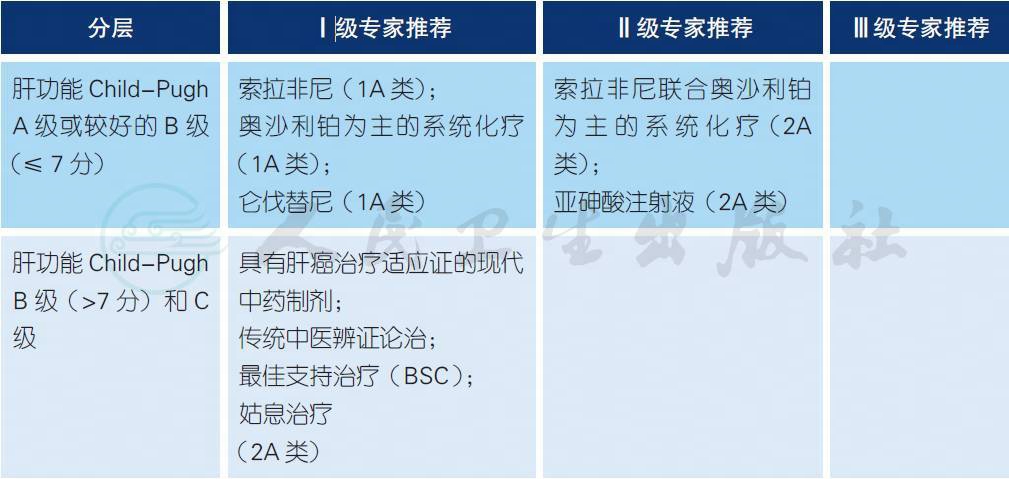
5.1 晚期HCC 一线治疗策略选择
5.2 晚期HCC 二线治疗策略选择
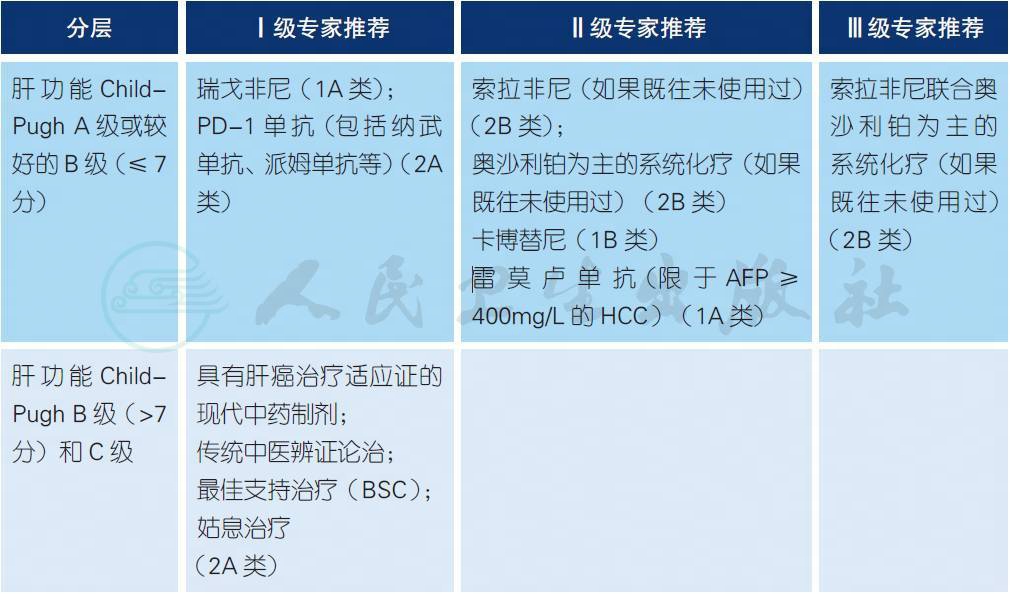
【注释】
a. 两项大型、随机对照的国际多中心临床试验SHARP 研究[1]和Oriental 研究[2]的结果均证明,索拉非尼能够延缓肿瘤进展,延长晚期HCC 患者的生存期。因此,2007 年以来,索拉非尼获得包括我国在内的全球180 多个国家/ 地区的药监部门批准,用于一线治疗无法手术或远处转移的HCC 患者,并且列入多国肝癌临床实践指南和推荐。
b. 一项开放、随机对照的国际多中心Ⅲ期临床研究(EACH 研究)[3,4],共纳入371 例不适于手术或局部治疗的晚期HCC 患者,其中中国患者占75%。结果表明:与单药阿霉素相比,FOLFOX 4 方案治疗显著延长了mPFS(1.77 个月vs. 2.93 个月,P ﹤ 0.001)、ORR(2.67% vs.8.15%,P=0.02) 和DCR(31.55% vs. 52.17%,P ﹤ 0.0001);进一步随访7 个月后的分析显示FOLFOX 4 组的mOS 续有获益(6.47 个月vs. 4.90 个月,P = 0.04)。主要的目标人群即中国患者群中,FOLFOX 4 组的mOS 显著延长(5.9 个月vs. 4.3 个月,P=0.0281),同时,mPFS、ORR和DCR 也继续显示出明显的优势。在毒性方面,FOLFOX 4 组的中性粒细胞减少和神经毒性发生率略高于对照组,但两组患者的3/4 级不良反应发生率并无明显差异。因此,2013 年3 月12日,CFDA 已正式批准含奥沙利铂的FOLFOX 4 方案用于治疗晚期肝癌的新适应证。2015 年起,美国NCCN 指南已经连续4 年收录推荐。
c. REFLECT 研究[5]是仑伐替尼(Lenvatinib) 与索拉非尼头对头比较的非劣效试验,入组不可切除的肝癌患者954 例,其中中国患者288 例。在主要终点OS 上,两组无明显差异;仑伐替尼的mPFS(7.4 个月vs. 3.7 个月)、mTTP(8.9 个月vs. 3.7 个月)和ORR(24% vs. 9%)均优于索拉非尼;其中中国患者亚群的仑伐替尼组OS 达到了优效,且延长了4.8 个月;同时,对于HBV 相关HCC,仑伐替尼具有生存获益优势;安全性方面,仑伐替尼与索拉非尼无明显差异。目前仑伐替尼一线治疗晚期HCC 适应证已获得日本PDMA 批准,在中国已列入CNDA 优先审批。
d. 含奥沙利铂的系统化疗联合索拉非尼已有多项Ⅱ期研究[6-9]报告,包括法国的GOTEXT 研究和香港- 新加坡肝癌协助组的多中心Ⅱ期研究等,可使ORR 有所提高,且TTP、PFS 和OS 都获得延长,且安全性良好。因此,提示含奥沙利铂的系统化疗与索拉非尼具有协同作用。对于肝功能和体力状态良好的患者,可以考虑联合治疗,但是尚需RCT 研究提供高级别证据。
e. 亚砷酸注射液是中药砒霜的主要成分,一项国内多中心临床研究[10]表明采用亚砷酸注射液治疗中晚期原发性肝癌具有一定的姑息治疗作用,可以改善患者生活质量、减轻癌痛和延长生存期。因此,2004 年获得国家药监局批准用于治疗晚期肝癌。临床应用时,应注意选择适当的患者,严密观察和积极防治不良反应,特别是肝、肾毒性,必须同时应用保肝、利胆和利尿药物。
f. 国家药监局已经批准若干种现代中药制剂[11-17],包括榄香烯、康莱特、华蟾素、消癌平、槐耳颗粒、肝复乐、金龙胶囊和艾迪注射液及其口服剂型等用于治疗肝癌。多年来,这些药物在临床上广泛应用,已经积累许多实践经验,具有一定的疗效和各自的特点,可以改善患者生活质量、减轻癌痛和延长生存期,患者的依从性、安全性和耐受性均较好。但是尚缺乏严格设计高质量、随机对照的、多中心临床试验资料。
g. 一项安慰剂对照、国际多中心Ⅲ期研究(RESORCE 研究)[18]结果显示:对于索拉非尼治疗失败后晚期HCC 患者,与安慰剂相比,瑞戈非尼(Regorafenib) 治疗提高TTP(3.2 vs.1.5 个月)、ORR(11% vs.4%) 和DCR(65% vs.36%),延长生存(10.6 个月 vs.7.8 个月),且在预设的各个亚组都观察到了一致的获益。瑞戈非尼不良反应与索拉非尼相类似,最常见的不良反应是高血压、手足皮肤反应、疲劳和腹泻。因此,欧美和我国药监局已批准瑞戈非尼二线治疗晚期HCC的适应证。
h. 免疫检查点抑制剂纳武单抗(Nivolumab,纳武利尤单抗) 是一种全人源化、抗PD-1 的IgG4 单克隆抗体[19]。CheckMate-040 研究是一项Ⅰ/Ⅱ期开放、多中心、单臂临床研究[20],共入组262 例晚期肝癌患者,分为剂量爬坡(48 例,0.1~10mg/kg) 和剂量扩展(214 例,3mg/kg) 两阶段,并根据是否接受过索拉非尼治疗进行分层。在所有的262 例患者中,按RECIST 1.1 标准评估ORR 是16.8%;索拉非尼未治的患者,mOS 达到了28.6 个月,而索拉非尼治疗失败后患者,mOS 在剂量爬坡队列和剂量扩展队列分别是15.0 和15.6 个月。该研究中,亚洲患者约占50%,其mOS 是14.9 个月。研究中还检测了肿瘤组织PD-L1 的表达,无论PD-L1 表达阳性或阴性,均观察到了肿瘤的缓解。在安全性方面,纳武单抗治疗晚期HCC 与其他肿瘤相似,未出现新的安全警示。因此,2017 年9 月,美国FDA 已批准纳武单抗二线治疗晚期HCC。2018 年6 月国家药监局已经批准纳武单抗在我国上市,用于治疗晚期非小细胞肺癌。
i. 免疫检查点抑制剂派姆单抗(Pembrolizumab,帕博利珠单抗)也是抗PD-1 人源化单克隆抗体。 KEYNOTE-224[21]是一项非随机、国际多中心、开放标签的Ⅱ期临床试验(NCT02702414)。 纳入标准为病理证实的HCC、索拉非尼治疗进展或毒性无法耐受、ECOG 评分0-1 分、脏器 功能正常、Child-Pugh 分级为A 级。受试者每3 周接受Pembrolizumab 200mg 静脉注射,共2 年或至PD、毒性无法耐受、患者撤回知情或研究者决定停药。主要研究终点为ORR,通过 RECIST 1.1 版本进行影像学评估。2016 年6 月7 日~2017 年2 月9 日,共有169 例晚期HCC 患者进入筛选,入组104 例接受治疗。104 例中,获得ORR 18 例(17%),包括CR 1 例(1%) 和PR 17 例(16%),SD 46 例(44%) 和PD 34 例(33%),另有6 例(6%) 为不可评估。至 2018 年2 月13 日,17 例(16%) 仍在接受派姆单抗治疗。104 例患者中76 例(73%) 出现治 疗相关AE,其中16 例(15%)SAE,25 例(24%)3 级AE。常见的是AST 升高(7 例,7%)、 ALT 升高(4 例,4%)、乏力(4 例,4%),仅有1 例(1%)出现4 级治疗相关的高胆红素血症, 1 例患者因治疗相关的溃疡性食管炎死亡,3 例(3%) 发生免疫相关的肝炎,无病毒复燃。研 究结论:派姆单抗对既往接受过索拉非尼治疗的晚期HCC 患者有效,耐受性好,提示可能是 这类患者的治疗选择之一。据此,厂家已向美国FDA 提出申请有条件批准派姆单抗二线治疗 晚期HCC 的适应证,且已获得优先审评。另外两项派姆单抗二线治疗HCC 随机对照的Ⅲ期临 床研究正在进行之中。
j. 卡博替尼(Cabozantinib) 是一种口服的多靶点、多激酶抑制剂,其作用靶点包括MET、VEGFR1-3、NTRK、RET、AXL 和KIT。CELESTIAL 研究[22](NCT01908426) 是一项随机、安慰剂对照的全球多中心Ⅲ期临床研究,纳入既往曾接受过索拉非尼治疗,在至少一线系统治疗后病情进展符合条件的HCC 患者。707 例患者以2∶1 的比例随机分配接受卡博替尼(60 mg,QD) 或安慰剂治疗。主要终点是OS,次要终点是PFS 和ORR;在第2 次计划的中期分析时研究达到了主要终点。卡博替尼组的mOS 明显延长( 10.2 个月 vs. 8.0 个月,P=0.005)。mPFS 分别为5.2 个月 vs.1.9 个月(P<0.001);ORR 分别为4%和< 1%(P=0.009)。对于仅接受索拉非尼治疗的患者,mOS(11.3 个月 vs. 7.2 个月)和mPFS(5.5 个月 vs.1.9 个月)的获益更为明显。卡博替尼组68% 的患者发生3 级或4 级不良事件,而安慰剂组为36%。常见的高级别事件是掌跖红肿(17% vs.0%)、高血压(16% vs. 2%)、AST 水平增加(12%vs.7%)、疲劳(10% vs. 4%) 和腹泻(10% vs. 2%)。因此,2018 年5 月卡博替尼已经获得美国FDA 批准用于二线治疗晚期HCC。
k. 雷莫芦单抗(Ramucirumab) 是一种抗VEGFR2 的完全人源化的IgG1 单克隆抗体,高度选择 性地抑制VEGFR2 的激活[23]。REACH-2 研究[24]是一项雷莫芦单抗对比安慰剂二线治疗索 拉非尼一线失败后AFP 升高的晚期HCC 患者的随机、双盲、安慰剂对照、全球Ⅲ期临床研 究,纳入索拉非尼治疗失败和基线AFP ≥ 400 ng/ml 的HCC 患者292 例,按照2∶1 的比例随 机接受雷莫芦单抗(8mg/kg) 或安慰剂。结果表明,与安慰剂比较,雷莫芦单抗显著改善了 AFP ≥ 400 ng/ml HCC 患者的mOS(8.5 个月vs. 7.3 个月,P=0.0199) 和mPFS(2.8 个月vs.1.6 个月,P<0.0001),降低了29% 的死亡风险;而ORR 分别为4.6% 和1.1%(P=0.1156)。患者 治疗耐受性良好,3 级及以上不良事件主要是高血压(12.2%)和低钠血症(5.6%)。REACH-2是肝癌领域第一个基于生物标记物选择患者人群的阳性临床研究,为基线AFP ≥ 400 ng/ml 的HCC 带来显著的OS 获益,并且安全性良好。
l. 由于迄今为止晚期HCC 的治疗效果仍然不尽如人意,应该鼓励患者积极参加新药临床试验。
m. 最佳支持治疗(best support care,BSC) 和姑息治疗(palative care,舒缓治疗) 包括对晚期肝癌患者的积极进行镇痛、纠正贫血、纠正低白蛋白血症、加强营养支持,控制合并糖尿病患者的血糖处理,防治腹水、黄疸、肝性脑病、消化道出血以及肝肾综合症等并发症。对于HBV或者HCV 相关HCC,应该积极进行抗病毒治疗,参见5.3 HCC 的抗病毒策略。
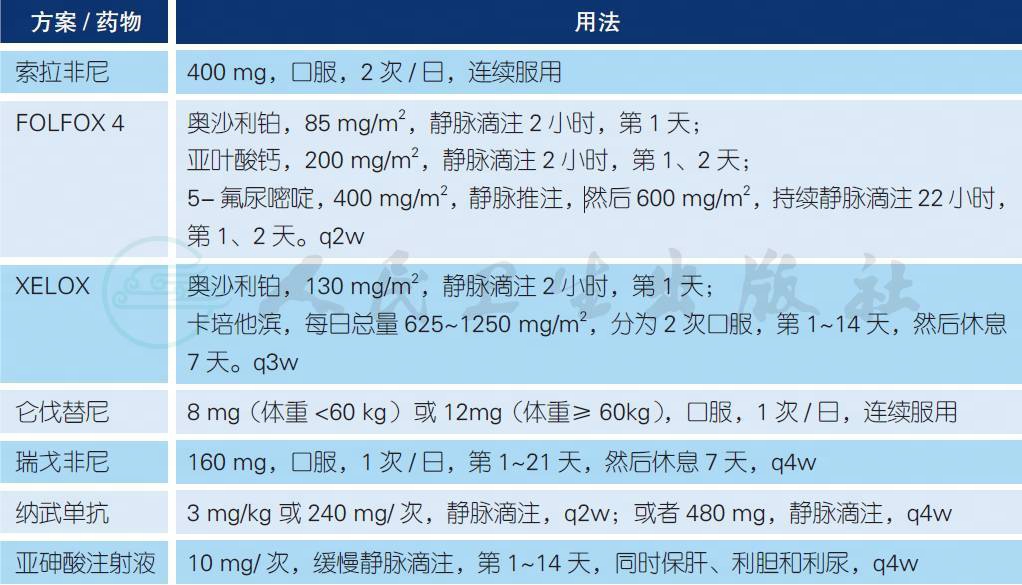
附 晚期HCC 系统治疗常用方案
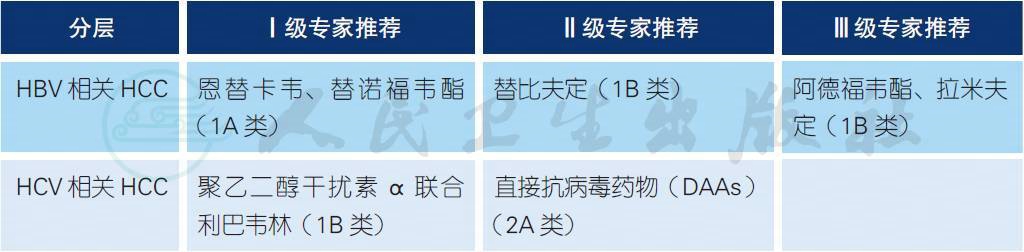
5.3 HCC 的抗病毒策略选择 a,b /sup>
5.4 HCC 的保肝利胆治疗策略选择c

6 随访和预后a,b
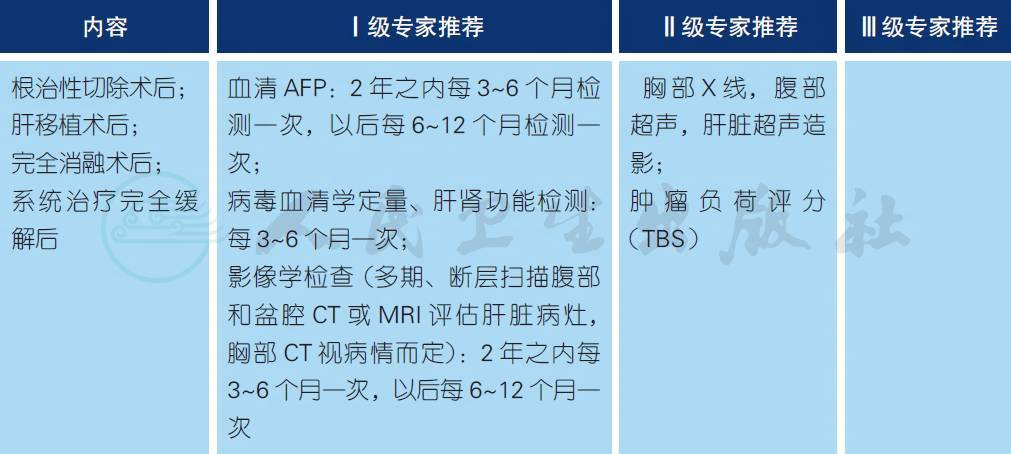
【注释】
a. HCC 手术切除后、肝移植术后、消融术后以及系统治疗完全缓解后的复发转移是临床备受关注的问题,故所有患者术后需要接受密切观察和随访[1]。一旦发现肿瘤复发,根据肿瘤复发的特征,可以选择再次手术切除、局部消融、TACE、放疗或系统治疗等,延长患者生存期。目前有关监测、随访作用的资料还很有限,但早期发现复发、转移可以让患者更及时的接受治疗,从而有可能改善预后。因此,仍然积极推荐术后进行定期监测和复查、随访。
b. 关于肿瘤负荷评分(tumor burden score,TBS)的研究表明,TBS 可很好地预测肝癌患者的生存。TBS 是指肿瘤的最大径以及肝脏肿瘤的数目两个变量,以肿瘤的最大径为X 轴,肿瘤数目为Y轴,应用勾股定理来计算,计算方法为:[TBS2=(肿瘤最大径)2+(肝脏肿瘤数目)2][2]。研究纳入2002 年1 月至2015 年3 月之间,从24 家单位前瞻性收集连续的参加ITA.LI.CA 研究的HCC 患者(n=4759)。对3909 例影像学证实血管侵犯或远处转移的人群进行了亚组分析。结果发现,与MC 和其他肿瘤特异性评分相比,TBS 表现了最佳的鉴别能力。多因素Cox 回归分析发现,TBS 是总生存的独立危险因素。TBS 每增加1 分,患者的死亡风险增加6%。研究认为,与其他连续的或二进制变量相比,TBS 模型具有最好的辨别能力和适用性。该模型包括肿瘤相关和肝功能相关的变量,进一步增加了其对生存预测的能力[3]。
7 附录
7.1 HCC 的巴塞罗那(Barcelona Clinic Liver Cancer,BCLC)分期
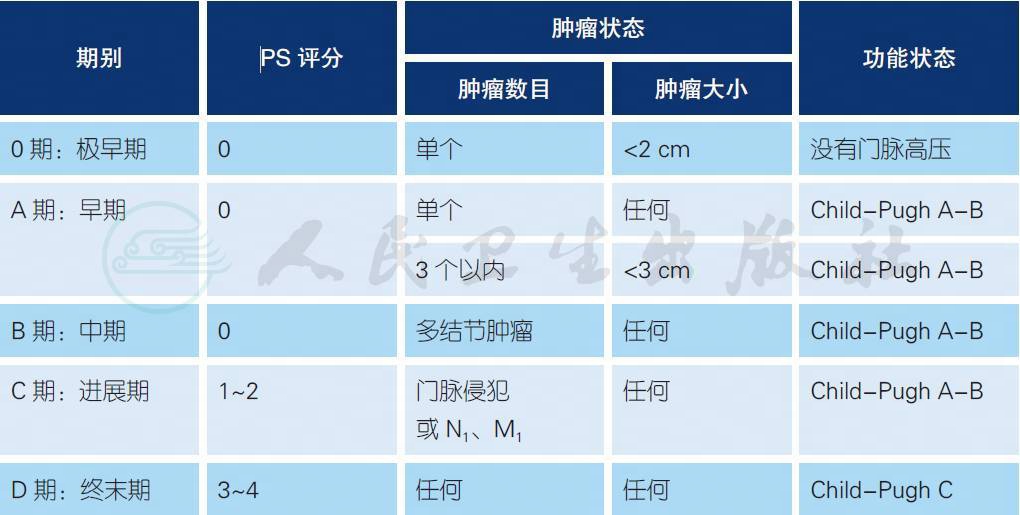
7.2 Child-Pugh 分级
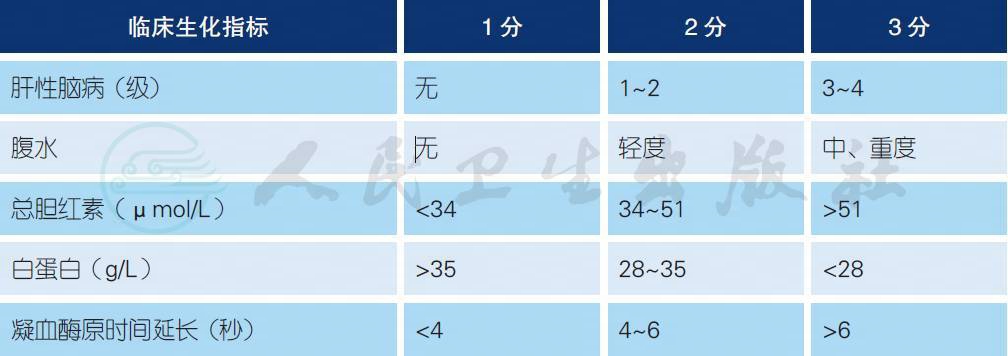
Child-Pugh 分级:A 级:5~6 分;B 级:7~9 分;C 级:≥ 10 分
7.3 ECOG PS 评分标准

1.1 HCC的筛查
1. Torre LA,Bray F,Siegel RL,et al. Global cancer statistics,2012. CA Cancer J Clin,2015;65:87-108.
2. Chen W,Zheng R,Baade PD,et al. Cancer statistics in China,2015. CA Cancer J Clin,2016;66:115-132.
3. Zhang BH,Yang BH,Tang ZY. Randomized controlled trial of screening for hepatocellular carcinoma.JCancer Res Clin Oncol,2004;130:417-422.
4. Galle PR,Forner A,Llovet JM,et al. EASL Clinical Practice Guidelines:Management of hepatocellularcarcinoma. J Hepatol(2018),https://doi.org/10.1016/j.jhep.2018.03.019
5. Zeng MS,Ye HY,Guo L,et al. Gd-EOB-DTPA-enhanced magnetic resonance imaging for focal liverlesions in Chinese patients:a multicenter,open-label,phase III study. Hepatobiliary Pancreat Dis Int,2013;12:607-616.
6. Lee YJ,Lee JM,Lee JS,et al. Hepatocellular carcinoma:diagnostic performance of multidetector CT and MR imaging-a systematic review and meta-analysis. Radiology,2015;275:97-109.
7. Ichikawa T,Saito K,Yoshioka N,et al. Detection and characterization of focal liver lesions:a Japanese7phase Ⅲ,multicenter comparison between gadoxetic acid disodium-enhanced magnetic resonance imagingand contrast-enhanced computed tomography predominantly in patients with hepatocellular carcinoma andchronic liver disease. Invest Radiol,2010;45:133-141.
8. 丁莺,陈财忠,饶圣祥,等. Gd+-EOB-DTPA 与Gd+-DTPA 增强磁共振检查肝细胞癌的对照研究.中华普通外科杂志,2013;28(9):682-685.
9. Chen BB,Murakami T,Shih TT,et al. Novel imaging diagnosis for hepatocellular carcinoma:consensus from the 5th Asia-Pacific Primary Liver Cancer Expert Meeting(APPLE 2014). Liver Cancer,2015;4:215-227.
10. Merkle EM,Zech CJ,Bartolozzi C,et al. Consensus report from the 7th International Forum for Liver Magnetic Resonance Imaging. Eur Radiol,2016;26:674-682.
11. 吴孟超,沈锋主编. 肝癌. 第1 版. 北京:人民卫生出版社;2010:58-61.
1.2 HCC 的病理诊断
1. Forner A,Vilana R,Ayuso C,et al. Diagnosis of hepatic nodules 20 mm or smaller in cirrhosis:Prospective validation of the noninvasive diagnostic criteria for hepatocellular carcinoma. Hepatology,2008;47:97-104.
2. 丛文铭主编. 肝胆肿瘤外科病理学. 第1 版. 北京:人民卫生出版社;2015:276-320.
3. World Health Organization. Guidelines for the prevention,care and treatment of persons with chronichepatitis B infection. Geneva,2015,http://www.drugsandalcohol.ie/23582/.
4. Rodriguez-Peralvarez M,Luong TV,Andreana L,et al. A systematic review of microvascular invasion inhepatocellular carcinoma:diagnostic and prognostic variability. Ann Surg Oncol,2013;20:325-339.
5. 中国抗癌协会肝癌专业委员会,中华医学会肝病学分会肝癌学组,中国抗癌协会病理专业委员会.原发性肝癌规范化病理诊断指南(2015 年版). 中华肝胆外科杂志,2015;21(3):145-151.
6. Eguchi S,Takatsuki M,Hidaka M,et al. Predictor for histological microvascular invasion of hepatocellular carcinoma:a lesson from 229 consecutive cases of curative liver resection. World J Surg,2010;34:1034-1038.
7. Fujita N,Aishima S,Iguchi T,et al. Histologic classification of microscopic portal venous invasion to
predict prognosis in hepatocellular carcinoma. Hum Pathol,2011;42:1531-1538.
8. Iguchi T,Shirabe K,Aishima S,et al. New pathologic stratification of microvascular invasion in hepatocellular carcinoma:predicting prognosis after living-donor liver transplantation. Transplantation,2015;99:1236-1242.
1.3 HCC 的临床诊断
1. NCCN Clinical Practice Guidelines in Oncology(NCCN Guidelines®). Hepatobiliary Cancers. Version 1.2018.
2. European Association for the Study of the Liver. EASL clinical practice guidelines:Management of hepatocellular carcinoma. J Hepatol,2018. https://doi.org/10.1016/j.jhep.2018.03.019
3. 国家卫生和计划生育委员会. 原发性肝癌诊疗规范(2017 年版). 中国实用外科杂志,2017;37(7):705-720.
1. 国家卫生和计划生育委员会. 原发性肝癌诊疗规范(2017 年版). 中国实用外科杂志,2017;37(7):705-720.
2. Chen ZH,Hong YF,Lin JX,et al. Validation and ranking of seven staging systems of hepatocellular carcinoma. Oncol Lett,2017;14:705-714.
3. NCCN Clinical Practice Guidelines in Oncology(NCCN Guidelines®). Hepatobiliary Cancers. Version 1.2018.
4. European Association for the Study of the Liver. EASL clinical practice guidelines:Management of hepatocellular carcinoma. J Hepatol,2018. https://doi.org/10.1016/j.jhep.2018.03.019
5. 郑可心,韩冰,祁兴顺,等.《 2018年美国肝病学会实践指导:肝细胞癌的诊断、分期和管理》摘译.临床肝胆病杂志,2018;34(6):1181-1182.
3 HCC 的MDT 模式
1. Fields TD,Philips P,Scoggins CR,et al. Multi-disciplinary concurrent management of recurrent hepatocellular therapy is superior to sequential therapy. World J Surg,2017;41(5):1331-1339.
2. 广东省抗癌协会肝癌专业委员会,中山大学肿瘤防治中心肝胆科. 肝癌多学科综合治疗团队建立—广东专家共识(1). 中国实用外科杂志,2014;34(8):732-734.
3. 国家卫生和计划生育委员会. 原发性肝癌诊疗规范(2017 年版). 中国实用外科杂志,2017;37(7):705-720.
4. 郑可心,韩冰,祁兴顺,等.《 2018年美国肝病学会实践指导:肝细胞癌的诊断、分期和管理》摘译.临床肝胆病杂志,2018;34(6):1181-1182.
5. Bruix J,Reig M,Sherman M. Evidence-based diagnosis,staging,and treatment of patients with hepatocellular carcinoma. Gastroenterology,2016;150(4):835-853.
4.1 肝切除术
1. Liu PH,Hsu CY,Hsia CY,et al. Surgical resection versus radiofrequency ablation for single hepatocellular carcinoma ≤ 2 cm in a propensity score model. Ann Surg,2016;263:538-545.
2. Feng K,Yan J,Li X,et al. A randomized controlled trial of radiofrequency ablation and surgical resection in the treatment of small hepatocellular carcinoma. J Hepatol,2012;57:794-802.
3. Xu Q,Kobayashi S,Ye X,et al. Comparison of hepatic resection and radiofrequency ablation for small hepatocellular carcinoma:a meta-analysis of 16,103 patients. Sci Rep,2014;4:7252.
4. Yin L,Li H,Li AJ,et al. Partial hepatectomy vs. transcatheter arterial chemoembolization for resectable multiple hepatocellular carcinoma beyond Milan Criteria:a RCT. J Hepatol,2014;61:82- 88.
5. Cescon M,Colecchia A,Cucchetti A,et al. Value of transient elastography measured with fibroscan in predicting the outcome of hepatic resection for hepatocellular carcinoma. Ann Surg,2012;256:706- 712.
6. Chacko S,Samanta S. “Hepatocellular carcinoma:A life-threatening disease”. Biomed Pharmacother (2016),http://dx.doi.org/10.1016/j.biopha.2016.10.078
7. Ogata S,Belghiti J,Farges O,et al. Sequential arterial and portal vein embolizations before righthepatectomy in patients with cirrhosis and hepatocellular carcinoma. Br J Surg,2006;93:1091-1098.
8. 周俭,王征,孙健,等. 联合肝脏离断和门静脉结扎的二步肝切除术. 中华消化外科杂志,2013; 12(7):485-489.
9. D’Haese JG,Neumann J,Weniger M,et al. Should ALPPS be used for liver resection in intermediatestage HCC? Ann Surg Oncol,2016;23:1335-1343.
10. Hong de F,Zhang YB,Peng SY,et al. Percutaneous microwave ablation liver partition and portal vein embolization for rapid liver regeneration:A minimally invasive first step of ALPPS for hepatocellular carcinoma. Ann Surg ,2016;264:e1-2.
11. Liu CL,Fan ST,Cheung ST,et al. Anterior approach versus conventional approach right hepatic resection for large hepatocellular carcinoma:a prospective randomized controlled study. Ann Surg, 2006;244(2):194-203.
12. Zhang ZM,Lai EC,Zhang C,et al. The strategies for treating primary hepatocellular carcinoma with portal vein tumor thrombus. Int J Surg,2015;20:8-16.
13. Fu SY,Lau WY,Li AJ,et al. Liver resection under total vascular exclusion with or without preceding Pringle manoeuvre. Br J Surg,2010;97:50-55.
14. An J,Lee KS,Kim KM,et al. Clinical features and outcomes of patients with hepatocellular carcinoma complicated with bile duct invasion. Clin Mol Hepatol,2017;23(2):160-169.
15. Shi HY,Wang SN,Wang SC,et al. Preoperative transarterial chemoembolization and resection forhepatocellular carcinoma:a nationwide Taiwan database analysis of long-term outcome predictors. J Surg Oncol,2014;109:487-493.
16. Zhou WP,Lai EC,Li AJ,et al. A prospective,randomized,controlled trial of preoperative transarterial chemoembolization for resectable large hepatocellular carcinoma. Ann Surg,2009;249: 195-202.
4.2 肝切除术后辅助治疗策略
1. 四川大学华西医院肝癌MDT 团队. 肝细胞癌切除术后复发转移的防治:华西医院多学科专家共识. 中国普外基础与临床杂志,2017;24(8):927-939.
2. 陈晓泓,张博恒,邱双健,等. 肝细胞癌根治术后辅助性肝动脉化疗栓塞对远期复发的影响. 中 华肝脏病杂志,2010;18(8):599-603.
3. Zhong JH,Li H,Li LQ,et al. Adjuvant therapy options following curative treatment of hepatocellular carcinoma:a systematic review of randomized trials. Eur J Surg Oncol,2012;38(4):286-295.
4. Ke-Wei L,Tian-Fu W,Xi L,et al. The effect of postoperative TACE on prognosis of HCC with microscopic venous invasion. Hepatogastroenterology,2012;59(118):1944-1946.
5. Peng BG,He Q,Li JP,et al. Adjuvant transcatheter arterial chemoembolization improves efficacy of hepatectomy for patients with hepatocellular carcinoma and portal vein tumor thrombus. Am J Surg,2009; 198(3):313-318.
6. Zhong JH,Li LQ. Postoperative adjuvant transarterial chemoembolization for participants with hepatocellular carcinoma:A meta-analysis. Hepatol Res,2010;40(10):943-953.
7. Kubo S,Nishiguchi S,Hirohashi K,et al. Effects of long-term postoperative interferon α-2b therapy on intrahepatic recurrence after resection of hepatitis c virus-related hepatocellular carcinoma:a randomized,controlled trial. Ann Intern Med,2001;134(10):963-967.
8. Lo CM,Liu CL,Chan SC,et al. A randomized,controlled trial of postoperative adjuvant interferon therapy after resection of hepatocellular carcinoma. Ann Surg,2007;245:831-842.
9. 徐建波,祁付珍,许刚,等. 干扰素辅助治疗乙肝相关性肝癌术后患者的Meta 分析. 中华肝胆外 科杂志,2014;20(2):81-84.
10. 程树群,吴孟超,陈汉,等. 肝癌患者术后肝动脉化疗栓塞联合胸腺肽治疗预防复发的随机对 照研究. 中华肿瘤杂志,2004;26(5):305-307.
11. Qiu SJ,Zhou ZG,Shen F,et al. A multicenter,randomized,observation-controlled clinical trial to evaluate the efficacy and safety of thymalfasin adjuvant therapy in patients with HBV-related HCC after curative resection-first announcement of the protocol. Expert Opin Biol Ther,2015;15 Suppl 1:133- 137.
12. Liang YR,Guo Z,Jiang Jh,et al. Thymosin α1 therapy subsequent to radical hepatectomy in patients with hepatitis B virus-associated hepatocellular carcinoma:A retrospective controlled study. Oncol Lett, 2016;12:3513-3518.
13. Chen Q,Shu C,Laurence AD,et al.Effect of Huaier granule on recurrence after curative resection of HCC:a multicentre,randomised clinical trial.Gut,2018,https://www.ncbi.nlm.nih.gov/ pubmed/29802174.
4.3 肝移植术
1. Rodriguez-Peralvarez M,Tsochatzis E,Naveas MC,et al. Reduced exposure to calcineurin inhibitors early after liver transplantation prevents recurrence of hepatocellular carcinoma. J Hepatol,2013;59: 1193-1199.
2. Liang W,Wang D,Ling X,et al. Sirolimus-based immunosuppression in liver transplantation for hepatocellular carcinoma:a meta-analysis. Liver Transpl,2012;18:62-69.
3. Zhou J,Wang Z,Wu ZQ,et al. Sirolimus-based immunosuppression therapy in liver transplantation forpatients with hepatocellular carcinoma exceeding the Milan criteria. Transplant Proc,2008;40:3548- 3553.
4. Agopian VG,Harlander-Locke MP,Ruiz RM,et al. Impact of pretransplant bridging locoregional therapy for patients with hepatocellular carcinoma within Milan criteria undergoing liver transplantation: analysis of 3601 patients from the us multicenter HCC transplant consortium. Ann Surg,2017;266(3): 525-535.
5. Lee MW,Raman SS,Asvadi NH,et al. Radiofrequency ablation of hepatocellular carcinoma as bridge therapy to liver transplantation:a 10-year intention-to-treat analysis. Hepatology,2017;65(6): 1979-1990.
4.4 局部消融治疗
1. Hasegawa K,Aoki T,Ishizawa T,et al. Comparison of the therapeutic outcomes between surgical resection and percutaneous ablation for small hepatocellular carcinoma. Ann Surg Oncol,2014;21 Suppl 3:348-355.
2. Chen MS,Li JQ,Zheng Y,et al. A prospective randomized trial comparing percutaneous local ablative therapy and partial hepatectomy for small hepatocellular carcinoma. Ann Surg,2006;243(3):321- 328.
3. Huang J,Yan L,Cheng Z,et al. A randomized trial comparing radiofrequency ablation and surgical resection for HCC conforming to the Milan criteria. Ann Surg,2010;252:903-912.
4. Peng ZW,Zhang YJ,Chen MS,et al. Radiofrequency ablation with or without transcatheter arterial chemoembolization in the treatment of hepatocellular carcinoma:a prospective randomized trial. J Clin Oncol,2013;31:426-432.
5. Morimoto M,Numata K,Kondou M,et al. Midterm outcomes in patients with intermediate-sized hepatocellular carcinoma:a randomized controlled trial for determining the efficacy of radiofrequency ablation combined with transcatheter arterial chemoembolization. Cancer,2010;116:5452-5460.
6. Ishizawa T,Hasegawa K,Aoki T,et al. Neither multiple tumors nor portal hypertension are surgicalcontraindications for hepatocellular carcinoma. Gastroenterology,2008;134:1908-1916.
7. Sheta E,El-Kalla F,El-Gharib M,et al. Comparison of single-session transarterial chemoembolization combined with microwave ablation or radiofrequency ablation in the treatment of hepatocellular carcinoma: a randomized-controlled study. Eur J Gastroenterol Hepatol,2016;28(10):1198-1203.
8. Di Vece F,Tombesi P,Ermili F,et al. Coagulation areas produced by cool-tip radiofrequency ablation and microwave ablation using a device to decrease back-heating effects:a prospective pilot study. Cardiovasc Intervent Radiol,2014;37:723-729.
9. Wen Luo,Yunfei Zhang,Guangbin He,et al. Effects of radiofrequency ablation versus other ablating techniques on hepatocellular carcinomas:a systematic review and meta- analysis. World J Surg Oncol, 2017;15(1):126-141.
10. 中国抗癌协会肝癌专业委员会,中国抗癌协会临床肿瘤学协作委员会,中华医学会肝病学分会 肝癌学组. 陈敏山,陈敏华执笔,叶胜龙,秦叔逵审校. 原发性肝癌局部消融治疗的专家共识. 临 床肿瘤学杂志,2011;16(1):70-73.
4.5 肝动脉介入治疗
1. Kim JW,Kim JH,Sung KB,et al. Transarterial chemoembolization vs. radiofrequency ablation for the treatment of single hepatocellular carcinoma 2 cm or smaller. Am J Gastroenterol,2014;109(8): 1234-1240.
2. Kim JH,Won HJ,Shin YM,et al. Medium-sized(3.1-5.0 cm) hepatocellular carcinoma: transarterial chemoembolization plus radiofrequency ablation versus radiofrequency ablation alone. Ann Surg Oncol,2011;18(6):1624-1629.
3. He MK,Le Y,Li QJ,et al. Hepatic artery infusion chemotherapy using mFOLFOX versus transarterial chemoembolization for massive unresectable hepatocellular carcinoma:a prospective non-randomized study. Chin J Cancer,2017;36(1):83.
4. Ikeda M,Kudo M,Aikata H,et al. Transarterial chemoembolization with miriplatin vs. epirubicin for unresectable hepatocellular carcinoma:a phase III randomized trial. J Gastroenterol,2018;53(2): 281-290.
5. Lencioni R.Chemoembolization for hepatocellular carcinoma. Semin Oncol,2012;39(4):503-509.
6. Yau T,Tang VY,Yao TJ,et al. Development of Hong Kong Liver Cancer staging system with treatment stratification for patients with hepatocellular carcinoma. Gastroenterology,2014;146(7):1691-1700.
7. Han K,Kim JH,Ko GY,et al. Treatment of hepatocellular carcinoma with portal venous tumor thrombosis:A comprehensive review. World J Gastroenterol,2016;22(1):407-416.
8. Leng JJ,Xu YZ,Dong JH. Efficacy of transarterial chemoembolization for hepatocellular carcinoma with portal vein thrombosis:a meta-analysis. ANZ J Surg,2016;86(10):816-820.
9. Lyu N,Kong Y,Mu L,et al. Hepatic arterial infusion of oxaliplatin plus fluorouracil/leucovorin versus sorafenib for advanced hepatocellular carcinoma. J Hepatol,2018;69(1):60-69.
10. Lyu N,Lin Y,Kong Y,et al. FOXAI:a phase II trial evaluating the efficacy and safety of hepatic arterial infusion of oxaliplatin plus fluorouracil/leucovorin for advanced hepatocellular carcinoma. Gut, 2018;67(2):395-396.
11. Nishikawa H,Kita R,Kimura T,et al. Clinical efficacy of non-transplant therapies in patients with hepatocellular carcinoma with Child-Pugh C liver cirrhosis. Anticancer Res,2014;34(6):3039- 3044.
12. Kudo M,Osaki Y,Matsunaga T,et al. Hepatocellular carcinoma in Child-Pugh C cirrhosis: prognostic factors and survival benefit of nontransplant treatments. Dig Dis,2013;31(5-6):490- 498.
13. Galle PR,Tovoli F,Foerster F,et al. The treatment of intermediate stage tumours beyond TACE: From surgery to systemic therapy. J Hepatol,2017;67(1):173-183.
14. Qi X,Liu L,Wang D,et al. Hepatic resection alone versus in combination with pre- and post operative transarterial chemoembolization for the treatment of hepatocellular carcinoma:A systematic review and meta-analysis. Oncotarget,2015;6(34):36838-36859.
15. Lencioni R,de Baere T,Soulen MC,et al. Lipiodol transarterial chemoembolization for hepatocellular carcinoma:A systematic review of efficacy and safety data. Hepatology,2016;64(1):106-116.
16. Park JW,Chen M,Colombo M,et al. Global patterns of hepatocellular carcinoma management from diagnosis to death:the BRIDGE Study. Liver Int,2015;35(9):2155-2166.
17. 中华医学会放射学分会介入学组协作组. 原发性肝细胞癌经导管肝动脉化疗性栓塞治疗技术操 作规范专家共识. 中华放射学杂志,2011;45(10):908-912.
18. Liapi E,Geschwind JF. Intra-arterial therapies for hepatocellular carcinoma:where do we stand. Ann Surg Oncol,2010;17(5):1234-1246.
19. Takayasu K,Arii S,Ikai I,et al. Overall survival after transarterial lipiodol infusion chemotherapy with or without embolization for unresectable hepatocellular carcinoma:propensity score analysis. AJR Am J Roentgenol,2010;194(3):830-837.
20. Molinari M,Kachura JR,Dixon E,et al. Transarterial chemoembolisation for advanced hepatocellular carcinoma:results from a North American cancer centre. Clin Oncol(R Coll Radiol),2006;18(9): 684-692.
21. El-Serag HB,Marrero JA,Rudolph L,et al. Diagnosis and treatment of hepatocellular carcinoma. Gastroenterology,2008;134(6):1752-1763.
22. Maluccio MA,Covey AM,Porat LB,et al. Transcatheter arterial embolization with only particles for the treatment of unresectable hepatocellular carcinoma. J Vasc Interv Radiol,2008;19(6):862- 869.
23. Lee YB,Lee DH,Cho Y,et al. Comparison of transarterial chemoembolization and hepatic resection for large solitary hepatocellular carcinoma:a propensity score analysis. J Vasc Interv Radiol, 2015;26(5):651-659.
24. Lencioni R,Llovet JM. Modified RECIST(mRECIST) assessment for hepatocellular carcinoma. Semin Liver Dis,2010,30(1):52-60.
25. Gillmore R,Stuart S,Kirkwood A,et al. EASL and mRECIST responses are independent prognostic factors for survival in hepatocellular cancer patients treated with transarterial embolization. J Hepatol, 2011;55(6):1309-1316.
26. Shim JH,Lee HC,Kim SO,et al. Which response criteria best help predict survival of patients with hepatocellular carcinoma following chemoembolization? A validation study of old and new models. Radiology,2012;262(2):708-718.
27. Jung ES,Kim JH,Yoon EL,et al. Comparison of the methods for tumor response assessment in patients with hepatocellular carcinoma undergoing transarterial chemoembolization. J Hepatol,2013;58 (6):1181-1187.
28. Raoul JL,Gilabert M,Piana G. How to define transarterial chemoembolization failure or refractoriness:a European perspective. Liver Cancer,2014;3(2):119-124.
29. Yamakado K,Miyayama S,Hirota S,et al. Hepatic arterial embolization for unresectable hepatocellular carcinomas:do technical factors affect prognosis. Jpn J Radiol,2012;30(7):560-566.
30. Yang M,Fang Z,Yan Z,et al. Transarterial chemoembolisation(TACE) combined with endovascular implantation of an iodine-125 seed strand for the treatment of hepatocellular carcinoma with portal vein tumour thrombosis versus TACE alone:a two-arm,randomised clinical trial. J Cancer Res Clin Oncol,2014;140(2):211-219.
31. Si ZM,Wang GZ,Qian S,et al. Combination therapies in the management of large(≥ 5cm) hepatocellular carcinoma:Microwave ablation immediately followed by transarterial chemoembolization. J Vasc Interv Radiol,2016;27(10):1577-1583.
32. Zeng ZC,Tang ZY,Fan J,et al. A comparison of chemoembolization combination with and without radiotherapy for unresectable hepatocellular carcinoma. Cancer J,2004;10(5):307-316.
33. Meng MB,Cui YL,Lu Y,et al. Transcatheter arterial chemoembolization in combination with radiotherapy for unresectable hepatocellular carcinoma:a systematic review and meta-analysis. Radiother Oncol,2009;92(2):184-194.
34. Lencioni R,Llovet JM,Han G,et al. Sorafenib or placebo plus TACE with doxorubicin-eluting beads for intermediate stage HCC:The SPACE trial. J Hepatol,2016;64(5):1090-1098.
35. Park JW,Koh YH,Kim HB,et al. Phase II study of concurrent transarterial chemoembolization andsorafenib in patients with unresectable hepatocellular carcinoma. J Hepatol,2012;56(6):1336- 1342.
36. Pawlik TM,Reyes DK,Cosgrove D,et al. Phase II trial of sorafenib combined with concurrent transarterial chemoembolization with drug-eluting beads for hepatocellular carcinoma. J Clin Oncol, 2011;29(30):3960-3967.
37. Duffy AG,Ulahannan SV,Makorova-Rusher O,et al. Tremelimumab in combination with ablation in patients with advanced hepatocellular carcinoma. J Hepatol,2017;66(3):545-551.
38. 中国医师协会介入医师分会. 中国肝细胞癌经动脉化疗栓塞治疗(TACE) 临床实践指南(2018 年版).
4.6 放射治疗
1. Wahl DR,Stenmark MH,Tao Y,et al. Outcomes after stereotactic body radiotherapy or radiofrequency ablation for hepatocellular carcinoma. J Clin Oncol,2016;34:452-459.
2. Chino F,Stephens SJ,Choi SS,et al. The role of external beam radiotherapy in the treatment of hepatocellular cancer. Cancer,2018,https://www.ncbi.nlm.nih.gov/pubmed/29645076
3. Ohri N,Dawson LA,Krishnan S,et al. Radiotherapy for hepatocellular carcinoma:New indications and directions for future study. J Natl Cancer Inst,2016,https://www.ncbi.nlm.nih.gov/pubmed/27377923
4. Hoffe SE,Finkelstein SE,Russell MS,et al. Nonsurgical options for hepatocellular carcinoma:evolving role of external beam radiotherapy. Cancer Control,2010;17:100-110.
5. Wu ZF,Wang Y,Yang P,et al. Toll‑like receptor 4 and its associated proteins as prognostic factors for HCC treated by post‑radiotherapy surgery. Oncol Lett,2018;15:9599-9608.
6. Wang WH,Wang Z,Wu JX,et al. Survival benefit with IMRT following narrow-margin hepatectomy inpatients with hepatocellular carcinoma close to major vessels. Liver Int,2015;35:2603-2610.
7. Jihye C,Jinsil S. Application of radiotherapeutic strategies in the BCLC-defined stages of hepatocellular carcinoma. Liver Cancer,2012;1:216-225.
8. Yoon SM,Ryoo BY,Lee SJ,et al. Efficacy and safety of transarterial chemoembolization plus external beam radiotherapy vs sorafenib in hepatocellular carcinoma with macroscopic vascular invasion:A randomized clinical trial. JAMA Oncol,2018;4:661-669.
9. 中华医学会放射肿瘤学分会,中国生物医学工程学会精确放疗分会肝癌学组与消化系统肿瘤专家 委员会,中国研究型医院学会放射肿瘤学分会肝癌学组. 2016 年原发性肝癌放疗共识. 中华放射 肿瘤学杂志,2016;25(11):1141-1150.
10. Zeng ZC,Tang ZY,Fan J,et al. Consideration of role of radiotherapy for lymph node metastases in patients with HCC:retrospective analysis for prognostic factors from 125 patients. Int J Radiat Oncol Biol Phys,2005;63:1067-1076.
11. Bujold A,Massey CA,Kim JJ,et al. Sequential phase I and II trials of stereotactic body radiotherapy for locally advanced hepatocellular carcinoma. J Clin Oncol,2013;31:1631-1639.
12. Wang MH,Ji Y,Zeng ZC,et al. Impact factors for microinvasion in patients with hepatocellular carcinoma:possible application to the definition of clinical tumor volume. Int J Radiat Oncol Biol Phys, 2010;76:467-476.
13. 曾昭冲. 肝细胞癌的立体定向放射治疗. 中华肿瘤杂志,2015;37(9):650-653.
14. Marks LB,Yorke ED,Jackson A,et al. Use of normal tissue complication probability models in the clinic. Int J Radiat Oncol Biol Phys,2010;76:10-19.
15. Pan CC,Kavanagh BD,Dawson LA,et al. Radiation-associated liver injury. Int J Radiat Oncol Biol Phys,2010;76:94-100.
16. Hanna GG,Murray L,Patel R,et al. UK consensus on normal tissue dose constraints for stereotactic radiotherapy. Clin Oncol(R Coll Radiol),2018;30:5-14.
17. Brade AM,Ng S,Brierley J,et al. Phase 1 trial of sorafenib and stereotactic body radiation therapy for hepatocellular carcinoma. Int J Radiat Oncol Biol Phys ,2016;94:580-587.
4.7 放射性核素免疫治疗
1. Zhang Z,Bian H,Feng Q,et al. Biodistribution and localization of iodine-131-labeled metuximab inpatients with hepatocellular carcinoma. Cancer Biol Ther,2006;5(3):318-322.
2. Chen ZN,Mi L,Xu J,et al. Targeting radioimmunotherapy of hepatocellular carcinoma with iodine(131I) metuximab injection:clinical phase I/II trials. Int J Radiat Oncol Biol Phys,2006;65(2):435-444.
3. 利卡汀临床应用专家组.《利卡汀临床应用专家共识》讨论稿.中国介入放射学,2008;2(1): 186-187.
4. Wu L,Shen F,Xia Y,et al. Evolving role of radiopharmaceuticals in hepatocellular carcinoma treatment. Anticancer Agents Med Chem,2016;16(9):1155-1165.
5. 李臻,周进学,任建庄,等.131I 美妥昔单克隆抗体灌注联合经肝动脉化疗栓塞术治疗中晚期肝癌 介入术后复发的临床价值. 中华肝脏病杂志,2013;21(10):728-733.
6. 余宙耀,程涛,李灼亮,等. 利卡汀治疗原发性肝癌72 例近期疗效观察. 广东医学,2009;30(1): 124-126.
7. 王公平,冯笑山,单探幽,等. 肝动脉栓塞与131I 美妥昔单抗注射液灌注治疗原发性肝癌的临床 对比研究. 中华肿瘤防治杂志,2009;16(13):1022-1024.
8. 魏长宏,卞晓山,王作志,等. 利卡汀联合TACE 治疗原发性肝细胞癌近期疗效观察. 武警医学 院学报,2009;18(12):1068-1070.
9. Wu L,Yang YF,Ge NJ,et al. Hepatic arterial iodine-131-labeled metuximab injection combined with chemoembolization for unresectable hepatocellular carcinoma:interim safety and survival data from 110 patients. Cancer Biother Radiopharm,2010;25(6):657-663.
10. Wu L,Yang YF,Ge NJ,et al. Hepatic artery injection of 131I-labelled metuximab combined with chemoembolization for intermediate hepatocellular carcinoma:a prospective nonrandomized study. Eur J Nucl Med Mol Imaging,2012;39(8):1306-1315.
11. He Q,Lu WS,Liu Y,et al.131I-labeled metuximab combined with chemoembolization for unresectable hepatocellular carcinoma. World J Gastroenterol,2013;19(47):9104-9110.
12. Ma J,Wang JH.131I-labeled-metuximab plus transarterial chemoembolization in combination therapy for unresectable hepatocellular carcinoma:results from a multicenter phase IV clinical study.Asian Pac J Cancer Prev,2015;16(17):7441-7447.
13. Bian H,Zheng JS,Nan G,et al. Randmized trial of 131I metuximab in treatment of hepatocellular carcinoma after percutaneous radiofrequency ablation. J Natl Cancer Inst,2014,https://academic.oup. com/jnci/article/106/9/dju239/913340
14. Xu J,Shen ZY,Chen XG,et a1.A randomized controlled trial of Licartin for preventing hepatoma recurrence after liver transplantation.Hepatology,2007;5(2):269-276.
15. 中华医学会器官移植学分会,中华医学会外科学分会移植学组,中国医师协会器官移植医师分 会. 中国肝癌肝移植临床实践指南(2014 版). 中华消化外科杂志,2014;13(7):497-550.
5.2 晚期HCC 二线治疗策略选择
1. Llovet JM,Ricci S,Mazzaferro V,et al. Sorafenib in advanced hepatocellular carcinoma . N Engl J Med, 2008;359(4):378-390.
2. Cheng AL,Kang YK,Chen Z,et al. Efficacy and safety of sorafenib in patients in the Asia-Pacific region with advanced hepatocellular carcinoma:a phase III randomised,double-blind,placebocontrolled trial. Lancet Oncol,2009;10(1):25-34.
3. Qin S,Bai Y,Lim HY,et al. Randomized,multicenter,open-label study of oxaliplatin plus fluorouracil/leucovorin versus doxorubicin as palliative chemotherapy in patients with advanced hepatocellular carcinoma from Asia. J Clin Oncol,2013;31(28):3501-3508.
4. Qin S,Cheng Y,Liang J,et al. Efficacy and safety of the FOLFOX4 regimen versus doxorubicin in chinese patients with advanced hepatocellular carcinoma:A subgroup analysis of the EACH study. Oncologist,2014;19(11):1169-1178.
5. Kudo M,Finn RS,Qin S,et al. Lenvatinib versus sorafenib in first-line treatment of patients with unresectable hepatocellular carcinoma:a randomised phase 3 non-inferiority trial. Lancet,2018;391 (10126):1163-1173.
6. Williet N,Dubreuil O,Boussaha T,et al. Neoadjuvant sorafenib combined with gemcitabine plusoxaliplatin in advanced hepatocellular carcinoma. World J Gastroenterol,2011;17(17):2255-2258.
7. Assenat E,Boige V,Thézenas S,et al. Sorafenib(S) alone versus S combined with gemcitabine and oxaliplatin(GEMOX) in first-line treatment of advanced hepatocellular carcinoma(HCC):Final analysis of the randomized phase II GONEXT trial(UNICANCER/FFCD PRODIGE 10 trial). J Clin Oncol,2013;31 Suppl 4:abstract 4028.
8. Yau T,Cheung FY,Lee F,et al. A multicenter phase II study of sorafenib,capecitabine,and oxaliplatin(SECOX) in patients with advanced hepatocellular carcinoma:Final results of Hong Kong- Singapore Hepatocellular Carcinoma Research Collaborative Group study. J Clin Oncol,2013;31 Suppl 4: abstract 4117.
9. 王锋,秦叔逵,华海清,等. 含奥沙利铂化疗方案治疗对索拉非尼耐药的晚期原发性肝癌的临床 观察. 临床肿瘤学杂志,2014;19(3):226-230.
10. 屈凤莲,郝学志,秦叔逵,等. 亚砷酸注射液治疗原发性肝癌的Ⅱ期多中心研究. 中华肿瘤杂志, 2011;33(9):697-701.
11. 成远,华海清. 榄香烯治疗原发性肝癌的研究进展. 临床肿瘤学杂志,2017;22(10):950- 953.
12. 路大鹏,王玉强,赵卫林,等. 康莱特联合肝动脉化疗栓塞术治疗肝癌的临床研究. 世界临床医 学,2017;11(5):70-72.
13. 田怀平,高蕙敏,杨萍,等. 华蟾素联合肝动脉化疗栓塞治疗原发性肝癌的疗效与安全性Meta分析. 世界中医院,2016;11(10):2151-2155.
14. 陈乃杰,吴丹红,赖义勤,等. 消癌平联合化疗治疗中晚期肝癌的临床分析. 光明中医,2009; 24(6):1111- 1112.
15. 刘冬梅. 肝复乐胶囊联合肝动脉栓塞化疗治疗晚期肝癌的疗效观察. 临床医药文献杂志,2016; 3(2):235-236.
16. 马文华,李娜,邹长鹏,等. 金龙胶囊联合TACE 治疗肝癌随机对照试验的系统评价. 世界科学 技术—中医药现代化,2016;18(4):692-698.
17. 杨玉雪,何璇,文建霞,等. 艾迪注射液与肝动脉栓塞化疗联合治疗原发性肝癌的系统评价. 中 国医院用药评价与分析,2016;16(12):1588-1593.
18. Bruix J,Qin S,Merle P,et al. Regorafenib for patients with hepatocellular carcinoma who progressed on sorafenib treatment(RESORCE):a randomised,double-blind,placebo-controlled,phase 3 trial. Lancet,2016;389(10064) :56-66.
19. Brahmer JR,Hammers H,Lipson EJ. Nivolumab:targeting PD-1 to bolster antitumor immunity. Future Oncol,2015;11(9):1307-1326.
20. EI-Khoueiry AB,Sangro B,Yau T,et al. Nivolumab in patients with advanced hepatocellular carcinoma(CheckMate 040):an open-label,non-comparative,phase 1/2 dose escalation and expansion trial. Lancet,2017;389(10088):2492-2502.
21. Zhu AX,Finn S,Edeline J,et al. Pembrolizumab in patients with advanced hepatocellular carcinomapreviously treated with sorafenib(KEYNOTE-224):a non-randomised,open-label phase 2 trial. Lancet Oncol,2018;19(7):940-952.
22. Abou-Alfa GK,Meyer T,Cheng AL,et al. Cabozantinib(C) versus placebo(P) in patients(pts) with advanced hepatocellular carcinoma(HCC) who have received prior sorafenib:Results from the randomized phase III CELESTIAL trial. J Clin Oncol,2018;36 suppl 4:abstract 207.
23. Zhu AX,Kang YK,Yen CJ,et al. REACH-2:A randomized,double-blind,placebo-controlled phase 3 study of ramucirumab versus placebo as second-line treatment in patients with advanced hepatocellular carcinoma(HCC) and elevated baseline alpha-fetoprotein(AFP) following first-line sorafenib. J Clin Oncol,2018;36 suppl:abstr 4003.
24. Zhu AX,Park JO,Ryoo BY,et al. Ramucirumab versus placebo as second-line treatment in patients with advanced hepatocellular carcinoma following first-line therapy with sorafenib(REACH):a randomised,double-blind,multicentre,phase 3 trial. Lancet Oncol,2015;16(7):859-870.
5.4 HCC 的保肝利胆治疗策略选择
1. 肝细胞癌抗病毒治疗专家组,中华医学会肝病学分会. HBV/HCV 相关性肝细胞癌抗病毒治疗专家共识. 临床肿瘤学杂志,2014;19(5):452-459.
2. Kim WR,Loomba R,Berg T,et al. Impact of long-term tenofovir disoproxil fumarate on incidence ofhepatocellular carcinoma in patients with chronic hepatitis B. Cancer,2015;121(20):3631-3638.
3. Huang G,Lau WY,Wang ZG,et al. Antiviral therapy improves postoperative survival in patients with hepatocellular carcinoma:a randomized controlled trial. Ann Surg,2015;261(1):56-66.
4. 邱福南,王耀东,田毅峰,等. 阿德福韦酯联合胸腺肽α1 对HBV 感染肝细胞癌术后疗效的影响.中华临床医师杂志(电子版),2010;4(3):278-283.
5. 孙建民. 胸腺肽α1 治疗免疫清除或低复制期低病毒载量慢性HBV 感染者的疗效观察. 临床肝胆病杂志,2015;31(2) :202-204.
6. Kubo S,Tanaka H,Takemura S,et al. Effects of lamivudine on outcome after liver resection forhepatocellular carcinoma in patients with active replication of hepatitis B virus. Hepatol Res,2007;37(2):94-100.
7. 中华医学会肝病学分会,中华医学会感染病学分会. 慢性乙型肝炎防治指南(2015 年版). 中华肝脏病杂志(电子版),2015;7(3):1-18.
8. 中华医学会肝病学分会,中华医学会感染病学分会. 丙型肝炎防治指南(2015 年版). 中华肝脏病杂志(电子版),2015;7(3):19-35.
9. 中国医师协会介入医师分会. 中国肝细胞癌经动脉化疗栓塞治疗(TACE) 临床实践指南(2018年版).
10. 中华人民共和国国家卫生和计划生育委员会. 原发性肝癌诊疗规范(2017 年版). 临床肝胆病杂志,2017;33(8):114-126.
11. 秦叔逵,杨柳青,王科明,等. 异甘草酸镁注射液预防抗肿瘤化疗相关急性肝损伤的随机对照、全国多中心临床研究. 临床肿瘤学杂志,2017;22(2):97-106.
6 随访和预后
1. Park H,Park JY. Clinical significance of AFP and PIVKA-II responses for monitoring treatment outcomes and predicting prognosis in patients with hepatocellular carcinoma. Biomed Res Int,2013;2103:310427.
2. Vitale A,Lai Q,Farinati F,et al. Utility of tumor burden score to stratify prognosis of patients with hepatocellular cancer:results of 4759 cases from ITA.LI.CA study group. J Gastrointest Surg,2018;22(5):859-871.
3. Sasaki K,Morioka D,Conci S,et al. The tumor burden score:A new “Metro-ticket” prognostic tool for colorectal liver metastases based on tumor size and number of tumors. Ann Surg,2018;267(1):132-141.