 去看看
去看看


1 治疗前评估
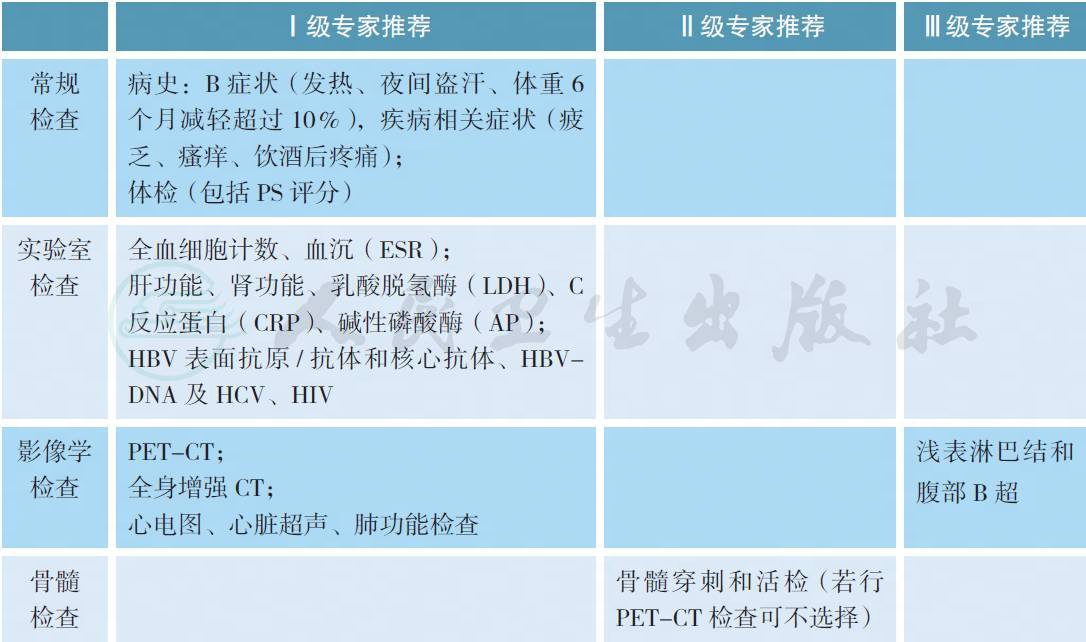
2 病理诊断
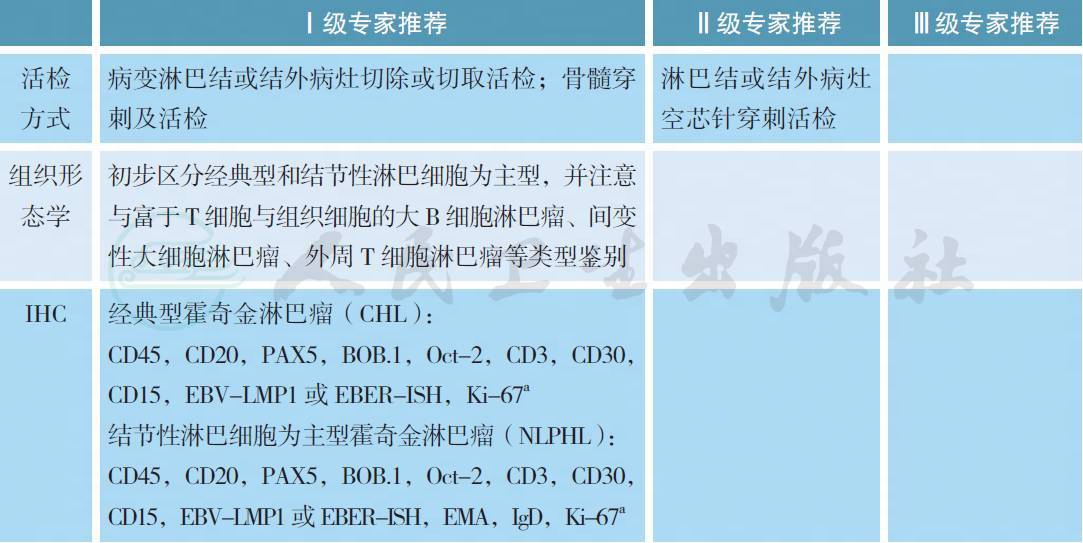
a. CHL 典型表型:CD45-,CD20-(或异质性阳性)、PAX+(弱阳性)、BOB.1 和Oct-2 至少一个失表达,CD30+,CD15+/-,LMP1 或EBER+/-;NLPHL 典型表型:CD45+、CD20+、PAX+、BOB.1 和Oct-2 均阳性,EMA+/-,IgD+/-,CD30-,CD15-,LMP1 或EBER-。
3 分期
参照2014 年Lugano 分期标准,见附录A。
附录A 2014 版Lugano 分期标准(CT、MRI 或PETCT作为分期检查方法)

【注释】
1.*.根据2014年Lugano改良分期标准,不再对淋巴瘤的大包块(bulky)病灶进行具体的数据限定,只需在病例中明确记载最大病灶之最大径即可;Ⅱ期伴有大肿块的患者,应根据病理类型及疾病不良预后因素而酌情选择治疗原则,如伴有大包块的惰性淋巴瘤患者可选择局限期治疗模式,但是伴有大包块的侵袭性淋巴瘤患者,则应选择进展期治疗模式。
2.AnnArbor分期对于淋巴结分布区域的定义(仍然适用于Lugano分期):膈上(共12个区域,由于不能被一个放射野涵盖,因此左右各为一个区域):韦氏环(Waldeyer环)(鼻咽及口咽部的淋巴组织环,包括腭扁桃体、咽后壁腺样体、舌扁桃体及其他该部位淋巴组织为一个区域)、左/右颈部(单侧耳前、枕部、颌下、颏下、颈内、锁骨上为一个区域)、左/右锁骨下、左/右腋窝(含胸部及内乳)、左/右滑车上(含肘窝)、纵隔(含气管旁、胸腺区域)、左/右肺门;膈下(共9个区域):脾脏、上腹部(脾门、肝门、腹腔)、下腹部(腹主动脉旁、腹膜后、肠系膜周围、腹部其他非特指淋巴结为一个区域)、左/右髂血管旁、左/右腹股沟(含股部)、左/右腘窝。
3.3.B症状主要在HL中有预后意义并需要记录;最新文献中B症状在NHL的价值较低,但是仍然建议在病例中记录。所谓B症状:不明原因体重下降10%(诊断前6个月内),发热>38℃并排除其他原因发热,盗汗(夜间大量出汗,需要更换衣服被褥)。
4.扁桃体、韦氏环、脾脏视为淋巴器官。
5.备注:淋巴瘤的分期尽管不断改良,但是争议持续存在,主要是对于分期的定义存在解读分歧,或者对特殊部位未能做出全面而明确的定义。正因如此,后续才建立了多种预后指数用于补充临床分期之不足,以指导临床治疗和判断预后。而且,不同于实体瘤的是,淋巴瘤的临床分期不是决定治疗和预后的最关键因素。
4 治疗
4.1 经典型霍奇金淋巴瘤
Ⅰ ~ Ⅱ期经典型霍奇金淋巴瘤根据有无不良预后因素,分为预后良好及预后不良组,不良因素见附录。Ⅲ ~ Ⅳ期国际预后评分(international prognostic score,IPS) 的不良预后因素见附录。
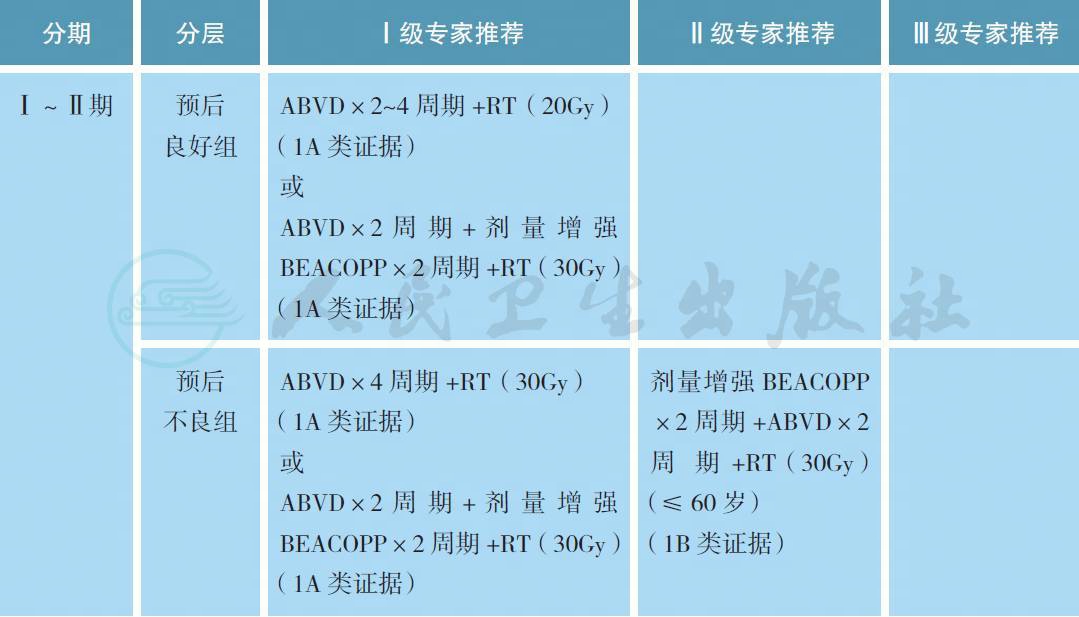

【注释】
经典型霍奇金淋巴瘤依据分期及有无预后不良因素进行分层治疗。Ⅰ ~ Ⅱ期霍奇金淋巴瘤的治疗原则是以化疗联合放疗为主的综合治疗,单纯化疗的整体预后仍较好,但疗效未能证实不劣于联合治疗,故适用于放疗长期毒性风险超过疾病短期控制获益的患者。根据有无不良预后因素,分为预后良好组和预后不良组。预后良好组:2~4 个周期ABVD 方案化疗联合放疗是标准治疗
常用化疗方案:
ABVD 方案(每28d 重复)
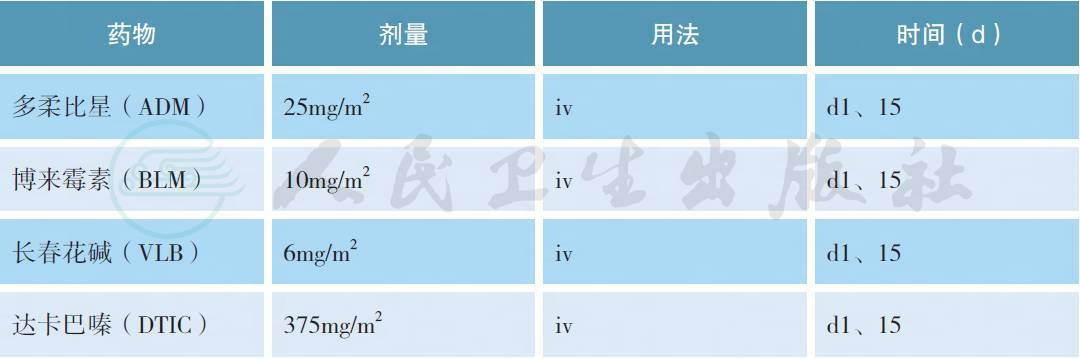
增强剂量BEACOPP 方案(每21d 重复)
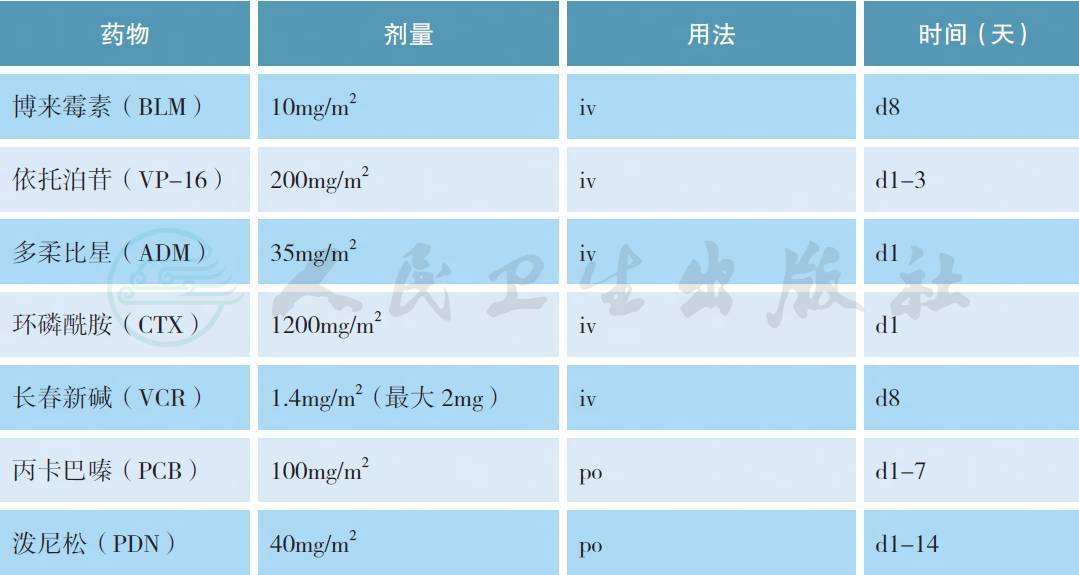
d8 起应用G-CSF 支持治疗。
4.2 复发/ 难治性经典型霍奇金淋巴瘤

【注释】
复发/ 难治性经典型霍奇金淋巴瘤的治疗首选二线挽救方案化疗后进行大剂量化疗联合自体造血干细胞移植[14],挽救方案可选择DHAP(地塞米松、大剂量阿糖胞苷、顺铂)、ICE(异环磷酰胺、卡铂、依托泊苷)、IGEV(异环磷酰胺、吉西他滨和长春瑞滨) 等方案,肿瘤原发耐药或一线治疗后12 个月内复发或复发时伴有结外病灶等不良因素的患者,行造血干细胞移植治疗后可进行Brentuximab Vedotin 单药维持治疗[15]。自体造血干细胞移植失败后亦可选择Brentuximab Vedotin 治疗[16]。免疫检查点抑制剂Nivolumab、Pembrolizumab 通常被推荐用于:基于合并症或首次解救化疗失败的不适合移植的复发/ 难治性经典型霍奇金淋巴瘤患者,以及大剂量化疗联合自体造血干细胞移植及Brentuximab Vedotin 治疗后复发的患者[17-18]。自体造血干细胞移植后复发且仍对化疗敏感的年轻患者,可考虑行异基因干细胞移植治疗。
4.3 结节性淋巴细胞为主型霍奇金淋巴瘤
结节性淋巴细胞为主型霍奇金淋巴瘤的治疗,除无临床不良预后因素的Ⅰ A 期患者可采用单纯放疗(30Gy)[19]外,其余各期的治疗均参照经典型霍奇金淋巴瘤的治疗原则[20],由于该类型肿瘤细胞CD20 表达阳性,因此可采用化疗± 利妥昔单抗± 放疗治疗,化疗方案可选择ABVD、CHOP、CVP 方案。对疑似复发者推荐重新进行活检以排除转化为侵袭性淋巴瘤的可能,复发时病变局限者可应用利妥昔单抗单药治疗,病灶广泛者可选择利妥昔单抗联合二线解救方案治疗。转化为弥漫大B 细胞淋巴瘤患者的治疗参考相应章节。由于结节性淋巴细胞为主型霍奇金淋巴瘤不表达CD30,因此不推荐应用Brentuximab Vedotin 治疗。
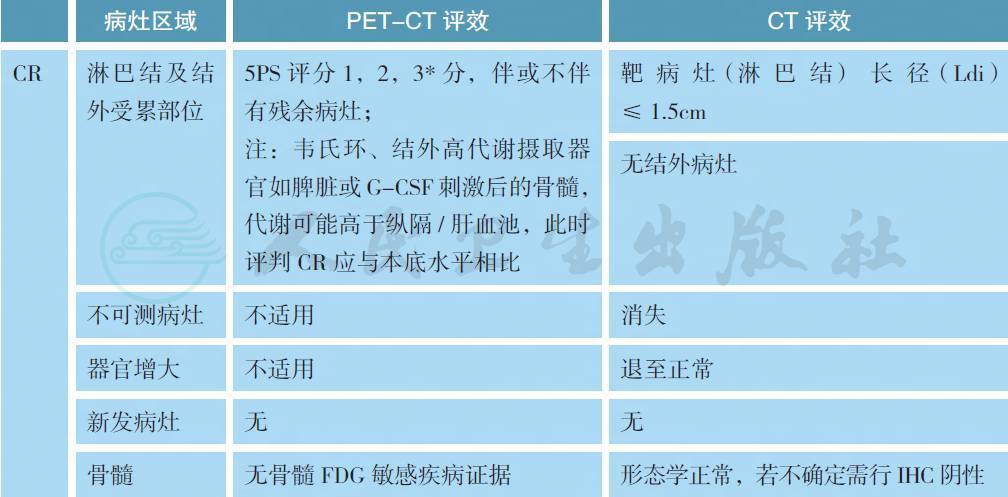
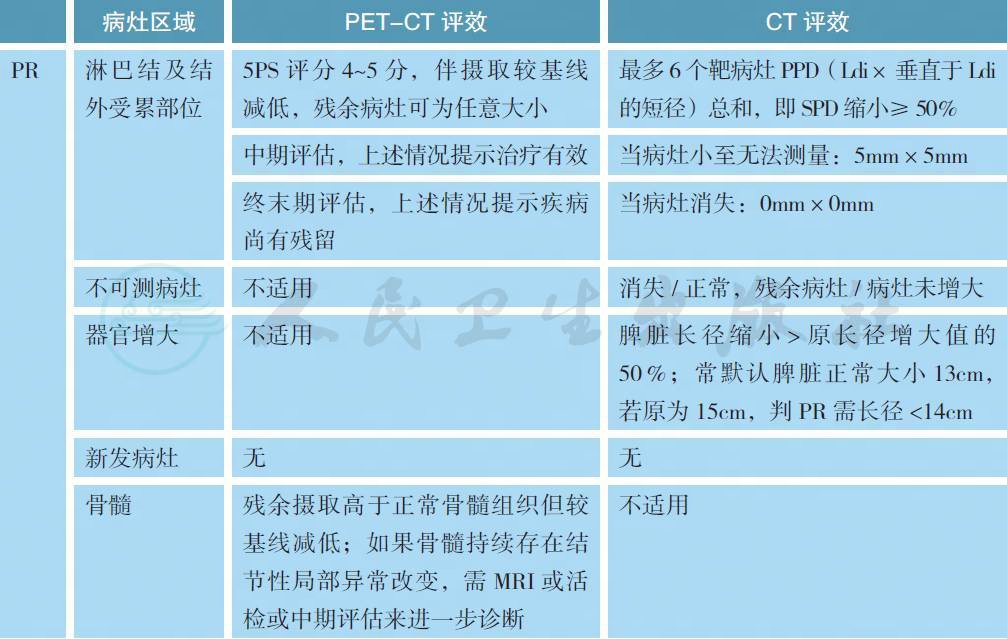
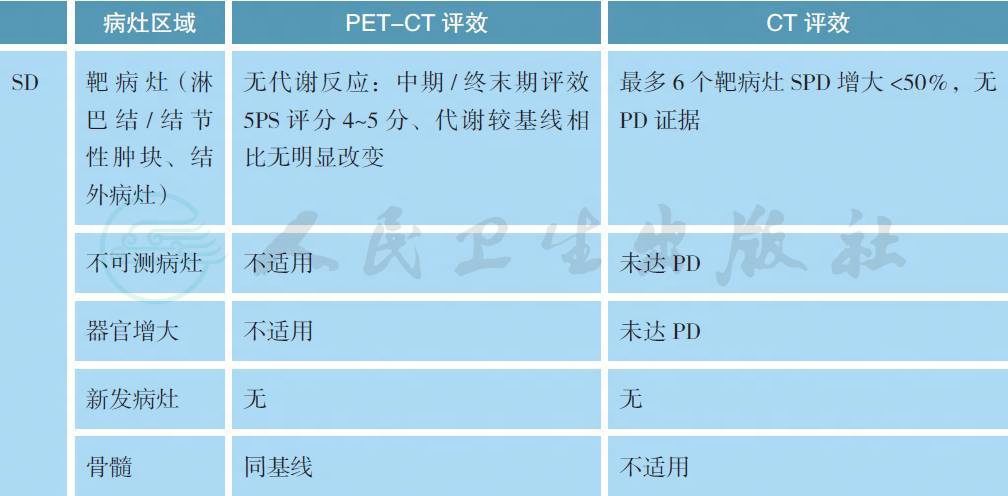
附录B Lugano 会议修订的评效标准
备注:疗效评价采用2014 版Lugano 会议修订的标准,分为影像学缓解(CT/MRI 评效) 和代谢缓解(PET-CT 评效)。
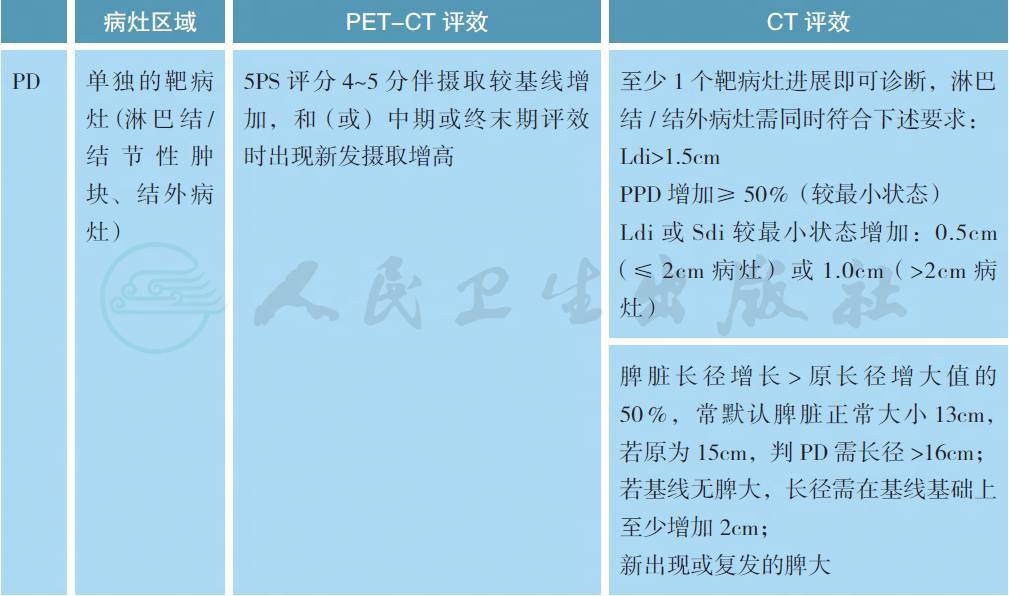
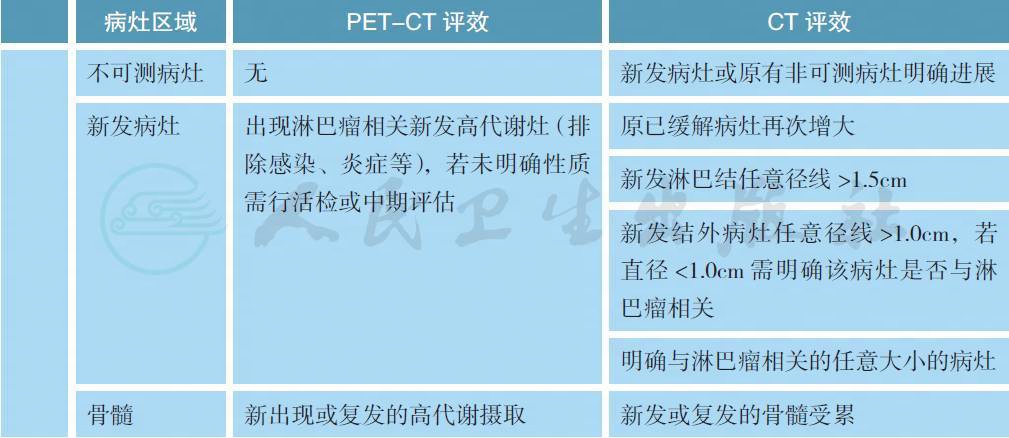
Deauville 的PET 评效5 分法:
1 分:摄取≤本底;
2 分:摄取≤纵隔血池;
3 分:纵隔血池< 病灶摄取≤肝血池;
4 分:摄取> 肝血池(轻度);
5 分:摄取> 肝血池(显著,SUVmax>2 倍肝血池) 或新发病灶;
X 分:新发摄取异常,考虑与淋巴瘤无关;
*5PS 评分为3 分:在多数患者中提示标准治疗下预后较好,特别对于中期评估患者。但是,在某些降阶梯治疗的临床试验中,评分为3 被认为治疗效果不佳,需要避免治疗不足。
可测量病灶:
最多6 个显著的淋巴结/ 淋巴结融合肿块、结外病灶,且两个径线均易被测量;
(1) 淋巴结(nodes):淋巴结需按照区域划分;如果有纵隔及腹膜后淋巴结肿大,则应该包括这些病灶;可测淋巴结需长径>1.5cm;
(2) 非淋巴结病灶(non-nodal lesions):包括实体器官(如肝、脾、肾、肺等)、消化道、皮肤或触诊可及标注部分,可测结外病灶需长径>1.0cm。
不可测量病灶:
任何无法作为可测量/ 可评估的显著病灶均被认为不可测量病灶。包括:
(1) 任何淋巴结/ 淋巴结融合肿块、结外病灶,即所有未能被选择为显著的、或可测量的、或未达到可测量标准但依然认为是病灶的部分;
(2) 考虑为疾病受累但难以量化测量的,比如胸水、腹水、骨转移、软脑膜受累、腹部肿块病灶等;
(3) 其他未确诊需要影像学随访病灶;
韦氏环以及结外病灶(extranodal sites)(如消化道、肝、骨髓):评判CR 时FDG 摄取可能高于纵隔池,但不应高于周围本底水平(例如骨髓因化疗或应用G-CSF 代谢活性普遍升高)。
6 预后评估
6.1 Ⅰ~Ⅱ期霍奇金淋巴瘤不良预后因素,在不同的研究组有所不同,见下表:
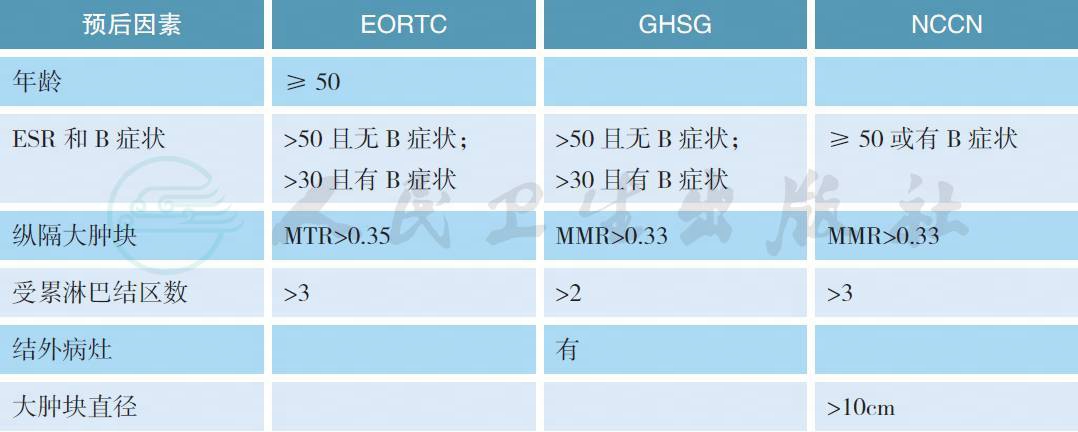
EORTC. 欧洲癌症研究与治疗组织;GHSG. 德国霍奇金淋巴瘤研究组;NCCN. 美国国立综合癌症网络;MMR. 肿块最大径/ 胸腔最大径;MTR. 肿块最大径/胸腔T5/6 水平横径>0.35
6.2 Ⅲ~Ⅳ期霍奇金淋巴瘤国际预后评分(international prognostic score,IPS)
白蛋白<40g/L;血红蛋白<105g/ L;男性;年龄≥ 45 岁;Ⅳ期病变;白细胞≥ 15×109/L;淋巴细胞占白细胞比例<8%和(或) 计数<0.6×109/L。
[1]Engert A,Franklin J,Eich HT,et al. Two cycles of doxorubicin,bleomycin,vinblastine,anddacarbazine plus extended-field radiotherapy is superior to radiotherapy alone in early favorableHodgkin’s lymphoma:final results of the GHSG HD7 trial. J Clin Oncol,2007,25:3495-3502.
[2]Ferme′ C,Eghbali H,Meerwaldt JH,et al. Chemotherapy plus involved field radiation in early-stageHodgkin’s disease. N Engl J Med,2007,357:1916-1927.
[3]Engert A,Plu¨tschow A,EichHT,et al. Reduced treatment intensity in patients with early-stageHodgkin’s lymphoma. N Engl J Med,2010,363:640-652.
[4]Andre′ MPE,Girinsky T,Federico M,et al. Early positron emission tomography response-adaptedtreatment in stage I and Ⅱ Hodgkin lymphoma:final results of the randomized EORTC/LYSA/FIL H10trial. J Clin Oncol,2017,35:1786-1794.
[5]von Tresckow B,Plu¨tschow A,Fuchs M,et al. Dose-intensification in early unfavorable Hodgkin’s lymphoma:final analysis of the German Hodgkin Study Group HD14 trial. J Clin Oncol,2012,30:907-913.
[6]Canellos GP,Niedzwiecki D,Johnson JL. Long-term follow-up of survival in Hodgkin’s lymphoma. N Engl J Med,2009,361:2390-2391.
[7]Engert A,Haverkamp H,Kobe C,et al. Reduced-intensity chemotherapy and PET-guidedradiotherapy in patients with advanced stage Hodgkin’s lymphoma (HD15 trial):a randomised,open-label,phase 3 noninferiority trial. Lancet,2012,379:1791-1799.
[8]Johnson P,Federico M,Kirkwood A,et al. Adapted treatment guided by interim PET-CT scan inadvanced Hodgkin’s lymphoma. N Engl J Med,2016,374:2419-2429.
[9]Press OW,Li H,Scho¨der H,et al. US Intergroup trial of response adapted therapy for stage Ⅲ to Ⅳ Hodgkin lymphoma using early interim fluorodeoxyglucose-positron emission tomography imaging:Southwest Oncology Group S0816. J Clin Oncol,2016,34:2020-2027.
[10]Zinzani PL,Broccoli A,Gioia DM,et al. Interim positron emission tomography response-adaptedtherapy in advanced-stage Hodgkin lymphoma:final results of the phase Ⅱ part of the HD0801 study.J Clin Oncol,2016,34:1376-1385.
[11]Connors JM,Jurczak W,Straus DJ,et al. Brentuximab vedotin with chemotherapy for stage Ⅲ or Ⅳ Hodgkin’s lymphoma. N Engl J Med,2018,378:331-344.
[12]Borchmann P,Goergen H,Kobe C,et al. PET-guided treatment in patients with advanced-stage Hodgkin’s lymphoma (HD18):final results of an open-label,international,randomised phase 3trial by the German Hodgkin Study Group. Lancet,2017,390:2790-2802.
[13]Bo¨ll B,Goergen H,Behringer K,et al. Bleomycin in older early-stage favorable Hodgkinlymphoma patients:analysis of the German Hodgkin Study Group (GHSG) HD10 and HD13 trials.Blood,2016,127:2189-2192.
[14]Schmitz N,Pfistner B,Sextro M,et al. Aggressive conventional chemotherapy compared with highdosechemotherapy with autologous haemopoietic stem-cell transplantation for relapsed chemosensitiveHodgkin’s disease:a randomised trial. Lancet,2002,359:2065-2071.
[15]Moskowitz CH,Nademanee A,Masszi T,et al. Brentuximab vedotin as consolidation therapyafter autologous stem-cell transplantation in patients with Hodgkin’s lymphoma at risk of relapseor progression (AETHERA):a randomised,double-blind,placebo-controlled,phase 3 trial.Lancet,2015,385:1853-1862.
[16]Chen R,Gopal AK,Smith SE,et al. Five-year survival and durability results of brentuximab vedotin in patients with relapsed or refractory Hodgkin lymphoma. Blood,2016,128:1562-1566.
[17]Younes A,Santoro A,Shipp M,et al. Nivolumab for classical Hodgkin’s lymphoma after failureof both autologous stem-cell transplantation and brentuximab vedotin:a multicentre,multicohort,single-arm phase 2 trial. Lancet Oncol,2016,17:1283-1294.
[18]Chen R,Zinzani PL,Fanale MA,et al. Phase Ⅱ study of the efficacy and safety of pembrolizumab for relapsed/refractory classic Hodgkin lymphoma. J Clin Oncol,2017,35:2125-2132.
[19]Eichenauer DA,Plu¨tschow A,Fuchs M,et al. Long-term course of patients with stage Ⅰ Anodular lymphocyte-predominant Hodgkin lymphoma:a report from the German Hodgkin Study Group.J Clin Oncol,2015,33:2857-2862.
[20]Nogova′ L,Reineke T,Brillant C,et al. Lymphocyte-predominant and classical Hodgkin’slymphoma:a comprehensive analysis from the German Hodgkin Study Group. J Clin Oncol,2008,26:434-439.
[21]Dann EJ. PET/CT adapted therapy in Hodgkin disease:current state of the art and future directions.Curr Oncol Rep,2012,14:403-410.