 去看看
去看看


1 治疗前评估

【注释】
预防性腰穿+ 鞘注在PTCL 中的意义仍不明确。
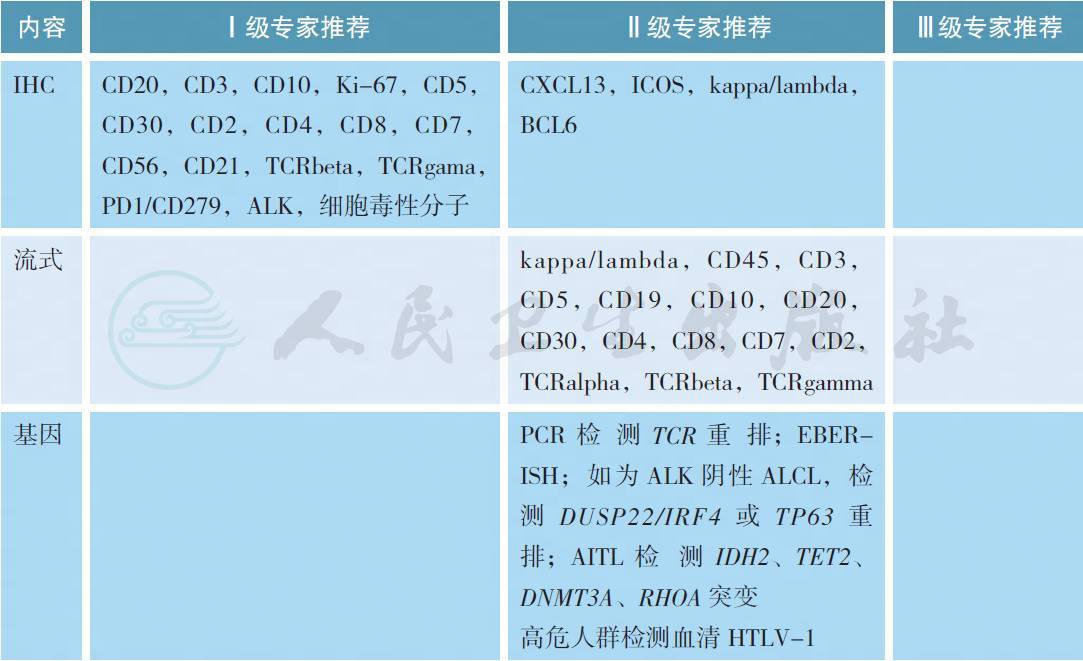
2 病理诊断
3 分期
参照2014 年Lugano 分期标准,见附录A。
附录A 2014 版Lugano 分期标准(CT、MRI 或PETCT作为分期检查方法)

【注释】
1.*.根据2014年Lugano改良分期标准,不再对淋巴瘤的大包块(bulky)病灶进行具体的数据限定,只需在病例中明确记载最大病灶之最大径即可;Ⅱ期伴有大肿块的患者,应根据病理类型及疾病不良预后因素而酌情选择治疗原则,如伴有大包块的惰性淋巴瘤患者可选择局限期治疗模式,但是伴有大包块的侵袭性淋巴瘤患者,则应选择进展期治疗模式。
2.AnnArbor分期对于淋巴结分布区域的定义(仍然适用于Lugano分期):膈上(共12个区域,由于不能被一个放射野涵盖,因此左右各为一个区域):韦氏环(Waldeyer环)(鼻咽及口咽部的淋巴组织环,包括腭扁桃体、咽后壁腺样体、舌扁桃体及其他该部位淋巴组织为一个区域)、左/右颈部(单侧耳前、枕部、颌下、颏下、颈内、锁骨上为一个区域)、左/右锁骨下、左/右腋窝(含胸部及内乳)、左/右滑车上(含肘窝)、纵隔(含气管旁、胸腺区域)、左/右肺门;膈下(共9个区域):脾脏、上腹部(脾门、肝门、腹腔)、下腹部(腹主动脉旁、腹膜后、肠系膜周围、腹部其他非特指淋巴结为一个区域)、左/右髂血管旁、左/右腹股沟(含股部)、左/右腘窝。
3.3.B症状主要在HL中有预后意义并需要记录;最新文献中B症状在NHL的价值较低,但是仍然建议在病例中记录。所谓B症状:不明原因体重下降10%(诊断前6个月内),发热>38℃并排除其他原因发热,盗汗(夜间大量出汗,需要更换衣服被褥)。
4.扁桃体、韦氏环、脾脏视为淋巴器官。
5.备注:淋巴瘤的分期尽管不断改良,但是争议持续存在,主要是对于分期的定义存在解读分歧,或者对特殊部位未能做出全面而明确的定义。正因如此,后续才建立了多种预后指数用于补充临床分期之不足,以指导临床治疗和判断预后。而且,不同于实体瘤的是,淋巴瘤的临床分期不是决定治疗和预后的最关键因素。
4 治疗
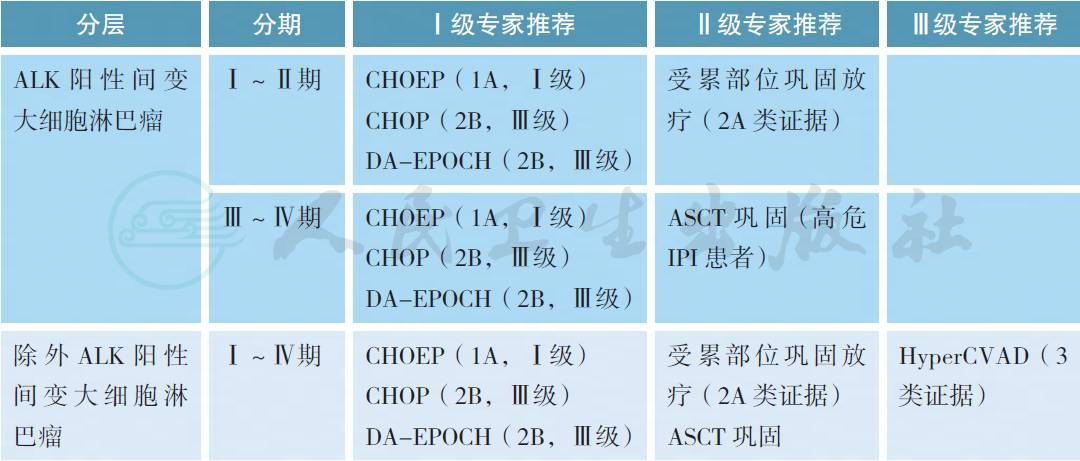
4.1 初治患者的治疗
【注释】
(1)CHOP 方案
环磷酰胺750mg/m2,d1
多柔比星40~50mg/m2,d1
长春新碱1.4mg/m2,d1(最大剂量2mg)
泼尼松100mg,d1-5
每21d 重复。
(2)CHOEP 方案
环磷酰胺750mg/m2,d1
长春新碱1.4mg/m2,d1
多柔比星40~50mg/m2,d1
依托泊苷100mg/m2,d1-3
泼尼松100mg,d1-5
每21d 重复。
(3)DA-EPOCH 方案
依托泊苷50mg/(m2·d),d1-4,96h 连续输注
长春新碱0.4mg/(m2·d),d1-4,96h 连续输注
多柔比星10mg/(m2·d),d1-4,96h 连续输注
环磷酰胺750mg/m2,d5
泼尼松60mg/(m2·d),d1-5
每21d 重复。
DA-EPOCH 剂量调整原则
1) 每次化疗后都需预防性使用粒细胞集落刺激因子。
2) 如果上周期化疗后中性粒细胞减少未达Ⅳ度,可以在上一周期化疗剂量基础上将依托泊苷、多柔比星和环磷酰胺的剂量上调20%。
3) 如果上周期化疗后中性粒细胞减少达Ⅳ度,但在1 周内恢复,保持原剂量不变。
4) 如果上周期化疗后中性粒细胞减少达Ⅳ度,且持续时间超过1 周,或血小板下降达Ⅳ度,在上一周期化疗剂量基础上将依托泊苷、多柔比星和环磷酰胺的剂量下调20%。
5) 剂量调整如果是在起始剂量以上,则上调时依托泊苷、多柔比星和环磷酰胺一起上调;剂量调整如果是在起始剂量以下,则下调时仅下调环磷酰胺。
1. 伴DUSP22 重排的ALK 阴性ALCL 的预后与ALK 阳性患者相似,治疗可以依据ALK 阳性ALCL 治疗原则。
2. 一部分年老且有并发症的AITL 患者,可以尝试单用激素类药物控制症状。ALK 阳性ALCL 较其他类型PTCL 预后好。经过含蒽环类药物的方案治疗后,ALK 阳性ALCL的5 年无失败生存率和总生存率分别为60%和70%,明显优于其他类型PTCL[6]。推荐Ⅰ ~ Ⅱ期患者接受6 个周期化疗(CHOEP,CHOP-21 或DA-EPOCH) 联合或不联合受累部位放疗(ISRT;30~40Gy),或者3~4 周期化疗联合ISRT(30~40Gy)。Ⅲ ~ Ⅳ ALK 阳性ALCL 患者接受6 个周期化疗(CHOEP,CHOP-21 或DA-EPOCH)。高危IPI 患者可以接受大剂量化疗联合自体造血干细胞移植巩固,但目前无前瞻性大样本量研究证实该结论。
与ALK 阳性ALCL 相比,其他类型PTCL 预后不佳。CHOEP 能够提高年轻PTCL 患者(<60 岁)的EFS。但由于CHOEP 的毒性较强,年龄大于等于60 岁患者,建议采用CHOP-21 方案。而高危患者(除外ALK 阳性ALCL) 接受CHOP 或者CHOEP 方案预后较差[7]。一项小样本量前瞻性研究发现,DA-EPOCH 方案能够改善患者的EFS 和OS[8]。在一项前瞻性大样本量研究(除外ALK 阳性ALCL) 中,CHOEP 联合自体造血干细胞移植巩固可以提高PTCL 患者的PFS 和OS[9]。推荐这部分患者首选参加临床试验。如无合适的试验,推荐患者接受6 个周期化疗联合或者不联合ISRT(30~40Gy)。化疗方案包括:CHOEP,CHOP-14,CHOP-21,DA-EPOCH。有条件的患者可在一线治疗缓解后接受大剂量化疗联合自体造血干细胞移植巩固。部分PTCL(如肝脾T 细胞淋巴瘤) 预后极差,可以选择一线异基因造血干细胞移植巩固[10,11],但也缺乏大样本量研究数据支持。
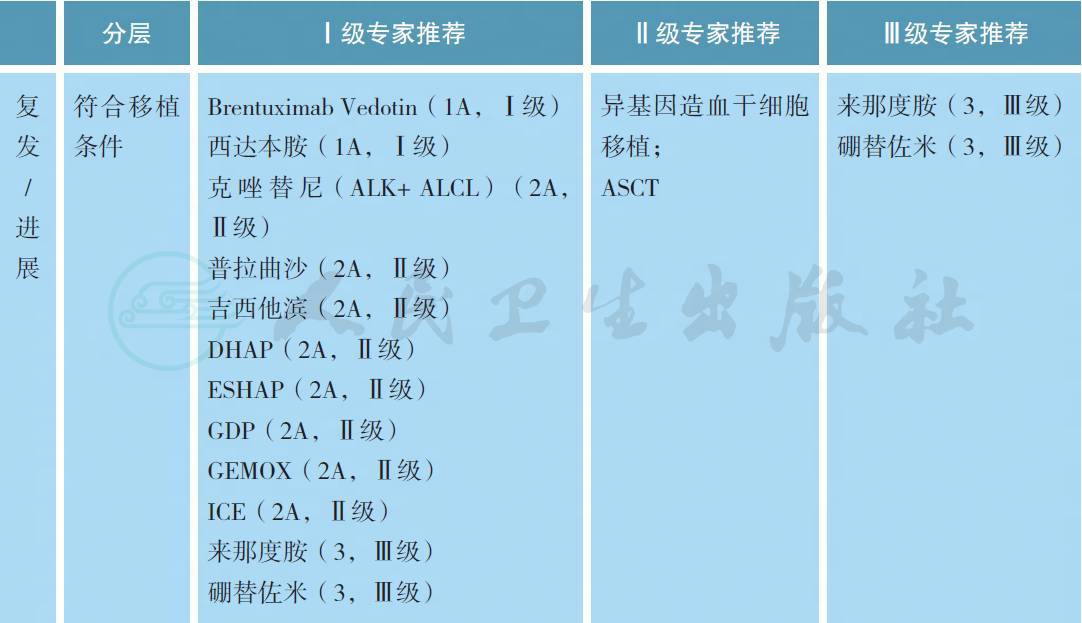
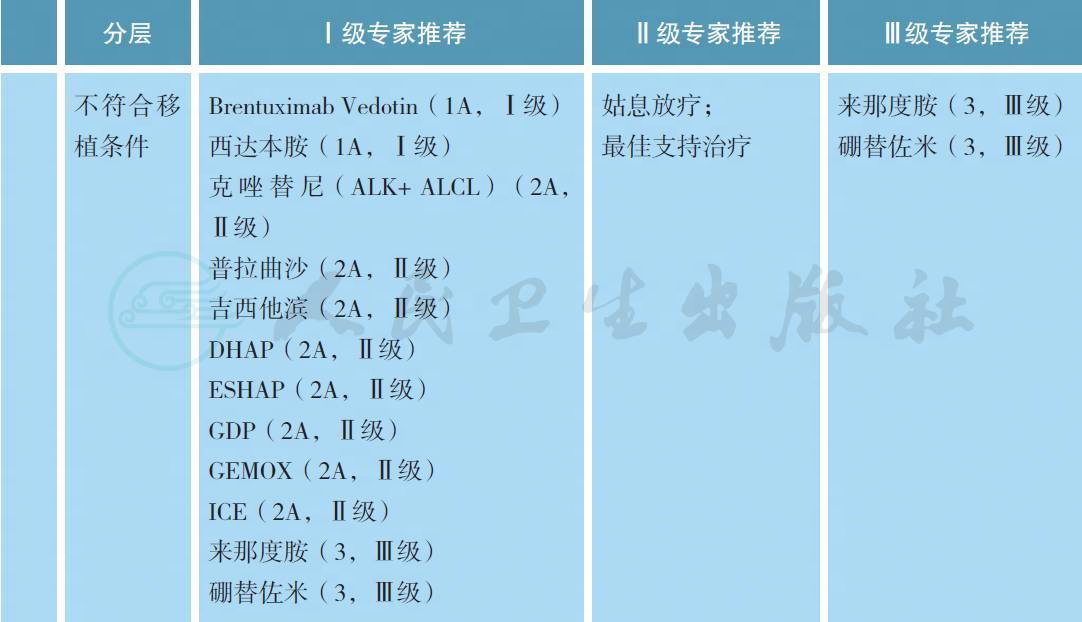
4.2 复发难治患者的治疗
【注释】
(1) 西达本胺方案
西达本胺30mg,口服,每周2 次。
(2) 吉西他滨方案
吉西他滨1200mg/m2 ,d1,d8,d15,每28d 重复。
(3)DHAP 方案
地塞米松40mg/d,d1-4(原方案为该剂量,各中心可酌情调整)
顺铂100 mg/m2,24h 连续输注,d1
阿糖胞苷2g/m2,q12h,d2
每21d 重复。
(4)ESHAP 方案
依托泊苷60mg/m2,d1-4
甲泼尼龙500mg,d1-4
顺铂25 mg/m2,96h 连续输注,d1-4
阿糖胞苷2g/m2,d5
每21d 重复。
(5)GDP 方案
吉西他滨1000mg/m2,d1,d8
顺铂75mg/m2,d1
地塞米松40mg,d1-4
每21d 重复。
(6)GemOx 方案
吉西他滨1000mg/m2,d1
奥沙利铂100mg/m2,d1
每14d 重复。
(7)ICE 方案
异环磷酰胺5g/m2,d2(100%剂量美司钠解救)
卡铂(按照AUC=5 计算,单次剂量≤ 800mg),d2
依托泊苷100mg/m2,d1-3
每21d 重复。
(8) 来那度胺方案
来那度胺25mg,口服,d1-21,每28d 重复。
(9) 硼替佐米方案
硼替佐米1.3mg/m2,d1,d4,d8,d11,每21d 重复。
多个研究证实部分挽救化疗方案在复发难治PTCL 患者中的作用,但没有前瞻性对照研究证实哪种方案更优。一些新药的出现为这部分患者带来希望。Brentuximab Vedotin(BV) 是CD30 单克隆抗体与MMAE 结合的抗体耦合药物,长期随访结果证实BV 在复发难治系统性ALCL 中可维持疗效[12],并且在CD30 阳性NHL 中也有效[13]。西达本胺是一种新型口服组蛋白去乙酰化酶抑制剂,研究结果显示其可改善复发难治PTCL 患者的生存[14]。普拉曲沙通过抗叶酸发挥抗肿瘤作用,Ⅱ期研究结果显示能够改善既往接受多种化疗方案治疗患者的生存[15]。免疫调节剂来那度胺在复发难治PTCL 中也显示初步疗效[16]。小样本量研究认为蛋白酶体抑制剂硼替佐米可能对复发难治PTCL 患者有效[17]。对于敏感复发/ 进展患者,若有合适供者,推荐选择异基因造血干细胞移植(allo-SCT)[18,19]。若无合适供者,可选择自体造血干细胞移植(ASCT)。
[1]李小秋,李甘地,高子芬,等. 中国淋巴瘤亚型分布:国内多中心性病例10002 例分析. 诊断学理论与实践,2012,11(2):111-115.
[2]Swerdlow SH,Campo E,Pileri SA,et al. The 2016 revision of the World Health Organizationclassification of lymphoid neoplasma [J]. Blood,2016,127(20):2375-2390.
[3]The International Non-Hodgkin’s Lymphoma Prognostic Factors Project. A predictive model foraggressive non-hodgkin’s lymphoma. N Engl J Med,1993,329:987-994.
[4]Gallamini A,Stelitano C,Calvi R,et al. Peripheral T-cell lymphoma unspecified (PTCL-U):Anew prognostic model from a retrospective multicentric clinical study. Blood,2004,103:2474-2479.
[5]Went P,Agostinelli C,Gallamini A,et al. Marker expression in peripheral T-cell lymphoma:aproposed clinical-pathologic prognostic score. J Clin Oncol,2006,24:2472-2479.
[6]Savage KJ,Harris NL,Vose JM,et al. ALK-anaplastic large-cell lymphoma is clinically andimmunophenotypically different from both ALK+ ALCL and peripheral T-cell lymphoma,not otherwisespecified:report from the International Peripheral T-Cell Lymphoma Project. Blood,2008,111:5496-5504.
[7]Schmitz N,Trumper L,Ziepert M,et al. Treatment and prognosis of mature T-cell and NK-celllymphoma:an analysis of patients with T-cell lymphoma treated in studies of the German High-GradeNon-Hodgkin Lymphoma Study Group. Blood,2010,116:3418-3425.
[8]Dunleavy K,Pittaluga S,Shovlin M,et al. Phase Ⅱ trial of dose- adjusted EPOCH in untreatedsystemic anaplastic large cell lymphoma. Haematologica,2016,101:e27-29.
[9]d’Amore F,Relander T,Lauritzsen GF,et al. Ten years median follow-up of the NORDICNLG-T-01 trial on CHOEP and upfront autologous transplantation in peripheral T-cell lymphomas[abstract]. Hematological Oncology,2015,33 (Suppl S1):Abstract 074.
[10]Konuma T,Ooi J,Takahashi S,et al. Allogeneic stem cell transplantation for hepatosplenicgammadelta T-cell lymphoma. Leuk Lymphoma,2007,48(3):630-632.
[11]Voss MH,Lunning MA,Maragulia JC, et al. Intensive induction chemotherapy followed by earlyhigh-dose therapy and hematopoietic stem cell transplantation results in improved outcome for patientswith hepatosplenic T-cell lymphoma:a single institution experience. Clin Lymphoma Myeloma Leuk,2013,13(1):8-14.
[12]Pro B,Advani R,Brice P,et al. Four-year survival data from an ongoing pivotal phase 2 study ofbrentuximab vedotin in patients with relapsed or refractory systemic anaplastic large cell lymphoma[abstract]. Blood,2014,124:Abstract 3095.
[13]Horwitz SM,Advani RH,Bartlett NL,et al. Objective responses in relapsed T-cell lymphomas withsingle-agent brentuximab vedotin. Blood,2014,123:3095-3100.
[14]Shi Y,Dong M,Hong X,et al. Results from a multicenter,open-label,pivotal phase Ⅱ study ofchidamide in relapsed or refractory peripheral T-cell lymphoma. Ann Oncol,2015 Aug,26(8):1766-1771.
[15]O’Connor OA,Pro B,Pinter-Brown L,et al. Pralatrexate in Patients With Relapsed or RefractoryPeripheral T-Cell Lymphoma:Results From the Pivotal PROPEL Study. J Clin Oncol,2011,29:1182-1189.
[16]Morschhauser F,Fitoussi O,Haioun C,et al. A phase 2,multicentre,single-arm,open-label study to evaluate the safety and efficacy of single-agent lenalidomide (Revlimid) in subjects withrelapsed or refractory peripheral T-cell non-Hodgkin lymphoma:the EXPECT trial. Eur J Cancer,2013,49:2869-2876.
[17]Zinzani PL,Musuraca G,Tani M,et al. Phase Ⅱ trial of proteasome inhibitor bortezomib in patientswith relapsed or refractory cutaneous T-cell lymphoma. J Clin Oncol,2007,25(27):4293-4297.
[18]Smith SM,Burns LJ,van Besien K,et al. Hematopoietic cell transplantation for systemic mature T-cellnon-Hodgkin lymphoma. J Clin Oncol,2013,31:3100-3109.
[19]Beitinjaneh A,Saliba RM,Medeiros LJ,et al. Comparison of survival in patients with T celllymphoma after autologous and allogeneic stem cell transplantation as a frontline strategy or in relapseddisease. Biol Blood Marrow Transplant,2015,21:855-859.
[20]Zinzani PL,Baliva G,Magagnoli M,et al. Gemcitabine treatment in pretreated cutaneous T-celllymphoma:experience in 44 patients. J Clin Oncol,2000 Jul,18(13):2603-2606.