 去看看
去看看


1.肿瘤患者的痛苦筛查、评估及应答
1.1 背景
美国国立综合癌症网(National Comprehensive Cancer Network, NCCN)痛苦管理指南将痛苦(distress)定义为:是由多种因素影响下的不愉快的情绪体验,包括心理上(认知、行为、情绪)、社会上和(或)灵性层面的不适,可以影响患者有效应对恶性肿瘤、躯体症状、临床治疗。痛苦症状是一个连续谱系,轻者可表现为正常的悲伤、恐惧,重者可表现为精神障碍,如焦虑、抑郁、惊恐发作、社会孤立感,以及生存和灵性的危机[1]。痛苦的产生对于患者躯体及社会功能、家庭生活以及职业和经济造成严重负面影响。另外,严重痛苦或达到精神障碍诊断标准可严重影响患者应对疾病,降低患者对临床治疗的依从性,从而影响患者最终的健康结局。
在2010年中国深圳举行的世界抗癌联盟(Union for International Cancer Control, UICC)大会上,与会代表投票通过了国际心理社会肿瘤协会(International Psycho-Oncology Society, IPOS)提议的治疗标准(http: //www. uicc.org/advocacy/distress-6th-vital-sign-cancer-care), 其中包括建议将痛苦定为第六大生命体征。认识恶性肿瘤患者的痛苦,可以在全世界范围内提高恶性肿瘤患者治疗的结局,提高恶性肿瘤治疗系统的有效性(www. ipos-society.org)。目前多个国家已经将痛苦筛查纳入到肿瘤治疗的相关指南与政府管理规范中,如:英国国家卫生与临床优化研究所(National Institute for Health and Clinical Excellence, NIHCE)[2]将痛苦筛查纳入医疗机构诊疗规范中,作为评估医疗机构是否合格的重要标准,其关键推荐点9(Key Recommendation 9)明确指出:为恶性肿瘤患者提供照顾的人,包括行政人员和医疗服务人员,都应该保证所有的恶性肿瘤患者在病程中的关键时刻能够接受系统的心理评估,并且能够获得合理的心理支持。NCCN痛苦管理指南强调痛苦筛查在患者首次就诊时就应该完成,并且间隔一定时间后要及时重新筛查,尤其当疾病状况发生变化时应该再次评估痛苦(如疾病复发、进展或者出现治疗相关的反应时)。美国医学研究所(Institute of Medicine, IOM)出版的Cancer Care for the Whole Patient: Meeting Psychosocial Health Needs一书[3]建议关注肿瘤患者精神心理需求,对痛苦进行常规筛查、转诊和治疗。美国外科医生协会肿瘤委员会(American College of Surgeons’ Commission on Cancer)自2015年起,将痛苦筛查作为考核肿瘤中心的一项指标,其肿瘤治疗规范中指出所有肿瘤患者在疾病的关键时间点就诊时至少应接受一次痛苦筛查[4]。加拿大安大略省的姑息治疗整合项目(Provincial Palliative Care Integration Project, PPCIP)将综合痛苦评估纳入其中,建议患者门诊进行症状和心理痛苦筛查,筛查同时给予积极应答并转诊和治疗。
1.2 证据
肿瘤临床有关痛苦筛查的效果由于缺少严格的、高质量的随机对照临床试验(randomized controlled trials, RCTs),因此对于指南推荐进行痛苦筛查,国外学者存在
[5]一定争议。Meijer等2013年发表的一篇系统回顾纳入了14个痛苦干预的RCTs试验,以及1项有关痛苦筛查效果的RCTs研究,结果显示针对痛苦的各种干预措施效果为小到中等效果,而筛查效果的RCTs研究显示其并未对患者的心理社会相关结局带来改善,由此认为实施常规痛苦筛查证据尚不充分。
在当年同一杂志,Bultz及Carlson等对Meijer的系统回顾给予评述[6],痛苦筛查是建立在痛苦的患病率基础上的,痛苦体现在躯体、心理、实际问题等多个领域,且痛苦筛查项目都包含所有涉及痛苦领域的评估和分级,而该文章反对广泛的筛查显然结论不严谨;另外,该系统回顾纳入研究条件过度严格,所有在痛苦相关领域的筛查研究都应该纳入其中,并且有且只有一篇有关痛苦筛查效果的RCTs研究,因此该结论也有所偏颇。
2004年Velikova等[7]发表的一篇RCTs研究,纳入28名肿瘤科医生、286名恶性肿瘤患者,对比在肿瘤临床常规筛查(包括焦虑、抑郁在内的生活质量筛查)能够提高沟
[8]通水平以及患者的整体状态。2010年Carlson等 发表的一篇对于肺癌(N=549)及乳腺癌(N=585)患者进行痛苦筛查的RCTs研究显示,接受全面痛苦筛查及分级的肺癌组患者,比其他组在随访时高痛苦水平的比例低;接受全面痛苦筛查及分级的乳腺癌患者与简单痛苦筛查组相比,其痛苦水平较低;在筛查过程中,患者焦虑、抑郁降低的预测因素是接受心理社会服务转诊。因此,推荐在大的肿瘤中心进行常规痛苦筛查以帮助患者降低痛苦水平。
Chen等[9]2013年发表的一篇系统综述显示,患者报告结局(patient reported outcome, PRO)的评估可以显著增强医患沟通及患者对治疗的满意度,同时可以提高工作人员对患者临床治疗反应的监测,有助于察觉未被发
[10]现的问题;2014年Kotronoulas等 的系统综述得到与上述研究一致的结果,对PRO的评估可以提高医患双方在医疗沟通过程中对疾病症状的讨论;而在PRO评估过程中,痛苦相关的问题,如躯体、心理、社会以及实际问题等等占据了非常重要的内容。
Mitchell等[11]的一篇综述指出,到2013年为止,有关痛苦筛查效果的RCTs研究共14项,其中6项研究结果显示痛苦筛查可以提高患者的总体状况,3项结果显示痛苦筛查可以带来促进医患沟通等其他获益,其中5项研究未显示获益。Carlson等[12]2012年发表于Journal of Clinical Oncology的一篇综述指出,痛苦筛查可以促进患者和临床医生的沟通,进而提高转诊率;尽管还没有直接证据显示筛查能够提高患者的生活质量,但是通过筛查可以促进患者与临床医生讨论生活质量相关的问题,因此建议对一线临床医生及相关人员进行痛苦筛查培训,从而有效实施痛苦筛查。
肿瘤患者的痛苦引起越来越多人的注意,它是认识肿瘤患者心理社会问题的窗口,临床工作人员对于痛苦的识别缺少专业培训,而识别率低是导致患者不能得到有效、合理干预和支持的最主要阻碍因素。Fallowfield等进行一项143位临床门诊医生对2297位恶性肿瘤患者心理状况的评估情况调查发现,临床医生的误诊率为34.7%[13];痛苦筛查能够为临床工作人员提供简单、快捷的识别工具,从而及时将患者转诊到心理社会服务部门。痛苦筛查给临床带来的获益需要从众多方面考虑,而不仅仅是患者的生活质量,也应该包含临床工作人员的获益。痛苦筛查的具体实施方法也是要考虑的一项内容,必须考虑到患者的需求、工作人员的负担以及对筛查效果的影响。Velikova等[14]进行的一项随机交叉试验,将电脑触屏问卷(N=81)与纸版问卷(N=149)进行对比,结果显示电脑触屏问卷更容易被恶性肿瘤患者接受,且数据质量及信度更好。筛查之后对患者所显示情况给予合理应答是系统筛查工作必不可少的一项内容,Mitchell [11]等 指出痛苦筛查成功的关键在于患者在筛查过后是否
[15]获得了妥善的帮助;Carlson等 开展了的一项大样本的随机对照试验,比较单纯电脑方案和个性化方案的筛查效果,结果显示两种方案均能减轻患者的焦虑、抑郁、疼痛、疲乏等症状,但是接受个性化筛查方案以及症状负担较重的患者更倾向于寻求帮助。所谓个性化筛查方案指筛查程序包括电脑问卷测试、患者获得打印的测试结果和指导建议,以及工作人员在拿到患者测试结果后的3个工作日内与患者取得联系,并讨论有关转诊事宜。
综上所述,尽管痛苦筛查效果的研究结论并非完全一致,但呈现积极效果的研究占据多数,我们有理由提出患者未能满足的需求以及患者报告结局,仍然值得引起专业人员的关注;给予系统的筛查、评估以及后续的合理应答是保证痛苦筛查成功的关键。
1.3 肿瘤临床痛苦筛查工具选择
很多重要的研究报道了关于痛苦筛查工具的使用情况,目前筛查工具分为三大类:①症状筛查;②心理社会问题筛查;③痛苦来源筛查。IOM建议[3]痛苦筛查工具应该能够综合识别引起痛苦的各种问题和担忧。所选筛查工具应该有效、稳定,并且对于临床工作人员来说简便易行,可以通过临界值来判断患者是否存在痛苦;能够同时评估患者是否存在躯体症状、情绪负担、社会问题等等,且能评估患者上述症状的严重程度,这样能够动员其他专业的人员有效地对患者的痛苦状况作出应答,包括将痛苦且有心理社会支持需求的患者转诊给专业的心理治疗师、精神科医生、社工等等。
1.3.1 躯体症状痛苦筛查的工具及方法
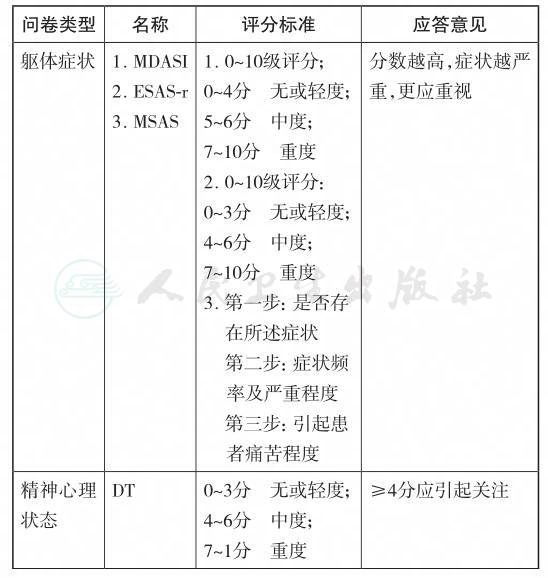
M.D.Anderson症状量表(M.D.Anderson Symptom Inventory,MDASI)由Cleeland等于2000年制订[16],是针对患者报告结局的多维度筛查工具。MDASI包含13个条目,每个条目分成0~10分11个评分等级,同时还将症状对患者日常生活造成的影响纳入筛查条目中,适用于不同恶性肿瘤类型患者的筛查。目前该评估量表已经被翻译为多个国家语言,且其测量学的信度和效度均已得到证实[17,18]。Aktas等对比了57个关于恶性肿瘤患者症状筛查的工具,其中包括埃德蒙顿症状评估系统(Edmonton Symptom Assessment System, ESAS)、医院焦虑抑郁量表(Hospital Anxiety and Depression Scale, HADS)、心境状态量表(Profile of Mood States, POMS)、症状痛苦量表(Symptom Distress Scale, SDS)、MDAS(I俄语版)、MDAS(I繁体中文版)、纪念斯隆凯瑟琳恶性肿瘤中心症状评估量表(Memorial Symptom Assessment Scale, MSAS),结果显示从测量学角度考虑,MDASI是最好的,其次是ESAS/POMS/SDS[19]。2004年Wang等完成了中文版MDASI的翻译,测量学研究提示中文版MDASI在中国恶性肿瘤患者症状筛查中应用有效,且评估结果稳定可信,5~6分为中度,7分及以上为重度[18]。
纪念斯隆凯瑟琳恶性肿瘤中心症状评估量表(Memorial Symptom assessment Scale, MSAS)由Portenoy在1994年制订[20],包含32个躯体及心理症状,其中24条症状需评估症状的频率,严重程度和引起痛苦的程度,另外8条症状仅需评估严重程度和引起痛苦的程度;首先要评估每一条症状是否存在,如果存在,使用1~4分分级标准评估患者症状出现频率和严重程度,引起痛苦的程度使用0~4分的5级评分标准。2009年Karis等将MSAS翻译为中文,并在中国香港的中国恶性肿瘤患者中应用,测量学结果显示中文版MSAS具有较好的信度和效度,可以用于中国恶性肿瘤患者症状筛查[21]。但由于该量表条目较多,完成量表时间较长,对于临床工作带来一定工作负担,目前在中国内地使用较少。
埃德蒙顿症状评估系统(Edmonton Symptom Assessment
[22] System,ESAS)于1991年由Bruera等人制订 ,包含9个条目,采用0~10分11级评分标准,得分越高,症状越严重。ESAS已经广泛用于肿瘤患者的症状评估,被翻译成30多个国家的语言,信度和效度等也得到验证。其在临床应用的优势在于可以短时间内对患者的躯体及情绪症状进行多维度评估。根据研究报道呈现出的ESAS的问题,Edmonton姑息治疗项目组再次将ESAS进行了修订,即为ESAS-r—其中指导语中评估时间限定为“目前”,对于容易引起困惑的症状给予了简短的解释。Watanabe等对1991—2006年间发表的有关ESAS效度相关研究进行综述,并且对ESAS及ESAS-r进行了对比,多中心研究结果显示患者对ESAS-r较ESAS更容易理解[23]。2015年Dong等首次进行ESAS在中国患者中应用的效度和效度研究[24],结果显示ESAS中文版有较好的内部一致性、重测信度及共时效度。
1.3.2 心理社会痛苦筛查的工具及方法
美国国立综合癌症网(The National Comprehensive Cancer Network,NCCN)推荐的痛苦温度计(Distress Thermometer,DT)是一个单条目的痛苦自评工具[25]。0分=没有痛苦,10分=极度痛苦;得分≥4分显示患者存在中度到重度痛苦,需要进一步专科评估。Akizuki等将DT与综合医院焦虑与抑郁量表(HADS)和贝克抑郁量表进行了比较,结果显示DT比HADS和贝克抑郁量表对心理痛苦的敏感度和特异性都高[26]。近年来不断有对心理痛苦温度计效度研究的报道,Tang等[27]将DT进行了中文版修订,与综合医院焦虑抑郁量表(Hospital Anxiety and Depression, HADS)和90条症状清单(Symptom Checklist-90, SCL-90)比较,使用工作者特征曲线(receiver operating characteristics, ROC)得到曲线下面积分别为0.803和0.834,临界值取4分是能得到最优的敏感度和特异性。Mitchell AJ等[28]2010年发表的一篇综述对45个短或超短评估工具进行了分析,其中6个工具效度得到验证,包括HADS、DT、单一条目的口头问题、心理痛苦问卷(Psychological Distress Inventory, PDI)、联合DT与影响温度计(Impact Themometer)、联合2个条目的口头问题;结果显示6个工具的准确性相当,但从可接受性及费用—效率方面考虑,DT及单一条目的口头问题获得了最佳证据支持,尤其适用于繁忙的肿瘤临床工作中进行初步筛查。
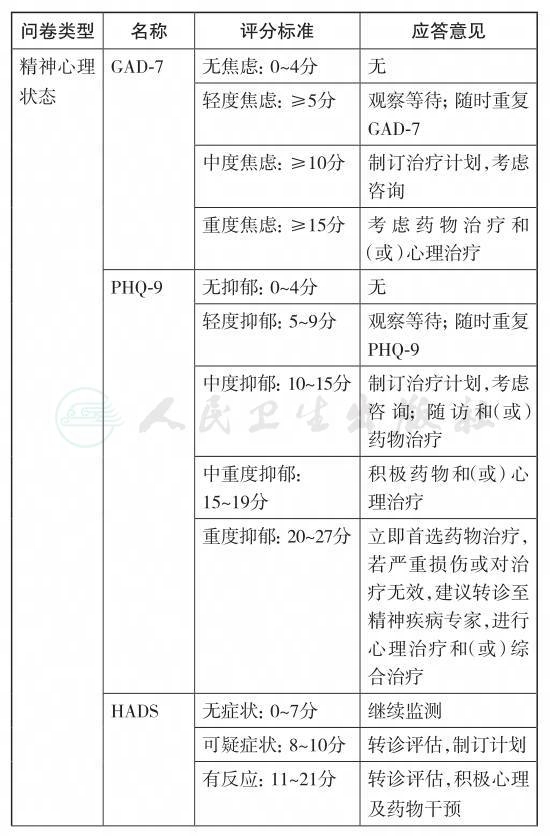
医院焦虑抑郁量表(Hospital Anxiety Depression Scale, HADS)由Zigmond与Snaith于1983年制订[29]。目前此量表广泛应用于综合医院患者焦虑和抑郁情绪的筛查以及心身疾病的研究中,其信度和效度也已经得到了验证。按原作者推荐标准,焦虑抑郁亚量表分:0~7分为无表现;8~10分属可疑;11~21分属有反应。HADS包括两部分,共14个条目,其中焦虑亚量表7个条目,抑郁亚量表7个条目,每条分4级计分(0、1、2、3分)。国内常用的中文版医院焦虑抑郁量表是由叶维菲等在1993年翻译并校对[30],在我国综合医院患者中应用显示以9分为分界点时,焦虑和抑郁分量表敏感度均为100%,特异性分别为90%和 100%,郑磊磊等的研究与上述结果基本吻合[31]。
广泛性焦虑自评量表(General Anxiety Disorder-7, GAD-7)和9条目患者健康问卷(9-item Patients Health Questionnaire, PHQ-9)是对患者精神障碍的初级自我评估,广泛应用于初级医疗机构对于精神健康状况的筛查。PHQ-9是根据美国精神障碍诊断与统计手册,第4版有关抑郁症状的条目设计的9个条目的自评量表,每个条目评分0~3分。量表制订者建议其轻度、中度及重度的临界值分别为≥5分,≥10分和≥15分[32]。一项大样本的门诊恶性肿瘤患者研究显示,将10分设定为临界值能得到最优的敏感度和特异性[33]。国内对于PHQ-9的研究分别在中医内科、老年人群以及综合医院人群中应用证实有较好的信度和效度,但所得出的临界值存在差异,中医内科及综合医院患者研究推荐10分为临界值[34],而老年人群研究结果显示15分为临界值[35]。目前PHQ-9在肿瘤患者中应用的测量学数据有待进一步证实。GAD-7常与PHQ-9联合使用,包含7个条目,每个条目评分为0~3分;制订者推荐≥5分,≥10分和≥15分分别代表轻、中和重度焦虑[36]。我国综合医院门诊患者研究推荐10分为临界值有[37],仍然缺乏在我国肿瘤患者中应用的测量学检验数据。PHQ-9中条目9“您是否有不如死掉或用某种方式伤害自己的念头?”可以用于对患者自杀观念的筛查。肿瘤患者的自杀观念与心理痛苦,持续的疼痛以及年龄较大相关[38]。自杀筛查和评估是发现患者自杀观念最直接的方式,可以有助于降低患者自杀的比例和带来的后续负面影响[39,40]。
1.3.3 痛苦来源的筛查
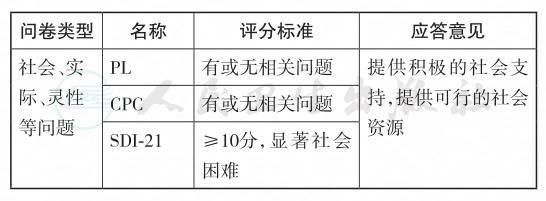
NCCN推荐使用的DT中包含问题列表(problem list, PL),包括围绕肿瘤患者出现的5个主要方面的问题:①实际问题(经济、照顾家庭、交通等等);②交往问题(与家属、朋友、邻居、医护人员等的沟通);③情绪问题(悲伤、注意力不集中、失眠等);④躯体问题(便秘、恶心、呕吐等常见临床症状);⑤宗教信仰问题。研究显示PL与DT得分密切相关[41],是DT在筛查痛苦程度之外的有效补充,且PL对于中重度痛苦患者转诊起到了重要的指导作用。
加拿大问题列表(Canadian Problem Checklist, CPC)包含6个方面内容:①情绪问题(害怕、担心);②实际问题(工作、经济);③信息问题(了解疾病、治疗决策);④灵性问题(生活意义、信念),⑤家庭问题(孤独、担心成为负担等),⑥躯体问题(记忆、睡眠、体重等)[42],该量表是在PL基础上根据加拿大临床实际情况修订而成,可以作为症状量表的有效补充,并探索引起患者痛苦的具体因素。
近年来,研究者多倾向于通过多维度的方式对痛苦进行常规筛查,如加拿大玛嘉烈公主恶性肿瘤中心制订了痛苦评估及应答工具(distress sssessment and response tool, DART),是一个电子版的多维度综合评估工具,包括问卷ESAS, PHQ-9, GAD-7,社会困难问卷(The Social Difficulties Inventory, SDI-21),加拿大问题列表(Canadian Problem Checklist, CPC)的信息和灵性量表部分。该评估系统已被纳入医院的日常诊疗体系,肿瘤患者每次就诊均进行ESAS评估,每2~3个月复诊时进行全套的DART评估。Li等对玛嘉烈公主恶性肿瘤中心近3年的DART实施情况进行评估,70%以上的患者接受的DART,结果显示DART有助于提高工作人员对工作的满意度、团队合作能力、医患沟通能力,有助于提高患者对医疗的满意度以及临床工作中患者的心理社会需求得到更多关注[43]。
社会困难指对一个人的社会世界造成困扰的事件或问题,包括生活中、工作中、娱乐活动中以及与他人的关系中出现的问题。所有人都会遇到社会困难。恶性肿瘤患者的社会困难涉及恶性肿瘤患者本人、恶性肿瘤疾病本身及治疗相关因素,致残的程度、患者本人的当前状况、恶性肿瘤治疗中所有人的情绪反应以及对于患者来说可行的支持网络等[44]。Cull等对英国505名恶性肿瘤患者以及51名接受转诊至心理社会相关机构的恶性肿瘤患者进行调查,结果显示社会困境在严重的情况下可加重患者的心理痛苦,降低患者整体生存状况[45]。Wright等[46]2005年制订了社会困难问卷(The Social Difficulties Inventory-21, SDI-21),此问卷共21个条目,每个条目分别从“0分—无困难”到“3分—非常困难”进行评分,包括3个经过效度检验的分量表:日常生活、经济问题、自我及周围其他人,总分≥10分提示显著社会困难。Leung等[47]应用SDI-21对4822名加拿大恶性肿瘤患者进行筛查,通过广义估计方程(generalized estimating equation, GEE)结果显示社会困难中的日常生活出现困难与患者的自杀企图密切相关,因此对恶性肿瘤患者社会困难的评估更应该引起临床工作人员的关注。
1.4 推荐意见
1.4.1 肿瘤临床工作人员应该保证为所有的肿瘤患者进行痛苦筛查,尽可能每次就诊应该进行痛苦筛查,至少在病程的关键时间点应该给予痛苦评估(强烈推荐,中等质量证据)。建议对患者的痛苦情况进行综合评估,推荐量表(表6-1)。
表6-1 综合痛苦筛查的工具选择
续表
续表
1.4.2监测患者在整个病程中痛苦变化的情况(强烈推荐,低质量证据)。
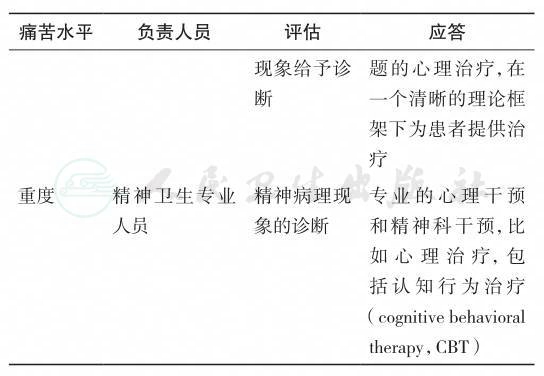
1.4.3 对于存在显著痛苦的患者,需给予及时应答,包括肿瘤临床工作人员的积极心理社会支持以及转诊至专业的心理治疗师及精神科医生;临床工作人员或参与筛查的工作人员在得到患者的筛查结果后应尽快给予回复并讨论转诊事宜(强烈推荐,中等质量证据)。推荐使用四级评估及应答模型(表6-2)。
表6-2 痛苦应答流程
续表
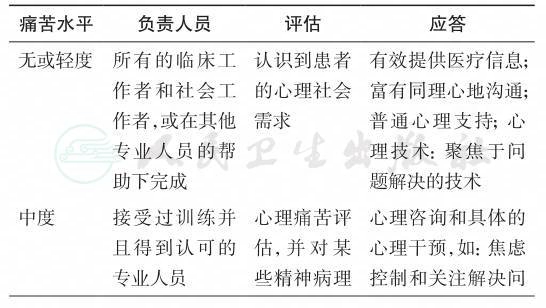
(1)痛苦水平—轻度
(所有筛查量表按推荐标准评分均为轻度)
1)人员:
包括直接为恶性肿瘤患者提供治疗的所有工作人员,或在专业人员帮助下完成,干预措施主要为普通的心理支持,或聚焦于问题解决的心理治疗技术。
2)评估:
所有直接为恶性肿瘤患者提供治疗的医务人员和社会工作者都应该有能力识别患者的心理痛苦,并且有能力避免在临床治疗中造成对患者及其照顾者的心理伤害。他们应该知道患者出现的哪些情况已经到了自己能力的边界,并且应该转诊给更专业的服务机构。筛查应该包括恶性肿瘤给患者日常生活、情绪、家庭关系(包括性关系)和工作带来的影响。评估过程应该保持开放并且不带有任何判断,这样才能建立相互信任的关系并认真倾听,最终使患者能够清晰地呈现自己的担忧和其他感受;评估本身能够帮助患者解决一些担忧,如果通过评估不能解决,则要为患者提供适宜的心理支持。出现显著心理痛苦的患者需要转诊接受专业的心理支持和干预。
3)应答:
所有人员应该能够做到以下几点:①诚实并富有同理心地与恶性肿瘤患者进行沟通(具体沟通技巧见第五章:医患沟通与告知消息);②带有仁慈之心、尊严感、尊重心态为患者及其照顾者提供治疗;③建立并保持支持性的医疗关系;④告知患者及其照顾者,有很多心理及支持性的服务机构可供使用;⑤心理技术主要聚焦于解决问题。由经过培训且受过督导的医疗和社会工作者提供,帮助患者处理一些在病程关键时刻的紧急情况。专业的临床护士在接受培训之后可以承担评估和提供干预的任务。
(2)痛苦水平—中度
(筛查量表按推荐标准评分其中一项及以上为中度,所有量表均未达到重度)
1)评估:
接受过心理社会干预培训并获得认可的专业人员能够识别中度到严重的心理需求,并能够将严重心理需求的患者转诊至精神卫生专业人员处。
2)应答:
痛苦水平中度所涉及的具体心理干预技术有焦虑控制和聚焦问题解决的心理治疗。由接受过培训、获得认可并且被督导过的心理咨询师根据清晰的理论框架提供干预。目标是控制轻度到中度心理痛苦,包括焦虑、抑郁和愤怒。这里的具体心理干预也适用于缓解轻度恶性肿瘤相关的担忧,比如对治疗的担忧、个人关系(包括性关系)、与医院工作人员的关系、灵性问题等等。
(3)痛苦水平—重度
(筛查量表按推荐标准评分有一项以上为重度)
1)评估:
精神卫生专业人员应该能够评估复杂的精神心理问题,包括严重的情感障碍、人格障碍、物质滥用和精神病等。
2)应答:
痛苦水平重度所涉及的干预包括具体的心理和精神科干预,由精神卫生专业人员提供,帮助患者改善中到重度的精神健康问题。这些精神健康问题包括重度抑郁和焦虑、器质性脑部综合征、严重的人际困难(包括严重的性心理问题)、酒精和物质相关的问题、人格障碍和精神病等。
2.如何进行转诊
2.1 背景
显著的心理痛苦或精神症状会对恶性肿瘤患者的生活质量造成影响,需要对其进行干预。然而,目前临床中对患者的焦虑抑郁情绪等心理痛苦识别率较低,其中能够接受恰当干预的患者数量更不为乐观。这一方面是源于临床医生对于心理及精神症状方面知识的缺失,另一方面是由于医生和患者倾向于回避情感问题的揭露[48,49]。在这样的背景下,建立一个最优化的转诊方式对于肿瘤患者非常重要。所有的临床以及心理社会肿瘤学医生都应该建立自己的转诊体系,来为他们的患者提供心理支持和关怀。
在许多发达国家和地区,他们的治疗团队往往包括精神科医生、临床心理师、社会工作者。大多数肿瘤科设置了具有丰富专业知识和经验的社工,能够为患者提供咨询服务,同时也有越来越多的肿瘤中心开始聘请专业的心理治疗师,使患者能够便捷地接受到适当的干预,而精神科医生则能为肿瘤患者诊治过程中出现的精神症状提供及时治疗。
2.2 证据
2.2.1 转诊对象
有证据表明,使用快速筛查工具识别患者是否存在显著心理痛苦以及患者心理支持需求是确定转诊对象的重要方法。NCCN指南推荐每一位患者都应在就诊前使用心理痛苦温度计,来帮助临床医生发现其心理痛苦程度[50]。国内学者亦对心理痛苦温度计在中国的适用进行
[51]了研究,证实了其能有效应用于我国肿瘤患者 。研究认为对于DT得分≥4分或存在显著中到重度心理痛苦的患者,临床医生或护士应对其进行进一步的评估,并在必要时向专业的精神心理机构转诊。而对于DT得分在4分以下或存在轻度心理痛苦的患者,可由肿瘤临床医护人员继续观察,并努力发掘患者身边可利用的支持性资源,如亲人、朋友等,帮助他们缓解痛苦。一项来自英国的研究者Elena A等的研究中[52],130名肿瘤患者在进行第一次化疗前参与研究,接受HADS、PHQ-9及PHQ-2测评,并用“是”“否”来回答“现阶段您是否需要情感及心理社会方面的帮助”,结果显示,仅有36.7%存在心理痛苦的患者表示需要帮助,而有90.1%并未显示存在心理痛苦的患者表示需要接受帮助。该项研究在患者治疗进程中的相同时间点使用多种测评工具评估患者心理痛苦,使得结果较为可靠,但研究样本量较小,且纳入患者的肿瘤分期有所差异,研究结论并不适用于所有患者。但我们可从结论中看出,若仅对患者的心理痛苦筛查,可能会遗漏部分真正需要得到心理干预的患者。患者是否存在心理痛苦和心理需求的程度也是患者是否接受心理转诊的重要影响因素。
2.2.2 转诊方式
患者向精神心理服务转诊的主要方式为医护人员建议转诊和患者自行转诊。
H. Ryan[53]在一篇研究综述中指出,患者一般会通过直接和间接两种方式给出他们的情绪线索,直接的情绪线索是指患者口头陈述他们内心的担忧,而间接线索则通过一些非语言的途径来表达,对于一些没有经过培训的临床医生来说,要识别这些间接的线索并不容易,需要医生敏锐地从患者的姿势、动作等躯体语言以及语气、语调等中捕捉更多的信息。同时,良好的医患关系也尤为重要,临床医生应该得到更多沟通技巧方面的培训,这能使他们在会谈中对患者的情绪和感受投以更多的关注,也为患者营造一个安全的、让他们能够无顾忌地表达内心感受的环境。Jenkins等[54]将93名临床医生随机分为两组,对干预组医生进行三天的医患沟通训练,在干预前及干预后三个月进行测评,了解参与者的对患者心理社会状况的态度,同时在这两个时间点用录音记录参与者与患者的医患沟通过程。结果表明,干预组医生对患者心理社会问题的关注度要显著高于对照组,在沟通中能对患者表达出更多的共情。研究指出,对医护人员进行培训,帮助他们识别患者就诊过程中的情绪问题,有效地提高转诊率。主动倾听、开放性地提问,对患者的情绪线索作出适当回应都有助于精神心理症状的识别,更有助于为患者提供有效地心理社会干预。但尚无高质量随机对照研究表明,精神心理及医患沟通培训对转诊的积极作用。
同时,在一项由Joo-Young Lee[55]主导的研究中,患者可以基于自己的意愿接受电子化的心理痛苦筛查,得到自动生成的评估报告,经过相关培训的肿瘤科医生根据评估结果在诊室中决定是否为患者提供转诊建议,有转诊、不转诊、延迟决定三种选择。研究结果显示,在达到指南推荐的标准、需要接受转诊的患者中,仅有18.2%得到了转诊,且心理痛苦水平与患者接受转诊的意愿呈显著正相关。考虑到研究中肿瘤科医生转诊是唯一的转诊方式,而转诊工作或许会给本已超负荷的肿瘤科医生增加更多工作量。研究者认为,为患者建立便捷通道,使有需要的患者能够自行进行转诊尤为重要。
国外一项肿瘤患者精神心理服务转诊模式的研究,对361名接受转诊的患者进行调查[56],其中48%的患者由医护人员提供转诊,42%的患者为自行转诊而来,另有4%的患者来自于社会工作者的转诊。我国亦有部分医院已经开始进行社工制度的探索,但目前尚不成熟,在未来,若社会工作者制度逐步健全,也可提高肿瘤患者的精神心理服务转诊率。
2.2.3 依从性
有证据指出,治疗依从性是影响患者转诊后心理干
[57]预效果的重要因素,在一项澳大利亚的研究中 ,研究者希望了解为肿瘤患者提供有针对性的心理社会干预能否满足患者需求,提高患者生活质量和对医疗服务的满意度。在完成电子化的问卷后,450名患者被随机分为干预组和实验组,志愿者能够看到干预组患者的评估结果,并为患者提供支持和转诊服务,在2个月和6个月后进行第二次和第三次评估,但两组患者并未呈现出差异。研究者认为,这一结果的原因在于患者并未接受志愿者的建议,接受转诊治疗。遗憾的是,本结论仅来源于推测,尚无研究直接印证依从性对于干预效果的影响。而一项META分析的结果提示[58],在电话咨询的干预形式中,患者对干预的依从性要好于面对面咨询,患者对由护士提供的心理干预的依从性,要优于由心理治疗师提供的干预,这一现象的主要原因是心理治疗师进行干预往往容易使患者产生病耻感(stigma)。然而,由护士提供的心理干预在具有较好依从性同时也存在一定的风险,Zimmermann等在一项对乳腺癌患者适合何种心理干预
[59]的META分析中 ,对56项RCTs研究进行分析,涉及心理治疗师、护士及社会工作者三种心理干预实施者,结果表明心理治疗师提供的心理干预,在治疗效果上要显著好于由护士提供的干预。Jane等在一项随机对照研究的研究报告提出了一种转诊模式[60],即由受过精神心理专业训练的护士为有心理支持需求的患者提供简单的心理干预,为存在持续性心理痛苦和复杂性心理支持需求的患者提供转诊,研究者认为此种模式的效果及依从性都将好于直接向心理治疗师和精神科医生转诊。但此种模式的随机对照研究仍在研究阶段,尚无证据支持。
2.3 推荐意见
2.3.1 我们推荐肿瘤科临床医生在初诊时对患者进行心理痛苦筛查和心理支持需求评估,为存在中重度心理痛苦和(或)强烈心理支持需求的高危患者提供转诊,接受由精神科医生和心理治疗师专业的精神治疗或心理干预,对存在轻度心理痛苦和(或)心理支持需求较弱的患者,可由护士、社会工作者等为其提供情感支持。(强烈推荐,中等质量证据)
2.3.2 我们建议肿瘤临床医护人员接受专业培训,以更好的识别患者在诊疗过程中的情绪线索,为患者提供及时有效的转诊。(强烈推荐,高等质量证据)
2.3.3 我们建议由接受过精神心理培训的护士为有心理支持需求的患者提供简单的基础心理干预,为存在持续性心理痛苦和复杂性心理支持需求的患者提供精神心理转诊。(弱推荐,低质量证据)
1.American Cancer Society & National Comprehensive Cancer Network. (2005). Distress Treatment guidelines for patients Version II/July 2005. Retrieved October 3, 2005, Available from http: //www. nccn. org/ patients_ gls/_ english/_distress/contents. aps
2.National Institute for Clinical Excellence(2004). Guidance on cancer services improving supportive and palliative care for adults with cancer. London: National Health Service.
3.Adler NE, Page AEK, eds. Institute of Medicine. Cancer Care for the Whole Patient: Meeting Psychosocial Health Needs. Washington, DC: The National Academies Press, 2008.
4.American College of Surgeons’ Commission on Cancer(2015). Cancer Program Standards: Ensuring Patients-Centered Care. Chicago, IL.
5.Anna Meijer, Michelle Roseman, Vanessa C, et al. Effects of screening for psychological distress on patient outcomes in cancer: A systematic review. Journal of Psychosomatic Research, 2013, 75: 1-17.
6.Barry D. Bultz, Linda E. Carlson . A commentary on effects of screening for psychological distress on patient outcomes in cancer: A systematic review. Journal of Psychosomatic Research, 2013, 75 : 18-19.
7.Galina Velikova, Laura Booth, Adam B. Smith, et al. Measuring Quality of Life in Routine Oncology Practice Improves Communication and Patient Well-Being: A Randomized Controlled Trial. J Clin Oncol, 2004, 22: 714-724.
8.Linda E, Carlson, Shannon L. et al. Screening for Distress in Lung and Breast Cancer Outpatients: A Randomized Controlled Trial. J Clin Oncol, 2010, 28: 4884-4891.
9.Jack Chen, Lixin Ou, Stephanie J Hollis. A systematic review of the impact of routine collection of patient reported outcome measures on patients, providers and health organisations in an oncologic setting. BMC Health Services Research 2013, 13: 211.
10.Kotronoulas G, Kearney N, Maguire R, et al. What is the value of the routine use of patient-reported outcome measures toward improvement of patient outcomes, processes of care, and health service outcomes in cancer care? A systematic review of controlled trials. J Clin Oncol, 2014 , 32(14): 1480-1501.
11.Alex J, Mitchell. Screening for cancer-related distress: When is implementation successful and when is it unsuccessful? Acta Oncologica, 2013, 52: 216-224.
12.Carlson LE, Waller A, Mitchell AJ. Screening for distress and unmet needs in patients with cancer: review and recommendations. J Clin Oncol, 2012 , 30(11): 1160-1177.
13.Fallowfield L, Ratcliffe D, Jenkins V, et al. Psychiatric morbidity and its recognition by doctors in patients with cancer. Br J Cancer, 2001, 84: 1011-1015.
14.G. Velikova EP, Wright AB, Smith, et al. Automated Collection of Quality-of-Life Data: A Comparison of Paper and Computer Touch-Screen Questionnaires. Journal of Clinical Oncology, 1999(1), 998.
15.LE Carlson, A Waller, SL Groff, et al. Online screening for distress, the 6th vital sign, in newly diagnosed oncology outpatients: randomised controlled trial of computerised vs personalised triage. British Journal of Cancer, 2012, 107: 617-625.
16.Cleeland CS, Mendoza TR, Wang XS, et al. Assessing symptom distress in cancer: The M. D. Anderson Symptom Inventory. Cancer, 2000: 1634-1646.
17.Guirimand F, Buyck JF, Lauwers-Allot E, et al. Cancer-related symptom assessment in France: validation of the French M. D. Anderson Symptom Inventory. J Pain Symptom Manage, 2010, 39(4): 721-733.
18.Wang XS, Laudico AV, Guo H, et al. Filipino version of the M. D. Anderson Symptom Inventory(MDASI-F): Validation and multisymptom measurement in cancer patients. J Pain Symptom Manage, 2006, 31(6): 542-552.
19.Aktas A, Walsh D, Kirkova J. The psychometric properties of cancer multisymptom assessment instruments: a clinical review. Support Care Cancer. 2015, 23(7): 2189-2202.
20.Portenoy RK, Thaler HT, Kornblith AB, et al. The Memorial Symptom Assessment Scale: an instrument for the evaluation of symptom prevalence, characteristics and distress. Eur J Cancer, 1994, 30(9): 1326-1336.
21.Karis KF, Cheng RN, Eric MC, et al. Measuring the Symptom Experience of Chinese Cancer Patients: A Validation of the Chinese Version of the Memorial Symptom Assessment Scale. Journal of Pain and Symptom Management, 2009, 37(1): 44-57.
22.Bruera E, Kuehn N, Miller MJ, et al. The Edmonton Symptom Assessment System(ESAS): a simple method for the assessment of palliative care patients. Journal of Palliative Care, 1991, 7: 6-9.
23.Sharon M. Watanabe, Chery L, et al. The Edmonton Symptom Assessment System, a proposed tool for distress screening in cancer patients: development and refinement. Psycho-Oncology, 2012, 21: 977-985.
24.Dong Y, Cheng H, Zhen Y, et al. Psychometric Validation of Edmonton Symptom Assessment System in Chinese Patients. Journal of Pain and Symptom Management, 2015.
25.National Comprehensive Cancer Network(NCCN). NCCN Clinical Practice Guidelines in Oncology: Distress Management. 2011. Fort Washington, PA: NCCN, 2010. Available online at: http: //www. nccn. org/professionals/physician_gls/ pdf/distress. pdf.
26.Akizuki N, Tatasuo A, Tatsuro N. Development of a brief screening interview for adjustment disorders and major depression in patients with cancer. Cancer, 2003, 97(10): 2605-2613.
27.Tang LL, Zhang YN, Pang Y, et al. Validation And Reliability of Distress Thermometer in Chinese Cancer Patients. Chin J Cancer Res, 2011, 23(1): 54-58.
28.Mitchell AJ. Short screening tools for cancer-related distress: a review and diagnostic validity meta-analysis. J Natl Compr Canc Netw, 2010, 8(4): 487-494.
29.AS Zigmond, RP Snaith. The Hospital Anxiety and Depression Scale. Acta Psychiatrica Scandinavica, 1983, 67(6): 361-370.
30.叶维菲,徐俊冕.综合医院焦虑抑郁量表在综合医院患者中的应用与评价.中国行为医学杂志,1993,2(3):17-19.
31.郑磊磊,王也玲,李惠春.医院焦虑抑郁量表在综合医院中的应用.上海精神医学,2003,15(5):264-266.
32.Kroenke K, Spitzer RL, Williams JB. The PHQ-9: validity of a brief depression severity measure. Journal of General Internal Medicine, 2001, 16: 606-613.
33.Thekkumpurath P, Walker J, Butcher I, et al. Screening for major depression in cancer outpatients: the diagnostic accuracy of the 9-item Patient Health Questionnaire. Cancer, 2011, 117: 218-227.
34.曾庆枝,何燕玲等,患者健康问卷抑郁量表在中医内科门诊患者中的信度和效度研究.中华医学会第十次全国精神医学学术会议论文汇编,2012年.
35.徐勇,吴海苏,徐一峰.患者健康问卷抑郁量表(PHQ-9)在社区老年人群中的应用—信度与效度分析.上海精神医学,2007,19(5):257-259,276.
36.Spitzer RL, Kroenke K, Williams JB, et al. A brief measure for assessing generalized anxiety disorder: the GAD-7. Archives of Internal Medicine, 2006, 166: 1092-1097.
37.何筱衍,李春波,钱洁,等.广泛性焦虑量表在综合性医院的信度和效度研究.上海精神卫生医学,2010,22(4):200-203.
38.Walker J, Waters RA, Murray G, et al. Better off dead: suicidal thoughts in cancer patients. J Clin Oncol, 2008, 26(29): 4725-4730.
39.Begley M, Quayle E. The lived experience of adults bereaved by suicide: a phenomenological study. Crisis: The Journal of Crisis Intervention and Suicide Prevention, 2007, 28(1): 26-34.
40.Alexander DA, Klein S, Gray NM, et al. Suicide by patients: questionnaire study of its effect on consultant psychiatrists. BMJ, 2000, 320: 1571-1574.
41.Lisa VanHoose L, Black LL, Doty K, et al. An analysis of the distress thermometer problem list and distress in patients with cancer. Support Care Cancer, 2015, 23: 1225-1232.
42.Bultz BD, Groff SL, Fitch M. The Screening for Distress Toolkit Working Group. Canadian Problem Checklist. In The Guide to Implementing Screening for Distress, the 6th Vital Sign: Moving Toward Person- centered Care, Part A: Background, Recommendations, and Implementation. Canadian Partnership Against Cancer: Toronto, ON, 2009;34. Retrieved from: http: // www. partnershipagainstcancer. ca/ sites/default/files/Guide_CJAG. pdf.
43.Li M, Macedo A, Crawford S, et al. ReCAP: Easier Said Than Done: Keys to Successful Implementation of the Distress Assessment and Response Tool(DART) Program. J Oncol Pract, 2016.
44.Wells NL, Turney ME. Common issues facing adults with cancer. In: Lauria MM, Clark EJ, Hermann JF, Stearns NM(eds), Social Work in Oncology. Atlanta: American Cancer Society, 2001: 27-43.
45.Cull A, Stewart M, Altman DG. Assessment of and intervention for psychosocial problems in routine oncology practice. Br J Canc, 1995, 72: 229-235.
46.Wright E, Kiely M, Johnston C, et al. Development and evaluation of an instrument to assess social difficulties in routine oncology practice. Qual Life Res, 2005, 14(2): 373-386.
47.Yvonne W, Madeline Li, Gerald Devins, et al . Psycho-Oncology, 2013. Published online in Wiley Online Library(Wiley online library. com). DOI: 10. 1002/pon. 3319.
48.Passik SD , Dugan W, McDonald MV, et al. Oncologists' recognition of depression in their patients with cancer. Journal of Clinical Oncology, 1988, 16: 1594-1600.
49.Jacobsen PB, Jim HS. Psychosocial intervention for anxiety and depression in adult cancer patients: achievements and challenges. CA: A Cancer Journal for Clinicians, 2008, 58: 214-230.
50.Holland JC, Bultz BD. The NCCN guideline for distress management: a case for making distress the sixth vital sign. Journal of the National Comprehensive Cancer Network, 2007, 5: 3-7.
51.张叶宁,张海伟,宋丽莉,等,心理痛苦温度计在中国恶性肿瘤患者心理痛苦筛查中的应用.中国心理卫生杂志.2010,24(12):897-902.
52.Baker-Glenn EA, Park B, Granger L, et al. Desire for psychological support in cancer patients with depression or distress: validation of a simple help question. Psycho-Oncology, 2011, 20: 525-531.
53.Ryan H. , Schofield P, Cockburn J, et al. How to recognize and manage psychological distress in cancer patients. European Journal of Cancer Care(English), 2005, 14: 7-15.
54.Jenkins V, Fallowfield L. Can communication skills training alter physicians' beliefs and behaviors in clinics? Journal of Clinical Oncology, 2002, 20: 765-769.
55.Lee JY, Jung D, Kim WH , et al. Correlates of oncologist-issued referrals for psycho-oncology services: what we learned from the electronic voluntary screening and referral system for depression(eVSRS-D). Psycho-Oncology 2016, 25: 170-178.
56.Cheryl LN, Ceinwen C, Jill T , et al. Referral patterns and psychosocial distress in cancer patients ac Psycho-Oncology counseling service. Psycho-Oncology, 2011, 20: 326-332.
57.Mclachlan SA, Allenby A, Matthews J, et al. Randomized trial of coordinated psychosocial interventions based on patient selfassessments versus standard care to improve the psychosocial functioning of patients with cancer. Journal of Clinical Oncology, 2001, 19: 4117-4125.
58.Brebach R, Sharpe L, Costa D S, et al. Psychological intervention targeting distress for cancer patients: a meta-analytic study investigating uptake and adherence. Psycho-Oncology, 2016.
59.Zimmermann T, Heinrichs N, Baucom D. “Does one size fit all? ”moderators in psychosocial interventions for breast cancer patients: a meta-analysis. Ann Behav Med, 2007, 34: 225-239.
60.Jane T, Brian K, David K, et al. A randomized trial of a psychosocial intervention for cancer patients integrated into routine care: the PROMPT study(promoting optimal outcomes in mood through tailored psychosocial therapies). BMC Cancer, 2011, 11: 48.