 去看看
去看看


一、简介
卵巢恶性肿瘤是女性生殖器常见的恶性肿瘤之一。由于卵巢位于盆腔深部,早期病变不易发现,一旦出现症状多属晚期。近二十年来,由于有效化疗方案的应用,使卵巢恶性生殖细胞肿瘤的治疗效果有了明显的提高,死亡率从90%降至10%。随着紫杉醇的问世以及与铂类联合应用,卵巢上皮性癌的疗效也发生了明显的变化,5年生存率已经接近或超过50%,但是其死亡率仍居妇科恶性肿瘤首位,其主要原因是70%的卵巢上皮癌患者在就诊时已为晚期,治疗后70%的患者将会复发,难以治愈。卵巢上皮癌已成为严重威胁妇女生命和健康的主要肿瘤,对其早期诊治、手术、化疗和放疗等方面也存在颇多的问题和争论,这正是当今妇科肿瘤界面临的严重挑战。
二、诊断
1.病史
(1) 危险因素:
卵巢癌的病因未明。年龄的增长、未产或排卵年增加、促排卵药物的应用等,以及乳腺癌、结肠癌或子宫内膜癌的个人史及卵巢癌家族史,被视为危险因素。
(2) 遗传卵巢癌综合征(HOCS):
尤其是BRCA1或BRCA2基因表达阳性者,其患病的危险率高达50%,并随年龄增长,危险增加。
(3) “卵巢癌三联症”:
即年龄40~60岁、卵巢功能障碍、胃肠道症状,可提高对卵巢癌的警戒。
2.症状
卵巢恶性肿瘤早期常无症状,部分患者可在妇科检查中被发现。晚期主要临床表现为腹胀、腹部肿块及腹水,症状的轻重决定于:①肿瘤的大小、位置、侵犯邻近器官的程度;②肿瘤的组织学类型;③有无并发症。
(1) 压迫症状:
由于肿瘤生长较大或浸润邻近组织所致。
(2) 播散及转移症状:
由于腹膜种植引起的腹水,肠道转移引起的消化道症状等。
(3) 内分泌症状:
由于某些卵巢肿瘤所分泌的雌激素、睾酮的刺激,可发生性早熟、男性化、闭经、月经紊乱及绝经后出血等。
(4) 急腹痛症状:
由于肿瘤破裂、扭转等所致。
3.体征
(1) 全身检查:
特别注意乳腺、区域淋巴结、腹部膨隆、肿块、腹水及肝、脾、直肠检查。
(2) 盆腔检查:
双合诊和三合诊检查子宫及附件,注意附件肿块的位置、侧别、大小、形状、边界、质地、表面状况、活动度、触痛及子宫直肠窝结节等。
应强调盆腔肿块的鉴别,以下情况应注意为恶性:①实性;②双侧;③肿瘤不规则、表面有结节;④粘连、固定、不活动;⑤腹水,特别是血性腹水;⑥子宫直肠窝结节;⑦生长迅速;恶病质,晚期可有大网膜肿块、肝脾肿大及消化道梗阻表现。
4.辅助检查
(1) 腹水或腹腔冲洗液细胞学:
腹水明显者,可直接从腹部穿刺,若腹水少或不明显,可从后穹隆穿刺。所得腹水经离心浓缩,固定涂片,进行细胞学检查。
(2) 肿瘤标志物
1) CA125:80%的卵巢上皮性癌患者CA125水平高于35kU/L,90%以上的晚期卵巢癌患者CA125水平的消长与病情缓解或恶化相一致,尤其对浆液性腺癌更有特异性。
2) HE4:人附睾蛋白4是一种新的卵巢癌肿瘤标志物。正常生理情况下,HE4在人体中有非常低水平的表达,但在卵巢癌组织和患者血清中均高度表达,可用于卵巢癌的早期检测、鉴别诊断、治疗监测及预后评估。88%的卵巢癌患者都会出现HE4升高的现象。与CA125相比,HE4的敏感度更高、特异性更强,尤其是在疾病初期无症状表现的阶段。疾病早期HE4诊断的敏感度是82.7%,而CA125却仅有45.9%。与CA125仅20%的特异性相比,HE4的特异性高达99%。HE4与CA125两者联合应用,诊断卵巢癌的敏感性可增加到92%,并将假阴性结果减少30%,大大增加了卵巢癌诊断的准确性。
3) CA199和CEA等肿瘤标记物在卵巢上皮癌患者中也会升高,尤其对卵巢黏液性癌的诊断价值较高。
4) AFP:对卵巢内胚窦瘤有特异性价值,或者未成熟畸胎瘤、混合型无性细胞瘤中含卵黄囊成分者均有诊断意义。其正常值为< 25μg/L。
5) hCG:对于原发性卵巢绒癌有特异性。
6) 性激素:颗粒细胞瘤、泡膜细胞瘤可产生较高水平的雌激素。黄素化时,亦可有睾酮分泌。浆液性、黏液性或纤维上皮瘤有时也可分泌一定的雌激素。
(3) 影像学检查
1) 超声扫描:对于盆腔肿块的检测有重要意义,可描述肿物大小、部位、质地等。良恶性的判定依经验而定,可达80%~90%,也可显示腹水。通过彩色多普勒超声扫描,能测定卵巢及其新生组织血流变化,有助诊断。
2) 盆腔或(和)腹部CT及MRI:对判断卵巢周围脏器的浸润、有无淋巴转移、有无肝脾转移和确定手术方式有参考价值。
3) 胸部、腹部X线摄片:对判断有无胸腔积液、肺转移和肠梗阻有诊断意义。
(4) 必要时选择以下检查
1) 系统胃肠摄片(GI)或乙状结肠镜观察,必要时行胃镜检查,提供是否有卵巢癌转移或胃肠道原发性癌瘤的证据。
2) 肾图、肾血流图、静脉肾盂造影或CT泌尿系统重建:观察肾脏的分泌及排泄功能、了解泌尿系压迫或梗阻情况。
3) 放射免疫显像或PET检查:有助于对卵巢肿瘤进行定性和定位诊断。
4) 腹腔镜检查:对盆腔肿块、腹水、腹胀等可疑卵巢恶性肿瘤的患者行腹腔镜检查可明确诊断。同时通过腹腔镜的观察,可以对于疾病的严重程度进行评估,决定手术的可行性,如果经过腹腔镜评估认为经过手术很难达到满意的肿瘤细胞减灭,应该选择先期化疗,然后再进行间歇性肿瘤细胞减灭术。若肿块过大或达脐耻连线中点以上、腹膜炎及肿块粘连于腹壁,则不宜进行此检查。腹腔镜检查的作用:①明确诊断,作初步临床分期;②取得腹水或腹腔冲洗液进行细胞学检查;③取得活体组织,进行组织学诊断;④术前放腹水或腹腔化疗,进行术前准备。
5.确诊卵巢癌的依据
明确卵巢癌诊断的依据是肿瘤的组织病理学,而腹水细胞学、影像学和肿瘤标志物检查结果均不能作为卵巢癌的确诊依据。
卵巢恶性肿瘤的诊断需与如下疾病鉴别:①子宫内膜异位症;②结核性腹膜炎;③生殖道以外的肿瘤;④转移性卵巢肿瘤;⑤慢性盆腔炎。
三、卵巢肿瘤组织学分类
卵巢肿瘤组织学分类,见图1。
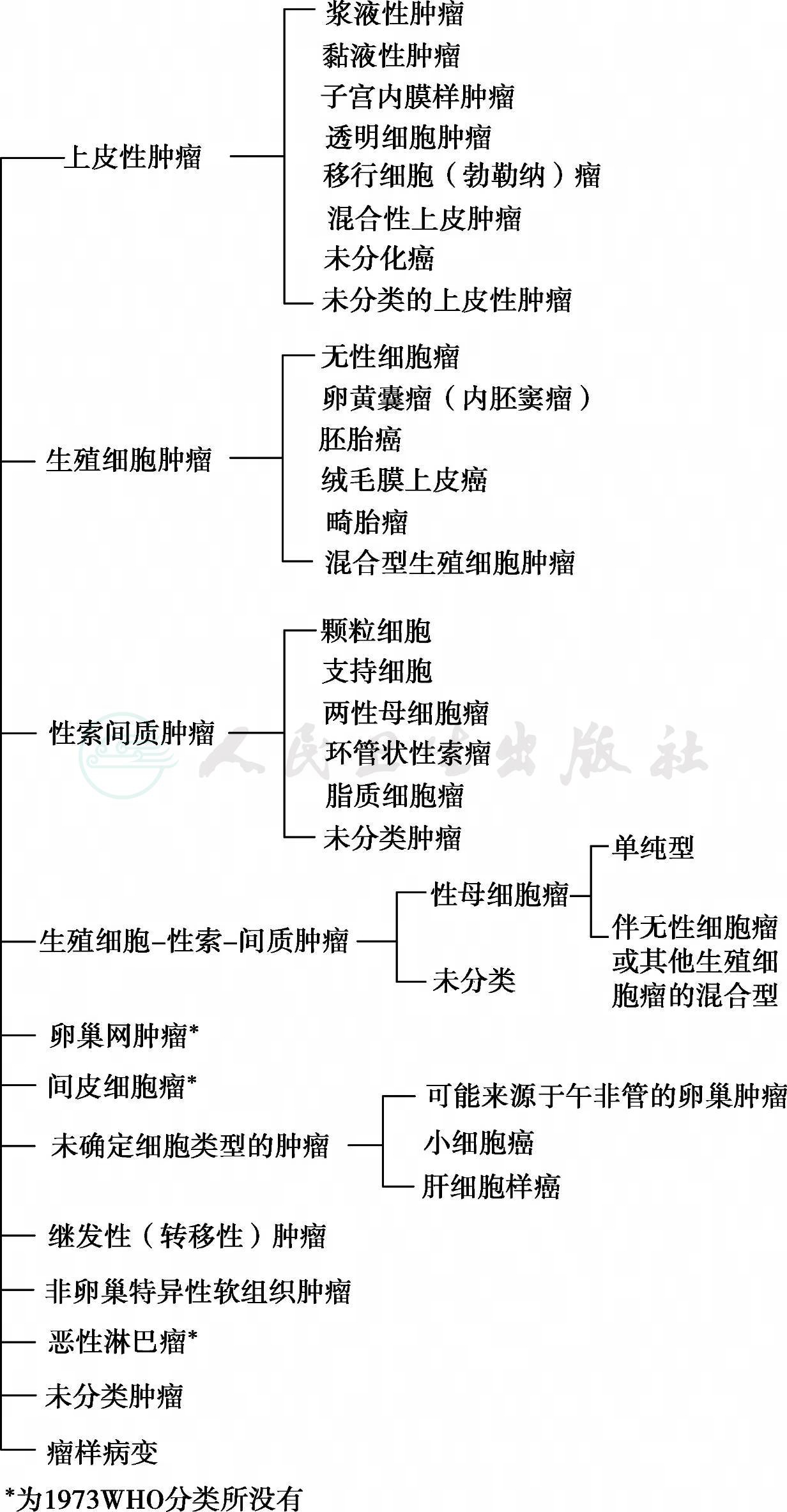
图1 卵巢肿瘤组织学分类(Scully,1988年)
四、卵巢恶性肿瘤分期(2012,FIGO)
卵巢恶性肿瘤FIGO分期,见表1。

表1 卵巢癌、输卵管癌、腹膜癌2012年FIGO新分期
五、卵巢恶性肿瘤的处理原则
一经发现卵巢肿瘤,应行手术。手术目的:①明确诊断;②切除肿瘤;③恶性肿瘤进行手术-病理分期。如果术前没有明确病理诊断,应在术中将切下的卵巢肿瘤送快速冷冻组织病理学检查,进行确诊。手术可通过腹腔镜和(或)剖腹进行,腹腔镜大多用来进行卵巢肿瘤的诊断,而晚期卵巢恶性肿瘤手术治疗应该是剖腹手术。应根据卵巢肿瘤的性质、组织学类型、手术-病理分期和患者的年龄等因素来决定治疗的目的和是否进行手术后的辅助治疗。
治疗的目的和原则:①对卵巢上皮癌治疗目标是早期争取治愈,晚期控制复发,延长生存期及提高患者生活质量。主要的治疗方式为手术加紫杉醇和铂类药物的联合化疗。②对卵巢生殖细胞恶性肿瘤治疗的目标是治愈,主要的治疗方式为手术和以PEB/PVB为主要方案的化疗,保留生育功能是该类肿瘤治疗的原则。③对性索间质性肿瘤的目标也是治愈,手术是主要的治疗手段,对年轻的早期患者可实施单侧卵巢切除术,保留生育功能。④对发生转移的患者还没确定最佳的治疗方案。要强调治疗医师的资格论证,最好是由经过正规训练的妇科肿瘤专科医师实施卵巢癌的治疗。
1.手术治疗
(1) 全面分期手术(comprehensive staging laparotomy):
①腹部足够大的纵切口;②全面探查;③腹腔细胞学检查(腹水或盆腔、结肠侧沟、横膈冲洗液);④大网膜切除;⑤全子宫和双侧附件切除;⑥仔细的盆腹腔探查及活检(粘连、可疑病变、盆腔侧壁、肠浆膜、肠系膜、横膈);⑦盆腔及腹主动脉旁淋巴结切除术(至少达到肠系膜下动脉水平,最好达到肾血管水平)。
(2) 再分期手术(re-staging laparotomy):
指首次手术未明确分期,亦未用化疗而施行的全面探查和分期手术。如术后患者已用化疗,应属于间歇性肿瘤细胞减灭术(interval cytoreductive surgery)。
(3) 肿瘤细胞减灭术(cytoreductive surgery):
尽最大努力切除原发灶及一切转移瘤,使残余癌灶直径< 1cm(满意的肿瘤细胞减灭术)。手术内容包括:①手术需要一个足够大的纵切口;②腹水或腹腔冲洗液的细胞学检查,但是对于腹腔已经明确受累,细胞学检查并不改变分期;③全子宫双侧附件及盆腔肿块切除,卵巢动、静脉高位结扎;④切除大网膜,尤其是受累的网膜必须切除,如果小网膜受累也应切除;⑤腹主动脉旁及盆腔淋巴结清除术(至少达到肠系膜下动脉水平,最好达到肾血管水平),可疑受累或增大的淋巴结应该切除;而对于盆腔以外受累且转移灶不超过2cm,也应该进行双侧盆腔及腹主动脉旁淋巴结切除;⑥阑尾切除及肠道转移病灶处理;⑦为了达到满意的肿瘤细胞减灭术可以采取某些特殊的手术措施,包括肠切除、部分横膈或腹膜剥除、脾切除、部分肝切除、胆囊切除、胃部分切除、膀胱部分切除、输尿管膀胱种植、胰尾切除、根治性盆腔切除(盆腔廓清术)等。
(4) 间歇性(“中间性”或间隔)肿瘤细胞减灭术[interval (or intervening)cytoreductive surgery]:
对于某些晚期卵巢癌病例,术前评估或术中评估或腹腔镜下评估难以达到满意的肿瘤细胞减灭,则可先用3个疗程的(最多不超过6个)化疗,再行肿瘤细胞减灭术。目前的循证医学证据已经证明这种治疗策略至少不影响最终的治疗结果,但是由于其可以明显地提高手术质量和减少手术并发症的发生,同时减低了手术难度,也不失为一种好的治疗手段。
(5) 再次肿瘤细胞减灭术(re-cytoreductive surgery):
指对残余瘤或复发瘤的手术,如果没有更有效的二线化疗药物,这种手术的价值是很有限的。
(6) 二次探查术(second look operation):
指经过满意的肿瘤细胞减灭术1年内,又施行了至少6个疗程的化疗,通过临床物理检查及辅助或实验室检测(包括CA125等肿瘤标志物)均无肿瘤复发迹象,而施行的再次剖腹探查术。其目的在于了解腹腔癌灶有无复发,作为日后制订治疗方案的依据。但是,由于近年的研究表明二次探查术并不能改善患者的生存时间和预后,现已很少应用。交界性肿瘤、Ⅰ期上皮性癌、恶性生殖细胞肿瘤、性索间质肿瘤不做二次探查术。
(7) 腹腔镜技术在卵巢癌治疗中的应用:
腹腔镜下的卵巢癌手术,是难度较大的一类手术,也是最受争议的手术,迄今,绝大多数妇科肿瘤学家都不主张采用腹腔镜下的手术方式治疗晚期卵巢癌。因此,腹腔镜手术一般仅适用于ⅡC期以前的早期卵巢上皮性癌和生殖细胞肿瘤。无论如何,在发现附件肿瘤为恶性时,实施卵巢癌的腹腔镜手术必须符合以下情况:①肿瘤直径<10cm;②腹腔内其他部位或脏器无明显的转移病灶;③术者有足够的技术以完成整个手术。卵巢癌的腹腔镜手术仅用于下列几个方面:①明确卵巢癌的诊断及病情程度的评估。②早期卵巢癌全面分期手术:包括卵巢癌的腹腔镜探查活检术,腹腔镜下大网膜切除术及全子宫、双附件切除术和盆腔及腹主动脉旁淋巴结切除。③卵巢癌的腹腔镜再分期手术。
2.化疗
(1)术后辅助化疗是晚期卵巢癌的重要治疗措施,一定要及时、足量、规范。对于进行了最大限度地肿瘤细胞减灭术,或瘤体很小的患者更为有效。卵巢上皮性癌的一线化疗方案主要包括TP(紫杉醇+顺铂)腹腔静脉联合化疗、TC(紫杉醇、卡铂)静脉化疗、DC(多西他赛、卡铂)静脉化疗、剂量密集型TC静脉化疗(dd-TC)、TC静脉化疗联合贝伐珠单抗等,最早应用的PC对于某些经济困难的患者仍有价值(表2)。二线化疗药物较多,但并没有首选的化疗方案。脂质体多柔比星、吉西他滨、拓扑替康联合铂类获得较好的循证医学证据。恶性生殖细胞肿瘤及性索间质肿瘤可用PEB(顺铂、依托泊苷、平阳霉素)、PVB(顺铂、长春新碱、平阳霉素)、VAC(长春新碱、放线菌素D、环磷酰胺)方案作一线方案。
表2 卵巢上皮性癌常用联合化疗方案

紫杉醇的问世,无疑给卵巢癌的治疗尤其是卵巢上皮癌的治疗带来了曙光,将其与治疗卵巢癌最有效的铂类药物结合起来无疑是当前最有价值的选择。GOG-111和OV-10均证明了将紫杉醇与顺铂联合应用(TP)明显优于治疗卵巢癌的传统方案PC,随后GOG-158进一步证实了TC和TP在临床近期疗效上相似,但是毒副作用更加可控,从而TC取代了TP,成为当前卵巢上皮性癌的首选化疗方案。多西他赛单药应用治疗卵巢癌尤其是复发性卵巢癌的疗效与紫杉醇相似,但是其毒性反应和紫杉醇却不同,SCOTROC的试验证实了DC的临床疗效与TC完全相同(ORR均为59%),但是不良反应却各不相同,DC表现更严重的骨髓抑制,而TC则会发生更严重的神经损害。
虽然TC在治疗卵巢上皮性癌方面已经取得了很好的疗效,但是针对其改进的探索从来没有停止过。腹腔化疗对卵巢癌的治疗价值近来受到重视。最近,美国GOG一项Ⅲ期临床研究(GOG-172)结果表明,与静脉化疗相比,腹腔与静脉联合化疗降低了卵巢癌患者20%的复发风险和25%的死亡风险。平均中位生存时间为65.6个月,这是迄今为止在一系列晚期卵巢癌临床随机对照试验中报道最长的中位生存时间。但是腹腔与静脉联合化疗组比静脉化疗组的患者更容易出现严重的药物不良反应,特别在白细胞减少、血小板减少和感染等化疗药物毒性反应。因此,腹腔化疗组中只有42%的患者完成了规定6个疗程的原方案腹腔化疗。基于GOG-172研究的结果,美国国家癌症综合治疗联盟(the National Comprehensive Cancer Network,NCCN)已将该腹腔化疗方案写入卵巢癌临床指南中。该研究使用的腹腔与静脉联合化疗方案为:紫杉醇135mg/m2 iv(d1)+顺铂75mg/m2 ip(d2)+紫杉醇60mg/m2 ip(d8)。研究中腹腔化疗药物除顺铂外还增加了紫杉醇。共429例患者参与研究(415例符合纳入标准),iv组给予紫杉醇135mg/m2 iv(d1)+顺铂75mg/m2 iv。另外一方面,这可能与ip组比iv组增加了化疗药物剂量和次数有关。而胃肠道反应、神经毒性、乏力、代谢异常和疼痛等非血液学毒性反应的发生率也是ip组高。ip组和iv组的中位无疾病进展时间分别为23.8个月和18.3个月(P = 0.05),总生存期分别为65.6个月和49.7个月(P = 0.03)。在GOG-172研究中化疗前、第4疗程前、6个疗程完成后的3~6周以及1年后四个时间段,对卵巢癌患者生活质量(quality-of-life,QOL)进行了评价。结果ip组比iv组的生活质量明显下降,特别是在第4疗程前以及6个疗程完成后的3~6周,ip组的QOL均比iv组低。但是在治疗1年后的QOL两组并无差异。由于GOG-172在生存数据上获得了很好的结论,NCI发布的了临床公告,对于已经接受了满意的肿瘤细胞减灭术的患者应该建议其进行腹腔化疗,至少要和患者说明这个实验的结果。但是由于此方案的毒副作用较强,也需要和患者充分知情。
日本的学者进行了一项非常有意义的RCT研究(JGOG 3016),对晚期的卵巢上皮性癌、输卵管癌、原发性腹膜癌患者采用剂量密集型TC周疗(dd-TC),可使患者获益。经过6.4年的随访,中位无进展生存期(PFS)分别为17.5个月和28.2个月(P = 0.0037),总生存期率分别为51.1个月和58.7个月(P=0.039)。GOG-218和ICON7是两个类似的临床试验,均是将卵巢上皮癌的一线化疗TC方案与新近问世的贝伐珠单抗进行联合,并于化疗结束一定时间内使用贝伐珠单抗进行维持治疗。两个实验均证实了TC联合贝伐珠单抗对于预后有不同程度地改善,但所需的治疗费用很高。
(2) 卵巢癌的先期化疗:也叫新辅助化疗(neoadjuvant chemotherapy),是指在明确诊断卵巢癌后,选择相应有效的化疗方案给予患者有限疗程的化疗,然后再行肿瘤细胞减灭术。新辅助化疗一般2~3个疗程。
1) 新辅助化疗目的:①减少肿瘤负荷;②提高手术质量;③改善患者预后。
2) 新辅助化疗的先决条件:①明确的病理诊断;②明确病变程度和范围。
3) 新辅助化疗的方法:①腹腔化疗;②动脉化疗;③静脉化疗。
4) 新辅助化疗的临床意义:主要是可以明显改善手术质量,提高手术彻底性。目前还没有极具有说服力的前瞻性研究报告表明先期化疗能提高卵巢癌患者的生存率,值得进一步研究。
(3) 卵巢癌的巩固化疗:目的在于加强初治效果,延缓复发,提高患者的生存率。但考虑到普通巩固化疗疗效的非限定性及毒副作用,在缺乏循证医学的证据的情况下,目前尚不作为临床的常规治疗。
(4) 化疗期限应根据肿瘤的类别和期别等而定。
(5) 化疗的实施应考虑“个体化”,重视评估化疗的效果和毒副作用,及时调整化疗药物的剂量和方案。
3.放疗
某些肿瘤对放疗非常敏感(如无性细胞瘤),对于残余瘤或淋巴结转移可行标记放疗,移动式带形照射(moving stripe radiation)亦可选用,放射性核素(32P)适于腹腔内灌注。放疗为卵巢癌手术和化疗的辅助治疗。
六、随访与监测
1.病情监测
卵巢癌易于复发,应长期予以随访和监测。随访和监测内容如下:
(1) 临床症状、体征、全身及盆腔检查,强调每次随诊盆腔检查的重要性。
(2) 肿瘤标志物:CA125、AFP、hCG。
(3) 影像检查:B超、CT及MRI(有条件者)。
(4) 正电子发射显像(PET)(有条件者)。
(5) 类固醇激素测定:雌激素、孕激素及雄激素(对某些肿瘤)。
(6) 术后随访:①术后1年,每月1次;②术后2年,每3个月1次;③术后3年,每6个月1次;④3年以上者,每年1次。(NCCN指南:术后1~2年内每2~4个月一次,术后3~5年内每3~6个月一次,5年后每年一次)。
2.疗效评定
(1) 复发征象:
①盆腔检查发现肿物;②腹部检查发现肿物;③腹水出现并找到瘤细胞;④肺部阴影;⑤淋巴转移;⑥影像检查(X线、CT、MRI、B超)及核素显像有阳性发现;⑦二次探查术或腹腔镜检查发现复发灶,并经病理学检查证实,腹腔冲洗液瘤细胞阳性;⑧CA125、hCG、AFP转阳性。
(2) 评价标准
1) 手术切净肿物,临床已无可测量的观察指标:①缓解:临床上未发现上述复发标准;②复发:符合复发的诊断标准。
2) 手术未切净肿块,临床仍有可测量观察指标:①缓解:肿瘤完全消失,标志物恢复正常达3个月以上;②进展:残留肿瘤生长超过原来肿瘤体积的50%。
七、卵巢交界性肿瘤或低度潜在恶性肿瘤的处理
卵巢交界性瘤占卵巢上皮性瘤的9.2%~16.3%,Ⅰ期为主,占50%~80%,其中主要是黏液性,而Ⅲ期中则主要是浆液性。患者发病年龄较轻,平均34~44岁,合并妊娠者占9%。卵巢交界性肿瘤是一类性质较为特别的卵巢肿瘤,具有下列特点:①易发生于生育年龄的妇女;②常为早期,Ⅰ~Ⅱ期患者占80%;③在临床上有一定的恶性上皮卵巢癌的组织学特征,但缺少可确认的间质浸润,恶性程度较低;④对化疗不敏感;⑤多为晚期复发;⑥复发多为卵巢交界瘤。
根据上述特点,通常可切除一侧附件而保留生育功能,对于Ⅰ期患者可不进行分期手术,术后多不需用化疗。交界性卵巢肿瘤双侧的发生率为38%。对于双侧交界性卵巢肿瘤,只要有正常卵巢组织存在,也可进行肿瘤切除而保留生育功能。期别较晚的交界性卵巢肿瘤如无外生乳头结构及浸润种植也可考虑保留生育功能手术治疗。
1.处理原则
手术为交界性肿瘤的最重要、最基本的治疗,手术范围视患者年龄、生育状况及临床分期而定:①早期、年轻、有生育要求者:切除患侧附件,对侧剖探,腹腔冲洗液细胞学检查及腹膜多点活检,保留生育功能。②晚期、年龄大或无生育要求者:行全子宫及双侧附件切除,大网膜、阑尾切除或施行肿瘤细胞减灭术。
2.原则上不给予术后辅助化疗
但亦有资料表明,对期别较晚、有浸润性种植和DNA为非整倍体的卵巢交界性肿瘤,术后也可施行3~6个疗程正规化疗(方案同卵巢上皮癌)。辅助化疗能否减少复发,提高患者生存率还有待证实。
3.预后与复发
交界性瘤恶性程度低、预后好,复发晚,复发率随时间推移而增加。交界性瘤复发,绝大多数病理形态仍为交界性,再次手术仍可达到较好结果。
八、早期卵巢上皮性癌的处理
早期卵巢上皮癌是指FIGO Ⅰ、Ⅱ期卵巢癌。全面的分期手术是早期卵巢上皮癌最基本,也是最重要的治疗手段,通过手术早期卵巢上皮癌可以分为低危和高危两大类。低危组包括所有FIGO ⅠA和ⅠB期肿瘤分化好的患者,预后良好。对这类患者的治疗,全面的分期手术是最重要的,术后大部分患者不需要进一步治疗,90%以上患者可长期无瘤存活。高危组包括所有ⅠA和ⅠB中分化到低分化的癌,以及ⅠC期的肿瘤和所有卵巢透明细胞癌,患者预后不良。有高危因素的患者,30%~40%有复发的危险,25%~30%在首次手术后5年内死亡。这些患者在全面手术分期结束后,还需要进行辅助治疗,建议TC化疗3~6个疗程。
早期卵巢上皮癌与复发有关的高危因素:①包膜破裂;②肿瘤表面生长;③低分化(G3);④与周围组织粘连;⑤透明细胞癌;⑥腹腔冲洗液阳性;⑦卵巢癌外转移。
早期卵巢上皮性癌的术后化疗指征:
(1) 无精确手术分期,即未行大网膜切除和(或)腹膜后淋巴结清除术。
(2) 透明细胞癌。
(3) 中分化或低分化肿瘤(G2、G3)。
(4) 卵巢表面有肿瘤生长(ⅠC)。
(5) 肿瘤破裂或包膜不完整。
(6) 肿瘤与盆腔粘连。
(7) 腹水或腹腔冲洗液阳性(ⅠC)。
(8) 化疗方案及疗程:应以紫杉醇和铂类药物为主,优先采用较为简便的化疗方案,如紫杉醇和卡铂(TC)。疗程以3~6个疗程为宜。
九、晚期卵巢上皮癌的处理
晚期卵巢上皮癌标准治疗模式是,患者一开始就应该进行满意的肿瘤细胞减灭术,尽最大可能使残余肿瘤直径< 1cm。对于满意的肿瘤细胞减灭术后的患者,应该和其讨论腹腔化疗的问题,应该积极使用TP腹腔静脉联合化疗,当然其他化疗方案也是好的选择(如TC、DC、dd-TC),如果经济条件好,TC与贝伐珠单抗联合也是好的治疗措施。对于未能行满意的肿瘤细胞减灭术后的患者,建议使用静脉化疗(如TC、DC、dd-TC)。另外,如果患者在首次肿瘤细胞减灭术后残余肿瘤数量相当多,可以给予2~3个疗程的新辅助化疗,紧接着行间歇性肿瘤细胞减灭术,术后再予6个疗程的化疗(总疗程8~9个)。
晚期卵巢上皮癌影响预后或危险因素如下:
(1) 年龄:年轻者(< 50岁)预后较好。
(2) 期别:是主要因素,期别越晚,预后越差。
(3) 病理分级:高、中、低分化的5年生存率分别为59%、25%、7%。
(4) 初次手术肿瘤切除的彻底性,或残留肿瘤体积大小。残留愈大,预后愈差。
(5) 肿瘤组织类型:浆液性癌、透明细胞癌较黏液性癌及子宫内膜样癌预后差。
(6) 腹膜后淋巴结转移阳性预后差。
(7) 肿瘤细胞减灭术后4周的血清CA125水平下降不满意(不及术前的50%)或术后2个月未降至正常,预后差。
十、复发卵巢上皮癌的诊断与治疗
1.复发卵巢癌的定义
①复发(recurrence,relapse):经过满意的肿瘤细胞减灭术和正规足量的化疗达到临床完全缓解,停药半年后临床上再次出现肿瘤复发的证据,视为复发。②未控(failure of the treatment):虽然经过肿瘤细胞减灭术和正规足量的化疗,但肿瘤仍进展或稳定,二探手术发现残余灶,或停化疗半年之内发现复发证据,均视为未控。
2.卵巢癌复发的迹象和证据
①CA125升高;②出现胸、腹水;③体检发现肿块;④影像学检查发现肿块;⑤不明原因肠梗阻。
只要存在上述中的两项就要考虑肿瘤复发。复发的诊断最好有病理的支持。
3.复发卵巢癌的分型
(1) 化疗敏感型:
定义为对初期以铂类药物为基础的治疗有明确反应,且已经达到临床缓解,停用化疗6个月以上病灶复发。
(2) 化疗耐药型:
定义为患者对初期的化疗有反应,但在完成化疗相对短的时间内证实复发,一般认为完成化疗后6个月内的复发应考虑为铂类药物耐药。
(3) 顽固型:
是指在初期化疗时对化疗有反应或明显反应的患者中发现有残余病灶,例如“二探”阳性者。
(4) 难治型:
是指对化疗没有产生最小有效反应的患者,包括在初始化疗期间肿瘤稳定或肿瘤进展者。大约发生于20%的患者,这类患者对二线化疗的有效反应率最低。
4.卵巢癌复发的治疗
(1) 治疗前的准备:详细复习病史包括:①手术分期;②组织学类型和分级;③手术的彻底性;④残余瘤的大小及部位;⑤术后化疗的方案、途径、疗程、疗效;⑥停用化疗的时间;⑦出现复发的时间等。
(2) 对复发性卵巢癌进行分型,对复发灶进行定位分析。
(3) 对患者的生活状态(PS)进行评分,对患者重要器官的功能进行评估。
5.治疗基本原则
目前观点认为对于复发性卵巢癌的治疗目的一般是趋于保守性的,因此在选择复发性卵巢癌治疗方案时,对所选择方案的预期毒性作用及其对整个生活质量的影响都应该加以重点考虑。在制订二线化疗方案时,常把耐药型、顽固型和难治型卵巢癌考虑为一组,而对铂类药物敏感的复发癌常被分开考虑。
对复发性卵巢癌的治疗应该个体化,分层进行治疗。耐药和难治型卵巢癌对再次治疗的反应率很低,仅为10%~15%。多发部位的复发灶和复发瘤>5cm也提示对再次治疗反应差。敏感型卵巢癌,尤其是有较长无瘤缓解的患者,对再次治疗有很好的疗效。对这一部分复发患者应该积极进行治疗。根据患者的不同情况选择适当的治疗时机,不可过早,也不能过晚。对复发性卵巢癌的治疗是姑息性的,在制订治疗方案时要充分考虑到患者的生存质量和各种治疗方案的毒副作用。
6.复发性卵巢癌的化疗
可用于卵巢癌二线治疗的药物有:紫杉醇(paclitaxel),脂质体多柔比星(doxorubicin liposome)、吉西他滨(gemcitabine)、多西他赛(docetaxel)、拓扑替康(topotecan)、六甲嘧胺、异环磷酰胺和依托泊苷(VP16)等。各种药物的有效率基本相似,大约为20%,因此,卵巢癌二线化疗没有首选的药物。选择药物主要考虑药物的毒性作用、患者以前是否使用过该药物和患者的生存质量。
7.复发性卵巢癌的手术治疗
手术对复发性卵巢癌的治疗价值尚未确定,手术的指征和时机还存在一些争论。
(1) 复发性卵巢癌的手术治疗主要用于3个方面:
①解除肠梗阻;②> 12个月复发灶的减灭;③切除孤立的复发灶。对晚期复发卵巢癌是先手术还是先化疗仍有争议。
(2) 下列情况是进行再次肿瘤细胞减灭术的合理选择:
①完成一线化疗后,> 12个月以上的复发;②残余瘤或复发灶有完整切除的可能;③对先前的化疗有很好的反应;④患者年龄较轻,有很好的生活状态评分。在上述情况下进行再次肿瘤细胞减灭术可达到预期的治疗目的,对患者有益。术前进行PET-CT检查,评估复发病灶切净程度,选择性进行再次肿瘤细胞减灭术,可使患者获益。
8.化疗敏感型的治疗
停用化疗时间越长,再次治疗缓解的可能性越大,对这类患者的治疗应该采取积极的态度。对于> 12个月复发的孤立可切除病灶,可考虑先行手术切除,然后再化疗。对于敏感型复发的化疗主要选用TC方案,吉西他滨与卡铂的联合以及脂质体多柔比星与卡铂的联合也是不错的选择,还有拓扑替康与铂类的联合效果也是很好的。
9.顽固型的治疗
治疗方案的选择取决于“二探”中发现残余病灶的大小、首次手术后残余瘤的大小、化疗的药物和方案、给药的途径等。对于这样患者的治疗目前主要采用耐药型复发的治疗,最好采用无铂单药治疗,NCCN指南推荐的药物有紫杉醇、多西他赛、脂质体多柔比星、吉西他滨、拓扑替康、VP16等,由于不少患者前次化疗的毒副作用尚未完全消失,因此,这是选药的原则应该是选择毒性低的药物。
10.耐药和难治型的治疗
对这类患者治疗效果很不理想,除了为解除肠梗阻外,一般不考虑手术治疗。对于耐药型复发的患者治疗原则应该是改善生活质量、控制肿瘤的进展,最大限度地延长无铂间期,最好采用无铂单药治疗。改善患者的生后质量应为主要的治疗目标。
11.卵巢癌复发合并肠梗阻的治疗
肠梗阻是复发性卵巢癌患者最常见和最难处理的问题。化疗对大部分肠梗阻患者的疗效不佳,姑息性的保守治疗是较为合适的选择(激素、止痛药、止吐药、胃肠减压和TPN等)。选择手术治疗应该谨慎,多处梗阻和多个复发灶手术很难奏效,而且并发症很多(10%~15%的患者将会在手术后8周内死亡,40%的患者手术没有任何效果)。对孤立的复发灶,仅一个部位的梗阻和对化疗敏感的患者手术可能会有一定的疗效,对肠梗阻患者进行评分有助于临床医师决定是否进行手术。
12.开始治疗的时机和指征
临床上有下列情况可考虑开始进行复发性卵巢癌的治疗:①临床上有症状,临床或影像学检查有复发的证据,伴有或不伴有CA125的升高;②临床上没有症状,但CA125升高,临床或影像学检查发现> 2~3cm的复发灶;③虽然没有临床和影像学检查的复发证据,但有症状和CA125的明显升高;④系列测定CA125持续升高,除外其他CA125升高的原因。
十一、卵巢恶性生殖细胞肿瘤的治疗
卵巢恶性生殖细胞肿瘤(ovarian malignant germ cell tumor)是指来源于胚胎性腺的原始生殖细胞而具有不同组织学特征的一组肿瘤,占所有卵巢恶性肿瘤的5%。
1.临床特点
(1) 多发生于年轻的妇女及幼女。
(2) 多数生殖细胞肿瘤是单侧的。
(3) 即使复发也很少累及对侧卵巢和子宫。
(4) 有很好的肿瘤标志物(AFP、hCG、NSE)。
(5) 对化疗敏感。近年来,由于找到有效的化疗方案,使其预后大为改观。卵巢恶性生殖细胞肿瘤的5年存活率分别由过去的10%提高到目前的90%。大部分患者可行保留生育功能的治疗。
2.病理分类
基于对卵巢肿瘤的进一步认识,1994年世界卫生组织制订的卵巢肿瘤的组织学分类对组织学类型的命名有所变更,并增加了一些新的亚型。主要的组织病理分类如下:①未成熟畸胎瘤;②无性细胞瘤;③卵黄囊瘤;④胚胎癌;⑤绒癌;⑥混合型恶性生殖细胞肿瘤。
3.诊断
卵巢恶性生殖细胞肿瘤在临床表现方面具有一些特点。如发病年龄轻、肿瘤较大、肿瘤标志物异常、很易产生腹水、病程发展快等。应注意到肿瘤的这些特点,给予及时诊断。特别是血清甲胎蛋白(AFP)和人绒毛膜促性腺激素(hCG)的检测可以起到明确诊断的作用。卵黄囊瘤可以合成AFP,卵巢绒癌可分泌hCG,这些都是很特异的肿瘤标志物。血清AFP和hCG的动态变化与癌瘤病情的好转和恶化是一致的,临床完全缓解的患者其血清AFP或hCG值轻度升高也预示癌瘤的残存或复发。虽然血清AFP和hCG的检测对卵巢内胚窦瘤和卵巢绒癌有明确诊断的意义,但卵巢恶性生殖细胞肿瘤的最后确诊还是依靠组织病理学的诊断。
4.治疗
(1) 治疗的目标:
治愈。
(2) 主要的治疗方式:
手术(剖腹探查进行手术分期、保守性单侧卵巢切除、切除容易切除的转移灶)和化疗(ⅠA期的无性细胞瘤和ⅠA期G1级的未成熟畸胎瘤除外)。保留生育功能是治疗的原则。
1) 手术治疗:由于绝大部分恶性生殖细胞肿瘤患者是希望生育的年轻女性,常为单侧卵巢发病,即使复发也很少累及对侧卵巢和子宫,更为重要的是卵巢恶性生殖细胞肿瘤对化疗十分敏感。因此,手术的基本原则是无论期别早晚,只要对侧卵巢和子宫未受肿瘤累及,均应行保留生育功能的手术,既仅切除患侧附件,同时行全面分期探查术。对于复发的卵巢生殖细胞肿瘤仍主张积极手术。
2) 化疗:恶性生殖细胞肿瘤对化疗十分敏感。根据肿瘤分期、类型和肿瘤标志物的水平,术后可采用3~6个疗程的联合化疗。常用化疗方案见表3。
表3 卵巢恶性生殖细胞肿瘤的常用化疗方案

注:博来霉素终生剂量为250mg/m
2,单次剂量不可超过30mg
生殖细胞肿瘤最有效的化疗方案是博来霉素、依托泊苷和顺铂(BEP)。所有的生殖细胞肿瘤,除了ⅠA期G1级的未成熟畸胎瘤,都应该进行单侧卵巢切除术和手术分期,紧接着4~6个疗程的BEP化疗。有肿瘤标志物升高的患者,化疗应持续至肿瘤标志物降至正常后2个疗程。ⅠA期G 1级未成熟畸胎瘤术后不需要进一步化疗。
(3) 放疗:
为手术和化疗的辅助治疗。无性细胞瘤对放疗最敏感,但由于无性细胞瘤的患者多年轻,要求保留生育功能,目前放疗已较少应用。对复发的无性细胞瘤,放疗仍能取得较好疗效。
(4) 随访和监测:
与卵巢上皮性肿瘤类似,内容包括盆腔检查、肿瘤标志物和影像学检查(CT、USG、PET)。术后1年,每个月1次;术后2年,每3个月1次;术后3年,每6个月1次;3年以上者,每年1次。
(5) 预后情况:
5年存活率:Ⅰ期95%,Ⅱ期70%,Ⅲ期60%,Ⅳ期30%。
十二、卵巢性索间质肿瘤的处理
1.诊断
卵巢性索间质肿瘤占卵巢恶性肿瘤的5%~8%,成人型颗粒细胞肿瘤(95%)发生在绝经期,发病的平均年龄是50~53岁。青少年型颗粒细胞肿瘤(5%)发生在20岁之前。颗粒细胞瘤常产生雌激素,75%的病例与假性性早熟有关,25%~50%的中老年女性病例与子宫内膜增生过长有关,5%与子宫内膜腺癌有关。支持细胞-间质细胞瘤属低度恶性,通常发生在30~40岁妇女,多数是单侧发生。典型的支持细胞-间质细胞肿瘤会产生雄激素,70%~85%的病例会有临床男性化的表现。虽然该类肿瘤多有性激素刺激的症状,但每一种性索间质肿瘤的诊断完全是根据肿瘤的病理形态,而不以临床内分泌功能及肿瘤所分泌的特殊激素来决定。
2.处理原则
治疗的目标是治愈。主要的治疗方式为手术和化疗。性索间质肿瘤较少见,并具有不可预测的生物学行为的特征。多数性索间质肿瘤(如:纤维瘤、泡膜细胞瘤、支持细胞瘤、硬化性间质瘤等)是良性的,应按良性卵巢肿瘤处理。有些是低度或潜在恶性的(如颗粒细胞瘤、间质细胞瘤、环管状性索间质瘤等),处理方案如下。
(1) 由于多数肿瘤是单侧发生,对于早期、年轻的患者可行单侧附件切除术及分期手术,保留生育功能。
(2) 对于期别较晚或已经完成生育的年龄较大患者,适合行全子宫双附件切除(TAH/BSO)进行手术分期,或行肿瘤细胞减灭手术。
(3) 还没确定最佳的辅助治疗方案,仅在存在低度恶性转移灶和残余肿瘤的时候才有化疗的指征。可以使用4~6个周期的BEP、VAC(长春新碱、放线菌素D和环磷酰胺)或PAC(顺铂、多柔比星和环磷酰胺)。因为分化不良的或Ⅱ期及Ⅱ期以上期别的支持细胞-间质细胞肿瘤更有可能复发,所以术后需要行辅助化疗。
(4) 因为这类肿瘤多数具有低度恶性、晚期复发的特点,故应坚持长期随诊。
3.预后
颗粒细胞肿瘤的10年存活率为90%,20年存活率为75%。支持细胞-间质细胞肿瘤的5年存活率为70%~90%。
[1] National Comprehensive Cancer Network. NCCN Clinical Practice Guidelines in Oncology(NCCN Guidelines):Ovarian cancer:including fallopian tube cancer and primary peritoneal cancer. Version 1.2013.Available at:http://www. nccn.org/professionals/physician_gls/pdf/ovarian.pdf.Accessed November 16,2012.
[2] Berek JS,Chalas E,Edelson M,et al. Prophylactic and riskreducing bilateral salpingo-oophorectomy:recommendations based on risk of ovarian cancer. Obstet Gynecol,2010,116 (3):733-743
[3] Coleman RL,Ramirez PT,Gershenson DM. Neoplastic diseases of the ovary:screening,benign and malignant epithelial and germ cell neoplasms,sex-cord stromal tumors// Lentz GM,Lobo RA,Gershenson DM,et al. Comprehensive Gynecology. 6th ed. Philadelphia,PA:Elsevier Mosby,2012
[4] Berek JS,Crum C,Friedlander M. FIGO cancer report 2012,Guest Editor:Lynette Danny. Int J Gynecol Obstet,2012,119:s11830-s12936
[5] Aghajanian C,Blank SV,Goff BA,et al. OCEANS:a randomized,double-blind,placebo-controlled phase Ⅲ trial of chemotherapy with or without bevacizumab in patients with platinum-sensitive recurrent epithelial ovarian,primary peritoneal,or fallopian tube cancer. J Clin Oncol,2012,30 (17):2039-2045
[6] Colombo N,Kutarska E,Dimopoulos M,et al. Randomized,open-label,phase Ⅲ study comparing patupilone(EPO906) with pegylated liposomal doxorubicin in platinum-refractory or-resistant patients with recurrent epithelial ovarian,primary fallopian tube,or primary peritoneal cancer. J Clin Oncol,2012,30(31):3841-3847
[7] Armstrong DK,Bundy B,Wenzel L,et al. Intraperitoneal Cisplatin and Paclitaxel in Ovarian Cancer. N Engl J Med,2006,354:34-43
[8] McGuire WP,Hoskins WJ,Brady MF,et al. Cyclophosphamide and cisplatin compared with paclitaxel and cisplatin in patients with stage III and stage IV ovarian cancer. N Engl J Med,1996,334:1-6
[9] Ozols RF,Bundy BN,Greer BE,et al. Phase III trial of carboplatin and paclitaxel compared with cisplatin and paclitaxel in patients with optimally resected stage III ovarian cancer:a Gynecologic Oncology Group study. J Clin Oncol,2003,21:3194-3200
[10] Bristow RE,Tomacruz RS,Armstrong DK,et al. Survival effect of maximal cytoreductive surgery for advanced ovarian carcinoma during the platinum era:a meta-analysis. J Clin Oncol,2002,20:1248-1259
[11] Armstrong D. Ovaries and fallopian tubes. In Abeloff MD,Armitage JO,Niederhuber JE,et al. ed. Abeloff's Clinical Oncology. 4th ed. Philadelphia,PA:Elsevier Churchill-Livingstone,2008