 去看看
去看看


1 头颈部肿瘤诊疗总则
头颈部肿瘤的MDT 诊疗模式

【注释】
头颈部肿瘤的诊治应特别重视多学科团队(multidisciplinary team,MDT)的作用,特别是对于局晚期头颈部鳞癌患者,MDT 原则应该贯穿治疗全程。
MDT的实施过程中由多个学科的专家共同分析患者的临床表现、影像、病理和分子生物学资料,对患者的一般状况、疾病的诊断、分期/侵犯范围、发展趋向和预后作出全面的评估,并根据当前的国内外治疗规范/指南或循证医学依据,结合现有的治疗手段,为患者制定最适合的整体治疗策略。
MDT团队应根据治疗过程中患者机体状况的变化、肿瘤的反应而适时调整治疗方案,以期最大幅度地延长患者的生存期、提高治愈率和改善生活质量。
2 头颈部肿瘤的诊断原则
2.1 影像诊断
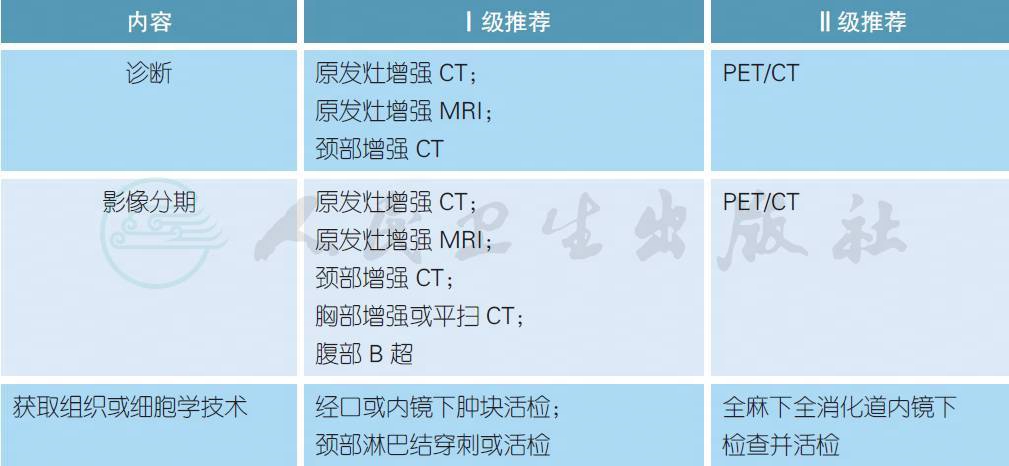
【注释】
头颈部肿瘤是常见的恶性肿瘤之一,在我国男性中的发生率为第6 位,死亡率为第7 位[2]。最常见的病理类型为鳞癌,除了鼻咽癌主要由EB 病毒引起,烟草和酒精是导致其他头颈部鳞癌的主要原因[3]。近年来,欧美国家中口咽癌的发病率明显上升,研究提示大部分与HPV感染具有直接关系,但我国的具体感染率尚不明确[4]。
原发灶的增强CT 或MRI 是诊断头颈部肿瘤的常用手段,二者各有利弊。CT 具有简便快速和普及性的优点,其缺点是具有一定的放射性辐射,并且不适合碘过敏或肾功能严重不全的患者。MRI的软组织分辨率较CT 显著提高同时具有多种显像参数,尤其适合原发于口腔、口咽和鼻咽的肿瘤,并且对于颅底和神经的显示能力出色。MRI 的缺点在于费时和价格相对昂贵,不适合具有金属植入以及患有幽闭综合征的患者。此外对于喉和下咽器官,容易由于不自主吞咽动作造成伪影。颈部是头颈部肿瘤最常见的淋巴结转移区域,颈部增强CT 是标准的分期手段,特别是对于特征性的淋巴结坏死具有良好的分辨能力。肺部是头颈部肿瘤最常见的远处转移部位,胸部CT 是标准的分期手段,并且有助于判断肺部其他合并疾病如慢支肺气肿等。
PET/CT 主要采用18F-FDG 作为示踪剂,近年来在头颈部肿瘤领域进行了广泛的研究[5]。对于原发病灶,由于PET/CT 通常结合低剂量平扫CT,因此其分辨率不如增强CT,并且具有一定的假阳性和假阴性。而对于颈部淋巴结和远处转移,荟萃分析显示PET/CT 具有一定的优势[6,7]。一项前瞻性研究显示,在常规分期手段上结合PET/CT 改变了13.7% 的患者治疗策略[8]。目前,NCCN 推荐对于临床Ⅲ / Ⅳ期患者治疗前进行PET/CT 检查[9]。
头颈部肿瘤的原发灶诊断主要依赖于经口或内镜下肿块活检,而淋巴结穿刺或活检有助于分期诊断。国外比较提倡在全麻下进行全上消化道内镜(panendoscopy) 检查,对可疑部位进行活检,有助于增加诊断成功率并且有可能发现第二原发肿瘤。
2.2 病理学诊断

【注释】
头颈部肿瘤的病理对于分期诊断和治疗选择至关重要[1]。无论是活检或穿刺标本,首先需要根据组织形态学确定良恶性及组织学类型,必要时结合免疫组化染色结果。对于头颈部鳞癌的根治性手术标本,需要提供肿瘤大小、分化程度、切缘、脉管侵犯、周围神经浸润、骨或软骨浸润、淋巴结转移部位和数目以及包膜外侵犯等信息。对于口腔癌,需要明确肿瘤浸润深度,从而有利于指导后续治疗策略[2]。对于口咽癌,有条件可以进行p16 的免疫组化检测以明确是否与HPV 感染相关,但目前各指南尚不建议根据检测结果决定后续个体化的治疗策略[2]。
2.3 分期
本指南采用UICC/AJCC TNM 分期系统(第7 版),主要考虑到普及性。虽然第8 版分期于2018年1 月1 日启用,但鉴于其特殊要求特别是针对口咽癌的HPV 检测以及口腔癌的浸润深度等内容尚未在国内常规开展,故本指南暂不采用。
2.3.1 唇癌和口腔癌
原发肿瘤(T)
Tx 原发肿瘤无法评价
T0 无原发肿瘤证据
Tis 原位癌
T1 肿瘤最大径≤ 2cm
T2 肿瘤最大径>2cm,≤ 4cm
T3 肿瘤最大径>4cm
T4a 中等晚期局部疾病*
(唇) 肿瘤侵犯骨皮质、下牙槽神经、口底或面部皮肤(如颏或鼻)
(口腔)肿瘤侵犯临近结构[ 如穿透骨皮质(下颌骨或上颌骨)至舌的深部(外部)肌肉(颏舌肌、舌骨舌肌、舌腭肌和茎突舌肌),上颌窦,面部皮肤
T4b 非常晚期局部疾病
肿瘤侵犯咀嚼肌间隙、翼板或颅底和/ 或包绕颈内动脉
* 注释:原发齿龈的肿瘤仅侵犯浅表的牙/ 牙槽窝不足以分为T4
区域淋巴结(N)
Nx 区域淋巴结无法评价
N0 无区域淋巴结转移
N1 同侧单个淋巴结转移,最大径≤ 3cm
N2 同侧单个淋巴结转移,最大径>3cm,≤ 6cm;或同侧多个淋巴结转移,最大径≤ 6cm;或双侧或对侧淋巴结转移,最大径≤ 6cm
N2a 同侧单个淋巴结转移,最大径>3cm,≤ 6cm
N2b 同侧多个淋巴结转移,最大径≤ 6cm
N2c 双侧或对侧淋巴结转移,最大径≤ 6cm
N3 转移淋巴结最大径>6cm
远处转移(M)
M0 无远处转移
M1 有远处转移
2.3.2 口咽癌
原发肿瘤(T)
Tx 原发肿瘤无法评价
T0 无原发肿瘤证据
Tis 原位癌
T1 肿瘤最大径≤ 2cm
T2 肿瘤最大径>2cm,≤ 4cm
T3 肿瘤最大径> 4cm,或侵犯会厌的舌面
T4a 中等晚期局部疾病
肿瘤侵犯喉、舌的外部肌肉、翼内肌、硬腭或下颌骨*
T4b 非常晚期局部疾病
肿瘤侵犯翼外肌、翼板、鼻咽侧壁、或颅底或包绕颈动脉
* 注释:舌根或会厌谷的原发肿瘤侵犯至会厌舌面黏膜并不意味着侵犯喉
区域淋巴结(N)**
Nx 区域淋巴结无法评价
N0 无区域淋巴结转移
N1 同侧单个淋巴结转移,最大径≤ 3cm
N2 同侧单个淋巴结转移,最大径>3cm,≤ 6cm;或同侧多个淋巴结转移,最大径
≤ 6cm;或双侧或对侧淋巴结转移,最大径≤ 6cm
N2a 同侧单个淋巴结转移,最大径>3cm,≤ 6cm
N2b 同侧多个淋巴结转移,最大径≤ 6cm
N2c 双侧或对侧淋巴结转移,最大径≤ 6cm
N3 转移淋巴结最大径>6cm
** 注释:Ⅶ区转移也被认为是区域淋巴结转移。
远处转移(M)
M0 无远处转移
M1 有远处转移
2.3.3 声门上型喉癌
原发肿瘤(T)
Tx 原发肿瘤无法评价
T0 无原发肿瘤证据
Tis 原位癌
T1 肿瘤局限在声门上的1 个亚区,声带活动正常
T2 肿瘤侵犯声门上1 个以上相邻亚区,侵犯声门区或声门上区以外(如舌根、会厌谷、梨状窝内侧壁的黏膜),无喉固定
T3 肿瘤局限在喉内,有声带固定和/ 或侵犯任何下述部位:环后区、会厌前间隙、声门旁间隙和/ 或甲状软骨内板
T4a 中等晚期局部疾病
肿瘤侵犯穿过甲状软骨和/ 或侵犯喉外组织(如气管、包括深部舌外肌在内的颈部软组织、带状肌、甲状腺或食管)
T4b 非常晚期局部疾病
肿瘤侵犯椎前筋膜,包绕颈动脉或侵犯纵隔结构
区域淋巴结(N)
Nx 区域淋巴结无法评价
N0 无区域淋巴结转移
N1 同侧单个淋巴结转移,最大径≤ 3cm
N2 同侧单个淋巴结转移,最大径>3cm,≤ 6cm;或同侧多个淋巴结转移,最大径≤ 6cm;或双侧或对侧淋巴结转移,最大径≤ 6cm
N2a 同侧单个淋巴结转移,最大径>3cm,≤ 6cm
N2b 同侧多个淋巴结转移,最大径≤ 6cm
N2c 双侧或对侧淋巴结转移,最大径≤ 6cm
N3 转移淋巴结最大径>6cm
远处转移(M)
M0 无远处转移
M1 有远处转移
2.3.4 声门型喉癌
原发肿瘤(T)
Tx 原发肿瘤无法评价
T0 无原发肿瘤证据
Tis 原位癌
T1 肿瘤局限于声带(可侵犯前联合或后联合),声带活动正常
T1a 肿瘤局限在一侧声带
T1b 肿瘤侵犯双侧声带
T2 肿瘤侵犯至声门上和/ 或声门下区,和/ 或声带活动受限
T3 肿瘤局限在喉内,伴有声带固定和/ 或侵犯声门旁间隙,和/ 或甲状软骨内板
T4a 中等晚期局部疾病
肿瘤侵犯穿过甲状软骨和/ 或侵犯喉外组织(如气管、包括深部舌外肌在内的颈部软组织、带状肌、甲状腺或食管)
T4b 非常晚期局部疾病
肿瘤侵犯椎前筋膜,包绕颈动脉或侵犯纵隔结构
区域淋巴结(N)
Nx 区域淋巴结无法评价
N0 无区域淋巴结转移
N1 同侧单个淋巴结转移,最大径≤ 3cm
N2 同侧单个淋巴结转移,最大径>3cm,≤ 6cm;或同侧多个淋巴结转移,最大径≤ 6cm;或双
侧或对侧淋巴结转移,最大径≤ 6cm
N2a 同侧单个淋巴结转移,最大径>3cm,≤ 6cm
N2b 同侧多个淋巴结转移,最大径≤ 6cm
N2c 双侧或对侧淋巴结转移,最大径≤ 6cm
N3 转移淋巴结最大径>6cm
远处转移(M)
M0 无远处转移
M1 有远处转移
2.3.5 声门下型喉癌
原发肿瘤(T)
Tx 原发肿瘤无法评价
T0 无原发肿瘤证据
Tis 原位癌
T1 肿瘤局限在声门下区
T2 肿瘤侵犯至声带,声带活动正常或活动受限
T3 肿瘤局限在喉内,伴有声带固定
T4a 中等晚期局部疾病
肿瘤侵犯环状软骨或甲状软骨和/ 或侵犯喉外组织(如气管、包括深部舌外肌在内的颈部软组织、带状肌、甲状腺或食管)
T4b 非常晚期局部疾病
肿瘤侵犯椎前筋膜,包绕颈动脉或侵犯纵隔结构
区域淋巴结(N)
Nx 区域淋巴结无法评价
N0 无区域淋巴结转移
N1 同侧单个淋巴结转移,最大径≤ 3cm
N2 同侧单个淋巴结转移,最大径>3cm,≤ 6cm;或同侧多个淋巴结转移,最大径≤ 6cm;或双侧或对侧淋巴结转移,最大径≤ 6cm
N2a 同侧单个淋巴结转移,最大径>3cm,≤ 6cm
N2b 同侧多个淋巴结转移,最大径≤ 6cm
N2c 双侧或对侧淋巴结转移,最大径≤ 6cm
N3 转移淋巴结最大径>6cm
远处转移(M)
M0 无远处转移
M1 有远处转移
2.3.6 下咽癌
原发肿瘤(T)
Tx 原发肿瘤无法评价
T0 无原发肿瘤证据
Tis 原位癌
T1 肿瘤局限在下咽的某一解剖亚区且最大径≤ 2cm
T2 肿瘤侵犯一个以上下咽解剖亚区或邻近解剖区
T3 肿瘤最大径>4cm 或半喉固定或侵犯食管
T4a 中等晚期局部疾病
肿瘤侵犯甲状/ 环状软骨、舌骨、甲状腺或中央区软组织*
T4b 非常晚期局部疾病
肿瘤侵犯椎前筋膜,包绕颈动脉或侵犯纵隔结构
* 注释:中央区软组织包括喉前带状肌和皮下脂肪
区域淋巴结(N)
Nx 区域淋巴结无法评价
N0 无区域淋巴结转移
N1 同侧单个淋巴结转移,最大径≤ 3cm
N2 同侧单个淋巴结转移,最大径>3cm,≤ 6cm;或同侧多个淋巴结转移,最大径≤ 6cm;或双侧或对侧淋巴结转移,最大径≤ 6cm
N2a 同侧单个淋巴结转移,最大径>3cm,≤ 6cm
N2b 同侧多个淋巴结转移,最大径≤ 6cm
N2c 双侧或对侧淋巴结转移,最大径≤ 6cm
N3 转移淋巴结最大径>6cm
远处转移(M)
M0 无远处转移
M1 有远处转移
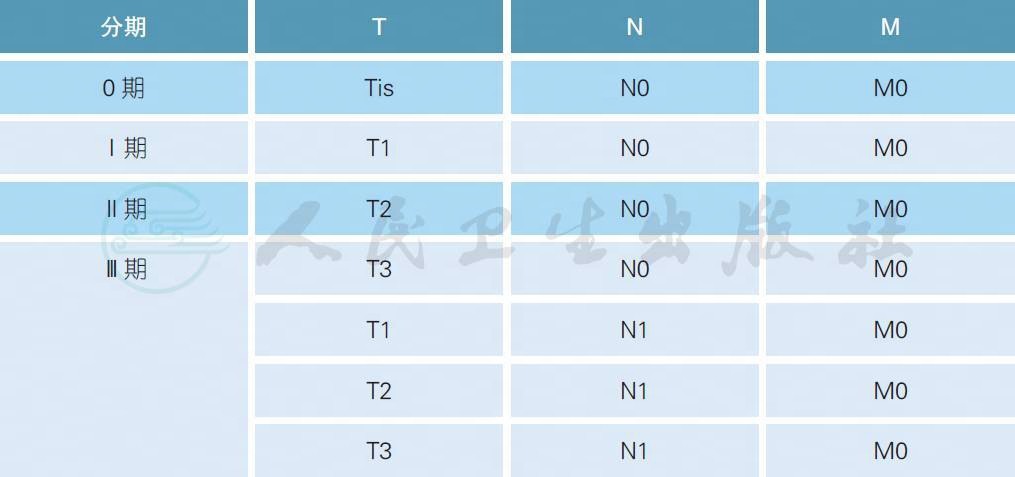
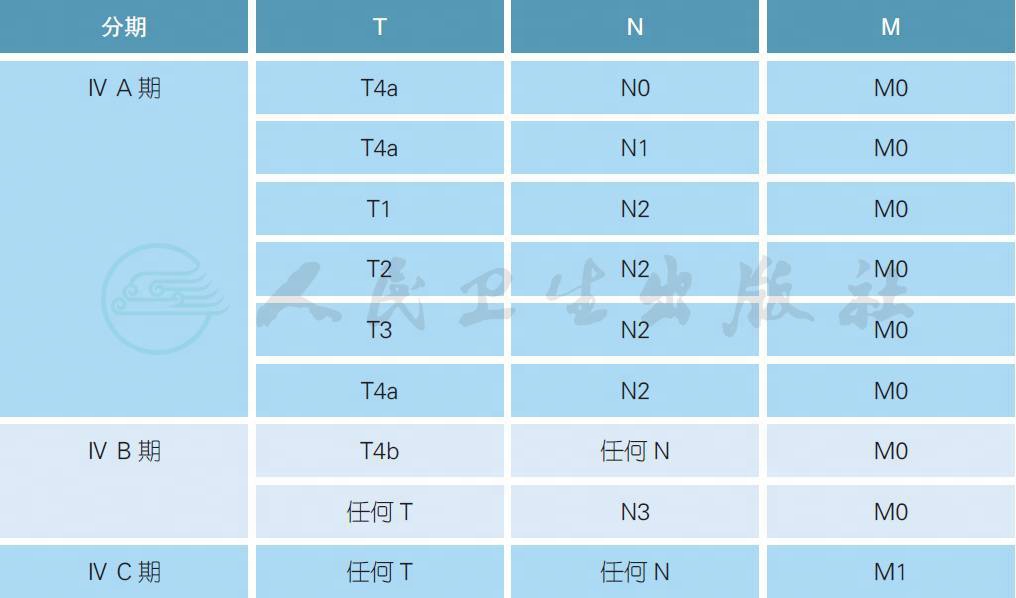
2.3.7 总体分期
3 早期和局晚期头颈部鳞癌的治疗原则
3.1 口腔癌的治疗
3.1.1 早期口腔癌的治疗

注:
不适宜手术定义:患者身体条件不允许或由于各种原因拒绝手术
【注释】
早期口腔癌应采用手术作为主要的根治手段,只有对于不适宜手术的患者可以考虑局部放疗。 手术应至少保证> 5mm 的安全切缘,否则有可能影响治疗效果[2]。早期口腔癌也有一定的几率发生 颈部淋巴结转移,虽然一项Ⅲ期随机试验证实了预防性颈部淋巴结选择性清扫(Ⅰ ~ Ⅲ区) 的生存 获益,但是否所有的早期患者均需要接受颈部淋巴结清扫尚无定论[3]。近年来多项研究显示肿瘤 的浸润深度与颈部淋巴结转移以及预后相关,因此也促成了第8 版AJCC 分期把浸润深度增加为 口腔癌的T 分期标准[4-6]。NCCN 指南推荐对于肿瘤浸润深度> 4mm 的患者进行Ⅰ - Ⅲ区的同侧或 双侧颈部淋巴结清扫(当肿瘤位于或靠近中线);对于浸润深度在2~4mm 的患者,指南推荐根据 临床实际情况决定是否需要进行淋巴结清扫[7]。前哨淋巴结活检是代替颈部淋巴结清扫的一种手 段,但需要在有经验的中心进行[8]。患者术后病理或组织学检测提示有高危因素时,需行术后放疗 或放化疗,术后放疗的剂量通常为60~66Gy。对于少部分因为身体条件不允许接受手术的早期口腔 癌患者,单纯放疗特别是近距离放疗是另一个选择,但需要在有经验的中心进行并遵循行业协会的 指南推荐[9,10]。
3.1.2 局晚期口腔癌的治疗
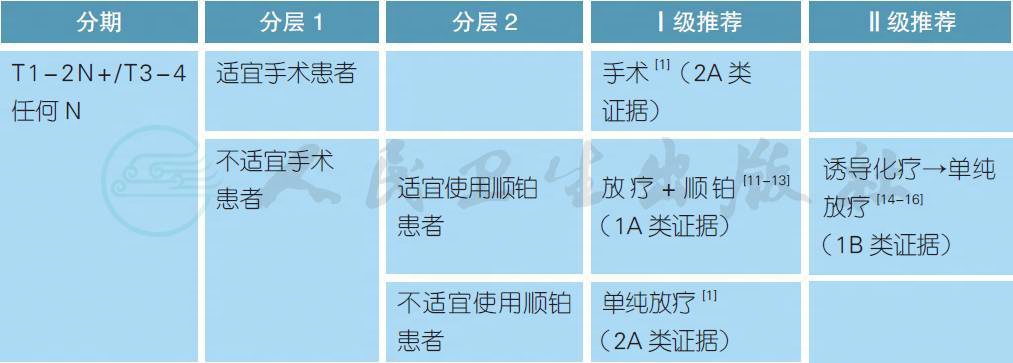
注:
不适宜手术定义:患者身体条件不允许、由于各种原因拒绝手术或肿瘤负荷太大无法切除
不适宜使用顺铂定义:患者年龄>70 岁、PS>2、听力丧失、肾功能不全(肌酐清除率< 50ml/min) 或具有>1 级的神经病变[17]
【注释】
对于局晚期口腔癌患者,手术仍然是主要的根治手段,手术方式包括经口、下颌骨舌侧松解
和下颌骨切开入路,同时对手术缺损采用必要的修复重建。颈部手术应采用选择性或根治性清扫淋巴结,如为N2c 期或原发灶位于或靠近中线应考虑对侧颈部清扫。术后辅助放疗应在术后6 周内进行,具有一般高危因素者(T3~4、淋巴结转移、脉管侵犯、周围神经浸润)建议术后单纯放疗,切缘阳性/ 不足或淋巴结包膜外侵者建议同期放化疗。研究显示,有淋巴结包膜外侵和/ 或镜下手术切缘距病灶<1mm 者接受了术后同期放化疗较单纯放疗者有明显的生存获益[18]。
对于不适宜手术的局晚期口腔癌患者,放疗联合顺铂(100mg/m2,每3 周1 次,连续3 次)是常用的治疗模式。放疗剂量通常为66~70Gy,对于不适宜使用顺铂或高龄患者(>70 岁) 可给予单纯放疗。对于肿瘤负荷太大无法切除的患者,也可以考虑行诱导化疗联合放疗的序贯治疗。常用的诱导化疗方案是TPF(多西他赛 75mg/m2,第1 天;顺铂 75mg/m2,第1 天;5-FU 750mg/m2,第1~5天;每3 周重复,连续3 个周期),但随机研究并未证明其生存结果优于同期放化疗[14-16]。
3.2 口咽癌的治疗
3.2.1 早期口咽癌的治疗

注:
不适宜手术定义:患者身体条件不允许或由于各种原因拒绝手术
【注释】
早期口咽癌应采用手术或单纯放疗的单一治疗模式,回顾性分析显示二者的总体疗效相近[2,3]。治疗方式的选择应基于肿瘤的大小、位置、手术后可能的功能障碍、手术或放疗医生的治疗水平和经验,强烈建议多学科综合治疗团队对生活质量和治疗结果做出完整评估(治疗的有效性、功能维持、并发症等) 后决定。手术方式可选择开放或经口入路切除原发灶,经口手术能够提供更好的功能保护,有条件可选择经口激光显微手术或机器人手术。早期口咽癌具有隐匿性的颈淋巴结转移,因此除了原发灶切除外需进行同侧选择性颈部淋巴结清扫。淋巴结清扫应包括同侧II~IV 区,当肿瘤向前侵犯时可能需要包括I 区[4]。如原发灶位于或靠近中线如软腭、舌根或咽后壁时则应考虑对侧清扫以得到对侧颈淋巴结的实际分期。有回顾性分析发现当术前提示颈部IIa 区无侵犯时,无需行IIb 区的颈清扫。患者术后病理或组织学检测提示有高危因素时,需行术后放疗或放化疗,术后放疗的剂量通常为60~66 Gy。
根治性放疗前患者应进行饮食、言语和口腔的评估,放疗剂量通常为66~70 Gy。放疗靶区勾画应基于增强CT,MRI 扫描可作为很好的辅助参考。放疗靶区包括原发灶和Ⅱ ~ Ⅳ区颈部淋巴结,肿瘤向前侵犯和/ 或侵及前扁桃体柱时需包括Ib 区。原发灶为单侧(如扁桃体) 可行同侧颈部淋巴结的预防性照射,如原发灶位于或靠近中线如软腭、舌根或咽后壁(侵及中线结构大于1cm) 则考虑双颈部照射。放疗计划应至少采取三维适形,推荐调强放疗(IMRT)。
3.2.2 局晚期口咽癌的治疗
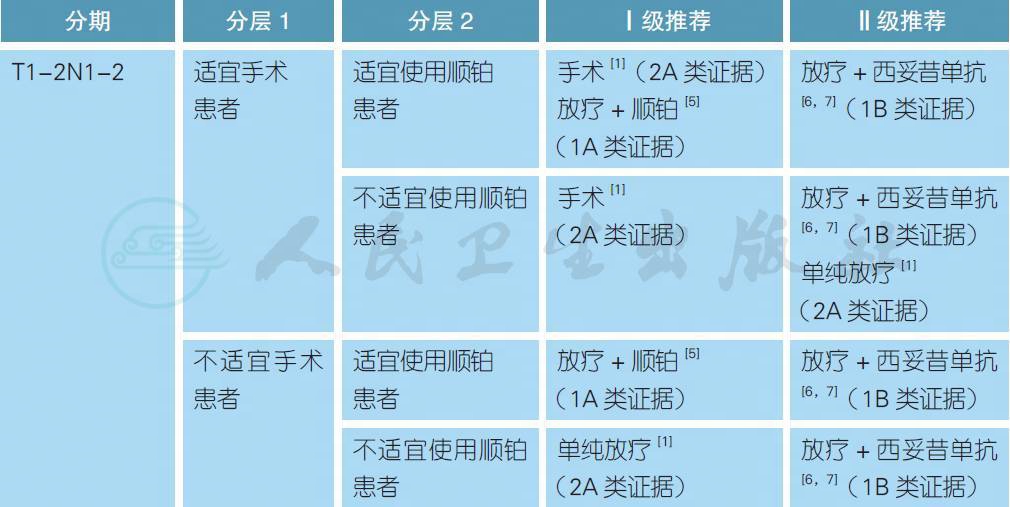
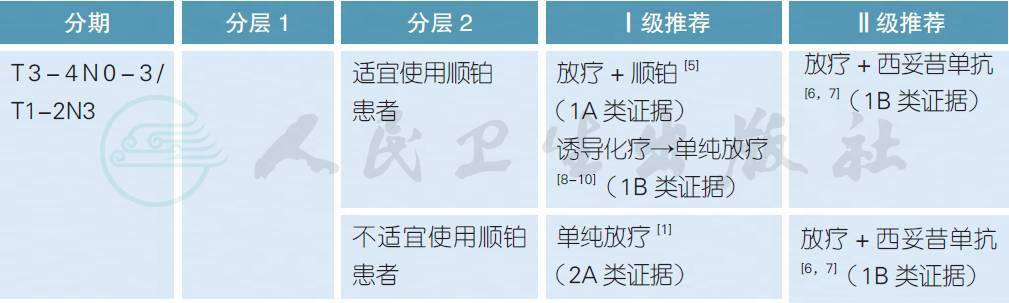
注:
不适宜手术定义:患者身体条件不允许、由于各种原因拒绝手术或肿瘤负荷太大无法切除
不适宜使用顺铂定义:患者年龄>70 岁、PS>2、听力丧失、肾功能不全(肌酐清除率< 50 ml/min) 或具有>1 级的神经病变[11]
3.3 喉癌的治疗
3.3.1 早期喉癌的治疗

注:
不适宜手术定义:患者身体条件不允许或由于各种原因拒绝手术
【注释】
早期喉癌应采用手术或单纯放疗的单一治疗模式,系统性综述显示二者的总体疗效相近[2]。治疗方式的选择应基于肿瘤的大小、位置(比如肿瘤累及前连合多采用放疗)、手术后可能的功能障碍、手术或放疗医生的治疗水平和经验,强烈建议多学科综合治疗团队对发音功能、生活质量和治疗结果做出完整评估(治疗的有效性、功能维持、并发症等) 后决定。手术方式可选择开放或经口入路切除原发灶,经口手术能够提供更好的功能保护,有条件可选择经口激光显微手术或机器人手术。早期声门型喉癌极少发生颈部淋巴结转移,因此无需进行颈部淋巴结清扫;而对于声门上型喉癌, 则需要进行双颈部II-IV 区的选择性颈部淋巴结清扫。患者术后病理或组织学检测提示有高危因素时,需行术后放疗或放化疗,术后放疗的剂量通常为60~66 Gy。
根治性放疗前患者应进行饮食、言语和口腔的评估,放疗剂量通常为66~70 Gy。放疗靶区勾画应基于增强CT,MRI 扫描可作为很好的辅助参考。早期声门型喉癌放疗靶区原则上包括原发灶即可, 无需行预防性颈淋巴结引流区的照射。对于声门上型喉癌,放疗靶区包括原发灶和双颈部II~IV 区淋巴结。放疗计划应至少采取三维适形,推荐调强放疗(IMRT)。
3.3.2 局晚期喉癌的治疗
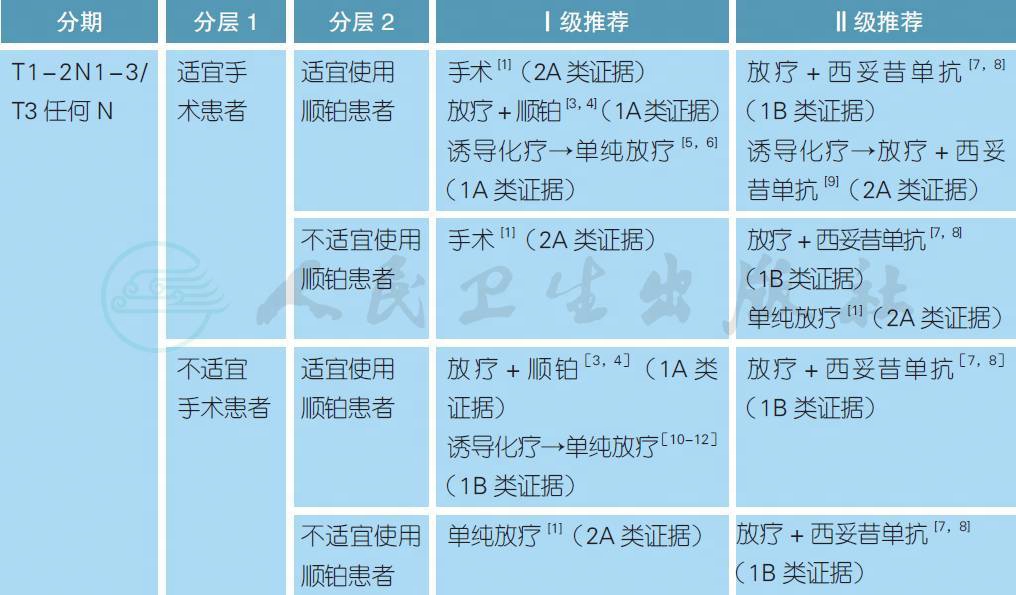
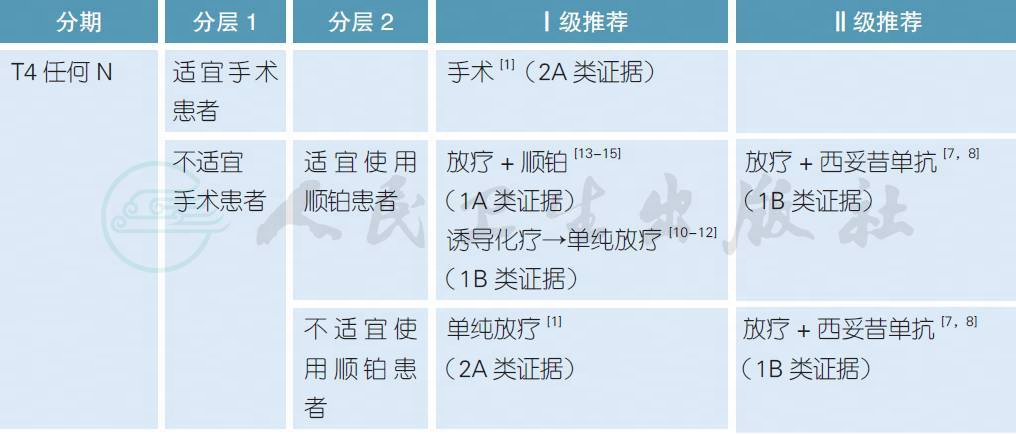
注:
不适宜手术定义:患者身体条件不允许、由于各种原因拒绝手术或肿瘤负荷太大无法切除
不适宜使用顺铂定义:患者年龄>70 岁、PS>2、听力丧失、肾功能不全(肌酐清除率<50ml/min) 或具有>1 级的神经病变[16]
【注释】
对于局晚期喉癌患者,除了T1~2 和部分T3 病灶以外(手术治疗参照前一节),大部分患者的手术治疗需要包括全喉切除术,通常需要联合术后放疗或放化疗。颈部手术应根据淋巴结转移部位采用选择性或根治性双颈部淋巴结清扫,至少包括II~IV 区,必要时(如T4) 包括V 区。术后辅助放疗应在术后6 周内进行,具有一般高危因素者(T3~4、淋巴结转移、脉管侵犯、周围神经浸润) 建议术后单纯放疗,切缘阳性/ 不足或淋巴结包膜外侵者建议同期放化疗。研究显示,有淋巴结包膜外侵和/ 或镜下手术切缘距病灶< 1mm 者接受了术后同期放化疗较单纯放疗者有明显的生存获益[17]。
对于原发灶分期T4 的患者,由于放疗的保喉和治疗效果欠佳,对于有手术切除可能的患者, 强烈建议手术治疗。此外,近期发表的ASCO 指南建议对于广泛的T3、T4 病灶或者治疗前已经有喉功能严重受损的患者,全喉切除术可能具有更好的生存率和生活质量[18]。而对于其他有保喉意愿的患者,放疗联合顺铂是常用的治疗模式[3,4]。对于不适宜使用顺铂的患者,可采用放疗联合西妥昔单抗[7,8]。放疗剂量通常为66-70Gy,可分别联合顺铂(100mg/m2,每3 周1 次,连续3 次) 或每周1 次的西妥昔单抗(400mg/m2,第1 周,250mg/m2,第2~8 周)。对于不适宜接受同期药物治疗的局晚期患者可接受单纯放疗,特别是对于同期治疗生存获益不明确的高龄患者(> 70 岁)[14]。对于接受根治性放疗的N2-3 患者,如果放疗后3 个月的PET/CT 显示完全缓解,则无需进行颈部淋巴结清扫[19]。对于放疗/ 同期放化疗后肿瘤残留或局部复发的患者,推荐有条件者接受挽救性手术,手术方式通常为全喉切除术[20]。
诱导化疗是另一种喉保留的治疗策略,如果化疗后肿瘤达到完全或部分缓解,这部分患者后续接受单纯放疗或同期联合西妥昔单抗,否则接受全喉切除术[5,6,9]。标准的诱导化疗方案是TPF(多西他赛 75mg/m2,第1 天;顺铂 75mg/m2,第1 天;5-FU 750mg/m2,第1~5 天;每3 周重复,连续3 个周期)。此外,对于肿瘤负荷太大无法切除或分期T4 或N2c-N3 的患者,也可以考虑行诱导化疗联合放疗的序贯治疗,在缩小肿瘤负荷同时有可能降低远处转移的风险。常用的化疗方案仍然是TPF,但随机研究并未证明其生存结果优于同期放化疗[10-12]。
3.4 下咽癌的治疗
3.4.1 早期下咽癌的治疗

注:
不适宜手术定义:患者身体条件不允许或由于各种原因拒绝手术
【注释】
早期下咽癌应采用手术或单纯放疗的单一治疗模式,回顾性分析显示二者的总体疗效相近[2,3]。治疗方式的选择应基于肿瘤的大小、位置、手术后可能的功能障碍、手术或放疗医生的治疗水平和经验,强烈建议多学科综合治疗团队对生活质量和治疗结果做出完整评估(治疗的有效性、功能维持、并发症等) 后决定。手术方式可选择开放或经口入路切除原发灶,经口手术能够提供更好的功能保护,有条件可选择经口激光显微手术或机器人手术。早期下咽癌具有隐匿性的颈淋巴结转移, 因此除了原发灶切除外需进行同侧Ⅱ ~ Ⅳ区的选择性颈部淋巴结清扫。如原发灶位于或靠近中线如咽后壁、环后隙或梨状窝内侧壁时则应考虑对侧清扫以得到对侧颈淋巴结的实际分期。患者术后病理或组织学检测提示有高危因素时,需行术后放疗或放化疗,术后放疗的剂量通常为60~66Gy。
根治性放疗前患者应进行饮食、言语和口腔的评估,放疗剂量通常为66~70Gy。放疗靶区勾画应基于增强CT,MRI 扫描可作为很好的辅助参考,放疗靶区包括原发灶和Ⅱ ~ Ⅳ区颈部淋巴结。原发灶为单侧可行同侧颈部淋巴结的预防性照射,如原发灶位于或靠近中线如咽后壁、环后隙或梨状窝内侧壁则考虑双颈部照射。放疗计划应至少采取三维适形,推荐调强放疗(IMRT)。
3.4.2 局晚期下咽癌的治疗
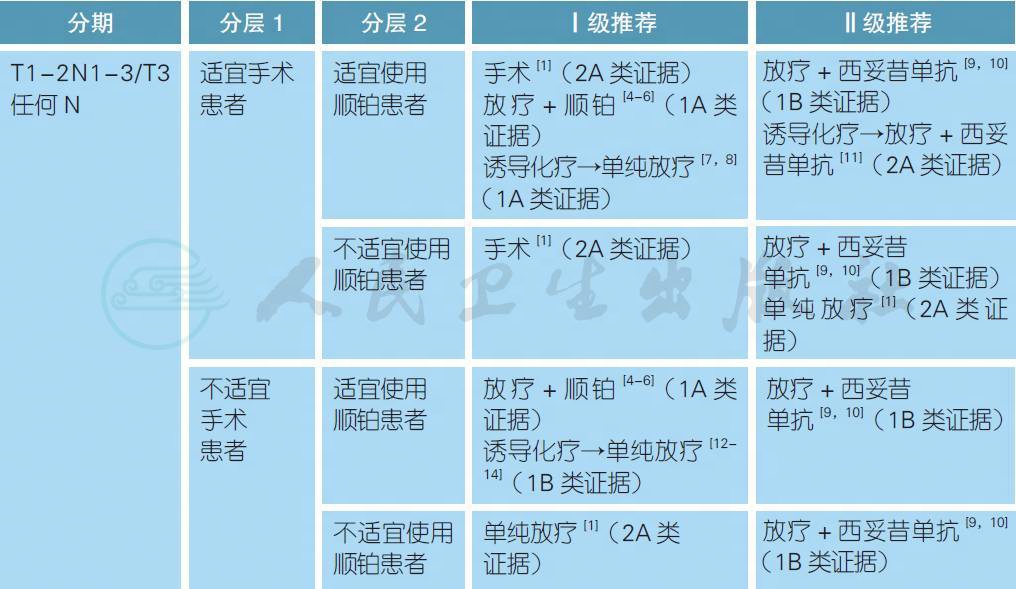

注:
不适宜手术定义:患者身体条件不允许、由于各种原因拒绝手术或肿瘤负荷太大无法切除
不适宜使用顺铂定义:患者年龄>70 岁、PS>2、听力丧失、肾功能不全(肌酐清除率< 50ml/min) 或具有>1 级的神经病变[15]
【注释】
对于局晚期下咽癌患者,除了T1 和部分T2 病灶以外(手术治疗参照前一节),大部分患者的手术治疗需要包括全喉切除术,通常需要联合术后放疗或放化疗。颈部手术应采用选择性或根治性清扫淋巴结,如为N2c 期或原发灶位于或靠近中线如咽后壁、环后隙或梨状窝内侧壁应考虑对侧颈部清扫。术后辅助放疗应在术后6 周内进行,具有一般高危因素者(T3~4、淋巴结转移、脉管侵犯、周围神经浸润)建议术后单纯放疗,切缘阳性/ 不足或淋巴结包膜外侵者建议同期放化疗。研究显示, 有淋巴结包膜外侵和/ 或镜下手术切缘距病灶<1mm 者接受了术后同期放化疗较单纯放疗者有明显的生存获益[16]。
对于原发灶分期T4 的患者,由于放疗的保喉和治疗效果欠佳,对于有手术切除可能的患者, 强烈建议手术治疗。而对于其他有保喉意愿的患者,放疗联合顺铂是常用的治疗模式[4-6]。对于不适宜使用顺铂的患者,可给予放疗联合西妥昔单抗[9,10]。放疗剂量通常为66~70Gy,可分别联合顺铂(100mg/m2,每3 周1 次,连续3 次) 或每周1 次的西妥昔单抗(400mg/m2,第1 周,250mg/m2, 第2~8 周)。对于不适宜接受同期药物治疗的局晚期患者可接受单纯放疗,特别是对于同期治疗生存获益不明确的高龄患者(> 70 岁)[5]。对于接受根治性放疗的N2~3 患者,如果放疗后3 个月的PET/ CT 显示完全缓解,则无需进行颈部淋巴结清扫[17]。对于放疗/ 同期放化疗后肿瘤残留或局部复发的患者,推荐有条件者接受挽救性手术[18]。
诱导化疗是另一种喉保留的治疗策略,如果化疗后肿瘤达到完全或部分缓解,这部分患者后续接受单纯放疗或同期联合西妥昔单抗,否则接受全喉切除术[7,8,11]。标准的诱导化疗方案是TPF(多西他赛 75mg/m2,第1 天;顺铂 75mg/m2,第1 天;5-FU 750mg/m2,第1~5 天;每3 周重复,连续3 个周期)。此外,对于肿瘤负荷太大无法切除或分期T4 或N2c~N3 的患者,也可以考虑行诱导化疗联合放疗的序贯治疗,在缩小肿瘤负荷同时有可能降低远处转移的风险。常用的化疗方案仍然是TPF,但随机研究并未证明其生存结果优于同期放化疗[12-14]。
4 复发转移性头颈部鳞癌的治疗
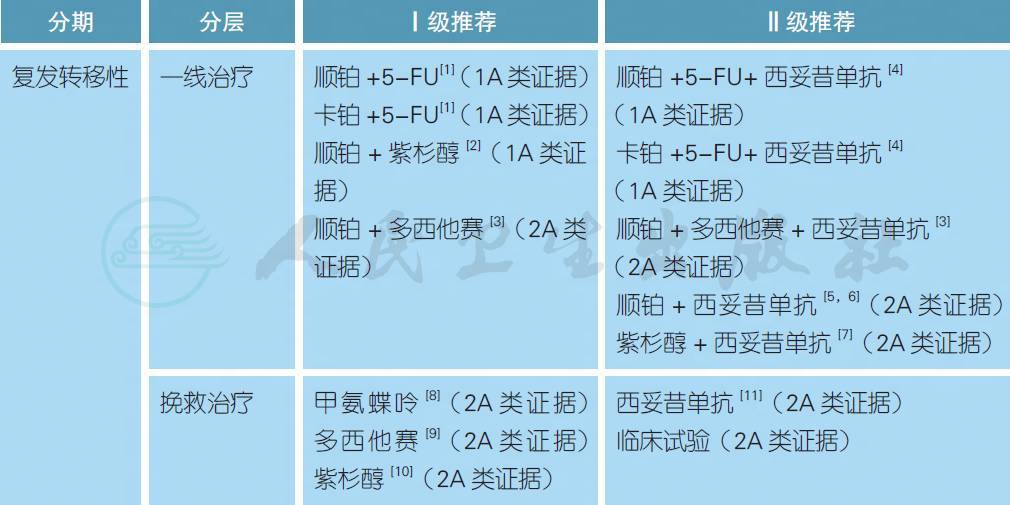
【注释】
对于复发性头颈部鳞癌患者,只有少部分有可能再次接受根治性局部治疗如手术或放疗,大部分和转移性患者一样需要接受姑息性系统治疗(PS 0-1)或最佳支持治疗(PS ≥ 2)。顺铂联合5-FU (PF 方案)或联合紫杉醇类是常用的一线化疗方案选择,如果患者不适宜接受顺铂,可以用卡铂替代。ECOG 1395 研究提示顺铂联合5-FU 或紫杉醇具有类似的疗效,前者具有较高的口腔黏膜炎,而后者的外周神经毒性发生率较高[2]。表皮生长因子受体(EGFR)是头颈部鳞癌重要的预后因素和治疗靶点[12]。一项名为EXTREME 的前瞻性III 期随机研究证实,在铂类联合5-FU 的化疗基础上联合西妥昔单抗显著延长了中位总生存(10.1 vs. 7.4 个月,HR 0.8,P = 0.04),同时改善了生活质量[4,13]。对于一线无法耐受5-FU 的患者,可以考虑顺铂、多西他赛和西妥昔单抗的组合[3]。对于一线无法耐受联合化疗的患者,顺铂联合西妥昔单抗是合理的选择[5,6]。对于一线无法耐受铂类药物(如高龄) 的患者,紫杉醇单药联合西妥昔单抗是合理的选择[7]。
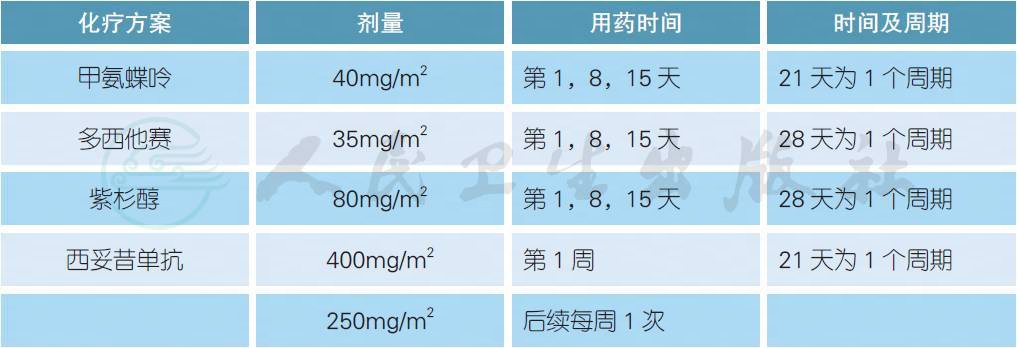
对于一线铂类药物治疗失败的复发转移性头颈部鳞癌,目前国内缺乏标准的治疗方案,国外常用的药物为甲氨蝶呤[8]。如果一线没有接受过紫杉类药物,二线使用紫杉醇或多西他赛具有一定的挽救治疗效果[9,10]。西妥昔单抗也同样适用于一线没有暴露过该药物或PS 评分不佳的患者[11]。近年来,免疫检查点抑制剂如抗PD-1 药物在晚期头颈部鳞癌中得到了迅速的发展,2016 年美国FDA 连续批准了派姆单抗(pembrolizumab) 和纳武单抗(nivolumab) 挽救治疗复发转移性头颈部鳞癌的适应证。在一项名为CheckMate-141 的前瞻性III 期随机对照研究中,对于以往铂类药物治疗后6 个月内进展的患者,与研究者的选择方案相比,纳武单抗显著延长了中位总生存(7.5 vs. 5.1 个月,HR 0.70,P = 0.01),并且改善了生活质量[14,15]。迄今为止,派姆单抗和纳武单抗尚未在国内上市,因此对于一线铂类药物治疗失败的患者,二线参加包含抗PD-1/PD-L1 单抗的临床试验也是一种合理的选择。
常用复发转移性头颈部鳞癌的一线化疗方案
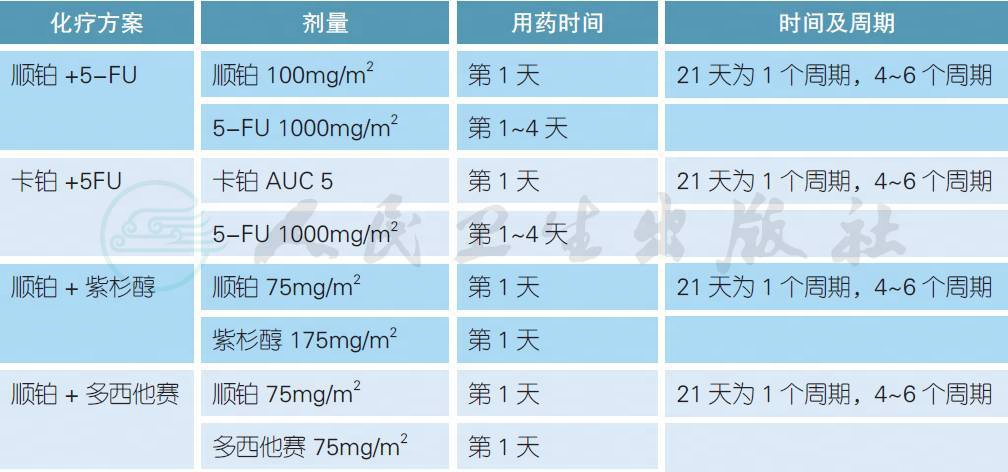
注:上述方案均可联合西妥昔单抗,用法为每周1 次,400mg/m2(第1 周),250mg/m2(后续每周),化疗结束后给予维持治疗直至疾病进展或毒性不可耐受
常用复发转移性头颈部鳞癌的挽救治疗方案
5 随访
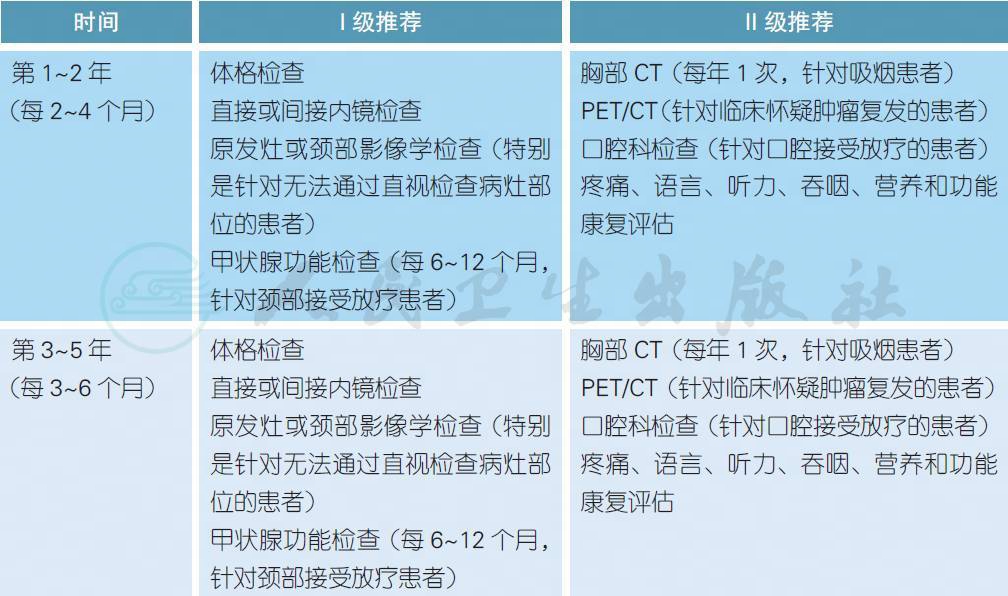
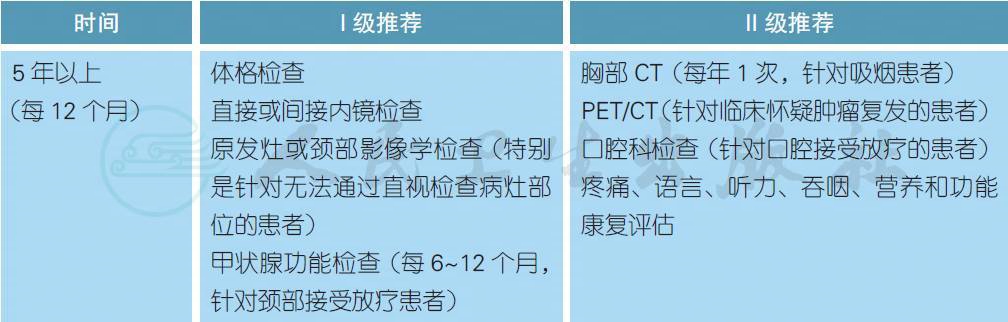
【注释】
头颈部肿瘤的治疗后随访非常重要,其目的在于评估治疗效果、早期发现复发病灶、早期发现第二原发肿瘤、监测和处理治疗相关并发症、促进功能康复等[1]。对于头颈部鳞癌,患者每次随访需要进行体格检查和既往病灶部位的直接或间接内镜检查。对于无法直视检查的部位,建议行相应的影像学检查。如果临床怀疑肿瘤复发,可以考虑行PET 检查[2]。对于接受根治性治疗的头颈部鳞癌患者,特别是接受放疗的患者,建议治疗后3 个月进行肿瘤评估。对于其中的N2~3 患者,建议3 个月后进行PET/CT 检查以决定是否需要接受颈部淋巴结清扫[3]。由于头颈部鳞癌患者大多有吸烟和酗酒的习惯,每年大约有3%~5% 的几率发生第二原发肿瘤,因此治疗后随访需要检查整个上消化道[4]。对于既往有吸烟习惯的患者,推荐每年行胸部CT 检查筛选早期肺癌[5]。对于接受颈部放疗的患者,推荐定期检查甲状腺功能以防止甲状腺功能减退,同时定期进行牙齿功能的检查。对于头颈部肿瘤,无论是手术或放疗均有可能损害头颈部器官的重要生理功能,推荐有条件的患者定期接受疼痛、语言、听力、吞咽、营养等功能评估,并积极接受康复治疗。
2.1 影像诊断
1. Lewis-Jones H,Colley S,Gibson D,et al. Imaging in head and neck cancer:United Kingdom National Multidisciplinary Guidelines. J Laryngol Otol. 2016;130(S2):S28-S31.
2. Pan R,Zhu M,Yu C,et al. Cancer incidence and mortality:A cohort study in China,2008-2013. Int J Cancer. 2017;141(7):1315-1323.
3. Argiris A,Karamouzis MV,Raben D,et al. Head and neck cancer. Lancet. 2008;371(9625): 1695-1709.
4. Gillison ML,Chaturvedi AK,Anderson WF,et al. Epidemiology of Human Papillomavirus-Positive Head and Neck Squamous Cell Carcinoma. J Clin Oncol. 2015;33(29):3235-3242.
5. Goel R,Moore W,Sumer B,et al. Clinical Practice in PET/CT for the Management of Head and NeckSquamous Cell Cancer. AJR Am J Roentgenol. 2017;209(2):289-303.
6. Yongkui L1,Jian L,Wanghan,et al. 18FDG-PET/CT for the detection of regional nodal metastasis in patients with primary head and neck cancer before treatment:a meta-analysis. Surg Oncol. 2013;22(2):e11-16.
7. Gao S,Li S,Yang X,et al. 18FDG PET/CT for distant metastases in patients with recurrent head and neck cancer after definitive treatment. A meta-analysis. Oral Oncol. 2014;50(3):163-167.
8. Lonneux M,Hamoir M,Reychler H,et al. Positron emission tomography with [18F] fluorodeoxyglucose improves staging and patient management in patients with head and neck squamous cell carcinoma:a multicenter prospective study. J Clin Oncol. 2010;28(7):1190-1195.
9. National Comprehensive Cancer Network. NCCN clinical practice guidelines:head and neck cancers, version 2,2017. Ft. Washington,PA:NCCN,2017.
2.2 病理学诊断
1. Helliwell TR,Giles TE. Pathological aspects of the assessment of head and neck cancers:United Kingdom National Multidisciplinary Guidelines. J Laryngol Otol. 2016;130(S2):S59-S65.
2. National Comprehensive Cancer Network. NCCN clinical practice guidelines:head and neck cancers,version 2,2017. Ft. Washington,PA:NCCN,2017.
3.1 口腔癌的治疗
1. Kerawala C,Roques T,Jeannon JP,et al. Oral cavity and lip cancer:United Kingdom National Multidisciplinary Guidelines. J Laryngol Otol. 2016;130(S2):S83-S89.
2. Nason RW,Binahmed A,Pathak KA,et al. What is the adequate margin of surgical resection in oral cancer? Oral Surg Oral Med Oral Pathol Oral Radiol Endod. 2009;107(5):625-629.
3. D'Cruz AK,Vaish R,Kapre N,et al. Elective versus Therapeutic Neck Dissection in Node-Negative Oral Cancer. N Engl J Med. 2015;373(6):521-529.
4. O'Brien CJ,Lauer CS,Fredricks S,et al. Tumor thickness influences prognosis of T1 and T2 oral cavity cancer--but what thickness? Head Neck. 2003;25(11):937-945.
5. Huang SH,Hwang D,Lockwood G,et al. Predictive value of tumor thickness for cervical lymph-node involvement in squamous cell carcinoma of the oral cavity:a meta-analysis of reported studies. Cancer.
2009;115(7):1489-1497.
6. Ebrahimi A,Gil Z,Amit M,et al. Primary tumor staging for oral cancer and a proposed modification incorporating depth of invasion:an international multicenter retrospective study. JAMA Otolaryngol HeadNeck Surg. 2014;140(12):1138-1148.
7. National Comprehensive Cancer Network. NCCN clinical practice guidelines:head and neck cancers,version 2,2017. Ft. Washington,PA:NCCN,2017.
8. Schilling C,Stoeckli SJ,Haerle SK,et al. Sentinel European Node Trial (SENT):3-year results ofsentinel node biopsy in oral cancer. Eur J Cancer. 2015;51(18):2777-2784.
9. Nag S,Cano ER,Demanes DJ,et al. The American Brachytherapy Society recommendations for highdose-rate brachytherapy for head-and-neck carcinoma. Int J Radiat Oncol Biol Phys. 2001;50(5):1190-1198.
10. Kov cs G,Martinez-Monge R,Budrukkar A,et al. GEC-ESTRO ACROP recommendations for head &neck brachytherapy in squamous cell carcinomas:1st update - Improvement by cross sectional imaging based treatment planning and stepping source technology. Radiother Oncol. 2017;122(2):248-254.
11. Pignon JP,Bourhis J,Domenge C,et al. Chemotherapy added to locoregional treatment for head and neck squamous-cell carcinoma:three meta-analyses of updated individual data. MACH-NC Collaborative Group. Meta-Analysis of Chemotherapy on Head and Neck Cancer. Lancet. 2000;355(9208):949-955.
12. Pignon JP,le Ma tre A,Maillard E,et al. Meta-analysis of chemotherapy in head and neck cancer(MACH-NC):an update on 93 randomised trials and 17,346 patients. Radiother Oncol. 2009;92(1):4-14.
13. Blanchard P,Baujat B,Holostenco V. et al. Meta-analysis of chemotherapy in head and neck cancer(MACH-NC):a comprehensive analysis by tumour site. Radiother Oncol. 2011;100(1):33-40.
14. Posner MR,Hershock DM,Blajman CR,et al. Cisplatin and fluorouracil alone or with docetaxel in head and neck cancer. N Engl J Med. 2007;357(17):1705-1715.
15. Lorch JH,Goloubeva O,Haddad RI,et al. Induction chemotherapy with cisplatin and fluorouracil alone or in combination with docetaxel in locally advanced squamous-cell cancer of the head and neck:long-term results of the TAX 324 randomised phase 3 trial. Lancet Oncol. 2011;12(2):153-159.
16. Vermorken JB,Remenar E,van Herpen C,et al. Cisplatin,fluorouracil,and docetaxel in unresectable head and neck cancer. N Engl J Med. 2007;357(17):1695-1704.
17. Ahn MJ,D'Cruz A,Vermorken JB,et al. Clinical recommendations for defining platinum unsuitable head and neck cancer patient populations on chemoradiotherapy:A literature review. Oral Oncol. 2016;53:10-16.
18. Bernier J,Cooper J S,Pajak T F,et al. Defining risk levels in locally advanced head and neck cancers:a comparative analysis of concurrent postoperative radiation plus chemotherapy trials of the EORTC(#22931) and RTOG (# 9501)[J]. Head Neck,2005,27(10):843-850.
3.2 口咽癌的治疗
1. Mehanna H,Evans M,Beasley M,et al. Oropharyngeal cancer:United Kingdom National Multidisciplinary Guidelines[J]. J Laryngol Otol,2016,130(S2):S90-S96.
2. Cosmidis A,Rame J P,Dassonville O,et al. T1-T2 NO oropharyngeal cancers treated with surgery alone. A GETTEC study[J]. Eur Arch Otorhinolaryngol,2004,261(5):276-281.
3. Mendenhall W M,Morris C G,Amdur R J,et al. Definitive radiotherapy for tonsillar squamous cell carcinoma[J]. Am J Clin Oncol,2006,29(3):290-297.
4. Lim Y C,Koo B S,Lee J S,et al. Distributions of cervical lymph node metastases in oropharyngeal carcinoma:therapeutic implications for the N0 neck[J]. Laryngoscope,2006,116(7):1148-1152.
5. Denis F,Garaud P,Bardet E,et al. Final results of the 94-01 French Head and Neck Oncology and adiotherapy Group randomized trial comparing radiotherapy alone with concomitant radiochemotherapy in advanced-stage oropharynx carcinoma. J Clin Oncol. 2004;22(1):69-76
6. Bonner JA,Harari PM,Giralt J,et al. Radiotherapy plus cetuximab for squamous-cell carcinoma of the head and neck. N Engl J Med. 2006;354(6):567-578.
7. Bonner JA,Harari PM,Giralt J,et al. Radiotherapy plus cetuximab for locoregionally advanced head and neck cancer:5-year survival data from a phase 3 randomised trial,and relation between cetuximabinduced rash and survival. Lancet Oncol. 2010;11(1):21-28.
8. Posner MR,Hershock DM,Blajman CR,et al. Cisplatin and fluorouracil alone or with docetaxel in head and neck cancer. N Engl J Med. 2007;357(17):1705-1715.
9. Lorch JH,Goloubeva O,Haddad RI,et al. Induction chemotherapy with cisplatin and fluorouracil alone or in combination with docetaxel in locally advanced squamous-cell cancer of the head and neck:longterm results of the TAX 324 randomised phase 3 trial. Lancet Oncol. 2011;12(2):153-159.
10. Vermorken JB,Remenar E,van Herpen C,et al. Cisplatin,fluorouracil,and docetaxel in unresectable head and neck cancer. N Engl J Med. 2007;357(17):1695-1704.
11. Ahn MJ,D'Cruz A,Vermorken JB,et al. Clinical recommendations for defining platinum unsuitable head and neck cancer patient populations on chemoradiotherapy:A literature review. Oral Oncol. 2016;53:10-16.
12. Bernier J,Cooper J S,Pajak T F,et al. Defining risk levels in locally advanced head and neck cancers: a comparative analysis of concurrent postoperative radiation plus chemotherapy trials of the EORTC(#22931) and RTOG (# 9501)[J]. Head Neck,2005,27(10):843-850.
13. Pignon JP,le Ma tre A,Maillard E,et al. Meta-analysis of chemotherapy in head and neck cancer (MACH-NC):an update on 93 randomised trials and 17,346 patients. Radiother Oncol. 2009;92(1): 4-14.
14. Mehanna H,Wong WL,McConkey CC,et al. PET/CT Surveillance versus Neck Dissection in Advanced Head and Neck Cancer. N Engl J Med. 2016;374(15):1444-1454.
15. Mehanna H,Kong A,Ahmed SK. Recurrent head and neck cancer:United Kingdom National Multidisciplinary Guidelines. J Laryngol Otol. 2016;130(S2):S181-S190.
3.3 喉癌的治疗
1. Jones TM,De M,Foran B,et al. Laryngeal cancer:United Kingdom National Multidisciplinary guidelines. J Laryngol Otol. 2016;130(S2):S75-S82.
2. Warner L,Chudasama J,Kelly CG,et al. Radiotherapy versus open surgery versus endolaryngeal surgery (with or without laser) for early laryngeal squamous cell cancer. Cochrane Database Syst Rev. 2014;(12):CD002027.
3. Forastiere AA,Goepfert H,Maor M,et al. Concurrent chemotherapy and radiotherapy for organ preservation in advanced laryngeal cancer. N Engl J Med. 2003;349(22):2091-2098.
4. Forastiere AA,Zhang Q,Weber RS,et al. Long-term results of RTOG 91-11:a comparison of three nonsurgical treatment strategies to preserve the larynx in patients with locally advanced larynx cancer. J Clin Oncol. 2013;31(7):845-852.
5. Pointreau Y,Garaud P,Chapet S,et al. Randomized trial of induction chemotherapy with cisplatin and 5-fluorouracil with or without docetaxel for larynx preservation. J Natl Cancer Inst. 2009;101(7):498- 506.
6. Janoray G,Pointreau Y,Garaud P,et al. Long-term Results of a Multicenter Randomized Phase III Trial of Induction Chemotherapy With Cisplatin,5-fluorouracil,± Docetaxel for Larynx Preservation. J Natl Cancer Inst. 2015;108(4):1-7.
7. Bonner JA,Harari PM,Giralt J,et al. Radiotherapy plus cetuximab for squamous-cell carcinoma of the head and neck. N Engl J Med. 2006;354(6):567-578.
8. Bonner JA,Harari PM,Giralt J,et al. Radiotherapy plus cetuximab for locoregionally advanced head and neck cancer:5-year survival data from a phase 3 randomised trial,and relation between cetuximab-induced rash and survival. Lancet Oncol. 2010;11(1):21-28.
9. Lefebvre JL,Pointreau Y,Rolland F,et al. Induction chemotherapy followed by either chemoradiot-herapy or bioradiotherapy for larynx preservation:the TREMPLIN randomized phase II study. J Clin Oncol. 2013;31(7):853-859.
10. Posner MR,Hershock DM,Blajman CR,et al. Cisplatin and fluorouracil alone or with docetaxel in head and neck cancer. N Engl J Med. 2007;357(17):1705-1715.
11. Lorch JH,Goloubeva O,Haddad RI,et al. Induction chemotherapy with cisplatin and fluorouracil alone or in combination with docetaxel in locally advanced squamous-cell cancer of the head and neck: long-term results of the TAX 324 randomised phase 3 trial. Lancet Oncol. 2011;12(2):153-159.
12. Vermorken JB,Remenar E,van Herpen C,et al. Cisplatin,fluorouracil,and docetaxel in unresectable head and neck cancer. N Engl J Med. 2007;357(17):1695-1704.
13. Pignon JP,Bourhis J,Domenge C,et al. Chemotherapy added to locoregional treatment for head and neck squamous-cell carcinoma:three meta-analyses of updated individual data. MACH-NC Collaborative Group. Meta-Analysis of Chemotherapy on Head and Neck Cancer. Lancet. 2000;355(9208): 949-955.
14. Pignon JP,le Ma tre A,Maillard E,et al. Meta-analysis of chemotherapy in head and neck cancer (MACH-NC):an update on 93 randomised trials and 17,346 patients. Radiother Oncol. 2009;92(1): 4-14.
15. Blanchard P,Baujat B,Holostenco V. et al. Meta-analysis of chemotherapy in head and neck cancer (MACH-NC):a comprehensive analysis by tumour site. Radiother Oncol. 2011;100(1):33-40.
16. Ahn MJ,D'Cruz A,Vermorken JB,et al. Clinical recommendations for defining platinum unsuitable head and neck cancer patient populations on chemoradiotherapy:A literature review. Oral Oncol. 2016; 53:10-16.
17. Bernier J,Cooper J S,Pajak T F,et al. Defining risk levels in locally advanced head and neck cancers: a comparative analysis of concurrent postoperative radiation plus chemotherapy trials of the EORTC (#22931) and RTOG (# 9501)[J]. Head Neck,2005,27(10):843-850.
18. Forastiere AA,Ismaila N,Lewin JS,et al. Use of Larynx-Preservation Strategies in the Treatment of Laryngeal Cancer:American Society of Clinical Oncology Clinical Practice Guideline Update. J Clin Oncol. 2017 Nov 27:[Epub ahead of print].
19. ehanna H,Wong WL,McConkey CC,et al. PET/CT Surveillance versus Neck Dissection in Advanced Head and Neck Cancer. N Engl J Med. 2016;374(15):1444-1454.
20. Mehanna H,Kong A,Ahmed SK. Recurrent head and neck cancer:United Kingdom National Multidisciplinary Guidelines. J Laryngol Otol. 2016;130(S2):S181-S190.
3.4 下咽癌的治疗
1. Pracy P,Loughran S,Good J,et al. Hypopharyngeal cancer:United Kingdom National Multidisciplinary Guidelines. J Laryngol Otol. 2016;130(S2):S104-S110.
2. Martin A,J ckel MC,Christiansen H,et al. Organ preserving transoral laser microsurgery for cancer of the hypopharynx. Laryngoscope. 2008;118(3):398-402.
3. Rabbani A,Amdur RJ,Mancuso AA,et al. Definitive radiotherapy for T1-T2 squamous cell carcinoma of pyriform sinus. Int J Radiat Oncol Biol Phys. 2008 ;72(2):351-355.
4. Pignon JP,Bourhis J,Domenge C,et al. Chemotherapy added to locoregional treatment for head and neck squamous-cell carcinoma:three meta-analyses of updated individual data. MACH-NC Collaborative Group. Meta-Analysis of Chemotherapy on Head and Neck Cancer. Lancet. 2000;355(9208):949-955.
5. Pignon JP,le Ma tre A,Maillard E,et al. Meta-analysis of chemotherapy in head and neck cancer (MACH-NC):an update on 93 randomised trials and 17,346 patients. Radiother Oncol. 2009;92(1): 4-14.
6. Blanchard P,Baujat B,Holostenco V. et al. Meta-analysis of chemotherapy in head and neck cancer (MACH-NC):a comprehensive analysis by tumour site. Radiother Oncol. 2011;100(1):33-40.
7. Pointreau Y,Garaud P,Chapet S,et al. Randomized trial of induction chemotherapy with cisplatin and 5-fluorouracil with or without docetaxel for larynx preservation. J Natl Cancer Inst. 2009;101(7): 498-506.
8. Janoray G,Pointreau Y,Garaud P,et al. Long-term Results of a Multicenter Randomized Phase III Trial of Induction Chemotherapy With Cisplatin,5-fluorouracil,± Docetaxel for Larynx Preservation. J Natl Cancer Inst. 2015;108(4):1-7.
9. Bonner JA,Harari PM,Giralt J,et al. Radiotherapy plus cetuximab for squamous-cell carcinoma of the head and neck. N Engl J Med. 2006;354(6):567-578.
10. Bonner JA,Harari PM,Giralt J,et al. Radiotherapy plus cetuximab for locoregionally advanced head and neck cancer:5-year survival data from a phase 3 randomised trial,and relation between cetuximab-induced rash and survival. Lancet Oncol. 2010;11(1):21-28.
11. Lefebvre JL,Pointreau Y,Rolland F,et al. Induction chemotherapy followed by either chemoradiotherapy or bioradiotherapy for larynx preservation:the TREMPLIN randomized phase II study. J Clin Oncol. 2013; 31(7):853-859.
12. Posner MR,Hershock DM,Blajman CR,et al. Cisplatin and fluorouracil alone or with docetaxel in head and neck cancer. N Engl J Med. 2007;357(17):1705-1715.
13. Lorch JH,Goloubeva O,Haddad RI,et al. Induction chemotherapy with cisplatin and fluorouracil alone or in combination with docetaxel in locally advanced squamous-cell cancer of the head and neck:
long-term results of the TAX 324 randomised phase 3 trial. Lancet Oncol. 2011;12(2):153-159.
14. Vermorken JB,Remenar E,van Herpen C,et al. Cisplatin,fluorouracil,and docetaxel in unresectable head and neck cancer. N Engl J Med. 2007;357(17):1695-1704.
15. Ahn MJ,D'Cruz A,Vermorken JB,et al. Clinical recommendations for defining platinum unsuitable head and neck cancer patient populations on chemoradiotherapy:A literature review. Oral Oncol. 2016;53:10-16.
16. Bernier J,Cooper J S,Pajak T F,et al. Defining risk levels in locally advanced head and neck cancers: a comparative analysis of concurrent postoperative radiation plus chemotherapy trials of the EORTC (#22931) and RTOG (# 9501)[J]. Head Neck,2005,27(10):843-850.
17. Mehanna H,Wong WL,McConkey CC,et al. PET/CT Surveillance versus Neck Dissection in Advanced Head and Neck Cancer. N Engl J Med. 2016;374(15):1444-1454.
18. Mehanna H,Kong A,Ahmed SK. Recurrent head and neck cancer:United Kingdom National Multidisciplinary Guidelines. J Laryngol Otol. 2016;130(S2):S181-S190.
4 复发转移性头颈部鳞癌的治疗
1. Forastiere AA,Metch B,Schuller DE,et al. Randomized comparison of cisplatin plus fluorouracil and carboplatin plus fluorouracil versus methotrexate in advanced squamous-cell carcinoma of the head and neck:a Southwest Oncology Group study. J Clin Oncol. 1992;10(8):1245-1251.
2. Gibson MK,Li Y,Murphy B. et al. Randomized phase III evaluation of cisplatin plus fluorouracil versus cisplatin plus paclitaxel in advanced head and neck cancer (E1395):an intergroup trial of the Eastern Cooperative Oncology Group. J Clin Oncol. 2005;23(15):3562-3567.
3. Guigay J,Fayette J,Dillies AF,et al. Cetuximab,docetaxel,and cisplatin as first-line treatment in patients with recurrent or metastatic head and neck squamous cell carcinoma:a multicenter,phase II GORTEC study. Ann Oncol. 2015;26(9):1941-1947.
4. Vermorken JB,Mesia R,Rivera F,et al. Platinum-based chemotherapy plus cetuximab in head and neck cancer. N Engl J Med. 2008;359(11):1116-1127.
5. Burtness B,Goldwasser MA,Flood W,et al. Phase III randomized trial of cisplatin plus placebo compared with cisplatin plus cetuximab in metastatic/recurrent head and neck cancer:an Eastern Cooperative Oncology Group study. J Clin Oncol. 2005;23(34):8646-8654.
6. Bossi P,Miceli R,Locati LD,et al. A randomized,phase 2 study of cetuximab plus cisplatin with or without paclitaxel for the first-line treatment of patients with recurrent and/or metastatic squamous cell carcinoma of the head and neck. Ann Oncol. 2017;28(11):2820-2826.
7. Hitt R,Irigoyen A,Cortes-Funes H,et al. Phase II study of the combination of cetuximab and weekly paclitaxel in the first-line treatment of patients with recurrent and/or metastatic squamous cell carcinoma of head and neck. Ann Oncol. 2012;23(4):1016-1022.
8. Stewart JS,Cohen EE,Licitra L,et al. Phase III study of gefitinib compared with intravenous methotrexate for recurrent squamous cell carcinoma of the head and neck. J Clin Oncol. 2009;27(11): 1864-1871.
9. Argiris A,Ghebremichael M,Gilbert J,et al. Phase III randomized,placebo-controlled trial of docetaxel with or without gefitinib in recurrent or metastatic head and neck cancer:an eastern cooperative oncology group trial. J Clin Oncol. 2013;31(11):1405-1414.
10. Soulières D,Faivre S,Mesía R,et al. Buparlisib and paclitaxel in patients with platinum-pretreated recurrent or metastatic squamous cell carcinoma of the head and neck (BERIL-1):a randomised, double-blind,placebo-controlled phase 2 trial. Lancet Oncol. 2017;18(3):323-335.
11. Vermorken JB,Trigo J,Hitt R,et al. Open-label,uncontrolled,multicenter phase II study to evaluate the efficacy and toxicity of cetuximab as a single agent in patients with recurrent and/or metastatic squamous cell carcinoma of the head and neck who failed to respond to platinum-based therapy. J Clin Oncol. 2007;25(16):2171-2177.
12. Kalyankrishna S,Grandis JR. Epidermal growth factor receptor biology in head and neck cancer. J Clin Oncol. 2006;24(17):2666-2672.
13. Mesía R,Rivera F,Kawecki A,et al. Quality of life of patients receiving platinum-based chemotherapy plus cetuximab first line for recurrent and/or metastatic squamous cell carcinoma of the head and neck. Ann Oncol. 2010;21(10):1967-1973.
14. Ferris RL,Blumenschein G Jr,Fayette J,et al. Nivolumab for Recurrent Squamous-Cell Carcinoma of the Head and Neck. N Engl J Med. 2016;375(19):1856-1867.
15. Harrington KJ,Ferris RL,Blumenschein G Jr,et al. Nivolumab versus standard,single-agent therapy of investigator's choice in recurrent or metastatic squamous cell carcinoma of the head and neck (CheckMate 141):health-related quality-of-life results from a randomised,phase 3 trial. Lancet Oncol. 2017;18(8):1104-1115.
5 随访
1. Simo R,Homer J,Clarke P,et al. Follow-up after treatment for head and neck cancer:United Kingdom National Multidisciplinary Guidelines. J Laryngol Otol. 2016;130(S2):S208-S211.
2. Sheikhbahaei S,Taghipour M,Ahmad R,et al. Diagnostic Accuracy of Follow-Up FDG PET or PET/ CT in Patients With Head and Neck Cancer After Definitive Treatment:A Systematic Review and Meta- Analysis. AJR Am J Roentgenol. 2015;205(3):629-639.
3. Mehanna H,Wong WL,McConkey CC,et al. PET/CT Surveillance versus Neck Dissection in Advanced Head and Neck Cancer. N Engl J Med. 2016;374(15):1444-1454.
4. Argiris A,Karamouzis MV,Raben D,et al. Head and neck cancer. Lancet. 2008;371(9625): 1695-1709.
5. Aberle DR,Adams AM,Berg CD,et al. Reduced lung-cancer mortality with low-dose computed tomographic screening. N Engl J Med. 2011;365(5):395-409.