 去看看
去看看


一、概述
晚期乳腺癌(Advanced Breast Cancer,ABC)患者不仅饱受病痛的折磨,还承受着巨大的精神压力和经济负担,经常会感到恐惧、绝望和不知所措,到底治还是不治?治了有没有效?加之患者家属和医护人员往往与患者沟通不够,这也会在一定程度上影响患者的情绪[1]。在治疗方案的选择以及疗效方面,晚期乳腺癌患者也有其特殊性,如何帮助患者做出正确的治疗选择,是每一位肿瘤科医生面临的挑战。
对于早期乳腺癌的治疗,我们已拥有大量的一类证据和相对成熟的治疗方案,但对于晚期乳腺癌的治疗(尤其在晚期一线治疗失败后),尚缺乏公认的标准治疗方案。晚期乳腺癌患者的总体中位生存期为2~3年,不同分子亚型的情况有所不同。对于人类表皮生长因子受体2(Human Epidermal growth factor Receptor 2,HER2)阳性晚期乳腺癌患者,抗HER2药物能够显著延长生存时间并改善预后;但是对于三阴性晚期乳腺癌患者,其总体预后尚未取得明显改善;另外,对于最常见的雌激素受体(Estrogen Receptor,ER)阳性晚期乳腺癌患者,自20世纪90年代以来,治疗上无明显突破,总生存期(Overall Survival,OS)基本维持不变[2-5]。虽然中国抗癌协会乳腺癌专业委员会制定了《中国抗癌协会乳腺癌诊治指南与规范》,并经过多次更新,其成功实施显著改善了早期乳腺癌的规范化治疗,但在ABC治疗领域,上述指南的篇幅较少,对临床医生的指导意义略显不足。因此2014年在中国抗癌协会乳腺癌专业委员会的倡导下,国内数十名乳腺癌诊断、治疗方面的专家对国内外晚期乳腺癌治疗的研究数据进行分析、总结和讨论,并于2014年6月召开了中国晚期乳腺癌专家共识会议,经过反复讨论和多次修改,制订出《中国晚期乳腺癌诊治专家共识》,并予以发布。
本文汇总了中国晚期乳腺癌专家共识会议上产生的指导意见,针对每条意见提供了相应的证据级别和支持文献,并指出了迫切需要解决的研究课题。需要强调的是,《中国晚期乳腺癌诊治专家共识》是供中国范围内应用的治疗建议,而各个地区可能需要根据现代肿瘤学的基本原则进行必要的调整,即结合晚期疾病的特殊性和每位患者的个体差异予以多学科、个体化的综合治疗。
二、方法
在中国晚期乳腺癌专家共识会议召开之前,组织者和工作组成员进行了初稿的撰写和筹备工作。根据初稿所涉及的不同领域进行了分组,并将这些内容通过电子邮件发送给所有工作组成员进行讨论和修改,对内容和措辞进行修正。在会议期间提出了一套修改版本的指导意见,并进行充分讨论。会议期间根据工作组成员的意见做了进一步修订。对每一项意见的来源附注了参考文献。会议结束后,根据讨论的内容,完成修订版本,并发给每个成员进行确认,最终形成终稿。
《中国晚期乳腺癌诊治专家共识》中的一部分建议对局部晚期和转移性乳腺癌(Metastatic Breast Cancer,MBC)均适用,而另一些意见则仅适用于MBC(表2)。附表列举了《中国晚期乳腺癌诊治专家共识》小组的所有成员名单。
三、指南总则
20世纪末提出的多学科综合治疗理念[6,7]是肿瘤学领域的重大成就之一。根据这一理念,医生需要为每个患者提供个体化的医疗措施,同时各学科相关人员的积极合作有助于为患者制订更好的治疗方案。乳腺病专科的建立[8]是另一重要举措,我国最早的乳腺癌中心成立于20世纪90年代,并在近20年的发展中得以不断完善。多学科合作和乳腺病专科的成立在乳腺疾病诊疗方面具有里程碑意义,尤其在早期乳腺癌的治疗中发挥了重要作用。然而,对于ABC患者的治疗,多学科合作尚显不足,尤其是针对某些特定转移部位(例如骨转移、脑转移)的综合治疗还亟待加强。
表1 指南总则

续表

四、证据级别
表2 证据级别
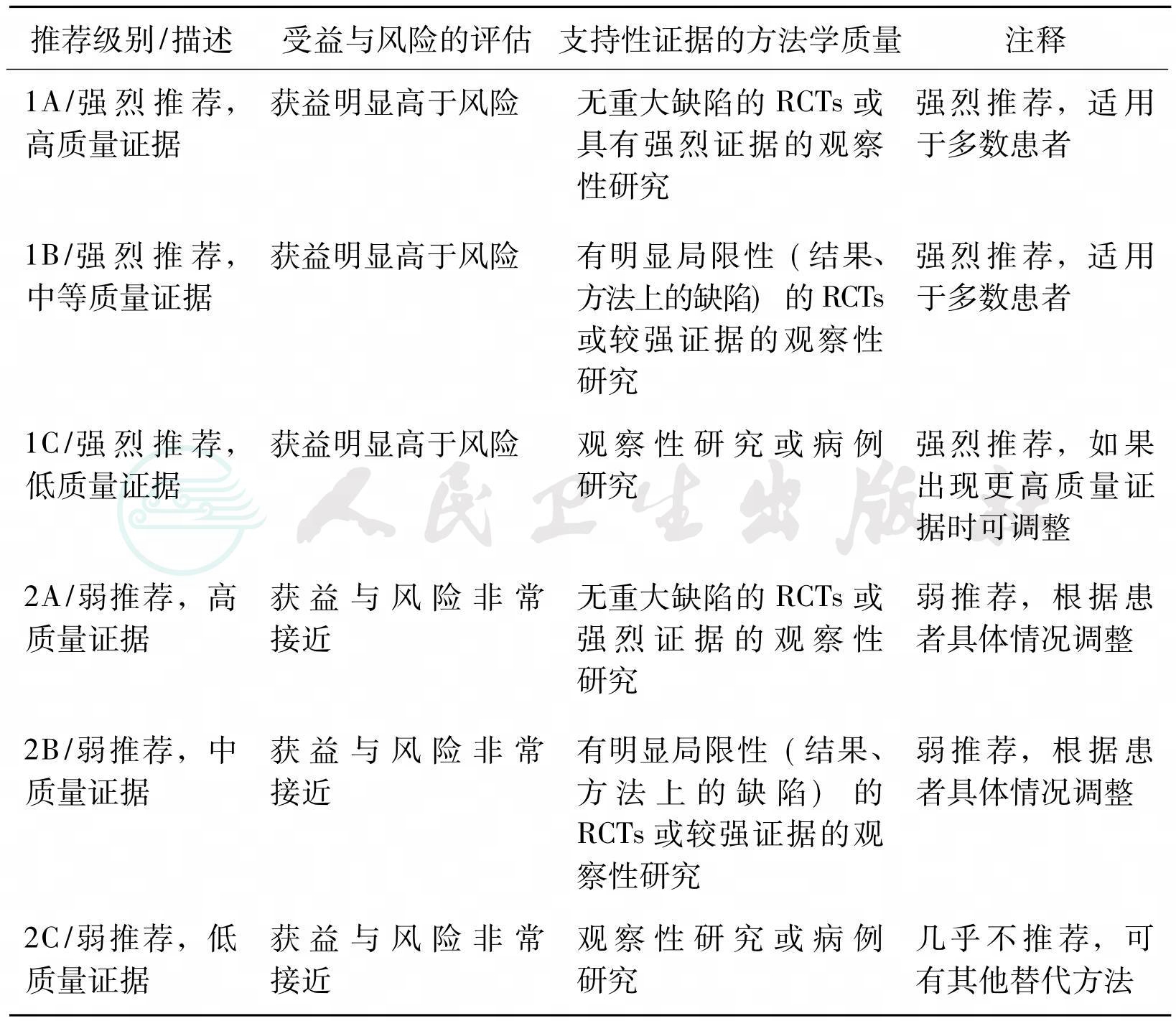
备注:RCT(Randomized Controlled Trial):随机对照试验
五、影像学、肿瘤标志物和疗效评价
(一)诊断分期相关检查
诊断分期相关检查应包括病史、体格检查、血液学检查(如:血常规、肝肾功能、血电解质、肿瘤标志物)、乳腺、心电图、胸、腹、骨骼等部位的影像学检查。若准备进行曲妥珠单抗治疗,还应加入心功能检查(如心脏彩超检查)等(1B)。肿瘤标志物是评价治疗反应的辅助指标,尤其在缺少可测量病灶时意义更加重要。但肿瘤标志物的变化不能作为调整治疗的依据(2C)。
(二)影像学检查
1.分期的影像学检查
分期影像学检查部位应包括乳腺(超声,钼靶或MRI)、胸(有条件可行胸部CT,或胸片)、腹(腹部超声,必要时行腹部CT或MRI)、骨骼(骨扫描)等(1B)。当需要明确是否复发或判断是否为多发病灶时可考虑选择PET-CT[9,10](2B),因目前缺乏高级别的证据的支持,故不推荐PET-CT作为常规检查[11-14]。
2.影像学检查的频率
内分泌治疗(Endocrine Therapy,ET)的疗效评价间隔时间应该为2~3个月,化疗(Chemotherapy,ChT)的疗效评价间隔时间应该为2~3个周期;对于不同治疗的具体评价间隔还应综合考虑疾病进展速度、转移部位和范围以及治疗方式来决定(专家意见)。对于疾病进展迅速的患者,应考虑缩短疗效评价间隔时间。部分情况下,例如疾病相对惰性、进展缓慢等,可以考虑适当延长评价间隔时间。如果怀疑疾病进展(Progressive Disease,PD)或出现明显疾病相关症状,应及时采取进一步检查。在进行影像检查的同时,应详细记录病史和体格检查的情况。
3.头部影像学检查
有明显头部或(和)脑部相关症状的患者应接受头部影像学检查,包括头颅MRI或CT(专家意见)。对于无症状的HER-2阳性或三阴乳腺癌患者,也可考虑进行头部影像学检查。
(三)生物标志物
如果临床上可行,推荐进行转移病灶的活组织检查以明确是否为转移(组织学样本为最佳),尤其是在首次诊断转移时。确诊疾病转移后建议进行至少1次乳腺癌生物学指标的再次评价[15,16][如激素受体(Hormone Receptor,HR)、HER-2和Ki67]。
(四)肿瘤标志物
1.肿瘤标志物在术后预测复发转移方面的临床价值尚未得到确认,但肿瘤标志物的动态变化能够协助疗效评价,尤其是在没有可测量病灶的MBC患者中(2C)。
2.尽管如此,仍不应仅凭肿瘤标志物的变化更改治疗方案(2C)。
3.术后肿瘤标志物持续上升可能是肿瘤复发的早期表现。ABC治疗过程中肿瘤标志物上升的原因有两种:一个原因是抗肿瘤治疗无效,但应同时结合影像学检查来明确判断,以决定是否需要更改治疗方案;另一种可能是治疗对肿瘤有效,伴有肿瘤标记物的一过性升高。对于没有可测量转移病灶的患者,仅有肿瘤标志物的升高也可能是治疗有效的标志,因此肿瘤标志物的单纯增高不能作为更改治疗方案的依据[17]。建议动态观察,1~2个月后再次复查。
4.肿瘤标志物持续下降可能是肿瘤治疗有效的早期表现,但在治疗过程中仍应结合影像学检查来判断疗效,从而决定进一步的治疗方案。不能仅凭肿瘤标志物的下降而更改治疗方案。
(五)疗效评估频率
1.内分泌治疗的疗效评价应该每2~3个月一次,化疗的疗效评价应该每2~3个周期一次,具体评估频率还应由疾病进展速度、转移位置和范围、治疗方式等决定。
2.对多数患者都建议进行靶病灶的影像学检查,对于疾病进展缓慢的患者,可以降低影像学检查的频率。如果怀疑PD或出现明显症状,应立即进行检查。每次疗效评价都要进行病史询问和体格检查。
六、晚期乳腺癌治疗总体原则
(一)一般原则
1.治疗选择应考虑以下因素:HR和HER-2状态、既往治疗(疗效、毒性、耐受性等)、无病间期、肿瘤负荷(转移部位和数量)、年龄、一般状态、月经状况、并发症等,并应根据患者症状严重程度、是否有快速控制疾病和(或)症状的需求以及患者的社会、经济和心理因素做出调整。
2.当原发灶和转移灶检测结果不一致时,只要有一次和(或)一个病灶HR和(或)HER-2阳性,即可依据这一阳性病灶选择内分泌治疗和(或)抗HER-2治疗[15,16]。
3.对高龄患者也应该根据具体情况尽量给予足量、有效的治疗(1B)。
4.对于初治Ⅳ期乳腺癌患者切除原发病灶是否能够获益尚有争论[18-21],部分患者可以考虑姑息性手术。需注意目前证据均来自回顾性研究,存在选择性偏倚,因此最终结果有待前瞻性临床试验进一步证实。
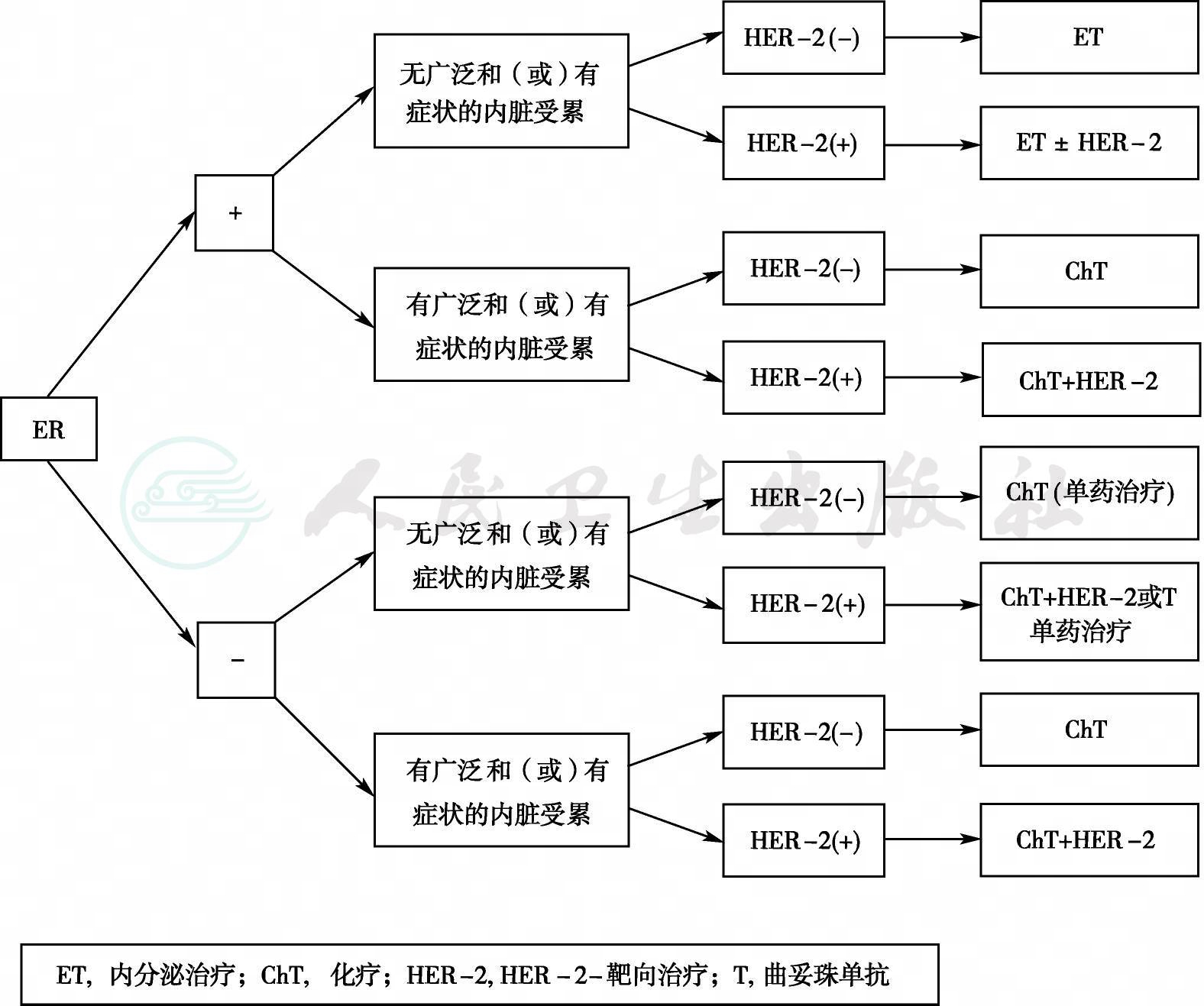
图1 ABC的一线治疗
(二)局部晚期乳腺癌
1.单个病灶的局部复发晚期乳腺癌应尽可能选择根治性治疗,包括乳腺切除术、根治术联合辅助放疗(Radiotherapy,RT)或根治术联合局部加量照射[22,23]。如果选择局部手术,应尽可能完全切除复发肿瘤。
2.不适合手术切除的局部复发晚期乳腺癌,全身治疗仍应作为主要治疗手段。
(三)转移性乳腺癌
1.转移性乳腺癌患者应首先进行全身治疗。
2.接受全身治疗的基础上,对于急需缓解症状或解除并发症的患者可采用局部治疗[24]。
七、ER阳性和( 或)HER-2阴性晚期乳腺癌治疗
(一)治疗原则
ER阳性和(或)HER-2阴性晚期乳腺癌治疗目的是控制肿瘤进展,缓解症状,延长生存期。对内分泌治疗敏感的患者,不仅可以推迟患者开始化疗的时间,而且可以使患者保持较好的生活质量,因此对于HR阳性[ER +和(或)孕激素受体(Progesterone Receptor,PR)阳性]、HER-2阴性的MBC,病变局限在乳腺、骨和软组织以及无症状,肿瘤负荷不大的内脏转移患者,可以优先选择内分泌治疗。但对于内分泌治疗耐药、肿瘤快速进展、内脏广泛转移或症状明显,需要快速减轻肿瘤负荷的患者应该先给予化疗等更有效的治疗[25,26](1A)。
1.对于既往内分泌治疗有效的患者(TTP大于6个月),无论患者是否绝经,后续内分泌治疗仍然有可能控制肿瘤,疾病进展后可以换用不同作用机制的其他内分泌药物治疗。连续3线内分泌治疗,治疗无效通常提示内分泌耐药,应该换用细胞毒药物治疗。
2.在内分泌治疗的治疗期间,应每2~3个月评估一次疗效,对SD,PR患者应继续维持治疗。如肿瘤出现进展,应根据病情决定更换新的内分泌治疗或改用化疗等其他治疗。
3.对于不适合内分泌治疗的患者,可先行化疗,在疾病得到有效控制后再给予内分泌维持治疗。这种治疗策略虽然尚未在随机临床试验进行评价,但在临床实践中被广泛应用。(1C)
4.三项随机对照试验比较了联合两种内分泌治疗药物与一种内分泌药物治疗的疗效。在晚期一线治疗中,FACT研究比较了氟维司群联合阿那曲唑与阿那曲唑单药治疗的疗效。结果显示联合组的疾病进展时间(Time To Progress,TTP)并不优于单药组;S0226研究采用同样的方案,但入组人群中包含了更多既往未用过他莫昔芬治疗的患者,结果显示联合组无进展生存期(Progression Free Survival,PFS)优于单药组。在二线治疗中,一项Ⅲ期对照研究显示氟维司群联合阿那曲唑或依西美坦的疗效与单药氟维司群相似。因此目前仍没有明确证据支持联合内分泌治疗。
5.目前没有临床研究证实化疗和内分泌治疗同时给药可延长患者的生存期,因此不建议在临床试验范围外使用。(1B)
6.由于HR检测存在假阴性,专家组认为对具有肿瘤进展缓慢、无复发生存时间(Recurrence Free Survival,RFS)较长、单纯骨和软组织转移等特征的ER/PR阴性MBC人群仍有可能从内分泌治疗中获益;美国国立综合癌症网络(National Comprehensive Cancer Network,NCCN)指南也特别指出,对于这部分患者也可给予内分泌治疗。
7.长期内分泌治疗后耐药发生率较高,临床前研究发现耐药机制可能与哺乳动物西罗莫司靶蛋白(mammalian target of rapamycin,m-TOR)信号转导通路的激活有关。已有临床研究证实依维莫司联合内分泌治疗使用较单纯内分泌治疗可显著延长既往内分泌治疗失败患者的PFS。
(二)ER阳性和(或)HER-2阴性 晚期乳腺癌患者内分泌治疗流程
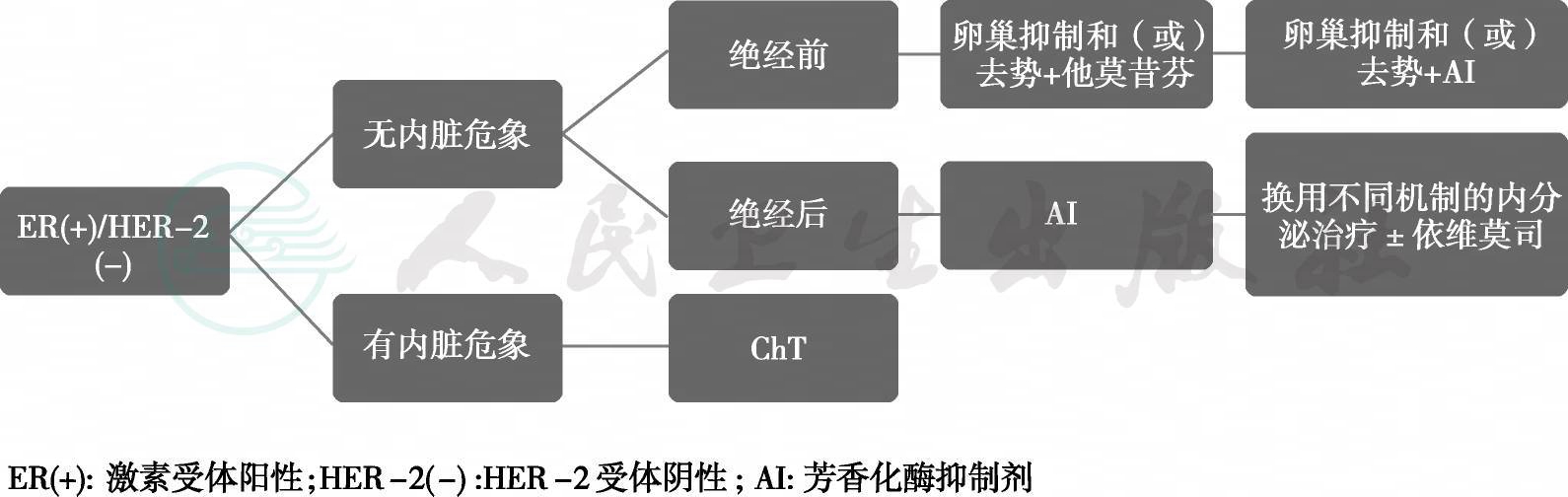
图2 ER阳性/HER-2阴性晚期乳腺癌患者内分泌治疗流程
(三)内分泌治疗药物的选择
1.绝经前乳腺癌患者复发转移后,首选卵巢抑制或去势联合内分泌药物治疗(1A),如果辅助治疗中未使用他莫昔芬或者已中断他莫昔芬治疗超过12个月,可选择他莫昔芬联合卵巢抑制或去势。卵巢抑制或卵巢去势后患者的后续治疗与绝经后患者相同。对辅助治疗接受过他莫昔芬治疗的人群,可选择卵巢抑制和(或)去势联合芳香化酶抑制剂(Aromatase Inhibitor,AI)(1B)。
2.绝经后患者一线内分泌治疗首选AI,部分患者也可选择他莫昔芬(1A)。对于经济条件受限的地区和人群,他莫昔芬也可以作为一线治疗药物。晚期乳腺癌患者在选择内分泌治疗药物时,应考虑患者在辅助治疗阶段使用的内分泌药物种类和时间(1A)。目前对二线内分泌治疗失败后的MBC没有标准内分泌治疗方案,可以选择的药物包括:他莫昔芬、不同机制的AI,氟维司群,醋酸甲地孕酮等。化疗致闭经患者,需要判断患者是否已绝经,特别是考虑联合应用AI时,因为年轻患者化疗后月经恢复的比例比年长的患者高(1A)。
3.乳腺癌内分泌治疗耐药后的靶向治疗选择。近几年,乳腺癌耐药研究取得了一定进展,临床前研究认为耐药机制可能与m-TOR信号转导通路激活有关。早期临床研究显示,在非甾体类AI或他莫昔芬治疗后疾病进展的患者中,内分泌药物联合m-TOR抑制剂依维莫司可改善预后[27]。Ⅲ期随机对照临床研究BOLERO-2证实:对非甾体类AI治疗失败后的HR阳性/HER-2阴性绝经后ABC患者[28],依维莫司联合依西美坦,较依西美坦单药显著延长PFS 6月以上(11个月vs . 4. 1个月),相应的,联合组不良反应发生率也较高,但是相对可控。基于此项研究,2012年美国和欧盟批准依维莫司用于非甾体类芳香化酶抑制剂(Non-Steroidal Aromatase Inhibitor,NSAI)治疗失败后的进展期乳腺癌的治疗(1A)。目前,依维莫司尚未在中国获批此适应证。医生应根据病情,权衡治疗可能取得的疗效和药物的不良反应、药物的可获得性及患者的意愿决定治疗的选择。
八、HER-2 阳性晚期乳腺癌治疗
(一)治疗原则
1.对于HER-2阳性[免疫组织化学HER-2(3 +)或荧光原位杂交技术(Fluorescence In Situ Hybridization,FISH)显示HER-2基因扩增]MBC,除非患者存在禁忌证,都应尽早开始抗HER-2治疗[29-32](1A)。
2.对于ER阴性和(或)HER-2阳性的晚期乳腺癌,可根据病情选用单药或联合化疗或化疗与抗HER-2治疗联合[29,30,33](1A)。
3.对于ER阳性和(或)HER-2阳性的进展期乳腺癌,抗HER-2治疗联合内分泌治疗显示出明确的PFS获益,可根据病情选用内分泌治疗联合抗HER-2治疗作为一线或二线以上治疗[34,35](1A)。
(二)抗HER-2治疗进展后治疗
1.持续抑制HER-2通路可带来生存获益,因此抗HER-2治疗失败后患者,应继续抗HER-2治疗。目前MBC应用抗HER-2治疗的最佳持续时间尚不明确,因此如果没有出现疾病进展或不可耐受毒性,建议维持原方案治疗[36,37](1B)。
2.对一线接受曲妥珠单抗联合细胞毒性药物治疗后疾病进展的患者,目前尚不明确最佳治疗选择是继续曲妥珠单抗联合另一种细胞毒性药物,还是变更为拉帕替尼联合卡培他滨。因此上述两种均可作为二线治疗选择[38,39](1A);此外,已有研究表明曲妥珠单抗与细胞毒药物耦联物(Trastuzumab-DM1,T-DM1)用于曲妥珠单抗耐药后患者可增加其生存获益,可作为抗HER-2二线治疗选择[40,41](1B);双重抑制HER-2通路策略如:曲妥珠单抗+帕妥珠单抗、曲妥珠单抗+拉帕替尼可克服部分曲妥珠单抗耐药,也可作为二线以后的治疗选择[42,43](1B)。有研究显示,mTOR抑制剂依维莫司对于既往接受过曲妥珠单抗治疗的晚期乳腺癌患者有一定疗效(2A),在无法获得T-DM1的情况下,也可作为二线以后的一种选择。
3.经曲妥珠单抗辅助治疗后复发的患者的最佳治疗仍不明确,但所有患者都应继续抗HER-2治疗。建议对停用曲妥珠单抗至复发间隔时间≤12个月患者可选用二线抗HER-2药物治疗;而对停用曲妥珠单抗至复发间隔时间>12个月以上的患者仍可选择曲妥珠单抗作为一线抗HER-2治疗。
(三)标准HER-2检测和结果判定
1.对于之前未明确HER-2基因状态的ABC患者,应采用原位杂交(In Situ Hybridization,ISH)法(测定HER-2基因的拷贝数量)或免疫组织化学(Immunohistochemistry,IHC)法(计算细胞膜表面HER-2受体数量)明确HER-2基因状态。不建议采用mRNA检测和多基因序列检测[44]。
2. ISH法显示HER-2基因扩增或者IHC法评分3 +可确定为HER-2阳性。IHC法评分2 +为临界值,应再进行FISH法进行确定。同样,ISH法测定如在临界范围(测定方法不同,标准可为1. 8~2. 0 HER-2基因、染色体17/细胞,或者>4或<6 HER-2基因/细胞)应计数更多的细胞或再次进行ISH检测,如仍为临界范围则进行IHC法进行确定[45]。
九、化学药物治疗和生物治疗
(一)化学药物治疗原则
多数MBC是不可治愈的,治疗的目的是在保证患者生活质量基础上,控制肿瘤,减轻症状,延长肿瘤控制时间和可能的情况下延长患者的生存时间。化疗采用细胞毒药物杀伤肿瘤,有效率高,比内分泌治疗见效更快,但是常常伴有更高的毒性反应,影响患者的生活质量,通常用于激素受体阴性的患者;对于激素受体阳性的患者如果出现内脏危象、疾病发展迅速、或者症状明显或内分泌耐药的患者,可以考虑给予化疗。
因此治疗方案的选择以及持续的时间,应该取决于方案的有效性和患者的耐受性。如一种方案有效,应持续该方案治疗直至疾病进展或发生不可耐受的毒性。
化学药物治疗适应证:
1. HR阴性
2.有症状的内脏转移
3. HR阳性但三线或以上内分泌治疗失败患者
常用化疗药物:蒽环类,如多柔比星、表柔比星、吡柔比星、聚乙二醇化脂质体多柔比星;紫杉类,如紫杉醇、多西他赛、白蛋白结合紫杉醇;抗代谢药,如卡培他滨和吉西他滨;以及非紫杉类微管形成抑制剂,如长春瑞滨、艾日布林。其他有效的药物包括环磷酰胺、顺铂、口服依托泊苷等。
化学药物治疗原则:
1.联合化疗和单药化疗都是合理的选择。对于晚期乳腺癌患者,治愈已不是治疗目的,应尽量保证患者生存质量,尽可能考虑单药化疗作为首选方案[46-48]。基于现有数据[46,48],对于病情进展迅速、存在内脏危象或需要迅速缓解症状、控制疾病进展的患者,可选择联合化疗。
2.对于HER-2阴性转移性乳腺癌,如既往未接受过蒽环或紫杉类药物的辅助治疗,通常选择蒽环或紫杉类药物为基础的方案,一线治疗可选择单药或联合方案。其他可选的药物包括卡培他滨[47,49]、长春瑞滨[50]、吉西他滨等。
3.对于蒽环耐药或出现蒽环类药物达到累积剂量或者出现蒽环类药物的剂量限制性毒性(例如心脏毒性),并且既往未用过紫杉类药物的转移性乳腺癌患者,后续化疗通常选择以紫杉类药物为基础的方案,优选紫杉类单药。其他可选择的药物包括卡培他滨、长春瑞滨、吉西他滨等。
4.对于在辅助治疗中已经用过紫杉类药物,如果在紫杉类辅助化疗结束后1年以上出现的肿瘤进展患者,复发转移后仍可再次使用紫杉类药物。
5.每个方案的持续时间(周期数)和能否接受多线化疗应当根据患者的具体情况进行个体化选择。Meta分析[51]表明一线化疗持续时间长能够延长疾病控制时间,并可能延长总生存。因此一线治疗可持续应用直至疾病进展或出现不可耐受的毒性(不可耐受毒性应由患者及医生共同决定)。
6. HR阳性乳腺癌患者,即便在出现内脏转移的情况下,通常首选方案是内分泌治疗,除非考虑到或证明为内分泌耐药或者需要快速缓解症状的疾病[25]。
7. HR阳性乳腺癌化疗有效之后,采用化疗或内分泌维持都是合理的选择。
8.化疗有效之后的维持治疗,可以继续选用原方案或其中一个药物进行维持[52];也可以换用口服化疗药如卡培他滨维持,但目前缺乏以卡培他滨维持治疗获得生存获益的相关证据。
(二)生物治疗
1.贝伐珠单抗联合紫杉类药物的疗效(OS)未在其他后续临床研究中证实。目前尚未找到贝伐珠单抗的疗效预测因子[53-55]。
2.综合分析现有临床研究结果以及一项近期荟萃分析[56]结论认为,在晚期乳腺癌中应用贝伐珠单抗,可以在PFS方面得到有限的获益,但对OS没有延长。
3.目前欧盟批准贝伐珠单抗联合应用紫杉类药物作为晚期乳腺癌一线治疗,贝伐珠单抗联合应用卡培他滨也是可以考虑的方案。
4.由于贝伐珠单抗在乳腺癌治疗方面尚未在中国获得批准,临床实践中,应慎重选择患者。
5.其他还有一些新药如周期蛋白依赖性激酶4/6(Cyclin-Dependent Kinase 4/6,CDK4/6)抑制剂,但目前还未在国内上市。
十、骨转移
(一)诊断
乳腺癌患者发生骨转移风险较高,可考虑把排除骨转移的临床检查作为常规检查项目。一旦患者出现骨痛、病理性骨折、碱性磷酸酶升高、脊髓压迫或脊神经根压迫、或高钙血症等临床表现,应进一步检查排除骨转移病变。放射性核素全身骨扫描是初步诊断骨转移的筛查方法,进一步确诊需根据情况选择X线片、或MR扫描、或CT扫描、或PET-CT扫描[18-氟脱氧葡萄糖(Fluorine-18-Deoxyglucose,18F-FDG)摄取和CT须同时提示骨转移]等方法检查,必要时还可考虑骨活检。
恶性肿瘤骨转移诊断标准需具备至少1项条件:
1.经组织病理学或细胞学检查诊断为恶性肿瘤,或骨病灶穿刺活检或细胞学诊断为恶性肿瘤骨转移;
2.骨病灶经X线片,或MR扫描,或CT扫描,或PET-CT扫描(FDG摄取和CT须同时提示骨转移)诊断为恶性肿瘤骨转移。
骨转移筛查及检查方法主要是依据影像学检查(图3)[57-63]。
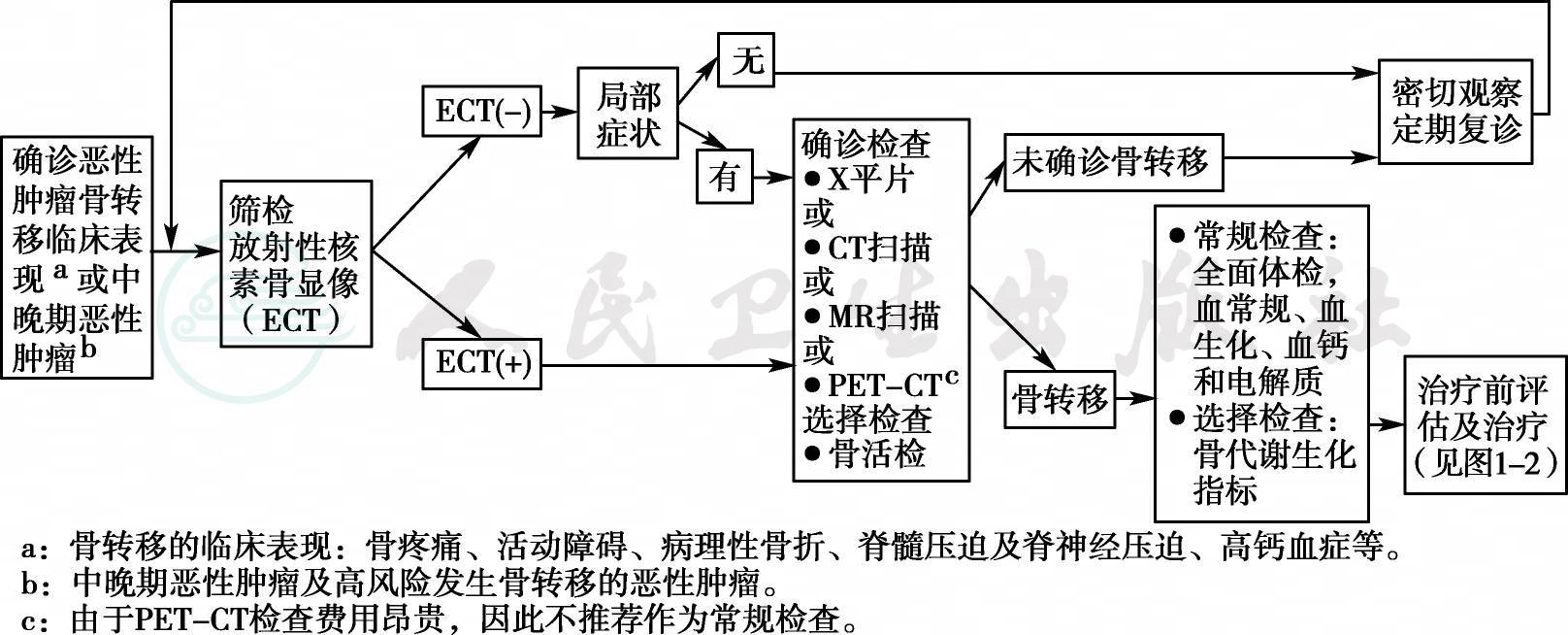
图3 骨转移筛查及检查方法
(二)治疗原则
1.乳腺癌骨转移综合治疗的主要目标:恢复功能,改善生活质量;控制肿瘤进展,延长生存期;预防及治疗骨相关事件(Skeletal Related Event,SREs)和缓解疼痛。SREs包括病理性骨折、脊髓压迫、针对骨转移的放射治疗(RT)和手术,部分文献中也包括高钙血症。
2.治疗应以全身治疗为主,化疗、内分泌治疗、分子靶向治疗是晚期乳腺癌的基本治疗药物,骨调节剂(双膦酸盐、地诺单抗)可以预防和治疗SREs,应作为乳腺癌骨转移治疗的基本用药。
3.判定骨调节剂疗效的标准是能否降低SREs发生率。
4.如患者已发生骨转移,推荐尽早在无骨痛等症状时加用双膦酸盐类,即使全身疾病进展也应继续应用[64,65](1A)。
5.双膦酸盐应持续使用,直至患者不能耐受或一般状况显著下降。目前循证医学提示每3~4周给予4 mg唑来膦酸持续2年是有效和安全的。
6.对于孤立性骨转移,还没有确定骨调节剂的最佳给药时间和持续时间。
7.评价骨转移灶对治疗的反应是困难的,尤其对一些单纯骨转移的患者,判定缓解或进展尤为困难。骨转移灶疗效评估手段中,X线片敏感性低;MR扫描和PET-CT扫描,不宜用于评估疗效;CT扫描加骨窗,是目前最佳手段,但需注意鉴别成骨性骨转移和骨转移灶的修复。
8.对骨转移引起持续性或局限性疼痛的患者,须进行影像学评估以确定是否即将出现或实际已出现了病理性骨折。对可能出现或者已经发生长骨骨折的骨转移患者,需要进行矫形评估,后续的治疗选择可能为手术固定或RT。如果没有明确的骨折风险,RT可作为治疗选择(1A)。
9.如怀疑患者出现脊髓受压引起的神经系统症状和体征,应立即作为肿瘤急症进行充分的评估。需要对可能影响的区域以及脊柱邻近区域进行充分的影像学评价。MRI是首选检查手段。可能需要急诊手术(神经外科和骨科手术)进行手术减压治疗。如果没有可行的减压方法和(或)固定方法,RT可作为治疗选择[66,67](1B)。
(三)药物选择及注意事项
1.大量的随机研究数据支持双膦酸盐用于乳腺癌骨转移患者[67-75]。第三代双膦酸盐(如唑来膦酸)与其他双膦酸盐相比,在作用强度和疗效方面有了进一步提高。荟萃分析提示,唑来膦酸能够更有效地预防骨转移引起的SREs。
2.女性骨转移患者应接受静脉注射双膦酸盐联合口服钙剂和维生素D治疗。
3.双膦酸盐和地诺单抗治疗均可能引起下颌骨坏死(Osteonecrosis of the Jaw,ONJ),ONJ在乳腺癌患者中发生率为3‰。发生ONJ的风险因素包括患者基线的口腔健康状态及治疗期间的口腔操作。因此,在静脉注射双膦酸盐或地诺单抗前应推荐患者进行牙科检查,并且尽可能避免治疗期间进行牙科手术[76]。
4.静脉注射双膦酸盐或皮下注射地诺单抗前应监测血浆钙浓度、肌酐、磷、镁水平。由于在治疗过程中容易出现低磷血症和低钙血症,因此建议在治疗过程中应加强监测钙、磷、镁水平。
十一、脑转移
治疗原则
1.乳腺癌脑转移概况及诊断的确立:在乳腺癌原发肿瘤诊断已确立的前提下,脑转移的诊断可建立在脑增强MRI影像上,但如需与其他脑肿瘤鉴别诊断,可进行影像引导下活检或开颅活检或(和)切除。约15%的ABC患者可发生中枢神经系统的转移[77]。实体肿瘤中,乳腺癌脑转移发生率仅次于肺癌,列第二位;在转移部位上,有多部位如脑膜和脑实质同时累及的倾向,并且在实体肿瘤中脑膜转移几率最高。脑转移预后判断的基本参数为递归分级指数(Recursive Partitioning Analysis,RPA)[78],也可参照乳腺-分级预后评估(Breast-Graded Prognostic Assessment,Breast-GPA)进行判断[79](2A)。
2.脑转移基本治疗原则:脑转移诊断确立后,需要根据患者一般情况、颅外病灶的控制情况及脑转移灶的数目和部位选择合理的局部治疗和支持治疗,并在此基础上根据原发肿瘤的分子分型和既往抗肿瘤全身治疗情况选择合理的全身治疗(2A)。
3.单个脑转移的局部治疗原则:根据脑转移预后指数评估为预后良好组患者,应综合考虑肿瘤的大小,部位及手术的风险大小,首选的治疗方案包括:①手术切除+ RT,和单纯全脑放疗相比,手术切除+全脑放疗可以获得更好的局部控制率,症状控制时间及中位生存时间[80]。对于有占位效应的患者手术有迅速缓解症状的优势。需要注意的是手术的生存获益只有在没有颅外转移灶或者颅外病灶得到控制的患者中才可以体现,合并未控制的其他脏器转移的患者并不适合推荐手术;手术切除+ RT和单纯手术相比也可以提高局部控制率,并降低2/3的颅内远处转移率[80](2A)。②立体定向RT(Stereotactic Radiotherapy,SRT),包括单次治疗的立体定向放射手术(Stereotactic Radiosurgery,SRS)或分次的立体定向RT(Fractionated Stereotactic Radiotherapy,FSRT),在SRT基础上的全脑放疗并不提高生存[81]。
4.转移灶数目2~3(或2~4)枚的局部治疗原则:对于转移灶不超过3枚(或4枚)的非单灶性脑转移,最大径不超过3cm或4cm,且预后良好类型的患者,选择方案包括:①SRS/ FSRT±全脑RT[81]。②如存在超过3cm或4cm并且表现症状的病灶,可手术切除直径较大病灶后补充术后RT,RT可选择全脑或SRS/FSRT[82]。③全脑RT±SRS/FSRT[83]。单纯SRT和 SRT +全脑放疗相比,SRT前者可以减少因全脑RT带来的神经认知功能影响[84]。SRT以后补充全脑RT可以显著降低颅内复发率,但是丧失了单纯SRT对认知功能的保护,所以临床实践中应结合颅内肿瘤情况、预期生存时间以及患者和家人的治疗意愿做出治疗决策。SRS剂量参考范围包括24Gy、18Gy或15Gy,剂量选择主要参考照射肿瘤的体积、单纯SRT还是配合全脑RT等(2A)。
5.多发脑转移或一般情况差和(或)伴有脑膜转移的局部治疗原则:虽然所有的脑转移患者都可以选择全脑RT作为局部治疗手段,但原则上对于脑转移数目超过4枚或者有脑膜累及或者虽然转移灶数目不超过3/4枚,但是合并有未控制的全身疾病播散以及卡氏功能状态评分(Karnofsky Performance Status,KPS)小于70的患者,首选在皮质激素和脱水等对症支持治疗基础上的全脑RT,全脑RT剂量选择范围包括(20~40)Gy/ (5~20)次,其中相对常见的选择包括30Gy/10次、37. 5Gy/15次和40Gy/20次。上述不同的剂量/分割方案对局部控制率和生存率的影响没有显著的差别,原则上,情况差的患者更倾向于选择短疗程治疗[85,86]。在多发脑转移的前提下,应根据患者一般情况和转移灶特点决定全脑RT后是否局部加量照射。如果一般情况差或患者及家属拒绝接受全脑RT,患者也可接受单纯的对症支持治疗(2A)。
6.全身治疗的价值:推荐在脑转移的患者中首先遵循原发肿瘤的分子分型而继续抗肿瘤全身治疗,尤其在接受过全脑RT后的患者,因为血-脑屏障的破坏程度更高,从全身治疗中获得的益处可能更高。在此基础上可综合考虑药物透过血-脑屏障的能力,在脑膜转移的患者中,药物选择需更多地考虑血-脑屏障通透能力。HER-2阳性乳腺癌患者作为一特殊类型的乳腺癌,虽然早期患者的中枢神经系统转移几率并不高于其他分子亚型,但是在转移性患者中,随着病程的发展,脑转移的几率也呈现持续性发生的趋势,如果患者的病程足够长,最终在接近50%的转移性HER-2阳性乳腺癌患者可以发生脑转移[87,88]。回顾性资料证实HER-2阳性脑转移患者在脑RT的基础上持续抗HER-2治疗可以有效改善患者的生存率[89]。在药物治疗方面,HER-2阳性脑转移患者应遵循HER-2阳性ABC患者的治疗原则[90],在某些特殊情况下,例如全脑RT和(或)立体SRS/FSRT后进展的患者,可以首选更易透过血-脑屏障的药物如拉帕替尼[91]。拉帕替尼和卡培他滨的联合的临床Ⅱ期研究显示:在没有接受过RT的HER-2阳性脑转移患者中,联合治疗达到了良好的转移灶的体积退缩作用,获得了65. 9%的客观有效率(定义为没有增加皮质激素的前提下肿瘤体积缩小50%及以上),中位无进展时间5. 5个月。虽然78%的首次治疗失败仍然位于中枢神经系统,且大部分失败的患者接受了挽救性RT,最终全组依然获得了17个月的中位生存时间。该研究提示,虽然RT仍然是目前HER-2阳性乳腺癌脑转移患者的标准治疗,但是在小体积,无症状的患者中,可以谨慎考虑将拉帕替尼和卡培他滨联合方案作为起始治疗,将RT作为挽救治疗手段在后续备用,前提是病情评估准确,和患者充分交流,并且随时有挽救性RT的条件[92](2A)。
7.特殊情况处理及新进展:虽然有报道在转移灶数目大于4枚的患者中也可以首选SRT而暂时不续以全脑RT,但是必须充分告知后续的复发风险,尤其是伴有神经定位体征的复发风险[93](2A)。
8.随访:脑转移患者治疗后1年之内每2~3个月一次增强脑磁共振,以后随着病情的稳定程度而调整(2A)。
1.男性乳腺癌是一种少见疾病,约占所有乳腺癌的1%。男性MBC更为罕见,基本没有关于男性MBC的随机临床试验,相关数据均来自回顾性病例分析。
2. HR阳性率约90%,高于女性乳腺癌。
十二、男性转移性乳腺癌指南
治疗
1.男性MBC的治疗策略均借鉴于女性乳腺癌的治疗。对于ER +男性MBC,除非怀疑内分泌耐药,或疾病进展迅速需要快速缓解,大多数情况下应优先选择内分泌治疗。
2.对于ER +男性MBC,他莫昔芬可作为首选,但不良反应较女性患者发生率高。
3.对于需要接受AI治疗的男性MBC患者,需要联合促黄体激素释放激素(Luteinising- Hormone Releasing Hormone,LHRH)激动剂或睾丸切除术治疗[94],因为AI的治疗可能会通过负反馈机制而引起雄激素和卵泡刺激素(Follicle-Stimulating Hormone,FSH)的升高,且男性患者体内部分雌激素直接来源于睾丸。单独AI治疗(不联合LHRHa)所致的男性雌激素水平的降低比例仅为50%~70%,而女性可达95%以上。
4.雄激素受体(Androgen Receptor,AR)的阳性率达到95%,睾丸切除术有效,肿瘤缓解率为32%~67%。
十三、结论
晚期乳腺癌的治疗是一个复杂的过程,应综合考虑肿瘤本身、患者机体状态及现有治疗手段等多种因素。因缺乏高水平循证医学证据,现有的晚期乳腺癌治疗措施仍存在一定局限性。在过去的几十年间,乳腺癌辅助治疗发生了实质性的改变,使得晚期乳腺癌在既往治疗和耐药机制方面发生相应改变,导致以往的研究结果可能不适合目前的治疗情况。
基于此,我们迫切需要集合各方力量(治疗机构、制药企业、慈善机构、社会团体)共同发起一些设计良好、高质量的临床试验,以寻求晚期乳腺癌的最优治疗策略和最佳药物选择(包括给药剂量、给药方案和疗效预测的标志物等)。此外还需通过临床科研工作者与继续教育工作者的共同努力,将研究结果广泛推广至临床实践,从而优化晚期乳腺癌患者的治疗,最终延长患者生存时间,提高患者生活质量。《中国晚期乳腺癌诊治专家共识》的发布已向这一目标迈出了关键的第一步,此后更重要的任务是充分落实和贯彻共识的内容,并在临床实践中得到正确应用。
1.Cardoso F. Metastatic breast cancer patients:the forgotten heroes,Editorial. The Breast. 2009;18:271-272.
2.Largillier R,Ferrero J-M,Doyen J,et al. Prognostic factors in 1038.women with metastatic breast cancer. Ann Oncol. 2008;19:2012-2019.
3.Andre Fabrice,Slimane Khemaies,Bachelot Thomas,et al. Breast cancer with Synchronous metas-tases:trends in survival during a 14-Year Period. J Clin Oncol 2004;22:3302-3308.
4.Sundquist M,Eriksson Z,Tejler G,et al. Trends in survival in metastatic breast cancer. Eur J Cancer. 2010;8(3):191(abstract 453).
5.Foukakis Theodoros,Fornander Tommy,Lekberg Tobias,et al. Age-specific trends of survival in metastatic breast cancer:26.years longitudinal data from a populationbased cancer registry in Stockholm,Sweden. Breast Cancer Res Treat. 2011. Doi:10. 1007/s10549-011-1594-z.
6.Chirgwin J,Craike M,Gray C,et al. Does multidisciplinary care enhance the management of advanced breast cancer?:evaluation of advanced breast cancer multidisciplinary team meetings. Oncol Pract. 2010;6(6):294-300.
7.Ueno NT,Ito TD,Grigsby RK,et al. ABC conceptual model of effective multidisciplinary cancer care. Nat Rev Clin Oncol 2010;7(9):544-547.
8.EUSOMA the Requirements of a specialist breast unit. Eur J Cancer. 2000;36:2288-2293.
9.Rosen EL,Eubank WB,Mankoff DA. FDG PET,PET/CT,and breast cancer imaging. Radiographics. 2007,27(1):S215-S229.
10.Eubank WB,Mankoff D,Bhattacharya M,et al. Impact of FDG PET on defining the extent of disease and on the treatment of patients with recurrent or metastatic breast cancer. AJR Am J Roentgenol. 2004,183(2):479-486.
11.Houssami N,Costelloe CM. Imaging bone metastases in breast cancer:evidence on comparative test accuracy. Ann Oncol. 2011. doi:10. 1093/annonc/mdr397. 32.
12.Whitlock JP,Evans AJ,Jackson L,et al. Imaging of metastatic breast cancer:distribution and radiological assessment at presentation. Clin Oncol(Royal College of Radiologists). 2001;13:181-186.
13.Costelloe CM,Rohren EM,Madewell JE,et al. Imaging bone metastases in breast cancer:techniques and recommendations for diagnosis. Lan Oncol. 2009;10:606-614.
14.National Collaborating Centre for Cancer. Advanced breast cancer:diagnosis and treatment(developed for NICE),www. guidance. nice. org. uk;2009. Website.
15.Arslan C,Sari E,Aksoy S,et al. Variation in hormone receptor and HER-2.status between primary and metastatic breast cancer:review of the literature. Expert Opin Ther Targets. 2011,15(1):21-30.
16.Pusztai L,Viale G,Kelly CM,et al. Estrogen and HER-2.receptor discordance between primary breast cancer and metastasis. Oncologist. 2010,15(11):1164-1168.
17.叶蓓,柳光宇,陆劲松,等.常用的乳腺癌血清肿瘤标志物在早期诊断中的应用价值不高.中国癌症杂志. 2009;19(10):807-808.
18.Dominici L,Najita J,Hughes M,et al. Surgery of the primary tumor does not improve survival in stageⅣbreast cancer. Breast Cancer Res Treat. 2011.Sep;129(2):459-465.
19.Rashaan ZM,Bastiaannet E,Portielje JE,et al. Surgery in metastatic breast cancer:patients with a favorable profile seem to have the most benefit from surgery. Eur J Surg Oncol. 2012.Jan;38(1):52-56.
20.Ly BH,Vlastos G,Rapiti E,et al. Local-regional radiotherapy and surgery is associated with a significant survival advantage in metastatic breast cancer patients. Tumori. 2010.Nov-Dec;96(6):947-954.
21.Neuman HB,Morrogh M,Gonen M,et al. StageⅣbreast cancer in the era of targeted therapy:does surgery of the primary tumor matter?Cancer. 2010. Mar 1;116.(5):1226-1233.
22.van Tienhoven G,Voogd AC,Peterse JL,et al. Prognosis after treatment for loco-regional recurrence after mastectomy or breast conserving therapy in two randomised trials (EORTC 10801And DBCG-82TM). EORTC Breast Cancer Cooperative Group and the Danish Breast Cancer Cooperative Group. Eur J Cancer. 1999.Jan;35(1):32-38.
23.Cox CE,Furman BT,Kiluk JV,et al. Use of reoperative sentinel lymph node biopsy in breast cancer patients. J Am Coll Surg. 2008.Jul;207(1):57-61.
24.Hortobagyi GN. Multidisciplinary management of advanced primary and metastatic breast cancer. Cancer. 1994.Jul 1;74(1.Suppl):416-423.
25.Wilcken N,Hornbuckle J,Ghersi D. Chemotherapy alone versus endocrine therapy alone for metastatic breast cancer. Cochrane Database Syst Rev 2003(2):CD002747.
26.Higgins MJ,Wolff AC. Therapeutic options in the management of metastatic breast cancer. Oncology(Williston Park). 2008.May;22(6):614-623.
27.Baselga J,Campone M,Piccart M,et al. Everolimus in postmenopausal hormone-receptor-positive advanced breast cancer. N Engl J Med. 2012.Feb 9;366(6):520-529.
28.Pritchard KI,Burris HA,Ito Y,et al. Safety and efficacy of everolimus with exemestane vs. exemestane alone in elderly patients with HER2-negative,hormone receptorpositive breast cancer in BOLERO-2. Clin Breast Cancer. 2013.Dec;13(6):421-432.
29.Slamon DJ,Leyland-Jones B,Shak S,et al. Use of chemotherapy plus a monoclonal antibody against HER2.for metastatic breast cancer that overexpresses HER2. N Engl J Med. 2001;344(11):783-792.
30.Marty M,Cognetti F,Maraninchi D,et al. Randomized phaseⅡtrial of the efficacy and safety of trastuzumab combined with docetaxel in patients with human epidermal growth factor receptor 2-positive metastatic breast cancer administered as first-line treatment:the M77001.study group. J Clin Oncol. 2005;23(19):4265-4274.
31.Di Leo A,Gomez HL,Aziz Z,et al. PhaseⅢ,double-blind,randomized study comparing lapatinib plus paclitaxel with placebo plus paclitaxel as first-line treatment for metastatic breast cancer. J Clin Oncol. 2008;26(34):5544-5552.
32.Zhong-zhen Guan,Binh-he Xu,Wichit Arpornwirat,et al. Overall survival benefit Observed with Lapatinib(L)plus Paclitaxel as first-line therapy in patients with HER2- Overexpressing Metastatic Breast Cancer. 2010.CTRC-AACR San Antonio Breast Cancer Symposium P3-14-24.
33.Vogel CL,Cobleigh MA,Tripathy D,et al. Efficacy and safety of trastuzumab as a single agent in first-line treatment of HER2-overexpressing metastatic breast cancer. J Clin Oncol. 2002;20:719-726.
34.Kaufman B,Mackey JR,Clemens MR,et al. Trastuzumab plus anastrozole versus anastrozole alone for the treatment of postmenopausal women with human epidermal growth factor receptor 2- positive,hormone receptor-positive metastatic breast cancer:results from the randomized phaseⅢTAnDEM study. J Clin Oncol. 2009;27(33):5529-5537.
35.Johnston S,Pippen Jr J,Pivot X,et al. Lapatinib combined with letrozole versus letrozole and placebo as first-line therapy for postmenopausal hormone receptor-positive metastatic breast cancer. J Clin Oncol. 2009;27(33):5538-5546.
36.Pegram M,Liao J. Trastuzumab treatment in multiple lines:current data and future directions. Clin Breast Cancer. 2012;12(1):10-18.
37.von Minckwitz G,du Bois A,Schmidt M,et al. Trastuzumab beyond progression in human epidermal growth factor receptor 2-positive advanced breast cancer:a german breast group 26/breast inter-national group 03-05.study. J Clin Oncol. 2009;27(12):1999-2006.
38.Blackwell KL,Burstein HJ,Storniolo AM,et al. Randomized study of Lapatinib alone or in combination with trastuzumab in women with ErbB2-positive,trastuzumab-refractory metastatic breast cancer. J Clin Oncol. 2010;28(7):1124-1130.
39.Baselga J,Bradbury I,Eidtmann H,et al. NeoALTTO Study Team. Lapatinib with trastuzumab for HER2-positive early breast cancer(NeoALTTO):a randomised,open-label,multicentre,phase 3.trial. Lancet. 2012;379(9816):633-640. Erratum in:Lancet. 379(9816):61.
40.Lewis Phillips GD,Li G,Dugger DL,et al. Targeting HER2-positive breast cancer with trastuzumab-DM1,anantibody-cytotoxicdrug conjugate. Cancer Res. 2008;68(22):9280-9290.
41.Junttila TT,Li G,Parsons K,et al. Trastuzumab-DM1(T-DM1)retains all themechanisms of action of trastuzumab and efficiently inhibits growth of lapatinib insensitive breast cancer. Breast Cancer Res Treat. 2011;128(2):347-356.
42.Baselga J,Gelmon KA,Verma S,et al. PhaseⅡtrial of pertuzumab and trastuzumab in patients with human epidermal growth factor receptor 2-positive metastatic breast cancer that progressed during prior trastuzumab therapy. J Clin Oncol. 2010;28(7):1138-1144.
43.Blackwell KL,Burstein HJ,Storniolo AM,et al. Overall survival benefit with lapatinib in combination with trastuzumab for patients with human epidermal growth factor receptor 2-positive metastatic breast cancer:final results from the EGF104900.Study. J Clin Oncol. 2012;30(21):2585-2592.
44.Wang S,Saboorian MH,Frenkel E,et al. Laboratory assessment of the status of HER-2/neu protein and oncogene in breast cancer specimens:comparison of immunohistochemistry assay with fluorescence in situ hybridisation assays. J Clin Pathol. 2000.May;53.(5):374-381.
45.Carlson RW1,Moench SJ,Hammond ME,et al. HER2.testing in breast cancer:NCCN Task Force report and recommendations. J Natl Compr Canc Netw. 2006.Jul;4.Suppl 3:S1-22.
46.Piccart-Gebhart MJ,Burzykowski T,Buyse M,et al. Taxanes alone or in combination with anthracyclines as first-line therapy of patients with metastatic breast cancer. J Clin Oncol. 2008;26:1980-1986.
47.Stockler MR,Harvey VJ,Francis PA,et al. Capecitabine versus classical cyclophosphamide,methotrexate,and fluorouracil as first-line chemotherapy for advanced breast cancer. J Clin Oncol. 2011;29:4498-4504.
48.Carrick S,Parker S,Wilcken N,et al. Single agent versus combination chemotherapy for metastatic breast cancer. Cochrane Database Syst Rev. 2005;18.(2):CD003372.
49黄红艳,江泽飞,王涛,等.卡培他滨单药或联合方案治疗晚期乳腺癌的疗效和安全性.中华肿瘤杂志. 2011;33(11):850-853.
50.Andersson M,Lidbrink E,Bjerre K,et al. PhaseⅢrandomized study comparing docetaxel plus trastuzumab with vinorelbine plus trastuzumab As first-line therapy of metastatic or locally advanced human epidermal growth factor receptor 2-Positive breast cancer:the HERNATA study. J Clin Oncol. 2011;29(3):264-271.
51.Gennar1A,Stockler M,Puntoni et al. Duration of chemotherapy for metastatic breast cancer:a systematic review and meta-analysis of randomizedclinical trials. J Clin Oncol. 2011;29:2144-2149.
52.Alba E,Ruiz-Borrego M,Martín M,et al. Prolongation of TTP by maintenance therapy with PLD in a multicenter phaseⅢrandomized trial following standard chemotherapy for MBC:GEICAM 2001-01.study. J Clin Oncol. 2007;25(18S):1007.
53.Miller K,Wang M,Gralow J,et al. Paclitaxel plus bevacizumab versus paclitaxel alone for metastatic breast cancer. N Engl J Med. 2007;357:2666-2676.
54.Miles DW,Chan A,Dirix LY,et al. PhaseⅢstudy of bevacizumab plus docetaxel compared with placebo plus docetaxel for the first-line treatment of human epidermal growth factor receptor 2-negative metastatic breast cancer. J Clin Oncol. 2010;28:3239-3247.
55.Robert NJ,Diéras V,Glaspy J,et al. RIBBON-1:randomized,double-blind,placebo-controlled,phaseⅢtrial of chemotherapy with or without bevacizumab for first-line treatment of human epidermal growth factor receptor 2-negative,locally recurrent or metastatic breast cancer. J Clin Oncol. 2011;29:1252-1260.
56.Rossari JR,Metzger-Filho O,Paesmans M,et al. Bevacizumab and Breast Cancer:A Meta-Analysis of First-Line PhaseⅢStudies and a Critical Reappraisal of Available Evidence. J Oncol. 2012;2012:417673. Epub 2012.Sep 12.
57.Rybak LD,Rosenthal DI. Radiological imaging for the diagnosis of bone metastases. Q J Nucl Med. 2001;45(3):53-64.
58.Diel I J,Kaufman M,Bastert G. Metastatic bone disease:fundamental and clinical aspect. Germany:Springer-Verlag Berlin Heidelberg. 1994:93-108.
59.Helms CA,Cann CE,Brunelle FO,et al. Detection of bone marrow metastases using quantitative computed tomograph. Radiology. 1981;40(3):745-750.
60.Steinborn MM,Heuck AF,Tiling R,et al. Whole-body bone marrow MRI in patients with metastic disease to the skeletal system. J Comput Assist Tomogr. 1999;23.(1):123-129.
61.Peterson JJ,Kransdorf MJ,O'Connor MI. Diagnosis of occult bone metastases:positron emission tomography. Clin Ort hop. 2003;415(10):120-128.
62.Cook GJ,Houston S,Rubens R,et al. Detection of bone metastases in breast cancer by 182FDG PET:Differing metabolic activity in osterblastic and osteolytic lesions. J ClinOncol. 1998;16(10):3375-3379.
63.Bury T,Barreto A,Daenen F,et al. Fluorine-18.deoxyglucosepositron emission tomography for the detection of bone metastases in patients with non small cell lung cancer. Eur J Nucl Med. 1998;25(9):1244-1247.
64.Wong MHF,Stockler M,Pavlakis N. Bisphosphonates and other bone agents for breast cancer. Cochrane databasesyst rev. 2012;2:CD003474.
65.Van Poznak CH,Temin S,Yee GC,Janjan NA,Barlow WE,Biermann JS,et al. American Society of clinical oncology executive summary of the clinical practice guideline update on the role of bone-modifying agents in metastatic breast cancer. J ClinOncol. 2011;29(9):1221-1227.
66.Dickinson F,Liddicoat A,Dhingsa R,et al. Magnetic resonance imaging versus radionuclide scintigraph for screening in bone metastases. Clin Radiol. 2000;55.(8):653.
67.George R,Jeba J,Ramkumar G,et al. Interventions for the treatment of metastatic extradural spinal cord compression in adults. Cochrane databasesyst rev. 2008.(4):CD006716.
68.Hortobagyi GN,Theriault RL,Lipton A,et al. Long-term prevention of skeletal complications of metastatic breast cancer with pamidronate. Protocol 19.Aredia Breast Cancer Study Group. J ClinOncol. 1998;16:2038-2044.
69.Theriault RL,Lipton A,Hortobagyi GN,et al. Pamidronate reduces skeletal morbidity in women with advanced breast cancer and lytic bone lesions:a randomized,placebo-controlled trial. Protocol 18.Aredia Breast Cancer Study Group. J ClinOncol. 1999;17:846-854.
70.Rosen LS,Gordon DH,Dugan W,et al. Zoledronic acid is superior to pamidronate for the treatment of bone metastases in breast carcinoma patients with at least one osteolytic lesion. Cancer. 2004;100:36-43.
71.Diel IJ,Body JJ,Lichinitser MR,et al. Improved quality of life after long-term treatment with the bisphosphonate ibandronate in patients with metastatic bone disease due to breast cancer. Eur J Cancer. 2004;40:1704-1712.
72.Hortobagyi GN,Theriault RL,Porter L,et al. Efficacy of pamidronate in reducing skeletal complications in patients with breast cancer and lytic bone metastases. Protocol 19.Aredia Breast Cancer Study Group. N Engl J Med. 1996;335:1785-1791.
73.Lipton A,Theriault RL,Hortobagyi GN,et al. Pamidronate prevents skeletal complications and is effective palliative treatment in women with breast carcinoma and osteolytic bone metastases:long term follow-up of two randomized,placebo-controlled trials. Cancer. 2000;88:1082-1090.
74.McLachlan SA,Cameron D,Murray R,et al. Safety of oral ibandronate in the treatment of bone metastases from breast cancer:long-term follow-up experience. Clin Drug Investig. 2006;26:43-48.
75.Pecherstorfer M,Rivkin S,Body J-J,et al. Long-term safety of intravenous ibandronic acid for up to 4.years in metastatic breast cancer:an open-label trial. Clin Drug Investig. 2006;26:315-322.
76.Woo S-B,Hellstein JW,Kalmar JR. Narrative[corrected]review:bisphosphonates and osteonecrosis of the jaws. Ann Intern Med. 2006;144:753-761.
77.Barnholtz-Sloan JS,Sloan AE,Davis FG,et al. Incidence proportions of brain metastases in patients diagnosed(1973.to 2001)in the Metropolitan Detroit Cancer Surveillance System. J Clin Oncol 2004;22:2865-2872.
78.Gaspar LE,Scott C,Rotman M,et al. Recursive partitioning analysis(RPA)of prognostic factors in three Radiation Therapy Oncology Group(RTOG)brain metastases trials. Int J Radiat Oncol Biol Phys. 1997;37:745-751.
79.Sperduto PW,Berkey B,Gaspar LE,et al. A new prognostic index and comparison to three other indices for patients with brain metastases:an analysis of 1960.patients in the RTOG database. Int J Radiat Oncol Biol Phys. 2008;70:510-514.
80.Patchell RA,Tibbs PA,Regine WF,et al. Postoperative radiotherapy in the treatment of single metastases to the brain:a randomized trial. JAMA. 1998;280(17):1485-1489.
81.Aoyama H,Shirato H,Tago M,et al. Stereotactic radiosurgery plus wholebrain radiation therapy vs stereotactic radiosurgery alone for treatment of brain metastases:a randomized controlled trial. JAMA. 2006;295(21):2483-2491.
82.Kocher M,Soffietti R,Abacioglu U,et al. Adjuvant whole-brain radiotherapy versus observation after radiosurgery or surgical resection of one to three cerebral metastases:results of the EORTC22952-26001.study. J Clin Oncol. 2011;29(2):134-141.
83.Andrews DW,Scott CB,Sperduto PW,et al. Bahary:whole brain radiation therapy with or without stereotactic radio-surgery boost for patients with one to three brain metastases:phaseⅢresults of the RTOG 9508.randomised trial. Lancet. 2004;363:1665-1672.
84.Chang EL,Wefel JS,Hess KR,et al. Neuro- cognition in patients with brain metastases treated with radiosurgery or radiosurgery plus whole-brain irradiation:a randomised controlled trial. Lancet Oncol. 2009;10(11):1037-1044.
85.Gaspar LE,Mehta MP,Patchell RA,et al. The role of whole brain radiation therapy in the management of newly diagnosed brain metastases:a systematic review and evidence based clinical practice guideline. J Neurooncol. 2010;96:17-32.
86.Tsao M N,Rades D,Wirth A,et al. Radiotherapeutic and surgical management for newly diagnosed brain metastasis(es):An American Society for Radiation Oncology evidence-based guideline,Practical Radiation Oncology. 2012;2:210-225.
87.Pestalozz1BC,Holmes E,de Azambuja E,et al. CNS relapses in patients with HER2-positive early breast cancer who have and have not received adjuvant trastuzumab:A retrospective substudy of the HERA trial(BIG 1-01). Lancet Oncol. 2013;14:244-248.
88.Olson EM,Abdel-Rasoul M,Maly J,et al:Incidence and risk of central nervous system metastases as site of first recurrence in patients with HER2-positive breast cancer treated with adjuvant trastuzumab. Ann Oncol. 2013;24:1526-1533.
89.Qian Zhang,Jian Chen,XiaoLi Yu et al. Systemic treatment after whole-brain radiotherapy may improve survival in RPA ClassⅡ/Ⅱ1Breast cancer patients with brain metastasis,Journal of Neuro-Oncology. 2013;114(2):181-189.
90.Naren Ramakrishna,Sarah Temin,Sarat Chandarlapaty et al. Recommendations on Disease Management for Patients With Advanced Human Epidermal Growth Factor Receptor 2-Positive Breast Cancer and Brain Metastases:American Society of Clinical Oncology Clinical Practice Guideline. J Clin Oncol. 2014;32:2100-2108.
91.Lin NU,Die ras V,Paul D,et al. Multicenter phaseⅡstudy of lapatinib in patients with brain metastases from HER2-positive breast cancer. Clin Cancer Res. 2009;15:1452-1459.
92.Bachelot T,Romieu G,Campone M,et al Lapatinib plus capecitabine in patients with previously untreated brain metastases from HER2-positive metastatic breast cancer (LANDSCAPE):A single-group phase 2.study. Lancet Oncol. 2013;14:64-71.
93.Serizawa T,Yamamoto M,Sato Y,et al. Gamma. Knife surgery as sole treatment for multiple brain metastases:2-center retro-spective review of 1508.cases meeting the inclusion criteria of the JLGK0901.multi- institutional prospective study. J Neurosurg. 2010;113(Suppl.):48-52.
94.Giordano SH,Hortobagyi GN. Leuprolide acetate plus aromatase inhibition for male breast cancer. J ClinOncol. 2006;24:e 42-43.