 去看看
去看看


编者按高催乳素血症(hyperprolactinemia,HPRL)是血中催乳素水平高于正常值的一种临床状态,可由多种疾病或生理状态造成,而不是一种独立的疾病。因为催乳素是一种应激激素,在生理状态下可以升高,而许多病理状态和药物也可导致催乳素水平高于正常,如甲状腺功能低减和精神疾病的药物治疗等。临床中应首先确认HPRL的存在,然后对众多的病因进行鉴别,确认为垂体催乳素腺瘤引起或特发性HPRL时,对有临床需要的患者加以治疗。从2006年6月起,中华医学会妇产科学分会内分泌学组、中华医学会内分泌学分会和中华医学会神经外科学分会的各位专家,会同影像学、男科学、放射治疗学等学科的各位学者,组成《高催乳素血症诊疗共识》编写组,多次召开研讨会,共同回顾HPRL的最新研究进展和临床经验,对HPRL的诊断和治疗提出了指导性意见,并达成本共识。这一共识整合了相关学科临床专家对HPRL的诊治认识,总结了因技术(如诊断影像学、神经外科手术等)进步对诊断的影响,规范了药物治疗、手术治疗以及其他治疗方法的不同适应证,明确了孕前、孕期和产后溴隐亭等药物的应用原则,以对妇产科医师的临床实践提供指导。
20世纪20年代,生理学家正式命名了催乳素(prolactin)。1971年,有学者首次用放射免疫方法检测到人血清中存在催乳素,不久又成功地进行了人催乳素的分离、鉴定、分子测序和基因定位。30多年来,随着检测技术的提高、临床新技术的应用和对高催乳素血症(hyperprolactinemia,HPRL)的基础和临床研究的深入,明确了临床上引起HPRL最重要的原因是垂体催乳素腺瘤。目前,对HPRL和垂体催乳素腺瘤的诊断和治疗已积累了丰富的经验。
1969年起,对多巴胺受体激动剂——溴隐亭(bromocriptine)进行的临床研究发现,溴隐亭对HPRL有较好的疗效,1973年溴隐亭正式上市,该药可使70%~90%的垂体催乳素腺瘤患者血清催乳素水平下降,并可抑制泌乳、缩小肿瘤体积、恢复月经和生育能力。这是垂体腺瘤治疗史上划时代的进步[1]。随后,一些疗效更佳的高效、长效和不良反应更少的新型多巴胺受体激动剂相继问世。越来越多的垂体催乳素腺瘤被采用多巴胺受体激动剂治疗,而传统的外科手术和放射治疗在催乳素腺瘤的治疗中逐渐减少。然而,随着经蝶窦途径垂体腺瘤切除术的推广、神经导航和三维立体定向等技术的运用,垂体催乳素腺瘤外科手术的治愈率、安全性也得到了显著提高,手术并发症和术后垂体功能损伤也在减少。同时,垂体催乳素腺瘤的放射治疗也有了长足的进步,涌现出了X刀、γ刀、质子刀等技术以及立体定向放射外科治疗方法等,这些技术和方法较传统治疗照射范围小、疗效出现快、对周围组织损伤小、垂体功能低减发生率低。在可供选择的治疗方法多样化的同时,轻度HPRL是否需要治疗、催乳素大腺瘤的治疗选择、有无生育要求的HPRL妇女的治疗、催乳素腺瘤妇女妊娠的合理处置、男性催乳素大腺瘤的诊治、催乳素腺瘤患者的长期治疗和随诊等问题均逐渐凸现,如何使催乳素腺瘤患者得到合理、规范的治疗,已被提上了议事日程。本共识旨在综合国内相关领域专家的诊治经验和意见,同时参考国内外最新文献资料,规范催乳素腺瘤和HPRL的诊治,让患者和临床工作者分享催乳素诊治的最新成果和经验,提高我国催乳素腺瘤、HPRL的诊治水平。
概述
一、催乳素的分泌、调节及功能
1.催乳素的分泌和调节:
催乳素由垂体前叶的催乳素细胞合成和分泌,受下丘脑多巴胺能途径的调节,多巴胺作用于催乳素细胞表面的多巴胺Dm2受体,抑制催乳素的生成与分泌。任何减少多巴胺对催乳素细胞表面多巴胺Dm2受体作用的生理性及病理性过程,都会导致血清催乳素水平升高[2]。HPRL时,多巴胺受体激动剂会逆转这一过程。
2.催乳素的生理功能:
催乳素的生理作用极为广泛和复杂。在人类,主要是促进乳腺分泌组织的发育和生长,启动和维持泌乳,使乳腺细胞合成蛋白增多。催乳素可影响性腺功能,在男性,催乳素可增强睾丸间质细胞合成睾酮,在睾酮存在的情况下,催乳素还可促进前列腺及精囊生长;但慢性HPRL却可导致性功能低下、精子发生减少,而出现阳痿和男性不育。在女性的卵泡发育过程中,卵泡液中催乳素水平变化明显;HPRL不仅对下丘脑促性腺激素释放激素(GnRH)及垂体卵泡刺激素(FSH)、黄体生成素(LH)的脉冲式分泌有抑制作用,而且可直接抑制卵巢合成黄体酮及雌激素,导致卵泡发育及排卵障碍,临床上表现为月经紊乱或闭经。另外,催乳素还与自身免疫功能相关,人类B、T淋巴细胞、脾细胞和自然杀伤(NK)细胞中均有催乳素受体,催乳素与受体结合后可调节细胞功能[3]。催乳素在渗透压调节上也有重要作用。
二、在生理和应激情况下催乳素分泌的变化
1.昼夜的变化:
催乳素的分泌有昼夜节律,入睡后逐渐升高,早晨睡醒前可达到峰值,睡醒后迅速下降,上午10点至下午2点降至谷值。
2.年龄和性别的变化:
由于母体雌激素水平的影响,刚出生的婴儿血清催乳素水平高达4.55nmol/L左右,之后逐渐下降,到出生后3个月时降至正常水平。催乳素水平在青春期轻度上升至成人水平。成年女性血清催乳素水平始终比同龄男性高。妇女绝经后的18个月内,体内的催乳素水平逐渐下降50%,但接受雌激素治疗的妇女下降较缓慢。在HPRL的妇女中,应用雌激素治疗不引起催乳素水平的变化。老年男性与年轻人比较,平均血清催乳素水平约下降50%[4]。
3.月经周期中的变化:
血清催乳素水平随月经周期的变化不明显,一些妇女在月经周期的中期催乳素水平升高,而在卵泡期催乳素水平降低,排卵期的催乳素水平轻度升高可能引起某些妇女不孕。
4.妊娠期的变化:
妊娠期间雌激素水平升高刺激垂体催乳素细胞增殖和肥大,导致垂体增大及催乳素分泌增多。在妊娠末期,血清催乳素水平可上升至非妊娠期的10倍。分娩后,增大的垂体恢复正常大小,血清催乳素水平随之下降。正常生理情况下,催乳素分泌细胞占腺垂体细胞的15%~20%,妊娠末期可增加到70%。
5.产后泌乳过程中的变化:
如果不哺乳,产后4周产妇血清催乳素水平降至正常;如果哺乳,当乳头被吸吮时可触发垂体催乳素快速释放,产后4~6周内哺乳妇女基础血清催乳素水平持续升高。此后4~12周,基础催乳素水平逐渐降至正常,随着每次哺乳发生的催乳素水平升高幅度逐渐减小。产后3~6个月,基础和哺乳刺激情况下催乳素水平的下降,主要是由于婴儿添加辅食导致的哺乳减少。如果坚持严格的母乳喂养,基础催乳素水平会持续升高,并可发生产后闭经。对健康的妇女,非哺乳状态下刺激乳房也可以导致催乳素水平上升。
6.应激情况下的变化:
应激(如情绪紧张、寒冷、运动等)时垂体释放的应激激素包括:催乳素、ACTH和生长激素(GH)。应激可以使催乳素水平升高数倍,通常持续时间不到1h。
三、HPRL
1.HPRL定义:
各种原因引起外周血清催乳素水平持续高于正常值的状态称为HPRL。正常育龄妇女催乳素水平不超过1.14~1.36nmol/L(各实验室有自己的正常值)。规范的血标本采集和准确可靠的实验室测定对判断HPRL至关重要,尤其是催乳素水平轻度升高时,需要重复测定才能确诊。
2.催乳素的实验室测定规范:
由于HPRL的诊断是以血清催乳素测定值为基础的,因而首先需要准确可靠的实验室技术。由于不同实验室使用的方法及试剂盒的差异可能会导致检测值上较大的不同,这一点无论应用放射免疫技术还是目前更广泛使用的固相、夹心法化学发光免疫量度检测(solid-phase,two-side chemoluminescent immunometric assay)均存在。必须确定用于检测的血清样本在离心前完全充分凝集,以去除纤维蛋白的干扰,并最好用超速离心方法去除血脂。每个实验室均应具有严格的质量控制标准,以最大限度地提高血清催乳素测定的可靠性,并应建立根据本实验室的正常值范围及试剂盒提供的参数提出的本实验室界定HPRL的标准[5]。
此外,由于血清催乳素水平受其脉冲式分泌及昼夜不同分泌的影响,采血时间应在每天最低谷的时相,即上午10~11时为宜。精神紧张、寒冷、剧烈运动等应激情况可导致催乳素水平升高数倍,但持续不超过1h,因而采血前应嘱患者安静1h后再取血。
3.HPRL的流行病学特征:
HPRL是年轻女性常见的下丘脑-垂体轴内分泌紊乱。不同的检测人群中HPRL的发生率不尽相同。在未经选择的正常人群中,HPRL的发生率约为0.4%;在计划生育门诊人群中,HPRL的发生率为5%;在单纯性闭经者中,约15%存在HPRL;而在闭经伴有溢乳的患者中,HPRL的发生率则高达70%。15%的无排卵妇女同时合并HPRL,43%的无排卵伴有溢乳者存在HPRL。3%~10%无排卵的多囊卵巢综合征患者伴发HPRL。有关HPRL在不孕、不育患者中发生率的报道很少[6]。
垂体腺瘤占所有颅内肿瘤的10%~15%。催乳素腺瘤是最常见的垂体功能性腺瘤,约占全部垂体腺瘤的45%,是临床上病理性HPRL最常见的原因。催乳素腺瘤多为良性肿瘤,根据直径大小可分为微腺瘤(肿瘤直径≤10mm)和大腺瘤(肿瘤直径> 10mm)。总体来说,催乳素腺瘤的年发病率为6/100万~10/100万,患病率为60/100万~100/100万。最近的研究表明,催乳素腺瘤的患病率可能远不止于此,要在此基础上增加3~5倍。
4.HPRL的原因:
HPRL的原因可归纳为生理性、药物性、病理性和特发性4类。(1)生理性HPRL:很多生理因素会影响血清催乳素水平,血清催乳素水平在不同的生理时期有所改变,甚至是每天、每小时都会有所变化。日常的运动、精神创伤、低血糖、夜间、睡眠、进食、性生活及各种生理现象如卵泡晚期和黄体期、妊娠、哺乳、产褥期、应激状态、乳头受到刺激、新生儿期等,均可出现催乳素水平暂时性升高,但升高幅度不会太大,持续时间不会太长,也不会引起相关的病理症状。(2)药物性HPRL:许多药物可引起HPRL,这些药物中大多数的作用是拮抗下丘脑催乳素释放抑制因子(PIF)或兴奋催乳素释放因子(PRF)的,多巴胺是典型的内源性PIF,少数药物还可能对催乳素细胞有直接影响。常见的可能引起催乳素水平升高的药物包括:多巴胺耗竭剂:甲基多巴,利血平;多巴胺转化抑制剂:阿片肽、吗啡、可卡因等麻醉药;多巴胺重吸收阻断剂:诺米芬辛;二苯氮类衍生物:苯妥因、安定等;组胺和组胺H1、H2受体拮抗剂:5羟色胺、苯丙胺类、甲氰咪胍等;单胺氧化酶抑制剂:苯乙肼等;血管紧张素转换酶抑制剂:依那普利等;激素类药物:雌激素、口服避孕药、抗雄激素类药物、促甲状腺激素释放激素等;中草药(尤其是具有安神、止惊作用的中草药):六味地黄丸、安宫牛黄丸等;其他:异烟肼、达那唑等。药物引起的HPRL,血清催乳素水平多<4.55nmol/L,但也有文献报道,长期服用一些药物,可使血清催乳素水平高达22.75nmol/L,引起大量泌乳和闭经[7]。(3)病理性HPRL:常见的导致HPRL的病理原因有:①下丘脑PIF不足或下达至垂体的通路受阻,常见于下丘脑或垂体柄病变,如颅底脑膜炎、结核、梅毒、放线菌病、颅咽管瘤、类肉瘤样病、神经胶质细胞瘤、空泡蝶鞍综合征、动-静脉畸形、帕金森综合征、精神创伤等,也可见于外伤和手术。②原发性和(或)继发性甲状腺功能减退,如假性甲状旁腺功能减退、桥本甲状腺炎。③自主性高功能的催乳素分泌细胞单克隆株,见于垂体催乳素腺瘤、GH腺瘤、ACTH腺瘤等及异位催乳素分泌(如未分化支气管肺癌、肾上腺样瘤、胚胎癌、子宫内膜异位症等)。④传入神经刺激增强可加强PRF的作用,见于各类胸壁炎症性疾病,如乳头炎、皲裂、胸壁外伤、带状疱疹、结核、创伤性及肿瘤性疾病等。⑤慢性肾功能衰竭时,催乳素在肾脏降解异常;或肝硬化、肝性脑病时,假性神经递质形成,拮抗PIF的作用。⑥妇产科手术如人工流产术、引产术、子宫切除术、输卵管结扎术、卵巢切除术等。(4)特发性HPRL:HPRL与妊娠、服药、垂体肿瘤或其他器质性病变无关,多因患者的下丘脑-垂体功能紊乱,从而导致催乳素分泌增加,其中大多数人表现为血清催乳素水平轻度升高,长期观察可恢复正常。临床上当无病因可循时,可诊断为特发性HPRL。但对部分伴月经紊乱而血清催乳素水平>4.55nmol/L者,需警惕隐性垂体微腺瘤的可能,应密切随访。在血清催乳素水平明显升高而无症状的特发性HPRL患者中,部分患者可能是巨分子催乳素血症,这种巨分子催乳素有免疫活性而无生物活性[8]。
诊断
HPRL的诊断包括确定存在HPRL和确定病因。
一、确诊HPRL
由于催乳素水平检测并非常规的筛查项目,所以医师通常通过特异的临床表现或在其他疾病检查过程中检查催乳素水平而发现可疑患者,进而经过对临床表现和血清催乳素水平的综合分析而确诊HPRL。
1.女性HPRL的临床表现:
(1)月经改变和不孕:HPRL可引起女性月经失调和生殖功能障碍。当血清催乳素水平轻度升高(4.55~6.82nmol/L)时,可引起黄体功能不足而发生复发性流产;而随着血清催乳素水平的进一步升高,可出现排卵障碍,临床表现为功能失调性子宫出血、月经稀发或闭经及不孕症[9]。(2)溢乳:HPRL时,在非妊娠期及非哺乳期出现溢乳者占27.9%,同时出现闭经和溢乳者占75.4%。这些患者血清催乳素水平一般都显著升高。(3)其他:HPRL者通常存在体重增加。长期HPRL可因雌激素水平过低导致进行性的骨痛、骨密度降低、骨质疏松。少数患者可出现多毛、脂溢及痤疮,这些患者可能伴有多囊卵巢综合征等其他异常。
2.男性HPRL的临床表现:
(1)男性勃起功能障碍:HPRL是导致男性勃起功能障碍的常见原因之一。反之,勃起功能障碍常常是HPRL的最早临床表现之一。导致男性勃起功能障碍的机制尚未完全阐明,目前认为,睾酮水平降低为其原因之一。但不少患者睾酮水平完全正常,却仍然表现出明显的勃起功能障碍。此外,若不将血清催乳素水平降到正常,补充睾酮治疗效果并不明显,说明HPRL对阴茎勃起功能可能有直接的作用。不能射精和性高潮障碍等也是HPRL常见的性功能障碍的表现。(2)性欲减退:HPRL时,下丘脑分泌GnRH的频率和幅度均明显降低,使垂体分泌LH与FSH的频率和幅度也减退,睾丸合成雄激素的量明显下降,因而引起性欲减退,表现为对性行为兴趣下降甚至消失。(3)生精能力减退及不育:HPRL可导致生精能力减退。当垂体分泌LH与FSH的频率和幅度减退时,精子生成的能力就明显下降。(4)第二性征减退:长期的HPRL状态,可导致男性第二性征的减退。表现为胡须生长速度变慢、发际前移、阴毛稀疏、睾丸变软、肌肉松弛等。此外,尚有不少患者出现男性乳腺发育。(5)其他:长期HPRL导致雄激素水平降低,可能会造成骨质疏松。
3.垂体前叶腺瘤的压迫症状:
催乳素腺瘤是病理性HPRL的最常见病因。肿瘤占位的临床表现包括头痛、视力下降、视野缺损和其他脑神经压迫症状、癫痫发作、脑积液鼻漏等。15%~20%的患者存在垂体腺瘤内自发出血,少数患者还可发生急性垂体卒中,表现为突发剧烈头痛、呕吐、视力下降、动眼神经麻痹等神经系统症状,甚至蛛网膜下腔出血、昏迷等危象[10]。男性垂体催乳素腺瘤患者,常因血清催乳素水平升高引起的症状轻而未能及时就诊,导致病程延长。而直到肿瘤体积较大,压迫视交叉引起视力下降、视野障碍或垂体瘤卒中出现剧烈头痛时就诊才获得诊断。
4.血清催乳素水平异常升高:
由于血清催乳素水平变化受许多生理因素和应激情况的影响,因此,测定血清催乳素水平有严格的采血要求,应于安静的清醒状态下、上午10~11时取血测定。如果血清催乳素水平显著高于正常者,1次检查即可确定,当血清催乳素测定结果低于正常上限3倍时,至少应检测2次,以确定有无HPRL。
另需注意一些临床表现和血清催乳素水平变化不一致的情况,在某些患者血清催乳素水平升高而没有相关临床症状,或者症状不能解释其升高程度时,需考虑存在巨分子催乳素血症。个别患者有典型HPRL和垂体腺瘤表现,而实验室测定值却很低或正常,可能因为催乳素水平太高造成“钩子(HOOK)”现象。这种情况与前面一种情况正好相反,需要用倍比稀释的方法重复测定患者的血清催乳素水平。
二、HPRL的病因诊断
HPRL的病因诊断需要通过详细询问病史、相应的实验室检查、影像学检查等排除生理性或者药物性因素导致的血清催乳素水平升高,明确是否存在病理性原因。其中最常见的病因为垂体催乳素腺瘤。
1.病史采集:
需要针对性地从HPRL的生理性、病理性和药物性原因3个方面了解患者相关的病史。应询问患者的月经史、分娩史、手术史和既往病史,有无服用相关药物史,采血时有无应激状态(如运动、性交、精神情绪波动或盆腔检查)等。
2.实验室检查:
包括妊娠试验、垂体及其靶腺功能、肾功能和肝功能等,根据病史进行选择。
3.影像学检查:
经上述检查,证实为血清催乳素水平轻度升高而未发现其他明确病因或血清催乳素水平>4.55nmol/L时,均应行鞍区影像学检查(MRI或CT),以排除或确定是否存在压迫垂体柄或分泌催乳素的颅内肿瘤及空蝶鞍综合征等。
鞍区病变的影像学检查主要为CT和MRI。MRI检查软组织分辨率高,可以多方位成像,在垂体微小肿瘤的检出,对鞍区病变的定性、定位诊断等各个方面都明显优于CT,并且无放射线损伤,可以多次重复进行,是鞍区病变首选的影像学检查方式。MRI检查常规应包括薄层、小扫描野(FOV)的矢状位和冠状位T1WI序列,且需至少1个平面的T2WI(矢状位或冠状位)。尽管有些病变MRI平扫即可提出较确定的诊断,仍建议同时行鞍区增强MRI检查,病变检出率更高,必要时还应行鞍区动态增强的MRI检查[11],见图1。HPRL的诊断流程见图2。
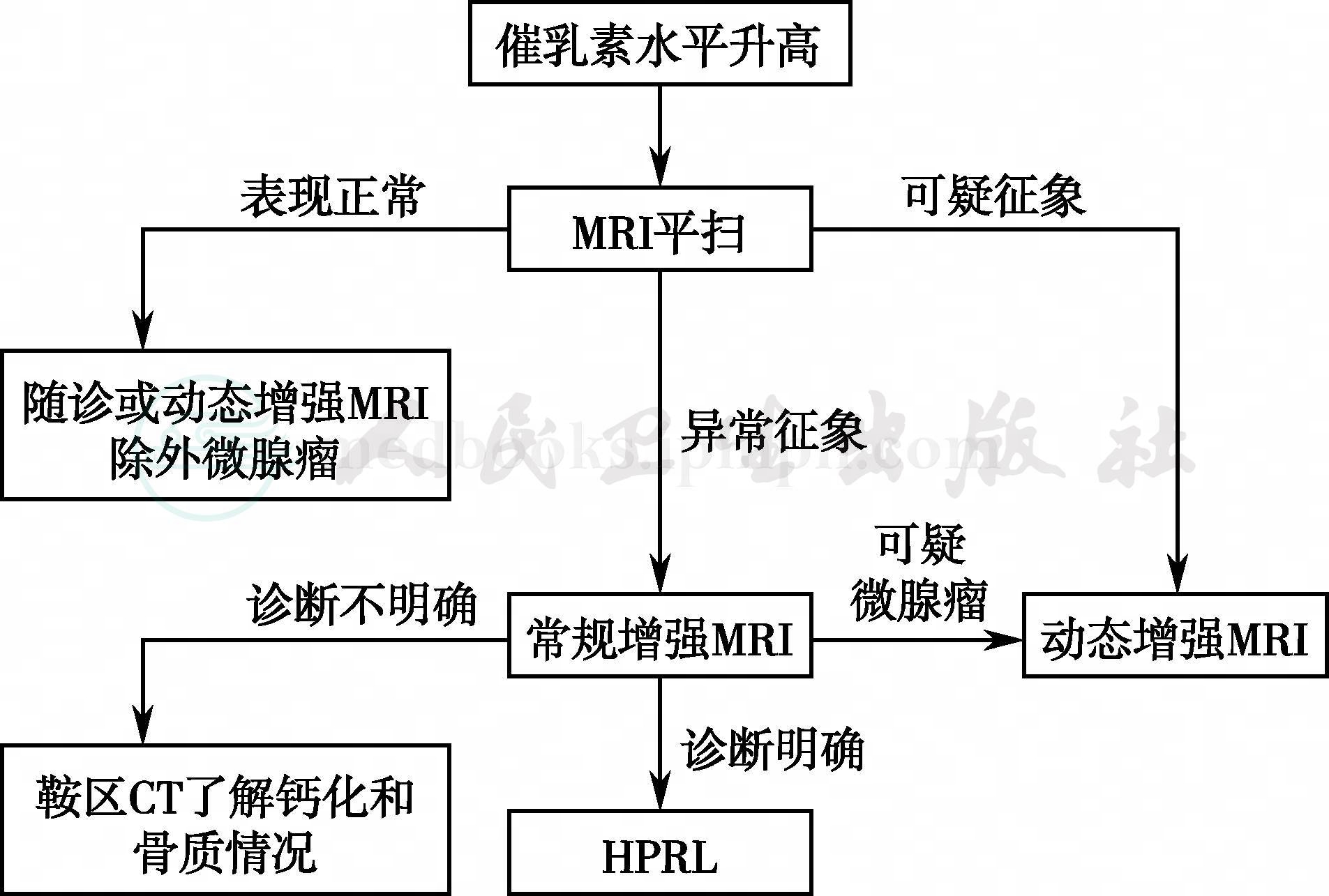
图1 HPRL的影像学检查程序
治疗
HPRL的治疗目标是控制HPRL、恢复女性正常月经和排卵功能或恢复男性性功能、减少乳汁分泌及改善其他症状(如头痛和视功能障碍等)。
在确定HPRL后,首先要决定是否需要治疗。垂体催乳素大腺瘤及伴有闭经、泌乳、不孕和(或)不育、头痛、骨质疏松等临床表现的微腺瘤患者都需要治疗;仅有血清催乳素水平升高而无以上表现者,可随诊观察;其次是决定治疗方案。垂体催乳素腺瘤不论是微腺瘤还是大腺瘤,都可以首选多巴胺受体激动剂治疗;对于药物疗效欠佳、不能耐受药物不良反应及拒绝接受药物治疗的患者可以选择手术治疗。选择治疗方法时,医师应该根据患者的自身情况,如年龄、生育状况和要求,在充分告知患者各种治疗方法的优势和不足的情况下,尊重患者的意见,帮助患者做出适当的选择。
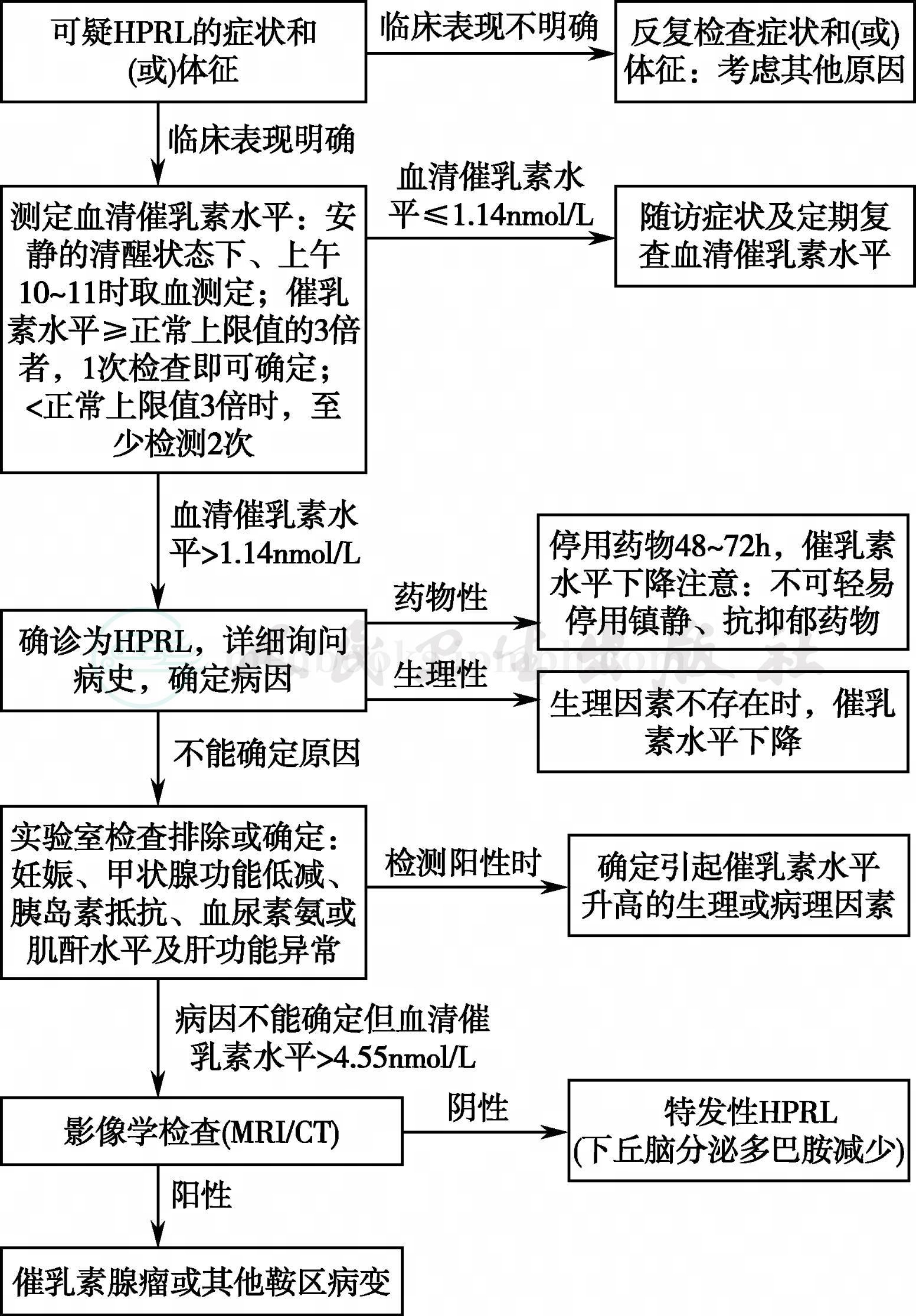
图2 HPRL的诊断流程
一、药物治疗
多巴胺受体激动剂治疗适用于有月经紊乱、不孕和(或)不育、泌乳、骨质疏松及头痛、视交叉或其他脑神经压迫症状的所有HPRL患者,包括垂体催乳素腺瘤。常用的药物有溴隐亭、卡麦角林(cabergoline)和喹高利特(quinagolide)。
1.溴隐亭:
溴隐亭是第一个在临床应用的多巴胺受体激动剂。为了减少药物的不良反应,溴隐亭治疗从小剂量开始渐次增加,即从每晚睡前1.25mg口服开始,递增到需要的治疗剂量。如果反应不大,可在几天内增加到治疗量。常用剂量为2.5~10.0mg/d,分2~3次服用,大多数患者5.0~7.5mg/d已显效。剂量的调整依据是血清催乳素水平。达到疗效后,可分次减量到维持量,通常1.25~2.5mg/d。溴隐亭治疗可以使70%~90%的患者获得较好疗效,表现为血清催乳素水平降至正常、泌乳现象消失或减少、垂体腺瘤缩小、恢复规则月经和生育能力,在男性也可恢复性欲和生精能力并纠正男性不育。
应注意的是,溴隐亭只是使垂体催乳素腺瘤可逆性缩小、抑制肿瘤细胞生长,长期治疗后肿瘤出现纤维化。但停止治疗后垂体催乳素腺瘤会恢复生长,导致HPRL再次出现,因此,需要长期治疗;只有少数病例在长期治疗后达到临床治愈。
溴隐亭的不良反应主要是恶心、呕吐、头晕、头痛、便秘,多数患者的这些不良反应可在短期内消失。由小剂量开始逐渐加量的给药方法可减少不良反应,如在增加剂量时出现明显不耐受现象,可减少递增剂量。大剂量时可能发生雷诺现象和心律异常。该药最严重的不良反应是初始剂量时少数患者发生体位性低血压,个别患者可出现意识丧失,故初始剂量一定要小,服药时不要进行可使血压下降的活动,如突然起立、热水淋浴或盆浴。溴隐亭治疗期间,不要同时使用致血清催乳素水平升高的药物。长期服用剂量高于30mg/d时,个别患者可能发生腹膜后纤维化[12]。
约10%的患者对溴隐亭不敏感,疗效不满意,或有严重头痛、头晕、胃肠反应、便秘等且持久不消失,不能耐受治疗剂量时,可更换其他药物或手术治疗。
2.其他药物:
卡麦角林和喹高利特是具有高度选择性的多巴胺D2受体激动剂,是溴隐亭的换代药物,抑制催乳素的作用更强大而不良反应相对减少,作用时间更长。对溴隐亭抵抗(15mg/d溴隐亭效果不满意)或不耐受溴隐亭治疗的催乳素腺瘤患者,改用这些新型多巴胺受体激动剂仍有50%以上有效。喹高利特每天服用1次,75~300μg;卡麦角林每周只需服用1~2次,常用剂量为每次0.5~2.0mg,患者顺应性较溴隐亭更好。
3.药物治疗后的随诊:
多巴胺受体激动剂治疗HPRL、垂体催乳素腺瘤时,无论是降低血清催乳素水平还是使肿瘤体积缩小,都是可逆性的,需长期用药才能维持疗效。给予初始治疗剂量达到血清催乳素水平正常、月经恢复后,原治疗剂量可维持不变,3~6个月后微腺瘤患者即可开始减量;大腺瘤患者此时需复查MRI,确认催乳素腺瘤已明显缩小(通常肿瘤越大,缩小越明显),血清催乳素水平正常后也可开始减量。减量应缓慢分次(2个月左右1次)进行,通常每次减量幅度为在原每日剂量的基础上减少1.25mg,以保持血清催乳素水平正常的最小剂量为维持量。每年至少随诊2次,以确认血清催乳素水平正常。在维持治疗期间,一旦再次出现月经紊乱或血清催乳素水平不能被控制时,应查找原因,如药物影响、妊娠等,必要时复查MRI,决定是否调整用药剂量。对小剂量溴隐亭维持治疗期间,血清催乳素水平保持正常、腺瘤基本消失的患者,5年后可试行停药,若停药后血清催乳素水平再次升高,则仍需长期用药。
对于催乳素大腺瘤患者,在多巴胺受体激动剂治疗后,如果血清催乳素水平正常,而垂体大腺瘤不缩小,应重新考虑是否诊断为非催乳素腺瘤或混合性垂体腺瘤,是否需改用其他治疗(如手术治疗)。治疗前有视野缺损的患者,治疗初期即应复查视野,视野缺损严重者在初始治疗时可每周查2次视野(已有视神经萎缩者相应区域的视野会永久性缺损)。如果药物治疗满意,通常在2周内可改善视野;但是对药物反应的时间,存在个体差异。对视野缺损无改善或只有部分改善者应在溴隐亭治疗后1~3周内复查MRI,以决定是否需要手术治疗,缓解视交叉压迫。
二、手术治疗
由于垂体的解剖位置以及在内分泌方面的重要作用,垂体催乳素腺瘤可以出现由于肿瘤压迫和下丘脑-垂体轴功能紊乱而导致的局部或全身各系统功能紊乱,治疗上有一定的困难。近年来,随着神经导航及内镜等仪器设备的发展及微创手术技术水平的提高,使经蝶窦入路手术更精确、更安全、损伤更小、并发症更少。因此,经蝶窦入路手术也是垂体催乳素腺瘤患者除药物治疗之外的另一选择。
1.手术适应证:
(1)药物治疗无效或效果欠佳者;(2)药物治疗反应较大不能耐受者;(3)巨大垂体腺瘤伴有明显视力、视野障碍,药物治疗一段时间后无明显改善者;(4)侵袭性垂体腺瘤伴有脑脊液鼻漏者;(5)拒绝长期服用药物治疗者。手术也可以治疗复发的垂体腺瘤,在药物治疗之前或之后也可以采用手术治疗。
手术几乎没有绝对禁忌证,而绝大多数相对禁忌证均与全身状态差及脏器功能障碍相关。对于这些患者,应在手术之前进行相应的治疗,改善全身一般情况。另有观点认为,由于多巴胺受体激动剂能使肿瘤纤维化,可能增加手术的困难和风险。
手术的成败取决于术者的经验和肿瘤的大小。微腺瘤的手术效果较大腺瘤好。60%~90%的微腺瘤患者术后血清催乳素水平可达到正常,而大腺瘤患者达到正常的比例则较低。另外,在手术后血清催乳素水平恢复正常的患者中,长期观察仍有20%的患者会复发。经蝶窦入路手术的死亡率和病残率分别为0.5%和2.2%,并发症主要涉及内分泌功能、局部解剖和医源性3个方面。内分泌方面的并发症包括新出现的垂体前叶功能低下和暂时性或持续性尿崩症,以及抗利尿激素分泌紊乱的症状,术后持续性垂体前叶功能减退症与原发肿瘤体积相关;局部解剖方面的并发症包括视神经的损伤、周围神经及血管的损伤、脑脊液鼻漏、鼻中隔穿孔、鼻窦炎、颅底骨折等,其中颈动脉海绵窦段的损伤是最严重的并发症,常常危及生命。其他与手术相关的并发症包括深静脉血栓和肺炎等,发生率均很低。但是也有内分泌专家认为,术后垂体功能低下的发生率应高于上述各种并发症。
2.手术治疗后的随访和处理:
手术后,均需进行全面的垂体功能评估。存在垂体功能低下的患者需要给予相应的内分泌激素治疗。手术后3个月应行影像学检查,结合内分泌学变化,了解肿瘤切除程度。视情况每半年或1年再复查1次。手术后仍有肿瘤残余的患者,需要进一步采用药物或放疗。
三、放疗
1.放疗的地位:
由于手术与药物治疗的发展,采取放疗的各种垂体瘤患者已越来越少。随着立体定位放射外科(X刀、γ刀、质子刀)的发展,选择性地对部分催乳素腺瘤患者采用立体定向放疗的报道日渐增多。放疗主要适用于大的侵袭性肿瘤、术后残留或复发的肿瘤、药物治疗无效或不能耐受药物不良反应的患者、存在手术禁忌证或拒绝手术的患者以及部分不愿长期服药的患者。
2.放疗的方法:
放疗方法分为传统放疗(包括普通放疗、适形放疗、调强适形放疗、IMRI)和立体定向放疗。传统放疗因照射野相对较大,易出现迟发性垂体功能低下等并发症,目前仅用于有广泛侵袭的肿瘤的术后治疗。立体定向放疗适用于边界清晰的中小型肿瘤,最好选择与视通路之间的距离>3~5mm的肿瘤,一次性治疗剂量可能需达到18~30Gy。
有研究发现,多巴胺受体激动剂可能具有放射保护作用。因此,建议在治疗催乳素腺瘤的同时,最好停用多巴胺受体激动剂。
3.放疗的疗效评价:
放疗的疗效评价应包括肿瘤局部控制以及异常升高的血清催乳素水平下降的情况。通常肿瘤局部控制率较高,而血清催乳素水平恢复至正常则较为缓慢。有文献报道,即使采用立体定向放疗后,2年内也仅有25%~29%的患者血清催乳素水平恢复正常,其余患者可能需要更长时间随访或需加用药物治疗。
4.放疗的并发症:
传统放疗后2~10年,有12%~100%的患者出现垂体功能低下,此外,1%~2%的患者可能出现视力障碍或放射性颞叶坏死。立体定向放疗后也有可能出现视力障碍和垂体功能低下。放疗还需特别注意可能出现对生育功能的影响。
HPRL的治疗流程见图3。
四、HPRL合并妊娠的相关处理
HPRL合并妊娠时,基本的处理原则是将胎儿对药物的暴露限制在尽可能少的时间内。未治疗的催乳素微腺瘤患者妊娠后,约5%的患者会发生视交叉压迫,而大腺瘤患者妊娠后出现这种危险的可能性达25%以上[3]。
对微腺瘤合并妊娠者,应在明确妊娠后停用溴隐亭,因为肿瘤增大的风险较小。停药后应定期测定血清催乳素水平和检查视野。正常妇女妊娠后,血清催乳素水平可以升高至非妊娠期的10倍左右,如果患者血清催乳素水平显著超过治疗前时,要增加血清催乳素水平监测及视野检查的频度。一旦发现视野缺损或海绵窦综合征,需立即加用溴隐亭,可望在1周内改善症状,若不见好转,应考虑手术治疗。
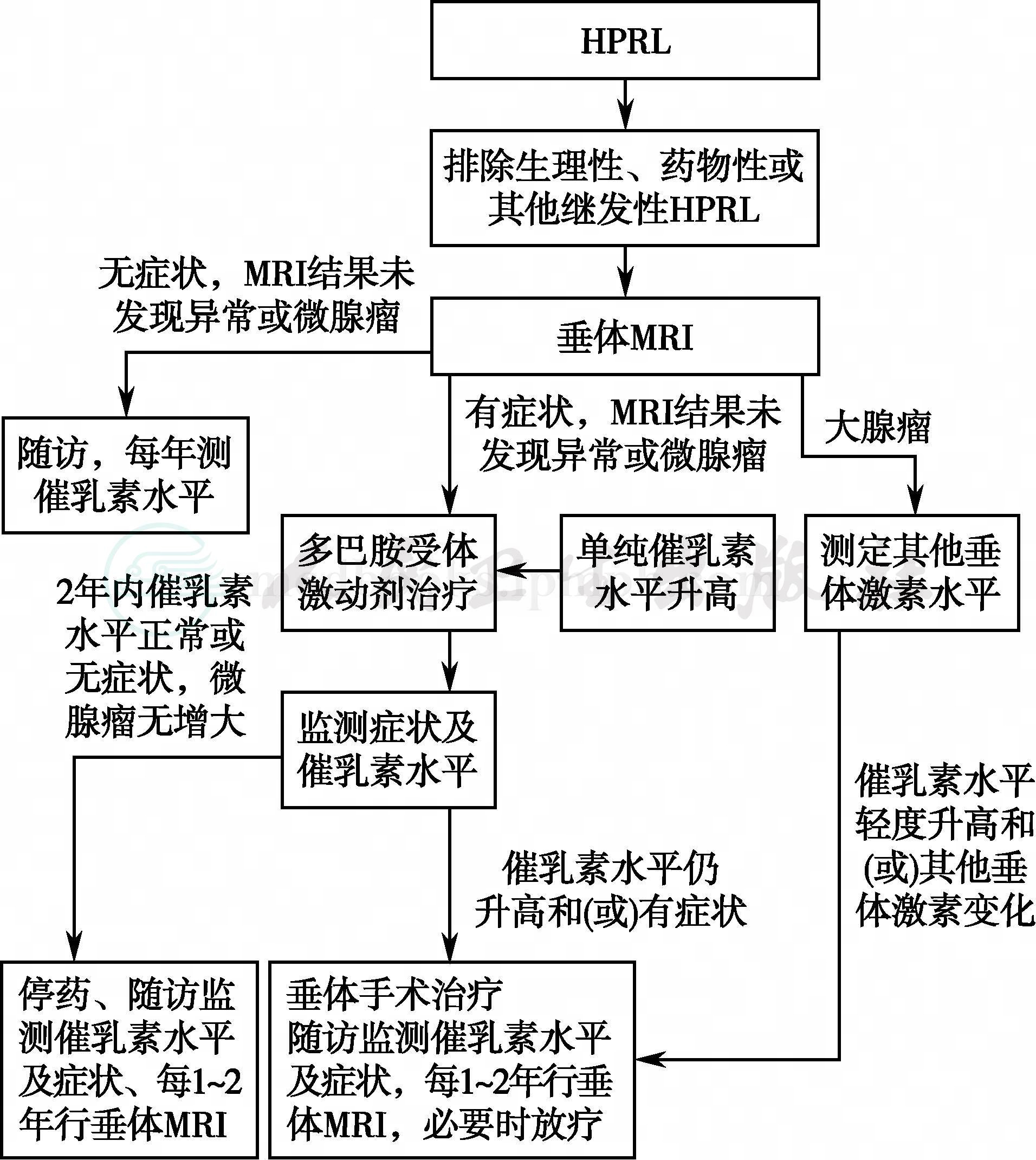
图3 HPRL的治疗流程
对于有生育要求的大腺瘤妇女,需经溴隐亭治疗腺瘤缩小后方可妊娠;所有垂体腺瘤合并妊娠者,在妊娠期需要每2个月评估1次。妊娠期间腺瘤再次增大者,给予溴隐亭仍能抑制其生长,但整个孕期须持续用药直至分娩。药物对母亲和胎儿的影响可能比手术小,但药物治疗需要严密的监测,对溴隐亭治疗无反应及视力、视野进行性恶化者,应该行经蝶窦入路的手术治疗并尽早终止妊娠(妊娠接近足月时)。
HPRL、垂体催乳素腺瘤妇女应用溴隐亭治疗期间妊娠,其自发性流产、胎死宫内、胎儿畸形等的发生率在14%左右,与正常妇女的异常妊娠发生率相近。没有证据支持哺乳会刺激肿瘤生长[14]。对于有哺乳意愿的妇女,除非妊娠诱导的肿瘤生长需要治疗,一般要到患者欲结束哺乳时再使用多巴胺受体激动剂。
尽管妊娠前的放疗(随后用溴隐亭)可使肿瘤增大的危险降至4.5%,但放疗很少能够治愈垂体催乳素腺瘤。放疗还可以导致长期的垂体功能低下,因此这种治疗方法的可接受性较小,不建议使用。
五、女性HPRL患者不孕、不育的治疗
1.枸橼酸氯米芬促排卵:
经药物治疗血清催乳素水平正常后仍无排卵者,可采用枸橼酸氯米芬(clomiphene,CC)促排卵治疗。采用多巴胺受体激动剂治疗后的HPRL妇女,90%以上血清催乳素水平可降至正常并恢复排卵。若血清催乳素水平下降而排卵仍未恢复者,可联合诱发排卵药物(如CC)促排卵。CC为非甾体类抗雌激素药物,其结构与雌激素相似,具有抗雌激素和微弱雌激素的双重活性。通过抑制内源性雌激素对下丘脑的负反馈作用,间接促进下丘脑GnRH的释放,刺激垂体促性腺激素(gonadotropin,Gn)的分泌,刺激卵巢,促进卵泡的发育。CC还具有微弱的雌激素作用,可直接作用于垂体和卵巢,提高其敏感性和反应性,并促进卵巢性激素合成系统的活性,增加性激素的合成和分泌,促进雌二醇的正反馈效应。由于排卵前出现的雌二醇峰对下丘脑-垂体-卵巢轴(HPOA)起正反馈效应,激发垂体LH峰而促进排卵。CC用于促排卵只适用于下丘脑和垂体有一定功能的患者,而对垂体大腺瘤患者或手术破坏垂体组织较严重、垂体功能受损时,CC促排卵无效。
2.Gn促排卵:
对CC促排卵无效或垂体瘤术后垂体组织遭破坏、功能受损而导致低Gn性闭经的患者,可用外源性Gn促排卵。Gn分为人垂体Gn和人绒毛膜Gn(human chorionic gonadotropin,hCG)。人垂体Gn又分为FSH和LH。垂体肿瘤术后低Gn者应以人绝经后尿促性腺激素(hMG,每支含75U的FSH及75U的LH)促排卵治疗为宜,促进卵泡发育、成熟,并用hCG诱发排卵。由于卵巢对Gn的敏感性存在个体差异,故应以低剂量hMG开始,一般可从hMG 75U,每日1次开始,连续使用5~7d,然后行超声监测卵泡发育,如果无明显卵泡发育,每隔5~7d增加hMG用量75U。切忌过快增加Gn用量,以防严重的卵巢过度刺激综合征(ovarian hyperstimulation syndrome,OHSS)发生。当最大卵泡直径达18mm时,注射hCG。
六、男性HPRL不育的治疗
男性HPRL经药物治疗血清催乳素水平降至正常后,下丘脑-垂体-性腺轴的功能异常一般可以恢复,勃起功能障碍和性欲低下症状明显改善,生精能力也逐渐恢复。但有部分患者因垂体腺瘤压迫,导致Gn细胞功能障碍,在血清催乳素水平下降后睾酮水平仍不能恢复正常,故应该同时进行雄激素补充治疗,以恢复和保持男性第二性征或用Gn治疗恢复生育功能;也可用多巴胺受体拮抗剂,如酚噻嗪类、丁酰苯类等神经精神科药和甲氧氯普胺、多潘立酮、舒必利等。
[1]Biller BM,Luciano A,Crosignani PG,et al. Guidelines for the diagnosis and treatment of hyperprolactinemia. J Reprod Med,1999,44:1075-1084.
[2]Biller BMK,Daniels CH. Neuroendocrine regulation and diseases of the anterior pituitary and hypothalamus//Harrison’s Principles of Internal Medicine. 14th ed. New York:McCraw Hill,1998:1972-1999.
[3]Bohnet HC,Dahlen HC,Wuttke W,et al. Hyperprolactinemic anovulatory syndrome. J Clin Endocrinol Metab,1976,42:132-143.
[4]Casanueva FF,Molitch ME,Schlechte JA,et al. Guidelines of the Pituitary Society for the diagnosis and management of prolactinomas. Clin Endocrinol(Oxf),2006,65:265-273.
[5]Franks S,Murray MA,Jequier AM,et al. Incidence and signifcance of hyperprolactinaemia in women with amenorrhea. Clin Endocrinol(Oxf),1975,4:597-607.
[6]Creer ME,Moraczewski T,Rakoff JS. Prevalence of hyperprolactinemia in anovulatory women. Obstet Cynecol,1980,56:65-69.
[7]Jacobs HS,Hull MC,Murray MA,et al. Therapy-orientated diagnosis of secondary amenorrhoea. Horm Res,1975,6:268-287.
[8]Josimovich JB,Lavenhar MA,Devanesan MM,et al. Heterogeneous distribution of serum prolactin values in apparently healthy young women,and the effects of oral contraceptive medication. Fertil Steril,1987,47:785-791.
[9]Kredentser JV,Hoskins CF,Scott JZ. Hyperprolactinemia:a significant factor in female infertility. Am J Obstet Gynecol,1981,139:264-267.
[10]Luciano AA. Clinical presentation of hyperprolactinemia. J Reprod Med,1999,44:1085-1090.
[11]Mah PM,Webster J. Hyperprolactinemia:etiology,diagnosis,and management. Semin Reprod Med,2002,20:365-374.
[12]Morton AS. Atlas of Clinical Cynecology. Noman Lavin:Wilkins Inc,2002:201-203.
[13]Serri O,Chick CL,Ur E,et al. Diagnosis and management of hyperprolactinemia. CMAJ,2003,169:575-581.
[14]Schlechte J,Sherman B,Halmi N,et al. Prolactin-secreting pituitary tumors in amenorrheic women:a comprehensive study. Endocr Rev,1980,1:295-308.