 去看看
去看看


一、检查目的
1.判断乳腺有无病变。
2.判断病变的物理性质,即囊性、实性、囊实复合性。
3.评估乳腺引流区淋巴结。
4.根据病变的超声图像特征和检查者经验,推测病变的恶性风险,给出BI-RADS评估分类。有经验者,可推测病变的临床诊断或病理诊断。
二、超声在乳腺影像学中的地位和价值
1.在我国,由于乳腺实质的差异(相对于欧美女性,体积较小,较致密)以及经济条件的限制,乳腺X线和乳腺超声成为目前国内乳腺筛查的主要方法。
2.乳腺超声检查无痛苦,对受检者无放射性损害,可以短期多次反复进行,适用于任何年龄和女性任何生理时期,包括妊娠期和哺乳期。
3.超声检查对于肿块的物理性质(囊、实性)判定较为准确;对X线显示困难的致密型乳腺,超声有助于肿块的检出。但超声对微小钙化灶、增生腺体内的微小肿块可能显示不清楚,对特殊型乳腺癌的诊断有一定困难。
三、适应证
(一)出现乳腺相关症状和体征
1.诊断和定位乳腺肿块。
2.评估特殊症状 如扪诊有异常,局部或整个乳房疼痛,乳头溢液(超声应该重点检查乳头、乳头深面和乳头周围)。建议结合乳腺X 线摄影、乳腺导管造影甚至MRI。
3.30岁以上的女性,对乳腺可触及肿块的首次评估,常规选择X线乳腺摄影和超声检查两种技术联合评估。
(二)其他辅助检查发现乳腺异常或诊断困难
1.乳腺X线摄影或其他乳腺影像检查方法(如MRI、核医学、胸部CT)发现的异常或肿块。
2.乳腺X线摄影诊断不清的致密乳腺、结构扭曲、难以显示的乳腺肿块。
(三)乳腺病变的随访
1.随访以前超声检查发现的乳腺病变,观察肿块稳定性和周期性变化。
2.乳腺癌新辅助化疗中,随访评估肿瘤大小、血供、引流淋巴结等变化。
(四)乳腺外科术前、术后评估
1.术前评估 术前评估病变的位置、大小、数目和引流区淋巴结情况。根据病变的声像图特征进行BIRADS评估分类,4类和5类建议穿刺活检。
2.术后评估 术后早期可了解局部血肿、积液、水肿等情况;乳腺癌术后定期随访可了解有无局部复发和淋巴结转移等。
(五)乳腺植入假体后的评估
假体囊是否完整、有无变形或破裂等。
(六)超声引导下介入诊断和(或)治疗
1.超声引导下穿刺组织学检查。
2.扪诊阴性的乳腺肿块术前体表定位或超声引导下乳腺导丝置入定位。
3.为各种介入操作提供可视化引导:如囊性病变的抽吸(术后积液、囊肿、脓肿等)、经皮肿瘤消融术或微创旋切术等。
(七)常规体检
1.一般人群
2.特殊人群
如妊娠妇女,中老年女性,绝经后激素替代治疗的妇女。
3.乳腺癌高危人群
乳腺癌家族史,乳腺癌个人史,以前活检显示高风险病变,遗传易感等。
四、禁忌证和局限性
无绝对检查禁忌证。超声对不均匀背景的腺体内局限性脂肪的判断、对非肿块内的微钙化有时难以判断,通常需要联合乳腺X线摄影检查。
五、检查前准备
1.一般无需特殊准备。
2.检查前了解近期有无乳腺导管造影、穿刺活检等,以免因造影剂或出血的干扰而影响诊断。
3.检查乳腺癌患者是否发生腹、盆腔转移时,需要检查前空腹和充盈膀胱。
4.介入前准备:签署知情同意书,检查凝血功能和血常规。
六、检查技术
(一)仪器和探头
1.仪器
一般选用中、高档彩色多普勒超声检查仪。
2.探头
常规采用中心频率≥7.5MHz的线阵高频探头。若病变位置表浅,且有更高频率线阵探头可选用。对于深部较大的肿块、有植入硅胶填充物等可采用中低频率的探头。
(二)设置检查部位
选择仪器预设置,设置为乳腺。
(三)患者体位
1.嘱患者充分暴露双侧乳腺和腋窝。
2.患者常规取仰卧位,双侧手臂上举,自然置于头部上方或两侧。这种姿势使乳腺组织贴紧胸壁,可减少病灶的滑动,减少乳腺下垂和褶皱对检查的影响。检查乳腺外侧时,可采用为面向对侧的半侧卧位。
3.乳房较大或乳房下垂明显时,检查者可用手向上托起乳腺以免漏扫。
4.如果肿块只有在特殊体位才能触及,可采用特殊体位,如直立位或半直立位。
5.有时为了与乳腺X线摄影结果相对照,超声检查可采取与乳腺X线摄影相似的体位。
(四)扫查方法
1.乳腺扫查方法
(1)旋转(放射状)扫查法:
以乳头为中心由内向外(或由外向内)、探头沿导管长轴方向置放,顺时针或逆时针方向扫查,从内向外移动探头,各扫查断面相互覆盖,不要遗漏。因为乳腺导管和腺叶是以乳头为中心呈放射状排列,放射状扫查可以较好地显示导管和腺叶的结构。
(2)反放射状扫查法:
反辐射状扫查时,探头从乳房边缘向乳头方向沿导管垂直的方向扫查,按顺时针或逆时针方向移动探头,完成360°检查。
(3)纵向扫查法和横向扫查法:
纵向扫查法,探头从腋前线乳腺外侧缘(含尾部)向胸骨旁方向或从胸骨旁向腋前线乳腺外侧缘方向,从上至下连续地沿乳腺依次纵向扫查。横向扫查法,探头从内向外或从外向内方向,从乳腺上缘至乳腺下缘,沿乳腺连续地依次横向扫查。
(4)乳头根部斜切扫查法:
将探头置于乳头旁,使声束斜切向乳头根部后方,以清晰显示乳头深面结构。针对乳头溢液特别是乳头溢血的患者,应特别留意乳头深面及周围导管,判断有无导管扩张、管壁增厚和内壁不光滑、导管内异常回声等。
上述乳腺的扫查方法中,ACR BI-RADS指南推荐旋转(放射状)扫查法和乳头根部的斜切扫查法,该方法能较好地观察乳腺导管管长轴、肿块的形态和对周围组织的压迫、浸润情况。
2.腋窝扫查方法
沿腋动脉和腋静脉的长轴和短轴多断面检查。判断腋窝淋巴结有无肿大,回声有无异常,有无副乳腺或其他占位病变等。
3.扫查范围
双侧全乳腺扫查,怀疑乳腺癌时应检查腋窝。
4.扫查内容
(1)乳腺导管系统形态结构,导管是否扩张。
(2)乳腺腺体内是否有局限性病变,单发还是多发,特别当触诊或乳腺X线摄影发现有肿块或有密集微小钙化时更应仔细检查是否存在局限性病变。
(3)肿块的灰阶超声表现:如位置、大小、纵横比、内部回声、是否有微小钙化灶,边缘是否清楚,形态是否规则,后方回声增强或衰减等。
(4)肿块的血流情况:肿块内部及周边是否有血流信号,血流是否粗大不规则,必要时可测量动脉的流速和阻力指数RI等。
(5)乳腺淋巴引流区是否有肿大淋巴结,或其他病变。
(6)库柏韧带结构和走行、浅筋膜的连续性是否有改变。
5.扫查时注意事项
(1)扫查速度不能太快,扫查时各扫查断面相互覆盖,不要有遗漏区域。问诊和触诊,并结合其他影像资料,减少漏诊。
(2)探头轻放于皮肤表面,不宜加压,以免改变肿块形态、位置等,特别在检查肿块内血流时,加压会使小血管难以显示。
(3)乳腺结构的不均匀性和腺体内脂肪可能会干扰对病变的识别。腺体内局灶性脂肪可形成似肿块的表现,应仔细加以甄别。局灶性脂肪与皮下脂肪回声一致,加压探头时脂肪有明显变形有助于鉴别。
(4)观察肿块时,应注意浅筋膜浅层和深层是否连续、Cooper韧带和胸壁结构是否受累。
(5)注意皮肤和皮下脂肪层的局灶性病变与乳腺肿块的鉴别。乳腺癌可能浸润胸壁,而胸壁局灶性病变临床上可能误判为乳腺肿瘤,因此乳腺后方的胸壁结构应该常规观察。
(五)检查时仪器调节
1.调节总增益和TGC(DGC)
总增益和TGC(TGC时间增益补偿,DGC深度增益补偿)调节以图像清晰、解剖层次分明为标准。TGC(DGC)的调节按深度逐渐补偿。以近场和远场清楚显示解剖结构,图像增益平滑过渡为标准。TGC远场增益过低将导致远场图像太暗,过高将导致远场图像太亮,均不利于乳腺结构和病变的显示。
2.调节检查深度
检查深度调节以图像远场能够清楚显示乳腺和胸壁结构为标准。通常远场深度调节到显示胸膜为佳。当患者乳腺和胸壁较薄时,可降低检查深度,放大乳腺超声图像,避免图像中场和远场有太多的肺部气体图像。检查多发病变或肿块体积较大时,推荐使用梯形成像、宽景成像技术或者双幅图像拼接。
3.聚焦点位置
聚焦点或聚焦带常规置于腺体对应的深度,发现病变应及时调节到病变所在的深度。多个病灶时,随检查病灶的深度进行适当的位置调节。
4.局部放大
对于较小病变,可选择局部放大功能以观察病变及周边的细节。
5.彩色多普勒血流显像
发现病变时启用彩色多普勒功能键,确定感兴趣区域(ROI),调节彩色多普勒取样框的大小和位置,观察病变血流。彩色多普勒取样框的大小通常为病变大小的两倍,病变置于彩色多普勒取样框的中央,病变及周边的血流能够充分显示。速度量程(scale)通常选择仪器的最低流速,根据所测量血流适当调节。使用低滤波,适当提高彩色多普勒增益,以不出现杂波彩色信号为标准。
6.脉冲多普勒测量
当病变有明显的血流信号,特别是不能排除乳腺癌时需要启用脉冲多普勒功能键测量血流速度和阻力指数(RI)。尽可能减小声束与血流方向的夹角(小于60°),取样门尽可能小(通常为0.5~1.0mm)。
(六)测量方法
1.肿块大小的测量
肿块大小的测量方法首先测量肿块最长径,再测量与之垂直断面的两个径线。在测量肿块大小时,如果低回声肿块边缘有强回声晕环征(强回声晕环征代表肿瘤对周围组织的浸润),其径线测量应包括肿块周边强回声的不规则外缘(图5-1)。
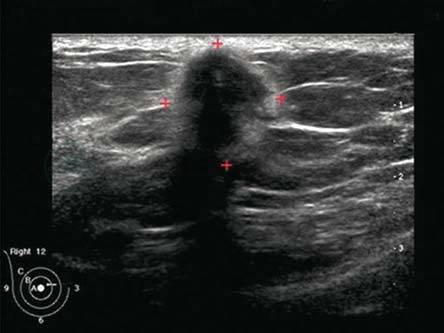
图5-1 肿块边缘有强回声晕环征时,其径线测量应包括肿块周边强回声的不规则外缘
2.导管管径的测量
导管扩张时测量导管管径,导管长轴断面垂直于管壁测量外径。
(七)图像记录
乳腺超声检查报告至少存储两张图像(左、右侧乳腺各一张,建议采用外上象限),有异常时显示病变的主要特征,增加图像存储。
(八)病变的定位
1.时钟表盘式定位法
乳腺病变的定位常用时钟表盘式定位法。发现病变,应明确标明位于左侧或右侧乳腺,注明病变位于几点钟、距离乳头的距离。此方法定位精确,最为常用,便于病变活检、手术介入、临床随访和影像对比。
2.象限定位法
对于较大肿块,可采用象限定位法。以乳头为中心,经过乳头的水平线和垂直线将乳腺分为四个象限,即外上象限、外下象限、内上象限和内下象限,乳头和乳晕所在区域为中央区。
3.解剖层次定位
病变定位应包括解剖层次定位。乳腺病变大多数来自腺体层,少数来自皮肤、皮下脂肪或胸壁,应明确注明病变的解剖层次。
七、正常乳腺超声表现
由浅至深,正常乳腺的声像图由皮肤、皮下脂肪层、腺体层组成,乳腺后方为乳腺后间隙和胸壁结构(图5-2)。乳腺随年龄和生理状态的变化主要表现在脂肪和腺体的变化,通常,随着年龄增加,腺体内终末导管和腺泡萎缩,腺体变薄,回声增高,皮下脂肪和乳腺后间隙脂肪相对增多。
1.皮肤
皮肤表现为一条平直带状稍强回声,厚度小于2mm(厚度>2mm定义为皮肤增厚,在乳晕周围区域和乳房下皱襞,正常的皮肤厚度可达4mm)。乳头大小因年龄、发育及经产情况而异。年轻、乳房发育良好及未生育者,乳头较小,哺乳后乳头增大,色素加深。
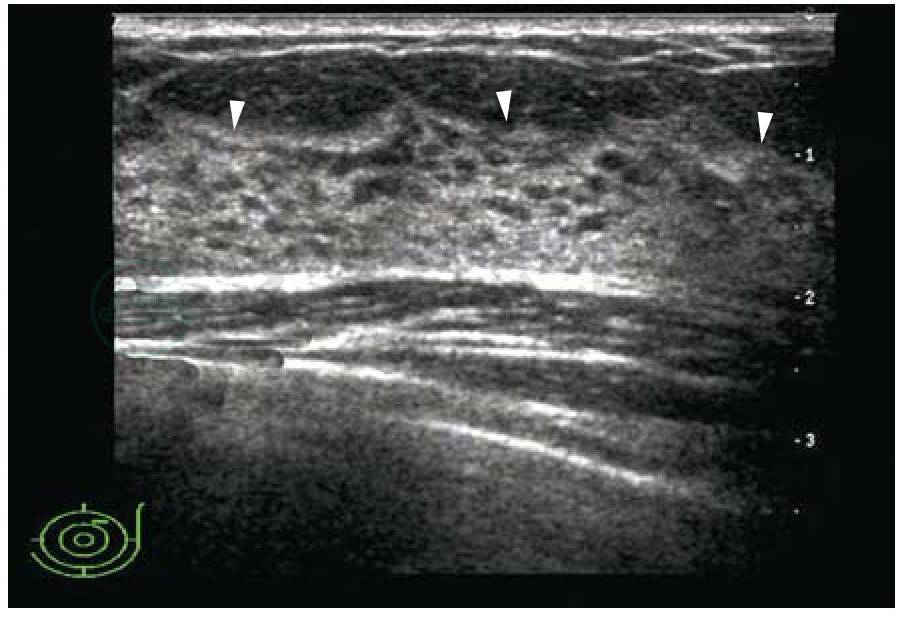
图5-2 正常乳腺的声像图
由浅入深分别是皮肤、皮下脂肪层、腺体层和胸壁肌层等,箭头示浅筋膜浅层
2.皮下脂肪层
介于皮肤和腺体层之间,除乳头外,腺体层均被脂肪组织覆盖。皮下脂肪厚薄因年龄和肥胖程度差异较大。皮下脂肪呈较低回声,穿行于其间的线状高回声为库柏(Cooper)韧带,一端连于皮肤和浅筋膜浅层,一端连于浅筋膜深层,牵拉乳腺小叶,使腺体表面在韧带附着处不平整略呈波浪形。库柏韧带将皮下脂肪分隔为结节样低回声结构,检查时需注意观察,勿误认为肿瘤。库柏韧带通常在老年女性容易显示(图5-3),青春期由于皮下脂肪菲薄而不易显示。皮下脂肪可呈条状或团状伸入腺体内,腺体内可以存在局灶性脂肪团,需要注意与瘤样病变鉴别。加压探头,脂肪容易受压变形,可作为重要的鉴别方法。
3.腺体层
腺体层由腺叶与间质组成,乳腺以脂肪回声为等回声,终末导管和腺泡,即终末导管小叶单元(terminal ductolobular unit,TDLU)为等回声或稍低回声,导管在腺叶内呈纤细单线或双线样稍高回声,腺叶之间的间质为较高回声。腺体层回声与年龄和哺乳史密切相关。乳腺导管缺乏公认的正常值标准,临床观察和大多数学者认为正常乳腺导管小于2mm。
青春期未生育女性腺体主要是导管系统的发育,中央区回声较低(图5-4A),扪诊质地稍硬,周围腺体呈高低相间的斑纹征(图5-4B)。静止期乳腺(图5-5)声像图差异较大,与年龄、是否生育、体型等相关,大多数呈高低相间的斑纹征。妊娠期TDLU充分发育,间质变薄,腺泡的充分发育导致腺体增厚(图5-6),哺乳期腺腔进一步扩大,充满乳汁,乳腺导管扩张,管壁薄而光滑,管腔内为无回声,显示清楚(图5-7)。乳腺血管增多、增粗,血流速度加快。哺乳期后TDLU退化萎缩。绝经后,TDLU进一步萎缩退化,腺体层逐渐变薄,回声增强,脂肪回声逐渐增多(图5-3)。依据乳腺导管系统和间质的比值、脂肪的多少,正常乳腺分为背景回声均匀腺体型、背景回声均匀脂肪型和背景回声不均匀三型。
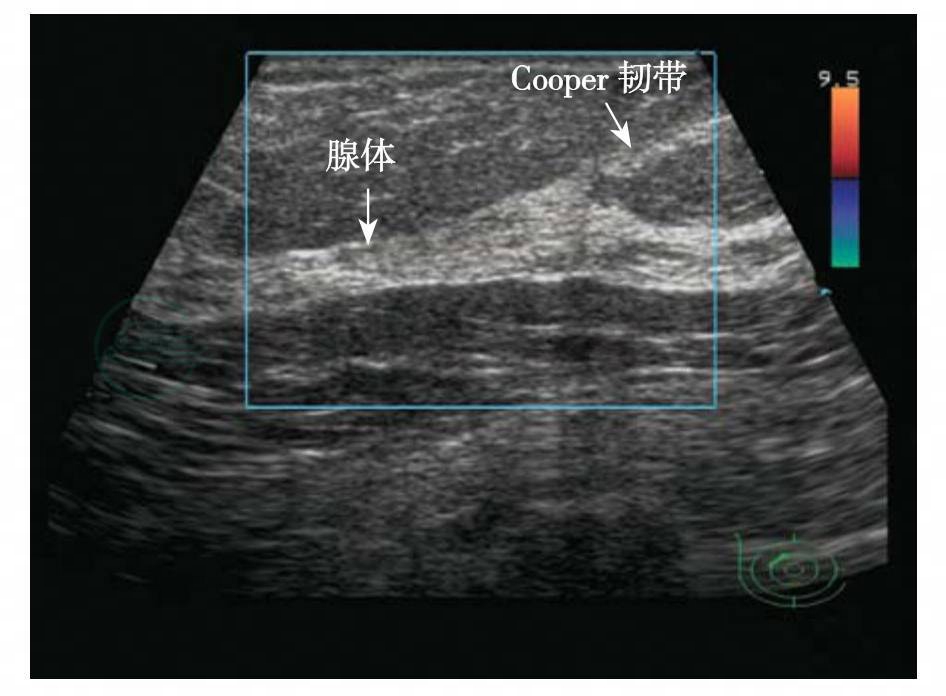
图5-3 库柏韧带
库柏韧带表现为穿行于皮下脂肪层的线状强回声,连接皮肤和浅筋膜浅层表现为穿行于皮下脂肪层的线状强回声,连接皮肤和浅筋膜浅层
4.乳腺后间隙
位于浅筋膜深层与胸壁肌层之间,以脂肪为主。大多数年轻女性的乳腺后间隙菲薄,老年女性尤其是脂肪较厚者的乳腺后间隙境界清楚。
5.胸壁
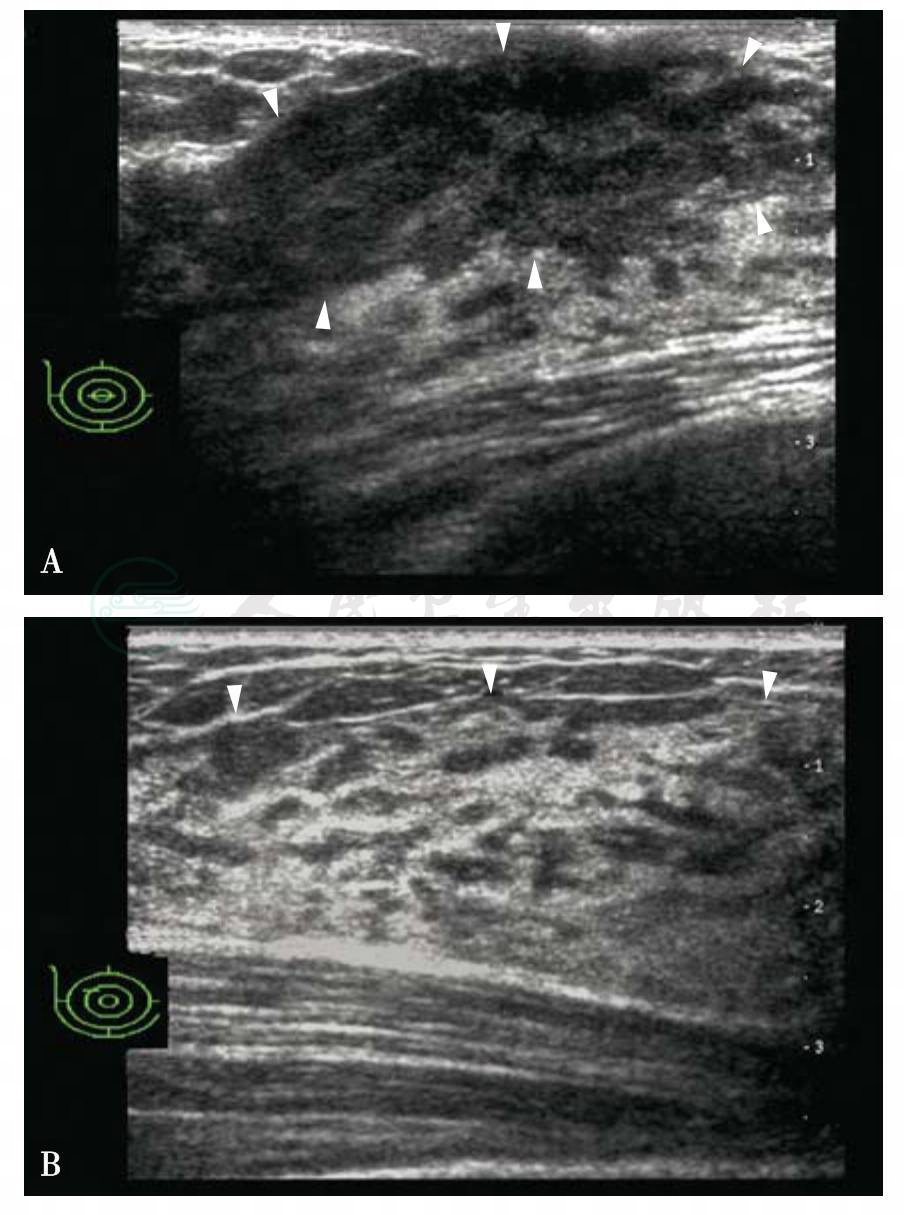
图5-4 青春期乳腺
A.中央区回声减低;B.周围腺体层表现为高低回声相间的斑纹征
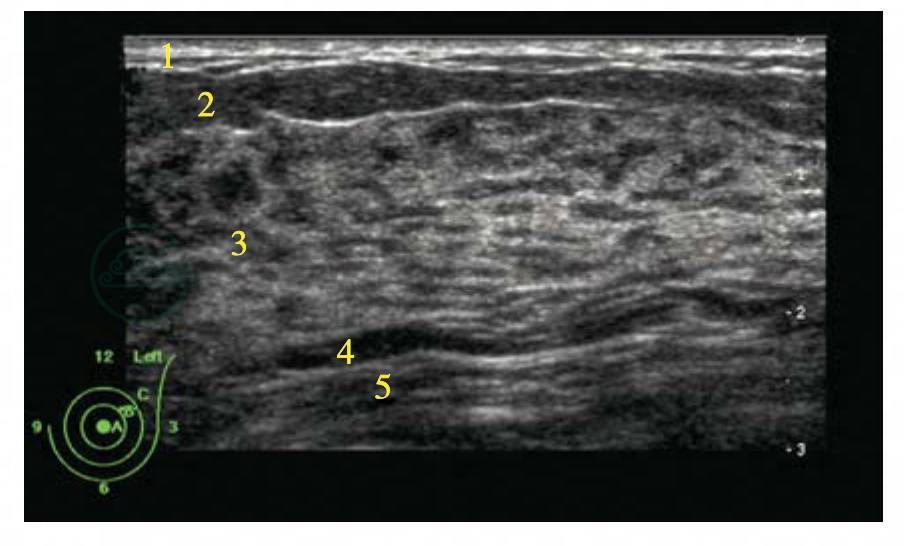
图5-5 静止期乳腺
腺体呈高低回声相间的斑纹征
胸壁肌层显示与解剖结构一致的肌纤维纹理,排列整齐。超声图像可清楚显示胸大肌、胸小肌以及肋间肌,肌筋膜为线状稍高回声,连续光滑,肌纤维呈相对稍低回声。肋骨长轴表现为带状强回声伴后方回声衰减,肋骨短轴表现为弧形强回声伴后方回声衰减(声影),胸膜壁层和脏层表现为肋骨和胸壁肌层深面的带状强回声(图5-8)。肋软骨短轴表现为近球形或椭圆形低回声,肋软骨边界清楚,形态规则,肋软骨后方回声衰减(图5-9)。肋软骨骨化表现为低回声肋软骨中央斑片状高回声(图5-10)。肋软骨短轴断面与乳腺纤维腺瘤的声像图特征类似,切勿误诊为肿瘤。关注解剖层次和后方回声是鉴别肋软骨和乳腺纤维腺瘤的关键(图5-8)。
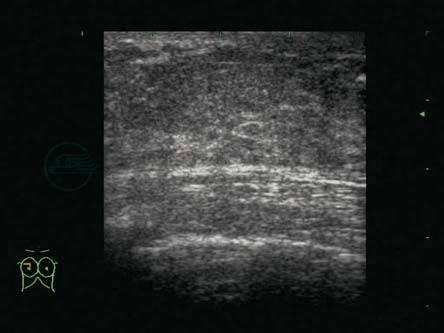
图5-6 妊娠期乳腺
TDLU充分发育,腺体层增厚,但腺叶之间的间质强回声变薄

图5-7 哺乳期乳腺
导管扩张,管腔内呈无回声,管壁光滑,间质强回声变薄
6.区域淋巴结
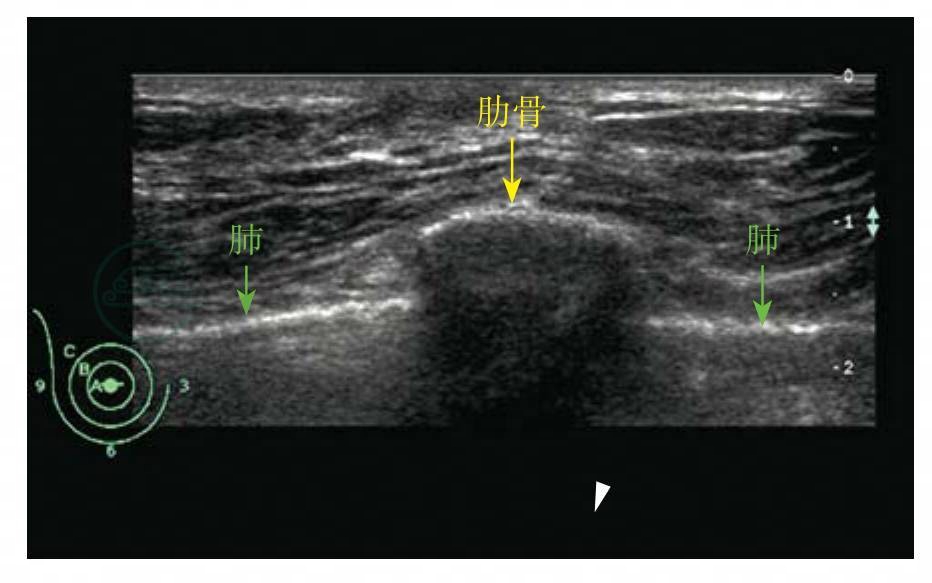
图5-8 肋骨短轴声像图
表现为弧形带状强回声(黄箭)伴后方声影,胸膜表现为肋骨和胸壁肌层深面的带状强回声(绿箭)
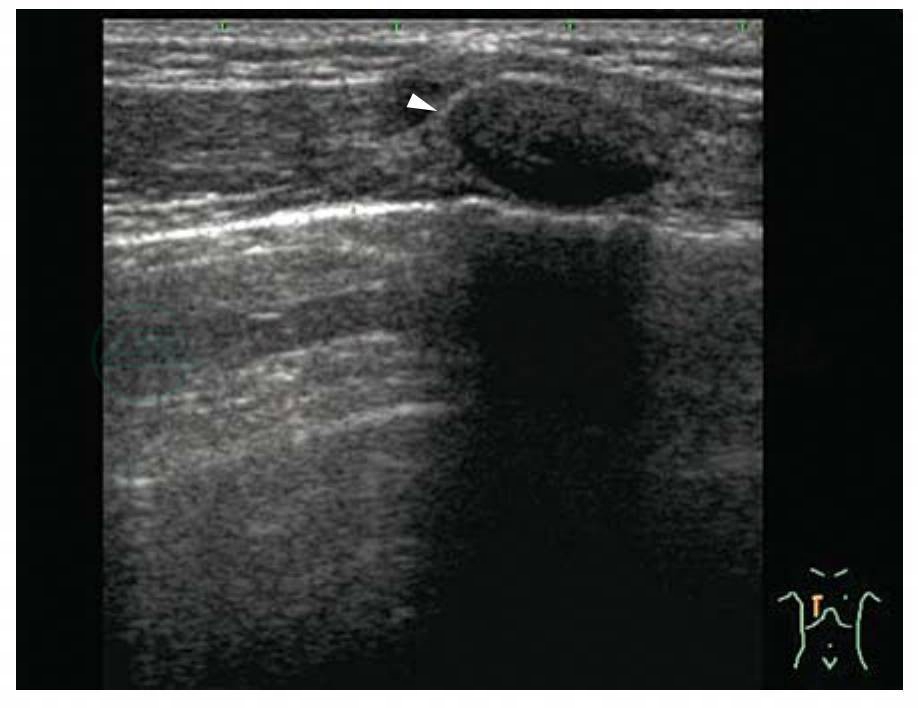
图5-9 肋软骨短轴声像图
表现为近球形或椭圆形低回声(白箭头)伴后方声影
正常腋窝淋巴结纵断面(图5-11)类似卵圆形或蚕豆形,长径与短径的比值大于2,淋巴门结构表现为中心稍高回声,与周围脂肪纤维结缔组织的回声相似,皮质表现为淋巴门周围、位于被膜下的薄层低回声,显示或不显示淋巴门血流。胸骨旁淋巴结、胸肌间淋巴结通常不显示。
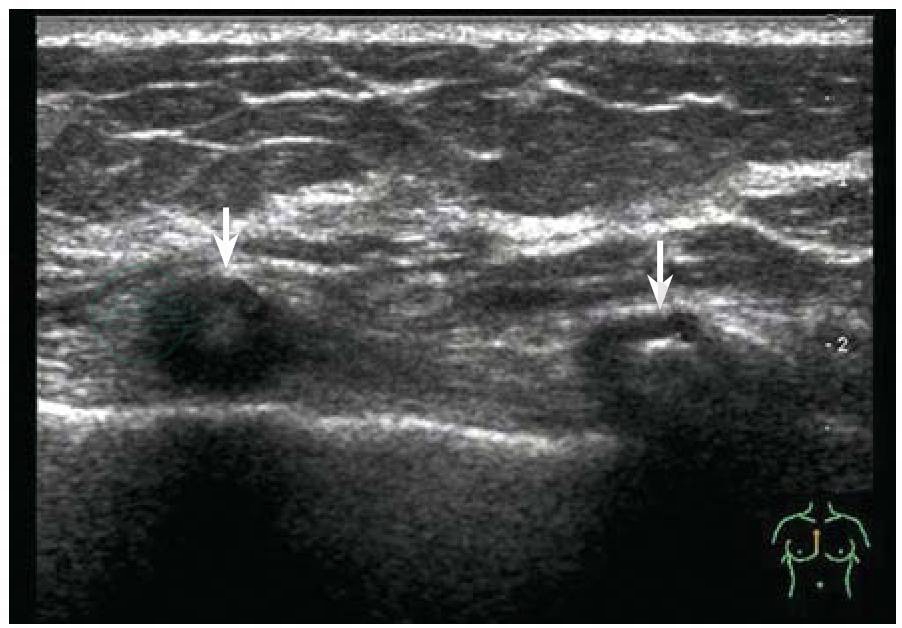
图5-10 肋软骨骨化
表现为低回声肋骨(白箭)内出现的斑片状高回声
图5-11 腋窝正常淋巴结
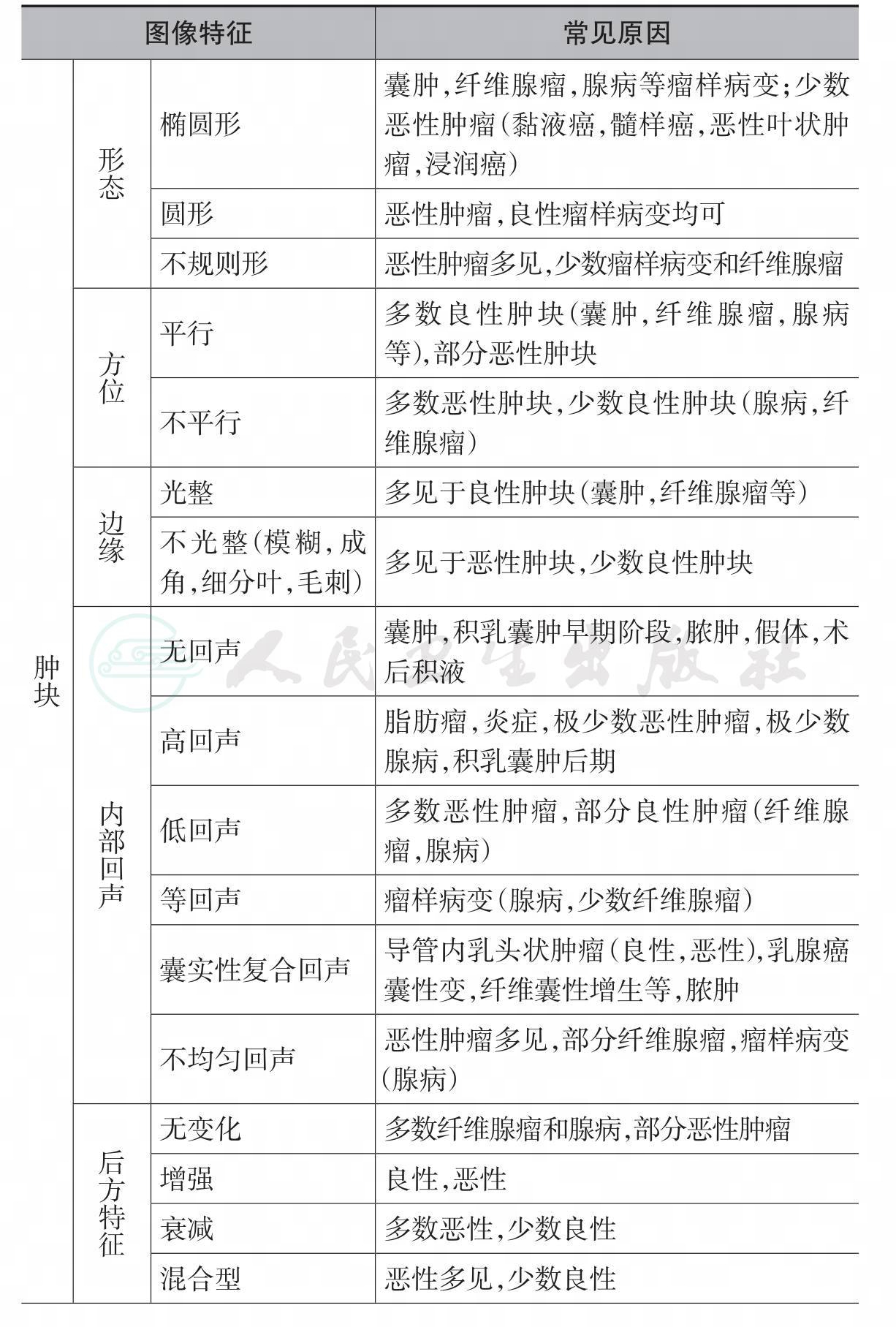
八、乳腺超声的评估指标(肿块的图像特征)
在两个不同的断面均可显示的占位病变称为肿块表5-1。触诊阳性的乳腺肿块在各年龄组妇女中的分布不同:在12~35岁的妇女中,乳腺纤维腺瘤最常见;在35~45岁的妇女中,乳腺囊肿最常见,其次是腺病;在55岁以上的妇女中,最常见的乳腺肿块是乳腺癌。在中国,乳腺癌有年轻化趋势。
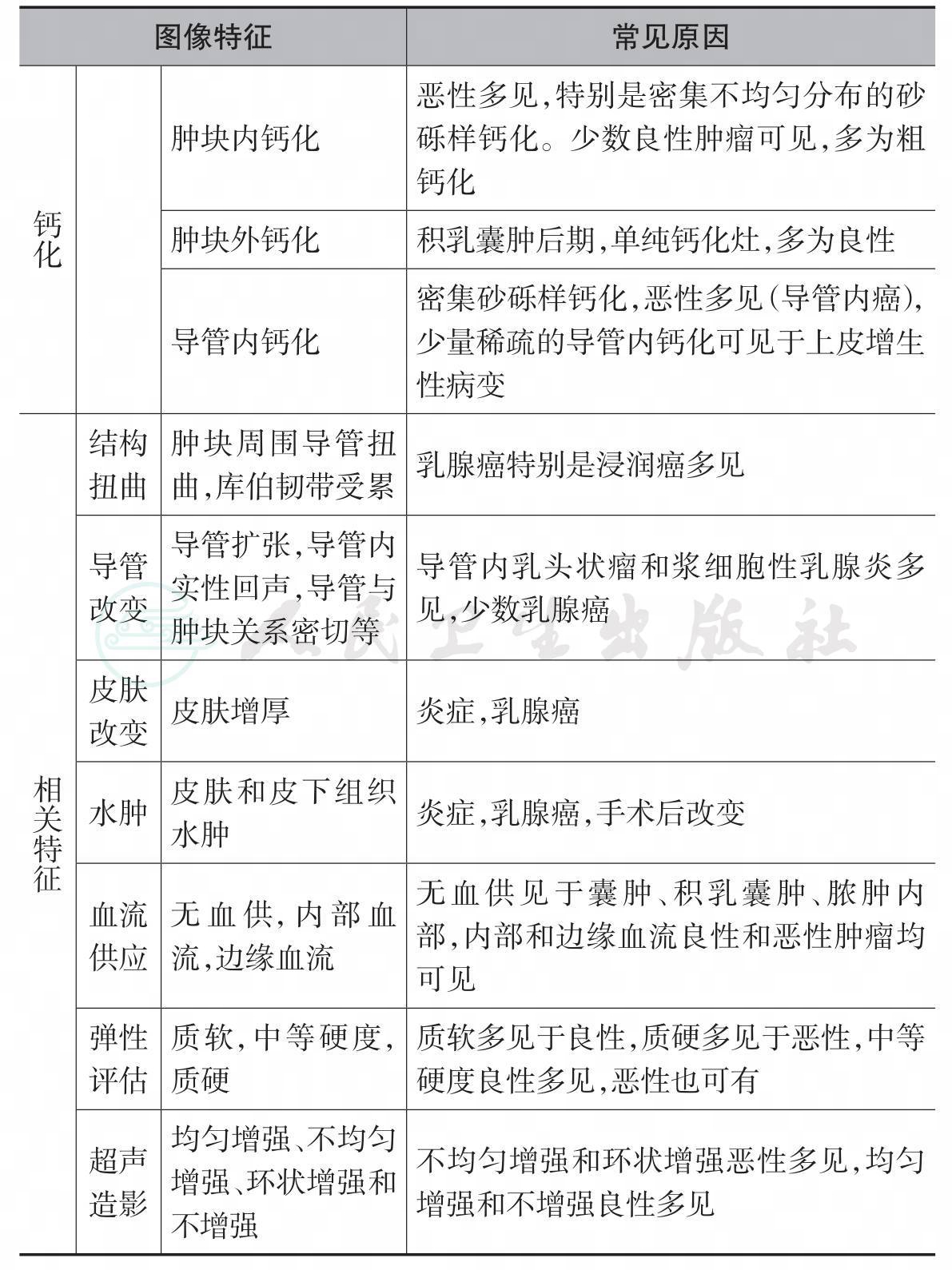
表5-1 乳腺肿块的超声评估指标(图像特征)及常见原因
续表
九、乳腺常见疾病超声评估
(一)乳腺良性肿瘤和瘤样病变
乳腺常见的良性肿瘤和瘤样病变包括纤维腺瘤、叶状肿瘤、瘤样病变、导管内乳头状病变等。2012年世界卫生组织WHO乳腺肿瘤分类将导管内乳头状肿瘤命名为导管内乳头状病变,包括了导管内乳头状瘤、导管内乳头状癌、囊内乳头状癌和实性乳头状癌。本书对该类病变不做讨论。
1.超声诊断要点
(1)纤维腺瘤:纤维腺瘤因为肿块内上皮和纤维间质的成分不同,导致肿块回声和均匀程度差异较大。典型的纤维腺瘤超声表现为肿块呈卵圆形,方位平行,边缘光整,等回声或低回声,后方特征无变化或增强,有侧壁声影(图5-12)。少数纤维腺瘤肿块内可出现钙化,多为粗钙化。较小的肿块内多数无血流信号或少量血流信号,肿块较大时可有较丰富的血流信号。通常不伴有腋窝淋巴结肿大。肿块大于5cm时称为巨纤维腺瘤,多见于青春期女性,宽景成像可显示肿块的全貌(图5-13)。随着超声仪器图像质量的改善和对低速血流敏感性的提高,临床触诊阴性的乳腺肿块越来越多地被超声检出,纤维腺瘤内检出血流信号的比例也明显地增加。
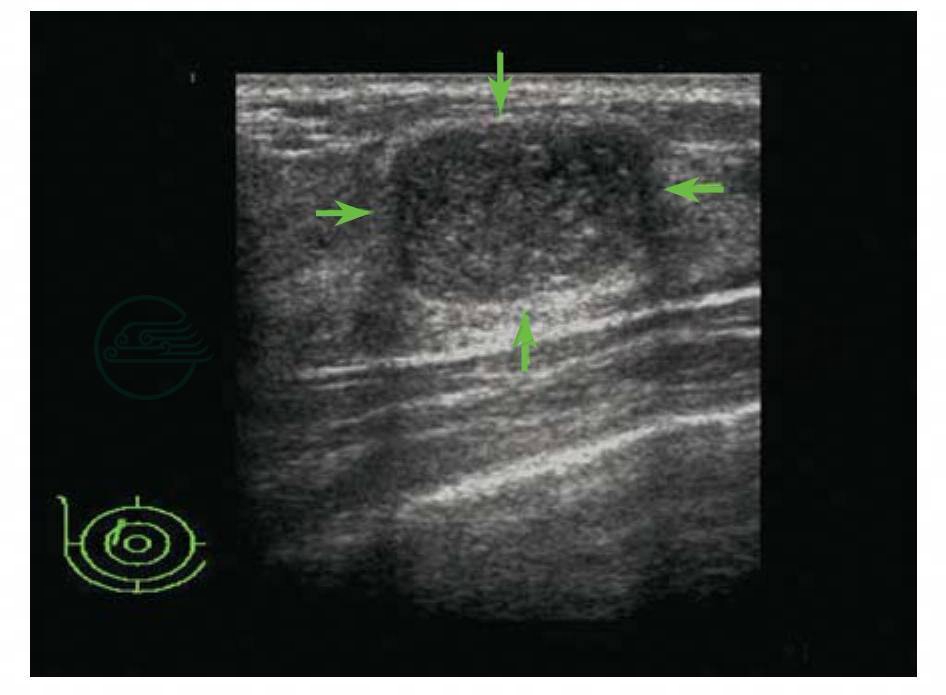
图5-12 乳腺纤维腺瘤
超声图像表现为卵圆形,边缘光整,稍低回声,后方特征增强,有侧壁声影。BI-RADS分类:3。病理:纤维腺瘤
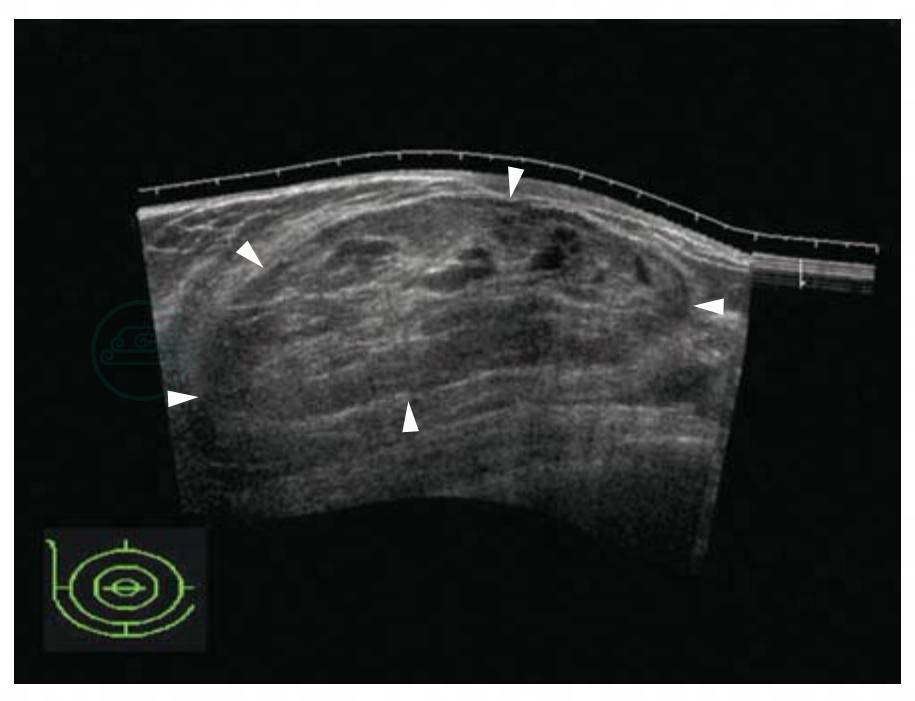
图5-13 乳腺纤维腺瘤超声宽景成像
显示肿块全貌,椭圆形,方位平行,边缘光整,中等回声,后方无变化。BI-RADS分类:3。病理诊断:纤维腺瘤
(2)叶状肿瘤叶状肿瘤包括良性、交界性和恶性。典型的良性叶状肿瘤超声表现为低回声肿块,卵圆形,边缘光整,内部回声均匀,后方回声增强,侧壁声影,肿块无血流信号或有血流信号,肿块体积不大时形态学特征与纤维腺瘤相似,两者不容易鉴别。大多数叶状肿瘤体积较大时呈浅分叶状(图5-14)。通常腋窝淋巴结无肿大。按照NCCN指南,所有>3cm的乳腺肿瘤,无论声像学表现如何,临床处理都应该穿刺活检或直接切除。因为超声无法判断其良恶性。所以,分类BIRADS 4较合适。恶性叶状肿瘤早期阶段具有膨胀性生长的特性,肿块不大时,与纤维腺瘤的特征相似,容易误诊为良性肿瘤。肿块进行性长大,容易出现裂隙状无回声和肿块内血流,这是恶性叶状肿瘤的特征(图5-15)。
(3)乳腺瘤样病变:乳腺瘤样病变指非肿瘤、非炎症性的一类疾病,是指以乳腺小叶腺泡增生为特征的一组疾病,包括乳腺良性上皮增生和纤维囊性增生等,在女性乳腺十分常见,包括了病因和临床经过均不相同的多种病变。病理类型有硬化性腺病、大汗腺腺病、微腺性腺病、放射状瘢痕等。腺病早期,表现为乳腺终末导管小叶数目增多或小叶内腺泡数目增多,小叶结构无显著改变。腺病晚期,间质纤维增生显著,同时有小叶内腺泡数目增多,没有囊肿结构,称硬化性腺病,增生的腺管呈小囊腔状、裂隙状或内腔不明显的条索状,病变呈分叶状,肌上皮细胞不明显,与浸润性癌极难鉴别。乳腺瘤样病变超声图像表现大致可归纳为以下几种表现:
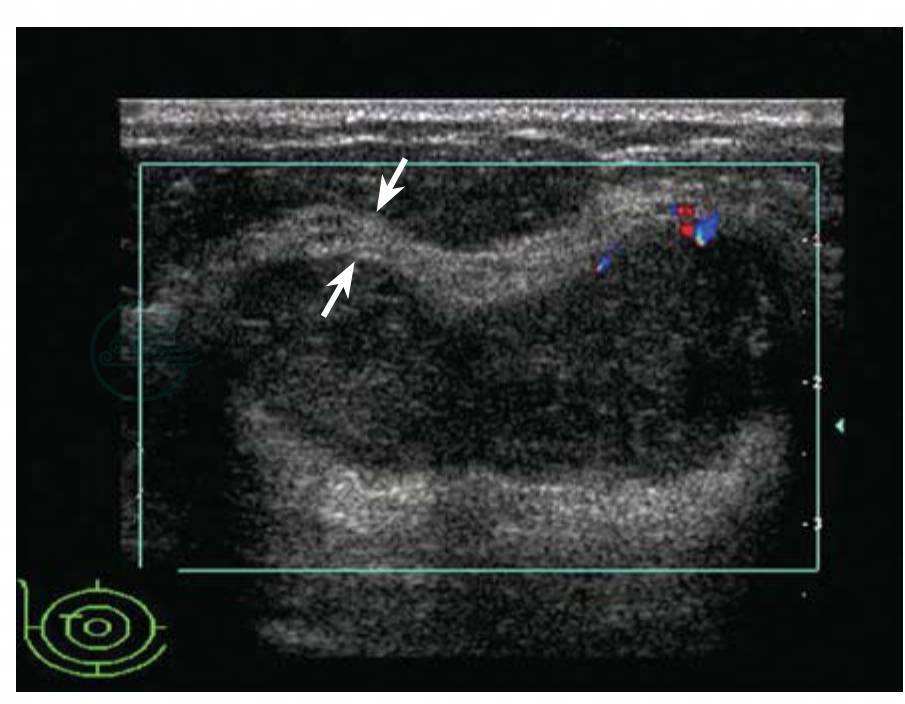
图5-14 乳腺良性叶状肿瘤
女性,39岁。右乳10点钟距乳头2cm处腺体层查见一个肿块,大小40mm×35mm×17mm,椭圆形,浅分叶,边缘光整,低回声,回声均匀,后方增强,肿块边缘有少量血流信号。BI-RADS分类:4a。病理:良性叶状肿瘤
1)肿块:肿块多数呈等回声或低回声(图5-16),大小不等,单个或多个,多数体积不大,小于20mm。椭圆形、圆形、不规则形,边缘光整,无包膜回声,无血流信号或少血流信号,腋窝淋巴结无肿大。硬化性腺病部分表现为肿块形态不规则,边缘模糊,低回声,容易误诊为乳腺癌(图5-17)。腺病形成的肿块(瘤样病变)多数被影像学评估分类为BI-RADS 3类,少数不规则的腺病和硬化性腺病容易误诊为乳腺癌,评估分类为BI-RADS4类甚至5类,腺病是4类活检中病理为良性的主要疾病。
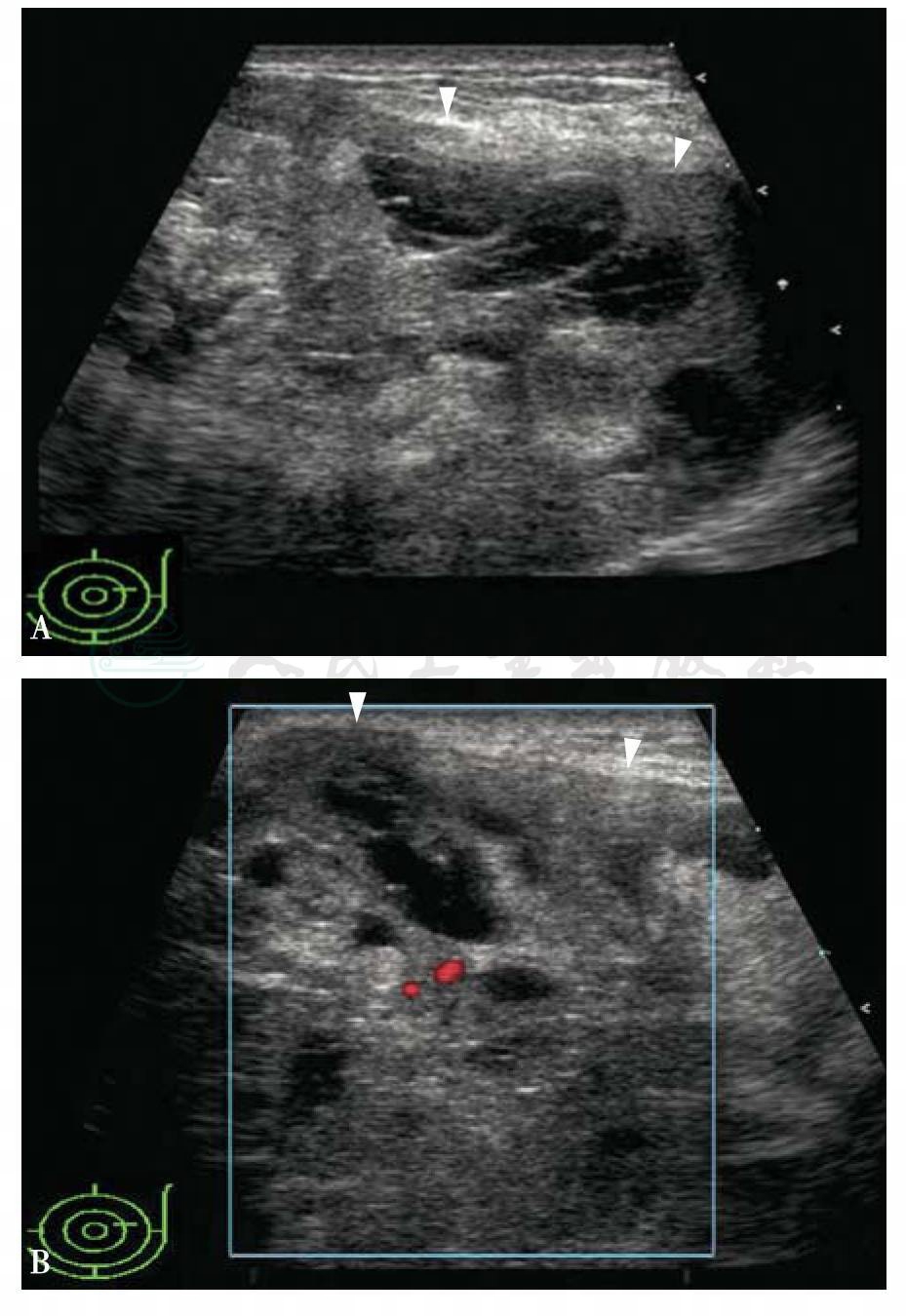
图5-15 乳腺恶性叶状肿瘤
女性,44岁。A.左乳3点钟距乳头3cm腺体层肿块,60mm×55mm×48mm,形态不规则,边缘模糊,内部回声囊实复合性,以实性为主伴裂隙状不规则无回声;B.肿块内实性成分有血流信号。BI-RADS分类:4c。病理诊断:恶性叶状肿瘤
2)囊肿或簇状微小囊肿:囊肿表现形式多种多样,囊肿大小、数目不等,单个或多个,单侧或双侧,集中或散在。典型的囊肿表现为圆形或卵圆形,边界光整,囊壁薄而光滑,囊内呈无回声,后方回声增强,有侧壁声影(图5-18)。簇状微小囊肿(图5-19)表现为多数的微小无回声,BI-RADS给出的标准描述语为:多个内径<5mm的囊性病灶集聚,囊间距<2mm。
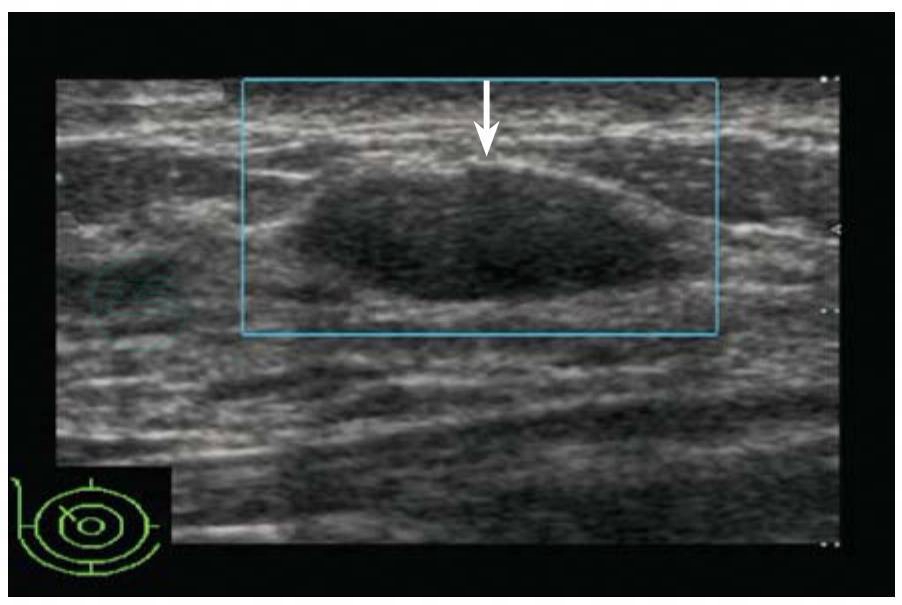
图5-16 病理诊断:腺病
女性,37岁,肿块超声表现:椭圆形,方位平行,边缘光整,低回声,肿块内未见钙化,肿块内无血流信号。BIRADS分类:3

图5-17 病理诊断:硬化性腺病
超声表现为形态不规则,边缘模糊,低回声,内部回声不均匀,肿块内血流。有可疑恶性征象,不能排除乳腺癌风险。BI-RADS分类:4b

图5-18 乳腺囊肿
超声表现为圆形或卵形,边缘光整,囊壁薄而光滑,内部呈无回声,后方增强,有侧壁声影。BI-RADS分类:2
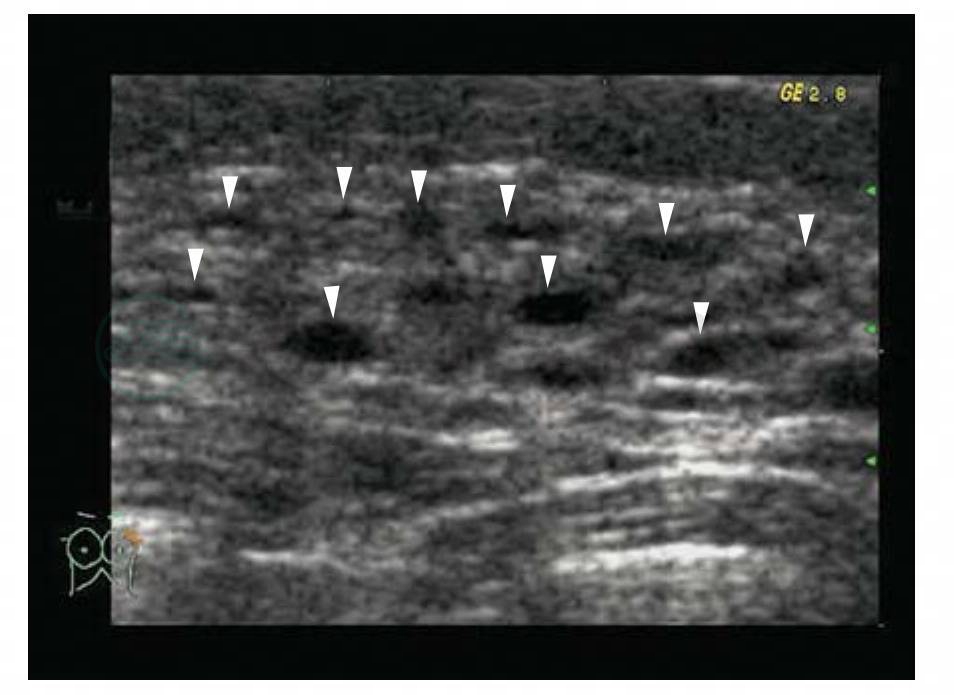
图5-19 乳腺腺病伴纤维囊性增生
女性,36岁,左乳外上象限腺体内查见密集的微小无回声,大小1~4mm,超声提示:簇状微小囊肿。BI-RADS分类:3。病理诊断:腺病伴纤维囊性增生
3)局限性腺体回声紊乱或增厚腺病可表现为腺体结构紊乱,回声局限性增强或减低,或腺体局限性增厚,扪诊可有质韧增厚感或扪及肿块,但超声图像无占位效应。这类表现最好建议乳腺X线检查。
4)混合型:上述3种表现形式不同程度并存。最常见的表现是局限性回声减低和簇状微小囊肿,或簇状微小囊肿和实性瘤样病变并存,肿块多无恶性可疑征象。
5)无明显异常表现:患者以乳腺疼痛就诊,超声检查无明显异常征象,至少是未见肿块图像。
2.鉴别诊断
(1)纤维腺瘤、腺病、叶状肿瘤等常见良性肿瘤的鉴别诊断:
纤维腺瘤和腺病是临床最常见的良性肿瘤或瘤样病变,肿瘤体积不大时,大多具有良性肿瘤的特征,超声图像表现为等回声或稍低回声肿块,生长缓慢,椭圆形或圆形,边缘光整,回声均匀,方位平行,后方特征无变化或增强。典型的纤维腺瘤表现为椭圆形、有包膜回声、侧壁声影。叶状肿瘤体积较大时,具有分叶状和裂隙状改变。腺病大小不等,部分体积较小的腺病表现为等回声,形体椭圆形、圆形或轻度不规则,内无血流信号。上述几种病变BI-RADS评估分类大多数是3类,常规3~6个月复查,1~2年无变化者,可6~12个月复查。对于体积较大,形态不规则,回声不均匀者,可评估为4类,少数硬化性腺病超声图像特征容易误诊为乳腺癌,BI-RADS评估分类为4类或5类,需要穿刺活检明确诊断。
(2)乳腺癌:
当上述良性病变表现为形态不规则、边缘不光整(模糊、毛刺、成角、细分叶),或复查时评估为BIRADS 3类的肿块最大径增大>20%,需要考虑具有乳腺癌风险。肿块内出现密集的微钙化灶(>5个强回声点)以及腋窝淋巴结肿大且门结构消失,提示乳腺癌可能性大。分类为BI-RADS 4类或5类,建议穿刺活检。
(二)乳腺炎性疾病
1.超声诊断要点
(1)急性乳腺炎在早期表现为蜂窝织炎时声像图无特异性。
(2)乳腺脓肿表现为皮肤红肿,不规则无回声,局部加压和振动后检查可见其内漩涡状流动的点状回声是其特征,形态不规则,边缘模糊(图5-20)。脓腔单发或多发。脓腔内无血流信号,脓肿壁及周围可见血流信号。
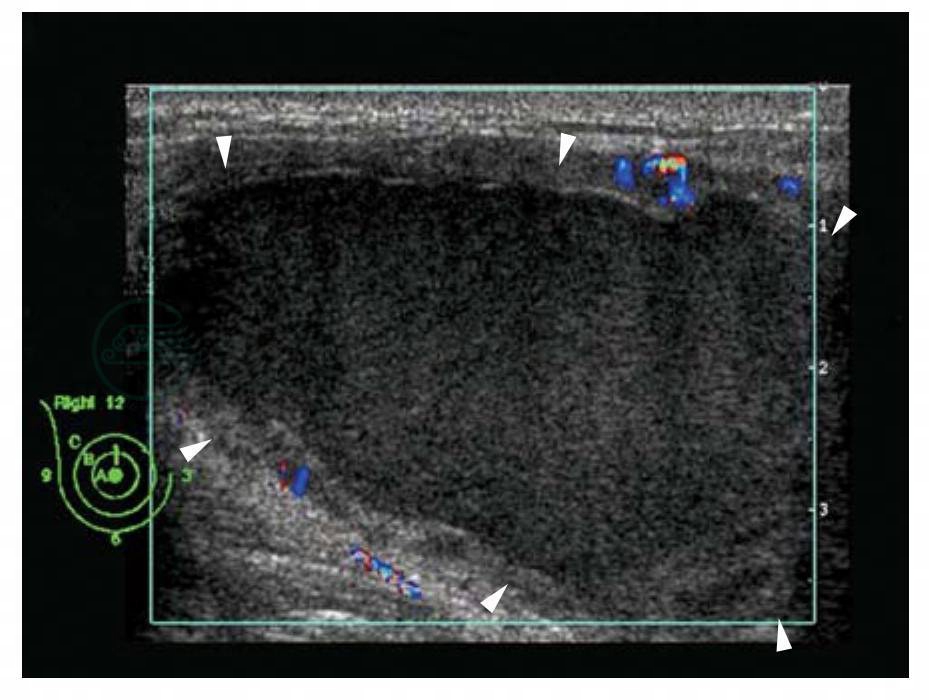
图5-20 急性乳腺脓肿
超声表现:右侧乳腺内查见一个巨大肿块,内呈无回声,但内见大量细小低回声,囊壁不光滑,囊内无血流信号,囊壁可见血流信号。加压振动探头检查时可见其内点状低回声飘浮和漩涡状流动。BI-RADS分类:2。超声引导下穿刺抽吸出黄白色黏稠脓液。诊断:乳腺脓肿
(3)慢性乳腺脓肿常表现为不均质肿块,中心伴有或不伴有小的液性暗区。BI-RADS评估为2类。部分临床症状不明显,慢性炎症过程导致肿块质硬,形态不规则,回声不均匀,边缘模糊,压痛不明显,容易误诊为乳腺癌。可能评估为BI-RADS评估为4类或5类。
2.鉴别诊断
(1)乳腺癌:
乳腺癌通常以肿块为首要就诊原因,而慢性乳腺脓肿则有慢性炎症的病史,肿块内多数有细小的脓腔。鉴别诊断困难者,建议穿刺活检明确诊断。
(2)乳腺囊肿:
乳腺囊肿伴出血时肿块内表现为细弱回声,但囊肿边缘清楚,囊肿壁薄、囊壁光滑,而脓肿的壁厚、内壁不规则,边缘模糊。
(三)乳腺癌
乳腺癌是来源于上皮组织的乳腺癌和来源于间叶组织的恶性肿瘤的总称。临床上最常见的病理类型是浸润性乳腺癌,包括非特殊型浸润性乳腺癌、浸润性小叶癌、黏液癌、髓样癌等。癌前病变包括导管原位癌和小叶原位癌等。其他病理类型少见,包括湿疹样乳腺癌、炎性乳腺癌,乳腺间叶组织来源的恶性肿瘤包括恶性叶状肿瘤、乳腺淋巴瘤等。大多数浸润性乳腺癌具有典型的恶性肿瘤的临床表现和超声图像特征,但髓样癌、黏液癌、叶状肿瘤在早期阶段具有膨胀性生长的特性,超声图像类似良性肿瘤的图像特征,容易误诊。部分浸润性癌不具备典型的恶性征象,需要超声多模态(弹性成像,超声造影)和多种影像学检查(乳腺X线检查、乳腺MRI、乳腺导管造影或乳管镜检查等)联合应用,怀疑乳腺癌时,需要穿刺活检和临床处理。
1.超声诊断要点
乳腺癌的病理类型很多,声像图表现与病理类型相关。
(1)乳腺癌典型的共同的超声图像特征如下。
1)形态:肿块形态不规则(图5-21)。
2)方位:肿块长径与皮肤不平行(肿块纵径≥横径,纵横比≥1)。肿块方位不平行为小乳癌的重要形态学特征(图5-22)。
3)边缘:乳腺癌边缘特征包括边缘模糊、毛刺、成角、细分叶、边缘强回声晕,是判断肿块恶性风险的重要指标(图5-21,图5-22)。
4)内部回声:以脂肪为等回声,乳腺癌的肿块绝大多数是低回声或极低回声(图5-21,图5-22)。发生出血和坏死时,可表现为囊实复合性回声。
5)后方回声:乳腺癌后方回声多数表现为衰减(图5-21,图5-22),或混合型。
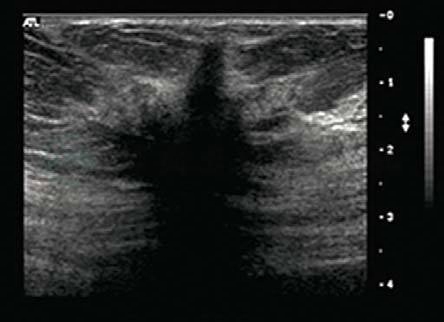
图5-21 乳腺癌
乳腺癌形态不规则,边缘模糊,成角,毛刺,低回声,后方声影。BI-RADS分类:5。病理:浸润性癌
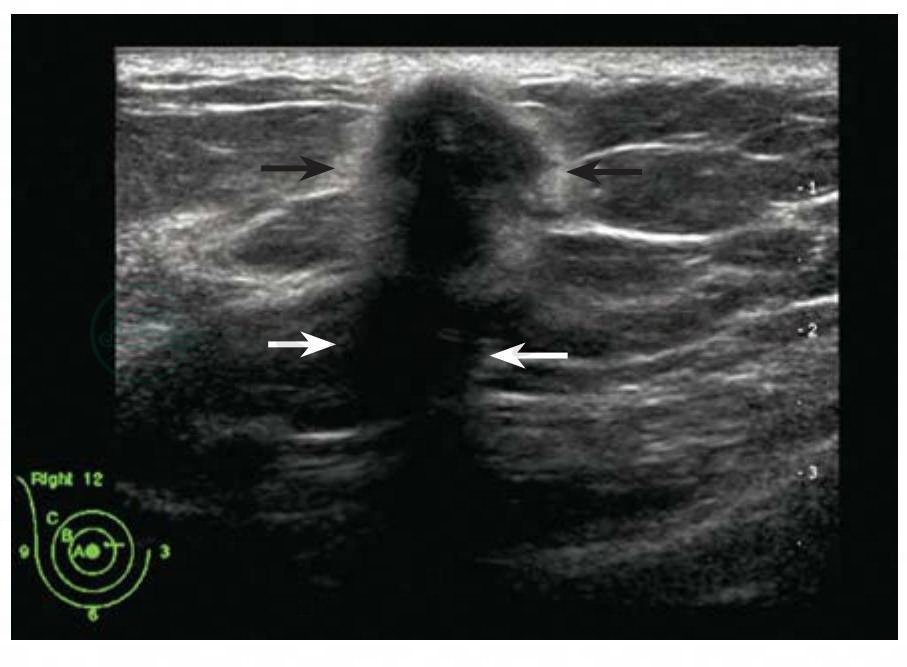
图5-22 乳腺癌
乳腺癌形态不规则,方位不平行,边缘模糊并可见强回声晕环征,肿块呈低回声,后方声影。BI-RADS分类:5。病理:浸润性癌
6)钙化灶在高频超声图像上,钙化灶可分为微钙化和粗钙化。肿块内微钙化提示乳腺癌,有较强特征性。典型的乳腺癌钙化灶表现为数目较多且相对集中呈簇状分布,以砂粒样微钙化为主(图5-23)。粗钙化可见于纤维腺瘤、积乳囊肿后期。
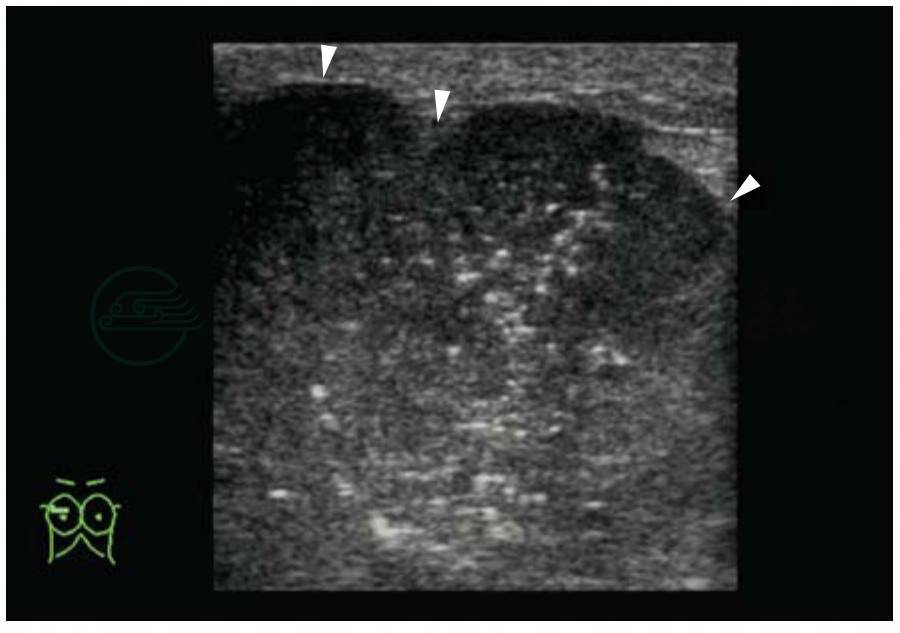
图5-23 乳腺癌
肿块形态不规则,分叶状,肿块内密集微钙化。BI-RADS分类:5。病理:浸润性癌
7)皮肤和周围组织改变乳腺癌淋巴管浸润可导致皮肤增厚,皮肤和皮下组织水肿,临床表现为橘皮征,乳腺癌浸润牵拉库柏韧带可导致皮肤凹陷征,乳腺癌浸润周围组织,可导致浅筋膜浅层连续性中断(图5-24),浸润乳腺后间隙可导致浅筋膜深层连续性中断(图5-25)。
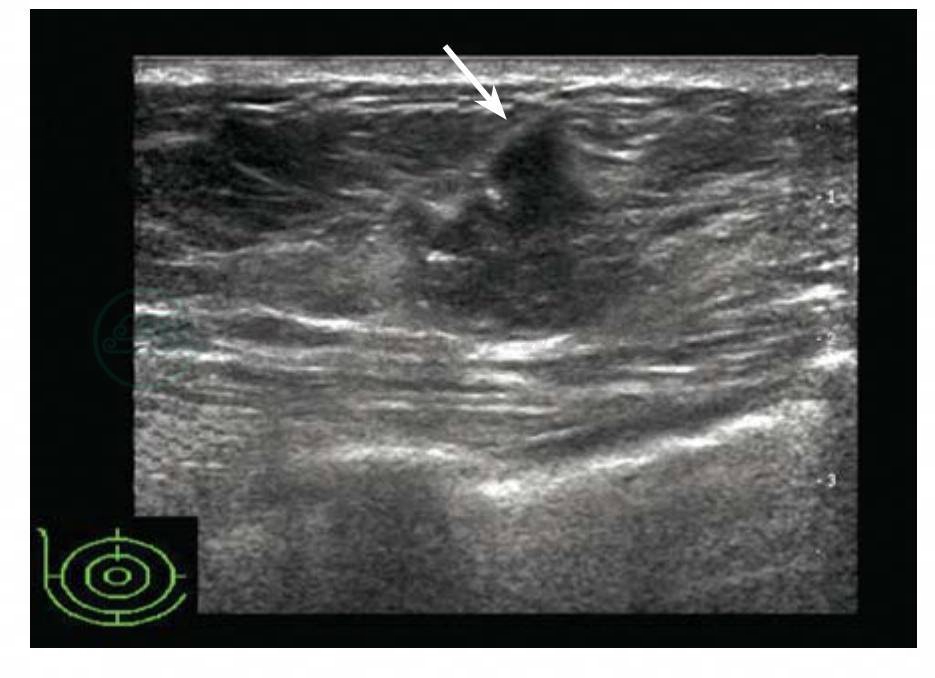
图5-24 乳腺癌
乳腺肿块浸润浅筋膜浅层和皮下脂肪层,导致浅筋膜连续性中断。BI-RADS分类:5。病理:浸润性癌
8)肿块血流良性肿瘤无血流或少血流多见,乳腺癌血流丰富多见。典型的乳腺癌血流可表现为血管增粗和走行不规则(图5-26),流速增高。彩色多普勒血流显像和频谱多普勒通常不作为乳腺癌独立的诊断指标。
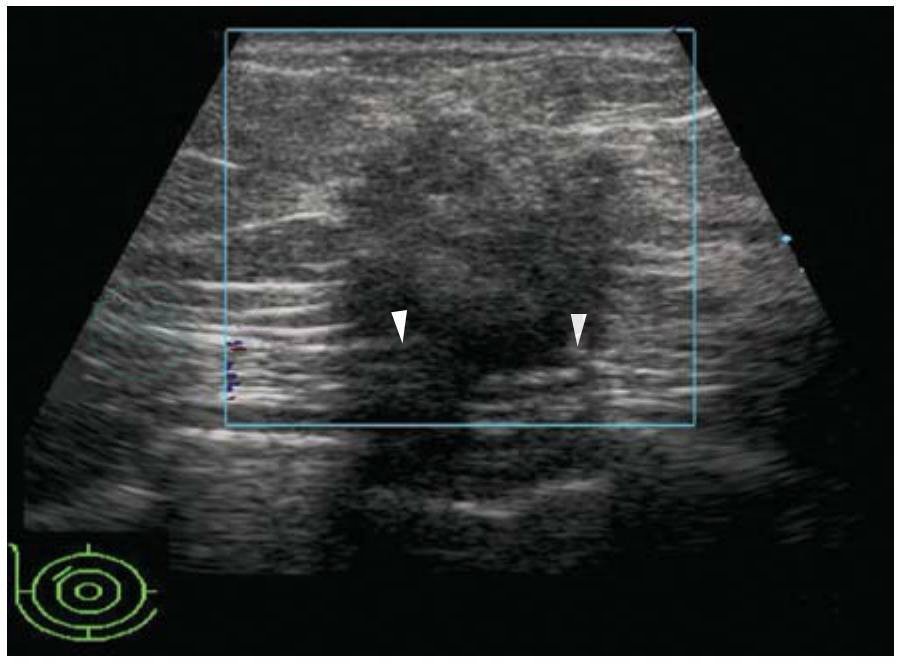
图5-25 乳腺癌
乳腺肿块浸润乳腺后间隙,肿块后方浅筋膜深层连续性破坏。BI-RADS分类:5。病理:浸润性癌
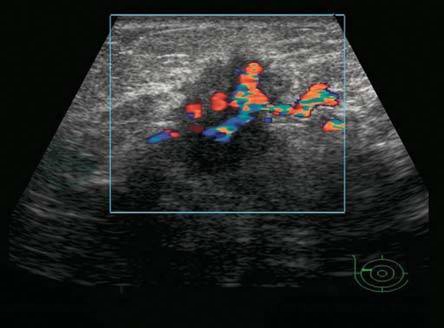
图5-26 乳腺癌
乳腺肿块血流丰富,血管增粗,向肿瘤内不规则分支。BI-RADS分类:5。病理:浸润性癌
9)淋巴结转移 典型的转移性淋巴结(图5-27)超声表现是淋巴结肿大,长/宽比值趋近于1,呈卵圆形或球形。淋巴门结构破坏或消失,皮质增厚,整个淋巴结呈低回声,门型血流消失,呈周围型血流信号。淋巴结转移是影响乳腺癌预后的决定性因素之一,数目越多,预后越差,转移部位越远,预后越差。乳腺癌引流区淋巴结包括腋下、中、上组,内乳淋巴结和锁骨上区。

图5-27 乳腺癌所致腋窝淋巴结转移
淋巴结肿大,淋巴门结构消失,整个淋巴结呈低回声
乳腺癌远处转移主要发生在肺、骨和肝。肺转移主要依靠胸部CT发现,骨转移主要依靠核医学骨扫描发现。超声重点是观察肝脏、盆腔和锁骨上淋巴结有无转移。肝转移多表现为肝实质内单发或者多发低回声结节,结节大小不等,边界清楚,形态较规则,背景肝实质回声多正常,接受过化疗的患者表现为肝实质回声多数表现为均匀增强。肝内门静脉和肝静脉血管无异常。盆腔转移表现为盆腔内子宫两侧出现不规则实质性肿块。乳腺癌肺转移、胸膜转移、腹腔和盆腔转移后期均可能出现胸腔积液和(或)腹腔积液。
(2)不同病理类型的乳腺癌有不同的超声表现。
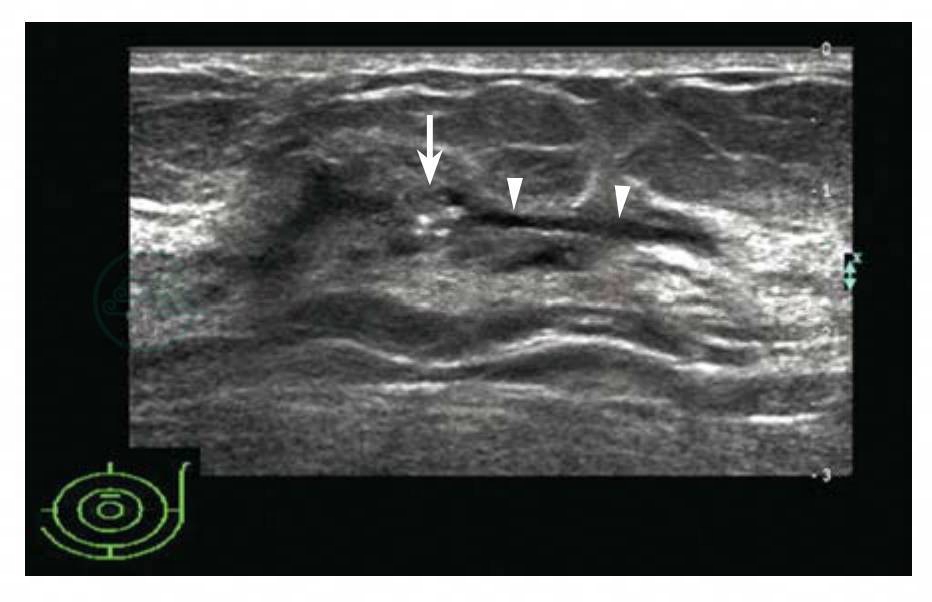
图5-28 乳腺癌
女性,56岁,乳头溢血。超声检查发现:左侧乳头上方导管增粗(白色箭头),内径1.5mm,导管内侧即乳头端见6mm×6mm×5mm的低回声肿块,形状不规则,边缘模糊,肿块内密集微钙化。BI-RADS分类:4c。病理诊断:导管原位癌
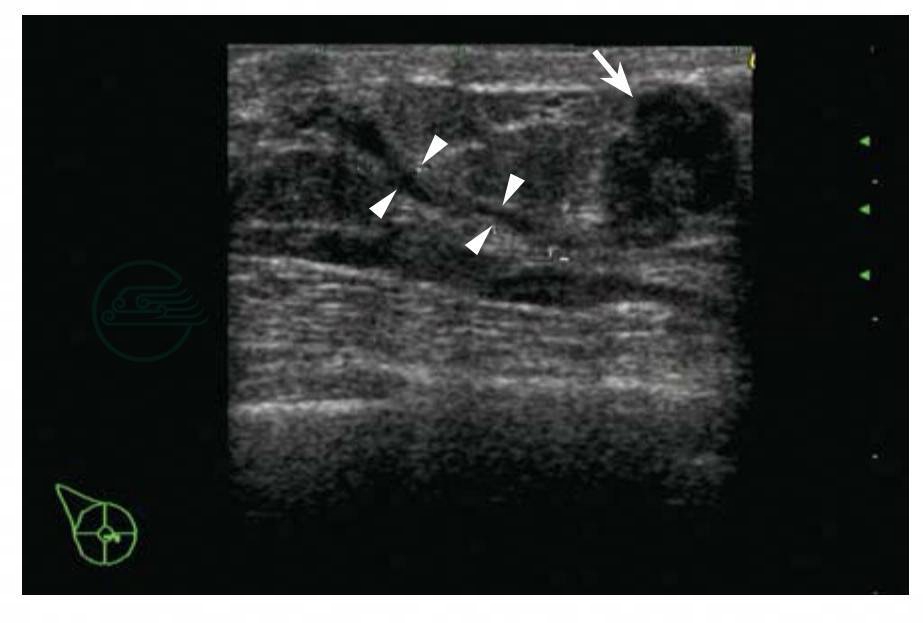
图5-29 乳腺癌
女性,40岁,右乳头旁扪及肿块。超声检查发现:右侧乳头旁肿块,12mm×9mm×12mm,形态不规则,边缘模糊,方位不平行,低回声,肿块深面与扩张导管相通(白色箭头),导管一端连接肿块,另一端连接乳头,导管内径1~2mm。BI-RADS分类:4b。病理诊断:导管原位癌
导管原位癌(又称导管内癌)指癌细胞没有浸润超过基底膜,包括多种病理类型,超声表现多种多样。部分导管原位癌超声图像上表现为具有恶性征象的肿块,部分肿块表现为以密集点状强回声为主要特征的无肿块型或局部结构紊乱(图5-28),部分肿块与扩张导管相通(图5-29)。髓样癌和黏液癌呈膨胀性生长,在肿瘤体积不大时,回声均匀,后方特征无变化或增强,超声图像与良性肿瘤特征相似,容易误诊为良性肿瘤。髓样癌可疑征象常常只有形态不规则和边缘模糊(图5-30),体积增大时容易囊性变,黏液癌分单纯型和混合型,单纯型容易误诊为纤维腺瘤,部分回声不均匀,可见黏液糊(图5-31),混合型具有部分可疑征象。
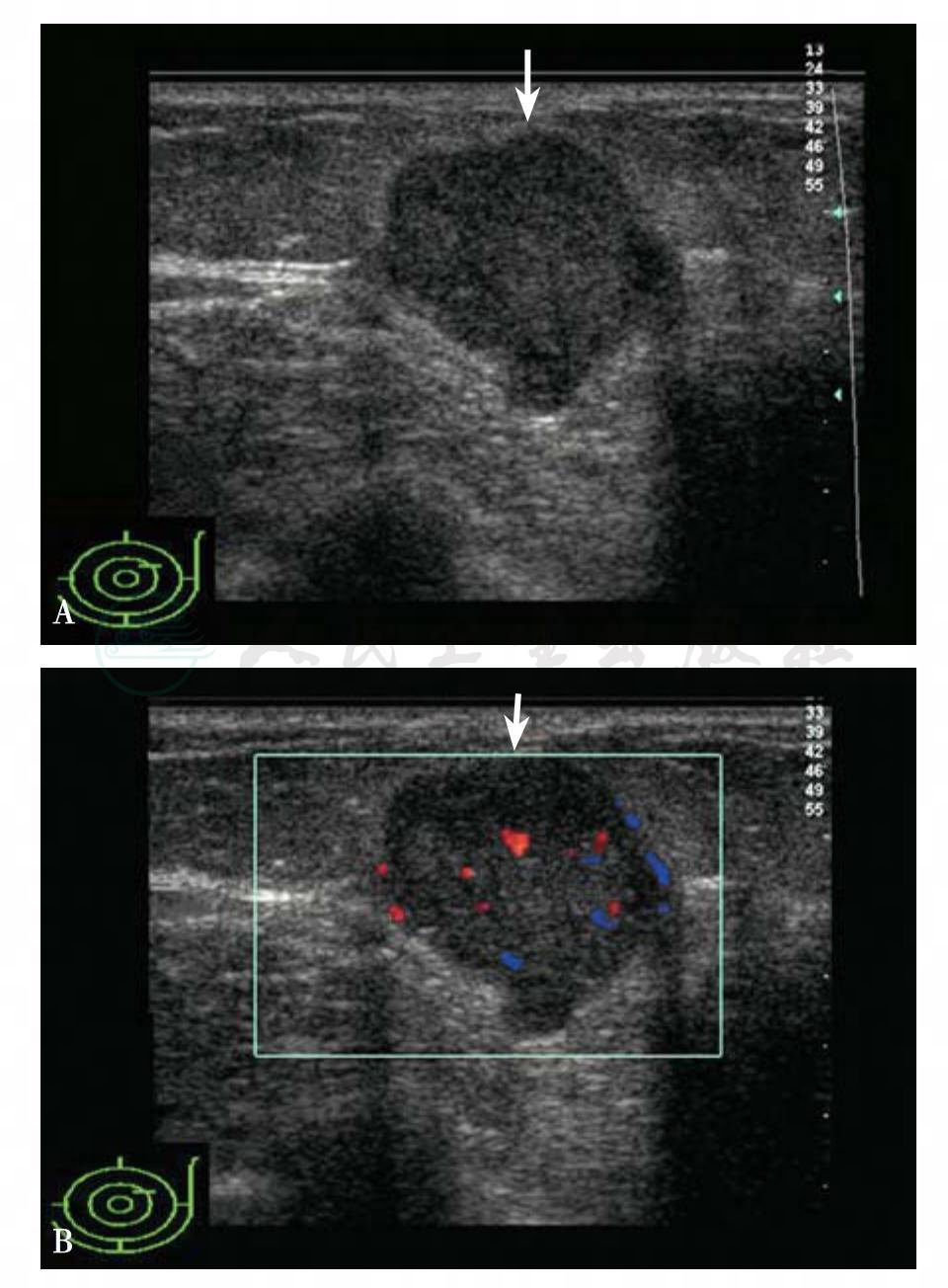
图5-30 乳腺癌
A.女性,37岁,左侧乳腺2点钟距乳头3cm腺体层查见一个肿块,24mm×20mm×25mm,形态不规则,边缘模糊,低回声,回声均匀;B.肿块有少量血流信号。BIRADS分类:4b。病理诊断:髓样癌
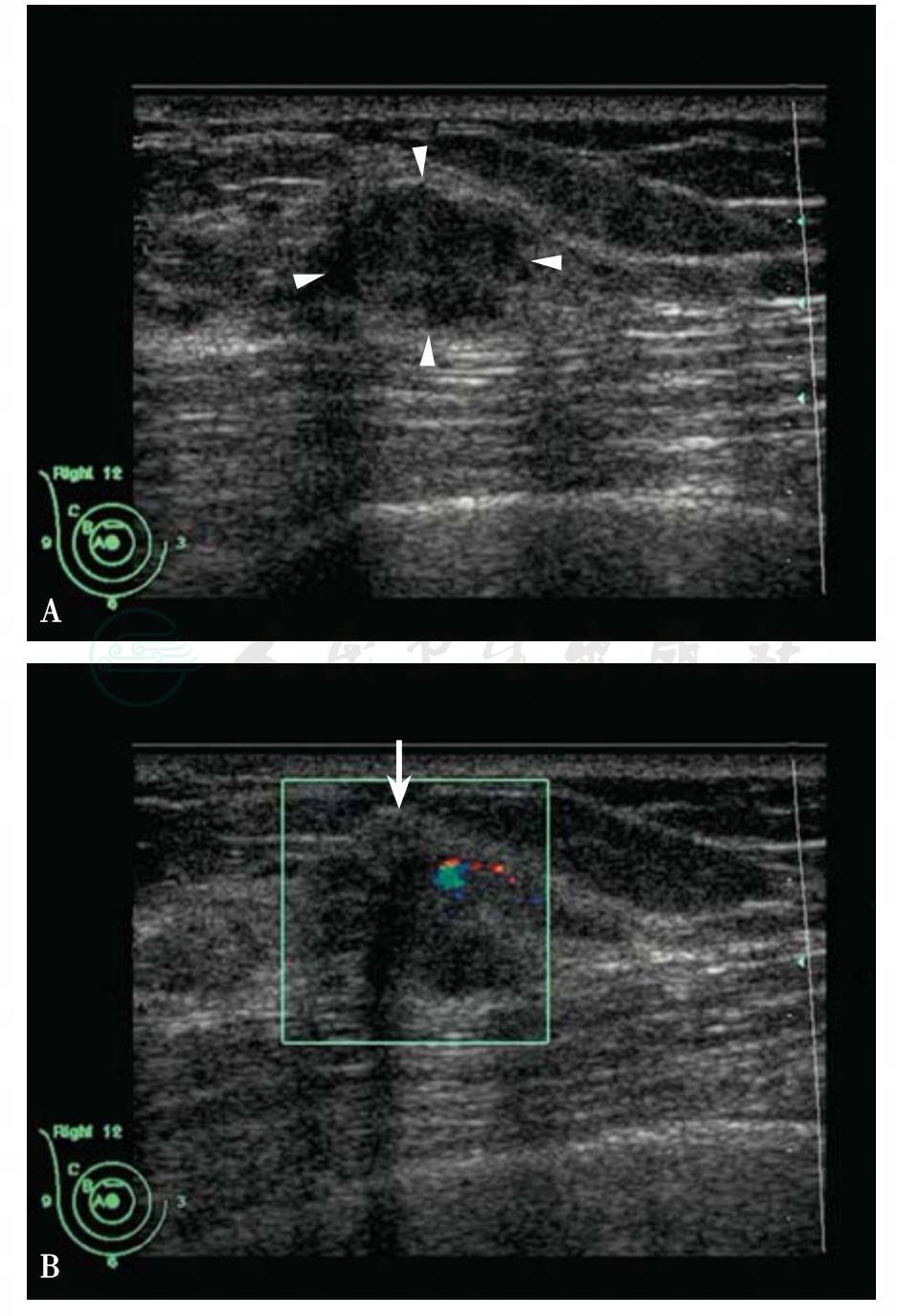
图5-31 乳腺癌
A.女性,33岁,右侧乳腺12点钟距乳头2cm处腺体内肿块,16mm×12mm×12mm,形态不规则,边缘模糊,低回声,不均匀,后方特征混合;B.肿块内有少量血流信号。BI-RADS分类:4c。病理诊断:黏液腺癌合并早期浸润性导管癌
2.鉴别诊断
乳腺癌最重要的是与乳腺良性肿瘤鉴别,鉴别诊断要点见表5-1。在临床工作中,乳腺良、恶性肿瘤之间的图像特征存在明显的重叠和交叉,造成乳腺癌的诊断困难。由于乳腺超声最重要的目的是找出恶性病灶,故正确使用BI-RADS就显得非常重要。既要不漏诊恶性病灶,又不能过度诊断。对不能排除乳腺癌风险的乳腺肿块(BI-RADS 4类),建议超声引导下穿刺活检明确诊断。
表5-1 乳腺癌与乳腺良性肿瘤的鉴别诊断要点
(四)男性乳腺肿块
1.超声诊断要点
男性乳腺肿块主要有男性乳腺发育和男性乳腺癌。男性乳腺发育是指男性在各年龄阶段因不同的原因出现单侧或双侧乳腺发育。多见于青春期及老年期,多数为单侧,少数为双侧,对称或不对称。男性乳腺发育根据发育程度有不同的超声表现。典型的超声表现为乳头深面低回声肿块(图5-32),椭圆形或不规则形,边缘完整。部分乳腺发育表现为树根状低回声,容易误诊为乳腺癌。部分男性乳腺发育类似女性青春期乳腺声像图,通常不伴导管扩张。
男性乳腺癌罕见,多见于老年人。临床表现主要是扪及乳腺肿块,少数为乳头溢血。肿块质硬,不规则,常无触痛。组织学以浸润性导管癌多见。超声表现为形态不规则,边缘模糊、成角、毛刺、细分叶状,肿块呈低回声,容易囊性变呈囊实复合回声,肿块血流信号丰富(图5-33)。
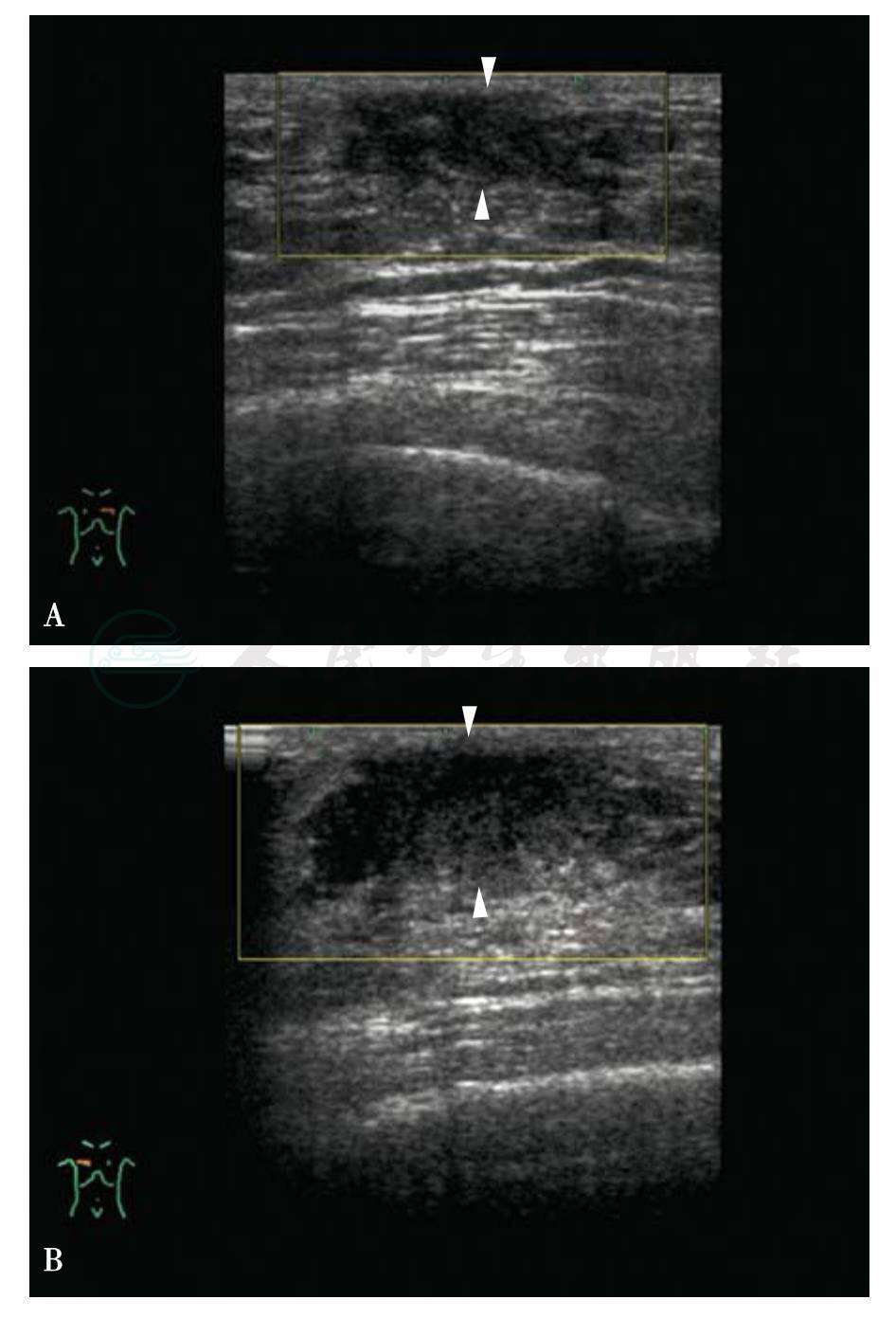
图5-32 男性乳腺发育
A.男性,16岁,左侧乳头深面肿块,20mm×20mm×7mm,卵圆形,低回声,边缘光整,形态规则,回声均匀。BIRADS分类:2;B.男性,16岁,右侧肿块较左侧稍大,30mm×30mm×11mm,边缘光整,形态规则,回声均匀。BI-RADS分类:2。超声提示:青春期男性双侧乳腺发育
2.鉴别诊断
男性乳腺发育的肿块通常边界清楚,形态规则,回声均匀,血流信号不明显。而男性乳腺癌的肿块通常形态不规则,边缘模糊、成角、毛刺、细分叶状,内部囊性变,血流信号丰富。当男性乳腺发育的肿块形态不规则,难以与乳腺癌鉴别时,可行穿刺活检明确性质。
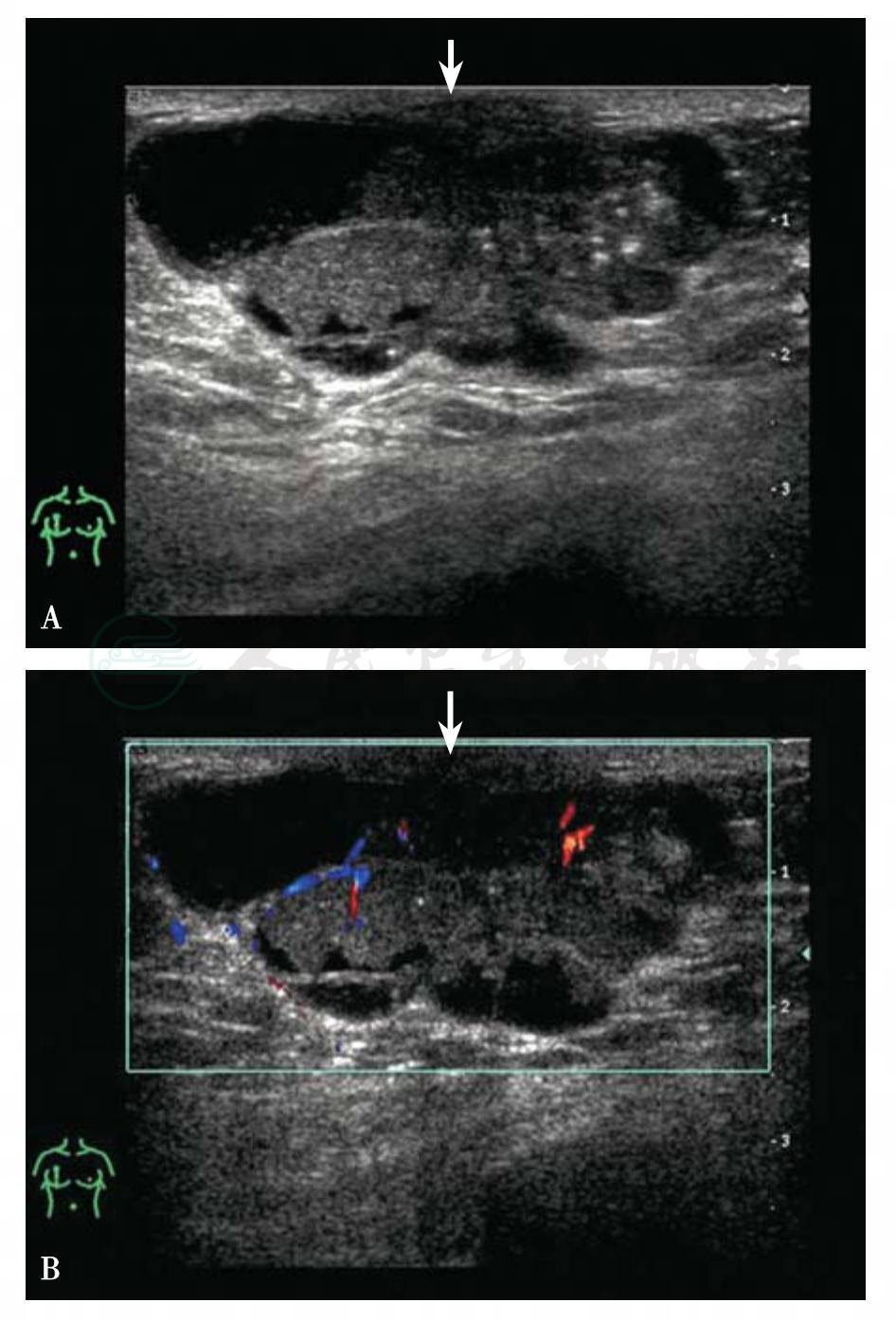
图5-33 男性乳腺癌
A.男,80岁,右侧乳头溢血和乳腺肿块就诊。超声检查见右侧乳腺肿块,46mm×42mm×25mm,形态不规则,边缘模糊,囊实复合性回声,囊性肿块内见乳头状实性回声,肿块内见微钙化;B.肿块内乳头状实性回声内血流信号丰富,流速加快。BI-RADS分类:5。病理诊断:浸润性导管癌
十、乳腺超声报告书写规范
(一)患者的基本信息
包括受检者的姓名、性别、年龄、申请科室、身份识别卡号、住院患者的病室和床号、超声检查号。最好纳入与图像质量密切相关的仪器型号和探头频率。
(二)超声报告图像部分
1.存储显示病变或肿块的重要超声图像特征,例如肿块的形态、方位、边缘、内部回声、后方回声、钙化、彩色多普勒和(或)频谱多普勒血流特征、周围组织改变和导管特征等。
2.每幅图像有体表标记,标明探头所在位置和方向。体表标记内代表探头位置和方向的标记线与实际检查时的探头位置和方向一致。体表标记的位置不影响图像和文字显示。
3.乳腺超声检查无异常发现时建议采集两张图像(左、右侧乳腺各一张),有异常时增加图像,显示病变的主要特征。
(三)超声报告文字描述及观察要点
1.超声报告文字描述
清楚地描述任何重要发现,采用BI-RADS标准术语进行图像特征的描述。形态描述词描述肿块形态、边缘和方位特征。病变对周围组织的影响、后方特征、内部回声类型、彩色多普勒和弹性成像可能对诊断提供有效信息,需描述重要阳性特征。如果有单纯性或复杂性囊肿、簇状小囊肿、乳腺内淋巴结、乳腺内异物等非典型病变发现,则需要在报告中给予简要解释。对重要阳性发现,特别是可疑恶性征象的肿块,对肿块大小进行测量并存储图像,肿块大小与前次检查对比。注明病变位于哪侧乳腺,病变定位常规采用钟表表盘式定位法进行准确描述,记录肿块位于几点钟、距离乳头的距离,怀疑肿块有恶性风险时,描述区域淋巴结情况。对于多发的、超声图像相似的囊性或实性肿块,考虑为良性病变时,可只描述最大的病变,测量每侧最大肿块的最大径,存储最有代表性的图像。最后的报告结论可统一评估为良性(BI-RADS 2类或3类)。针对乳腺X线摄影的异常区域或者患者、医师所关注的区域,超声检查需要对目标区域进行描述和记录。腋窝正常淋巴结可以不记录,但是对于乳腺内淋巴结应该记录,尽管可能无症状并考虑良性淋巴结,评估分类为2类。
2.观察要点
(1)有无肿块:
肿块应该具有占位效应,在两个不同的断面都能显示。如有肿块,观察肿块及周围组织的图像特征。
(2)有无导管异常:
观察有无导管扩张、扭曲、导管壁增厚、导管内肿块、导管周围肿块等,导管扩张时在导管长轴断面测量导管外径。
(3)围组织改变:
库柏韧带基底增宽,常常代表乳腺癌浸润库柏韧带。浅筋膜浅层或深层连续性破坏可能系乳腺癌浸润性生长所致。局限性回声减低或回声增强,局部腺体增厚,多与乳腺良性上皮增生有关,偶见于导管内癌。
(4)有无淋巴结肿大:
淋巴结肿大,特别是皮质增厚和淋巴门结构破坏或消失,多系乳腺癌转移所致。
(四)超声诊断意见
超声检查最重要的原则是判断病变的恶性风险,超声报告结论建议给出BI-RADS评估分类,但BI-RADS评估分类并不是取代超声诊断意见,而是建立了数据库标准,对病变的恶性风险评估采用统一的标准和一致的临床处理意见。因此,超声结论最好先给出物理诊断(囊性、实性、囊实复合性),有经验者可提示临床诊断或病理诊断。
1.超声诊断首先是确定病变的物理性质(囊性,实性,囊实复合性)
尽管超声仪器越来越先进,超声诊断水平越来越高,临床应用越来越广,超声诊断仍不能超越物理性质的判断。乳腺超声检查首先是判断有无病变,如果有病变,则根据声像图特征确定病变的物理性质(囊性、实性或囊实复合性)。
2.乳腺超声BI-RADS评估分类
根据超声图像特征和检查者的临床经验,推测肿块良、恶性质,重点是肿块的恶性风险评估。在实际工作中,可以根据掌握的临床资料和对疾病的认识,对可能产生这些物理学改变的病因或疾病进行提示,严格地说这个提示属于假说。任何的乳腺超声检查结论都应该给出相应的BI-RADS评估分类(详见后面编译的BIRADS标准)。
(五)落款
落款包括具有签字权的医师签名(手写签名或电子签名),检查者和报告录入者姓名,检查时间。如果检查者为超声技师或尚未取得职业医师资格证的规范化培训医师或研究生等,报告必须由具有签字资格的医师审核和签名。不具备电脑录入和编辑报告的条件时,应按照上述内容提供手写报告。涂改报告需要在涂改处盖章或签名。
附录1 ACRBI-RADS®—超声辞典分类表(2013)
在以下分类中,选择能最佳描述主要病灶特征的选项。如有可能,乳腺X线摄影BI-RADS中的定义和描述词也可应用于超声。
乳腺组织
A. 组织构成(限于筛查时):乳腺不均匀的背景回声质地可能影响乳腺超声探测病变的灵敏度。(选择一项)
1.均匀背景回声-脂肪
2.均匀背景回声-纤维腺体
3.不均匀背景回声
检查发现
B. 肿块:肿块具有三维空间和占位效应。使用二维超声肿块应该在两个不同的观察断面显示;使用容积成像应该在三个不同的观察断面显示。
1.形状(选择一项)
a. 椭圆形 椭圆形或卵形(可能包括2或3个波状起伏,即平缓分叶或大分叶)
b. 圆形 球形、球状或环形
c. 不规则形 既非圆形,也非椭圆形
2.方位(选择一项)
a. 平行 肿块长轴与皮肤平行(宽径大于前后径,水平位)
b. 不平行 肿块长轴与皮肤不平行(前后径大于宽径,垂直位,包括圆形)
3.边缘(选择所有适合项)
a. 光整 肿块的全部边缘有明确界定或锐利,病灶和周围组织有突变
b. 不光整 肿块具备以下一项或多项特征:肿块的任何部分呈模糊、成角、微小分叶或针状
i. 模糊 在边缘的任何部分,肿块和周围组织间无清晰分界
ii. 成角 部分或全部边缘有锐利角度,通常形成锐角
iii. 微小分叶 边缘具有微小波动的特征
iv. 毛刺 从肿块放射状突出的锐利线状物
4.回声模式(选择一项)
a. 无回声 肿块内部没有回声
b. 高回声 回声高于脂肪组织,与乳房腺体纤维成分相同
c. 囊实性复合回声 肿块含有无回声(囊性或液性)和有回声(实性)成分
d. 低回声 回声低于脂肪组织
e. 等回声 回声等于脂肪组织
f. 不均匀回声 实性肿块内各种回声模式的混合
5.后方回声特征(选择一项)
a. 无改变 无后方声影或回声增强
b. 增强 后方回声增强
c. 声影 后方回声减低(侧方边缘声影除外)
d. 混合性 肿块后方一项以上后方特征,包括声影和回声增强
C. 钙化:超声不易很好地定性钙化,但能识别肿块内钙化。(如果存在,选择所有适合项)
1.肿块内钙化 相对于纤维腺体组织,肿块内和导管内钙化更易显示。除非微钙化聚集得很紧密或是每个钙化都较粗大,否则不会造成声衰减。
2.肿块外钙化 和位于肿块内部的钙化相比,超声不容易发现位于脂肪和纤维腺组织内的钙化。
3.导管内钙化
D. 相关特征(选择所有适合项)
1.结构扭曲
2.导管改变 表现为一支或多支导管囊状扩张,包括管径不规则和(或)树枝状,导管延伸至肿块或从肿块向外延伸,或出现导管内肿块、血栓或碎屑。
3.皮肤改变(选择所有适合项)
a. 皮肤增厚 皮肤增厚可以是局灶性或弥漫性,厚度>2mm定义为皮肤增厚(在乳晕周围区域和乳房下皱襞,正常的皮肤厚度可达4mm)
b. 皮肤回缩 皮肤表面凹陷或边界不清,出现牵拉。
4.水肿 周围组织回声增强,呈网状(低回声线构成的成角的网状图像)
5.血供(选择一项) 必须与对侧正常乳腺区域或同侧乳腺非病变区域进行对比
a. 无血供
b. 内部血供 血流出现在肿块内部
c. 边缘血供 血流出现在边缘,部分或全部环绕肿块
6.弹性评估(选择一项) 硬度是肿块和周围组织的特征,应该和更重要的形态学特征一起考虑
a. 质软
b. 质中
c. 质硬
E. 特殊征象:指有独特诊断意义或表现的征象(选择所有适合项)
1.单纯囊肿 边缘光整,圆形或椭圆形,无回声,后方回声增强
2.簇状小囊肿 一簇直径小于2mm的微小无回声灶,分隔薄,小于0.5mm,无实性成分
3.复杂囊肿 囊肿内含碎屑,特征性地表现为囊内均匀低回声无独立的实性成分,具有不易分辨的囊壁。可能出现分层表现,在改变体位时分层可发生缓慢移动;可包含点状高回声,当发生移位时可出现回声闪烁征象。
4.皮肤内部或表面肿块 这些肿块临床表现很明显,包括皮脂囊肿或表皮囊肿、瘢痕、痣、神经纤维瘤和副乳头
5.异物(包括植入物) 可能包括标记夹、线圈、金属线、导管套管、注射或泄露的硅酮、与金属或玻璃有关的外伤以及植入物
6.淋巴结-乳腺内 界限清楚的椭圆形团块,包含低回声皮质和高回声淋巴门,常呈肾形,包含淋巴门脂肪。最常见于乳腺外上象限(特别是腋尾部);大小通常为3~4mm到约1cm。
7.淋巴结-腋窝
8.血管异常(选择一项)
a. 动静脉畸形(动静脉畸形/假性动脉瘤)
b. 胸壁浅表性血栓性静脉炎(Mondor病)
9.术后积液
10.脂肪坏死
附录2 乳腺超声BI-RADS评估分类及处理建议(附表2-1)
附表2-1 超声BI-RADS 分类以及处理建议
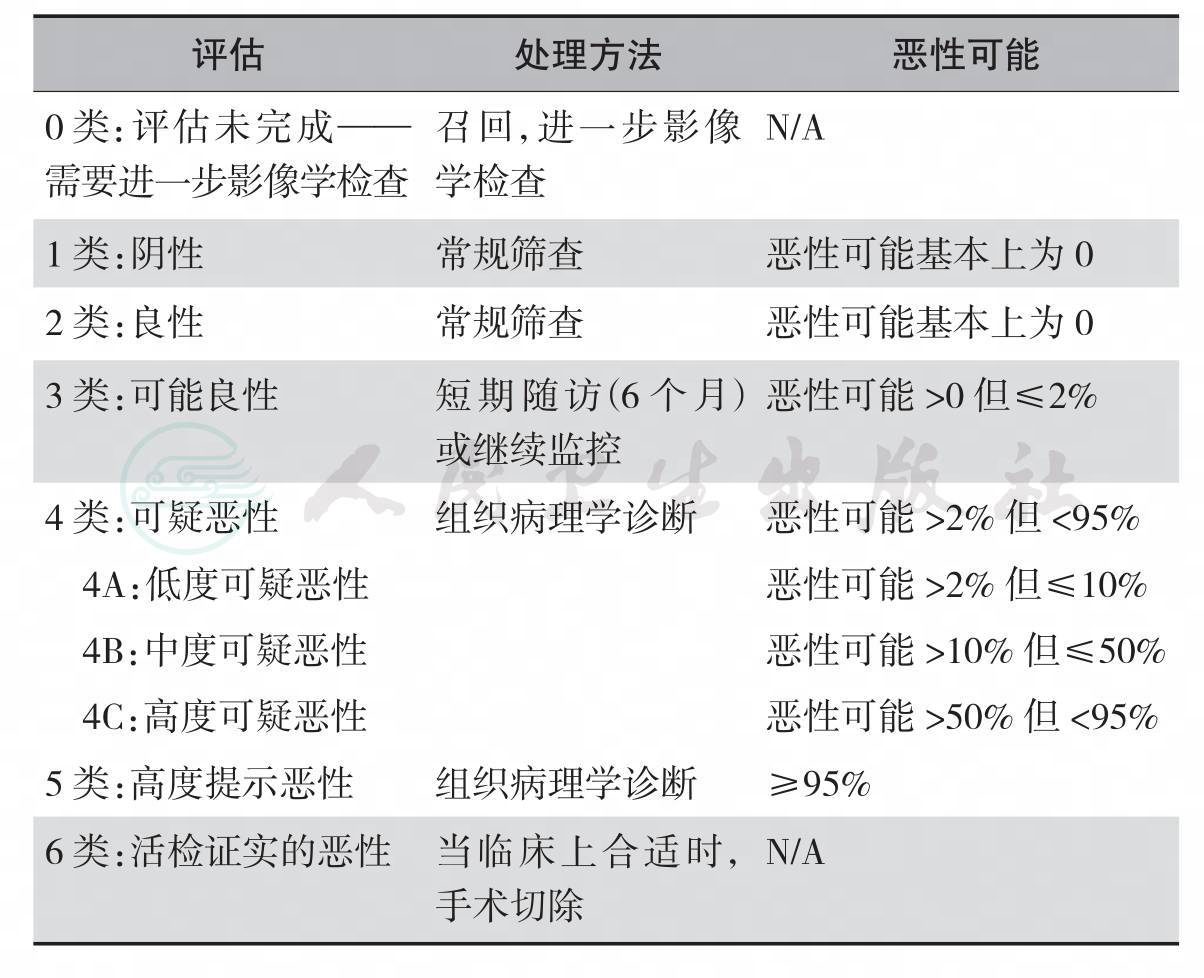
1.评估未完成(assessment is incomplete)
BI-RADS 0类(category 0):评估未完成——需要进一步的影像学评估和(或)与既往影像学检查相比较。
2.评估完成(assessment is complete)——最终分类
(1)BI-RADS 1类(category 1):阴性(negative):1类是正常的超声检查结果。乳腺结构回声紊乱是一种正常的超声表现,属于1类。1类结果的患者无需处理,只需要进行和年龄相适应的常规筛查。
(2)BI-RADS 2类(category 2):良性(benign):2类是良性的评估结果,如单纯囊肿、乳房内淋巴结、术后积液、乳腺植入物,或至少经2年或3年无改变的复杂囊肿/可能的纤维腺瘤。和1类结果相似,2类结果的患者也只需进行和年龄相适应的常规筛查。
(3)BI-RADS 3类(category 3):可能良性(probably benign):指恶性可能>0但≤2%的超声发现。超声BI-RADS指出,有以下6种超声改变可以评估为3类:①边缘光整的椭圆形平行位生长肿块;②单发的复杂囊肿;③簇状小囊肿;④脂肪坏死;⑤脂肪小叶的边缘产生的折射声影;⑥术后瘢痕所致的结构扭曲。
以上6种超声改变中,第1种和第2种有强有力的证据支持,但对于第1种文献仅强力支持小于40岁的女性。有不是很强有力的证据支持第3种超声改变。另外3种超声改变则仅有专家意见支持。另外,超声医师根据个人经验,通过观察足够数量的病例,证实某一种超声改变的恶性可能在≤2%的界限范围内,则也可将这种超声改变评估为BI-RADS 3类。
对于BI-RADS 3类的可能良性病灶,初次的短期随访间隔通常是6个月。如果在这6个月的检查中病灶稳定,再次给予3类的评估,推荐第二次6个月内短期随访检查,如第二次随访结果还是3类,则建议将随访的间隔延长至1年,如果经2~3年病灶保持稳定,最终的评估等级改为良性(BI-RADS 2类)。如果肿块完全消失,可评估为1类;如果在6个月内直径增加大于20%,或出现其他可疑的改变,应立刻将评估升为可疑(BI-RADS 4类),推荐进行活检;在完成上述3类病灶的随访分析之前,如果随访所见无恶性可能,根据阅片者的意见,也可以给病灶良性评估结果,即BI-RADS 2类。
(4)BI-RADS 4类(category 4):可疑恶性(suspicious):4类病灶的恶性可能>2%但<95%,因而包含了大范围间距的恶性可能。证明一个良性评估结果的描述词是边缘光整、椭圆形(包括术语大分叶)和平行位生长,如果这3组特征分类的任何其他描述词适合于肿块,比如边缘模糊、形态不规则或非平行位,则肿块至少应被评估为4类。
可以将4类病灶分为4A(低度可疑恶性,恶性可能>2%但≤10%)、4B(中度可疑恶性,恶性可能>10%但≤50%)和4C(高度可疑恶性,恶性可能>50%但<95%)。但超声BI-RADS没有提出亚分类的划分原则。对4类病灶建议进行活检。
(5)BI-RADS 5类(category 5):高度提示恶性(high suggestive of malignancy):该类病灶有高度的恶性危险(≥95%)。对于该类病变,如果经皮组织学活检为非恶性,则需要进行再次活检(通常真空辅助或手术活检)。一般将具有非常典型恶性特征的肿块判定为5类,如果合并有腋窝异常淋巴结,则判定为5类的证据将更充分。
(6)BI-RADS 6类(category 6):活检证实的恶性(known biopsy-proven malignancy):在获得恶性的活检证据后,但是在手术前进行影像学检查的病灶属于BI-RADS 6类。
1.国家卫生计生委能力建设和继续教育中心.超声医学专科能力建设专用初级教材:浅表器官分册.北京:人民卫生出版社,2016.
2.詹维伟,周建桥.乳腺超声影像报告与书记系统解读.北京:人民卫生出版社,2015.
3.中国医师协会超声医师分会.血管和浅表器官超声检查指南.北京:人民军医出版社,2011.
4.Laszlo Tabar,Tibor Tot,Peter B Dean.Understanding the breast in health and disease(Vol 1). C & C offset priting Co.,Ltd. 2013:1-64.
5.A.ThomasStavros.Breastultrasound.Lippincott Williams & Wilkins,2004.
6.杨文涛,朱雄增.2012版WHO乳腺肿瘤分类解读.中华病理学杂志,2013,42(2):78-80.
7.刘标,周晓军.解读2012年WHO乳腺肿瘤分类.临床与实验病理学杂志,2012,28(11):1185-1187.
8.李泉水.浅表器官超声医学.北京:人民军医出版社,2013.
9.张建兴.乳腺超声诊断学.北京:人民卫生出版社,2012.
10.严松莉.乳腺超声与病理.北京:人民卫生出版社,2009.
11.林礼务,林新霖,薛恩生.浅表器官与血管疾病彩色多普勒超声诊断图谱.厦门:厦门大学出版社,2006.