 去看看
去看看


随着血管造影和经皮冠状动脉介入治疗(PCI)技术的发展,含碘对比剂的使用越来越广泛,其安全使用和合理选择也日益受到关注。鉴于此,由临床多学科组成的专家组通过对现有临床研究证据的系统性回顾,并结合临床实践经验,共同制定了此共识,以指导对比剂的规范使用。
一、对比剂的分类
含碘对比剂基本结构是含3个碘的苯环(3-乙酰-2,4,6-三苯甲酸)。根据苯环的个数分为单体和双聚体,按照是否在溶液中电离出离子分为离子型和非离子型,按照渗透压分为高渗、低渗和等渗对比剂(表1)。含碘对比剂的发展经历了从离子型到非离子型、从高渗到相对低渗直至等渗的过程。高渗对比剂为离子型单体,其渗透压高达血浆渗透压的5~7倍;低渗对比剂[实际上为目前常用的相对高渗对比剂(590~770mOsm/kgH2O)]包括非离子型单体和离子型二聚体,其渗透压明显低于高渗对比剂,但高于血浆渗透压2倍左右;等渗对比剂为非离子型二聚体,其渗透压与血浆渗透压相等[1]。高渗对比剂不良反应相对较多,现已很少使用。目前临床常用的含碘对比剂以等渗或低渗对比剂为主。
表1 常用含碘对比剂的分类和理化性质

二、对比剂相关的急性肾损伤
(一)定义和流行病学
部分患者在使用含碘对比剂后24~48小时内,血清肌酐(serum creatinine,Scr)值会升高,一般3天内达峰值,曾将排除其他原因后因对比剂引起的肾脏损害称为对比剂肾病(contrast induced nephropathy,CIN)。2003及2008年欧洲泌尿生殖放射协会(European Society of Urogenital Radiology,ESUR)确定的CIN诊断标准是:使用对比剂后3天内,Scr绝对值升高≥0.5mg/dl(1mg/dl=88.4μmol/L)或较基础值升高≥25%,并排除其他原因的肾脏损害[2]。
近年主张采用对比剂致急性肾损伤(contrast-induced acute kidney injury,CI-AKI)概念代替CIN[3-4]。CI-AKI是仅次于肾灌注不足和肾毒性药物引起的医院内发生肾功能衰竭的第三大原因,占全部医院获得性肾功能衰竭的11%[5]。
(二)危险因素
CI-AKI的主要危险因素包括原有肾功能不全、糖尿病、水化不完全及使用过多剂量对比剂,其他可能的危险因素包括心力衰竭、低血压、主动脉内球囊反搏、使用肾毒性药物、高龄及贫血等[6-11](表2,表3)。CI-AKI提示预后不良[8]。
表2 CI-AKI危险因素评分量表[10]
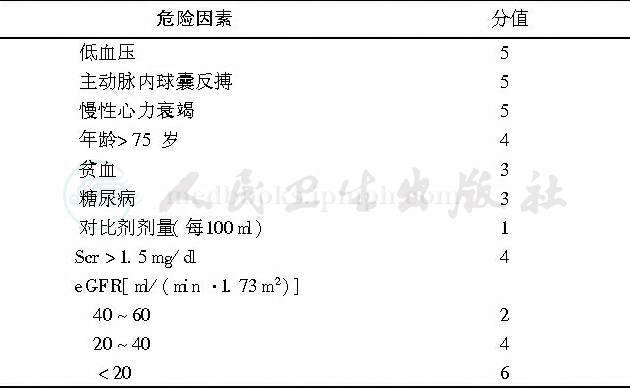
注:1mg/dl=88.4μmol/L;CI-AKI:对比剂致急性肾损伤;Scr:血清肌酐;eGFR:肾小球滤过率估测值;表3、图1同此
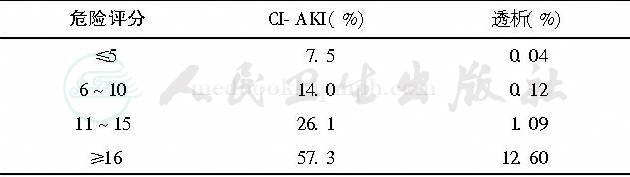
表3 危险评分值与CI-AKI及透析风险[10]
(三)发病机制
CI-AKI的发生是多因素共同参与的结果,但目前尚未完全阐明其发病机制。CI-AKI的核心机制是合并肾脏的基础疾病、肾动脉低灌注和对比剂对肾髓质的损伤。含碘对比剂的渗透压、黏度及对比剂分子对肾管细胞毒性的共同作用是产生药物不良反应的主要原因[12]。
1.肾脏因素
肾功能不全是患者接受心导管介入治疗后发生CI-AKI的独立危险因素。对急性冠状动脉综合症(acute coronary syndrome,ACS)行PCI患者肾功能状态调查发现,接受PCI的ACS患者63.1%已存在不同程度肾功能不全[eGFR<90ml/(min·1.73m2)],其中13.1%的患者为中度以上肾功能不全[eGFR<60ml/(min·1.73m2)][13]。同时,肾脏血流动力学变化也是CI-AKI发生的重要机制[14]。渗透压高于血液的对比剂注射入人体后,可能引起一系列血流动力学改变,初期诱发肾血管一过性舒张,而后很快发生强烈持续收缩,导致肾脏缺血、缺氧。肾髓质对缺氧最敏感,所以损伤最重。对比剂所致的渗透性利尿作用使血容量减少,还可引起血管收缩因子(包括肾素-血管紧张素-醛固酮系统、内皮素、钙离子等)和舒张因子(一氧化氮和前列腺素等)的比例失调,进一步加重肾血管收缩。
2.对比剂因素
渗透效应:在注射对比剂后的第1小时,对比剂对肾小管所造成的渗透负荷非常高,其中以高渗对比剂最为严重。高渗尿液使肾小管内静水压升高,从而降低肾小球滤过压及肾小球滤过率。
黏度的影响[15]:对比剂过高黏度可能会增加肾小管中的液体黏度,造成肾小管梗阻,或增加血液黏度、降低直小动脉灌注压[16]。
(四)预后
大多数行PCI的患者应用对比剂后Scr值增高为一过性,即应用对比剂后的24~48小时内Scr值增高,3天达峰值,7~10天回落到或接近基线水平;其转归与患者肾功能减退及全身状况有关,肾功能严重障碍者可造成不可逆性结果;发生CI-AKI的患者PCI后并发症发生率更高,且增加晚期心血管事件、死亡[17]及透析的风险[18-19]。
三、对比剂的使用原则
(一)绝对禁忌证[20]
对含碘对比剂过敏及未控制的甲状腺功能亢进的患者禁用对比剂。
(二)签署知情同意书[20]
使用含碘对比剂前,建议与患者或其监护人充分沟通并签署“含碘对比剂使用患者知情同意书”,或者将有关对比剂应用的适应证、禁忌证、可能发生的不良反应和注意事项包括在手术签字单中。
(三)限制对比剂最大使用剂量
CI-AKI的发生和对比剂的用量相关,因此应尽量减少对比剂用量[21-22]。冠状动脉造影时,应根据病情需要,在保证造影质量和手术操作的前提下,尽量采取合适的投照体位以减少对比剂总用量,并避免短时间内大量、快速和连续推注对比剂。对慢性闭塞或复杂多支血管病变,应尽量简化PCI治疗方案,控制对比剂推注次数,减少每次用量;对肾功能正常的患者,对比剂用量控制在4~6ml/kg,总量不宜超过300~400ml,并予以充分水化疗法。
2011美国心脏病学会基金会(ACCF)/美国心脏协会(AHA)的不稳定性心绞痛/非ST段抬高型心肌梗死(UA/NSTEMI)患者治疗指南[23]建议:慢性肾病患者可根据肌酐清除率计算,对比剂使用剂量=5ml×体质量(kg)/Cr(mg/dl),限定最大对比剂使用剂量,降低CI-AKI风险。
2011ACCF/AHA/血管造影和介入联合会(SCAI)的PCI治疗指南[24]也指出,在eGFR<60ml/(min·1.73m2)的慢性肾病患者中,尽量减少对比剂的剂量(Ⅰ,B)。肾功能不全患者接受冠状动脉造影和PCI时,原则上对比剂总量不应超过其基础eGFR毫升数的2倍[25]。
(四)对比剂的选择
关于合并慢性肾脏疾病患者接受冠状动脉造影或PCI对比剂的选择,根据2011ACCF/AHA的UA/NSTEMI患者治疗指南及2011ACCF/AHA/SCAI的PCI患者治疗指南,本共识对优先选择何种含碘对比剂不作明确推荐。
(五)使用前预处理
含碘对比剂的存放条件必须符合产品说明书要求,有条件时建议使用前加热到37℃,以降低黏度,便于推注[26],并可提高患者耐受度。
(六)不良反应的处理
1.预防
(1)建议使用非离子型碘对比剂。目前尚无确切证据表明预防性用药可降低过敏反应或不良反应的发生率,故不推荐预防性用药。(2)患者在注射对比剂后需留观30min后离开导管室。
2.处理措施
(1)不良反应轻微,可对症治疗。(2)对于出现气管、支气管痉挛,喉头水肿或过敏性休克等症状者,应判断患者的意识和呼吸情况,立刻给予下述抢救措施:保证患者呼吸道通畅,必要时使用球囊通气;如患者心跳停止,应迅速进行体外人工心脏按压,并根据具体病情,适当给予肾上腺素、升压药、肾上腺糖皮质激素(琥珀酸氢化可的松)、抗过敏药等急救药品[20]。(3)必要时通知麻醉科参加抢救。
四、对比剂致急性肾损伤的预防和治疗措施
预防和治疗措施包括基础肾功能评估、危险分层、水化、控制对比剂用量、药物等,以降低CI-AKI风险。
1.基础肾功能评估
在应用含碘对比剂之前,评估患者基础肾功能有助于指导医生采取恰当的策略,降低CI-AKI的发生率。肾功能评估方法通常有3种:(1)Scr:eGFR或肌酐清除率(CCr)值下降一半后,Scr才升高,Scr敏感度不高,但特异度高。2003及2008年ESUR制定的CI-AKI诊断标准和2007年美国国家肾脏病基金会发起的急性肾脏病损伤网络(AKIN)注册公布的CIAKI诊断标准,均采用Scr进行诊断。(2)eGFR:目前最提倡应用。美国国家肾脏病基金会制定的《肾脏病患者预后及生存质量指导(K/DOQI)》建议eGFR作为肾功能评估的指标,并推荐使用简化的肾脏病膳食改良(modification of diet in renal disease,MDRD)公式计算成人eGFR。MDRD公式的有效性已在不同人群得到验证。根据我国慢性肾脏患者群特征,我国肾脏病学者已将该公式调整改良,使之更适合中国人[27]。专家组建议,所有患者在使用含碘对比剂之前,应使用适合中国人群的改良MDRD公式计算eGFR。
简化的MDRD公式:eGFR[ml/(min·1.73m2)]=186×Scr(mg/dl)-1.154×年龄-0.203×(0.742女性)×(1.21黑人)。
适合中国人群的改良MDRD公式[27]:eGFR[ml/(min·1.73m2)]=175×Scr(mg/dl)-1.234×年龄-0.179×(0.79女性)
紧急情况时,如果使用含碘对比剂行PCI的获益大于可能的危险,可在未评估肾功能的情况下实施PCI操作[28]。
2.术前危险分层[22]
术前评估包括:基础肾功能,病史及药物使用情况。
CI-AKI的高危因素包括:(1)肾功能不全(Scr水平升高),有慢性肾脏病史,MDRD公式估算eGFR<60ml/(min·1.73m2);(2)糖尿病肾病;(3)血容量不足;(4)慢性心力衰竭;(5)使用肾毒性药物(如肾毒性抗生素)及影响肾脏血流动力学的药物(如非甾体类药物);(6)低蛋白血症、低血红蛋白血症;(7)高龄(年龄>70岁);(8)低钾血症;(9)副球蛋白血症;(10)72h内重复使用含碘对比剂或大剂量应用含碘对比剂。
3.水化
动物实验及临床研究均证实,水化是降低CI-AKI发生风险的关键措施[29]。水化增加肾血流量,减少肾血管收缩,减少对比剂在肾脏停留时间,减少管型形成,从而降低CI-AKI发生率。2011ACCF/AHA的UA/NSTEMI患者治疗指南及2011ACCF/AHA/SCAI的PCI治疗指南建议,接受心脏导管介入治疗的患者应采取充分预防性水化措施,预防CI-AKI的发生。
目前提倡静脉应用等渗盐水的水化疗法,尚无充分证据表明口服补液和静脉持续生理盐水输注的效果相当[29-30]。
2010年欧洲心脏病学会(ESC)/欧洲心胸外科学会(EACTS)的心肌血运重建指南[31]和2011ACCF/AHA的UA/NSTEMI患者治疗指南[23]推荐,在血管造影和(或)血管成形术前及术后进行水化可显著降低PCI患者CI-AKI的发生率。
对于中高危患者[eGFR<60ml/(min·1.73m2)]更应注意术前充分水化[32]。推荐水化方法为:造影前3~12小时至造影后6~24小时[23],持续静脉滴注生理盐水[1.0~1.5ml/(min·1.73m2)],保持尿量75~125ml/h,但对心功能不全患者要注意控制补液速度。
4.控制对比剂用量
对肾功能不全患者,应更严格限制冠状动脉造影和PCI时对比剂用量(详见本共识对比剂使用原则中的限制对比剂最大使用剂量)。
本共识专家组系统回顾了CI-AKI的相关文献,结合国内的临床实践经验,共同制定了应用含碘对比剂患者的处理程序(图1)。
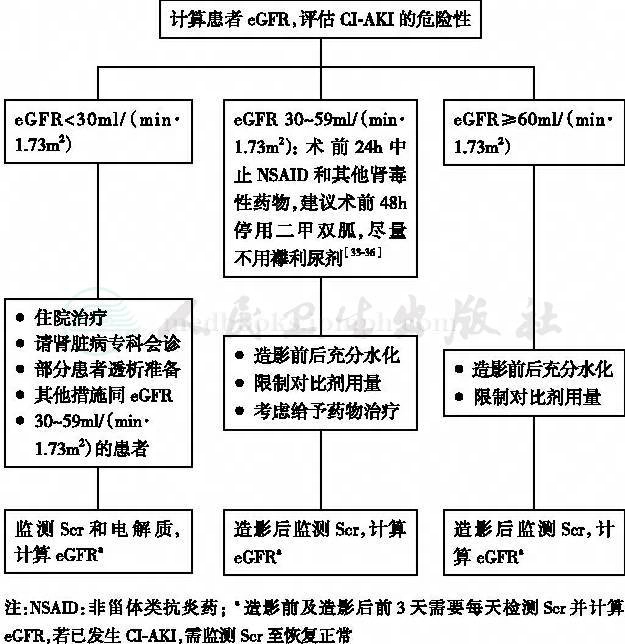
图1 应用含碘对比剂患者的处理程序
5.药物治疗
近年研究表明他汀类药物[37-38]对预防CI-AKI可能有一定效果。2011ACCF/AHA的UA/NSTEMI患者治疗指南建议,经肾脏排泄药物的使用剂量应根据具体药物的药代动力学数据和肾功能情况调整。
五、特殊人群对比剂使用策略
1.冠心病合并糖尿病
糖尿病是CI-AKI的独立预测因子[10,39],急性血糖升高是CI-AKI的危险因素。在原有肾功能损害基础上合并糖尿病可导致CI-AKI危险倍增。eGFR60ml/(min·1.73m2)时,糖尿病进一步增加CI-AKI危险,并增加术后血糖控制及其他合并症治疗的复杂程度,此类患者术中应注意控制对比剂用量。糖尿病合并肾功能不全者CI-AKI的发生率较单纯肾功能不全者更高。
目前认为双胍类药物本身不会导致肾功能衰竭。但如果患者原先已有肾功能不全,或由于使用对比剂引起了急性肾损害,这些高危因素可能导致双胍类药物在体内蓄积并诱发乳酸性酸中毒这一罕见的严重不良反应。因此,本共识同意ESUR指南[2]的建议,对肾功能中度受损的糖尿病患者,在对比剂使用前48小时内停用双胍类降糖药物;充分水化,至少静脉滴注生理盐水100ml/h至术后24小时;密切监测肾功能,确认未发生急性肾损伤或肾功能已恢复到术前水平时,才可重新使用该药。
近期2个荟萃分析(糖尿病患者比例占3%~100%)提示:以动脉途径给药时,等渗对比剂应用后CI-AKI的发生风险可能低于低渗对比剂[40-41]。该问题有待进一步研究。
2.冠心病合并慢性肾功能不全
肾功能不全是PCI术后预后不良的重要预测因素[42]。流行病学调查显示,急慢性肾脏疾病及肾功能不全是使用对比剂后发生死亡的主要原因。相关研究显示,eGFR<60ml/(min·1.73m2)(相当于男性Scr≥1.3mg/dl或115.0μmol/L,女性Scr≥1.0mg/dl或88.4μmol/L)的患者发生CI-AKI的危险显著升高,应特别小心。
鉴于目前水化是唯一被临床研究证实的有效防治措施,提倡使用等渗盐水实施静脉水化疗法,水化量需根据患者心功能情况适当调整;同时,在保证造影质量和手术操作的前提下,尽量控制对比剂用量[43]。
对冠心病合并慢性肾功能不全的患者除围术期水化治疗外,严格控制对比剂用量至关重要。建议对慢性肾病和糖尿病肾病患者两次接触对比剂的时间至少大于72小时。
3.ACS
多项研究结果显示,急诊PCI的CI-AKI发生率较高,Kini等[44]对12997例PCI患者的统计分析显示,CI-AKI发生率为5.9%,其中合并慢性肾脏疾病组CI-AKI发生率为11.3%,Scr正常组为5.1%(P<0.01)。
值得注意的是,发生急性心肌梗死时,由于患者伴发疼痛、出汗、呕吐,常导致体液丢失过多。此外,部分患者同时合并高血压、糖尿病等,术前往往合并肾功能损害或潜在损害。以上因素易导致患者PCI术后发生急性肾损伤或原有肾功能不全恶化。此种情况下,术中应控制对比剂用量,围术期要特别注意对肾脏的综合保护。
4.老年冠心病
PCI在老年冠心病患者中的应用日益普遍,CI-AKI的发生率随增龄亦逐渐增高。老年人冠状动脉及全身动脉病理形态学改变比较严重,冠状动脉多存在多支、迂曲和钙化等复杂病变,PCI术中对比剂需求量相对增多;老年人对对比剂不良反应的代偿能力降低;心脏储备功能下降,合并心功能不全的概率增高。以上因素导致老年患者发生CI-AKI的风险及其危害性增加。
建议在PCI前对老年患者的临床情况综合评估并慎重选择治疗策略,正确的签署知情同意书。应在PCI前评估老年患者肾功能状态;术前术后给予积极有效的水化治疗,若患者全身状况和心功能允许,从术前12小时持续至术后6~24小时静脉给予生理盐水水化[1~1.5ml/(kg·h)];尽可能减少对比剂用量,按照推荐最大对比剂用量=5ml×体质量(kg)/基础Scr(mg/dl),最好控制单次PCI对比剂用量在150ml以内。
5.心力衰竭
临床研究和实践证明,冠心病合并心力衰竭的患者可通过PCI达到血运重建,使心功能得到明显改善。但大剂量对比剂可能加重心力衰竭,甚至发生急性肺水肿。本共识建议应术前综合评估,权衡利弊,选择恰当手术时机,将心功能纠正到最佳状态,选择预期收益大于风险作为实施心血管介入诊疗操作的时机;实施左心室造影和冠状动脉造影过程中,必须常规全程监测生命体征和心电图,并适当对症治疗;合并右心衰竭、肺动脉高压的患者应用对比剂时应仔细计算剂量,特别注意避免右心室流出道注射大剂量对比剂对患者血流动力学产生严重影响。并且,应根据心力衰竭患者的心功能情况进行适当水化治疗,包括水化的剂量宜适度,速度不宜过快,出入量相对平衡等。
六、总结
1.应用对比剂前患者的危险分层对预测或避免CI-AK及其不良后果具有重要意义。
2.水化是预防和治疗CI-AKI的有效措施。
3.控制对比剂用量是预防CI-AKI的根本措施,尤其对慢性肾功能不全、糖尿病、ACS、老年、心力衰竭等高危人群。
4.在术前充分告知患者和家属,并得到其完全理解同意的前提下,签署知情同意书非常重要。
[1]Aspelin P,Bellin MF,Jakobsen J,et al.Classification and terminology//Thomsen HS.Contrast media safety issues and ESUR guidelines.Berlin:Springer,2006:1-4.
[2]Thomsen HS.European Society of Urogenital Radiology(ESUR)guide lines on the safe use of iodinated contrast media.Eur J Radiol,2006,60:307-313.
[3]Lakhal K,Ehrmann S,Chaari A,et al.Acute kidney injury network defi nition of contrast-induced nephropathy in the critically ill:Incidence and outcome.J Crit Care,2011,26:593-599.
[4]Mehta RL,Kellum JA,Shah SV,et al.Acute kidney injury network:re port of an initiative to improve outcomes in acute kidney injury.Crit Care,2007,11:R31.
[5]Nash K,Hafeez A,Hou S.Hospital-acquired renal insufficiency.Am J Kidney Dis,2002,39:930-936.
[6]Nikolsky E,Mehran R,Turcot D,et al.Impact of chronic kidney disease on prognosis of patients with diabetes mellitus treated with percutaneous coronary intervention.AM J Cardiol,2004,94:300-305.
[7]Müller C,Buerkle G,Buettner HJ,et al.Prevention of contrast media-as sociated nephropathy:randomized comparison of2hydration regimens in 1620patients undergoing coronary angioplasty.Arch Intern Med,2002,162:329-336.
[8]Rihal CS,Textor SC,Grill DE,et al.Incidence and Prognostic impor tance of acute renal failure after percutaneous coronary intervention.Cir culation,2002,105:2259-2264.
[9]Lindsay J,Apple S,Pinnow EE,et al.Percutaneous coronary interven tion-associated nephropathy foreshadows increased risk of late adverse events in patients with normal baseline serum creatinine.Catheter Card iovascInterv,2003,59:338-343.
[10]Mchran R,Aymong ED,Nikolsky E,et al.A simple resk score for pre diction of contrast-induced nephropathy after percutaneous coronary in tervention:development and initial validation.J Am Coll Cardiol,2004,44:1393-1399.
[11]Lindsay J,Canos DA,Apple S,et al.Causes of acute renal dysfunction after percutaneous coronary intervention and comparison of late mortali ty rates with postprocedure rise of creatine kinase-MB versus rise of se rum creatinine.Am J Cardiol,2004,94:786-789.
[12]Rudnick MR,Goldfarb S.Pathogenesis of contrast-induced nephropa thy:experimental and clinical observations with an emphasis on the role of osmolality.Rev Cardiovasc Med.2003,4Suppl5:S28-S33.
[13]ACS-PCI患者肾功能状态调查协作组,霍勇,何华.急性冠状动脉综合征接受介入治疗患者肾功能状态多中心注册研究.北京大学学报(医学版),2007,39:624-629.
[14]Lepor NE,Mathur VS.Radiocontrast nephropathy.CurrInterv Cardiol Rep,2000,2:335-341.
[15]Voeltz MD,Nelson MA,McDaniel MC,et al.The important properties of contrast media:focus on viscosity.J Invasive Cardiol,2007,19:1A-9A.
[16]Persson PB,Hansell P,Liss P.Pathophysiology of contrast medium-in duced nephropathy.Kidney Int,2005,68:14-22.
[17]Martin-Paredero V,Dixon SM,Baker JD,et al.Risk of renal failure af ter major angiography.Arch Surg.1983,118:1417-1420.
[18]Gruberg L,Mintz GS,Mehran R,et al.The prognostic implications of further renal function deterioration within48h of interventional coro nary procedures in patients with preexistent chronic renal insufficiency.J Am Coll Cardiol,2000;36:1542-1548.
[19]Nikolsky E,Mehran R,Turcot D,et al.Impact of chronic kidney dis ease on prognosis of patients with diabetes mellitus treated with percu taneous coronary intervention.Am J Cardiol,2004,94:300-305.
[20]中华医学会放射学分会,中国医师协会放射医师分会.对比剂使用指南(第1版).中华放射学杂志.2008,42:320-325.
[21]Marenzi G,Assanelli E,Campodonico J,et al.Contrast volume during primary percutaneous coronary intervention and subsequentcontrast-in duced nephropathy and mortality.Ann Intern Med.2009,150:170-177.
[22]McCullough PA,Wolyn R,Rocher LL,et al.Acute renal failurecoro nary intervention:incidence,risk factors,and relationship tomortality.Am J Med,1997,103:368-375.
[23]Wright RS,Anderson JL,Adams CD,et al.2011ACCF/AHA focused update of the guidelines for the management of patients with unstable angina/non-ST-elevation myocardial infarction(updating the2007 guideline):a report of the American College of Cardiology Foundation/American Heart Association task force on practice guidelines.Circula tion,2011,123:2022-2060.
[24]Levine GN,Bates ER,Blankenship JC,et al.2011ACCF/AHA/SCAI guideline for percutaneous coronary intervention:a report of the Ameri can College of Cardiology Foundation/American Heart Association task force on pracyice guidelines and the society for cardiovascular angiogra phy and interventions.Circulation,2011,124:e574-e651.
[25]Laskey WK,Jenkins C,Selzer F,et al.Volume-to-creatinine clearance ratio:apharmacokinetically based risk factor for prediction of early cre atinine increase after percutaneous coronary intervention.J Am Coll Cardiol,2007,50:584-590.
[26]Klein LW,Sheldon MW,Brinker J,et al.The use of radiographic con trast media during PCI:a focused review:a position statement of the So ciety of Cardiovascular Angiography and Interventions.atheter Cardio vasc Interv.2009,74:728-746.
[27]Ma YC,Li Z,Chen JH,et al.Modified glomeruar filtration rate estima ting equation for chinese patients with chronic kidney disease.J Am Soc Nephrol,2006,17:2937-2944.
[28]周玉杰,胡大一.对比剂肾病中国专家共识//胡大一.心血管疾病防治指南和共识2009.北京:人民卫生出版社,2009:257-294.
[29]Weisbord SD,Palevsky PM.Prevention of contrast-induced nephropa thy with volume expansion.Clin J Am Soc Nephrol,2008,3:273-280.
[30]Merten GJ,Burgess WP,Gray LV,et al.Prevention of contrast-induced nephropathy with sodium bicarbonate:a randomized controlled trial.JAMA.2004,291:2328-2334.
[31]Wijns W,Kolh P,Danchin N,et al.Guidelines on myocardial revascular ization.The task force on myocardial revascularization of the European Society of Cardiology(ESC)and the European Association for Cardio-Thoracic Surgery(EACTS).Eur Heat J,2010,31:2501-2555.
[32]Chen Y,Hu S,Liu Y,et al.Renal tolerability of iopromide and iodix anol in562renally impaired patients undergoing cardiac catheterisation:the DIRECT study.Euro Intervention,2012,22:830-838.
[33]Kelly AM,Dwamena B,Cronin P,et al.Meta-analysis:effectiveness of drugs for preventing contrast-induced nephropathy.Ann Intern Med,2008,148:284-294.
[34]Spargias K,AlcxopoulosE,Kyzopoulos S,et al.Ascorbic acid preven tion contrast-mediated nephropathy in patients with renal dysfunction undergoing coronary angiography or intervention.Criculation,2004,110:2837-2842.
[35]Marenzi G,Assanelli E,Marana I,et al.N-acetylcysteine and contrastinduced nephropathy in primary angioplasty.N Engl J Med,2006,354:2773-2782.
[36]Briguori C,Airoldi F,D’Andrea D,et al.Renal insufficiency following contrast media administration trial(REMEDIAL):a randomized com parison of3preventive strategies.Circulation,2007,115:1211-1217.
[37]Khanal s,Attallah N,Smith DE,et al.Statin therapy reduces contrastinduced nephropathy:an analysis of contemporary percutaneous inter ventions.Am J Med,2005,18:843-849.
[38]Patti G,Nusca A,Chello M,et al.Usefulness of statin pretreatment to prevent contrast-induced nephropathy and to improve long-term out come in patients undergoing percutaneous coronary intervention.Am J Cardiol,2008,101:279-285.
[39]Lautin EM,Freeman NJ,Schoenfeld AH,et al.Radiocontrast-associat ed renal dysfunction:incidence and risk factors.AJR Am J Roentgenol,1991,157:49-58.
[40]Dong M,Jiao Z,Liu T,et al.Effect of administration route on the renal safety of contrast agents:a meta-analysis of randomized controlled tri als.J Nephrol.2012,25:290-301.
[41]McCullough PA,Brown JR.Effects of intra-arterial and intravenousisoosmolar contrast medium(Iodixanol)on the risk of contrast-induced acute kidney injury:a meta-analysis.Cardiorenal Med,2011,1:220-234.
[42]Mueller C,Neumann FJ,Perruchoud AP,et al.Renal functionand long term mortality after unstable angina/non-ST segmentelevation myocar dial infarction treated very early andpredominantly with percutaneoous coronary intervention.Heart,2004,90:902-907.
[43]中华医学会心血管病学分会,中华心血管病杂志编辑委员会.中国经皮冠状动脉介入治疗指南2012(简本).中华心血管病杂志.2012,40:271-277.
[44]Kini AS,Sarkar K,Rafael OC,et al.Serum creatinine ratio:a novel pre dictor of mortality after percutaneous coronary intervention in patients with normal and abnormal renal function.Catheter Cardiovasc Interv.2009,74:49-55.