 去看看
去看看


1 结直肠癌诊疗总则
结直肠癌的MDT诊疗模式
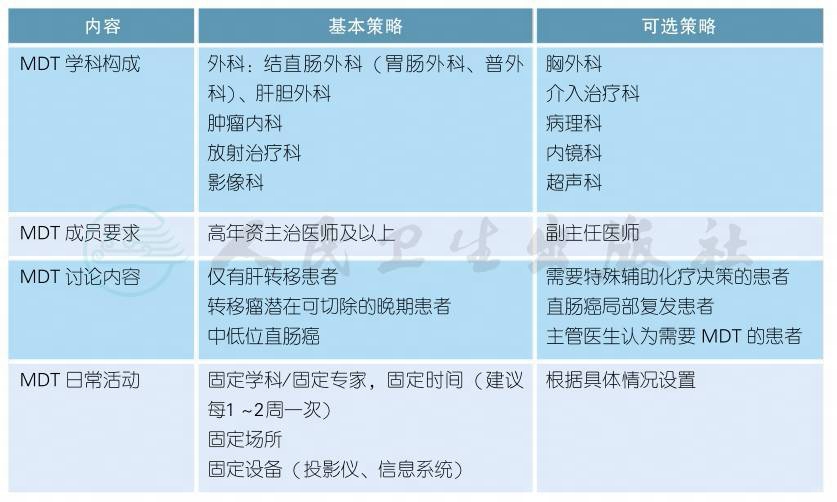
注释
a.结直肠癌的诊治应重视多学科团队(multidisciplinary team,MDT)的作用,推荐有条件的单位将尽可能多的结直肠癌患者,尤其是转移性的结直肠癌患者的诊疗纳入MDT的管理。
b.MDT的实施过程中由多个学科的专家共同分析患者的临床表现、影像、病理和分子生物学资料,对患者的一般状况、疾病的诊断、分期/侵犯范围、发展趋向和预后作出全面的评估,并根据当前的国内外治疗规范/指南或循证医学依据,结合现有的治疗手段,为患者制订最适合的整体治疗策略。
c.MDT原则应该贯穿每一位患者的治疗全程。
d.MDT团队应根据治疗过程中患者机体状况的变化、肿瘤的反应而适时调整治疗方案,以期最大幅度地延长患者的生存期、提高治愈率和改善生活质量。
2 结直肠癌的诊断原则
2.1 无症状健康人群的结直肠癌筛查
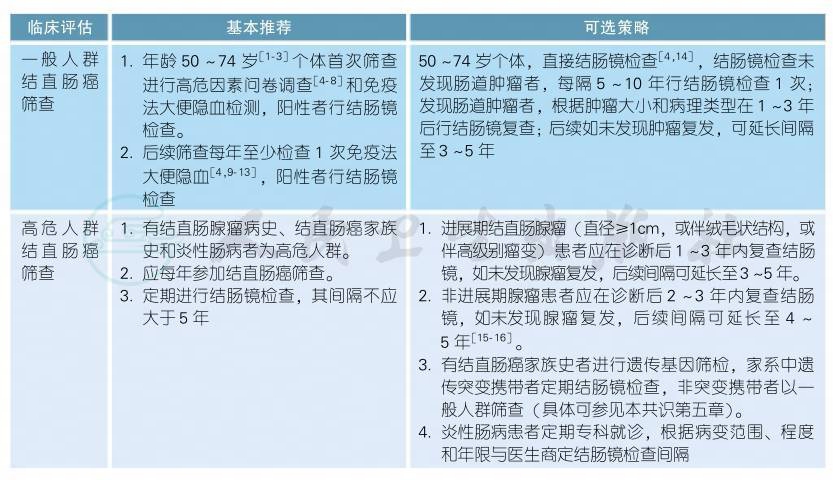
2.2 诊断基本原则
2.2.1 结肠癌的诊断
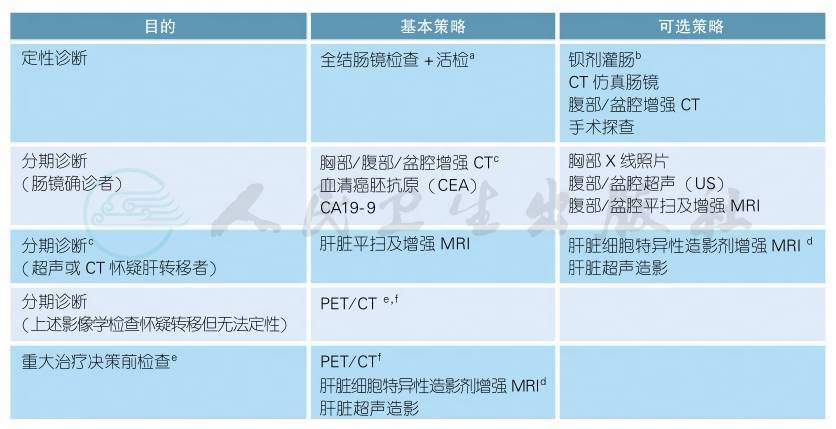
注释:
影像学诊断的更多具体内容详见“影像学检查附录”
a.已知患者存在临床显性肠梗阻,原则上禁止行结肠镜检查,因为结肠镜检查前的肠道准备会加剧梗阻或造成穿孔。
b.如果结肠镜不能完全检查全部结肠,考虑加做钡剂灌肠了解残余肠段情况。肠梗阻患者不应该接受钡剂灌肠检查。
c.应该使用静脉注射和口服对比增强。如果腹腔/盆腔CT不能完成,或患者有CT静脉造影的禁忌证,可以考虑腹/盆腔增强MRI加上非增强胸部CT。推荐CT平扫/增强扫描及多角度重建影像用于判断结肠癌位置、肿瘤浸润深度、肿瘤与周围结构及器官的相对关系、区域淋巴结转移以及周围血管肿瘤侵犯。
d.临床或US/CT检查怀疑肝转移时,尤其肝转移有潜在手术切除机会时,应该行肝脏MRI检查,能最有效确定肝转移瘤的数目、大小及分布[1];有条件者可行肝脏细胞特异性造影剂增强MRI,该方法有助于检出更多的肝内1cm以下的小病灶[2]。
e.指拟行转移瘤手术切除或治疗决策的重大更改时;PET/CT用于发现可能存在的更多转移灶,从而避免了过度手术/治疗[3-5]。
f.不推荐PET/CT作为结肠癌诊断的常规检查手段。
2.2.2 直肠癌的诊断
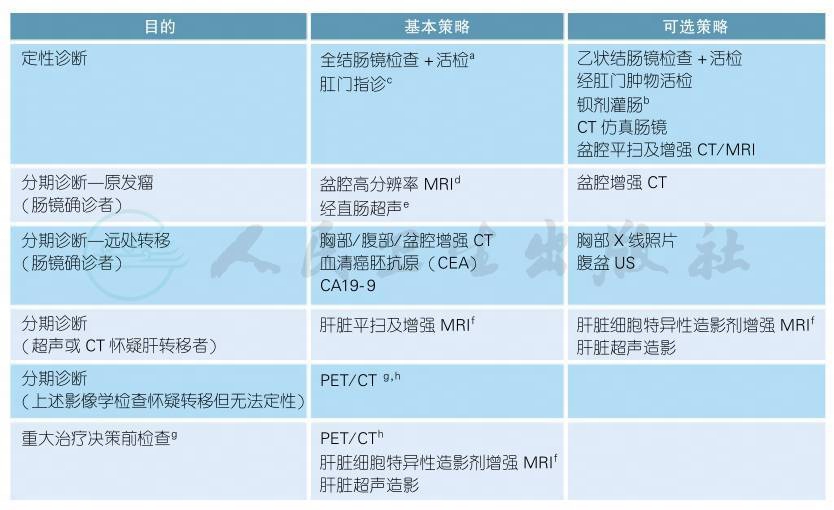
注释:
影像学诊断的更多具体内容详见“影像学检查附录”
a.已知患者存在临床显性肠梗阻,原则上禁止行结肠镜检查,因为结肠镜检查前的肠道准备会加剧梗阻或造成穿孔。
b.如果结肠镜不能完全检查全部结肠,考虑加做钡剂灌肠了解残余肠段情况。肠梗阻患者不应该接受钡剂灌肠检查。
c.强调对所有怀疑直肠癌的患者均应行肛门指诊,尽管不能作为诊断的客观依据。
d.盆腔MRI应被列为所有直肠癌患者分期检查手段[6];对于直肠系膜筋膜 (MRF)的判断,盆腔高分辨率MRI是最优的检查[7-8]。
e.对T分期的判断,直肠内置超声及MRI皆优于CT,T2及以下分期直肠内置超声优于MRI[9]。
f.临床或超声/CT检查怀疑肝转移时,尤其肝转移有潜在手术切除机会者,应该行肝脏MRI检查,能最有效确定肝转移瘤的数目、大小及分布[1];有条件者可行肝脏细胞特异性造影剂增强MRI,该方法有助于检出更多的肝内1cm以下的小病灶[2]。
g.指拟行转移瘤手术切除或治疗决策的重大更改时;PET/CT用于发现可能存在的更多转移灶,从而避免了过度手术/治疗[3-5]。
h.不推荐PET/CT作为直肠癌诊断的常规检查手段。
2.2.3 附录
附录2.2.3-1:
直肠-肛管癌影像学检查的重要参数

直肠-肛管癌影像学检查的重要参数(续表)

附录2.2.3-2:
根据2016年ESMO直肠癌指南,局部进展期直肠癌放化疗前及手术前风险度分层[14]:
1.超低度风险:
T1sm1(-2),N0
2.低度风险:
低位T1-2;中高位T3a(b),N0(orN1如果是高位),MRF阴性,EMVI阴性
3.中等度风险:
低位T2期,中高位T3c以上,N1-2期,EMVI阳性,T4a,但MRF阴性
4.重度风险:
T3且CRM阳性,T4a或T4b,侧方淋巴结转移
附录2.2.3-3:
直肠癌新辅助放化疗效果的MR影像评价标准
此项工作需要临床研究证据进一步证实。轴位小FOV高分辨T2WI非抑脂序列为评价TRG的主要序列。信号定义:肿瘤高于直肠肌层但低于黏膜下层的中等信号;黏液为高于黏膜下层的极高信号;纤维为与肌肉相似的低信号或更低信号。
根据病理Mandard诊断标准得出直肠癌TRG的MRI诊断标准[15]:
1.mrTRG1:
无残余肿瘤。
2.mrTRG2:
大量纤维成分,少量残余肿瘤。
3.mrTRG3:
纤维/黏液成分与残余肿瘤各占约50%。
4.mrTRG4:
少量纤维/黏液成分,大部分为残余肿瘤。
5.mrTRG5:
肿瘤未见明确变化。
2.3 病理学诊断原则
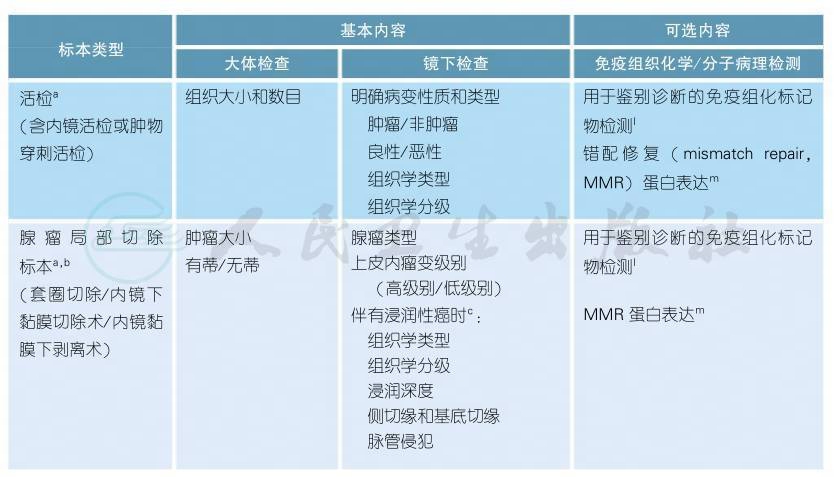
病理学诊断原则(续表)

注释
a.所有标本应及时固定(离体30min内固定最佳),使用新鲜的3.7%中性缓冲甲醛固定液,固定液的量应为组织的10倍,固定时间8~48h。
b.标本应由内镜或手术医师充分展开标本,黏膜面向上,在标本边缘用大头针固定于软木板或泡沫板上钉板固定。应每隔2~3mm垂直于黏膜面切开全部取材。
c.“腺瘤伴浸润性癌”是指腺瘤含有穿透黏膜肌层浸润到黏膜下层的腺癌。“腺瘤伴高级别上皮内瘤变”包括了腺瘤伴重度异形增生、原位癌和黏膜内癌。“高级别腺癌”、“肿瘤距离切缘小于1mm”和“脉管侵犯”为预后不良因素[1]。
d.根治术标本,通常沿肿瘤对侧剪开肠管后固定,建议钉板固定。
e.全直肠系膜切除术(total mesorectal excision,TME)的直肠癌标本,系膜完整性评估标准见附表1[2-3]。
f.“环周切缘”是指没有腹膜覆盖的肠壁“基底”切缘,建议手术医生在环周切缘处涂色或加以标识。“环周切缘阳性”是指肿瘤距离切缘小于或等于1mm[4]。
g.淋巴结按淋巴引流方向进行取材并分组(肠旁、中间、中央),未经新辅助治疗的根治术标本,检出淋巴结总数原则上不少于12枚。若第一次未找到12枚淋巴结,建议复检。
h.结直肠癌组织学分型参考WHO消化系统肿瘤分类2010版[5],见附表2。
i.组织学分级包括传统的4级分法和WHO分类的2级分法,详见附表3。
j.TNM病理分期(pTNM)采用AJCC/UICC第7版[6],详细参见“2.4结直肠癌的分期”。pTNM前加前缀m、r和y分别代表多发性原发肿瘤、复发性肿瘤和治疗后肿瘤的TNM病理分期。
k.肿瘤退缩分级(TRG)的病理学评估依据残留肿瘤成分以及纤维化程度进行分析。推荐使用AJCC第7版TRG评分系统,见附表4。
l.根据鉴别目标选取,结直肠腺癌典型的免疫表型为CK 7-/CK 20+/CDX 2+。
m.错配修复(MMR)蛋白的检测:免疫组织化学方法检测4个常见MMR蛋白(MLH1、MSH2、MSH6和PMS2)的表达,阳性表达定位于细胞核。
n.微卫星不稳定(MSI):建议采用美国国家癌症研究院(NCI)推荐的5个微卫星(MS)检测位点(BAT25,BAT26,D5S346,D2S123,D17S250),判断标准为三级:MSS微卫星稳定,MSI-L微卫星低度不稳定,MSI-H微卫星高度不稳定。
o.RAS基因突变检测:采用DNA直接测序法或ARMS法,检测位点包括KRAS和NRAS基因的第2、3、4号外显子。检测样本采用原发瘤或转移瘤标本均可。
p.BRAF基因突变检测:检测BRAF V 600E突变,原发瘤或转移瘤标本均可。
附表1 直肠系膜完整性的判定标准

附表2 结直肠癌WHO组织学分型

结直肠癌WHO组织学分型(续表)

附表3 组织学分级与组织学分型的关系

附表4 TRG评分
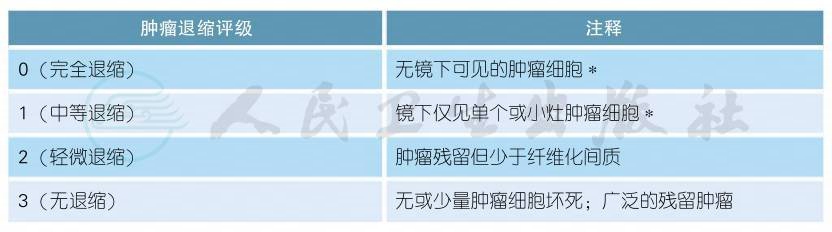
注:TRG评分仅限于原发肿瘤病灶;
∗肿瘤细胞是指存活的细胞,不包括退变、坏死细胞;
无细胞成分的黏液湖不能被评估为肿瘤残留
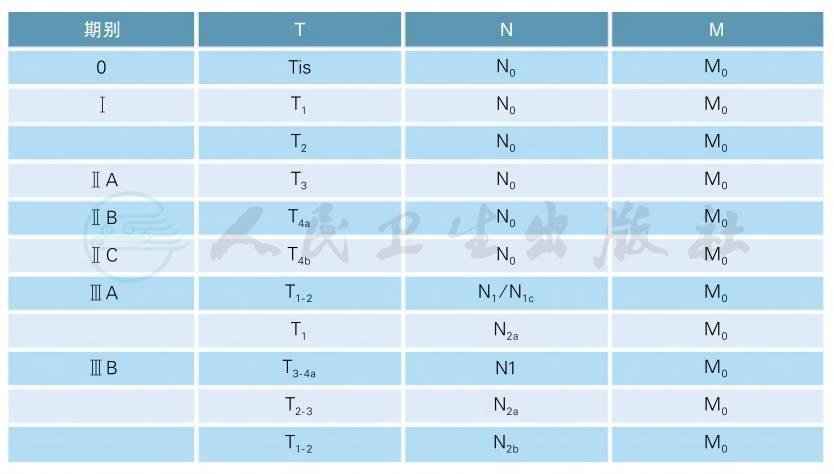
2.4 分期
本指南采用UICC/AJCC TNM分期系统(2010年第7版)[1],详细内容如下:
2.4.1 T、N、M的定义
原发肿瘤(T)
Tx 原发肿瘤无法评价
T0 无原发肿瘤证据
Tis原位癌:局限于上皮内或侵犯黏膜固有层
T1 肿瘤侵犯黏膜下层
T2 肿瘤侵犯固有肌层
T3 肿瘤穿透固有肌层到达结直肠旁组织
T4a 肿瘤穿透腹膜脏层
T4b 肿瘤直接侵犯或粘连于其他器官或结构区域淋巴结(N)
Nx 区域淋巴结无法评价
N0 无区域淋巴结转移
N1 有1~3枚区域淋巴结转移
N1a 有1枚区域淋巴结转移
N1b 有2~3枚区域淋巴结转移
N1c 浆膜下、肠系膜、无腹膜覆盖结肠/直肠周围组织内有肿瘤种植(tumor deposit,TD),无区域淋巴结转移
N2 有4枚以上区域淋巴结转移
N2a 4~6枚区域淋巴结转移
N2b 7枚及更多区域淋巴结转移
远处转移(M)
Mx 远处转移无法评价
M0 无远处转移
M1 有远处转移
M1a 远处转移局限于单个器官或部位(如肝、肺、卵巢、非区域淋巴结)
M1b 远处转移分布于一个以上的器官/部位或腹膜转移
2.4.2 解剖分期/预后组别
解剖分期/预后组别(续表)
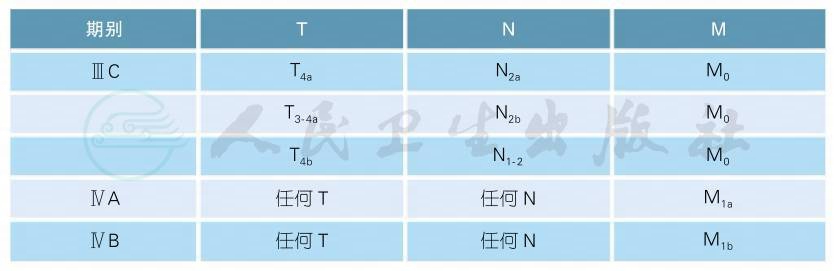
2.4.3 说明
Tis:包括肿瘤细胞局限于腺体基底膜(上皮内)或黏膜固有层(黏膜内),未穿过黏膜肌层到达黏膜下层。
T4b:T4b的直接侵犯包括穿透浆膜侵犯其他肠段,并得到镜下诊断的证实(如盲肠癌侵犯乙状结肠),或者位于腹膜后或腹膜下肠管的肿瘤,穿破肠壁固有基层后直接侵犯其他的脏器或结构,例如降结肠后壁的肿瘤侵犯左肾或侧腹壁,或者中下段直肠癌侵犯前列腺、精囊腺、宫颈或阴道。肿瘤肉眼上与其他器官或结构粘连则分期为cT4b。但是,若显微镜下该粘连处未见肿瘤存在则分期为pT3。
V和L亚分期:用于表明是否存在血管和淋巴管浸润,而PN则用以表示神经浸润。
前缀:cTNM是临床分期,pTNM是病理分期;前缀y用于接受新辅助治疗后的肿瘤分期(如ypTNM),病理学完全缓解的患者分期为ypT0N0cM0,可能类似于0期或1期。前缀r用于经治疗获得一段无瘤间期后复发的患者(rTNM)。
3 结肠癌的治疗原则
3.1 非转移性结肠癌的治疗
3.1.1 可切除结肠癌的治疗
3.1.1.1 内镜治疗
3.1.1.1.1 内镜治疗策略
结肠腺瘤或部分T1期结肠腺癌可采用内镜下治疗。

结肠腺瘤或部分T
1期结肠腺癌可采用内镜下治疗(续表)

注:内镜下黏膜切除术 (endoscopic mucosal resection,EMR);内镜下黏膜下切除术 (endoscopic submucosal dissection,ESD);分步内镜下黏膜切除术 (piecemeal endoscopic mucosal resection,PEMR)
注释
a.所有无蒂息肉或怀疑癌变的息肉,均建议在明确病理后再决定是否镜下切除。各种特殊内镜检查方法有助于判断息肉的良恶性。
b.在T1(SM)癌内镜治疗后,不仅局部行结肠镜检查,同时需检测肿瘤标志物癌胚抗原(CEA)、腹部超声、胸部和腹部CT[1]。
c.确定治愈性内镜下切除T1结直肠癌组织学标准:①黏膜下浸润小于1000μm的病变;②缺乏淋巴血管侵犯的情况;③肿瘤分化好;④无肿瘤萌芽;⑤肿瘤距切缘≥1mm[2-3]。
d.当切缘无法判断阴性还是阳性时,建议在3~6个月之内复查内镜。如果切缘阴性可以在内镜治疗后1年内复查[4-5]。
e.较大的病变可能需要分步内镜下黏膜切除术(PEMR),但PEMR局部复发率较高,需加强监测[6]。
f.参见“3.1.1.2手术治疗”部分。
3.1.1.1.2 息肉镜下切除术后的处理策略
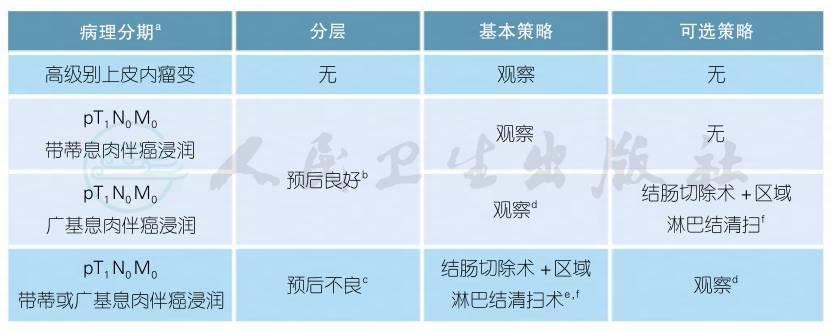
注释
a.详见“2.3病理学诊断原则”。
b.具备以下全部因素[1]:标本完整切除,切缘阴性,且组织学特征良好(包括1或2级分化,无血管、淋巴管浸润)。
c.具备以下因素之一[1]:标本破碎,切缘未能评估或阳性(距切缘1mm内存在肿瘤或电刀切缘可见肿瘤细胞[1-3]),具有预后不良的组织学特征(包括3/4级分化,血管/淋巴管浸润)。
d.需告知患者:广基癌性息肉发生不良预后事件的比率会显著增加,包括疾病复发、病死率和血源性播散,主要与内镜下切除后切缘阳性有较大关系[4-7]。
e.预后不良者建议行结肠切除和区域淋巴清扫[1,8-9]。
f.所有的局部切除术或结肠切除术均可选择传统开腹手术或腹腔镜、机器人手术,取决于当地的技术和设备可获得性。
3.1.1.2 手术治疗
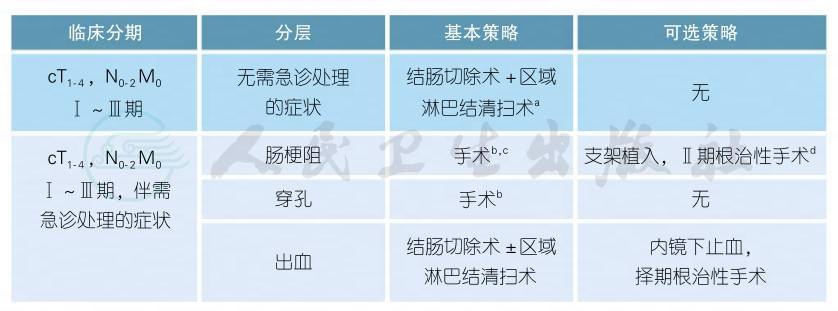
注释
a.根治性手术方式是结肠切除加区域淋巴结整块清扫[1-2]。肿瘤血管起始部的根部淋巴结及清扫范围外的可疑转移淋巴结也应切除或活检。只有完全切除的手术才能认为是根治性的[3-4]。
b.可选的手术方式包括:Ⅰ期切除吻合,或Ⅰ期切除吻合+近端保护性造口,或Ⅰ期肿瘤切除近端造口远端闭合,或造瘘术后Ⅱ期切除。
c.梗阻者不建议腹腔镜手术。
d.肠道支架通常适用于远端结肠的病灶,并且放置后能使近端结肠减压,从而择期结肠切除时能一期吻合的病例[5]。
e.视腹腔污染程度选择,手术方式同b,充分冲洗引流。
3.1.1.3 术后辅助化疗
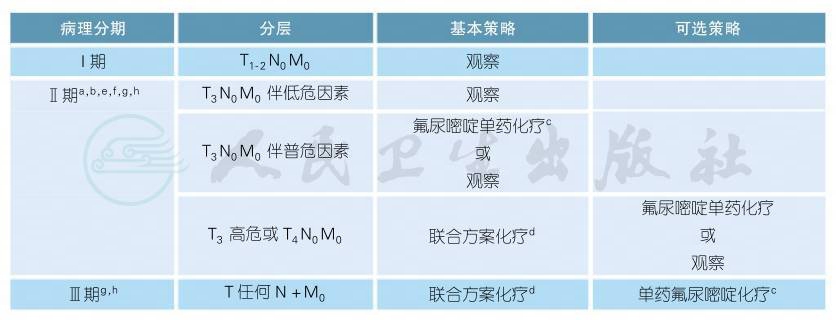
注释
a.Ⅱ期患者:高危因素[1],包括T4(ⅡB、ⅡC期)、组织学分化差(3/4级,不包括MSI-H者)、脉管浸润、神经浸润、肠梗阻、肿瘤部位穿孔、切缘阳性或情况不明、切缘安全距离不足、送检淋巴结不足12枚。低危因素指MSI-H(微卫星高度不稳定性)或dMMR(错配修复蛋白缺失)。普危因素指既没有高危因素也没有低危因素者。
b.根据MOSAIC试验及使用奥沙利铂后可能的远期后遗症,FOLFOX方案不适合用于无高危因素的Ⅱ期患者辅助治疗[2]。
c.推荐的单药氟尿嘧啶方案包括:口服卡培他滨(首选),5-FU/LV持续静脉输注双周方案。
d.推荐的联合化疗方案包括:XELOX(又称CapeOx)和mFOLFOX6。
e.所有Ⅱ期患者均应考虑进行错配修复蛋白(MMR)检测,详细信息参见“2.3病理学诊断原则”。MMR蛋白缺失或MSI-H(高度微卫星不稳定)的Ⅱ期患者可能预后较好,且不会从单药5-FU的辅助化疗中获益[3]。
f.辅助化疗的具体方案需要综合考虑年龄、身体状况、合并基础疾病等;尚无证据显示增加奥沙利铂至5-FU/LV可以使70岁或以上的患者受益[2]。
g.术后身体恢复后应尽快开始辅助化疗,一般在术后3周左右开始,不应迟于术后2个月。辅助化疗总疗程一共为6个月。
h.除临床试验外,不推荐在辅助化疗中使用如下药物:伊立替康、TAS-102和所有的靶向药物(包括贝伐珠单抗、西妥昔单抗、帕尼单抗、阿柏西普、瑞戈非尼等)。
3.1.1.4 附:常用的结肠癌术后辅助化疗方案
氟化嘧啶为基础的单药方案
卡培他滨
卡培他滨每次1250mg/m2,每日2次,口服,第1~14天
每3周重复,共24周
简化的双周5-FU输注/LV方案(sLV5FU2)
LV 400mg/m2静脉滴注2h,第1天
随后5-FU 400mg/m2静脉推注,然后1200mg/(m2•d) ×2d,持续静脉输注(总量2400mg/m2,输注46~48h)
每2周重复,共24周
联合化疗方案
CapeOX
奥沙利铂130mg/m2,静脉输注2h,第1天
卡培他滨每次1000mg/m2,每日2次,第1~14天
每3周重复,共24周
mFOLFOX6
奥沙利铂85mg/m2静脉输注2h,第1天
LV 400mg/m2静脉输注2h,第1天
5-FU 400mg/m2静脉推注,第1天,然后1200mg/(m2•d) ×2d,持续静脉输注
(总量2400mg/m2,输注46~48h)
每2周重复,共24周
3.1.2 不可切除结肠癌的治疗
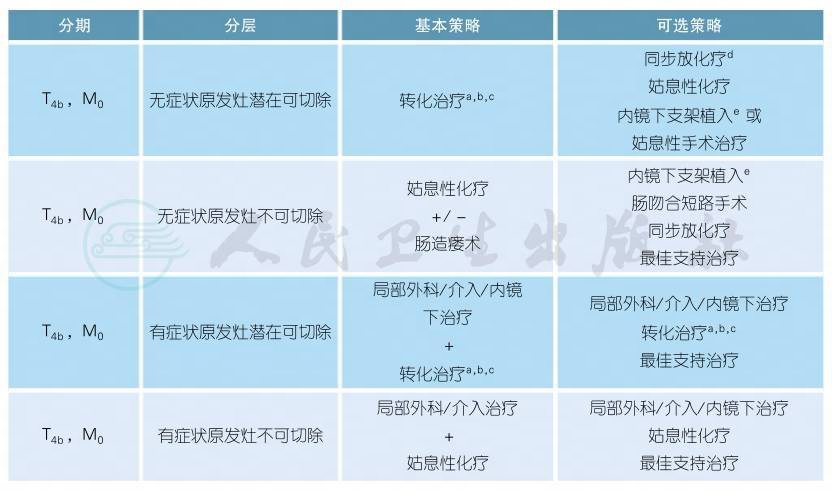
注释
3.2 转移性结肠癌治疗原则
3.2.1 同时性转移性结肠癌
3.2.1.1 初始可切除转移性结肠癌的治疗a
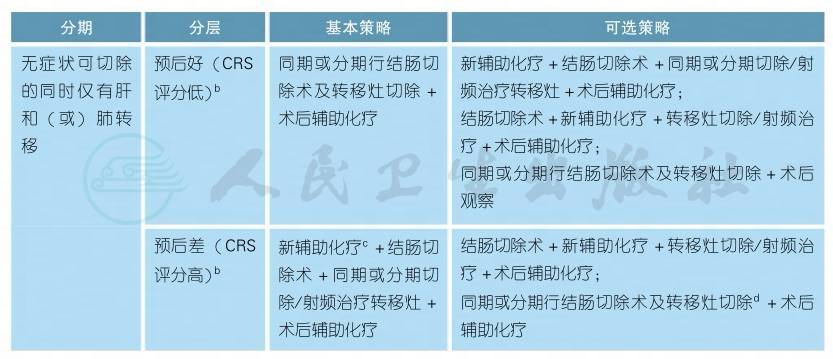
初始可切除转移性结肠癌的治疗a(续表)

注释
a.可切除的转移性结肠癌,外科手术切除是潜在根治的治疗方法。技术要求:足够的残留肝脏体积,切缘达到R0切除[1]。
b.复发风险评分(CRS)的五个参数:原发肿瘤淋巴结状态,无病生存时间,肝转移肿瘤数目>1个,术前CEA水平>200ng/ml和转移肿瘤最大直径>5cm,每个项目为1分。如果CRS评分越高,围术期化疗越有获益[2-3]。如肝脏转移灶数目大于5个,请参见初始不可切除结肠癌部分。
c.新辅助化疗可减小术前肿瘤的体积及降低体内微小转移的发生,可提高手术根治性切除率[4]。为了限制药物性肝损害发生,新辅助化疗的疗程一般限于2~3个月。新辅助化疗方案根据患者个体情况可选择奥沙利铂为基础的方案(FOLFOX/CapeOx)或伊立替康为基础的方案(FOLFIRI)。
d.对于同时性转移性结肠癌的手术治疗包括原发灶优先还是转移灶优先,取决于影响患者生存和生活质量的主要因素,如转移灶是主要影响因素可先行转移灶切除术,再行原发灶切除术[4]。
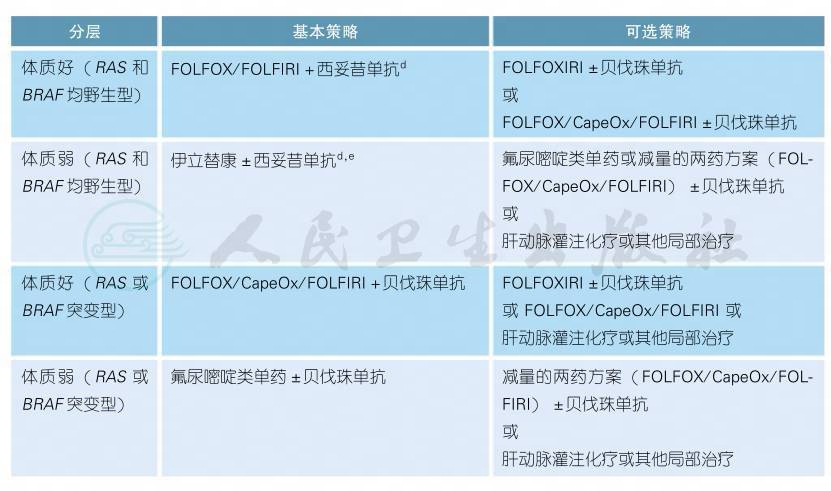
3.2.1.2 初始不可切除转移性结肠癌的治疗

对于所有拟接受全身系统治疗的初始不可切除转移性结肠癌患者可根据转移灶是否有潜在根治性切除可能分为:潜在可切除组和姑息治疗组。该类患者尤其应在MDT团队指导下进行全程管理和治疗。
潜在可切除组治疗a,b,c
姑息治疗组一线方案c
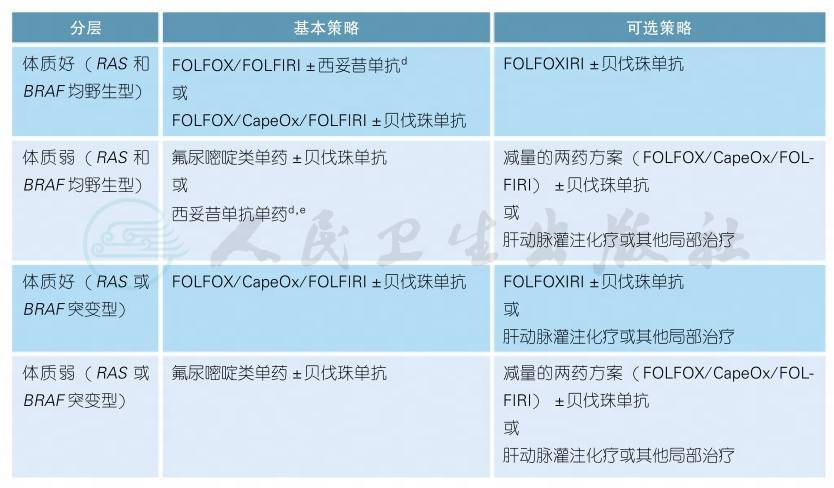
姑息治疗组二线方案
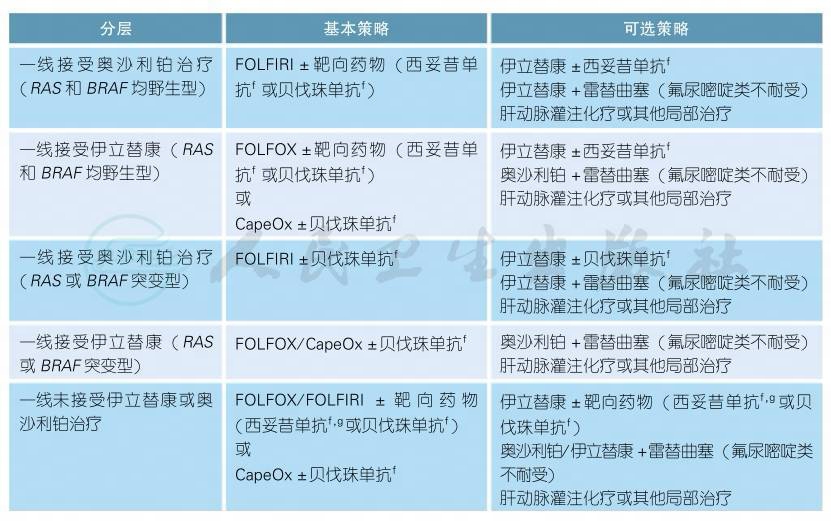
姑息治疗组三线方案

注释
a.对于潜在可切除的患者:应选用5-FU/LV(或卡培他滨)联合奥沙利铂或伊立替康的方案[1,2]加分子靶向治疗,或高选择性患者可谨慎使用强力的FOLFOXIRI±贝伐珠单抗方案[3]。转化成功获得原发灶和转移灶R0切除的患者,一般建议术后继续辅助化疗完成围术期总共半年的治疗。如术前联合了靶向药物有效,术后是否继续应用靶向药物目前尚存在争议。
b.转化治疗应密切评估转移灶可切除性,建议每6~8周行一次影像学评估,如转移灶转变成可切除时,即予以手术治疗。
c.维持治疗:潜在可切除组如果接受转化治疗超过半年后转移灶仍无法R0切除,姑息治疗组一线治疗4~6个月后疾病有效或稳定但仍然没有R0手术机会者,可考虑进入维持治疗[如采用毒性较低的5-FU/LV或卡培他滨单药联合靶向治疗(贝伐珠单抗的数据比较完善)]或暂停全身系统治疗,以降低持续高强度联合化疗的毒性反应[4-5]。
d.近期有较多回顾性研究数据表明原发瘤位于右侧(回盲部到脾曲)的转移性结直肠癌预后明显差于左侧者(自脾曲至直肠),EGFR单抗(西妥昔单抗)在右侧转移性结直肠癌的获益甚微;暂未观察到VEGF单抗(贝伐珠单抗)的疗效与部位存在关联。头对头的比较研究数据显示:右侧转移性结直肠癌中VEGF单抗的疗效优于EGFR单抗,而在左侧转移性结直肠癌中EGFR单抗疗效优于VEGF单抗[6]。
e.不推荐使用卡培他滨联合西妥昔单抗治疗[1]。不推荐卡培他滨联合伊立替康治疗。
f.若姑息一线化疗联合西妥昔单抗治疗,不推荐二线继续行西妥昔单抗治疗。若一线化疗联合贝伐珠单抗治疗,二线可考虑更换化疗方案联合继续贝伐珠单抗治疗[7]。
g.RAS及BRAF应均为野生型患者可考虑行西妥昔单抗治疗。
h.继获得美国FDA和欧盟EMEA批准之后,瑞戈非尼于2017年3月24日被中国CFDA(国家食品药品监督管理总局)批准作为氟尿嘧啶、奥沙利铂、伊立替康,或抗VEGF、抗EGFR靶向药物等现有标准治疗失败后的三线用药,以中国为主的亚洲临床研究(CONCUR)证明了瑞戈非尼的生存期延长较西方人群更有优势[8]。
3.2.3 附:转移性结直肠癌的常用全身治疗方案
FOLFOX
mFOLFOX6
奥沙利铂85mg/m2静脉输注2h,第1天
LV 400mg/m2静脉输注2h,第1天
5-FU 400mg/m2静脉推注,第1天,然后1200mg/(m2•d)×2d持续静脉输注
(总量2400mg/m2,输注46~48h)
每2周重复
mFOLFOX6+贝伐珠单抗
奥沙利铂85mg/m2静脉输注2h,第1天
LV 400mg/m2静脉输注2h,第1天
5-FU 400mg/m2静脉推注,第1天,然后1200mg/(m2•d)×2d持续静脉输注
(总量2400mg/m2,输注46~48h)
贝伐珠单抗5mg/kgⅣ,第1天
每2周重复
mFOLFOX6+西妥昔单抗
奥沙利铂85mg/m2静脉输注2h,第1天
LV 400mg/m2静脉输注2h,第1天
5-FU 400mg/m2静脉推注,第1天,然后1200mg/(m2•d)×2d持续静脉输注
(总量2400mg/m2,输注46~48h)
西妥昔单抗400mg/m2Ⅳ,第一次注射大于2h,然后250mg/m2Ⅳ,第1天,注射超过60min,每周重复一次
或者西妥昔单抗500mg/m2Ⅳ,第1天,注射超过2h,每2周重复一次
CapeOX
奥沙利铂130mg/m2Ⅳ大于2h,第1天
卡培他滨每次1000mg/m2,每天2次,口服,第1~14天,随后休息7d
每3周重复
CapeOX+贝伐珠单抗
奥沙利铂130mg/m2Ⅳ大于2h,第1天
卡培他滨1000mg/(m2•d),每天2次,口服,第1~14天,随后休息7d
贝伐珠单抗7.5mg/kgⅣ,第1天
每3周重复
FOLFIRI
伊立替康180mg/m2静脉输注大于30~90min,第1天
LV 400mg/m2静脉输注2h,配合伊立替康注射时间,第1天
5-FU 400mg/m2静脉推注,第1天,然后1200mg/(m2•d)×2d持续静脉输注
(总量2400mg/m2,输注46~48h)
每2周重复
FOLFIRI+贝伐珠单抗
伊立替康180mg/m2静脉输注大于30~90min,第1天
LV 400mg/m2静脉输注2h,配合伊立替康注射时间,第1天
5-FU 400mg/m2静脉推注,第1天,然后1200mg/(m2•d)×2d持续静脉输注
(总量2400mg/m2,输注46~48h)
贝伐珠单抗5mg/kg静注,第1天
每2周重复
FOLFIRI+西妥昔单抗
伊立替康180mg/m2静脉输注大于30~90min,第1天
LV 400mg/m2静脉输注2h,配合伊立替康注射时间,第1天
5-FU 400mg/m2静脉推注,第1天,然后1200mg/(m2•d)×2d持续静脉输注
(总量2400mg/m2,输注46~48h)
每2周重复
西妥昔单抗400mg/m2第一次静注超过2h,然后250mg/m2静注,第1天,注射超过60min,每周重复一次
或西妥昔单抗500mg/m2静注,第1天,注射超过2h,每2周重复一次
卡培他滨
1250每次mg/m2,口服,每天2次,第1~14天;每3周重复
卡培他滨+贝伐珠单抗
1250每次mg/m2,口服,每日2次,第1~14天;每3周重复
贝伐珠单抗7.5mg/kg,Ⅳ,第1天,每3周重复
简化的双周5-FU输注/LV方案(sLV5FU2)
LV 400mg/m2静脉滴注2h,第1天
随后5-FU 400mg/m2静脉推注,然后1200mg/(m2•d)×2d持续静脉输注
(总量2400mg/m2,输注46~48h)
每2周重复
FOLFOXIRI±贝伐珠单抗
伊立替康165mg/m2,静脉输注,第1天;奥沙利铂85mg/m2,静脉输注,第1天;LV 400mg/m2,静脉输注,第1天,然后5-FU 1600mg/(m2•d)×2d,持续静脉输注 (总量3200mg/m2,输注48h),第1天开始;
贝伐珠单抗5mg/kgⅣ,第1天;
每2周重复
伊立替康
伊立替康125mg/m2静脉输注30~90min,第1、8天,每3周重复
伊立替康300~350 mg/m2静脉输注30~90min,第1天,每3周重复
西妥昔单抗±伊立替康
西妥昔单抗首次剂量400mg/m2输注,然后250mg/m2,每周1次
或西妥昔单抗500mg/m2,每2周1次
伊立替康300~350mg/m2静脉输注,每3周重复
或伊立替康180mg/m2静脉输注,每2周重复
或伊立替康125mg/m2静脉输注,第1、8天,每3周重复
西妥昔单抗
西妥昔单抗首次剂量400mg/m2输注,然后250mg/m2,每周1次
或西妥昔单抗500mg/m2,每2周1次
瑞戈非尼
瑞戈非尼160mg,口服,每日1次,第1~21天,每28d重复
雷替曲塞
3mg/m2,静脉输注(+50~250ml 0.9%氯化钠注射液或5%葡萄糖注射液),给药时间15min
每3周重复
3.3 结肠癌的随访
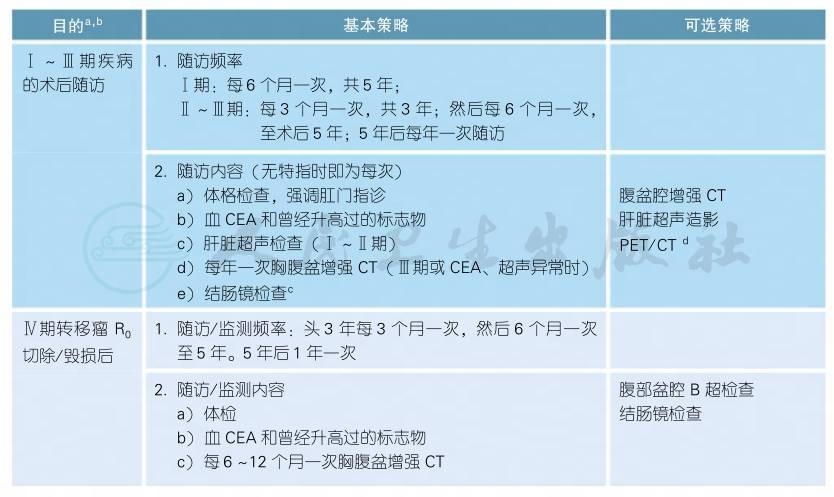
注释
a.随访/监测的主要目的是发现那些还可以接受潜在根治为目的治疗的转移复发;没有高级别循证医学证据来支持什么样的随访/监测策略是最佳的。
b.如果患者身体状况不允许接受一旦复发而需要的抗癌治疗,则不主张对患者进行常规肿瘤随访/监测。
c.肠镜检查的策略[1]:推荐术后1年内进行结肠镜检查,如果术前因肿瘤梗阻无法行全结肠镜检查,术后3~6个月检查;每次肠镜检查若发现进展期腺瘤(绒毛状腺瘤,直径大于1cm,或有高级别不典型增生),需在1年内复查,若未发现进展期腺瘤,则3年内复查,然后每5年一次。
d.PET/CT仅推荐用于临床怀疑复发,但常规影像学阴性的时候,比如持续CEA升高;不推荐将PET列为常规随访/监测手段。
4 直肠癌的治疗原则
4.1 非转移性直肠癌的治疗原则
4.1.1 直肠腺瘤的治疗原则a,c

注释
a.“3.1.1.1.1内镜治疗策略”里的所有原则均适用于直肠腺瘤的治疗。
b.TEM是一种借助特殊器械经肛门切除肿瘤的手术方法,可以对更近端的直肠病灶进行切除(20cm以内),其优点为直视下进行全层切除术和缝合术[1-2]。
c.直肠腺瘤局部切除术后的处理参见“3.1.1.1.2息肉镜下切除术后的处理策略”。
4.1.2 cT1-2N0直肠癌的治疗原则

cT
1-2N
0直肠癌的治疗原则(续表)

注释
a.适用于患者对保留肛门括约肌有强烈愿望、不愿意接受APR(腹会阴联合切除术)者;
b.直肠癌根治术
1)中低位直肠癌应该行全直肠系膜切除术(TME)[1],高位直肠癌行广泛系膜切除术(切除肿瘤下缘至少5cm的直肠系膜),不建议常规扩大清扫范围至髂血管旁淋巴结,除非临床怀疑有转移。
2)腹腔镜/机器人辅助的直肠癌根治术:目前并不是直肠癌手术的金标准,仍有争议,有待进一步评估,建议在有经验的中心谨慎开展。
c.局部切除术后病理检查具有以下情况之一时,需要挽救性直肠癌根治术:肿瘤组织学分化差、脉管浸润、切缘阳性、肿瘤浸润超过黏膜下肌层外1/3(sm3级)或T2期肿瘤[2-3]。如不接受挽救性手术,应行放化疗。
4.1.3 cT3/CT4N+直肠癌的治疗原则
此部分内容适用于距肛缘10cm以下的中低位直肠癌。10cm以上的高位直肠癌,治疗原则参见结肠癌。
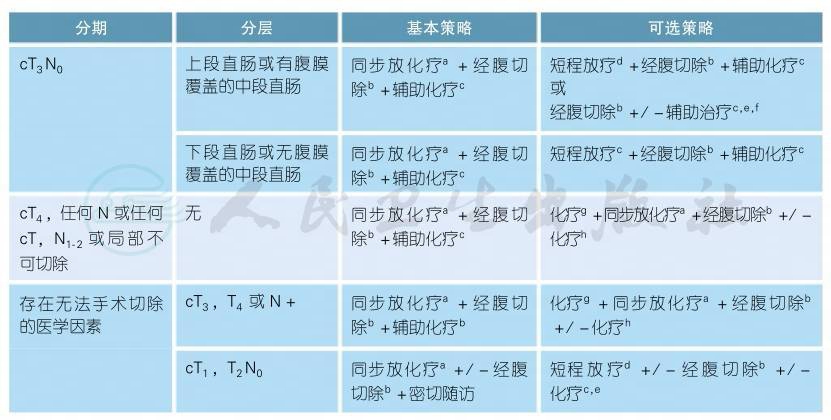
续表
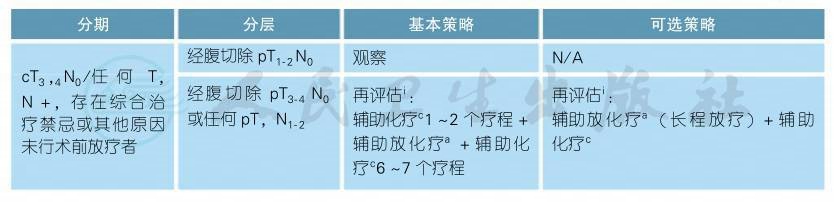
注释
a.术前同步放化疗+手术+辅助化疗的治疗策略仍是中低位局部晚期直肠癌(Ⅱ、Ⅲ期)的标准治疗策略[1-8],详见附录。不建议临床试验以外直肠癌放疗同时应用奥沙利铂[9-12]、伊立替康、贝伐珠单抗、西妥昔单抗或帕尼单抗。照射范围肿瘤放射治疗学组(RTOG)盆腔轮廓图谱(可在线获取https://www.rtog.org/CoreLab/Contouring Atlases.aspx)可供参考[13]。
b.长程放化疗后等待5~12周的间歇期再行手术治疗,以便患者能从术前放化疗毒性中恢复。
c.术后辅助化疗可参考结肠癌“3.1.1.3术后辅助化疗”。
d.建议行多学科讨论是否采用短程放疗[14-17],主要考虑其降期的必要性和可能的长期毒性反应。短程放疗具体方案为5∗5Gy,每天1次,每次5Gy,共5d,连续照射,建议行3D-CRT或IMRT技术。放疗后1周内进行根治手术,不推荐同期应用化疗药物,包括靶向治疗药物。
e.辅助治疗根据术后病理判断,如果为T1N0或T2N0,则无需辅助化疗。所有接受术前辅助治疗的患者,均应接受术后辅助治疗,总的辅助治疗的疗程推荐为6个月[18]。
f.考虑到放化疗带来的毒性,对于局部复发低风险的直肠癌患者可采用手术+辅助化疗的治疗方案。
g.术前化疗+放化疗+手术的治疗策略来自少数Ⅱ期或回顾性研究[19-20],可以作为一种治疗选择,目前首选治疗仍是术前同期放化疗+手术+辅助化疗的治疗策略。术前化疗方案同辅助化疗。
h.如存在手术禁忌,推荐行有效的化疗方案进行化疗,但是不推荐使用FOLFOXIRI方案。而术后总的辅助治疗的疗程推荐为6个月[18]。
i.再次评估,如果可以接受综合治疗,则进行辅助治疗,总的辅助治疗的疗程包括化疗和放疗不超过6个月[18]。术后辅助治疗建议8周内进行,而术后辅助放疗开始时间建议不超过12周。
4.1.4 附录
4.1.4.1 放射治疗的原则
放射野应包括肿瘤或者瘤床及2~5cm的安全边缘、骶前淋巴结、髂内淋巴结。T4肿瘤侵犯前方结构时需照射髂外淋巴结。
应用三维精确放疗技术,如3D-CRT技术或IMRT技术。应采取改变体位或其他方法尽量减少照射野内的小肠。
腹会阴联合切除术后患者照射野考虑包括会阴切口。
放疗剂量:盆腔剂量45~50.4Gy/25~28次,单次剂量1.8~2.0Gy。
对于可切除肿瘤,照射45Gy之后应考虑瘤床和两端2cm范围予追加剂量。术前放疗追加剂量为5.4Gy/3次,术后放疗为5.4~9Gy/3~5次。
小肠受量应限制在45Gy以内。
对于不可切除的肿瘤,如果技术上可行,放疗剂量可能需要高于54Gy。
放疗期间应同期使用5-FU为基础的化疗。
肝或肺转移瘤数目局限为几个时,放疗可使用于高度选择的病例或者临床试验。放疗不应替代手术切除。放疗方法应该使用高度适型的方式。可以考3D适型放疗,IMRT(调强放疗)或者立体定位放疗刀 (SBRT)(3类)。
副反应处理:
女性患者应该考虑并使用阴道扩张器来缓解阴道狭窄带来的症状。
男性患者应该被告知不孕不育的风险,并提供相关精子库的信息。
女性患者应该被告知不孕不育的风险,并在治疗前提供相关卵母细胞、卵细胞、卵巢组织库的信息。
4.1.4.2 常用化疗方案
4.1.4.2.1 同期放化疗给药方案
放疗+5-FU持续输注:225mg/(m2•d),放疗期间每天24h每周5d或7d维持。
放疗+卡培他滨:放疗5周,期间卡培他滨825mg/m2,每天2次,每周5d。
4.1.4.2.2 术后辅助化疗方案:
见 “3.1.1.4附录:常用的结肠癌术后辅助化疗方案”。
4.2 转移性直肠癌的治疗原则
4.2.1 同时性转移性直肠癌的治疗原则

同时性转移性直肠癌的治疗原则a(续表)
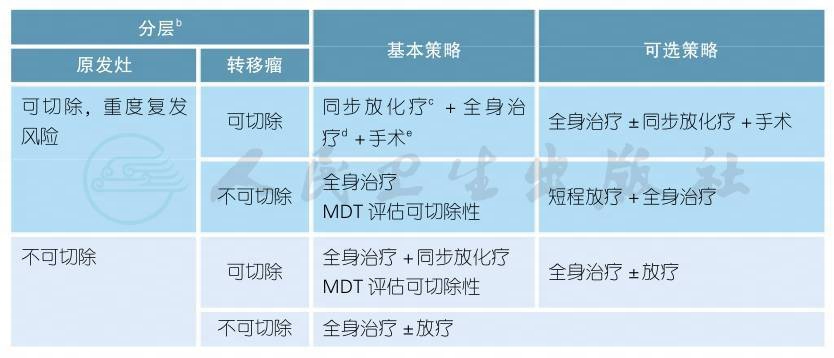
注释
a.同时性转移性直肠癌,由于直肠原发瘤和远处转移瘤同时并存,因此,针对原发瘤的局部治疗和针对远处转移的全身治疗都是必需的,应该在MDT框架下讨论如何安排局部治疗和全身治疗的顺序问题,总体来说,对健康威胁最大的优先处理。
b.直肠原发瘤局部复发风险评估采用ESMO分类方法 (见附录2.2.3-2:ESMO直肠癌危险度分层):中等度风险为低位T2期,中高位T3c以上,N1-2期,EMVI阳性,T4a,但MRF阴性。高度风险:T3且CRM阳性,T4a或T4b,侧方淋巴结转移。转移瘤是否可切除的判断标准参考结肠癌部分。
c.关于放疗的详细内容,参见4.1.3 cT3/CT4N+患者的治疗。
d.全身化疗的详细内容,参见结肠癌的相关部分。
e.手术可以是直肠原发瘤和远处转移瘤的同期切除或分期切除。
4.2.2 术后复发转移性直肠癌的治疗原则
4.2.2.1 直肠癌术后局部复发的诊疗原则
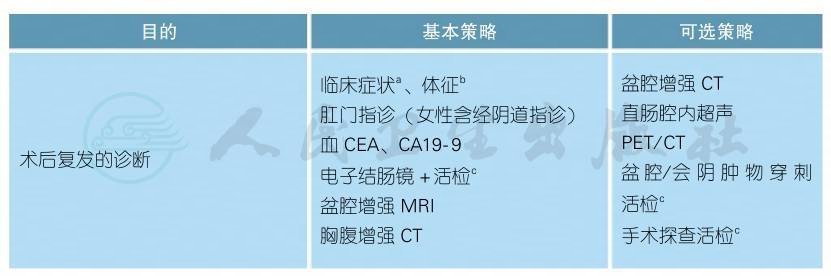
直肠癌术后局部复发的诊疗原则(续表)
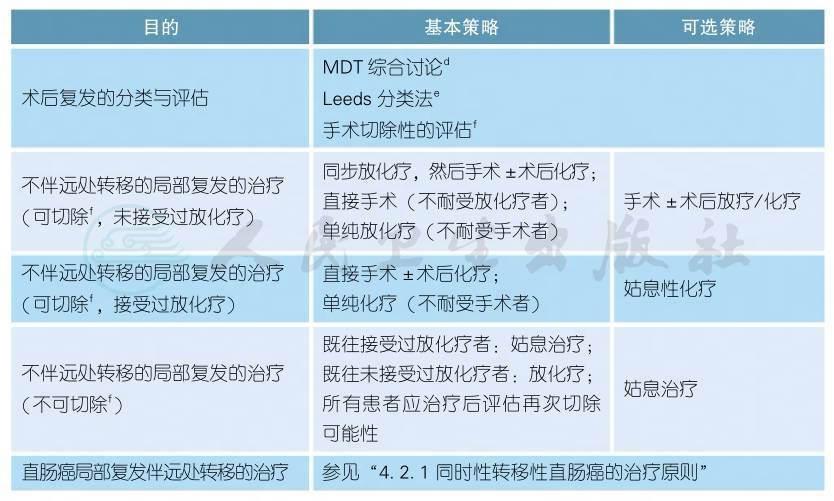
注:影像学诊断的更多具体内容参见 “2.2诊断基本原则”
注释
a.局部复发症状:
最常见的是盆腔或会阴部疼痛、感觉异常、不适等。其他症状包括血便、便频等类似于原发性直肠癌的症状,这类症状主要见于直肠癌前切除术 (AR)后的吻合口复发患者。
b.局部复发体征:
会阴或盆腔肿块最常见。女性患者可以通过阴道检查触及到会阴、盆腔内的复发病灶;接受AR手术的患者,肛门指诊可探及盆腔内位置较低的复发病灶,或吻合口复发病灶。
c.关于复发后的病理活检:
一般可以通过临床、影像检查获得临床诊断而开始治疗。但如果患者确诊后有可能接受器官毁损性的根治性手术切除者 (例如盆腔脏器廓清术),则必须要有病理学证实为肿瘤复发。
d.直肠癌术后复发的MDT评估:
除了常规结直肠癌MDT学科参与外,还需纳入泌尿外科、妇瘤科、整形外科等学科一起参与。
e.术后复发的Leeds分类法:
见附录一。
f.直肠癌术后局部复发的再次手术切除性评估:
手术禁忌证见附录二[2-7]。Leeds分型里中央型的切除率最高,侧壁型最低。
g.直肠癌术后局部复发的总体诊疗流程[8]:
见附录三。
附1:直肠癌术后局部复发的Leeds分类法[1]

附2:直肠癌局部复发的手术禁忌证

附3:直肠癌术后复发的诊疗流程
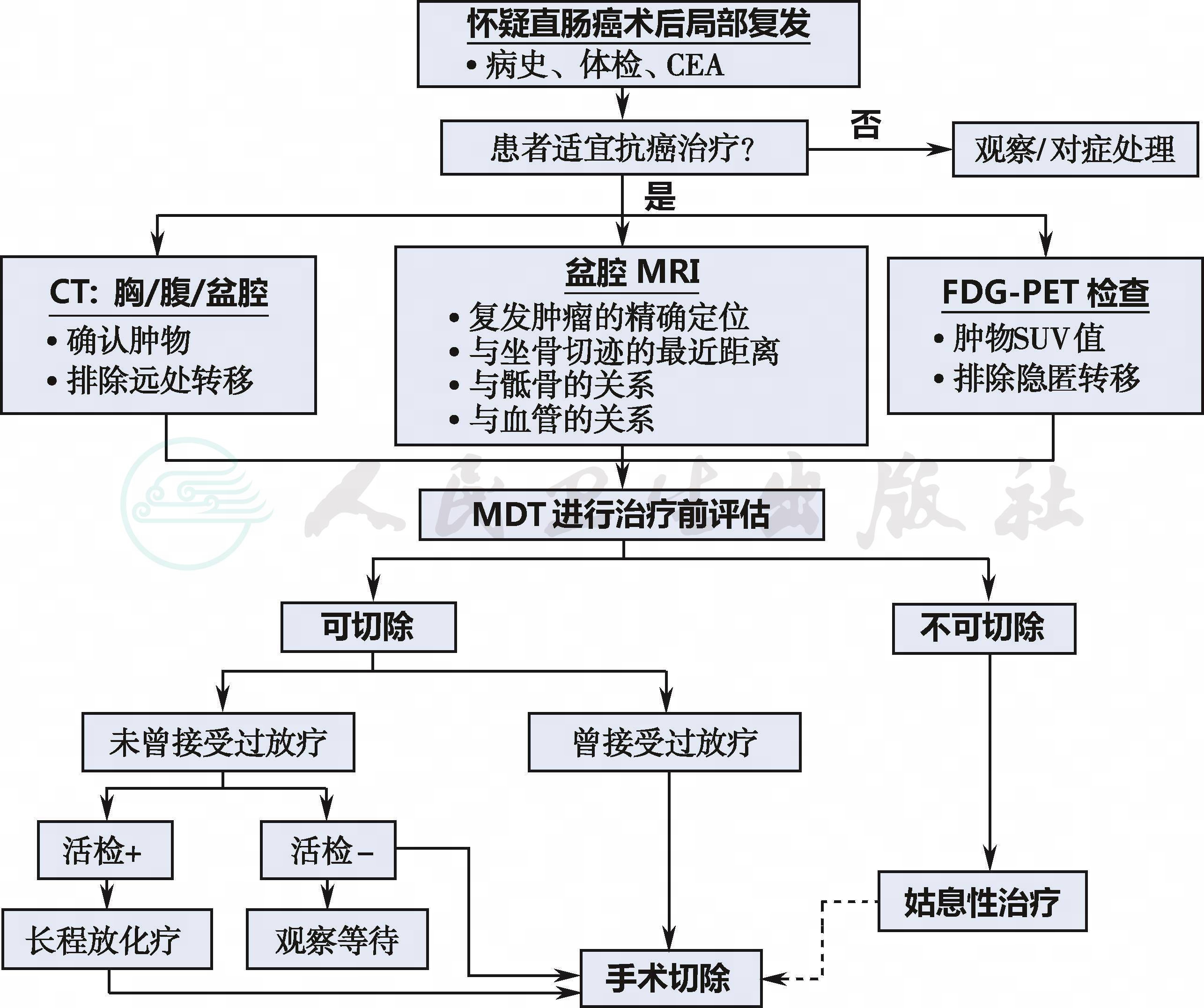
直肠癌术后复发的诊疗流程
4.3 直肠癌的随访

直肠癌的随访(续表)

注释
a.随访/监测的主要目的是发现那些还可以接受潜在根治为目的治疗的转移复发;没有高级别循证医学证据来支持什么样的随访/监测策略是最佳的。
b.如果患者身体状况不允许接受一旦复发而需要的抗癌治疗,则不主张对患者进行常规肿瘤随访/监测。
c.直肠癌术后的结肠镜随访主要目的是发现新生腺瘤或多原发癌,高位直肠癌的吻合口局部复发是很少发生的,而低位直肠癌的吻合口局部复发可以通过肛门指诊来监测。
d.肠镜检查的策略[1]:推荐术后1年内进行结肠镜检查,如果术前因肿瘤梗阻无法行全结肠镜检查,术后3~6个月检查;每次肠镜检查若发现进展期腺瘤 (绒毛状腺瘤,直径大于1cm,或有高级别不典型增生),需在1年内复查,若未发现进展期腺瘤,则3年内复查,然后每5年一次。
e. PET/CT仅推荐用于临床怀疑复发,但常规影像学阴性的时候,比如,持续CEA升高;不推荐将PET列为常规随访/监测手段。
5 遗传性结直肠癌筛检和基因诊断原则
遗传性结直肠癌筛检和基因诊断原则

遗传性结直肠癌筛检和基因诊断原则(续表)

遗传性结直肠癌筛检和基因诊断原则(续表)

遗传性结直肠癌筛检和基因诊断原则(续表)

遗传性结直肠癌筛检和基因诊断原则(续表)

2.1 无症状健康人群的结直肠癌筛查
1.李其龙,马新源,俞玲玲,等.农村高发地区大肠癌优化序贯筛查病变年龄别检出分析.中华肿瘤杂志,2013,35(2):154-157.
2.Chen W, Zheng R, Baade PD, et al. Cancer statistics in China,2015.CA Cancer J Clin,2016,66(2):115-132.
3.Bibbins-Domingo K, Grossman DC, Curry SJ, et al. Screening for Colorectal Cancer: US Preventive Services Task Force Recommendation Statement. JAMA,2016,315(23): 2564-2575.
4.中华医学会消化病学分会.中国大肠肿瘤筛查、早诊早治和综合预防共识意见.胃肠病学和肝病学杂志,2011,20(11):979-995.
5.Cai SR, Zhang SZ, Zhu HH, Zheng S. Barriers to colorectal cancer screening: a case-control study.World J Gastroenterol, 2009, 15(20): 2531-2536.
6.Meng W, Cai SR, Zhou L, et al. Performance value of high risk factors in colorectal cancer screening in China. World J Gastroenterol, 2009, 15(48): 6111-6116.
7.Sung JJ, Ng SC, Chan FK, et al. An updated Asia Pacific Consensus Recommendations on colorectal cancer screening. Gut, 2015, 64(1): 121-132.
8.Lee JK, Liles EG, Bent S, et al. Accuracy of fecal immunochemical tests for colorectal cancer: systematic review and meta-analysis. Ann Intern Med, 2014, 160(3): 171.
9.Huang Y,Li Q,Ge W,et al. Optimizing sampling device for the fecal immunochemical test increases colonoscopy yields in colorectal cancer screening. Eur J Cancer Prev, 2016, 25(2): 115-122.
10.Hol L, Wilschut JA, van Ballegooijen M, et al. Screening for colorectal cancer: random comparison of guaiac and immunochemical faecal occult blood testing at different cut-off levels. Br J Cancer, 2009,100(7):1103-1110.
11.Park DI, Ryu S, Kim YH, et al. Comparison of guaiac-based and quantitative immunochemical fecal occult blood testing in a population at average risk undergoing colorectal cancer screening. Am J Gastroenterol, 2010, 105(9): 2017-2025.
12.Labianca R, Nordlinger B, Beretta GD, et al. Early colon cancer: ESMO Clinical Practice Guidelines for diagnosis, treatment and follow-up. Ann Oncol, 2013, 24 Suppl 6: vi64-72.
13.Halloran SP, Launoy G, Zappa M. European guidelines for quality assurance in colorectal cancer screening and diagnosis. First Edition--Faecal occult blood testing. Endoscopy, 2012 44 Suppl 3:SE65-87.
14.中华医学会消化内镜学分会,中华医学会麻醉学分会.中国无痛苦消化内镜应用指南.中国实用内科杂志,2014,34(1):32-36.
15.Facciorusso A,Di MM,Serviddio G,et al. Factors Associated With Recurrence of Advanced Colorectal Adenoma After Endoscopic Resection. Clin Gastroenterol Hepatol, 2016, 14(8): 1148-1154.e4.
16.Cubiella J, Carballo F, Portillo I, et al. Incidence of advanced neoplasia during surveillance in highand intermediate-risk groups of the European colorectal cancer screening guidelines. Endoscopy, 2016,48(11):995-1002.
2 结直肠癌的诊断原则
1.Floriani I, Torri V, Rulli E, et al. Performance of imaging modalities in diagnosis of liver metastases from colorectal cancer: a systematic review and meta-analysis. Journal of Magnetic Resonance Imaging,2010, 31(1): 19-31.
2.Valérie Vilgrain, Maxime Esvan, Maxime Ronot, et al. A meta-analysis of diffusion-weighted and gadoxetic acid-enhanced MR imaging for the detection of liver metastases. Eur Radiol, 2016, 26(12):4595-4615.
3.Moulton CA, Gu CS, Law CH, et al. Effect of PET before liver resection on surgical management for colorectal adenocarcinoma metastases: a randomized clinical trial. JAMA, 2014, 311: 1863-1869.
4.Joyce DL, Wahl RL, Patel PV, et al. Preoperative positron emission tomography to evaluate potentially resectable hepatic colorectal metastases. Arch Surg, 2006, 141: 1220-1226; discussion 1227.
5.Pelosi E,Deandreis D. The role of 18F-fluoro-deoxy-glucose positron emission tomography(FDGPET)in the management of patients with colorectal cancer. Eur J Surg Oncol, 2007, 33: 1-6.
6.Beets-Tan RG,Lambregts DM,Maas M,et al. Magnetic resonance imaging for the clinical management of rectal cancer patients:recommendations from the 2012 European Society of Gastrointestinal and Abdominal Radiology(ESGAR)consensus meeting. Eur Radiol, 2013, 23: 2522-2531.
7.Taylor FG, Quirke P, Heald RJ, et al. Preoperative magnetic resonance imaging assessment of circumferential resection margin predicts disease-free survival and local recurrence:5-year follow-up results of the MERCURY study. J Clin Oncol, 2014, 32: 34-43.
8.Xie H, Zhou X, Zhuo Z, et al. Effectiveness of MRI for the assessment of mesorectal fascia involvement in patients with rectal cancer: a systematic review and meta-analysis. Dig Surg, 2014, 31: 123-134.
9.Bipat S, Glas AS, Slors FJM, et al. Rectal cancer: local staging and assessment of lymph node involvement with endoluminal US, CT, and MR imaging--a meta-analysis. Radiology, 2004, 232: 773-783.
10.Nougaret S1, Reinhold C,Mikhael HW, et al. The use of MR imaging in treatment planning for patients with rectal carcinoma: have you checked the “DISTANCE”?Radiology, 2013 Aug, 268(2):330-344.
11.Al-Sukhni E. Diagnostic accuracy of MRI for assessment of T category, lymph node metastases, and circumferential resection margin involvement in patients with rectal cancer:a systematic review and meta-analysis. Annals of surgical oncology, 2012, 19: 2212-2223.
12.Chand,M. The prognostic significance of postchemoradiotherapy high-resolution MRI and histopathology detected extramural venous invasion in rectal cancer. Annals of surgery, 2015, 261: 473-479.
13.Battersby NJ. Prospective Validation of a Low Rectal Cancer Magnetic Resonance Imaging Staging System and Development of a Local Recurrence Risk Stratification Model:The MERCURYⅡStudy. Annals of surgery, 2016, 263: 751-760.
14.Glimelius B, Tiret E, Cervantes A, et al. Rectal cancer: ESMO Clinical Practice Guidelines for diagnosis, treatment and follow-up. Annals of oncology, 2013, 24 Suppl 6: vi81-88.
15.Patel UB. Magnetic resonance imaging-detected tumor response for locally advanced rectal cancer predicts survival outcomes: MERCURY experience. Journal of clinical oncology, 2011, 29: 3753-3760.
2.3 病理学诊断原则
1.Cooper HS. Pathology of endoscopically removed malignant colorectal polyp. Curr Diagn Pathol, 2007,13(6):423-437.
2.Benson AB, Venook AP, Bekaii-Saab T, et al. NCCN Clinical Practice Guidelines in Onclology: Rectal Cancer,Version 3.2015.
3.Parfitt JR, Driman DK. The total mesorectal excision specimen for rectal cancer: a review of its pathological assessment. J Clin Pathol, 2007, 60: 849-855.
4.Nagtegaal ID,Marijnen CA, Kranenbarg EK,et al. Pathology Review Committee;Cooperative Clinical Investigators. Circumferential margin involvement is still an important predictor of local recurrence in rectal carcinoma: not one millimeter but two millimeters is the limit. Am J Surg Pathol, 2002, 26(3):350-357.
5.Bosman FT, Carneiro F, Hruban RH, et al. WHO Classification of Tumours of the Digestive System,4th Edition. Geneva, Switzerland: WHO Press, 2010: 137.
6.AJCC Cancer Staging Manual.7th ed. New York: Springer, 2010.
2.4 分期
1.AJCC Cancer Staging Manual.7th ed. New York: Springer, 2010.
3.1.1.1.1 内镜治疗策略
1.Tanaka S, Kashida H, Saito Y, et al. JGES guidelines for colorectal endoscopic submucosal dissection/endoscopic mucosal resection. Digestive Endoscopy, 2015, 27(4): 417-434.
2.Fujiya M,Tanaka K,Dokoshi T,et al. Efficacy and adverse events of EMR and endoscopic submucosal dissection for the treatment of colon neoplasms:a meta-analysis of studies comparing EMR and endoscopic submucosal dissection. Gastrointest Endosc, 2015, 81(3): 583-595.
3.Asayama N, Oka S, Tanaka S, et al. Endoscopic Submucosal Dissection as Total Excisional Biopsy for Clinical T1 Colorectal Carcinoma. Digestion, 2015, 91(1): 64-69.
4.De Ceglie A, Hassan C,Mangiavillano B,et al. Endoscopic mucosal resection and endoscopic submucosal dissection for colorectal lesions: A systematic review. Critical Reviews in Oncology/Hematology,2016, 104: 138-155.
5.Pimentel-Nunes P, Dinis-Ribeiro M, Ponchon T, et al. Endoscopic submucosal dissection: European Society ofGastrointestinalEndoscopy(ESGE) Guideline. Endoscopy, 2015, 47 (9):829-854.
6.Ribeiro MS,Wallace MB. Endoscopic Treatment of Early Cancer of the Colon. Gastroenterol Hepatol(NY), 2015, 11(7): 445-452.
3.1.1.1.2 息肉镜下切除术后的处理策略
1.Cooper HS, Deppisch LM, Gourley WK, et al. Endoscopically removed malignant colorectal polyps:clinicopathologic correlations. Gastroenterology, 1995, 108: 1657-1665.
2.Seitz U, Bohnacker S, Seewald S, et al. Is endoscopic polypectomy an adequate therapy for malignant colorectal adenomas?Presentation of 114 patients and review of the literature. Dis Colon Rectum, 2004,47:1789-1796.
3.Volk EE, Goldblum JR, Petras RE, et al. Management and outcome of patients with invasive carcinoma arising in colorectal polyps. Gastroenterology, 1995, 109: 1801-1807.
4.Markowitz AJ, Winawer SJ. Management of colorectal polyps. CA Cancer J Clin, 1997, 47: 93-112.
5.Yoshii S,Nojima M, Nosho K,et al. Factors associated with risk for colorectal cancer recurrence after endoscopic resection of T1 tumors. Clin Gastroenterol Hepato, 2014, 12: 292-302 e293.
6.Cooper HS. Surgical pathology of endoscopically removed malignant polyps of the colon and rectum. Am J Surg Pathol, 1983, 7: 613-623.
7.Hassan C,Zullo A,Risio M,et al. Histologic risk factors and clinical outcome in colorectal malignant polyp: a pooled-data analysis. Dis Colon Rectum,2005,48:1588-1596.
8.Cranley JP, Petras RE, Carey WD, et al. When is endoscopic polypectomy adequate therapy for colonic polyps containing invasive carcinoma?Gastroenterology, 1986, 91: 419-427.
9.Haggitt RC, Glotzbach RE, Soffer EE, Wruble LD. Prognostic factors in colorectal carcinomas arising in adenomas: implications for lesions removed by endoscopic polypectomy. Gastroenterology, 1985, 89:328-336.
3.1.1.2 手术治疗
1.Cohen AM. Surgical considerations in patients with cancer of the colon and rectum. Semin Oncol, 1991,18:381-387.
2.West NP,Hohenberger W,Weber K,et al. Complete mesocolic excision with central vascular ligation produces an oncologically superior specimen compared with standard surgery for carcinoma of the colon. J Clin Oncol, 2010, 28: 272-278.
3.Edge SBB DR, Compton CC, Fritz AG, et al. AJCC Cancer Staging Manual.7th Edition. New York:Springer,2010.
4.Berger AC, Sigurdson ER, LeVoyer T, et al. Colon cancer survival is associated with decreasing ratio of metastatic to examined lymph nodes. J Clin Oncol, 2005, 23: 8706-8712.
5.Huang X, Lv B, Zhang S, Meng L. Preoperative colonic stents versus emergency surgery for acute leftsided malignant colonic obstruction: a meta-analysis. J Gastrointest Surg, 2014, 18: 584-591.
3.1.1.3 术后辅助化疗
1.Colon Cancer, Version 2, 2016.Clinical Practice Guidelines in Oncology(NCCN Guidelines® ).https://www.nccn.org/.
2.Tournigand C, André T, Bonnetain F, et al. Adjuvant therapy with fluorouracil and oxaliplatin in stageⅡ and elderly(between ages 70 and 75 years)with colon cancer: a subgroup analyses of the Multicenter International Study of Oxaliplatin, Fluorouracil, and Leucovorin in the Adjuvant Treatment of Colon Cancer trial. J Clin Oncol, 2012, published online ahead of print on August 20,2012.
3.Sargent DJ, Marsoni S, Monges G, et al. Defective mismatch repair as a predictive marker for lack of efficacy of fluorouracil based adjuvant therapy in colon cancer. J Clin Oncol, 2010, 28:3219-3226.
3.1.2 不可切除结肠癌的治疗
a.对于初始不可切除的结肠癌,依据患者具体情况使用氟尿嘧啶类药物单药化疗或者联合奥沙利铂或者伊立替康联合化疗,甚或三药联合化疗[1]。
b.多项临床试验显示,化疗联合贝伐珠单抗或者西妥昔单抗可以改善患者的预后[2-5],但两种靶向剂联合使用会显著增加毒副作用[6-7]。
c.对可能转化的病人要选择高反应率的化疗方案或化疗联合靶向治疗方案,病人应每2个月评估一次,如果联合贝伐珠单抗治疗,则最后一次治疗与手术间隔至少6周,术后6~8周再重新开始贝伐珠单抗治疗。
d.局部放疗对部分T4b患者,如伴有局部侵犯的乙状结肠,可提高治疗的缓解率,增加转化性切除的概率[8]。
e.对于有梗阻的T4b结肠癌患者可通过内镜下支架植入[9-10]或旁路手术解除梗阻。
1.Chibaudel B, C Tournigand, F Bonnetain, et al. Therapeutic strategy in unresectable metastatic colorectal cancer: an updated review. Ther Adv Med Oncol, 2015, 7(3): 153-169.
2.Saltz LB, S Clarke, E Diaz-Rubio, et al. Bevacizumab in combination with oxaliplatin-based chemotherapy as first-line therapy in metastatic colorectal cancer: a randomized phase Ⅲ study. J Clin Oncol,2008, 26(12): 2013-2019.
3.Loupakis F, C Cremolini, G Masi, et al. Initial therapy with FOLFOXIRI and bevacizumab for metastatic colorectal cancer. N Engl J Med, 2014, 371(17): 1609-1618.
4.Tebbutt NC, K Wilson, VJ Gebski, et al. Capecitabine, bevacizumab, and mitomycin in first-line treatment of metastatic colorectal cancer:results of the Australasian Gastrointestinal Trials Group Randomized PhaseⅢ MAX Study. J Clin Oncol, 2010, 28(19): 3191-3198.
5.Kabbinavar FF, J Schulz, M McCleod, et al. Addition of bevacizumab to bolus fluorouracil and leucovorin in first-line metastatic colorectal cancer: results of a randomized phase Ⅱ trial. J Clin Oncol,2005, 23(16): 3697-3705.
6.Hecht J R, E Mitchell, T Chidiac, et al. A randomized phase ⅢB trial of chemotherapy, bevacizumab,and panitumumab compared with chemotherapy and bevacizumab alone for metastatic colorectal cancer. J Clin Oncol, 2009, 27(5): 672-680.
7.Tol J, M Koopman, A Cats, et al. Chemotherapy, bevacizumab, and cetuximab in metastatic colorectal cancer. N Engl J Med, 2009, 360(6): 563-572.
8.Qiu B, PR Ding, L Cai, et al. Outcomes of preoperative chemoradiotherapy followed by surgery in patients with unresectable locally advanced sigmoid colon cancer. Chin J Cancer, 2016, 35(1): 65.
9.Lee J M, J S Byeon. Colorectal Stents: Current Status. Clin Endosc, 2015, 48(3): 194-200.
10.Cetinkaya E, AB Dogrul, MB Tirnaksiz. Role of self expandable stents in management of colorectal cancers. World J Gastrointest Oncol, 2016, 8(1): 113-120.
3.2.1.1 初始可切除转移性结肠癌的治疗
1.Hamady Z Z, Cameron I C, Wyatt J, et al. Resection margin in patients undergoing hepatectomy for colorectal liver metastasis: a critical appraisal of the 1cm rule. Eur J Surg Oncol, 2006, 32(5):557-563.
2.Fong Y, Fortner J, Sun R L, et al. Clinical score for predicting recurrence after hepatic resection for metastatic colorectal cancer: analysis of 1001 consecutive cases. Ann Surg, 1999, 230(3): 309-318,318-321.
3.Ayez N, van der Stok E P, Grunhagen D J, et al. The use of neo-adjuvant chemotherapy in patients with resectable colorectal liver metastases: Clinical risk score as possible discriminator. Eur J Surg Oncol,2015, 41(7): 859-867.
4.Cutsem E V, Cervantes A, Adam R, et al. ESMO consensus guidelines for the mangament of patients with metastatic colorectal cancer. Ann Oncol, 2016, 27(8): 1386-1422.
3.2.1.2 初始不可切除转移性结肠癌的治疗
1.Colon Cancer, Version 1, 2017.Clinical Practice Guidelines in Oncology(NCCN Guidelines®).https://www.nccn.org/.
2.Alberts SR, Horvath WL, Sternfeld WC, et al. Oxaliplatin, fluorouracil, and leucovorin for patients with unresectable liver-only metastases from colorectal cancer:a North Central Cancer Treatment Group phaseⅡ study. J Clin Oncol, 2005, 23(36): 9243-9249.
3.Falcone A, Ricci S, BrunettiⅠ, et al. PhaseⅢ trial of infusional fluorouracil, leucovorin, oxaliplatin, and irinotecan(FOLFOXIRI)compared with infusional fluorouracil, leucovorin, and irinotecan(FOLFIRI)as frst-line treatment for metastatic colorectal cancer:the Gruppo Oncologico Nord Ovest. J Clin Oncol, 2007, 25: 1670-1676.
4.Yaicin S, Uslu R, Dane F, et al. Bevacizumab+Capecitabine as Maintenance Therapy after Initial Bevacizumab+XELOX Treatment in Previously Untreated Patients with Metastatic Colorectal Cancer:PhaseⅢ ‘Stop and Go’ Study Results-A Turkish Oncology Group Trial. Oncology, 2013, 85: 328-335.
5.Esin E, Yalcin S. Maintenance strategy in metastatic colorectal cancer: A systematic review. Cancer Treament Reviews, 2016, 42: 82-90.
6.Tejpar S, SStintzing S, Ciardiello F, et al. Prognostic and predictive relevance of primary tumor location in patients with RAS wild-type metasticic colorectal cancer. JAMA Oncol, 2016, doi.10001/jamaoncol.2016.3797.
7.Masi G, Salvatore L, Boni L, et al. Continuation or reintroduction of bevacizumab beyond progression to first-line therapy in metastatic colorectal cancer: final results of the randomized BEBYP trial. Ann Oncol,2015, 26: 724-730.
8.Li J, Qin S, Xu R, et al. Regorafenib plus best supportive care versus placebo plus best supportive care in Asian patients with previously treated metastatic colorectal cancer(CONCUR): a randomised, double-blind, placebo-controlled, phase 3 trial. Lancet Oncol, 2015, 16(6): 619-629.
3 结肠癌的治疗原则
Rex DK, Kahi CJ, Levin B, et al. Guidelines for colonoscopy surveillance after cancer resection: a consensus update by the American Cancer Society and the US Multi-Society Task Force on Colorectal Cancer. Gastroenterology, 2006, 130: 1865-1871.
4.1.1 直肠腺瘤的治疗原则
1.Al-Najami I, Rancinger C P, Larsen M K, et al. Transanal endoscopic microsurgery for advanced polyps and early cancers in the rectum-Long-term outcome:A STROBE compliant observational study. Medicine(Baltimore),2016,95(36): e4732.
2.Tanaka S, Kashida H, Saito Y, et al. JGES guidelines for colorectal endoscopic submucosal dissection/endoscopic mucosal resection. Digestive Endoscopy, 2015, 27(4): 417-434.
4.1.2 cT1-2N0直肠癌的治疗原则
1.Heald RJ, Husband EM, Ryall RD. The mesorectum in rectal cancer surgery--the clue to pelvic recurrence? Br J Surg, 1982, 69: 613-616.
2.Nascimbeni R, Burgart LJ, Nivatvongs S, Larson DR. Risk of lymph node metastasis in T1 carcinoma of the colon and rectum. Dis Colon Rectum, 2002, 45: 200-206.
3.Yamamoto S,Watanabe M,Hasegawa H,et al. The risk of lymph node metastasis in T1 colorectal carcinoma. Hepatogastroenterology, 2004, 51: 998-1000.
4.1.3 cT3/CT4N+直肠癌的治疗原则
1.Sauer R,Becker H,Hohenberger W,et al. Preoperative versus postoperative chemoradiotherapy for rectal cancer. N Engl J Med, 2004, 351: 1731-1740.
2.Sauer R, Liersch T, Merkel S, et al. Preoperative versus postoperative chemoradiotherapy for locally advanced rectal cancer: results of the German CAO/ARO/AIO-94 randomized phaseⅢtrial after a median follow-up of 11 years. J Clin Oncol, 2012, 30: 1926-1933.
3.Wagman R,Minsky BD,Cohen AM,et al. Sphincter preservation in rectal cancer with preoperative radiation therapy and coloanal anastomosis: long term follow-up. Int J Radiat Oncol Biol Phys, 1998, 42: 51-57.
4.Gerard JP, Conroy T, Bonnetain F, et al. Preoperative radiotherapy with or without concurrent fluorouracil and leucovorin in T3-4 rectal cancers: results of FFCD 9203.J Clin Oncol, 2006, 24: 4620-4625.
5.Bosset JF, Calais G, Mineur L, et al. Enhanced tumorocidal effect of chemotherapy with preoperative radiotherapy for rectal cancer: preliminary results--EORTC 22921.J Clin Oncol, 2005, 23: 5620-5627.
6.Bosset JF, Collette L, Calais G, et al. Chemotherapy with preoperative radiotherapy in rectal cancer. N Engl J Med, 2006, 355: 1114-1123.
7.De Caluwe L, Van Nieuwenhove Y, Ceelen WP. Preoperative chemoradiation versus radiation alone for stageⅡandⅢresectable rectal cancer. Cochrane Database Syst Rev:CD006041.
8.Hofheinz RD, Wenz F, Post S, et al. Chemoradiotherapy with capecitabine versus fluorouracil for locally advanced rectal cancer: a randomised, multicentre, non-inferiority, phase 3 trial. Lancet Oncol, 2012,13:579-588.
9.O'Connell MJ, Colangelo LH, Beart RW, et al. Capecitabine and oxaliplatin in the preoperative multimodality treatment of rectal cancer:surgical end points from National Surgical Adjuvant Breast and Bowel Project trial R-04.J Clin Oncol, 2014, 32: 1927-1934.
10.Aschele C, Cionini L, Lonardi S, et al. Primary tumor response to preoperative chemoradiation with or without oxaliplatin in locally advanced rectal cancer:pathologic results of the STAR-01 randomized phaseⅢ trial. J Clin Oncol, 2011, 29: 2773-2780.
11.Gerard JP, Azria D, Gourgou-Bourgade S, et al. Clinical outcome of the ACCORD 12/0405 PRODIGE 2 randomized trial in rectal cancer. J Clin Oncol, 2012, 30: 4558-4565.
12.Rodel C, Liersch T, Becker H, et al. Preoperative chemoradiotherapy and postoperative chemotherapy with fluorouracil and oxaliplatin versus fluorouracil alone in locally advanced rectal cancer:initial results of the German CAO/ARO/AIO-04 randomised phase 3 trial. Lancet Oncol, 2012, 13 (7):679-687.
13.Gay HA, Barthold HJ, O’ Meara E, et al. Pelvic normal tissue contouring guidelines for radiation therapy: a Radiation Therapy Oncology Group consensus panel atlas. Int J Radiat Oncol Biol Phys,2012, 83 (3): e353-362.
14.Improved survival with preoperative radiotherapy in resectable rectal cancer. Swedish Rectal Cancer Trial. N Engl J Med, 1997, 336: 980-987.
15.van Gijn W,Marijnen CA,Nagtegaal ID,et al. Preoperative radiotherapy combined with total mesorectal excision for resectable rectal cancer: 12-year follow-up of the multicentre, randomised controlled TME trial. Lancet Oncol, 2011, 12: 575-582.
16.Bujko K,Nowacki MP,Nasierowska-Guttmejer A, et al. Long-term results of a randomized trial comparing preoperative short-course radiotherapy with preoperative conventionally fractionated chemoradiation for rectal cancer. Br J Surg, 2006, 93: 1215-1223.
17.Ngan SY, Burmeister B, Fisher RJ, et al. Randomized trial of short-course radiotherapy versus longcourse chemoradiation comparing rates of local recurrence in patients with T3 rectal cancer:Trans-Tasman Radiation Oncology Group trial 01.04.J Clin Oncol, 2012, 30: 3827-3833.
18.Andre T, Boni C, Mounedji-Boudiaf L, et al. Oxaliplatin, fluorouracil, and leucovorin as adjuvant treatment for colon cancer. N Engl J Med, 2004, 350: 2343-2351.
19.Fernandez-Martos C, Pericay C, Aparicio J, et al. PhaseⅡ, randomized study of concomitant chemoradiotherapy followed by surgery and adjuvant capecitabine plus oxaliplatin(CAPOX) compared with induction CAPOX followed by concomitant chemoradiotherapy and surgery in magnetic resonance imagingdefined, locally advanced rectal cancer: Grupo cancer de recto 3 study. J Clin Oncol, 2010, 28:859-865.
20.Marechal R, Vos B, Polus M,et al. Short course chemotherapy followed by concomitant chemoradiotherapy and surgery in locally advanced rectal cancer: a randomized multicentric phaseⅡ study. Ann Oncol, 2005, 23: 1525-1530.
4.2.2.1 直肠癌术后局部复发的诊疗原则
1.Boyle KM,Sagar PM,Chalmers AG,et al. Surgery for locally recurrent rectal cancer. Dis Colon Rectum,2005,48:929-937.
2.Hahnloser D, Nelson H,Gunderson LL,et al. Curative potential of multimodality therapy for locally recurrent rectal cancer. Ann Surg, 2003, 237: 502-508.
3.Moore HG, Shoup M, Riedel E, et al. Colorectal cancer pelvic recurrences: determinants of resectability. Dis Colon Rectum,2004,47: 1599-1606.
4.Heriot Ag, Byrne CM, Dobbs B, et al. Extended radical resection: the choice for locally recurrent rectal cancer. Dis Colon Rectum, 2008, 51: 284-291.
5.Yamada K, Ishizawa T, Niwa K, et al. Pelvic exenteration and sacral resection for locally advanced primary and recurrent rectal cancer. Dis Colon Rectum, 2002, 45: 1078-1084.
6.Bouchard P, Efron J. Management of Recurrent Rectal Cancer. Ann Surg Oncol, 2010, 17:1343-1356.
7.Mirnezami AH,Sagar PM,Kavanagh D,et al. Clinical Algorithms for the Surgical Management of Locally Recurrent Rectal Cancer. Dis Colon Rectum, 2010, 53: 1248-1257.
8.陈功.直肠癌局部复发的多学科综合诊治进展.中国普外基础与临床杂志,2013,20(11):1208-1216.
4.3 直肠癌的随访
1.Rex DK, Kahi CJ, Levin B, et al. Guidelines for colonoscopy surveillance aftercancer resection: a consensus update by the American Cancer Society and theUS Multi-Society Task Force on Colorectal Cancer. Gastroenterology, 2006, 130: 1865-1871.
5 遗传性结直肠癌筛检和基因诊断原则
1.Lynch HT, Shaw TG. Practical genetics of colorectal cancer. Chin Clin Oncol, 2013, 2(2): 12.
2.Grover S, Kastrinos F, Steyerberg EW, et al. Prevalence and phenotypes of APC and MUTYH mutations in patients with multiple colorectal adenomas. JAMA,2012,308(5): 485-492.
3.杨邵瑜,蔡善荣,张苏展.家族性腺瘤性息肉病及其亚型的临床及遗传表型.实用肿瘤杂志,2007, (3): 270-273.
4.Nieuwenhuis MH,Vasen HF. Correlations between mutation site in APC and phenotype of familial adenomatous polyposis(FAP): a review of the literature. Crit Rev Oncol Hematol, 2007, 61(2):153-161.
5.丁衍,许预,徐晓东.家族性腺瘤性息肉病患者中先天性视网膜色素上皮肥厚的FFA研究.国际眼科杂志,2010,10(6):1157-1159.
6.楼征,于恩达,孟荣贵.家族性腺瘤性息肉病相关性硬纤维瘤病.第二军医大学学报,2006(5):541-543.
7.曹海龙,王邦茂,曹晓沧.Gardner和 Turcot综合征的临床特点93例.世界华人消化杂志,2010, 18(36): 3922-3925.
8.Sieber OM, Lipton L, Crabtree M, et al. Multiple colorectal adenomas, classic adenomatous polyposis,and germ-line mutations in MYH. N Engl J Med, 2003, 348(9): 791-799.
9.袁瑛,曹文明,蔡善荣,张苏展.中国人遗传性非息肉病性结直肠癌家系的临床表型分析.中华肿瘤杂志,2006,28(1):36-38.
10.Lindor NM,Rabe K,Petersen GM,et al. Lower cancer incidence in Amsterdam-I criteria families without mismatch repair deficiency: familial colorectal cancer type X. JAMA, 2005, 293(16):1979-1985.
11.李晓芬,袁瑛.中国Lynch综合征的过去、现在和将来.中华结直肠疾病电子杂志,2015(3):21-26.
12.Moreira L, Balaguer F, Lindor N, et al. Identification of Lynch syndrome among patients with colorectal cancer. JAMA, 2012, 308(15): 1555-1565.
13.全国遗传性大肠癌协作组.中国人遗传性大肠癌筛检标准的实施方案.中华肿瘤杂志,2004,26(3):191-192.
14.Ligtenberg MJ, Kuiper RP, Chan TL, et al. Heritable somatic methylation and inactivation of MSH2 in families with Lynch syndrome due to deletion of the 3’ exons of TACSTD1.Nat Genet, 2009, 41(1):112-117.
15.Senter L,Clendenning M,Sotamaa K,et al. The clinical phenotype of Lynch syndrome due to germline PMS2 mutations. Gastroenterology, 2008, 135(2): 419-428.
16.Hampel H, Frankel WL, Martin E, et al. Screening for the Lynch syndrome(hereditary nonpolyposis colorectal cancer).N Engl J Med, 2005, 352(18): 1851-1860.
17.王石林,笪冀平,顾国利.Muir-Torre综合征的研究进展.中国普外基础与临床杂志,2005,12(2):192-194.
18.Xicola RM, Llor X, Pons E, et al. Performance of different microsatellite marker panels for detection of mismatch repair-deficient colorectal tumors. J Natl Cancer Inst, 2007, 99(3): 244-252.
19.Boland CR, Thibodeau SN, Hamilton SR, et al. A National Cancer Institute Workshop on Microsatellite Instability for cancer detection and familial predisposition:development of international criteria for the determination of microsatellite instability in colorectal cancer. Cancer Res, 1998, 58(22): 5248-5257.
20.朱明,刘晓蓉,黄彦钦,等.中国人家族性结直肠癌错配修复基因大片段变异分析.中华医学遗传学杂志,2005,22(6):603-606.
21.戴益琛,谢军培,曾伟,等.中国大陆黑斑息肉综合征临床荟萃分析.临床内科杂志,2008,25(8):526-527.
22.康连春,赵喜荣,周永双,等.STK11基因在Peutz-Jeghers综合征家系中的突变分析.科学通报,2002,47(21):1639-1643.