 去看看
去看看


复方口服避孕药(combined oral contraceptives,COC)是目前全球范围广泛使用的高效避孕方法之一,是含有低剂量雌激素和孕激素(与女性体内天然的雌激素和孕激素相似)的复合甾体激素制剂。其应用始于20世纪60年代初,主要通过抑制排卵,发挥避孕作用。炔雌醇的含量≤35µg的COC 是WHO推荐使用的低剂量COC。目前,大量的基础和临床研究证实,COC除了避孕效果显著外,健康获益也远远大于其可能存在的风险。
目前,COC在我国育龄期妇女的使用率非常低[1]。出于对激素类药物的恐惧心理,对COC的了解不足或存在偏见,是我国COC使用率甚低的主要原因之一。另一方面,临床医师对COC的获益和风险认知不足,对如何应用COC存在一些顾虑和误区。为了向大众介绍COC在避孕上的显著效果及对一些疾病的的明显疗效,也为了消除顾虑,服务于大众的健康和医务工作者的临床需要,中国妇产科及计划生育专家在COC应用的通用准则和方法的基础上,借鉴国内临床用药经验及WHO和国外的相关指南,参考近年来发表的相关临床和基础研究的结果,结合国内临床实际情况,经过专家们共同努力形成了《复方口服避孕药临床应用中国专家共识》(以下简称《COC共识》)。《COC共识》的制定工作经历了临床调查研究、成立专家组、文献查阅、综合分析、撰写草案、多学科专家咨询研讨、专家审议修改等多步骤的工作。
应用COC的主要目标是控制生育、避免非意愿妊娠,并在避孕同时获得额外的受益。应用COC应根据患者的不同情况,给予个体化处理,在高效避孕的同时,最大程度防止或减轻心血管疾病等不良反应。由于使用COC的妇女个体及临床情况十分复杂,而且,目前在COC应用方面还存在许多尚待解决的问题,因此,在今后的工作中还需要通过深入研究及临床实践,进一步完善COC应用的专家共识。
COC的避孕应用
一、COC的现状
要点:COC上市50余年并不断发展,主要体现在3个方面:降低雌激素含量,以减少不良反应;开发不同类型、高活性的孕激素;改变给药方案。
从1960年“避孕药之父”美国科学家Pincus与美籍华人张觉明共同研制的第1个COC——Enovid被美国食品药品管理局(FDA)批准在美国上市,至今COC已有50余年历史。COC不断发展,体现在以下3个方面:(1)雌激素剂量由Enovid中的150μg减少到30~35μg,甚至20μg。(2)发现和应用更具有天然孕激素特性、不同类型的孕激素:第1代孕激素伴有较强的雄激素作用,现已少用;第2代,避孕效能更高;第3代,与第2代相比,其抑制排卵的作用更强,且几乎无雄激素作用。新型孕激素有类似于天然孕酮的生理活性,并具有抗雄激素的作用,有些还具有抗盐皮质激素的作用,见表1。(3)不断改进COC给药方案,从最初模仿自然的28d月经周期,到现代COC(由于组分中孕激素更新、更高效,也称为现代COC)的21d活性激素摄入期、之后为7d的无激素间期(HFI),通过人为降低雌激素和孕激素的血液浓度来诱导每月的撤退性出血。近年来研发出HFI更短的COC(如24/4方案:24d活性激素与4d HFI)能更好地抑制排卵并减少激素水平的波动,从而有可能降低激素撤退相关症状的发生率和严重程度[2-3]。
表1 不同孕激素在治疗剂量下的药理学特性
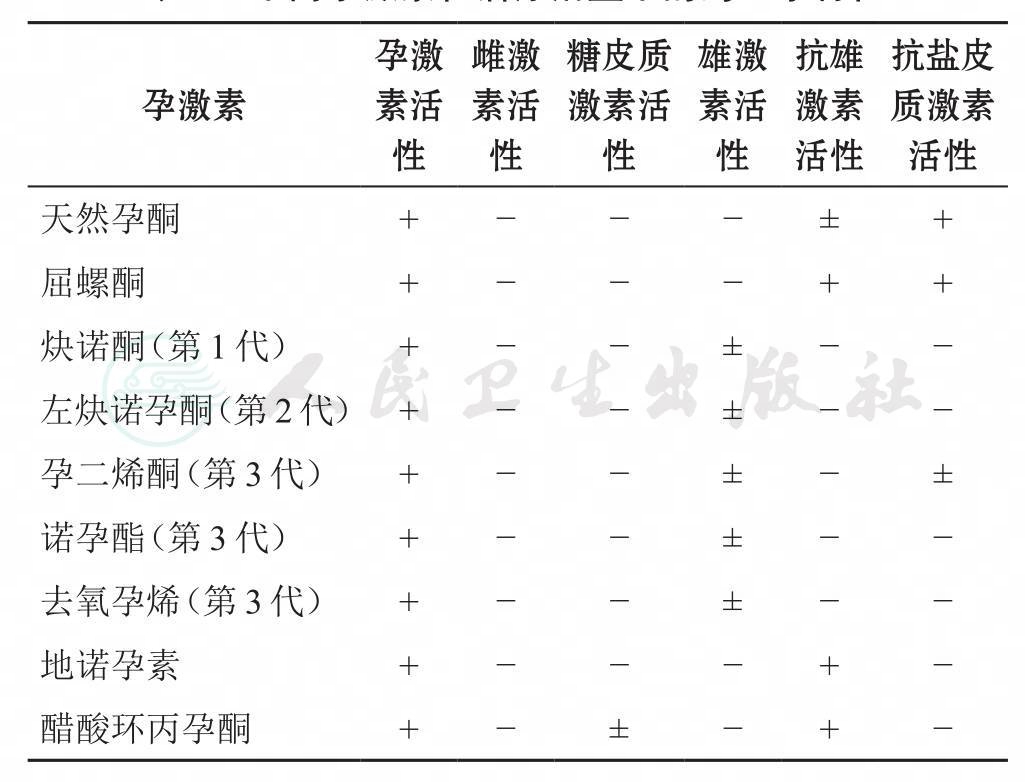
注:+有活性;-无活性;±治疗剂量下活性可忽略
二、COC的避孕应用
要点:(1)COC通过抑制排卵、改变子宫颈黏液性状、改变子宫内膜形态及功能、改变输卵管功能等多环节共同作用达到控制生育的目的。(2)COC具有高效、简便、可逆等优势。正确使用,COC的避孕有效率可达99%以上。(3)COC适用于健康育龄期妇女的常规避孕,但在使用时需排除COC禁忌证及风险因素。
研究表明,避孕药物的使用可以有效避免孕产妇死亡,如果避孕需求被满足,每年将使孕产妇死亡率降低29%[4]。COC具有高效、简便、可逆等优势。通过抑制排卵、改变子宫颈黏液性状、改变子宫内膜形态及功能、改变输卵管功能等多环节共同作用达到控制生育的目的。大多数COC的给药方案于月经周期的第1~5天开始服用,每天1片;停药4~7d,停药期间有少量阴道流血即撤退性出血。常规、正确使用,COC的避孕有效率可达99%以上。WHO关于COC避孕效果的研究发现,导致COC避孕失败的主要原因是服药不规律和漏服。当1个周期中漏服3片甚至更多药片时,其妊娠的可能性最大。另外,如果同时正在使用影响肝酶代谢的药物,也会对COC的避孕效果产生干扰[5-6]。
倾向于使用COC的妇女认为,这种避孕方法能够由自己控制,并可以随时停用,无需计划生育服务提供者的更多的帮助,不影响性生活。目前,COC除了在临床上被广泛用作避孕、预防非意愿妊娠外,其在使用的同时所带来的健康获益越来越多地被大众所认知,而其已知的健康风险罕见,对大多数育龄期健康妇女都安全和适用[6]。
COC的使用禁忌证见表2、慎用情况见表3。COC的药物相互作用:(1)抗逆转录病毒治疗药物:利托那韦等蛋白酶抑制剂;(2)抗惊厥药物:苯妥英钠、卡马西平、巴比妥、扑米酮、托吡酯、奥卡西平、拉莫三嗪;(3)抗微生物治疗药物:利福平、利福布汀。
表2 COC的使用禁忌证

注:1mmHg = 0.133kPa;COC:复方口服避孕药;VTE:静脉血栓栓塞;DVT:深静脉血栓形成;PE:肺栓塞;SLE:系统性红斑狼疮
表3 COC的慎用情况

注:1mmHg = 0.133kPa;COC:复方口服避孕药;VTE:静脉血栓栓塞;DVT:深静脉血栓形成;PE:肺栓塞;SLE:系统性红斑狼疮
COC的不良反应:(1)类早孕反应:少数妇女常在服药第1~2周期发生,如轻度的恶心、食欲不振、头晕、乏力、嗜睡、呕吐等,继续服药后即可自行改善。(2)阴道流血:一般发生在服药初期,表现为点滴出血或月经样突破性出血。较常见的原因一部分与服药初期一些妇女体内激素水平波动有关,另外常见的原因为漏服、不定时服用、服药方法错误或药品质量受损等。可在医师检查指导下处理。(3)月经量减少或停经:这是因为COC会抑制子宫内膜增殖,导致月经量减少或停经。出现月经量减少一般不需要处理,因为不影响健康,停药后自行恢复正常。对停经的妇女,需排除妊娠的可能。若使用者确实不能接受月经量减少或停经,根据具体情况可停用或更换其他避孕方法。(4)乳房胀痛:一般不需处理,随服药时间延长,症状可自行消失。(5)体质量增加:少数妇女服药后发生水钠潴留,表现为体质量轻度增加。不影响健康,若体质量增加明显可以停药观察。(6)皮肤褐斑:少数妇女服药后出现皮肤褐斑,日晒后加重。不影响健康。停药后多能自行减弱。(7)极少数使用者可出现精神抑郁、头晕、乏力、性欲减退、皮疹、皮肤瘙痒等。
COC漏服时的补救措施:服用COC过程中如出现漏服现象,需立即补救以免出现避孕失败。漏服1片且未超时12h,除须按常规服药1片外,应立即再补服1片,以后继续每天按时服用,无需采用其他避孕措施。如漏服超过12h或漏服2片及以上时,原则为立即补服1片,若剩余药片为7片及以上时,可继续常规服药,同时,需要避孕套等屏障避孕法最少7d,或采用紧急避孕方法,防止非意愿妊娠;若剩余药片不足7片,可在常规服用完本周期药片后立即服用下个周期的药片。如在月经来潮第2~5天后开始服药,服药最初7d内最好加用其他避孕措施。若漏服无活性药片,无论几片,丢弃未服用的无活性药片,照常继续服药。
COC的长期使用安全性
一、COC与生育的关系
要点:(1)COC对生育的影响是可逆的,停药后即可恢复。(2)COC本身无致畸作用,不增加胎儿先天性畸形的风险,对染色体无影响。(3)COC对生育力有保护作用。
若坚持正确使用COC,使用COC期间可避免妊娠,停用后即可恢复生理周期和生育力,停药第1个月经周期就可以恢复排卵,恢复生育功能[7]。而且,对停用COC后的妊娠无影响。使用COC期间妊娠或妊娠期间误服了COC,并不增加胎儿先天性畸形的风险,不会导致新生儿致畸[8-10]。而且,停药后即可妊娠,无需等待3~6个月。
另外,COC对生育力有保护作用。首先,COC具有可靠的避孕效果,可减少非意愿妊娠(宫内或异位妊娠),从而减少了因流产导致的各种并发症及对生育的影响。其次,COC还能调节月经,使妇女免于因月经失调所致的疾病。第三,COC还能减少盆腔感染的发生,从而对输卵管的功能起到保护作用。COC使用者异位妊娠的发生风险可减少90%[11]。
二、COC与心血管疾病的关系
要点:COC使用与静脉血栓栓塞(venous thrombo embolism,VTE)、脑卒中和心肌梗死等心血管疾病风险增加相关,这一直是COC安全性的重要关注点。
当前的观点如下:
1.COC使用与VTE:
VTE发生风险与多种因素有关,包括高龄、肥胖、妊娠或产后、凝血因子基因突变、VTE家族和个人史、使用雌激素和孕激素、制动、手术或意外、长途飞行等[12]。COC中雌激素的剂量与VTE发生风险有关,降低COC中的雌激素(炔雌醇)含量,能明显降低VTE的发生风险。WHO、FDA和国际计划生育联合会(IPPF)建议使用低剂量COC,即COC中炔雌醇含量≤35µg[5]。但使用低剂量COC发生VTE的风险并没有降至0。VTE是低剂量COC的一种罕见不良事件,VTE发生风险显著低于妊娠和产后[13]。未妊娠、非COC使用者的VTE发生率为5/10 000妇女年,COC使用者为9/10 000妇女年,而妊娠妇女为29/10 000妇女年。
使用COC的初期(第1年)VTE发生风险最高;使用时间越长,风险越低。若使用间断4周以上,则再次使用的初期风险也会增加[13-14]。
凝血因子Ⅴ Leiden突变是目前已明确的与VTE相关的遗传缺陷。研究显示,该突变在高加索人群发生率为5.27%,比亚裔(0.45%)高出10余倍,故亚洲人群发生VTE的风险远低于高加索人群[15]。
因此,识别危险因素(如年龄、个人史、家族史、肥胖等)是降低使用COC妇女VTE发生风险的关键。
2.COC使用与动脉血栓栓塞:
动脉血栓栓塞(ATE;包括脑卒中和心肌梗死)发生风险与多种因素有关,主要包括高龄、吸烟、高血压、肥胖、糖尿病、脂代谢异常等。COC使用者中所有类型的动脉事件总发生率非常低(1/10 000妇女年~3/10 000妇女年)。识别危险因素是降低使用COC妇女ATE发生风险的关键[16]。
3.关于含不同孕激素COC与心血管疾病发生风险的争议:
这一争议始于20世纪90年代。根据20多年的争论[13-14,17-18],总结证据,可得到目前的结论:(1)第3代孕激素COC(含孕二烯酮、去氧孕烯)发生VTE的风险略高于第2代孕激素COC(含左炔诺孕酮),而含屈螺酮的COC发生VTE的风险介于第2代与第3代孕激素COC之间。(2)第2代孕激素COC发生ATE(脑卒中和急性心肌梗死)的风险高于第3代孕激素COC、含屈螺酮的COC。(3)全面评估表明,新型COC(第3代孕激素COC、含屈螺酮的COC)利大于弊,总体获益优于第2代孕激素COC。
总之,心血管疾病发生是多因素共同作用的结果。有高危因素存在时,如吸烟、肥胖、高血压、脂代谢异常、有血栓疾病史等,会增加COC使用者发生心血管疾病的风险。但COC在健康妇女中使用心血管疾病发生的绝对风险极低。临床医师在应用COC时应排除禁忌证,对有高危因素的妇女应根据实际情况而定,以求获益最大,风险最小。
三、COC与恶性肿瘤的关系
要点:健康妇女使用COC,可降低卵巢上皮性癌(卵巢癌)、子宫内膜癌和结直肠癌的发生风险;不增加或轻微增加乳腺癌的发生风险;可增加子宫颈癌的发生风险,但不是子宫颈癌的主要风险因素。
1.COC与卵巢癌:
COC可降低卵巢癌的发生风险。首次服用的年龄越早,服用时间越长,卵巢癌的发生风险越低。这种风险降低在停用COC后可持续近30年[19-22]。
2.COC与子宫内膜癌:
COC可显著降低子宫内膜癌的发病风险。随着持续使用COC时间的延长,对预防子宫内膜癌的保护作用也逐渐增加,即使停用COC多年后预防子宫内膜癌的保护作用仍持续存在[21-22]。
3.COC与乳腺癌 :
COC使用情况与乳腺癌的风险关系,不同研究结论不一致,大多数研究的结论认为,无论近期还是以前使用过COC,乳腺癌的发生率均与同龄的未使用者无明显差异或仅轻微增加;长期使用COC的妇女中,乳腺癌的发生率也未增加或仅轻微增加;即使在那些显示使用COC的妇女乳腺癌发生率轻微增加的研究中,这种风险也会在停用COC10年内逐渐消失[21-25]。有乳腺癌家族史的妇女,使用COC后,其乳腺癌的发生率并未进一步增加。总之,COC不增加或仅轻微增加乳腺癌的发生风险;对有乳腺癌家族史的妇女,根据WHO“避孕方法选择的医学标准”,也可以合理选择使用COC,在使用的过程中,需定期随访[5]。
4.COC与子宫颈癌:
COC会增加子宫颈癌的发生风险,但不是子宫颈癌的主要风险因素,HPV感染是子宫颈癌的主要风险因素。COC仅增加了感染HPV的妇女发生子宫颈癌的风险,对未感染HPV的妇女并无影响。对曾经使用或正在使用COC的妇女,子宫颈癌的发生风险增加。有HPV感染并且使用COC超过5年的妇女,子宫颈癌发生风险增加约3倍。在停药后,COC对子宫颈癌的这种不利影响降低,并在10年后恢复到正常人群水平。生殖器官感染HPV的概率与避孕方法有关。避孕套、宫内节育器、宫内缓释系统均不增加子宫颈癌的风险;而使用COC的妇女,往往不会再同时使用避孕套,这种屏障作用减少了,增加了HPV的暴露。雌、孕激素可增加某些HPV的基因表达,并通过病毒基因组的激素应答及受体调节刺激子宫颈细胞增殖[21-23,26]。与其说COC增加了子宫颈癌的发生风险,不如说COC增加了使用者HPV暴露的机会,从而增加了子宫颈癌的发生风险。可以通过预防,将这种风险降至最低,建议使用COC的妇女1年至少进行1次子宫颈癌筛查,尤其是使用超过5年的妇女。
5.COC与结直肠癌:
使用COC的妇女与从未使用过COC的妇女相比,结直肠癌的发病风险降低15%左右[23,27]。
COC的非避孕应用
一、COC对异常子宫出血的作用
要点:异常子宫出血(abnormal uterine bleeding,AUB)指非妊娠期源于宫腔的出血,表现在周期、量、频率及持续时间的异常,病因包括有结构性改变和无结构性改变两类。COC对各种无结构性改变的病因导致的AUB有不同程度的治疗作用;另一方面,COC在用药初期或用药方法不当时又会导致AUB的发生。
国际妇产科联盟(FIGO)规定的育龄期妇女正常月经的各参数正常值为:月经周期24~38d,12个月内月经周期长度之间的变化范围为2~20d,经期持续4.5~8.0d,平均失血量为5~80ml[28]。我国确定的月经的正常值范围为:月经周期21~35d,12个月内月经周期长度之间的变化范围< 7d,经期持续3~7d,平均失血量为5~80ml[29]。凡不符合上述标准者均属AUB。
AUB的病因有多种,分为有结构性改变和无结构性改变的AUB[30],2011年FIGO关于AUB的PALM-COEIN病因分类具体为:结构性改变病因:子宫内膜息肉(polyp)所致AUB、子宫腺肌病(adenomyosis)所致AUB、子宫肌瘤(leiomyoma)所致AUB、子宫内膜恶变和不典型增生(malignancy and hyperplasia)所致AUB。无结构性改变病因:凝血相关疾病(coagulopathy)所致AUB、排卵功能障碍(ovulatory dysfunction)相关的AUB、子宫内膜局部异常(endometrial)所致AUB、医源性(iatrogenic)AUB、未分类(not yet classified)的AUB。
COC可减少月经量,周期性使用可规律月经周期,连续使用可长期抑制月经[31],COC对各种无结构性改变的病因导致的AUB均有不同程度的治疗作用。并无证据证明不同COC的治疗效果有不同;周期服用COC和连续服用COC均有效,而周期服用产生规律的撤退性出血,连续服用COC可延长月经间的时间;连续服用COC比周期服用COC减少出血时间和量的作用更强,但突破性出血和点滴出血症状增多。COC用于止血治疗,建议每次1~2片,每8~12小时重复1次,血止3d后逐渐减量至每天1片维持至本周期结束。对于出现中重度贫血的患者,可增加COC的服药天数以推迟月经,待贫血改善后停药发生撤退性月经。为调节月经周期,一般在止血用药撤退性出血后,周期性使用COC 3个周期,病情反复者可酌情延长至6个周期。
COC治疗排卵功能障碍相关的AUB的效果,临床研究发现,与单纯雌激素或单纯孕激素药物相比,COC的止血率更高、止血所需时间更短。但相关的随机对照临床研究较少,关于哪种治疗方法或哪种制剂更加有效,目前尚不能得出结论[32-35]。对于青少年排卵功能障碍相关的AUB者推荐选择低剂量COC(20~35μg炔雌醇),尤其是伴有多毛症和雄激素过多症者,COC抑制卵巢和肾上腺产生雄激素,增加性激素结合球蛋白(SHBG),进一步减少游离雄激素,改善痤疮和多毛症状,有助于恢复月经周期[36]。
子宫内膜局部异常所致AUB表现为月经周期规律,但月经量过多或经间期出血。系统评价显示,COC可使出血量减少35%~69%,效果劣于左炔诺孕酮宫内缓释系统(后者减少71%~95%),但优于非甾体类抗炎药(后者减少10%~52%)[37]。
凝血相关疾病所致AUB表现为月经量过多,治疗应首先纠正凝血功能,使用COC可减少子宫出血量[38]。
导致医源性AUB的因素包括使用外源性激素、宫内节育器、影响性激素水平的非性激素类药物及干扰凝血功能的药物等,使用外源性激素类避孕制剂及宫内节育器是医源性AUB的主要原因[30]。需评估COC使用方法有无不当,以及有无与其他药物相互作用导致药物吸收不良等,必要时行妊娠试验以排除妊娠,并确认出血来源于子宫。使用性激素类避孕制剂的最初3个月内出现AUB比较常见,继续使用同样的制剂至少3个月后AUB有可能自然好转;对于3个月后的持续性出血,可换用含雌激素剂量更高的COC[39]。宫内节育器(不含激素成分)对子宫内膜的机械性刺激导致宫腔内纤溶酶原激活物、纤溶酶活性增加,是发生AUB的重要原因[40]。随机对照研究显示,COC能够有效治疗由于放置宫内节育器而导致的AUB[40]。
二、COC对经前期综合征的作用
要点:经前期综合征(premenstrualsyndrome,PMS)是指在月经前周期性发生影响妇女日常生活和工作,涉及躯体、精神及行为的症候群,在黄体期发生,月经来潮后可自然消失。目前发病原因不清,治疗以COC和抗抑郁药物为首选。
1.诊断:
PMS中伴有严重情绪不稳定者为经前期情绪障碍(premenstrualdysphoricdisorder,PMDD),发病原因与卵巢激素变化有关[41]。在人群中的发生率差异很大。PMDD的确诊应包括至少1项心理或生理症状并严重影响妇女的日常生活,为确定诊断应包括至少连续观察3个月经周期、症状限制在月经周期的黄体期并且周期性复发[42]。PMDD的发病因素尚无定论,存在多种假说,但卵巢激素的波动是各种假说的基础,激素波动导致黄体期的水潴留是PMS症状发生的重要影响因素[43]。
2.治疗:
轻度症状可采用改变生活方式、饮食调节、补充维生素和钙剂、社会支持和认知行为治疗。上述治疗效果不佳时,应选用药物治疗,药物治疗包括两种治疗方案:1种是针对下丘脑-垂体-卵巢轴抑制性激素水平波动,如GnRH类似物、雌二醇、COC;另1种是针对大脑神经突触的神经递质,如选择性5-羟色胺再摄取抑制剂(SSRI)[42]。
具有抗盐皮质激素和抗雄激素作用的COC治疗PMS和 PMDD,可明显改善症状[44-45]。屈螺酮3mg +炔雌醇20μg COC的服用模式对PMS治疗效果的比较研究表明,服用24d含激素药片+ 4d空白药片的用法能更好地改善PMDD症状[46-47]。2006年,FDA公布支持屈螺酮3mg +炔雌醇20μg COC的24d活性药片+ 4d空白药片(即24/4)方案用于有避孕要求的PMDD妇女。
三、COC对女性痤疮、多毛症的作用
(一)COC对女性痤疮的作用
要点:(1)雄激素水平增高或雄激素受体敏感性增加均可导致皮脂过量分泌,是导致痤疮发生的重要原因。(2)所有COC对痤疮均有潜在的治疗作用,对于有避孕要求的女性痤疮患者是理想的选择。(3)含有低雄激素活性孕激素的COC,以及含有抗雄激素作用孕激素的COC治疗女性痤疮效果肯定。
1.发病机制和流行病学:
痤疮的发生主要与皮脂分泌过度、毛囊皮脂腺导管异常角化堵塞、大量皮脂排出障碍致细菌感染及炎症反应等有关。其中皮脂腺分泌由雄激素主导,雄激素水平增高或雄激素受体敏感性增加均可导致皮脂过量分泌,是导致痤疮的重要原因。12~24岁的青少年中,痤疮发病率高达85%[48];而在20~49岁的妇女中,痤疮发病率为26.3%~50.9%[49]。
2.COC的治疗作用:
所有的COC对痤疮均有一定的治疗作用,因为所有的COC都能抑制LH的分泌,从而减少卵巢间质细胞中雄激素的合成,减少皮脂的分泌;COC还能减少肾上腺产生的雄激素,但机制不明确,可能与降低了促肾上腺皮质激素的分泌有关;COC中的雌激素能促进肝脏合成SHBG,SHBG可以与睾酮结合,从而降低血清游离睾酮(活性雄激素)水平;一些具有抗雄激素活性的孕激素如醋酸环丙孕酮、屈螺酮等,可抑制毛囊皮脂腺上皮细胞5α-还原酶的活性,减少睾酮向双氢睾酮转化,从而阻断雄激素作用的下游启动;这些具有抗雄激素活性的孕激素还可竞争性与雄激素核受体结合,拮抗雄激素的作用[50]。COC能抑制排卵,减少LH促发的卵巢雄激素生成。所以,对于有避孕要求的女性痤疮患者,COC是理想的选择。
COC中的孕激素种类较多,包括左炔诺孕酮、屈螺酮、诺孕酯、地诺孕素等。第1代孕激素(炔诺酮)和第2代孕激素(左炔诺孕酮)有兴奋雄激素受体的作用,削弱了治疗痤疮的作用,因此不首先推荐使用。第3代孕激素(去氧孕烯、孕二烯酮、诺孕酯等)仅有微弱雄激素活性,可用于治疗痤疮。环丙孕酮是17-羟孕酮衍生物,是抗雄激素作用最强的孕激素。醋酸环丙孕酮单独使用、含醋酸环丙孕酮的COC治疗痤疮的效果明显。新型孕激素(屈螺酮、地诺孕素、诺美孕酮、曲美孕酮等)与PR的结合更具选择性且无雄激素活性,也可以用于治疗痤疮。其中屈螺酮是螺内酯类似物,具有抗雄激素和抗盐皮质激素的作用,含屈螺酮成分的COC也可有效治疗痤疮。
3.不同类型COC的优势对比:
不同类型COC在治疗痤疮方面的优势对比研究有限。目前已有的研究表明,含去氧孕烯的COC比含左炔诺孕酮的COC效果明显[51];含屈螺酮的COC效果好于含诺孕酯的COC[52];含醋酸环丙孕酮的COC比含去氧孕烯的COC效果明显[53]。研究显示,COC使用6个月可明显减少前额、前胸和背部的皮脂分泌,改善痤疮症状[54-55]。不同类型COC在治疗痤疮方面的优劣还需要进一步研究,含有抗雄激素作用孕激素(醋酸环丙孕酮、屈螺酮)的COC可能略占优势。
(二)COC对女性多毛症的作用
要点:(1)女性多毛症最常见的病因是多囊卵巢综合征(PCOS)。(2)含有第3代孕激素的COC,以及含有抗雄激素作用孕激素的COC是治疗多毛症的一线用药。(3)对于易栓症人群可考虑使用含有第2代孕激素的COC治疗多毛症,以降低血栓风险。
1.发病机制:
女性多毛症的定义为女性性征区域毛发增多且呈现男型分布,这些区域包括上唇、下颌、胸部、后背、上下腹、近端手臂和大腿等[56]。育龄期妇女多毛症的发生率为5%~10%,主要与体内雄激素过多或对雄激素过度敏感有关。多毛症最常见的病因是多囊卵巢综合征(PCOS),占多毛症的72%~82%[57-58]。在治疗多毛症时,要注意鉴别各种引起雄激素水平增高的疾病,特别要注意排除恶性肿瘤[59]。
2.治疗:
多毛症的治疗原则是纠正性激素不平衡、减缓毛发生长或使其停止、改善生命质量[60]。COC通过增加SHBG,抑制卵巢雄激素合成来降低血清游离睾酮水平达到治疗多毛症的目的。目前,COC已成为绝经前无妊娠要求的妇女治疗多毛症的一线药物。不同类型COC治疗多毛症的效果有所不同。含有第3代孕激素(如去氧孕烯、孕二烯酮)的COC,其孕激素成分具有低雄激素活性,能够用于治疗多毛症;含有抗雄激素活性的孕激素(如醋酸环丙孕酮、屈螺酮)的COC治疗多毛症效果肯定。另外,因为终毛的更新比较慢,通常至少需要6个月的抗雄激素药物治疗才能有疗效[61],国外的临床指南也推荐使用COC 1~2年治疗多毛症,因为有研究显示,在长期使用COC停药后,血清雄激素水平仍能被持续抑制长达2年之久[53]。
四、COC对子宫内膜异位症、子宫腺肌病及痛经的作用
要点:(1)COC是原发性痛经和子宫内膜异位症(内异症)相关疼痛的一线治疗药物,并可以治疗子宫腺肌病相关疼痛和月经量增多,可选择周期性或连续用药。(2)COC可以预防内异症手术后疼痛和异位囊肿的复发。(3)不推荐COC用于治疗内异症合并不孕的患者。
内异症的主要症状有疼痛[痛经、慢性盆腔痛(CPP)、性交痛等]、不孕等[62]。内异症影响5%~10%的育龄期妇女[63]。目前,治疗内异症的方法主要包括手术及药物。手术治疗可以明确诊断,切除病灶,恢复盆腔解剖,从而减轻症状,有助于妊娠。药物治疗可以抑制卵巢功能,阻止内异症进展,减少内异症病灶的活性,从而控制疼痛症状,减少复发[62]。
COC治疗内异症疼痛的机制是通过抑制排卵和子宫内膜生长,从而减少月经量和前列腺素分泌,降低宫腔压力和子宫痉挛[64]。COC治疗原发性痛经和内异症相关疼痛的有效率达75%~90%或以上[65-67]。
COC在内异症和子宫腺肌病中的应用主要是以下几个方面:
1.内异症相关疼痛症状的控制:
对于轻中度痛经患者,如果无手术指征且无生育要求,可以不经手术确诊内异症而进行经验性药物治疗[64]。COC是一线治疗药物,用药方式可选择周期性或连续用药[68]。对重度痛经的内异症患者,可以先使用促性腺激素释放激素激动剂(GnRH-a)治疗3~6个月,之后可使用COC进行后续治疗[69]。COC也可用于治疗内异症相关的慢性盆腔痛(CPP)、性交痛和排便痛。
2.预防术后复发:
子宫内膜异位囊肿或深部浸润型内异症手术后使用COC或GnRH-a3~6个月并后续使用COC,可预防术后疼痛和内膜异位囊肿的复发[70]。如果无COC的使用禁忌且无生育要求,COC可以长期使用。治疗期间应随诊内异症病情的变化。
3.治疗子宫腺肌病相关疼痛和月经量增多:
子宫腺肌病可以引起严重的痛经和月经量增多。COC可使子宫内膜及异位内膜萎缩,使月经量减少,痛经减轻[71]。治疗原则同内异症。
周期性COC用法是模拟月经模式,突破性出血的机会较少,患者依从性较好。COC连续用药可以避免月经来潮,减少激素撤退症状,效果比周期性用药好,但突破性出血的发生率较高[72]。痛经可以先周期性用药,如果无效,则可改成连续用药[68]。内异症相关的非周期性CPP则建议连续用药[68]。如果连续用药仍无效,则改用其他方法如二线药物治疗。
五、COC治疗CPP
要点:(1)CPP原因众多,应该积极查找病因,进行源头治疗。(2)COC是治疗CPP首选的经济实惠药物,连续用药效果可能优于周期性用药。(3)COC有助于降低CPP发生率。
美国妇产科医师协会(ACOG)将CPP定义为发生在盆腔、前腹壁、腰背及臀部的非周期性疼痛,持续至少6个月,而且导致功能障碍和需要医疗干预[73]。CPP的发病率为5.7%~26.6%。CPP的高危因素包含有多种心理共病现象,妇科疾病包括内异症、盆腔炎症性疾病(PID)、月经过多、盆腔静脉淤血综合征、盆腔粘连等,其中以内异症最常见[74]。
治疗上,应积极寻找病因,采取针对性的治疗。对内异症、子宫腺肌病和盆腔静脉淤血综合征等疾病导致的疼痛,推荐使用COC、孕激素和GnRH-a治疗,通常能取得一定疗效,其中COC因为经济实惠可作为CPP的首选治疗药物。COC能够显著改善痛经,COC能有效治疗原发性痛经。2005年,加拿大妇产科医师协会(SOGC)的原发性痛经指南建议将COC应用于原发性痛经的治疗。由于COC有避孕作用,对于有避孕要求的患者可作为一线治疗。若出现撤退性出血和COC使用相关疼痛(多出现在使用COC空白片期间)可以改为连续服用COC,疗程一般为6~12个月。鉴于内异症相关疼痛的机制复杂,现多主张对内异症采取长期综合个体化治疗。COC缓解内异症相关CPP的效果与GnRH-a相仿,但是潮热、阴道干涩等不良反应较少[75],而且相对价廉,因此,目前国内外推荐COC作为缓解内异症相关疼痛的一线治疗药物。内异症手术后常需药物来控制疼痛,可周期性使用COC,若效果不佳,可改为连续用药,后者控制痛经复发的效果更佳[76]。经2~3个月的治疗后若疼痛症状仍无明显改善,则需改用GnRH-a治疗。
COC还有助于降低CPP发生率。COC的避孕成功率达99%以上,使非意愿妊娠发生率和人工流产率降低,有助于减少流产后感染和宫腔粘连,防止PID和异位妊娠发生,从而降低此类疾病引起的CPP。
六、COC对子宫肌瘤的作用
要点:(1)COC不影响子宫肌瘤生长,子宫肌瘤患者可以规范使用COC。(2)COC不能缩小子宫肌瘤的体积,但可以减少月经量并控制月经周期。
子宫肌瘤多见于30~50岁妇女,发生发展的确切机制仍未明确。生育年龄的高发病率和绝经后发病率降低的临床特点,提示该病可能与性激素有关[77]。并无证据显示,低剂量COC促进肌瘤的生长[78],WHO指出,子宫肌瘤患者无使用COC的限制[5]。
子宫肌瘤的治疗包括保守治疗和手术治疗,保守治疗的目的是缓解症状,目前治疗子宫肌瘤的药物包括孕激素、COC、非甾体类抗炎药、GnRH-a。在治疗子宫肌瘤的药物中,COC的不良反应最小。COC不能缩小子宫肌瘤的体积,但可以减少月经量并且规律月经周期。临床上应用COC能暂时治疗子宫肌瘤相关的出血,从而在一定程度上改善临床症状[79]。
七、COC对PID的作用
COC可以通过多种途径减少PID的发生、发展:
1. COC的孕激素成分使子宫颈黏液的黏度增加并增厚,不利于细菌生长,子宫颈黏液栓的形成可以抑制细菌的上行感染途径,减少PID的发生。
2. COC的规律使用可以减少月经量及AUB的发生率,从而减少PID发生的机会。
3. COC的使用可以减少非意愿妊娠的发生和随后的终止妊娠手术,在一定程度上减少了宫腔操作,减少PID的发生机会。
PID的及早诊断和有效治疗可以减少PID后遗症(如输卵管因素不孕、异位妊娠和CPP等)的发生。在PID的病原菌中,性传播感染(sexuallytransmittedinfection,STI)的病原体如淋病奈瑟菌、沙眼衣原体是其主要的致病原[80]。
关于COC与子宫内膜炎的关系,有研究认为,与未使用COC的妇女相比,COC使用者在使用期间可以降低子宫内膜炎的发生率。COC使用是炎性疾病的保护性因素,同时发现,之前使用COC但停用较长时间如2~4年后,COC的炎性疾病保护作用会逐渐减弱。一些流行病学研究证明,与未使用避孕方法或使用屏障避孕方法的妇女相比,使用COC会使输卵管炎的发生风险降低50%~80%[81];可能的保护机制包括COC的孕激素成分使子宫颈黏液的黏度增加并增厚,不利于细菌生长,子宫颈黏液栓的形成可以抑制细菌的上行感染途径,另外,COC可以减少月经量,从而减少经血逆流到输卵管的可能性。COC对PID的发生提供保护作用[81]。COC的使用可以减少非意愿妊娠的发生和随后的终止妊娠手术,在一定程度上减少了宫腔操作,减少PID的发生机会,同时减少输卵管妊娠和不孕不育问题的发生。
八、COC对子宫内膜息肉的作用
要点:(1)COC是子宫内膜息肉的保护性因素。(2)育龄期妇女,子宫内膜息肉保守治疗可以选择COC使用3~6个月。(3)育龄期妇女,宫腔镜子宫内膜息肉切除术(TCRP)后联合COC治疗3~6个月,可以减少子宫内膜息肉的复发。
子宫内膜息肉的发病率有不同的报道,为2.7%~8.0%,随着宫腔镜技术的普及,报道的发病率也在增加。其在35岁后高发,在绝经后妇女中也有一定的发生率。其发病机制不明,长期持续高雌激素及炎症等刺激使局部子宫内膜过度增殖可形成息肉。有研究表明,使用COC与子宫内膜息肉负相关,是子宫内膜息肉的保护性因素[82]。
子宫内膜息肉保守治疗可以选择COC使用3~6个月[83]。
子宫内膜息肉手术后配合药物治疗可以减少复发。TCRP术后使用短效COC不但在减少术后出血、调整月经周期等方面有一定疗效[84],而且,可显著控制息肉复发[85]。手术后加用孕激素、COC和孕三烯酮均能明显降低子宫内膜息肉的复发率。COC和孕三烯酮的疗效优于孕激素,其中COC的接受性和依从性优于孕三烯酮[85]。建议TCRP术后联合COC治疗3~6个月以减少子宫内膜息肉的复发。
COC是目前全球范围内广泛应用的避孕方式之一,其具有高效、简便、可逆等优势。合理规范的应用COC可以使避孕效果达到99%以上。COC不断发展,以降低使用过程中的不良反应,增加药物的额外获益。禁止对有禁忌证的妇女使用COC,在应用COC时需注意高危因素,并结合个体情况具体处理,以将COC可能发生的不良反应降到最低,增加使用者的接受性和依从性。在避孕的同时,临床上也应用COC治疗AUB、PMS、PMDD、痤疮、多毛症、痛经、内异症、CPP、PID、子宫肌瘤、子宫内膜息肉等,而且已经经过多年发展,已使使用者获得了多方面的受益。在临床治疗时需结合患者的避孕需求,对作为一线治疗的疾病应尽早应用,对作为手术辅助用药时需考虑应用的必要性。
[1] Wang C. Trends in contraceptive use and determinants of choice in China:1980-2010[J]. Contraception,2012,85(6):570-579.
[2] Klipping C. Suppression of ovarian activity with a drospirenonecontaining oral contraceptive in a 24/4 regimen[J]. Contraception,2008,78(1):16-25.
[3] Christin-Maitre S,Serfaty D,Chabbert-Buffet N,et al. Comparison of a 24-day and a 21-day pill regimen for the novel combined oral contraceptive,nomegestrol acetate and 17β-estradiol (NOMAC/E2):a double-blind,randomized study[J]. Hum Reprod,2011,26(6):1338-1347.
[4] Ahmed S,Li Q,Liu L,et al. Maternal deaths averted by contraceptive use:an analysis of 172 countries[J]. Lancet,2012,380(9837):111-125.
[5] WHO. Medical eligibility criteria for contraceptive use. A WHO family planning cornerstone[M]. 4th ed. Geneva:WHO,2009.
[6] WHO. Family planning:a global handbook for providers. A WHO family planning cornerstone[M]. Geneva:WHO,2007.
[7] Cronin M,Schellschmidt I,Dinger J. Rate of pregnancy after using drospirenone and other progestin-containing oral contraceptives[J]. Obstet Gynecol,2009,114(3):616-622.
[8] Harlap S,Shiono PH,Ramcharan S,et al. Chromosomal abnormalities in the Kaiser-Permanente birth defects study,with special reference to contraceptive use around the time of conception[J]. Teratology,1985,31(3):381-387.
[9] Bracken MB. Oral contraception and congenital malformations in offspring:a review and meta-analysis of the prospective studies[J]. Obstet Gynecol,1990,76(3 Pt 2):552-557.
[10] Waller DK,Gallaway MS,Taylor LG,et al. Use of oral contraceptives in pregnancy and major structural birth defects in offspring[J]. Epidemiology,2010,21(2):232-239.
[11] 彭舟丽,阮祥燕.复方口服避孕药与盆腔炎和异位妊娠[J].实用妇产科杂志,2004,20(6):326-327.
[12] Anderson FA Jr,Spencer FA. Risk factors for venous thromboembolism[J]. Circulation,2003,107(23 Suppl 1):9-16.
[13] Dinger JC,Heinemann LA,Kühl-Habich D. The safety of a drospirenone-containing oral contraceptive:final results from the European Active Surveillance Study on oral contraceptives based on 142,475 women-years of observation[J]. Contraception,2007,75(5):344-354.
[14] Dinger J,Assmann A,Mohner S,et al. Risk of venous thromboembolism and the use of dienogest- and drospirenonecontaining oral contraceptives:results from a German casecontrol study[J]. J Fam Plann Reprod Health Care,2010,36 (3):123-129.
[15] 赵永强.我国静脉血栓栓塞症的研究现状[J].中华内科杂志,2005,44(2):83-84.
[16] Baillargeon JP,McClish DK. Association between the current use of low-dose oral contraceptives and cardiovascular arterial disease:a meta-analysis[J]. J Clin Endocrinol Metab,2005,90(7):3863-3870.
[17] Dinger J,Bardenheuer K,Heinemann K. Cardiovascular and general safety of a 24-day regimen of drospirenonecontaining combined oral contraceptives:final results from the International Active Surveillance Study of Women Taking Oral Contraceptives[J]. Contraception,2014,89(4):253-263.
[18] Ouellet-Hellstrom R,Graham DJ,Staffa JA,et al. Combined hormonal contraceptives(CHCs)and the risk of cardiovascular endpoints [EB/OL]. 2011 [2014-09-26]. http://www.fda.gov/ downloads/Drugs/DrugSafety/UCM277384.pdf.
[19] Beral V,Doll R,Hermon C,et al. Ovarian cancer and oral contraceptives:collaborative reanalysis of data from 45 epidemiological studies including 23,257 women with ovarian cancer and 87,303 controls[J]. Lancet,2008,371(9609):303-314.
[20] Havrilesky LJ,Gierisch JM,Moorman PG,et al. Oral contraceptive use for the primary prevention of ovarian cancer[J]. Evid Rep Technol Assess(Full Rep),2013,212:1-514.
[21] Hannaford PC,Selvaraj S. Cancer risk among users of oral contraceptives:cohort data from the Royal College of General Practitioner's oral contraception study[J]. BMJ,2007,335 (7621):651.
[22] Vessey M,Yeates D. Oral contraceptive use and cancer:final report from the Oxford-Family Planning Association contraceptive study[J]. Contraception,2013,88(6):678-683.
[23] Gierisch JM,Coeytaux RR. Oral contraceptive use and risk of breast,cervical,colorectal,and endometrial cancers:a systematic review[J]. Cancer Epidemiol Biomarkers Prev,2013,22(11):1931-1943.
[24] Zhu H,Lei X,Feng J,et al. Oral contraceptive use and risk of breast cancer:a meta-analysis of prospective cohort studies[J]. Eur J Contracept Reprod Health Care,2012,17(6):402-414.
[25] Kahlenborn C,Modugno F,Potter DM,et al. Oral contraceptive use as a risk factor for premenopausal breast cancer:a metaanalysis[J]. Mayo Clin Proc,2006,81(10):1290-1302.
[26] 王平,郑芳,田小飞,等.口服避孕药的应用与宫颈上皮性鳞癌关系的系统评价[J].现代肿瘤医学,2009,17(5):917-920.
[27] Bosetti C,Bravi F,Negri E,et al. Oral contraceptives and colorectal cancer risk:a systematic review and meta-analysis[J]. Hum Reprod Update,2009,15(5):489-498.
[28] Munro MG,Critchley HO,Fraser IS. The FIGO systems for nomenclature and classification of causes of abnormal uterine bleeding in the reproductive years:who needs them?[J]. Am J Obstet Gynecol,2012,207(4):259-265.
[29] 中华医学会妇产科分会妇科内分泌学组.异常子宫出血诊断与治疗指南[J].中华妇产科杂志,2014,49(11):801-806.
[30] Munro MG,Critchley HO,Broder MS,et al. FIGO classification system(PALM-COEIN)for causes of abnormal uterine bleeding in nongravid women of reproductive age[J]. Int J Gynaecol Obstet,2011,113(1):3-13.
[31] ACOG Practice Bulletin No. 110:noncontraceptive uses of hormonal contraceptives[J]. Obstet Gynecol,2010,115(1):206-218.
[32] Committee on Practice Bulletins—Gynecology. Practice bulletin no. 136:management of abnormal uterine bleeding associated with ovulatory dysfunction[J]. Obstet Gynecol,2013,122(1):176-185.
[33] Hickey M,Higham JM,Fraser I. Progestogens with or without oestrogen for irregular uterine bleeding associated with anovulation[J]. Cochrane Database Syst Rev,2012,9:CD001895.
[34] 孙春玲,袁桂兰,章颖.口服雌激素、孕激素、避孕药治疗青春期功能性子宫出血的效果[J].中国妇幼保健,2011,26 (16):2551-2553.
[35] 蔡琼.优思明治疗功能性子宫出血的临床观察[J].中国医药科学,2012,2(16):76-79.
[36] Wilkinson JP,Kadir RA. Management of abnormal uterine bleeding in adolescents[J]. J Pediatr Adolesc Gynecol,2010,23(6 Suppl):S22-S30.
[37] Matteson KA,Rahn DD,Wheeler TL 2nd,et al. Nonsurgical management of heavy menstrual bleeding:a systematic review[J]. ObstetGynecol,2013,121(3):632-643.
[38] Nichols WL,Hultin MB,James AH,et al. vonWillebrand disease(VWD):evidence-based diagnosis and management guidelines,the National Heart,Lung,and Blood Institute (NHLBI)Expert Panel report(USA)[J]. Haemophilia,2008,14(2):171-232.
[39] Faculty of Sexual and Reproductive Healthcare. Management of unscheduled bleeding in women using hormonal contraception [EB/OL]. 2009 [2014-06-28]. http://www.fsrh.org/pdfs/ unscheduledbleedingmay09.pdf.
[40] 黎燕玲.短期口服避孕药防治放环后不规则阴道出血的效果[J].华夏医学,2013,26(4):677-679.
[41] 曹泽毅.中华妇产科学[M]. 2版.北京:人民卫生出版社,2004:2487-2494.
[42] Committee for Medicinal Products for Human Use(CHMP). Guideline on the treatment of premenstrual dysphoric disorder (PMDD)[EB/OL]. 2011 [2014-09-26]. http://www.ema. europa.eu/docs/en_GB/document_library/Scientific_guideline/ 2011/08/WC500110103.pdf.
[43] Barnhart KT,Freeman EW,Sondheimer SJ. A clinician's guide to premenstrual syndrome[J]. Med Clin North Am,1995,79(6):1457-1472.
[44] 周茜.一种含屈螺酮的新型单相口服避孕药对经前期综合征的影响[J].国外医学计划生育分册,2002,21(4):248.
[45] Lopez LM,Kaptein AA,Helmerhorst FM. Oral contraceptives containing drospirenone for premenstrual syndrome[J]. Cochrane Database Syst Rev,2012,2:CD006586.
[46] Yonkers KA,Brown C,Pearlstein T,et al. Efficacy of a new low-dose oral contraceptive with drospirenone in premenstrual dysphoric disorder[J]. Obstet Gynecol,2005,106(3):492-501.
[47] 付艺,宓为峰,李玲芝,等.屈螺酮炔雌醇片治疗经前期情绪障碍的疗效及安全性[J].中华妇产科杂志,2014,49(7):506-509.
[48] 涂平.痤疮治疗新进展:中国痤疮治疗共识会推荐治疗方案[J].中华皮肤科杂志,2003,36(7):421-422.
[49] Williams HC,Dellavalle RP,Garner S. Acne vulgaris[J]. Lancet,2012,379(9813):361-372.
[50] Imperato-McGinley J,Gautier T,Cai LQ,et al. The androgen control of sebum production. Studies of subjects with dihydrotestosterone deficiency and complete androgen insensitivity[J]. J Clin Endrocrinol Metab,1993,76(2):524-528.
[51] Winkler UH,Ferguson H,Mulders JA. Cycle control,quality of life and acne with two low-dose oral contraceptives containing 20 microg ethinylestradiol[J]. Contraception,2004,69(6):469-476.
[52] Thorneycroft lH,Gollnick H,Schellschmidt I. Superiority of a combined contraceptive containing drospirenone to a triphasic preparation containing norgestimate in acne treatment[J]. Cutis,2004,74(2):123-130.
[53] Bhattacharya SM,Jha A. Comparative study of the therapeutic effects of oral contraceptive pills containing desogestrel,cyproterone acetate,and drospirenone in patients with polycystic ovary syndrome[J]. Fertil Steril,2012,98(4):1053-1059.
[54] Archer JS,Chang RJ. Hirsutism and acne in polycystic ovary syndrome[J]. Best Pract Res Clin Obstet Gynaecol,2004,18 (5):737-754.
[55] Tan JK,Ediriweera C. Efficacy and safety of combined ethinyl estradiol/drospirenone oral contraceptives in the treatment of acne[J]. Int J Womens Health,2010,1:213-221.
[56] Brodell LA,Mercurio MG. Hirsutism:diagnosis and management[J]. Gend Med,2010,7(2):79-87.
[57] Carmina E,Rosato F,Janni A,et al. Extensive clinical experience:relative prevalence of different androgen excess disorders in 950 women referred because of clinical hyperandrogenism[J]. J Clin Endocrinol Metab,2006,91(1):2-6.
[58] Azziz R,Sanchez LA,Knochenhauer ES,et al. Androgen excess in women:experience with over 1000 consecutive patients[J]. J Clin Endocrinol Metab,2004,89(2):453-462.
[59] Bode D,Seehusen DA,Baird D. Hirsutism in women[J]. Am Fam Physician,2012,85(4):373-380.
[60] Escobar-Morreale HF,Carmina E,Dewailly D,et al. Epidemiology,diagnosis and management of hirsutism:a consensus statement by the Androgen Excess and Polycystic Ovary Syndrome Society[J]. Hum Reprod Update,2012,18(2):146-170.
[61] Amsterdam ESHRE/ASRM-Sponsored 3rd PCOS Consensus Workshop Group. Consensus on women's health aspects of polycystic ovary syndrome(PCOS)[J]. Hum Reprod,2012,27(1):14-24.
[62] 中华医学会妇产科学分会子宫内膜异位症协作组.子宫内膜异位症的诊断与治疗规范[J].中华妇产科杂志,2007,42 (9):645-648.
[63] Vercellini P,Viganò P,Somigliana E,et al. Endometriosis:pathogenesis and treatment[J]. Nat Rev Endocrinol,2014,10 (5):261-275.
[64] Hauksson A,Ekström P,Juchnicka E,et al. The influence ofa combined oral contraceptive on uterine activity and reactivity to agonists in primary dysmenorrhea[J]. Acta Obstet Gynecol Scand,1989,68(1):31-34.
[65] Lefebvre G,Pinsonneault O,Antao V,et al. Primary dysmenorrhea consensus guideline[J]. J Obstet Gynaecol Can,2005,27(12):1117-1146.
[66] Davis L,Kennedy SS,Moore J,et al. Modern combined oral contraceptives for pain associated with endometriosis[J]. Cochrane Database Syst Rev,2007,3:CD001019.
[67] Wong CL,Farquhar C,Roberts H,et al. Oral contraceptivepill for primary dysmenorrhea[J]. Cochrane Database Syst Rev,2009,4:CD002120.
[68] Giudice LC. Clinical practice. Endometriosis[J]. N Engl J Med,2010,362(25):2389-2398.
[69] 张绍芬,陈珣,张剑峰,等.促性腺激素释放激素激动剂与口服避孕药联合治疗重度子宫内膜异位性疾病的研究[J].中国实用妇科与产科杂志,2006,22(12):912-914.
[70] Vercellini P,DE Matteis S,Somigliana E et al. Long-term adjuvant therapy for the prevention of postoperative endometrioma recurrence:a systematic review and meta-analysis[J]. Acta Obstet Gynecol Scand,2013,92(1):8-16.
[71] Johnson NP,Hummelshoj L,World Endometriosis Society Montpellier Consortium. Consensus on current managementof endometriosis[J]. Hum Reprod,2013,28(6):1552-1568.
[72] Machado RB,de Melo NR,Maia H Jr. Bleeding patterns and menstrual-related symptoms with the continuoususe of a contraceptive combination of ethinylestradiol and drospirenone:a randomized study[J]. Contraception,2010,81(3):215-222.
[73] ACOG Committee on Practice Bulletins-Gynecology. ACOG Practice Bulletin No. 51. Chronic pelvic pain[J]. Obstet Gynecol,2004,103(3):589-605.
[74] Latthe P,Mignini L,Gray R,et al. Factors predisposing women to chronic pelvic pain:systematic review[J]. BMJ,2006,332(7544):749-755.
[75] Ozawa Y,Murakami T,Terada Y,et al. Management of the pain associated with endometriosis:an update of the painful problems[J]. Tohoku J Exp Med,2006,210(3):175-188.
[76] Seracchioli R,Mabrouk M,Frascà C,et al. Long-term oral contraceptive pills and postoperative pain management after laparoscopic excision of ovarian endometrioma:a randomized controlled trial[J]. Fertil Steril,2010,94(2):464-471.
[77] Terry KL,De Vivo I,Hankinson SE,et al. Reproductive characteristics and risk of uterine leiomyomata[J]. Fertil Steril,2010,94(7):2703-2707.
[78] Lefebvre G,Vilos G,Allaire C,et al. The management of uterine leiomyomas[J].J Obstet Gynaecol Can,2003,25(5):396-418.
[79] Farquhar C,Arroll B,Ekeroma A,et al. An evidence-based guideline for the management of uterine fibroids[J]. Aust N Z J Obstet Gynaecol,2001,41(2):125-140.
[80] 中华医学会妇产科学分会感染性疾病协作组.盆腔炎症性疾病诊治规范(草案)[J].中华妇产科杂志,2008,43(7):556-558.
[81] Wolner-Hanssen P,Eschenbach DA,Paavonen J,et al. Decreased risk of symptomatic chlamydial pelvic inflammatory disease associated with oral contraceptive use[J]. JAMA,1990,263 (1):54-59.
[82] Dreisler E,Sorensen SS,Lose G. Endometrial polyps and associated factors in Danish womenaged 36-74 years[J]. Am J Obstet Gynecol,2009,200(2):147.
[83] Wada-Hiraike O,Osuga Y,Hiroi H,et al. Sessile polyps and pedunculated polyps respond differently to oral contraceptives[J]. Gynecol Endocrinol,2011,27(5):351-355.
[84] 薛晖,金力.短效口服避孕药在子宫内膜息肉切除术后的应用[J].中国妇幼保健,2009,19(24):2746-2747.
[85] 滑玮,邹伟,刘朵朵,等.宫腔镜下子宫内膜息肉切除术后应用不同类型药物预防复发的疗效分析[J].现代医药卫生,2013,29(5):672-674.