 去看看
去看看


1 治疗前评估
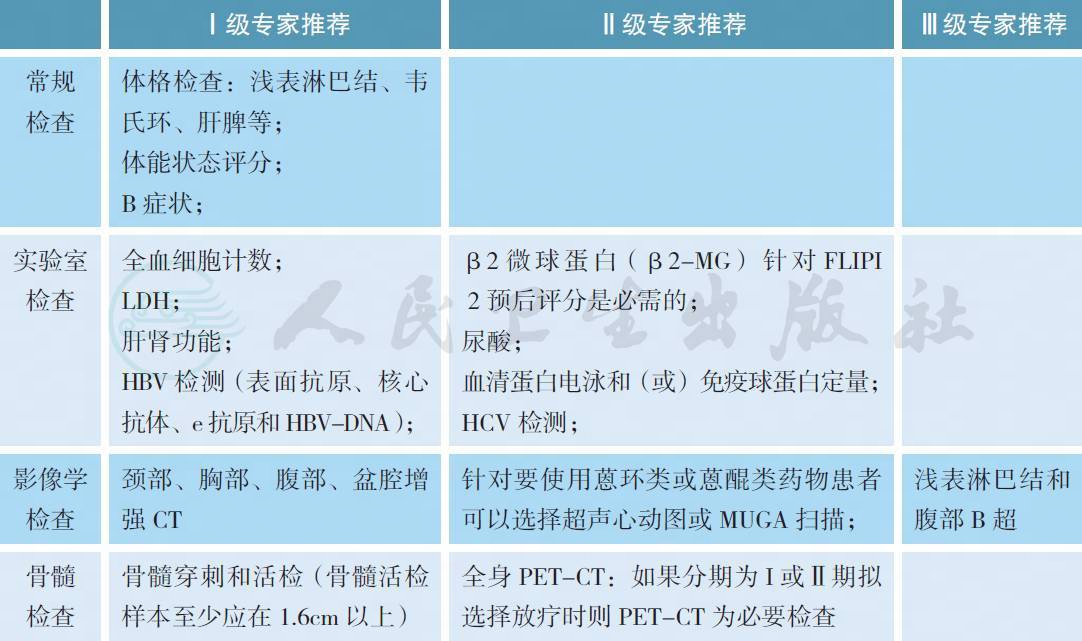
【注释】
颈、胸、腹、盆腔增强CT 是目前的标准影像学检查,用以评估初始病变状态、监测治疗期间疾病缓解程度和评估疗效[1]。与传统检查方法比较,PET-CT 可使疾病分期更准确,从而使治疗计划更有针对性[2-4],尤其在分期为Ⅰ ~ Ⅱ期拟选择放疗时PET-CT 的检查更有必要。但由于PET-CT价格昂贵,故本指南将PET-CT 作为诊断和分期的Ⅱ级专家推荐。
2 病理诊断
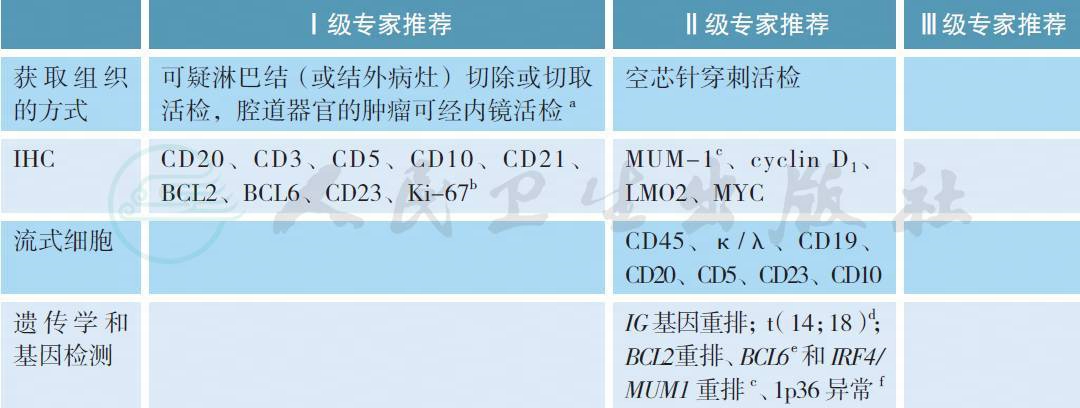
【注释】
a. 滤泡性淋巴瘤(follicular lymphoma,FL) 是起源于滤泡中心B 细胞的一种淋巴瘤。依靠组织病理学和免疫组化分析明确诊断。CD20+、BCL6+、CD10+、CD3-、CD23+/-、BCL2+ 是FL 的典型免疫表型。病理诊断应行淋巴结(肿物) 切除或切取活检,较深部位(例如:腹膜后、纵隔) 病灶亦可考虑在B 超/CT 引导下空芯针穿刺活检,细针吸取活检不能作为诊断依据。如所取材料不能明确诊断,建议重新取活检。联合其他辅助检查技术[免疫组化、流式细胞术、PCR 技术扩增克隆性免疫球蛋白(IG) 和T 细胞受体(TCR) 基因重排、FISH 检测等]对淋巴瘤进行诊断(参照2018版NCCN 指南的建议)。
b. Ki-67>30%常被认为具有更侵袭性临床表现,但并没有证据表明能够指导治疗选择。
c. 伴有IRF4/MUM1 重排的大B 细胞淋巴瘤,好发于咽淋巴环和(或)颈部淋巴结,临床多为早期,形态学类似于FL3B 或DLBCL,BCL2 重排阴性,局部侵袭但疗效好[1]。
d. FL 最常见遗传学异常为t(14;18),累及BCL2 基因和IgH 基因,发生率为70% ~95%,可以用FISH 方法检测。
e. 如果年轻患者且为局灶性病变,并且无BCL2 的表达或者无t(14;18),则有必要做BCL6 基因重排以鉴别儿童型FL(PTFL)[1],Ki-67 较高(>30%),几乎所有PTFL 病例都呈局限型,多为男性,除了手术切除外不需要治疗,如不能手术切除,则受累部位放疗(ISRT)或R-CHOP 方案化疗。
f. 弥漫性FL 特殊亚型:伴1p36 缺失,低级别,多发于腹股沟,大的局限性肿块,预后较好
组织病理分级
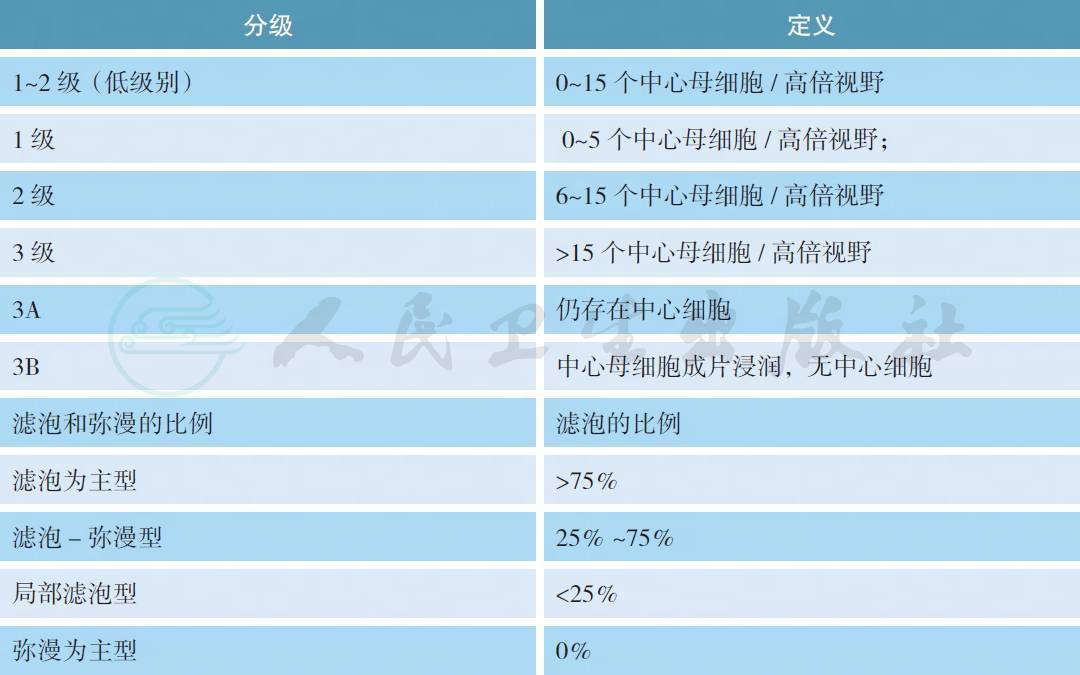
【注释】
FL 是起源于滤泡中心B 细胞(中心细胞及中心母细胞) 的一种淋巴瘤,形态学上至少有部分滤泡存在。根据中心母细胞数量将其分为3 个组织学级别:FL1、FL2 和FL3(又进一步分为3A 和3B)。由于FL1 和FL2 的临床均为惰性,在临床表现、治疗和预后上没有差别,故认为应将两者合并在一起。而3B 级按弥漫大B 细胞淋巴瘤进行治疗。建议在病理报告中应注明滤泡区和弥漫区的相对比例。
3 分期
参照2014 年Lugano 分期标准,见附录A。
附录A 2014 版Lugano 分期标准(CT、MRI 或PETCT作为分期检查方法)

【注释】
1.*.根据2014年Lugano改良分期标准,不再对淋巴瘤的大包块(bulky)病灶进行具体的数据限定,只需在病例中明确记载最大病灶之最大径即可;Ⅱ期伴有大肿块的患者,应根据病理类型及疾病不良预后因素而酌情选择治疗原则,如伴有大包块的惰性淋巴瘤患者可选择局限期治疗模式,但是伴有大包块的侵袭性淋巴瘤患者,则应选择进展期治疗模式。
2.AnnArbor分期对于淋巴结分布区域的定义(仍然适用于Lugano分期):膈上(共12个区域,由于不能被一个放射野涵盖,因此左右各为一个区域):韦氏环(Waldeyer环)(鼻咽及口咽部的淋巴组织环,包括腭扁桃体、咽后壁腺样体、舌扁桃体及其他该部位淋巴组织为一个区域)、左/右颈部(单侧耳前、枕部、颌下、颏下、颈内、锁骨上为一个区域)、左/右锁骨下、左/右腋窝(含胸部及内乳)、左/右滑车上(含肘窝)、纵隔(含气管旁、胸腺区域)、左/右肺门;膈下(共9个区域):脾脏、上腹部(脾门、肝门、腹腔)、下腹部(腹主动脉旁、腹膜后、肠系膜周围、腹部其他非特指淋巴结为一个区域)、左/右髂血管旁、左/右腹股沟(含股部)、左/右腘窝。
3.3.B症状主要在HL中有预后意义并需要记录;最新文献中B症状在NHL的价值较低,但是仍然建议在病例中记录。所谓B症状:不明原因体重下降10%(诊断前6个月内),发热>38℃并排除其他原因发热,盗汗(夜间大量出汗,需要更换衣服被褥)。
4.扁桃体、韦氏环、脾脏视为淋巴器官。
5.备注:淋巴瘤的分期尽管不断改良,但是争议持续存在,主要是对于分期的定义存在解读分歧,或者对特殊部位未能做出全面而明确的定义。正因如此,后续才建立了多种预后指数用于补充临床分期之不足,以指导临床治疗和判断预后。而且,不同于实体瘤的是,淋巴瘤的临床分期不是决定治疗和预后的最关键因素。
4 FL1-3a 级的治疗原则
4.1 FL1-3a 级一线治疗基本原则
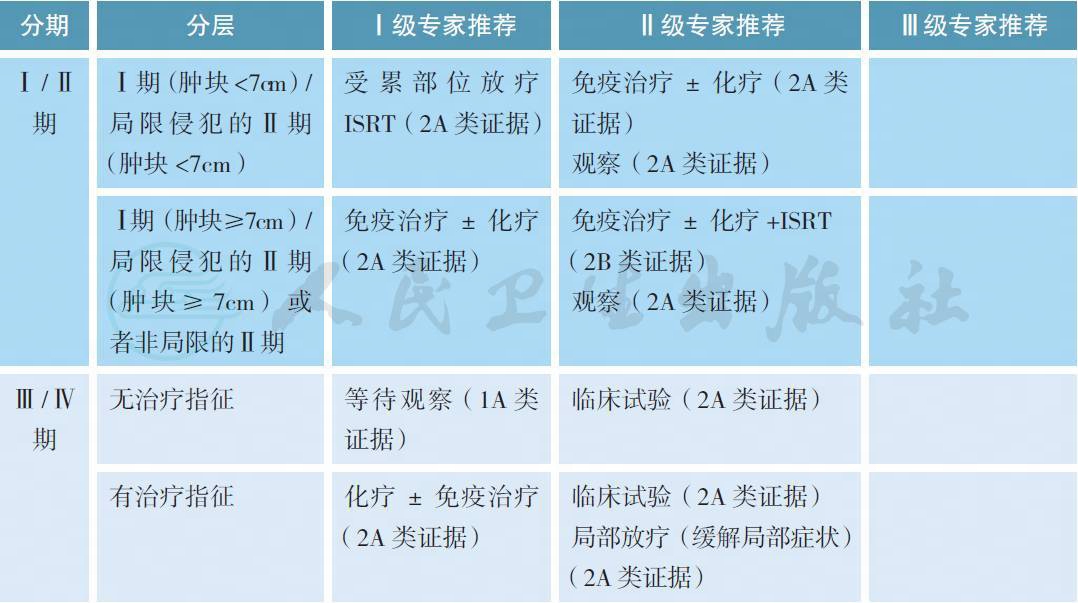
【注释】
FL 1~2 级为惰性淋巴瘤,病程进展缓慢,但是除极少数病灶非常局限的患者经放疗± 化疗有望得到治愈外,绝大部分患者不能治愈,因此治疗原则因临床分期不同而定。FL3b 级按照DLBCL进行治疗。而FL3a 级是按照滤泡性淋巴瘤还是按照弥漫大B 细胞淋巴瘤进行治疗,目前还存在争议。本指南推荐FL 1-3a 级按照滤泡性淋巴瘤进行治疗。
FL1-3a 级的基本治疗原则:
Ⅰ ~ Ⅱ期:以积极治疗为主,患者有望得到长期疾病控制。放疗是早期患者的标准治疗。没有大肿块的Ⅰ期或者病灶极局限的Ⅱ期、部位适宜放疗且不会导致较严重放疗副作用的患者,可选择单纯受累部位放射治疗,首程放疗疗效优于首程治疗为全身治疗[5,6]。推荐放疗采用受累部位照射,剂量为24~30Gy。当化疗或者受累部位局部放疗的毒性超过可能的临床获益时,观察也是合适的选择[7]。有大肿块的Ⅰ / Ⅱ期或病灶较广泛的Ⅱ期,则免疫治疗± 化疗是常用的治疗模式。早期年轻病人应考虑放疗± 化疗,不适于观察。
Ⅲ ~ Ⅳ期:属不可治愈性疾病,由于病变进展缓慢,因此无治疗指征者(无症状和低肿瘤负荷)可观察等待[8,9];有治疗指征者可选择治疗,如化疗/ 免疫治疗(单药或联合治疗)/ 参加临床试验/局部放疗(缓解局部症状)。治疗指征:①有适合的临床试验;②有任何不适症状,影响正常工作生活;③终末器官功能受损;④淋巴瘤侵及骨髓继发的血细胞减少症;⑤巨块型病变(参照GELF 标准);⑥病情持续或快速进展。GELF 高瘤负荷标准(符合其中一项即可视为肿瘤负荷较高,该标准在较大程度上与治疗指征一致),见附录。解除局部症状可采用姑息放疗,推荐剂量4~24Gy[10]。
4.2 FL1-3a 级一线免疫化疗方案

【注释】
a. 利妥昔单抗(375mg/m2,每周1 次,连用4 次,低肿瘤负荷);
b. 烷化剂单药:苯丁酸氮芥6mg/m2 或环磷酰胺100mg/m2;
c. 利妥昔单抗:375mg/m2,每8 周1 次,持续2 年维持治疗;
d. 如果初始治疗为单药利妥昔单抗,则予利妥昔单抗375mg/m2,每8 周1 次,使用4 次巩固
治疗
(1)R-CHOP 方案
利妥昔单抗375mg/m2,d0
环磷酰胺750mg/m2,d1
多柔比星50mg/m2,d1
长春新碱1.4mg/m2,d1(最大剂量2mg)
泼尼松100mg,d1-5
每21d 重复。
(2)R-CVP 方案
利妥昔单抗375mg/m2,d0
环磷酰胺750mg/m2,d1
长春新碱1.4mg/m2,d1(最大剂量2mg)
泼尼松40mg/m2,d1-5
每21d 重复。
(3) 苯达莫司汀+ 利妥昔单抗方案
利妥昔单抗375mg/m2,d0
苯达莫司汀90 mg/m2,d1-2
每28d 重复。
(4) 来那度胺+ 利妥昔单抗方案
利妥昔单抗375mg/m2,d1,每28d 重复。
来那度胺20mg,d1-21,每28d 重复。
免疫化疗是目前国内外最常选择的治疗模式,利妥昔单抗联合化疗已经成为国内外初治FL 的首选标准方案。无论是CHOP 还是CVP 联合利妥昔单抗,均明显改善了患者的近期和远期疗效包括总生存期[11,12]。因此对于体质好,相对年轻患者建议常规剂量联合化疗加利妥昔单抗。研究发现苯达膜司汀联合利妥昔单抗(BR) 较RCHOP,延长了PFS,而中性粒细胞减少及脱发等副作用更小[13]。来那度胺+ 利妥昔单抗联合方案高效低毒,疗效与免疫化疗类似,也是FL 的治疗选择之一[14,15]。由于FL 难以治愈,因此初诊时表现为高肿瘤负荷或FLIPI 中高危的患者,接受R-CHOP或R-CVP 等免疫化疗后可选择利妥昔单抗维持治疗:375mg/m2,每8 周1 次,持续2 年,以延长缓解期[16,17]。而初始治疗为单药利妥昔单抗(375mg/m2,每周1 次,连用4 次),再接受利妥昔单抗每8 周1 次,共4 次巩固治疗,可以明显延长EFS 和反应持续时间[18]。由于FL 属于不可治愈性疾病,绝大多数将多次复发进展,因此任何治疗方案的选择均应以保护患者骨髓功能、保障后续治疗的长期可行性为前提,尽量避免应用对骨髓造血干细胞造成损伤的药物。
4.3 复发难治FL(FL1-3a 级) 二线治疗及FL 转化为DLBCL 治疗

【注释】
a. Idelalisib[19]为一种PI3K 抑制剂,在烷化剂和利妥昔单抗都耐药的患者中使用;
b. copanlisib[20]作为一种PI3K 抑制剂,它能抑制PI3K-α 和PI3K-δ 两种激酶亚型,在至少2种以上方案耐药的患者中可选用;
c. 自体干细胞移植(ASCT):首次复发后再次缓解的患者,酌情考虑,不作常规推荐;≥ 2 次复发且复发间隔时间短者或高滤泡淋巴瘤国际预后指数(FLIPI)的患者考虑;
d. 异基因干细胞移植主要限于自体干细胞移植后复发,但是目前倾向认为异基因干细胞移植是唯一有望治愈滤泡性淋巴瘤的方法;
e. 利妥昔单抗[21]375mg/m2,每12 周1 次,持续2 年维持治疗。复发、难治性FL 患者的标准治疗目前尚未完全统一,挽救治疗方案的选择取决于既往方案的疗效、缓解时间、患者年龄、身体状态、复发时的病理类型以及治疗目标。对于一线治疗后长期缓解且无转化的复发患者,可重新使用原方案或选用其他一线方案。对于早期(<12 个月)复发的患者,可选用非交叉耐药的方案治疗,还可选择弥漫大B 细胞淋巴瘤的二线治疗方案,也可以考虑新药临床实验,部分年轻高危多次复发后化疗仍然敏感者,可酌情选用ASCT。复发、难治患者在诱导化疗结束,获得CR 或部分缓解(PR) 后,建议每3 个月采用利妥昔单抗单药维持治疗1 次,共计2年时间,能够显著改善PFS[21]。
FL 有转化倾向,怀疑有转化的患者应重新活检。对于FL 转化为DLBCL 患者,如果既往只接受过单纯ISRT 或温和化疗(单药治疗一疗程) 或未接受过化疗的患者可选择含蒽环类或蒽醌类药物为基础的联合化疗(参照DLBCL 一线治疗方案)+ 利妥昔单抗±ISRT[局部病变、大肿块和(或) 局限性骨病]。如果患者既往已接受多种(≥ 2 种) 免疫化疗方案反复强烈治疗,则考虑临床试验/ 免疫化疗(参照DLBCL 二线治疗方案)±ISRT/ISRT/ 最佳支持治疗,这部分患者预后很差,如果化疗敏感,再次缓解后应积极考虑给予造血干细胞移植,特别是ASCT,少数高选择的患者可尝试异基因造血干细胞移植(allo-HSCT)。
5 预后评估
5.1 GELF 高瘤负荷标准
受累淋巴结区≥ 3 个,直径≥ 3cm
任何淋巴结或者结外瘤块直径≥ 7cm
B 症状
脾大
胸腹腔积液
白细胞<1.0×109/L 和(或) 血小板<100×109/L
白血病(恶性细胞>5.0×109/L)
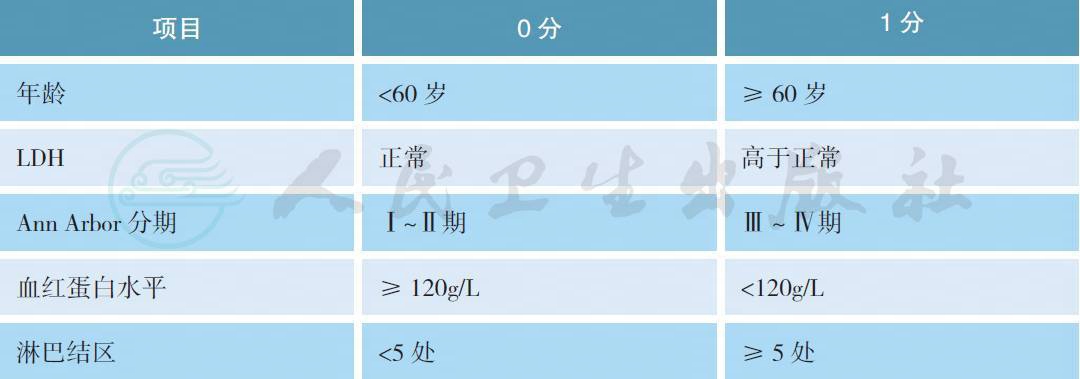
5.2 滤泡性淋巴瘤国际预后指数(FLIPI)
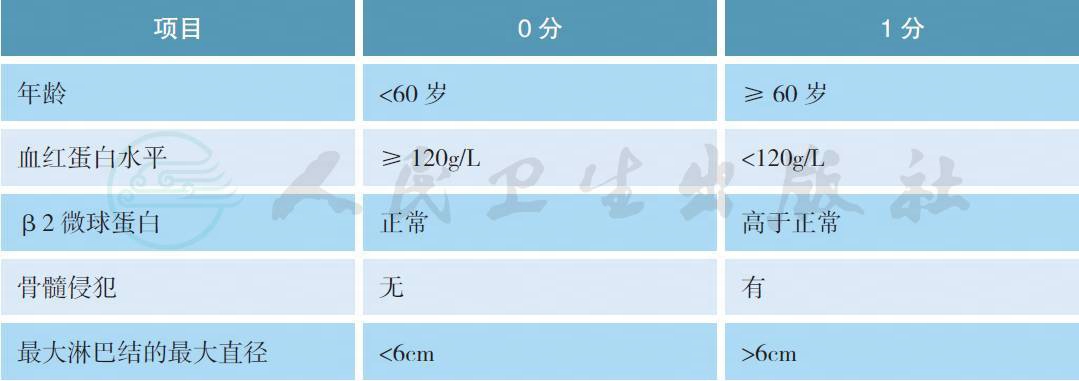
5.3 滤泡淋巴瘤国际预后指数2(FLIPI-2)
【注释】
FLIPI 是利妥昔单抗前时代的预后指数,是回顾性研究得出的结论。FLIPI-2 是利妥昔单抗时代的预后指数,系前瞻性研究获得,但是由于使用时间短、病例数少,还需要进一步临床验证。通常FLIPI 用于判断OS 更佳,而FLIPI-2 更适用于PFS 分析。
[1]National Comprehensive Cancer Network. NCCN Clinical Practice Guidelines in Oncology:B-CellLymphomas (v.3.2018)
[2]Kostakoglu L,Cheson BD. Current role of FDG PET/CT in lymphoma[J]. Eur J Nucl Med MolImaging,2014,41(5):1004-1027.
[3]Valls L,Badve C,Avril S,et al. FDG PET imaging in hematological malignancies [J]. Blood Rev,2016,30(4):317-331.
[4]Cheson BD,Fisher RI,Barrington SF,et al. Recommendations for initial evaluation,staging,andresponse assessment of Hodgkin and non- Hodgkin lymphoma:the Lugano classification [J]. J ClinOncol,2014,32(27):3059-3068.
[5]Vargo JA,Gill BS,Balasubramani GK,Beriwal S. What is the optimal management of early-stagelow-grade follicular lymphoma in the modern era? Cancer,2015,121:3325-3334.
[6]Pugh TJ,Ballonoff A,Newman F,et al. Improved survival in patients with early stage low-gradefollicular lymphoma treated with radiation. Cancer,2010,116(16):3843-3851.
[7]Advani R,Rosenberg SA,Horning SJ,et al. Stage Ⅰ and Ⅱ follicular non-Hodgkin’s lymphoma:long-term follow-up of no initial therapy. J Clin Oncol,2004,22(8):1454-1459.
[8]Ardeshna KM,Smith P,Norton A,et al. Long-term effect of a watch and wait policy versus immediatesystemic treatment for asymptomatic advanced-stage non-Hodgkin lymphoma:a randomised controlledtrial. Lancet,2003,362(9383):516-522.
[9]Ardeshna KM,Qian W,Smith P,et al. Rituximab versus a watch-and-wait approach in patients withadvanced-stage,asymptomatic,non-bulky follicular lymphoma:an open-label randomised phase 3trial. Lancet Oncol,2014,15(4):424-435.
[10]Hoskin PJ,Kirkwood AA,Popova B,et al. 4 Gy versus 24 Gy radiotherapy for patients with indolentlymphoma (FORT):a randomised phase 3 non-inferiority trial. Lancet Oncol,2014,15(4):457-463.
[11]Marcus R1,Imrie K,Solal-Celigny P,et al. Phase Ⅲ study of R-CVP compared withcyclophosphamide,vincristine,and prednisone alone in patients with previously untreated advancedfollicular lymphoma. J Clin Oncol,2008,26(28):4579-4586.
[12]Hiddemann W1,Kneba M,Dreyling M,et al. Frontline therapy with rituximab added to thecombination of cyclophosphamide,doxorubicin,vincristine,and prednisone (CHOP) significantlyimproves the outcome for patients with advanced-stage follicular lymphoma compared with therapy withCHOP alone:results of a prospective randomized study of the German Low-Grade Lymphoma StudyGroup. Blood,2005,106(12):3725-3732.
[13]Rummel MJ,Niederle N,Maschmeyer G,et al. Bendamustine plus rituximab versus CHOP plusrituximab as first-line treatment for patients with indolent and mantle-cell lymphomas:an open-label,multicentre,randomised,phase 3 non-inferiority trial. Lancet,2013,381(9873):1203-1210.
[14]Martin P, Jung SH, Pitcher B,et al. A phase Ⅱ trial of lenalidomide plus rituximab in previouslyuntreated follicular non-Hodgkin’s lymphoma (NHL):CALGB 50803 (Alliance). Ann Oncol,2017,28(11):2806-2812.
[15]Fowler NH,Davis RE,Rawal S,et al. Safety and activity of lenalidomide and rituximab in untreatedindolent lymphoma:an open-label,phase 2 trial. Lancet Oncol,2014,15(12):1311-1318.
[16]Salles G,Seymour JF,Offner F,et al. Rituximab maintenance for 2 years in patients with hightumour burden follicular lymphoma responding to rituximab plus chemotherapy (PRIMA):a phase 3,randomised controlled trial. Lancet,2011 Jan 1,377(9759):42-51.
[17]Salles G,Seymour JF,Feugier P,et al. Long term follow-up of the PRIMA Study:Half of patientsreceiving rituximab maintenance remain progression free at 10 years [abstract].Blood,2017,130(suppl1):abstract 486.
[18]Ghielmini M , Schmitz SF, Cogliatti SB,et al. Prolonged treatment with rituximab in patients withfollicular lymphoma significantly increases event-free survival and response duration compared with thestandard weekly x 4 schedule. Blood,2004,103(12):4416-4423.
[19]Gopal AK1, Kahl BS, de Vos S,et al. PI3Kδ inhibition by idelalisib in patients with relapsedindolent lymphoma. N Engl J Med,2014 Mar 13,370(11):1008-1018.
[20]Dreyling M1, Santoro A1, Mollica L,et al. Phosphatidylinositol 3-Kinase inhibition by copanlisib inrelapsed or refractory indolent lymphoma. J Clin Oncol,2017 Dec 10,35(35):3898-3905.
[21]van Oers MH1, Van Glabbeke M, Giurgea L,et al. Rituximab maintenance treatment of relapsed/resistant follicular non-Hodgkin’s lymphoma:long-term outcome of the EORTC 20981 phase Ⅲrandomized intergroup study. J Clin Oncol,2010 Jun 10,28(17):2853-2858.
[22]Federico M,Luminari S,Dondi A,et al. R-CVP versus R-CHOP versus R-FM for the initialtreatment of patients with advanced-stage follicular lymphoma:results of the FOLL05 trial conductedby the Fondazione Italiana Linfomi. J Clin Oncol,2013 Apr 20,31(12):1506-1513. doi:10.1200/JCO.2012.45.0866.
[23]Leonard JP,Jung SH,Johnson J,et al. Randomized trial of lenalidomide alone versus lenalidomideplus rituximab in patients with recurrent follicular fymphoma:CALGB 50401 (Alliance). J ClinOncol,2015 Nov 1,33(31):3635-3640. doi:10.1200/JCO.2014.59.9258.
[24]Martinelli G,Montoro J,Vanazzi A,et al. Chlorambucil-rituximab as first-line therapy in patientsaffected by follicular non-Hodgkin’s lymphoma:a retrospective single-centre study. Hematol Oncol,2015 Dec,33(4):129-135. doi:10.1002/hon.2154.
[25]Smith SM,Johnson J,Cheson BD,et al. Recombinant interferon-alpha2b added to oralcyclophosphamide either as induction or maintenance in treatment-naive follicular lymphoma:final analysis of CALGB 8691. Leuk Lymphoma,2009 Oct,50(10):1606-1617. doi:10.1080/10428190903093807.