 去看看
去看看


一、儿童青少年糖尿病

续表

(一)背景
在儿童及青少年糖尿病患者中,1型糖尿病所占比例为80%~90%[1]。但是,随着儿童肥胖发病率增加,2型糖尿病患者数逐渐增多。1型糖尿病和2型糖尿病的发病机制与临床表现均有所不同,其营养管理的要求也有所差异。但对于1型和2型糖尿病,饮食干预的主要目标在本质上是相同的[2]。
为达到最优血糖控制和整体健康,1型糖尿病MNT应该考虑5个关键方面[3]:①日常正餐和零食摄入碳水化合物量一致性;②根据血糖、饮食或运动的变化调整胰岛素;③体重管理(能量摄入与消耗平衡);④营养素含量(均衡选择蛋白质、碳水化合物和脂肪);⑤进餐与胰岛素注射定时定量。
75%的1型糖尿病患者在18岁时已诊断为糖尿病。因此,需适当考虑儿童和青少年1型糖尿病管理方面的独特性。糖尿病患儿在许多方面均不同于成年人,包括与性成熟和身体生长有关的胰岛素敏感性的变化、自我管理能力、在幼儿园和学校里的管理,以及容易发生低血糖和糖尿病酮症等。对于实施一个最佳的糖尿病治疗来讲,非常重要的是需考虑患儿生长发育不同阶段及性成熟相关的生理差异以及其家庭的参与[3]。儿童或青少年1型糖尿病患者的管理者应由多学科专家团队组成。
(二)证据
随机对照试验已经证明,对于1型糖尿病患者,MNT可使HbA1c降低大约1%[4,5]。因此,在新诊1型糖尿病时即应采用饮食疗法,2~4周后复诊,此后定期(至少每年)随访[6]。儿童1型糖尿病的营养管理专注于提供足够能量以满足生长发育要求,并且最初可能需要额外增加能量摄入来弥补诊断前的体重丢失。建议随着儿童和青少年的成长、食欲和活动水平的变化来修订相应的饮食方案。制订1型糖尿病的膳食推荐计划还应该考虑到患者的食欲、进食模式、运动水平和胰岛素用法。MNT的一个关键方面是制订全天所进食的碳水化合物量、类型和分布须考虑到1型糖尿病患者的年龄和胰岛素用法[2]。建议食物中碳水化合物占能比为45%~60%[7]。食物(特别是碳水化合物)摄入量的变化,可能导致1型糖尿病患者血糖的不稳定和低血糖。基础加短效胰岛素注射的强化治疗方案允许食物的碳水化合物量有一些灵活性。在一项患者接受强化胰岛素治疗的研究中,根据食物中所含碳水化合物量调整胰岛素剂量,则碳水化合物总量不影响血糖数值[8]。使用短效胰岛素类似物或者使用胰岛素泵的患者,进食超过含有10~15g碳水化合物的零食可能需要额外追加注射胰岛素。碳水化合物与胰岛素的一致性与患者HbA1c水平下降相关,而日常总能量、蛋白质或脂肪摄入量的变化与HbA1c无显著相关性[9]。
对于1型糖尿病患者,碳水化合物计数法是ADA推荐最常用的膳食计划方法[10],接受强化胰岛素治疗的患者需确定一定数量的碳水化合物与短效或速效胰岛素的量相匹配。而且,对于接受胰岛素治疗的患者,为达到血糖控制目标而无不适当的低血糖,定时进餐[6]很重要。胰岛素治疗方案是基于每天在相同时间注入大致相匹配数量的胰岛素,如果碳水化合物摄入量数量和时间的差异很大,则血糖波动较大。近期的研究表明,碳水化合物计数法是较难掌握的,并且为保证评估的准确性,应由经验丰富的健康专业人士反复进行与年龄相适宜的教育[11,12],尽管强化治疗增加了饮食的灵活性,但是为了理想的血糖控制,规律进餐和每日至少4次血糖监测仍然是重要的[3]。
对于所有1型糖尿病患者的饮食建议还应包括关于GI的教育[13]。摄入中低GI的食物可有效降低餐后血糖,改善平均血糖水平,取得较好的血糖控制的结果[14]。相较于高GI食物可使得餐后血糖产生剧烈波动,低GI食物(如全麦面包、大多数意大利面、豆类、温带气候水果、牛奶和酸奶等)则可使餐后血糖缓慢上升,长期的血糖控制得以改善。在实际应用中,所有的正餐和零食均可用低GI食物来代替高GI食物[13]。
除关注碳水化合物外,摄入脂肪的类型和数量也是至关重要的。应降低饱和脂肪酸和避免反式脂肪酸,并适当增加单不饱和脂肪酸和ω-3脂肪酸的摄入[15]。针对具有高心血管风险的1型糖尿病患儿,美国心脏病协会(AHA)建议采用生活方式和药物治疗高的LDL-C水平[16]。随机临床试验数据表明,即使是7月龄的孩子这种饮食也是安全的,不会干扰正常的生长和发育[17]。蛋白质摄入量亦应适当,蛋白质占膳食计划的15%~20%即足以满足一般人群的机体需要[7]。此外,糖尿病患者也需要确保他们的饮食含有足够的纤维、基本的维生素和矿物质。
DCCT证明,青少年1型糖尿病患者的血糖水平比成年人更难以达标。糖尿病管理的目标是尽可能安全降糖,对于患1型糖尿病的儿童青少年,设定血糖目标时,应考虑患者年龄因素[15]。应该特别关注幼儿无感知的低血糖。大多数6~7岁孩子不成熟,相对无法识别和应对低血糖症状,因而面临更大的严重低血糖及其后遗症的风险[18-20],包括注意力较差、认知功能障碍等。5岁以下糖尿病患儿发生严重低血糖则有可能出现永久性的认知障碍[20]。控制低血糖发生是儿童期糖尿病患者营养管理的重要任务之一。如果患者出现低血糖(血糖<3.9mmol/L),可以应用10~15g快速起作用的碳水化合物治疗,使血糖水平快速恢复到2.8~3.9mmol/L范围内;若血糖浓度≤3.9mmol/L,则需进食20~30g快速起作用的碳水化合物。15分钟后复测血糖,根据血糖水平必要时重复治疗。一旦血糖>3.9mmol/L,患者应该使用适当的胰岛素剂量以覆盖进餐所摄入碳水化合物的量。如果低血糖事件距离下一餐时间较长,需再进食另一含有15g碳水化合物的零食。低血糖过度处理会导致血糖大于预期上升的水平,并增加能量的摄入,导致体重增加[15]。
体育锻炼是糖尿病管理的一个重要组件。锻炼的好处包括改善血糖水平、控制体重、减少并发症(高血压、高血脂、心血管疾病)、改善心情和生活质量。建议大多数成年人在每周大多数的天数中能够每天进行30分钟或更多的中等强度体力活动,儿童至少需要60分钟/天[21]。若为了减重和保持体重,则需要每天60~90分钟中等强度或剧烈的运动。ADA鼓励患糖尿病或糖尿病前期的儿童每天至少运动60分钟[15]。虽然锻炼对1型糖尿病患者的血糖改善情况不一致[22],但患者学会自我调整饮食或胰岛素来适应运动,可以达到接近正常的HbA1c水平而没有过度的低血糖。应考虑到运动的时间与胰岛素剂量、类型、注射方式和时间的关系。应该在运动之前和之后检查血糖水平,特别是在开始一项运动计划时,需评估血糖对于运动的反应并调整胰岛素应用。建议患者携带便利的零食,以防血糖降得太低。进食适当的食物量来治疗低血糖以及根据运动来调整食物和胰岛素的指导可由营养(医)师来提供。
保持合适的体重对于1型糖尿病患者来讲是一个重要的管理策略。对于儿童1型糖尿病患者,应该根据其年龄、性别、身高、体重和日常的体力活动来计算每天总能量的摄入,以使得既能满足生长发育的需要,又不至于超重或肥胖。超重的影响因素可能是:①胰岛素剂量过大;②吃零食来匹配胰岛素峰值;③为避免或治疗低血糖而摄入过多的能量[3]。如果HbA1c水平较高而采用强化治疗促进降糖,为防止体重增加,每天减少250~300kcal摄入是必要的。用来减少胰岛素强化治疗带来的体重增加的另一策略是低血糖时优先减少胰岛素剂量,而不是增加食量或添加一个不健康的零食。为进一步减少能量摄入,可减少脂肪摄入而尽量保持碳水化合物摄入量一致,以使得低血糖风险最小化[23]。
尽管针对儿童和青少年的建议不太容易完全基于临床试验证据,在儿童和青少年1型糖尿病管理方面,在ADA声明中对专家意见和现有相关实验数据的回顾作了总结[4]:理想情况下,儿童或青少年1型糖尿病患者的管理应由多学科专家团队进行,至少应该由医疗卫生人员为1型糖尿病的孩子和家人提供与之年龄相符的培训与指导。一旦诊断糖尿病,应该为不断长大的孩子和家庭提供DSME、MNT和心理社会支持,并且之后定期提供个体化的教育、行为、营养和情感需求等方面的指导。期望能够在成人监督和自我管理之间达到平衡,并逐步发展到身体、心理及情感的成熟。家庭的参与仍然是优化整个童年和青春期的糖尿病管理的一个重要方面。应特别强调父母或监护人在儿童青少年糖尿病管理中的作用。
迄今为止,1型糖尿病没有有效的预防措施。虽然有观察研究提示,婴儿期对牛奶蛋白产生的抗体可能与自身免疫反应和1型糖尿病有关[24]。但目前流行病学调查结果尚无定论支持或反对婴儿早期牛乳喂养是1型糖尿病发生的危险因素。有研究显示,纯人工喂养婴儿的1型糖尿病发病率是纯母乳喂养婴儿的2倍[25],提倡母乳喂养可在一定程度上降低1型糖尿病的发病率[26]。1型糖尿病患者经常出现维生素D缺乏的情况,2008年一项针对340名参与者的对照研究发现,1型糖尿病患者发生严重维生素D缺乏的概率显著高于健康人(28.8%vs 17.1%)[27]。但是,迄今为止,还不清楚这两者之间是否存在真正的因果关系。
在过去的10年里,青少年2型糖尿病的发病率已大大增加[28]。目前无针对中国儿童和青少年的建议,可参考ADA的推荐[16]:超重并有2项或2项以上其他糖尿病危险因素(表4-1)的儿童和青少年,应考虑筛查2型糖尿病。
表4-1 在无症状的儿童和青少年(≤18岁)中筛查2型糖尿病

目前没有足够的数据支持预防青少年发生2型糖尿病的针对性建议,但在青少年中也可以采用经证实可有效预防成人2型糖尿病的干预措施,包括控制能量摄入和定期体力活动的生活方式改变[29],只要能保证青少年正常生长发育所需的营养需求即可。
二、妊娠糖尿病

(一)背景
对于妊娠糖尿病(gestational diabetes mellitus,GDM)患者,平衡血糖控制与孕期营养需求之间的关系是综合管理的难点。从妊娠中期(孕13周)开始,母体能量需求较孕前增加300kcal/d(单胎妊娠,合10%~15%),用于满足自身代谢以及子宫、乳房等母体器官和胎儿的快速生长发育所需。能量摄入合理时,孕期母体增重和胎儿发育正常,而能量摄入不足与过剩或者血糖控制不佳则可致胎儿宫内发育迟缓、巨大儿,或增加妊娠高血压综合征发生率,导致难产或早产,不仅直接影响妊娠结局,还可能影响母体和子代远期健康。
(二)证据
大约85%的妊娠高血糖患者可以通过合理营养治疗将血糖控制在理想水平。孕期营养管理有助于这一目标的实现,同时建议在孕前和妊娠早期开始补充含0.4~1.0mg叶酸的多种维生素补充剂,以降低神经管畸形及微量营养素缺乏的风险[1]。孕期合理的血糖控制有助于降低1型和2型糖尿病妇女子代发生先天性畸形的风险。应根据妊娠糖尿病的患病风险及时进行空腹血糖或服糖1小时后负荷、口服葡萄糖耐量试验以早期发现、诊断和治疗妊娠糖尿病[2]。MNT应为个体化的饮食计划,用以优化血糖控制效果。根据孕妇的食物选择和饮食习惯以及血糖控制的情况确定能量和碳水化合物摄入量的分布。由于胎儿自身无糖异生能力,需持续从母体中吸取葡萄糖,因此,保证用餐时间和进食量的稳定对于避免餐后及下一餐餐前低血糖很重要。监测体重及血糖、记录每日饮食可提供有价值的信息,用于调整胰岛素剂量和饮食计划[3]。GDM的MNT应保证母亲和胎儿的最佳营养状况,摄入足够的能量以保证孕期适度的体重增加,达到并维持正常的血糖水平,避免发生酮症。一项大规模临床随机对照研究证实,采用营养治疗、血糖监测以及必要的胰岛素治疗与常规治疗方法相比,能够减少GDM围产期严重并发症的发生,同时,剖宫产的发生率没有升高,母体健康相关生活质量也得到了改善[4]。
超重或肥胖的GDM孕妇,采用极低能量饮食可能引起酮血症和酮尿症。不过,适度的能量限制(减少估计能量需求量的30%)可在不引起酮血症的同时优化血糖和体重控制。目前的数据尚不足以确定此类饮食对围产期结局有何影响。可采用每日饮食记录、每周体重检查和酮体检测来调整个体的能量需求,及时纠正孕妇单纯为避免胰岛素治疗而造成营养摄入不足。
孕期能量需要的估计可参照每日30~35kcal/kg标准体重,至妊娠中晚期,在此基础上平均增加约200kcal/d。推荐按照IOM(2009)的推荐根据孕前体重来计划体重增长的速度(表4-2),以便及时调整能量摄入。
表4-2 孕期体重增长速度*

*单胎妊娠;出自http://www.iom.edu/
碳水化合物的量和分布应基于临床结果指标(饥饿感、血糖水平、体重增幅、酮体水平),但每天最少应提供175g碳水化合物。应在一日三餐主食以及2~4次加餐中均匀分配碳水化合物[4]。为了防止夜间长时间空腹出现酮症,睡前往往需要一次加餐。餐后适度的体力活动是改善血糖控制的一种辅助手段。如果需要在MNT中加入胰岛素治疗,保持一日三餐和加餐中碳水化合物的数量和种类相对固定至关重要。有研究显示,低血糖指数(Glycemic Index,GI)饮食有助于GDM血糖控制和营养状况的维持[5,6]。虽然多数GDM患者在产后都恢复为正常的葡萄糖耐量水平,但她们在再次妊娠中发生GDM以及日后罹患2型糖尿病的危险度显著升高。建议在妊娠期结束后改善生活方式,保持体形正常和增加体力活动,以降低日后发生糖尿病的危险[3,7]。对已有糖尿病或GDM的妇女,建议实施母乳喂养,但需遵循临床治疗方案安排哺乳时限[8]。大多数情况下,母乳喂养者对外源性胰岛素的需求更少,因为哺乳的过程也是消耗能量的过程。应根据是否哺乳以及每日哺乳量估计能量需要量,在完全母乳喂养的阶段,较非孕期约需额外增加400~500kcal/d。有报道提示,哺乳期妇女产生血糖波动,通常需要在哺乳之前或期间进行含碳水化合物的加餐[9]。
对糖尿病孕妇进行围产期管理需要营养(医)师参与。营养(医)师应向孕妇推荐满足怀孕期间各种营养素需求的糖尿病治疗饮食。少食多餐或营养代餐的饮食结构在降低低血糖症和酮症风险的同时,还可能有助于改善妊娠反应,如恶心、胃灼热等。少食多餐制还可能减少血糖峰值的偏移[9],避免胰岛素用量的调整。一项纳入69名中国妊娠糖尿病患者的随机对照研究发现,与普通牛奶相比,使用糖尿病专用营养配方代餐者,餐后2小时血糖更理想,分娩时的HbA1c更低,分娩体重较轻,且孕妇的胎膜早破和羊水过多比例均较少;同时,新生儿出生体重和肺炎发生率均较低。这一研究提示,使用糖尿病适用营养配方,能更好地帮助孕期血糖控制,改善妊娠结局[10]。
在产后初期,患糖尿病的产妇还应该定期检测血糖水平。同时,哺乳期的胰岛素用量应根据其血糖自我监测结果进行相应调整[1,11]。身边常备一些及时防止低血糖发生的食物。两餐间隔过长比哺乳期能量消耗更容易引起母亲发生低血糖[12]。在停止母乳喂养后,糖尿病妇女仍应按照健康管理团队制订的目标进行体重管理以及能量摄入、药物使用和血糖水平的监测和管理。
三、老年糖尿病
续表

(一)背景
老年糖尿病的特点是症状不典型,并发症多,致残、致死率高。控制高血糖可以减少糖尿病并发症的发生。饮食控制是老年糖尿病的基本措施之一。基于老年人饮食习惯、器官功能衰退以及健忘等因素,应对老年糖尿病患者给予更科学、合理的营养指导,纠正认识偏差,达到控制病情的目的,让大多数患者与正常人同样生活。
(二)证据
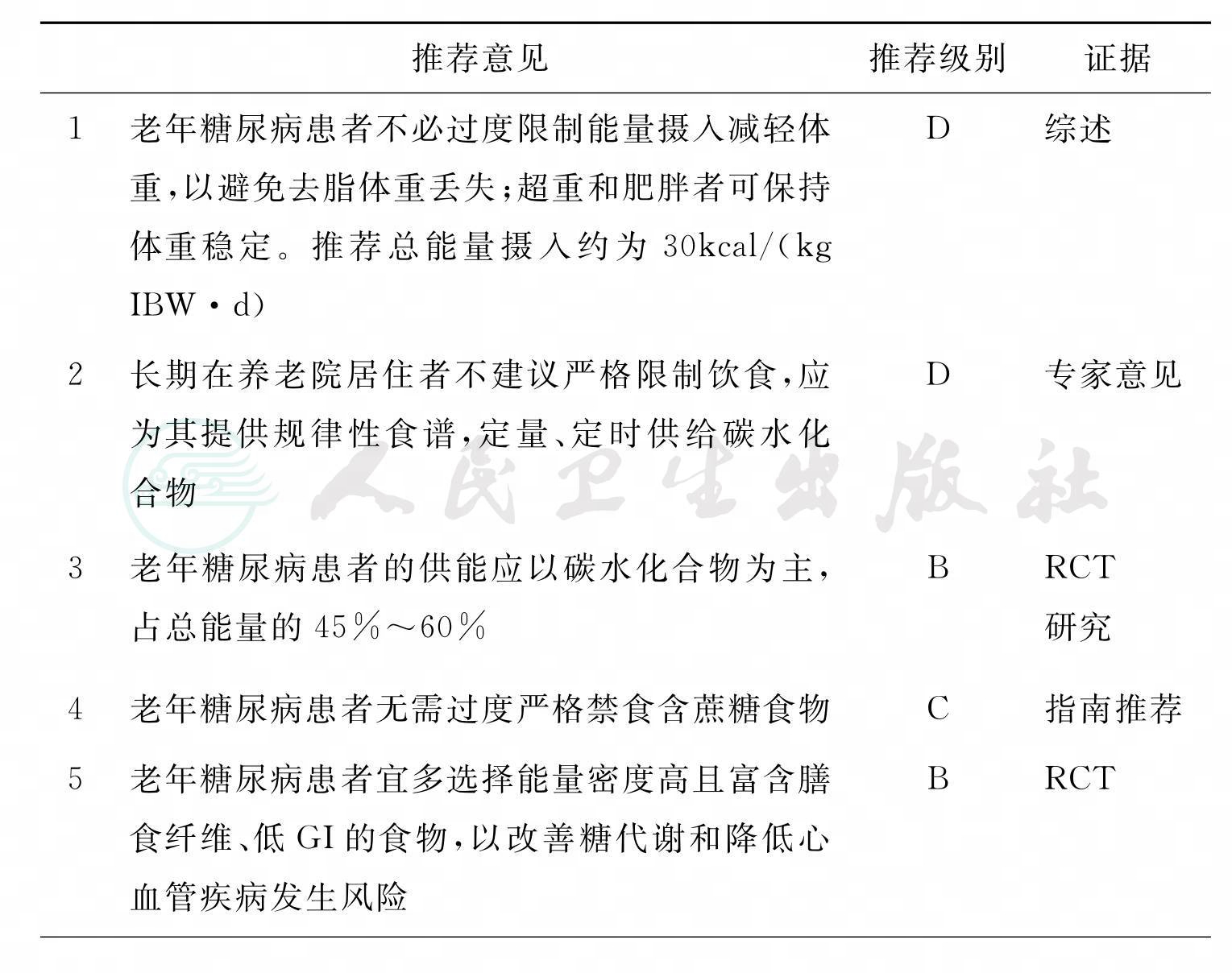
老年糖尿病患者营养治疗的目标是保持良好的营养状况、改善生活质量、鼓励社交等,加强药物治疗控制血糖通常比严格控制饮食更有效[1]。老年患者最好保持体重稳定,不需要严格限制能量摄入,即使超重和肥胖患者也是如此,任何减轻体重的措施都可能导致去脂体重减轻(主要是骨骼肌重量减轻),甚至丧失日常活动能力的风险也会提高。总能量摄入大约是30kcal/(kg IBW·d),并应保证一日三餐。为减少血糖波动,可采取将每餐饭量减少,并在餐间进食少量零食的策略[2]。
住养老院的糖尿病患者一般体形偏瘦,营养不足[1],病死率较高[3]。研究表明,专为老年人设计的糖尿病饮食与标准饮食相比,对老年人的影响效果一样[4]。
糖尿病患者每日碳水化合物所提供的能量应占总摄入能量的45%~60%,但大约2/3的老年糖尿病患者碳水化合物供能仅占总能量的45%以下,因此为老年人制订饮食计划时要考虑此方面因素[5]。老年糖尿病患者不必完全禁食蔗糖类食物[6]。
老年2型糖尿病患者应进食能量密度高且富含膳食纤维、血糖指数低的食物[7]。有证据表明,摄入膳食纤维可以延缓血糖和胰岛素的升高,还可以改善老年患者血脂谱,进而降低心血管疾病的风险。ADA推荐膳食纤维的摄入量为14g/(1000kcal·d)[8]。进食优质蛋白质对肌细胞内物质合成、减轻年龄相关的肌肉萎缩很重要[7]。Morais等在对多项氮平衡的研究中发现,老年患者蛋白质的摄入量应为1.0~1.3g/(kg·d)[9],原因可能为:摄入较高量蛋白质可以对减少的能量摄入进行补偿、改善胰岛素分泌、减轻年龄相关的肌肉萎缩等。
老年糖尿病患者钙的推荐摄入量是1200mg/d(法国)或1000~1500mg/d(美国),接受光照不足的老年人需要口服维生素D 800IU/d或每4个月口服负荷量10 000IU[10]。
锻炼(如每周进行3次有氧运动、每次60分钟,以达到最大心率的60%~75%为标准)可明显改善随年龄增长出现的最大有氧代谢能力下降,降低动脉粥样硬化的危险性[11],延缓与年龄有关的瘦组织群减少,减轻中心性肥胖,提高胰岛素敏感性。同时,在减少能量摄入联合运动的情况下,机体对瘦素的敏感性也有改善[12],这些措施对糖尿病老年患者均有益处[13,14]。但是,锻炼也有潜在风险,如心肌缺血、肌肉骨骼损伤和低血糖等,应及时进行风险评估。
有研究表明,定期给予老年糖尿病患者糖尿病教育和饮食指导可以使HbA1c明显下降[15]。老年糖尿病患者在控制血糖、血脂、血压的同时,需要预防医源性营养不良的发生,具体营养干预措施取决于患者年龄、合并症、期望寿命和偏好等多种因素[16]。
四、糖尿病前期
(一)背景
流行病学证据显示,糖尿病的危害从糖尿病前期就已开始。2008年美国内分泌学会/美国临床内分泌医师学会(ACE/AACE)正式发表了《糖尿病前期诊治共识》[1-3],再次强调了关注糖尿病前期的重要性,即早期诊断和治疗糖尿病前期患者,可能降低或延缓糖尿病及其相关心血管并发症和微血管疾病的进展。
糖尿病前期人群包括空腹血糖受损(IFG)、糖耐量受损(IGT)或同时存在IFG和IGT者。IFG的诊断标准为空腹血糖5.6~6.9mmol/L (100~125mg/dl),IGT的诊断标准为糖负荷(OGTT口服75g葡萄糖)后2小时血糖7.8~11mmol/L(140~199mg/dl)[1]。据估计,到2025年糖尿病患者将达到4.18亿[4]。目前糖尿病前期患者的长期转归,1/3进展为2型糖尿病,1/3仍维持糖尿病前期状态,1/3血糖恢复正常[3]。与基线血糖水平正常者糖尿病发生率(4.5%)相比,合并IFG和IGT者6年累计糖尿病发生率高达64.5%[5]。
糖尿病前期不但增加糖尿病发生危险,而且增加心血管事件发生危险。大量研究提示,当患者血糖水平低于目前的2型糖尿病诊断标准时,心血管疾病危险与血糖水平有很好的线性相关性。而且,流行病学研究(Framingham研究)和干预研究(STOP-NIDDM、DREAM研究)显示,与非IFG或IGT患者相比,糖尿病前期患者的心血管危险增加1倍。
为了改善患者的远期转归,对糖尿病前期的干预须从多方面入手,包括生活方式干预、减轻体重以及针对多种危险因素(血糖、血脂、血压异常)的药物治疗和抗血小板治疗。首选的治疗手段为强化生活方式干预,因为其安全并有证据支持可改善血糖和降低心血管危险。
(二)证据
近年来发表的几项大型研究证实,对于糖尿病高风险人群而言,健康的饮食结构和适度的锻炼明显有助于预防糖尿病的发生。
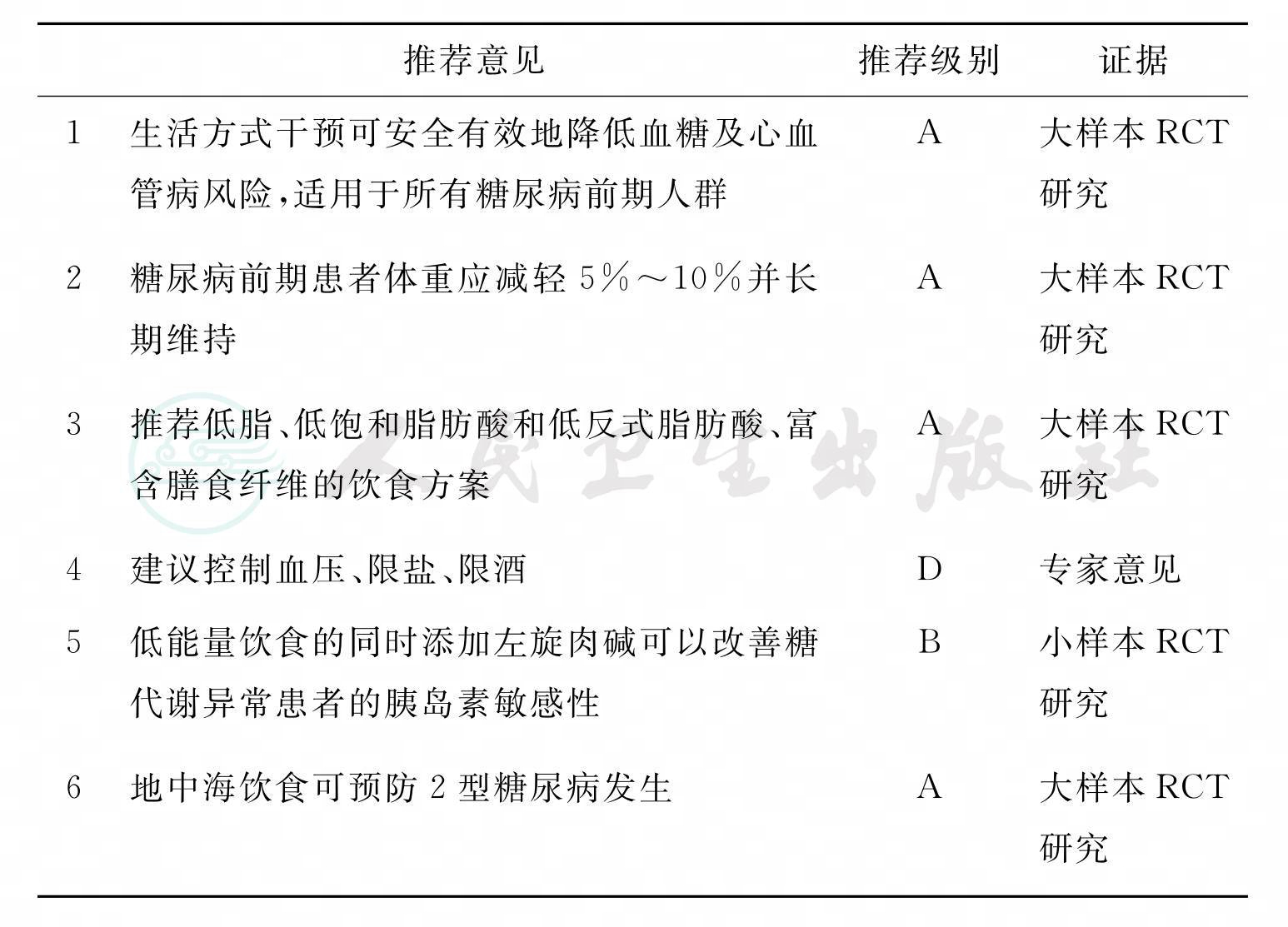
中国大庆研究是国内首个大样本糖尿病生活方式研究[6]。糖耐量受损人群经过6年的生活方式干预后,与对照组相比,糖尿病的发生率降低51%。而新公布的20年追踪研究[7]再次证实,在中国糖尿病前期人群中,生活方式的尽早干预可长期持久地减少43%的糖尿病发生风险。
为确定生活方式干预是否可以预防或延缓超重糖耐量受损(IGT)受试者发生2型糖尿病,芬兰糖尿病预防研究(FDPS)[8]将522例超重的IGT受试者(平均年龄55岁,BMI 25kg/m2)随机分为对照组(接受普通饮食、运动建议以及每年进行体格检查)和强化生活方式干预组组(接受营养学家的个体化营养咨询),随访3.2年。生活方式干预目标设定为体重减轻>5%、膳食总脂肪<30%、膳食饱和脂肪酸含量<10%、膳食纤维含量>15g/1000kcal以及运动大于4小时/周等。研究期间,干预组患糖尿病的概率降低了58%。
美国糖尿病预防计划(DPP)[9]研究第2.8年的随访结果显示,糖耐量损害患者经过强化生活方式干预,糖尿病的危险可减少58%。
中国大庆研究、芬兰糖尿病预防研究和美国糖尿病预防计划被国际公认为通过生活方式干预预防糖尿病的里程碑。上述研究均表明,强化生活方式干预对延缓糖尿病前期发展为2型糖尿病效果良好,亦较安全,更重要的是经济耗费低。
研究表明,绝经后女性通过DPP[9]及Look AHEAD[10]生活方式干预(每日摄入能量1200~2000kcal,30%能量来源于脂肪),并减少10%体重达6个月,可显著改善胰岛素抵抗及空腹血糖受损。
多项RCT研究显示,糖尿病前期人群中,为期12周的全身大肌肉群抗阻练习(每周3次,每次3组,每组7~8次重复次数)可改善血糖水平[11]。
用糙米代替白米16周,对糖尿病患者的BMI、腰围、血压、糖化血红蛋白、血糖、血脂和胰岛素水平都没有明显的影响[12]。而富含膳食纤维的谷类制品可以通过结肠发酵和产生短链脂肪酸的机制改善糖耐量[13]。日本2012年进行的一项针对糖耐量受损的肥胖患者的研究证明,早餐进食纳豆(由黄豆通过枯草杆菌发酵制成,具有黏性)、山药和秋葵等黏性食物2周,可以降低餐后即时血糖,增加胰岛素敏感性,降低血脂[14]。
Molfino等发现,低能量饮食的同时添加左旋肉碱可以改善糖代谢异常患者的胰岛素敏感性。左旋肉碱可能成为糖代谢异常患者的一种辅助治疗方式[15]。
韩国一项对45例空腹血糖受损患者的随机对照研究显示,口服红参8周可以降低患者的血总胆固醇、低密度脂蛋白、载脂蛋白B等的含量,同时改善空腹血糖[16]。但一项包含15例糖尿病及糖耐量异常患者的为期30天的干预研究发现,人参和人参皂苷不能有效改善糖尿病及糖耐量异常患者的胰岛细胞功能和胰岛素敏感性[17]。
许多研究都发现,地中海饮食可预防2型糖尿病(T2DM)[18,19]。推荐的地中海饮食方案为:食用未加工的谷类食品或谷类制品(全麦面包、意大利面、糙米等),水果(4~6份/天),蔬菜(2~3份/天),橄榄油(作为主要食用脂类),无脂或低脂食品(1~2份/天);鱼类、禽类、土豆、橄榄、干豆及坚果类食品(4~6份/周),或蛋类及甜食(1~3份/周);红肉及肉类制品(4~5份/月)[20]。
一、儿童青少年糖尿病
1.中华医学会糖尿病学分会.中国1型糖尿病诊治指南.医药卫生指南,2013,1:6-21.
2.Bantle JP,Wylie-Rosett J,Albright AL,et al.Nutritionrecommendations and interventionsfor diabetes-2006:a position statement of the American Diabetes Association.Diabetes Care,2006,29:2140-2157.
3.Silverstein J,Klingensmith G,CopelandK,et al.Care of children and adolescents with type 1diabetes:a statement of the American Diabetes Association.Diabetes Care,2005,28:186-212.
4.Pastors JG,Warshaw H,Daly A,et al.The evidence for the effectiveness of medical nutrition therapy in diabetes management.Diabetes Care,2002,25:608-613.
5.Delahanty LM,Halford BN.The role of diet behaviors in achieving improved glycemic control in intensively treated patients in the Diabetes Control and Complications Trial.Diabetes Care,1993,16:1453-1458.
6.Barclay A,Gilbertson H,Marsh K,et al.Dietary management in diabetes.Aust Fam Physician,2010,39(8):579-583.
7.陈伟,李海龙,康军仁.1型糖尿病的医学营养治疗.中华糖尿病杂志,2013,2:73-75.
8.Rabasa-Lhoret R,Garon J,Langelier H,et al.Effects of meal carbohydrate content on insulin requirements in type 1diabetic patients treated intensively with the basal-bolus(ultralente-regular)insulin regimen.Diabetes Care,1999,22:667-673.
9.Wolever TM,Hamad S,Chiasson JL,et al.Day-to-day consistency in amount and source of carbohydrate intake associated with improved blood glucose control in type 1diabetes.J Am Coll Nutr,1999,18:242-247.
10.Anderson EJ,Richardson M,Castle G,et al.Nutrition interventions for intensive therapy in the Diabetes Control and Complications Trial.The DCCT Research Group.J Am Diet Assoc,1993,93:768-772.
11.Mehta S,Quinn N,Volkening L,et al.Impact of carbohydrate counting on glycemic control in children with type 1diabetes.Diabetes Care,2009,32:1014-1016.
12.Smart CE,Ross K,Edge JA,et al.Can children with type 1diabetes and their caregivers estimate the carbohydrate content of meals and snacks?Diabet Med,2010,27:348-353.
13.Thomas D,Elliott EJ.Low glycaemic index,or low glycaemic load,diets for diabetes mellitus.Cochrane Database Syst Rev,2009,1:CD006296.
14.Queiroz KC,Novato Silva I,de Cassia Goncalves Alfenas R.Influence of the glycemic index and glycemic load of the diet in the glycemic control of diabetic children and teenagers.Nutr Hosp,2012,27(2):510-515.
15.American Diabetes Association.Standards of Medical Care in Diabetes—2013.Diabetes Care,2013,36:S11-66.
16.McCrindle BW,Urbina EM,Dennison BA,et al.Drug therapy of high-risk lipid abnormalities in children and adolescents:a scientific statement from the American Heart Association Atherosclerosis,Hypertension,and Obesity in Youth Committee,Council of CardiovascularDisease in the Young,with the Council on Cardiovascular Nursing.Circulation,2007,115:1948-1967.
17.Salo P,Viikari J,Hmlinen M,et al.Serum cholesterol ester fatty acids in7-and 13-month-old children in a prospective randomized trial of a low saturated fat,low-cholesterol diet:the STRIP baby project.Special Turku coronary Risk factor Intervention Project for children.Acta Paediatr,1999,88:505-512.
18.Northam EA,Anderson PJ,Werther GA,et al.Neuropsychological complications of IDDM in children 2years after disease onset.Diabetes Care,1998,21:379-384.
19.Rovet J,Alvarez M.Attentional functioning in children and adolescents with IDDM.Diabetes Care,1997,20:803-810.
20.Bjrgaas M,Gimse R,Vik T,et al.Cognitive function in type 1diabetic children with and without episodes of severe hypoglycaemia.Acta Paediatr,1997,86:148-153.
21.Brooks GA,Butte NF,Rand WM,et al.Chronicle of the Institute of Medicine physical activity recommendation:how a physical activity recommendation came to be among dietary recommendations.Am J Clin Nutr,2004,79:921S-930S.
22.Wasserman DH,Davis SN,Zinman B.American Diabetes Association.Physical activity/exercise and diabetes.Diabetes Care,2004,27(Suppl 1):S58.
23.Delahanty L,Simkins SW,Camelon K.Expanded role of the dietitian in the Diabetes Control and Complications Trial:implications for clinical practice.The DCCT Research Group.J Am Diet Assoc,1993,93:758-764.
24.Karjalainen J,Martin JM,Knip M,et al.A bovine albumin peptide as a possible trigger of insulin-dependent diabetes mellitus.N Engl J Med,1992,327(5):302-307.
25.Hyppnen E,LrE,Reunanen A,et al.Intake of vitamin D and risk of type 1diabetes:a birth-cohort study.Lancet,2001,358(9292):1500-1503.
26.Cardwell CR,Stene LC,Ludvigsson J,et al.Breast-feeding and childhood-onset type 1 diabetes:apooled analysis of individual participant data from 43observational studies.Diabetes Care,2012,35(11):2215-2225.
27.Bener A,Alsaied A,Al-Ali M,et aI.Impact of lifestyle and dietary habits on hypovitaminosis D in type 1diabetes mellitus and healthy children from Qatar,a sun-rich country.Ann Nutr Metab,2008,53(3-4):215-222.
28.Dabelea D,D’Agostino RB Jr,Mayer-Davis EJ,et al.Testing the acceleratorhypothesis:body size,beta-cell function,and age at onset of type 1(autoimmune)diabetes.Diabetes Care,2006,29:290-294.
29.American Diabetes Association.Type 2diabetes in children and adolescents.Diabetes Care,2000,23:381-389.