 去看看
去看看


1 食管鳞癌癌前病变及早期食管鳞癌的定义
1.1 食管鳞癌癌前病变的定义
癌前病变是指可以发展为癌的一种病理变化。食管鳞癌的癌前病变主要指食管鳞状上皮细胞的异型增生[6,7],世界卫生组织称之为上皮内瘤变(intraepithelial neoplasia),定义是细胞形态、大小、结构异常,包括多形细胞以及深染的核分裂象,细胞幼稚并出现异型有丝分裂、细胞正常极性消失。根据细胞异型增生的程度和上皮累及的深度分为低级别上皮内瘤变(low grade intraepithelial neoplasia,LGIN)和高级别上皮内瘤变(high grade intraepithelial neoplasia,HGIN),其中LGIN指异型细胞局限在上皮下1/2以内,HGIN指异型细胞累及上皮下1/2及以上。
1.2 早期食管鳞癌的定义
早期食管鳞癌(early esophageal squamous cell carcinoma)是指局限于食管黏膜层的鳞状细胞癌,不论有无淋巴结转移。
1999年日本食管癌分型[8]中将早期食管癌定义为局限于黏膜层及黏膜下层并且无淋巴结转移的癌。但随后的研究发现,当肿瘤局限于黏膜层时淋巴结的转移率几乎为0,而当肿瘤侵犯到黏膜下浅层时淋巴结转移率为21%~29%,侵犯到黏膜下深层时淋巴结转移率为50%~76%[9,10]。所以,目前认为仅局限于黏膜层的食管鳞癌为早期食管鳞癌,而侵犯到黏膜下层的鳞状细胞癌属于浅表食管癌(superficial esophageal carcinoma)范畴[11-13]。
2002年消化道肿瘤巴黎分型[14]中指出,根据肿瘤浸润深度可将浅表食管鳞癌进行如下分期:肿瘤局限于黏膜层者称为M期癌,浸润至黏膜下层未达固有肌层者称为SM期癌。对M期癌及SM期癌又进行细分:病变局限于黏膜上皮表层者为M1期癌;浸润至黏膜固有层者为M2期癌;浸润至黏膜肌层但未突破黏膜肌层者为M3期癌;肿瘤浸润至黏膜下层的上、中、下1/3者分别称为SM1期癌、SM2期癌及SM3期癌,其中将病变浸润至黏膜下层但距黏膜肌层200μm以内者称为SM1期癌(图1)。
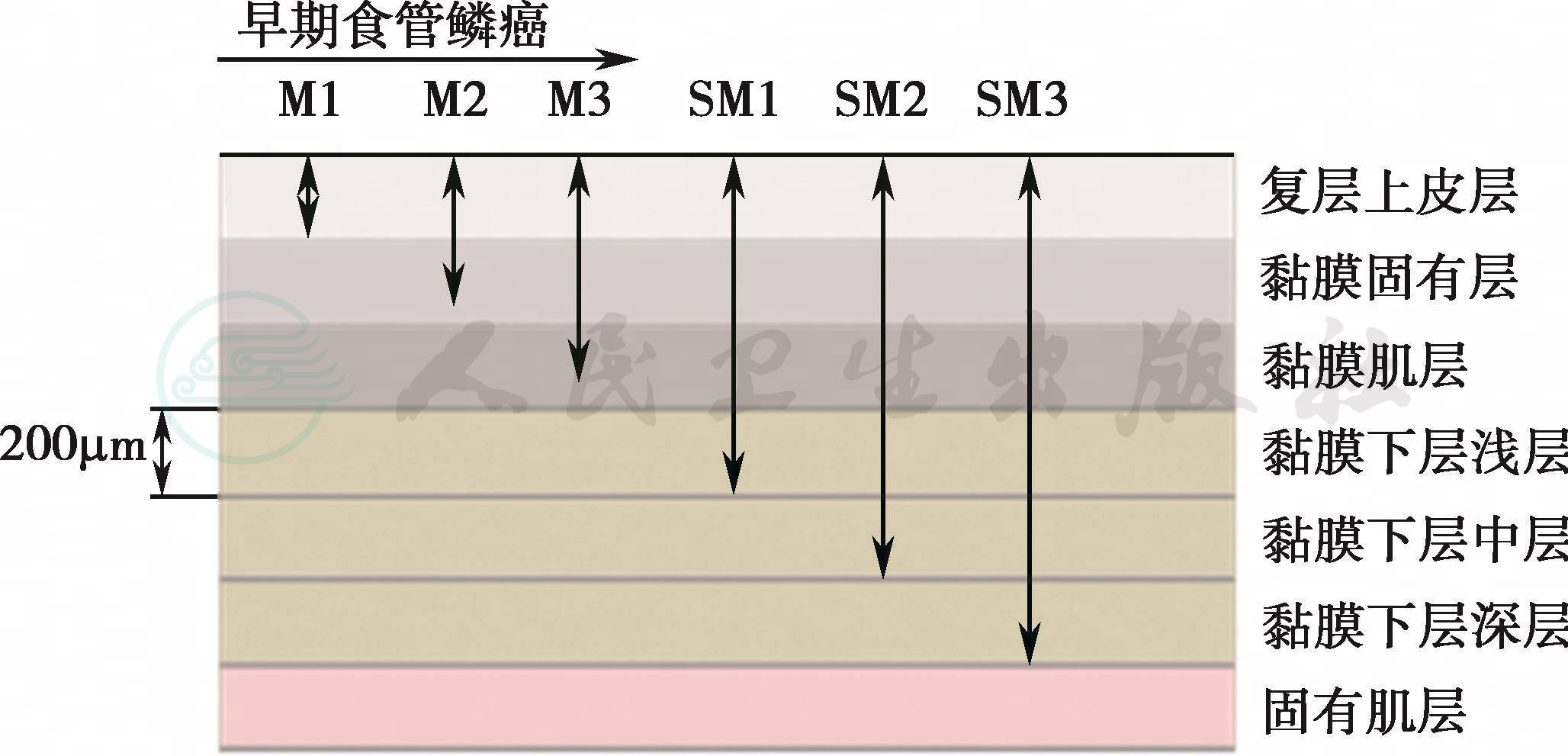
图1 浅表食管鳞癌巴黎分型分期模式图
M1、M2、M3期癌属于早期食管癌;病变浸润至黏膜下层但距黏膜肌层200μm以内者称为SM1期癌
2 早期食管鳞癌及癌前病变的筛查
发现早期患者是降低食管鳞癌死亡率的关键之一[15]。筛查有助于食管鳞癌的早发现、早诊断和早治疗,这是预防食管鳞癌和降低食管鳞癌累积死亡率的重中之重。
2.1 需要进行食管鳞癌及癌前病变筛查的无症状人群
对于食管鳞癌及癌前病变筛查人群,目前国内外指南均未提及。国内食管鳞癌流行病学调查显示,我国食管鳞癌发病主要集中在55~74岁[16,17],多项食管鳞癌高发区现场筛查研究均选择40~69岁人群作为筛查对象[18-21]。然而我国人口基数巨大,如对适龄人口全部进行相关检查(如胃镜),所需要的筛查成本及工作量无法与我国当前的医疗资源相适应,故建议首先对所有成年人进行食管鳞癌危险评估。根据国内高发区食管鳞癌相关危险因素流行病学的研究结果[22,23],将其按风险程度分为3组,分别为:一般风险人群、高风险人群和家族史不详人群。对于高风险人群和家族史不详者于40岁开始考虑进行食管鳞癌筛查,筛查截止于74岁;而一般风险者则于55岁开始,筛查截止于74岁。故推荐对于无症状人群在对全体成年人初筛的基础上确立食管鳞癌不同风险人群,分别给予不同的筛查方案,将55~74岁的一般风险人群、40~74岁的高风险人群以及家族史不详人群作为内镜筛查的目标人群。
结合国内食管鳞癌高发区相关危险因素及流行病学相关调查研究,将一些相关概念总结如下[24]:①食管鳞癌高风险人群,有以下任意1条者视为高危人群:a.长期居住于食管鳞癌高发区;b.一级亲属有食管鳞癌病史;c.既往有食管病变史(食管上皮内瘤变);d.本人有癌症史;e.长期吸烟史;f.长期饮酒史;g.有不良饮食习惯如进食快、热烫饮食、高盐饮食、进食腌菜者。②一般风险人群:无上述任意1条者。
2.2 食管鳞癌及癌前病变的筛查方法
2.2.1 基于高危因素的问卷调查
主要功能是依据病因学、危险因素,能较有把握地将高危人群筛选出来,是一种简单而经济的筛查方法,推荐通过问卷初筛确立高风险人群,再进一步行消化内镜等筛查,进而发现食管鳞癌癌前病变和早期食管鳞癌患者。
2.2.2 胃镜检查
推荐胃镜检查作为食管鳞癌及癌前病变精检筛查的常规手段,有条件者予以色素内镜检查(chromoendoscopy)、电子染色内镜检查(optical chromoendoscopy),尤其对于高风险人群。胃镜检查是食管鳞癌和癌前病变早期诊断的有效手段之一,可以早期发现和治疗食管鳞癌。胃镜检查对病变的检出率受多方面因素的影响,主要包括被检查者合作配合情况、内镜医生的内镜操作技术及对病变的识别能力、检查时间等[25-27]。
色素内镜:在食管鳞癌筛查时,选择1.2%~2.5%碘剂对食管黏膜喷洒,可提高早期食管鳞癌及癌前病变的检出率[28-32]。由于异常的鳞状上皮细胞内糖原含量减少或消失,故遇碘后出现淡染或不染色,能清楚显示病变与正常区域,借助于“粉色征”有助于识别病变黏膜的部位及范围,利于定位与活检,可以显著提高早期食管鳞癌以及癌前病变的检出率。
电子染色内镜:包括窄带成像技术(narrowband imaging,NBI)、内镜智能分光比色技术(flexile spectral imaging color enhancement,FICE)、高清智能电子染色内镜(i-scan)等。在不延长内镜检查时间的前提下,电子染色内镜对病变诊断的敏感性要明显优于白光内镜(97% vs 55%,P<0.01)[33],并且可避免过多活检而影响内镜下的治疗[34,35]。
不推荐使用上消化道钡餐检查、拉网细胞学检查进行早期食管鳞癌及癌前病变的筛查;病理组织标记物、肿瘤蛋白质组学等检查目前仅作为研究,暂不建议应用于人群筛查。
2.3 食管鳞癌及癌前病变的筛查流程
初筛应针对全体成年人,宜选择经济且简便易行的方法,推荐使用基于高危因素的问卷调查进行初筛,确立一般风险人群、高风险人群及家族史不详的人群,进一步行胃镜检查,并个体化配合使用色素内镜和(或)电子染色内镜,疑有问题处应予以活检进行病理诊断;有反酸、胃灼热等上消化道症状者就诊时予以机会性筛查。对于无症状人群食管鳞癌及癌前病变筛查流程见图2。
2.4 食管鳞癌及癌前病变筛查的实施
2.4.1 推荐各医院单位加强对早期食管鳞癌及癌前病变筛查的宣传
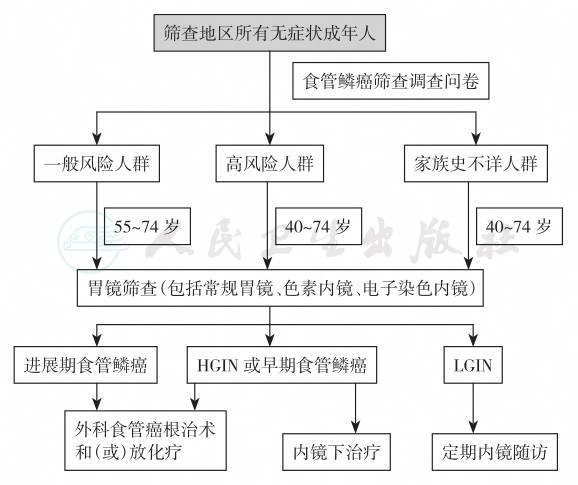
图2 无症状人群进行食管鳞癌及癌前病变筛查的流程图
HGIN:高级别上皮内瘤变;LGIN:低级别上皮内瘤变
早期食管鳞癌患者多无临床症状,对其筛查能否有效开展取决于大众对筛查的认识和依从性,故应向大众普及食管鳞癌筛查的相关知识,进行全民食管鳞癌筛查教育,使不具有专业医学知识的广大人群能够了解对食管鳞癌筛查的意义,让高危人群主动到医院进行胃镜检查,以实现早期发现、早期诊断和早期治疗。对于宣传教育的执行,可以通过印发宣传资料让社区医生对社区居民进行普及教育,充分利用各种媒体举办相关的专题讲座等。
2.4.2 推荐对基层医院医生进行早期食管鳞癌及癌前病变筛查教育
基层医院医
生是绝大部分患者就诊的首诊医生。一方面,他们可以成为对人群进行食管鳞癌筛查的主要实行者;另一方面,也要求其既能从思想上认识到筛查工作的必要性,又能从业务上具备顺利开展筛查工作的能力。因此,需要对基层医院医生系统地进行早期食管鳞癌及癌前病变筛查、诊断、治疗、随访有关知识的培训。
2.4.3 推荐加强对消化内镜医师的规范化培训,强化发现早期食管鳞癌及癌前病变的意识,提高对早期食管鳞癌及癌前病变的识别、诊断能力
对于综合医院的消化内科内镜医生,要重点提高对早期食管鳞癌识别、诊断能力。因此,有必要通过制定消化内镜操作规范并在有资质的消化内镜培训基地规范化培训内镜操作医师,加强其对早期食管鳞癌以及癌前病变的认识,尽力发现早期食管鳞癌和癌前病变的意识,规范胃镜的操作,尽量减少病变的遗漏。检查时应仔细观察食管黏膜的细微变化,包括黏膜色泽的变化、“草席征”、血管纹理的变化以及有无隆起或凹陷性病变等,尤其注意对小病变、平坦病变的发现,以免漏诊。在内镜检查过程中要充分应用充气及吸气手法、色素内镜,使病变更清晰。
2.4.4 推荐在胃镜检查前做好充分的消化道准备(包括黏液和气泡的清除)
良好的食管清洁度是提高早期食管鳞癌及癌前病变检出率的重要前提。
2.4.5 推荐在通过胃镜检查食管时一定要注意进镜和退镜速度,避免病变遗漏,同时要特别注意食管上段(包括食管入口处)等容易遗漏病变的部位。
3 早期食管鳞癌及癌前病变的诊断
上消化道内镜检查结合组织病理学仍是食管鳞癌诊断的金标准。对于难以发现的病变则要依靠色素内镜以及电子染色内镜发现,然后靶向活检,通过组织病理学予以诊断。食管鳞癌的诊断还应对恶性程度、浸润深度以及有无淋巴结转移作出诊断。恶性程度可以根据病理组织学类型进行判断,浸润深度则需结合色素放大内镜、超声内镜等检查甚至诊断性内镜下切除来予以诊断,并据此来评估淋巴结转移的情况以指导临床治疗方案的选择。
3.1 上消化道内镜检查前的准备
①检查前应向患者及家属告知内镜检查的必要性以及相关风险,并签订知情同意书。②完善检查前的相关检查,如心电图、凝血功能检查等。③检查前10~20分钟予以口服去泡剂及去黏液剂,检查前5分钟含服含局麻药的胶浆行局部浸润麻醉。有条件者可予以无痛苦胃镜检查。
3.2 常规胃镜检查
早期食管鳞癌患者临床上多无任何症状及体征,诊断上依赖于有经验医生的规范化食管检查、早期食管鳞癌及癌前病变的筛查,对可疑病变行活检,以组织病理学为诊断依据;推荐早期食管鳞癌及癌前病变的内镜下分型采用巴黎分型,主要分为隆起型、平坦型和凹
陷型。
早期食管鳞癌及癌前病变在内镜下主要有以下几种表现:①颜色的改变,可为斑片状发红或发白,边界欠清晰。②黏膜形态的改变,微隆起或凹陷,亦有完全平坦型,黏膜比较粗糙,可伴有糜烂或结节,质地比较脆或硬,触碰易出血。③血管纹理的改变,黏膜下血管模糊或消失[6]。观察时要注意调节充气量,充气过多或过少均会影响病变的诊断。
早期食管鳞癌内镜下可分为3种类型(图3),即0-Ⅰ型(隆起型)、0-Ⅱ型(平坦型)、0-Ⅲ型(凹陷型)。0-Ⅱ型又可分为0-Ⅱa型(浅表隆起型)、0-Ⅱb型(完全平坦型)和0-Ⅱc型(浅表凹陷型)。对于0-Ⅰ型、0-Ⅲ型病变,白光内镜下仔细观察多不会漏诊,0-Ⅱ型病变较为平坦,容易漏诊,尤其0-Ⅱb型病变。此时则需要行色素内镜或电子染色内镜检查,对于可疑病变行靶向活检。
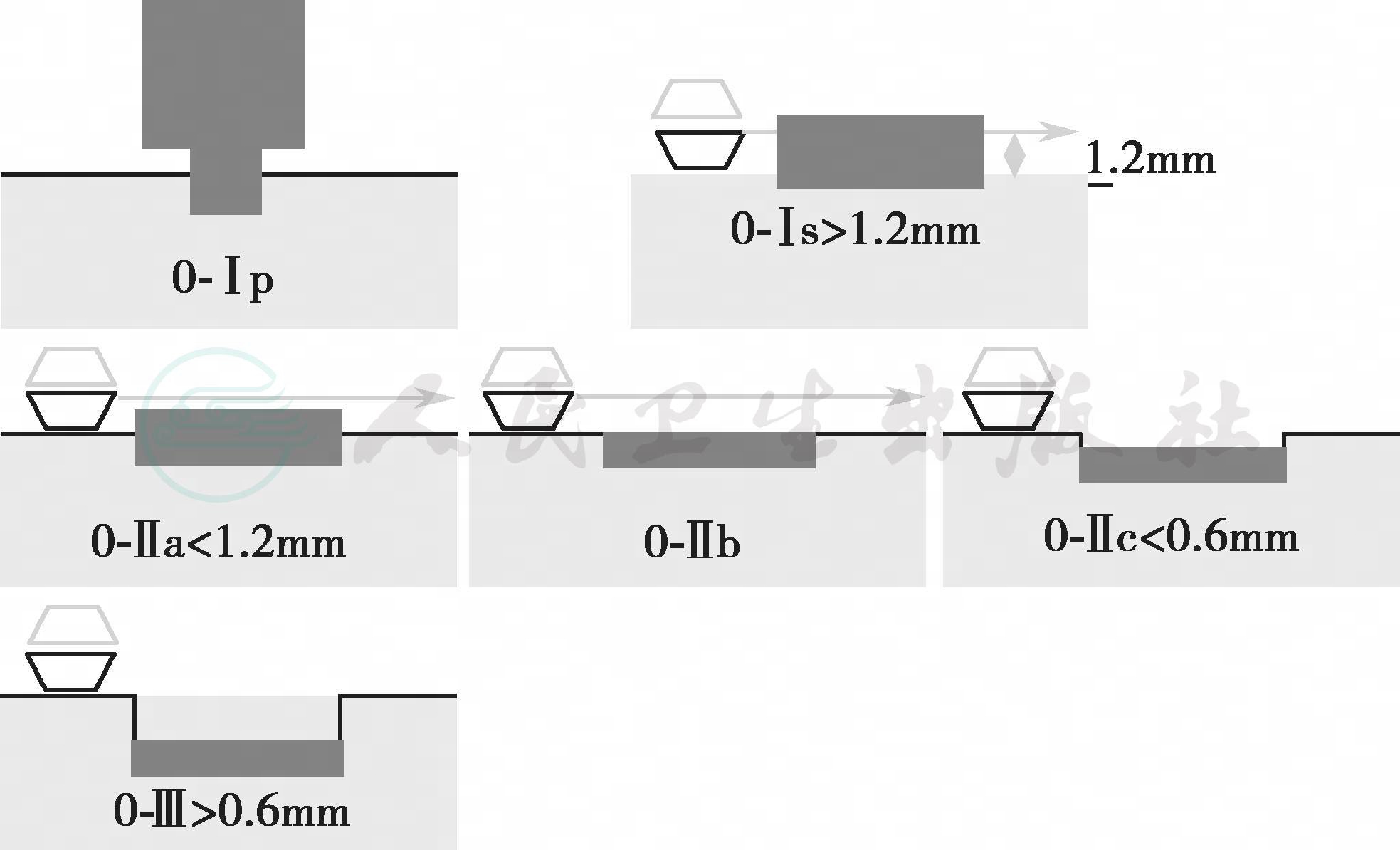
图3 早期食管鳞癌内镜下分型模式图及判断标准
内镜下分型可帮助区分食管鳞状上皮黏膜内癌以及黏膜下层癌。有研究对350例浅表食管鳞癌进行了分析,发现92%的0-Ⅰ型肿瘤侵及黏膜下层,96%的0-Ⅲ型肿瘤侵及黏膜下层,而85%的0-Ⅱ型肿瘤局限于黏膜层,其中15%的0-Ⅱa型及0-Ⅱc型病变侵及黏膜下层,而所有0-Ⅱb型病变均为黏膜内癌[36]。在0-Ⅱa型病变中,病变<2mm、呈颗粒状而非结节状外观、病变颜色苍白者提示为黏膜内癌;在0-Ⅱc型病变中,食管黏膜碘染色不着色、颗粒状无结节的病变提示为黏膜内癌;0-Ⅱb型病变或外观苍白的0-Ⅱa型病变提示为上皮内癌;如为混合型则高度怀疑黏膜下层癌。
3.3 色素内镜
推荐对于可疑的早期食管鳞癌及癌前病变采用碘染色借助“粉色征”或“银色征” 行进一步诊断和靶向活检。20世纪70年代即有应用碘染色来诊断食管疾病的报道[37,38]。碘染色的原理是正常成熟非角化食管鳞状上皮细胞含有的大量糖原含量减少甚至消失,碘染后相应部位呈淡染或不染区。碘染色模式分为4级[39]:Ⅰ级为浓染区,比正常食管黏膜染色深,多见于糖原棘皮症;Ⅱ级为正常表现,呈棕褐色;Ⅲ级为淡染区,多见于LGIN或急慢性炎症;Ⅳ级为不染区,多见于浸润癌、原位癌和HGIN。内镜下对食管进行碘染色可以清晰显示病变存在的部位和范围,使活检取材部位更加明确,从而提高早期食管鳞癌及癌前病变的检出率。然而在食管黏膜炎症、LGIN、HGIN以及癌变部位都可以出现碘溶液不染区,此时可借助于“粉色征”进行区分,即在喷洒碘溶液后病变部位呈不染或者淡黄色,2~3分钟后,HGIN和癌变部位可变为粉红色[31,32]。“粉色征”在NBI下观察可以被强化,呈闪亮的银色,称为“银色征”。利用“粉色征”或“银色征”来判断HGIN和癌变的敏感性和特异性可达88%和95%[40] 。
色素内镜检查常用碘溶液的浓度为1.2%~2.5%,喷洒碘溶液前宜应用链霉蛋白酶冲洗食管,去掉表面的黏液,自贲门向口侧喷洒至食管上段,抬高床头,染色完毕后应用西甲硅油溶液冲洗食管,以将黏液和多余的碘洗去便于观察,观察完毕后注意将胃腔内碘液吸出以减轻患者的痛苦。应用食管碘染色时,需要注意询问患者有无应用碘溶液后出现心慌不适、血压下降等过敏史,有碘过敏史者应避免碘染色;甲状腺功能亢进患者及孕妇避免应用碘染色;部分患者在进行食管碘染色后会出现明显的胸骨后烧灼感以及食管痉挛,可予以硫代硫酸钠中和碘溶液缓解患者的不适感;另外还需注意的是,食管黏膜损伤会影响碘染色效果,故再次碘染色应在7天后进行。
3.4 电子染色内镜及放大内镜
推荐对于早期食管鳞癌及癌前病变的电子染色内镜及放大内镜下观察采用早期食管鳞癌放大内镜日本食管学会分型(Japanese Esophageal Society Classification,JES分型),结合病变区域背景着色情况进行病变的诊断,并以此初步判定病变的范围及浸润深度。
3.4.1 Inoue's IPCL分型
正常食管黏膜表浅血管由分支状血管构成,紧贴黏膜肌层,向水平方向延伸,这是黏膜肌层以上最为常见的血管网。将食管鳞状上皮放大100倍可观察到食管鳞状上皮内乳头状微血管袢(intra-epithelial papillary capillary loop,IPCL)。IPCL垂直起源于分支状血管网(图4),使用放大内镜观察时正常食管黏膜的IPCL可表现为红色逗点状。NBI结合放大内镜观察时,位于深部的分支状血管为绿色,表浅的IPCL呈棕色点状[41]。而当发生浅表食管鳞癌时,肿瘤部分扩张的异常血管密集增生,此时可通过NBI加放大内镜观察IPCL状态,诊断食管鳞状上皮病变,包括上皮内瘤变及浅表癌,并可反映肿瘤的浸润深度。
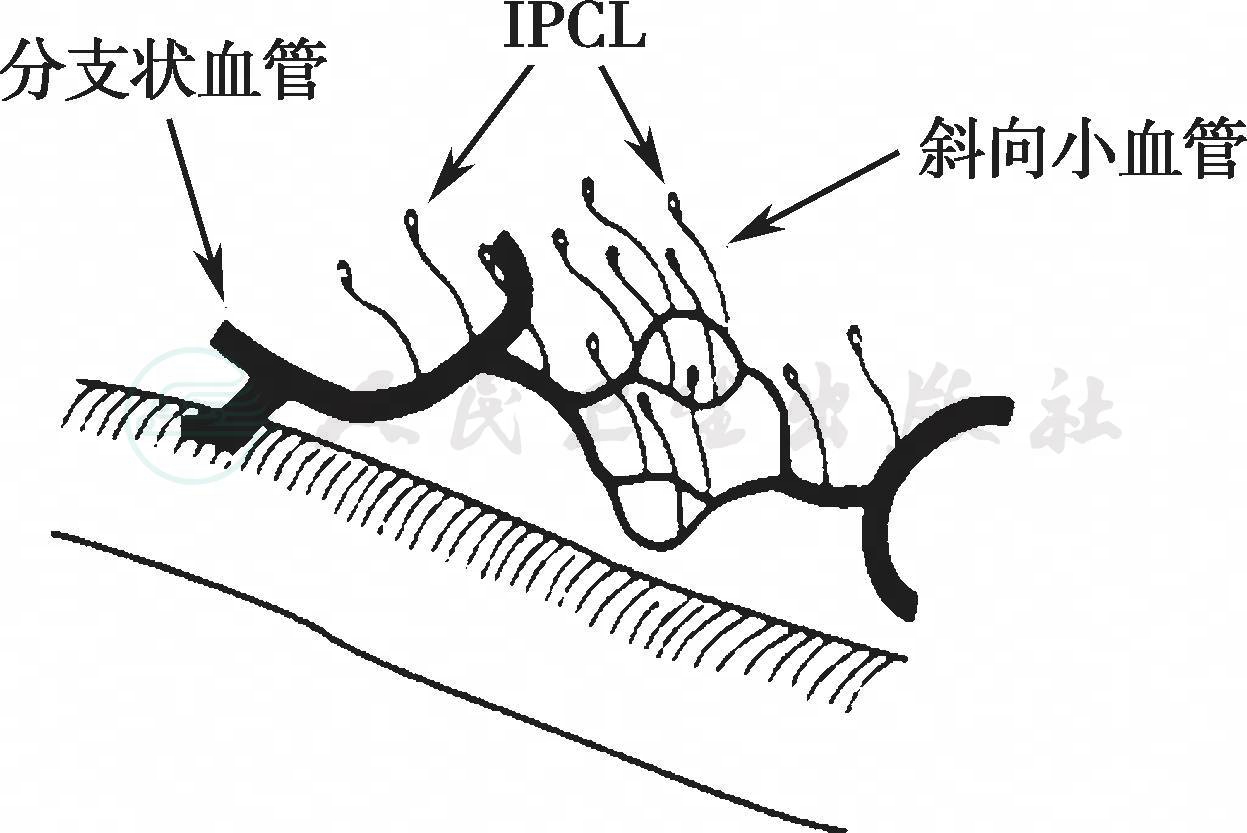
图4 食管鳞状上皮表浅血管的放大内镜检查结果示意图[41]
IPCL:上皮内乳头状微血管袢
利用IPCL诊断食管病变时分为两个步骤:首先找到NBI下呈褐色变化的区域,或者是碘染色的不染区;第二步使用放大内镜观察病灶,评估IPCL类型。IPCL可分为5型(图5),其变化包括扩张、弯曲、不均匀、管径变化等特征,据此可初步诊断病变的性质,从正常食管黏膜、炎症、异型增生到癌,内镜下图像见图6[42]。其中从IPCLⅡ型到Ⅴ-2型的变化发生在黏膜层,能够保持原IPCL的结构,变化主要发生在垂直平面;Ⅴ-3型则表现为不规则的IPCL原结构进一步破坏,呈水平面变化;在ⅤN型中原IPCL结构完全破坏,粗大管径的新生肿瘤血管呈水平方向分布。Ⅴ-3和ⅤN型的区别在于肿瘤血管的管径,ⅤN型肿瘤血管的管径约为Ⅴ-3型的10倍,提示肿瘤的浸润深度不同。
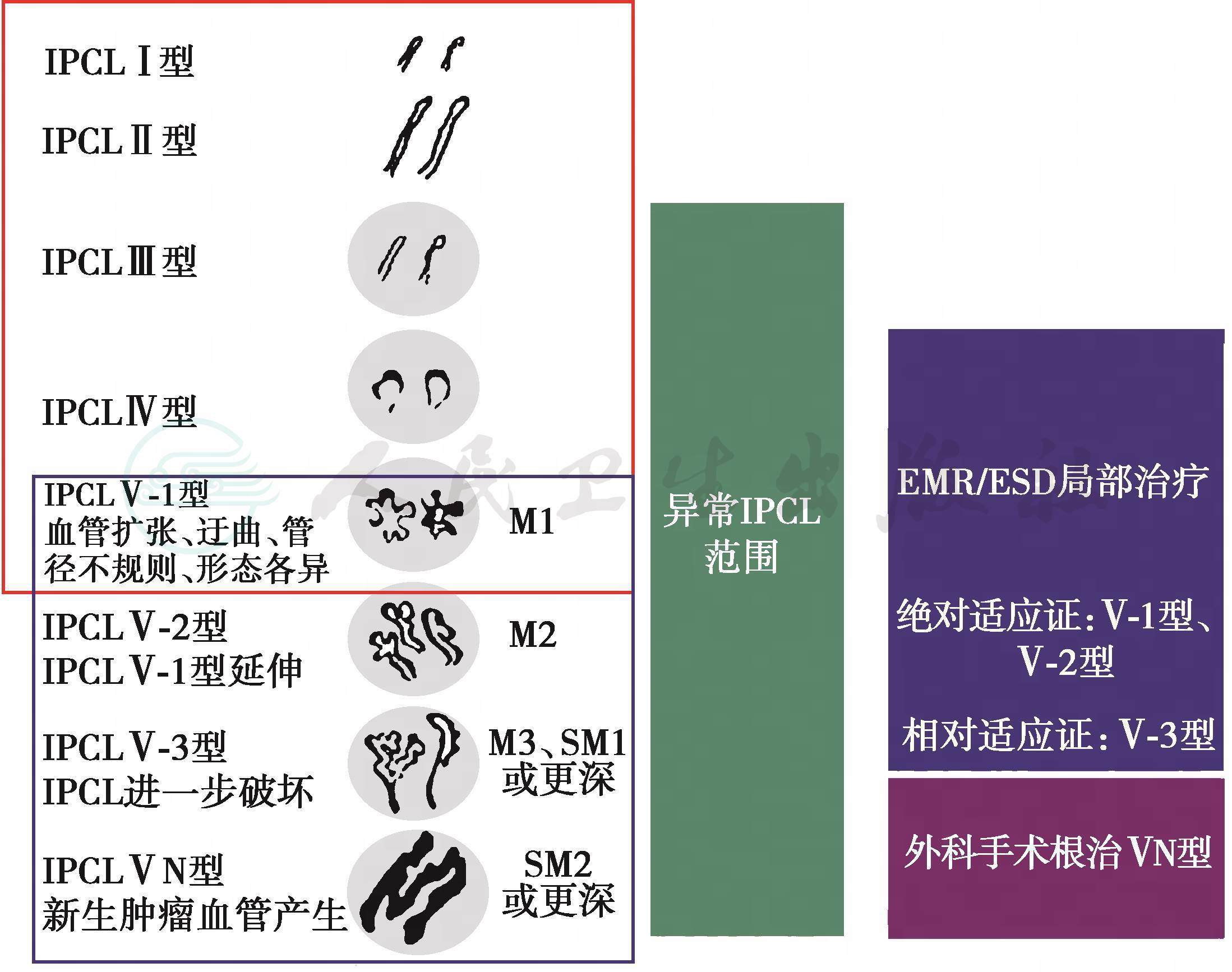
图5 Inoue's上皮内乳头状微血管袢(IPCL)分型[41]
EMR:内镜黏膜切除术;ESD:内镜黏膜下剥离术
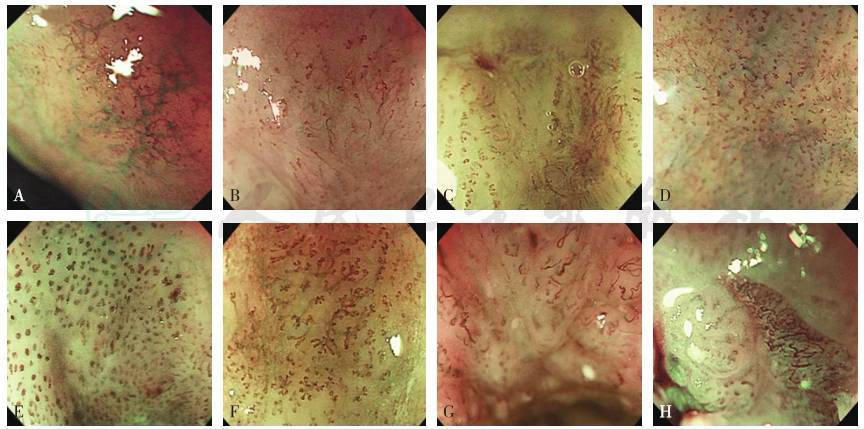
图6 上皮内乳头状微血管袢(IPCL)各分型的内镜下表现[42]
A~D分别为IPCLⅠ~Ⅳ型,E~H分别为IPCLⅤ-1型、Ⅴ-2型、Ⅴ-3型和ⅤN型
不同的IPCL分型代表不同的病变和浸润深度,IPCLⅠ型见于正常食管黏膜,IPCLⅡ型见于炎性病变,IPCL Ⅲ型见于慢性食管炎等,IPCL Ⅳ型见于HGIN,IPCLⅤ-1型及Ⅴ-2型分别见于M1期癌和M2期癌,IPCLⅤ-3型主要见于M3期癌、SM1期癌或浸润更深的癌,IPCL ⅤN型主要见于SM2期癌或浸润更深的癌,详见图5。通过IPCL分型来预测肿瘤浸润深度的准确率比较高,Goda等[43]报道显示,通过IPCL分型来预测黏膜内癌和黏膜下层癌的敏感性和特异性分别为78%和95%;Inoue等[44]报道显示,对于IPCLⅣ型病变的诊断准确率为80%。
3.4.2 Arima浅表食管鳞癌微血管形态分型[45]
Arima根据食管黏膜表面的微血管的形状和不规则形将其分为4型。1型为上皮下乳头内的细小的线形毛细血管,见于正常食管黏膜;2型为略微膨胀扩张的血管,并且上皮下乳头内的毛细血管形状正常,主要见于炎性病变;3型为口径不均的螺旋状血管,并且有挤压现象,排列不规则,主要见于M1期癌和M2期癌;4型表现为血管有重叠,不规则的分支状、网状或无血管区(avascular area,AVA),主要见于M3期癌和浸润更深层的癌。
3.4.3 早期食管鳞癌放大内镜下JES分型[46]
Inoue's IPCL分型和Arima浅表食管鳞癌微血管形态分型均较复杂,为便于临床应用,日本食管学会将上述两种分型结合起来,制定了一个新的简单易行的分型——JES分型,既包含了血管形态又包括了AVA。该分型将食管黏膜浅表血管分为A型和B型。A型为轻度异常或没有异常的血管,B型为异常的血管(包括扩张、迂曲、口径改变及形态不均)。B型又可分为3个亚型,即B1型、B2型和B3型,分别提示肿瘤浸润至M1或M2,M3 或SM1,SM2。另外根据AVA大小又可分为3种亚型,与肿瘤的浸润深度有关:AVA直径<0.5mm者为小AVA(AVA-small),0.5~3mm者为中AVA(AVA-middle),>3mm者为大AVA(AVA-large)。JES分型方法诊断的准确率可达90%(表1),但文献显示血管口径比AVA的评估更为客观[47]。
表1 早期食管鳞癌放大内镜下日本食管学会分型(JES分型)

注:IPCL:乳头内毛细血管袢;AVA:无血管区
3.4.4 背景着色
(background coloration,BC) BC是指在用NBI+放大内镜观察食管黏膜病变时,IPCL之间的食管黏膜上皮的着色情况。病变区域IPCL之间的黏膜上皮如果发生颜色的改变称为BC阳性(图7),如果没有颜色改变则称为BC阴性。BC对于区分食管黏膜的良性病变与鳞状细胞癌有着重要意义[48,49]。Minami等[50]对223处食管咽喉部早期鳞状细胞癌病变进行研究,发现BC对区分鳞状上皮良恶性病变的敏感性、特异性和总体准确性都特别高,分别为91.1%、71.4%和89.4%。对于BC颜色改变的原因目前尚无定论,有研究报道可能与肿瘤细胞牵拉导致的角质层变薄有关[51],也有报道指出这可能与肿瘤细胞较正常细胞表达血红蛋白高有关[50]。
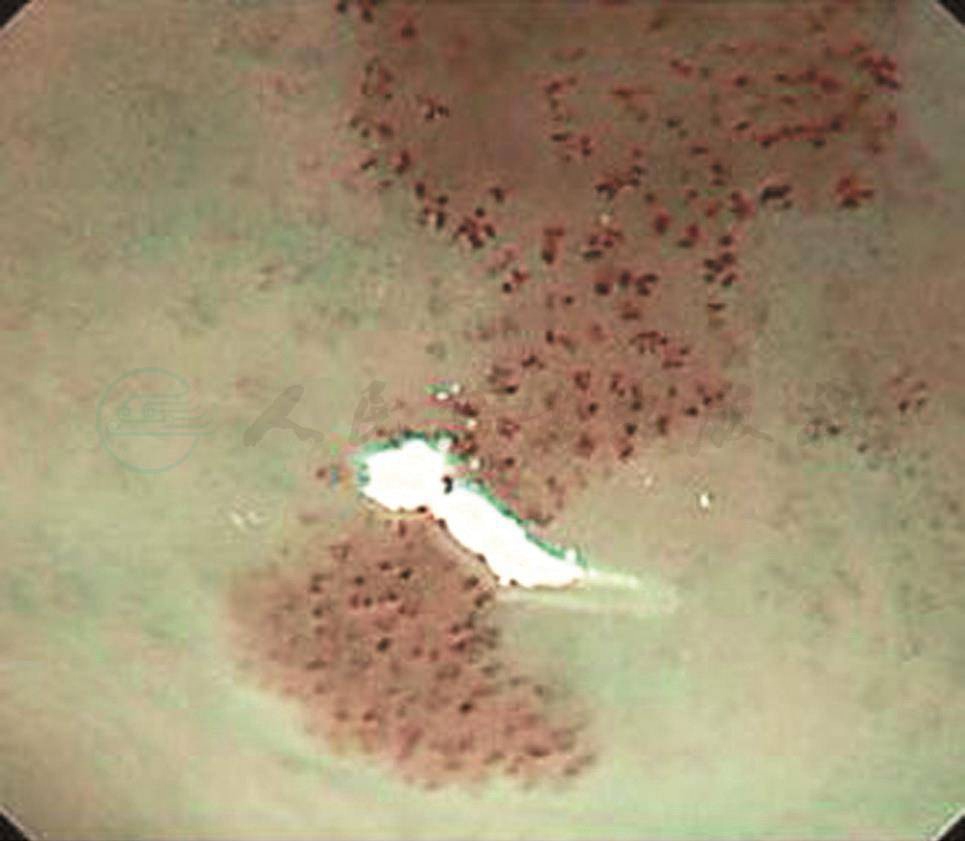
图7 窄带成像+放大内镜观察 病变区域上皮内乳头状微血管袢之间的黏膜上皮颜色和周围正常区域黏膜上皮颜色相比发生了改变,呈褐色,即该病变区域的背景着色为阳性[50]
3.5 内镜超声检查
(endoscopic ultrasonography, EUS) 推荐对可疑早期食管鳞癌予以EUS检查以评估肿瘤浸润的深度及周围淋巴结转移的情况,指导临床治疗方案的选择。
EUS探头频率范围为7.5~30Hz,在观察食管壁时可显示食管的分层结构。尽管EUS是对食管癌肿瘤分期的一项较为准确的技术,但对于通过EUS判定食管癌肿瘤分期以及淋巴结分期也曾一度受到怀疑[52-55],认为EUS对于早期食管癌的分期诊断并没有临床意义。但报道显示,高频探头对于区分浸润至黏膜层或黏膜下层的准确率可达75%~95%[56-63];EUS对于食管癌淋巴结分期的诊断准确率为68%~86%,对于可疑淋巴结的EUS引导下细针穿刺吸取活检术(endoscopic ultrasonography guided fine needle aspiration,EUS-FNA)可以明显提高食管癌淋巴结转移情况的判定准确率,可达90%以上[64]。与CT、PET-CT相比,EUS是对食管癌淋巴结进行分期准确率最高的方法[65]。最近文献显示,通过EUS进行的淋巴结分期可以用来评估食管癌患者的预后[66]。该研究对PET-CT显示的无淋巴结转移的患者进行了EUS,发现其中33.3%患者是有淋巴结转移的,并且通过随访发现EUS发现的淋巴结转移与患者预后密切相关。所以,通过EUS进行的食管癌淋巴结分期可以用来指导临床治疗方案的选择以及预后判断,具有临床意义[67,68]。
2015版美国国家综合癌症网络(National Comprehensive Cancer Network,NCCN)食管癌指南[69]以及2013版美国胃肠内镜协会(American Society for Gastrointestinal Endoscopy, ASGE)食管癌内镜评估和治疗指南[70]中指出,对于食管癌患者,在治疗前通过EUS进行临床分期很重要,EUS可评估肿瘤浸润深度、周围异常增大的淋巴结以及有无周围脏器的浸润。EUS检查时食管癌病变部位的食管壁呈低回声,正常的食管壁结构消失,从而可判断病变浸润至食管壁的深度;对于纵隔和胃周淋巴结,EUS很容易观察到,病变区域内增大、低回声、均质、边界清楚的圆形淋巴结可能为转移或炎性肿大,对于这类淋巴结的诊断要综合考虑,有条件者可行EUS-FNA,进一步行细胞学检查来明确诊断,以指导临床治疗方案的选择。
3.6 CT、PET-CT等影像学检查
不推荐使用上消化道钡餐检查行早期食管鳞癌及癌前病变的诊断,建议在EUS检查前予以CT或PET-CT检查,评估是否需要行EUS-FNA来判断淋巴结转移情况。
PET-CT可用来判断食管鳞癌淋巴结分期,但其敏感性及特异性较低,分别为57%和85%[71],PET-CT判断的淋巴结阴性或阳性并不可靠。NCCN食管癌指南建议在EUS检查前宜行CT或PET-CT检查,以此来判定对肿大的淋巴结是否需要行EUS-FNA检查。
4 早期食管鳞癌及癌前病变的内镜下治疗
4.1 早期食管鳞癌及癌前病变内镜下治疗的适应证、禁忌证
对早期食管鳞癌及癌前病变进行内镜下治疗具有简便、创伤性小、并发症少、住院时间短、疗效与外科手术相当等优点[72]。对于肿瘤的治疗,旨在根除,达到临床治愈的效果,故对早期食管鳞癌在选择内镜治疗时要严格把握其适应证及禁忌证,适应证的原则是没有淋巴结转移的可能,在选择治疗方案之前对患者的病情进行综合、详尽的评估至关重要,包括病变的性质、大小、个数等。
4.1.1 早期食管鳞癌及癌前病变内镜下治疗的适应证
推荐内镜下治疗前评估为食管HGIN、M1期癌、M2期癌为内镜下治疗的绝对适应证;M3期癌、累及食管3/4周以上的上述病变为内镜下治疗的相对适应证。研究显示,在食管M1期癌、M2期癌中淋巴结转移率均在5%以下[73-75],M1或M2期癌行内镜下治疗后淋巴结及再发远处转移的报道极少,内镜下治疗比外科食管癌根治术的并发症少,所以推荐M1或M2期癌为内镜下治疗的绝对适应证。有报道显示食管M3期癌淋巴转移率约10%,SM1期癌约为20%[10,76],但是由于内镜下切除与外科食管癌根治术相比,并发症少、患者术后的生活质量高,所以推荐对于术前评估没有明显淋巴结转移的M3期癌为内镜下治疗的相对适应证,此类患者可行诊断性内镜黏膜下剥离术(endoscopic submucosal dissection,ESD)治疗,术后应对切除标本仔细评估,评估认为淋巴转移风险较大者应追加食管癌根治术,术后予以放化疗。治疗后食管黏膜缺损在3/4周以上者,多会发生食管狭窄,这些病例为内镜下治疗的相对适应证[77],为预防术后食管狭窄应尽可能保留正常黏膜,要慎行食管黏膜环周切除治疗。以上事宜在行内镜下治疗前均应详尽告知患者和(或)其家属。对于食管SM2、SM3期癌,因其发生转移的概率较高,可达30%~56%[10],故不推荐行内镜下治疗。对于癌前病变,由于没有淋巴结及脉管转移的风险,并且癌变风险大,所以是内镜下治疗的绝对适应证。具体治疗方案的选择见图8。
4.1.2 早期食管鳞癌及癌前病变内镜下治疗的禁忌证
①患者不同意。②患者不能配合。③有严重出血倾向者。④严重心肺功能异常不能耐受内镜治疗者。⑤生命体征不平稳者。⑥有食管静脉曲张或静脉瘤,无有效的出血预防对策者。⑦病变位于食管憩室内或波及憩室者。⑧术前评估有淋巴结转移的M3及SM1期癌。⑨低分化食管鳞癌及未分化食管鳞癌。
4.2 早期食管鳞癌及癌前病变行内镜下治疗的术前准备
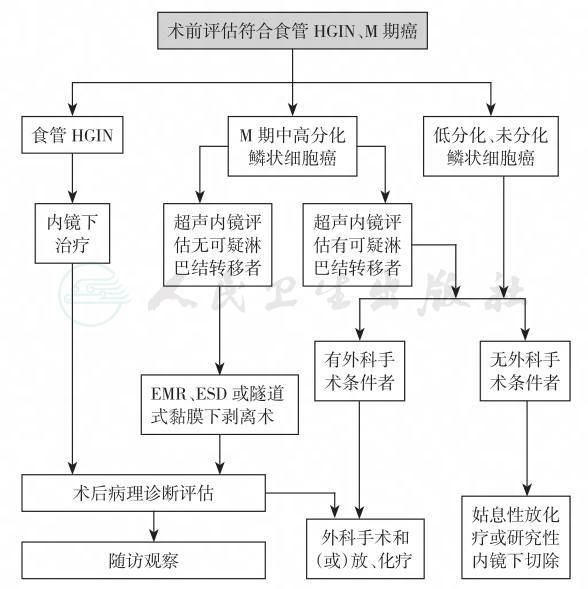
图8 早期食管鳞癌及癌前病变治疗流程图
HGIN:高级别上皮内瘤变;EMR:内镜黏膜切除术;ESD:内镜黏膜下剥离术
①知情同意:将治疗中可能出现的不良事件(如麻醉意外、黏膜损伤或感染、出血、穿孔、病灶切除不完全或基底部有恶变需进一步行根治性手术、术后狭窄以及术中的心、肺、脑血管意外等)告知患者并签订术前知情同意书。②完善术前各项相关检查,稳定高龄患者以及合并其他内科疾病患者的病情。③做好上消化道准备,如术前禁食8小时,术前30分钟口服去泡剂、去黏液剂,术前5分钟含服局部浸润麻醉润滑剂。④准备手术需要的各种器械以及药物,特别注意抢救设备及药品的准备。⑤充分评估病情,选择最适治疗方案。
4.3 早期食管鳞癌及癌前病变的内镜下治疗方法
所有病变在治疗前均应明确其范围,可以通过色素内镜或电子染色内镜加放大内镜来实现,确定好范围后,在距离病变外缘5mm处做标记,在进行内镜下治疗时应将标记部位均包括在内,以确保不遗漏病变。
4.3.1 ESD
推荐对于食管HGIN、M1期癌、M2期癌以及术前评估无可疑淋巴结转移的M3期癌首选ESD治疗。对于早期食管鳞癌及癌前病变采用ESD治疗可获得完整切除,有利于术后的病理评估,更好地确定疗效以及是否需要进一步治疗。食管病变ESD治疗基本流程包括:标记→黏膜下注射→黏膜切开→黏膜下剥离→创面处理(图9)。提醒术者操作时需考虑到食管管壁结构的特殊性,调整诸如黏膜下注射的深度、标记时电凝的功率等技术参数以减少出血、穿孔等并发症的发生。
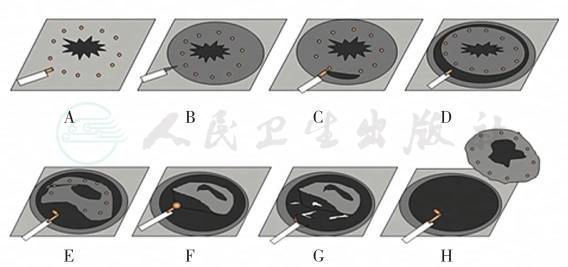
图9 内镜黏膜下剥离术示意图
A.充分暴露病变,确定病变范围并在病变外围进行标记;B.进行黏膜下注射,观察抬举征;C.在病变周围切开病变黏膜至黏膜下层;D.在病变周围标记点的外缘环周切开黏膜;E、F.黏膜下层剥离;G.在剥离的过程中不断处理裸露的血管;H.将病变黏膜完全剥离下来,并处理创面,预防迟发性出血
隧道式黏膜剥离术是在经典ESD基础上的改进,其提出主要是针对环周型病变。在环形切开上下缘后,从上缘向下进行隧道式剥离,即先从黏膜下剥离使内镜直接从远端环切口穿出,再沿隧道两侧剥离黏膜,直至完全剥离病变。 该方法克服了食管环周病变经典ESD切除后无法对切缘进行精确评估的缺点。但术后容易出现食管狭窄,术前应与患者和(或)家属讲明此情况。
4.3.2 内镜黏膜切除术(endoscopic mucosal resection,EMR)
推荐对于可一次性完全切除的食管HGIN、M1期癌、M2期癌以及术前评估无可疑淋巴结转移的M3期癌可使用EMR治疗。对于可一次性完全切除的食管鳞癌癌前病变以及M1、M2期癌,EMR治疗是安全有效的[78]。目前采用的EMR技术已日趋多样化,如:黏膜下注射法黏膜切除术(标准EMR)、透明帽辅助法黏膜切除术(EMR with a cap,EMRC)、结扎式EMR术(EMR with ligation,EMR-L)、分片黏膜切除术(endoscopic piecemeal mucosal resection,EPMR)、多环套扎黏膜切除术(multi-band mucosectomy,MBM)等。各种EMR操作步骤虽略有不同,但基本原则与操作技巧基本一致。EMR过程中黏膜下注射是关键的步骤,充分的黏膜下注射使病变完全抬举,可避免穿孔的发生。具体EMR术式应根据病灶具体情况进行选择,以获得最佳疗效。有些直径略大的病变也可以通过EPMR、MBM等方式治疗,但不作为首选,因为EPMR、MBM为分片切除病灶,切下的小片组织由于受电凝等作用常影响进一步的病理评估。若术后残留部分较大,应再次追加内镜下局部治疗,对于小的残余病灶可用热活检钳或氩离子束凝固术(argonplasma coagulation,APC)处理。切除的标本要回收,进行病理组织学检查。
4.4 早期食管鳞癌及癌前病变内镜下治疗的常见并发症及处理方法
并发症主要
包括出血、穿孔以及食管狭窄。对早期食管鳞癌及癌前病变内镜下治疗并发症处理的原则:首选内镜下处理,内镜下难以解决者选择外科手术治疗。常用的技术包括内镜下电凝止血、钛夹止血、钛夹封闭穿孔、内镜下病变再次切除以及内镜下食管狭窄扩张治疗等。
出血是早期消化道癌及癌前病变内镜下治疗最常见的并发症,包括术中出血以及术后出血。有报道显示早期食管癌内镜下切除术中的出血量比较小,多在内镜操作过程中采用ESD治疗的剥离刀或止血钳就能得到很好的止血效果[79-81]。术中及时止血及术后仔细处理暴露血管是预防出血的关键。早期食管癌内镜下切除治疗过程中出现穿孔的风险要高于胃部病变,有报道显示食管ESD的穿孔率为0~6%[79-81]。预防穿孔的关键是内镜医生的丰富经验及仔细操作,如在术中及时发现穿孔可用钛夹予以夹闭。食管狭窄主要发生于病变环周比例较大者,报道显示病变超过1/2食管周径者术后食管狭窄发生率为6.9%~18%[82-84]。另有研究显示病变黏膜环周的比例和病变深度可作为术后食管狭窄的预测因子[77],切除病变黏膜超过1/2环周时,27.6%患者出现术后食管狭窄;超过3/4环周时,94.1%患者出现术后食管狭窄;病变深度超过M2期显著增加术后食管狭窄的发生率。对于术后的食管狭窄,多数予内镜下气囊扩张治疗后可缓解,但亦有较顽固者,需反复内镜下扩张治疗或扩张后短期内放置可取出的全覆膜自膨式食管金属支架。另外,糖皮质激素可以抑制炎症反应,防止胶原蛋白交联,故可用于食管狭窄的预防和治疗,主要用法有口服和局部应用[85,86]。Mori等[87]报道了将含糖皮质激素类药物的凝胶在内镜下喷洒于食管ESD术后的创面,并应用球囊局部压迫使凝胶渗入创面,该方法可以预防食管ESD术后食管狭窄的形成,并且避免了口服导致的全身性不良反应以及局部注射导致的穿孔、出血风险。
4.5 早期食管鳞癌及癌前病变内镜治疗术后患者的处置
①当日禁食,可进水,次日可进流食,逐渐增加饭量。②给予黏膜保护剂,予以质子泵抑制剂抑酸治疗。③一般不用抗菌药物,当切除面积较大、患者年龄较大及免疫功能低下者可预防性使用抗菌药物。
4.6 出现以下情况建议追加内镜或外科手术
①切除标本侧切缘阳性者建议再次内镜下治疗或外科手术治疗。②有以下任意1条者均建议追加外科食管癌根治手术:a.切除标本基底切缘阳性;b.浸润至黏膜下层200μm以上(SM2及更深);c.脉管侵袭阳性;d.低分化及未分化鳞状细胞癌。早期食管鳞癌及癌前病变内镜治疗后再治疗方案流程图见图10。
4.7 早期食管鳞癌及癌前病变内镜治疗疗效评价
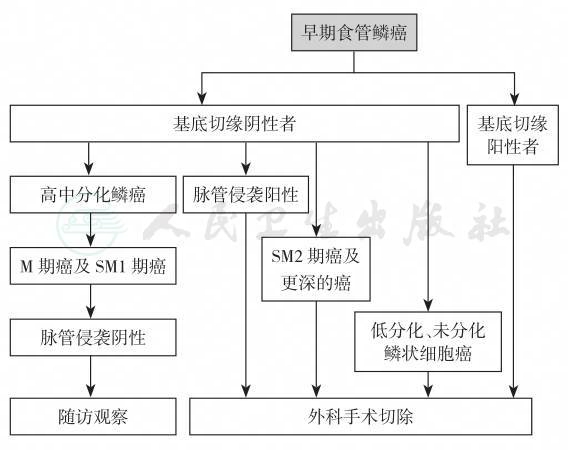
图10 早期食管鳞癌内镜下切除治疗后再治疗方案流程图
①整块切除(en bloc resection):病灶在内镜下被整块切除并获得单块标本。②完全切除/R0切除(complete resection/ R0 resection):内镜下切除标本的侧切缘和基底切缘无肿瘤残留。③不完全切除/R1切除(incomplete resection/R1 resection):内镜下切除标本的侧切缘和基底切缘无肉眼可见肿瘤残留,但显微镜下可见肿瘤残留。④残留切除/R2切除(residual resection/R2 resection):内镜下切除标本的侧切缘和基底切缘有肉眼可见的肿瘤残留。⑤Rx切除(Rx resection):由于血凝块或分块切除的影响,无法进行标本切缘评估时称为Rx切除。⑥内镜下完全治愈:a.属于R0切除;b.黏膜内癌或黏膜下层浸润深度不超过200μm(SM1)的黏膜下癌;c.无脉管浸润;d.组织学类型为高、中分化。⑦残留(residual):术后6个月以内在原切除部位及周围1cm内黏膜发现肿瘤病灶。⑧局部复发(local recurrence):手术6个月以后在原切除部位及周围1cm内黏膜发现肿瘤病灶。
5 早期食管鳞癌及癌前病变的标本处理及病理诊断
5.1 病理检查申请单和送检标本的接收
临床医生认真逐项填写申请单内的有关项目,特别是简要病史、内镜下病变形态及初步诊断,签名后随同标本送往病理科。病理科在接收申请单和送检标本时,应对两者进行认真核对。
5.2 标本的病理学处理
5.2.1 活检标本的病理学处理
①内镜医师及时将活检标本放入10%中性甲醛溶液中固定,固定时间为6~48小时。②病理科仔细核对临床送检标本数量,送检活检标本必须全部取材。③每个蜡块内包裹不超过2粒活检标本。④将标本包于纱布或柔软的透水纸中以免丢失。⑤建议在组织包埋过程中使用放大镜或立体显微镜观察活检标本,仔细辨认黏膜面,确保在蜡块中包埋方向正确。片状食管活检组织标本竖立包埋。⑥每个蜡块应切取6~8个切片,置于载玻片上,行常规HE染色。
5.2.2 黏膜切除(EMR或ESD)标本的病理学处理
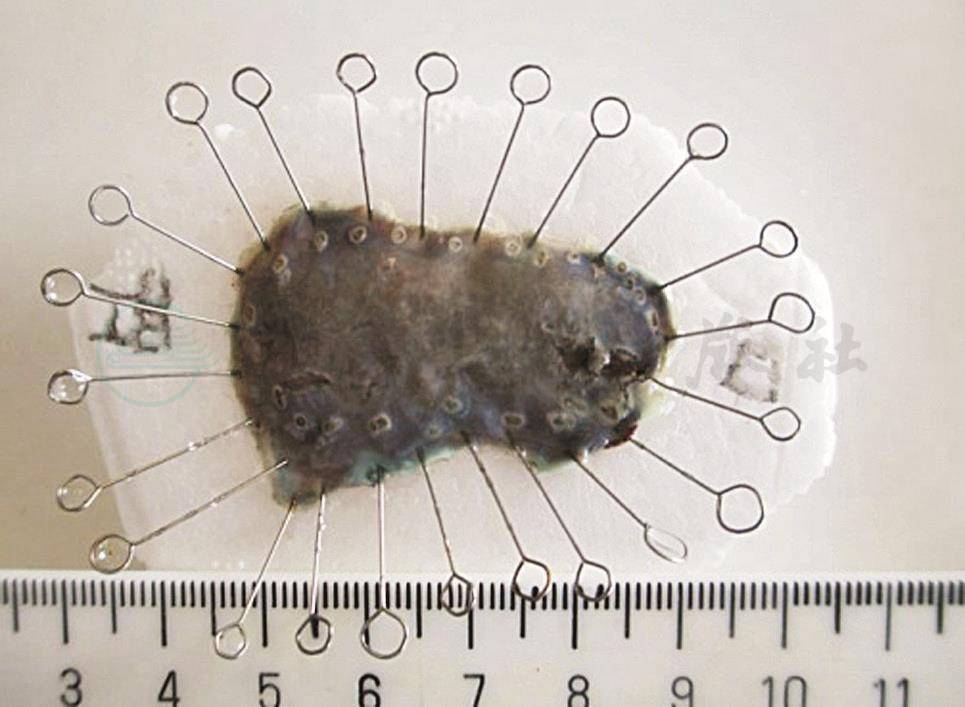
图11 将内镜下切除的黏膜组织用细针固定、展平在泡沫板上
①充分伸展黏膜标本,保持病变原形:为了充分显示病变,避免黏膜肌层回缩,内镜医生或护士需要使用针径较小的不锈钢细针将EMR或ESD标本整块固定于泡沫塑料或橡胶板上(图11)。在固定黏膜标本时应该保持整个黏膜标本的平展,在标本边缘用针将整个黏膜层,特别是黏膜肌层均匀用力向外牵拉,使黏膜伸展固定于泡沫板上,充分暴露黏膜面的病变。黏膜伸展的程度应该和黏膜本身在相应脏器的生理状态相当,不要过分牵拉破坏标本的完整性而影响后续对病变的病理组织学观察。尽可能在充分固定好的标本周围标记标本在体内的相对位置,比如口侧、肛侧、前壁、后壁等。②及时固定标本,避免过度干燥:对标本处理时间的规定关系到抗原修复,影响免疫组化及分子生物学检查结果,一般来说组织标本固定时间不应该超过72小时。固定液:10%中性甲醛固定液。固定液量:大于所固定标本体积的10倍。固定温度:正常室温。固定时间:12~48小时。③黏膜切除(EMR或ESD)标本的病理取材和照相:a.根据内镜医师送检标本标记的方位(如口侧、肛侧、前壁、后壁等)将黏膜平展开,记录标本及肿瘤的大小、各方位距切缘的距离,并照相存档;b.建议对甲醛固定后的黏膜标本再行1%~5%碘溶液染色,显示黏膜表面不染色区域,明确病变范围,测量病变大小,辨认距离肿瘤或不染色区域最近距离的黏膜切缘,照相存档,以此切缘的切线为基准,垂直于此切线每间隔0.3cm平行切开标本并照相存档,分成适宜大小的组织块,用墨汁标记切缘,记录组织块对应的方位(图12)。④黏膜切除(EMR或ESD)标本的病理包埋、制片:组织包埋时,应将黏膜标本按照同一空间顺序竖立包埋,确保对各方位黏膜组织全层结构的观察,如肉眼判断有困难,可借助放大镜或立体显微镜辨别黏膜方向帮助包埋。将包埋好的组织蜡块在组织切片机上切片,切片厚度为4~5μm。HE染色后显微镜下观察(图13)。
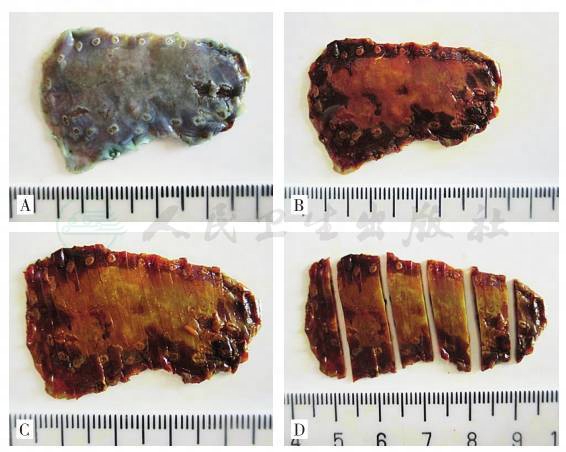
图12 甲醛固定后的组织标本取材
A.甲醛固定后内镜黏膜下剥离(ESD)标本;B.固定后的标本行5%碘溶液染色,显示黏膜表面不染色区域;C.将ESD标本每间隔0.3cm平行切开标本;D.将切开的标本分成6份,放置于包埋盒中脱水、浸蜡
图13 组织切片在显微镜下所见(HE×40)
5.3 黏膜切除(EMR或ESD)标本的规范化病理学报告
规范化的病理报告应该包括以下几点:①标本类型、病变肉眼形态及大小。②组织学分型:a.癌前病变(低级别上皮内瘤变、高级别上皮内瘤变);b.高分化鳞癌、低分化鳞癌。③肿瘤侵犯的深度(SM1:<200μm)。④脉管有无侵犯。⑤黏膜标本的手术切缘状态。⑥周围黏膜其他病变。⑦绘制黏膜病变谱系图。示例见图14。

图14 规范的病理报告示例
6 早期食管鳞癌及癌前病变治疗后的随访[88]
①在治疗后的第1年每3个月复查1次,后续每年复查1次。②每次胃镜复查应予以碘染色和(或)电子染色内镜仔细观察,发现可疑病变时予以活检行病理学检查;对于仅行内镜下切除治疗的M3、SM1期癌,每次复查应行颈部超声检查及超声内镜检查,注意有无淋巴结肿大。③对于多发食管鳞癌及食管碘染色多部位不染色者异时性食管鳞癌发生率高,建议每6个月复查1次。在术后前2~3年内每3~6个月定期行直肠检查以明确有无局部复发[28]。④对于随访过程中发现病变残留或局部复发以及新发病灶,可再次予以内镜下治疗,内镜下治疗失败者可追加外科手术治疗或放化疗。
[1] Montgomery EA. Oesophageal cancer[A]//Stewart BW, Wild CP. World Cancer Report 2014[ M].Lyon: International Agency for Research on Cancer, 2014.374-382.
[2] 赫捷,邵康.中国食管癌流行病学现状、诊疗现状及未来对策[J].中国癌症杂志,2011,21(7):501-504.
[3] 王国清.食管癌高发现场早诊早治30年临床研究经验[J].中国医学科学院学报,2001,23(1):69-72.
[4] 张蕾,郝长清,赵德利,等.早期食管癌及其癌前病变食管黏膜切除术[J].中国消化内镜,2007,1(1):4-6.
[5] 王贵齐,魏文强,郝长青,等.内镜下应用氩离子血浆凝固术治疗早期食管癌及其癌前病变的临床研究[J].中华消化内镜杂志,2004, 21(6):365-367.
[6] Guindi M, Riddell RH. The pathology of epithelial pre-malignancy of the gastrointestinal tract[ J]. Best Pract Res Clin Gastroenterol, 2001, 15(2):191-210.
[7] Shimizu M, Nagata K, Yamaguchi H, et al. Squamous intraepithelial neoplasia of the esophagus: past, present, and future[ J]. J Gastroenterol, 2009, 44(2):103-112.
[8] Japanese Society for Esophageal Diseases. Guidelines for the clinical and pathologic studies on carcinoma of the esophagus[ M]. 9th ed. Tokyo:Kanehara, 1999.
[9] Sepesi B, Watson TJ, Zhou D, et al. Are endoscopic therapies appropriate for superficial submucosal esophageal adenocarcinoma? An analysis of esophagectomy specimens[ J].J Am Surg, 2010, 210 (4):418-427.
[10] Hölscher AH, Bollschweiler E, Schröder W, et al. Prognostic impact of upper, middle, and lower third mucosal or submucosal infiltration in early esophageal cancer[J]. Ann Surg, 2011, 254(5):802-807.
[11] Shimizu M, Zaninotto G, Nagata K, et al. Esophageal squamous cell carcinoma with special reference to its early stage[ J]. Best Pract Res Clin Gastroenterol, 2013, 27(2):171-186.
[12] Schlemper RJ, Riddell RH, Kato Y, et al. The Vienna classification of gastrointestinal epithelial neoplasia[ J]. Gut, 2000, 47(2):251-255.
[13] Japan Esophageal Society. Japanese Classification of Esophageal Cancer, tenth edition: Part 1[J].Esophagus, 2009(1):1-25.
[14] Participants in the Paris Workshop. The Paris endoscopic classification of superficial neoplastic lesions: esophagus, stomach, and colon: November 30 to December 1, 2002[J]. Gastrointest Endosc, 2003, 58(6 Suppl):S3-S43.
[15] Fan YJ, Song X, Li JL, et al. Esophageal and gastric cardia cancers on 4238 Chinese patients residing in municipal and rural regions: a histopathological comparison during 24-year period[J]. World J Surg, 2008, 32(9):1980-1988.
[16] 邹小农.食管癌流行病学[J].中华肿瘤防治杂志,2006, 13(18): 181-184.
[17] 陈洁君,周余春,刘红建,等.江苏省泰兴市2003-2010年食管癌发病趋势分析[J].复旦学报(医学版),2014, 41(1):22-26.
[18] Wang X, Fan JC, Wang AR, et al.Epidemiology of esophageal cancer in Yanting - regional report of a national screening programme in China[ J]. Asian Pac J Cancer Prev, 2013, 14(4): 2429-2432.
[19] 王国清,魏文强,乔友林.食管癌筛查和早诊早治的实践与经验[J].中国肿瘤,2010, 19(1):4-8.
[20] Lu YF, Liu ZC, Li ZH, et al. Esophageal/gastric cancer screening in high-risk populations in Henan Province,China[J].Asian Pac J Cancer Prev, 2014, 15( 3):1419-1422.
[21] Liu SZ, Wang B, Zhang F, et al. Incidence, survival and prevalence of esophageal and gastric cancer in Linzhou city from 2003 to 2009 [J].Asian Pac J Cancer Prev, 2013, 14(10):6031-6034.
[22] 韩书婧,魏文强,张澍田,等.食管癌高发地区人群危险因素的调查研究[J].中国全科医学,2012, 15(32):3745-3748.
[23] 刘佳,李鹏,张澍田,等.河北省武安市居民吸烟及饮酒与食管黏膜低级别瘤变发病关系的病例对照研究[J].首都医科大学学报,2010, 31(3):335-338.
[24] Freedman ND, Abnet CC, Leitzmann MF, et al. A prospective study of tobacco, alcohol, and the risk of esophageal and gastric cancer subtypes[ J]. Am J Epidemiol, 2007, 165(12):1424-1433.
[25] Yokoyama A, Ohmori T, Makuuchi H, et al. Successful screening for early esophageal cancer in alcoholics using endoscopy and mucosa iodine staining[J]. Cancer, 1995, 76(6):928-934.
[26] Endo M, Takeshita K, Yoshida M. How can we diagnose the early stage of esophageal cancer[J]? Endoscopy, 1986, 18(Suppl 3): 11-18.
[27] Muto M. Endoscopic diagnostic strategy of superficial esophageal squamous cell carcinoma[ J]. Dig Endosc, 2013, 25(Suppl 1):1-6.
[28] 张永贞,王新正,张铭,等.食管癌高发区内镜碘染色筛查食管癌/贲门癌的5年结果分析[J].中国肿瘤,2012, 21(1):32-34.
[29] 王中琼,祝德,谭礼让,等.四川省巴中市2010~2013年居民食管癌筛查结果分析[J].肿瘤预防与治疗,2014,27(2):81-84.
[30] Lopes AB, Fagundes RB. Esophageal squamous cell carcinomaprecursor lesions and early diagnosis[ J].World J Gastrointest Endosc, 2012, 4(1):9-16.
[31] Ohmori T, Yokoyama A. Clinical usefulness of pink-color sign (Japanese)[J]. Gastroenterol Endosc, 2001, 43(suppl 2):S1613.
[32] Shimizu Y, Omori T, Yokoyama A, et al. Endoscopic diagnosis of early squamous neoplasia of the esophagus with iodine staining: high-grade intra-epithelial neoplasia turns pink within a few minutes [J]. J Gastroenterol Hepatol, 2008, 23(4):546-550.
[33] Muto M, Minashi K, Yano T, et al. Early detection of superficial squamous cell carcinoma in the head and neck region and esophagus by narrow band imaging: a multicenter randomized controlled trial [J]. J Clin Oncol, 2010, 28(9):1566-1572.
[34] Yokoyama A, Ichimasa K, Ishiguro T, et al. Is it proper to use nonmagnified narrow-band imaging for esophageal neoplasia screening? Japanese single-center, prospective study[J]. Dig Endosc, 2012, 24(6):412-418.
[35] Uedo N, Fujishiro M, Goda K, et al. Role of narrow band imaging for diagnosis of early-stage esophagogastric cancer: current consensus of experienced endoscopists in Asia-Pacific region[ J]. Dig Endosc, 2011, 23(Suppl 1):58-71.
[36] Kodama M, Kakegawa T. Treatment of superficial cancer of the esophagus: a summary of responses to a questionnaire on superficial cancer of the esophagus in Japan[J]. Surgry, 1998, 123(4):432-439.
[37] Brodmerkel GJ. Jr.Schiller's test: an aid in esophagoendoscopic diagnosis[J]. Gastroenterology, 1971(60):813-821.
[38] Sano M, Okuda S, Tamura H,et al. Esophagoendoscopy using Lugol's staining: diagnosis of esophageal cancer[A]//Takemoto T, Kawai K, Ida K. Chromoendoscopy for the gastrointestinal cancer [M]. Tokyo: Igaku Shoin, 1978.13-24.
[39] Mori M, Adachi Y, Matsushima T, et al. Lugol staining pattern and histology of esophageal lesions[ J]. Am J Gastroenterol, 1993, 88(5): 701-705.
[40] Ishihara R, Yamada T, Iishi H, et al. Quantitative analysis of the color change after iodine staining for diagnosing esophageal high-grade intraepithelial neoplasia and invasive cancer[J]. Gastrointest Endos, 2009, 69(2):213-218.
[41] Inoue H. Magnifying endoscopic diagnosis of tissue atypia and cancer invasion depth in the area of pharyngo-esophageal squamous epithelium by NBI enhanced magnification image: IPCL pattern classification[ A]//Cohen J. Advanced digestive endoscopy: comprehensive atlas of high resolution endoscopy and narrowband imaging[ M]. Malden: Blackwell, 2007.49-66.
[42] Xue H, Gong S, Shen Y, et al. The learning effect of a training programme on the diagnosis of oesophageal lesions by narrow band imaging magnification among endoscopists of varying experienc[eJ]. Dig Liver Dis, 2014, 46(7):609-615.
[43] Goda K, Tajiri H, Ikegami M, et al. Magnifying endoscopy with narrow band imaging for predicting the invasion depth of superficial esophageal squamous cell carcinoma[ J]. Dis Esophagus, 2009, 22 (5):453-460.
[44] Inoue H, Ishigaki T, Misawa M, et al. NBI magnifying endoscopic diagnosis for superficial esophageal cancer[J]. Stomach and Intestine, 2011(46):664-675.
[45] Arima M, Tada M, Arima H. Evaluation of microvascular patterns of esophageal cancers by magnifying endoscopy[ J]. Esophagus, 2005 (2):191-197.
[46] Oyama T, Ishihara R, Takeuchi M, et al. Usefulness of Japan esophageal society classification of magnified endoscopy for the diagnosis of superficial esophageal squamous cell carcinoma[J]. Gastrointest Endosc, 2012, 75(Suppl):AB456.
[47] Santi GE, Inoue H, Ikeda H, et al. Microvascular caliber changes in intramucosal and submucosally invasive esophageal cancer[J]. Endoscopy, 2013, 45(7):585-588.
[48] Minami H, Inoue H, Ikeda H, et al. Usefulness of Background Coloration in Detection of Esophago-Pharyngeal Lesions Using NBI Magnification[J]. Gastroenterol Res Pract, 2012(2012):529782.
[49] Ishihara R, Inoue T, Uedo N, et al. Significance of each narrowband imaging finding in diagnosing squamous mucosal high-grade neoplasia of the esophagus[ J]. J Gastroenterol Hepatol, 2010, 25 (8):1410-1415.
[50] Minami H, Isomoto H, Inoue H, et al. Significance of background coloration in endoscopic detection of early esophageal squamous cell carcinoma[J]. Digestion, 2014, 89(1):6-11.
[51] Kanzaki H, Ishihara R, Ishiguro S, et al. Histological features responsible for brownish epithelium in squamous neoplasia of the esophagus by narrow band imaging[J]. J Gastroenterol Hepatol, 2013, 28(2):274-278.
[52] Pech O, May A, Günter E, et al. The impact of endoscopic ultrasound and computed tomography on the TNM staging of early cancer in Barrett's esophagus[J]. Am J Gastroenterol, 2006, 101(10):2223-2239.
[53] Pech O, Günter E, Dusemund F, et al. Accuracy of endoscopic ultrasound in preoperative staging of esophageal cancer: results from a referral center for early esophageal cancer[J]. Endoscopy, 2010, 42(6):456-461.
[54] Pouw RE, Heldoorn N, Alvarez Herrero L, et al. Do we still need EUS in the workup of patients with early esophageal neoplasia? A retrospective analysis of 131 cases[J]. Gastrointest Endosc, 2011, 73(4):662-668.
[55] Chemaly M, Scalone O, Durivage G, et al. Miniprobe EUS in the pretherapeutic assessment of early esophageal neoplasia[ J]. Endoscopy, 2008, 40(1):2-6.
[56] Buskens CJ, Westerterp M, Laharde SM, et al. Prediction of appropriateness of local endoscopic treatment for high-grade dysplasia and early adenocarcinoma by EUS and histopathologic features[ J]. Gastrointest Endos, 2004, 60(5):703-710.
[57] Pech O, Günter E, Dusemund F, et al. Value of high-frequency miniprobes and conventional radial endoscopic ultrasound in the staging of early Barrett's carcinoma[J]. Endoscopy, 2010, 42(2): 98-103.
[58] Scotiniotis IA, Kochman MI, Lewis JD, et al. Accuracy of EUS in the evaluation of Barrett's oesophagus and high-grade dysplasia or intramucosal carcinoma[ J]. Gastrointest Endosc, 2001, 54(6): 689-696.
[59] May A, Günter E, Roth F, et al. Accuracy of staging in early oesophageal cancer using high resolution endoscopy and high resolution endosonography: a comparative, prospective, and blinded trial[J]. Gut, 2004, 53(5):634-640.
[60] Larghi A, Lightdale CJ, Memeo L, et al. EUS followed by EMR for staging of high-grade dysplasia and early cancer in Barrett's esophagus[ J]. Gastrointest Endos, 2005, 62(1):16-23.
[61] Esaki M, Matsumoto T, Moriyama T, et al. Probe EUS for the diagnosis of invasion depth in superficial esophageal cancer: a comparison between a jelly-filled method and a water-filled balloon method[J]. Gastrointest Endosc, 2006, 63(3):389-395.
[62] Chemaly M, Scalone O, Durivage G, et al. Miniprobe EUS in the pretherapeutic assessment of early esophageal neoplasia[ J]. Endoscopy, 2008, 40(1):2-6.
[63] Rampado S, Bocus P, Battaglia G, et al. Endoscopic ultrasound: accuracy in staging superficial carcinomas of the oesophagus[J]. Ann Thorac Surg, 2008, 85(1):251-256.
[64] Vazquez-Sequeiros E, Norton ID, Clain JE, et al. Impact of EUS-guided fine-needle aspiration on lymph node staging in patients with esophageal carcinoma[J]. Gastrointest Endosc, 2001, 53(7):751-757.
[65] Van Vliet EP, Heijenbrok-Kal MH, Hunink MG, et al. Staging investigations for oesophageal cancer: a meta-analysis[ J]. Br J Cancer, 2008, 98(3):547-557.
[66] Foley KG, Lewis WG, Fielding P, et al. N-staging of oesophageal and junctional carcinoma: is there still a role for EUS in patients staged N0 at PET/CT[ J]? Clin Radiol, 2014, 69(9):959-964.
[67] Sobin LH, Gospodarowicz MK, Wittekind CH. UICC TNM classification of malignant tumours[ M]. 7th ed. New York: Wiley, 2009.
[68] Twine CP, Roberts SA, Lewis WG, et al. Prognostic significance of endoluminal ultrasound-defined disease length and tumor volume (EDTV) for patients with the diagnosis of esophageal cancer[ J]. Surg Endosc, 2010, 24(4):870-878.
[69] Ajani JA, D'Amico TA, Almhanna K, et al. Esophageal and esophagogastric junction cancers, version 1.2015[J]. J Natl Compr Canc Netw, 2015, 13(2):194-227.
[70] ASGE Standards of Practice Committee, Evans JA, Early DS, et al. The role of endoscopy in the assessment and treatment of esophageal cancer[J]. Gastrointest Endosc, 2013, 77(3):328-334.
[71] van Vliet EP, Heijenbrok-Kal MH, Hunink MG, et al. Staging investigations for oesophageal cancer: a meta-analysis[ J]. Br J Cancer, 2008, 98(3):547-557.
[72] Prasad GA, Wu TT, Wigle DA, et al. Endoscopic and surgical treatment of mucosal( T1a) esophageal adenocarcinoma in Barrett's esophagus[ J]. Gastroenterology, 2009, 137(3):815-823.
[73] Sepesi B, Watson TJ, Zhou D, et al. Are endoscopic therapies appropriate for superficial submucosal esophageal adenocarcinoma? An analysis of esophagectomy specimens[J]. J Am Coll Surg, 2010, 210(4):418-427.
[74] Kodama M, Kakegawa T. Treatment of superficial cancer of the esophagus: a summary of responses to a questionnaire on superficial cancer of the esophagus in Japan[J]. Surgery, 1998, 123(4):432-439.
[75] Eguchi T, Nakanishi Y, Shimoda T, et al. Histopathological criteria for additional treatment after endoscopic mucosal resection for esophageal cancer: analysis of 464 surgically resected cases[J]. Mod Pathol, 2006, 19(3):475-480.
[76] 小山恒男.第46回食道色素研究会アケ一卜調查報告一転移のぁったm3.sm1食道癌の特征[J]. 胃と腸,2002(37):71-74.
[77] Shi Q, Ju H, Yao LQ, et al. Risk factors for postoperative stricture after endoscopic submucosal dissection for superficial esophageal carcinoma[J]. Endoscopy, 2014, 46(8):640-644.
[78] Othman MO, Wallace MB. Endoscopic mucosal resection( EMR)and endoscopic submucosal dissection( ESD) in 2011, a Western perspective[ J]. Clin Res Hepatol Gastroenterol, 2011, 35(4):288-294.
[79] Katada C, Muto M, Momma K, et al. Clinical outcome after endoscopic mucosal resection for esophageal squamous cell carcinoma invading the muscularis mucosae--a multicenter retrospective cohort study[J]. Endoscopy, 2007, 39(9):779-783.
[80] Ciocirlan M, Lapalus MG, Hervieu V, et al. Endoscopic mucosal resection for squamous premalignant and early malignant lesions of the esophagus[ J]. Endoscopy, 2007, 39(1):24-29.
[81] Pech O, May A, Gossner L, et al. Curative endoscopic therapy in patients with early esophageal squamous-cell carcinoma or highgrade intraepithelial neoplasia[J]. Endoscopy, 2007, 39(1): 30-35.
[82] Ono S, Fujishiro M, Niimi K, et al. Long-term outcomes of endoscopic submucosal dissection for superficial esophageal squamous cell neoplasms[J]. Gastrointest Endosc, 2009, 70(5): 860-866.
[83] Nonaka K, Arai S, Ishikawa K, et al. Short term results of endoscopic submucosal dissection in superficial esophageal squamous cell neoplasms[ J]. World J Gastrointest Endosc, 2010, 2(2):69-74.
[84] Tamiya Y, Nakahara K, Kominato K, et al. Pneumomediastinum is a frequent but minor complication during esophageal endoscopic submucosal dissection[J]. Endoscopy, 2010, 42(1):8-14.
[85] Sato H, Inoue H, Kobayashi Y, et al. Control of severe strictures after circumferential endoscopic submucosal dissection for esophageal carcinoma: oral steroid therapy with balloon dilation or balloon dilation alone[ J]. Gastrointest Endosc, 2013, 78(2):250-257.
[86] Orive-Calzada A, Bernal-Martinez A, Navajas-Laboa M, et al. Efficacy of intralesional corticosteroid injection in endoscopic treatment of esophageal strictures[ J]. Surg Laparosc Endosc Percutan Tech, 2012, 22(6):518-522.
[87] Mori H, Rafiq K, Kobara H, et al. Steroid permeation into the artificial ulcer by combined steroid gel application and balloon dilatation: prevention of esophageal stricture[J].J Gastroenterol Hepatol, 2013, 28(6):999-1003.
[88] 日本消化内镜学会.消化内镜指南[M].汪旭,译.第3版.沈阳:辽宁科学技术出版社,2014.