 去看看
去看看


在核苷和核苷酸类药物(nucleoside and nucleotide analogs,NAs)治疗慢性乙型肝炎过程中,耐药是一个极为重要的问题。与未发生耐药的患者比较,耐药不仅可导致疾病进一步进展,并可增加发生肝功能失代偿和肝细胞癌(HCC)的风险;还会加大后续治疗的难度,增加长期治疗的医疗成本。因此,耐药的预防和管理是提高疗效、缩短疗程、改善预后和减少医疗成本的重要措施。近年来,我国、亚太、欧洲和美国肝病学会先后对慢性乙型肝炎诊治指南或共识进行了更新,对NAs耐药的预防和管理提出了新的认识和建议。2008年我国有关专家曾发表《乙型肝炎病毒耐药专家共识》(以下简称《共识》),并在2009年更新,国内许多专家曾对此《共识》提出宝贵的意见和建议,并对目前我国慢性乙型肝炎抗病毒治疗中较为普遍存在的耐药问题感到担忧。因此,由《中国病毒病杂志》、《中华传染病杂志》、《肝脏》和《临床肝胆病杂志》发起,《传染病信息》、Infection International(Electronic Edition)、《实用肝脏病杂志》、《中国病原生物学杂志》、《中国肝脏病杂志(电子版)》、《中国实用内科杂志》、《中国预防医学杂志》、《中华肝脏病杂志》、《中华临床感染病杂志》和《中华实验和临床感染病杂志(电子版)》参加,组织专家撰写《核苷和核苷酸类药物治疗慢性乙型肝炎的耐药及其管理》一文。
1 核苷和核苷酸类药物耐药现状及危害
目前我国用于治疗慢性乙型肝炎的NAs主要有4种:拉米夫定(LAM)、阿德福韦酯(ADV)、替比夫定(LdT)和恩替卡韦(ETV)。在欧美及亚洲的一些国家和地区,还有替诺福韦酯(TDF)等。由于不同 NAs的抗病毒效力和耐药基因屏障(genetic barrier)不同,这些药物长期治疗的耐药率差异显著。根据现有临床试验数据,对于初治慢性乙型肝炎患者,LAM治疗1年的耐药率为24%,治疗5年的耐药率高达70%。LdT治疗2年,HBeAg阳性和阴性慢性乙型肝炎患者的耐药率分别为25%和11%。ADV治疗5年,HBeAg阳性和阴性慢性乙型肝炎患者的累积耐药率分别为42%和29%。我国报道,ADV治疗HBeAg阳性慢性乙型肝炎患者5年累积耐药率为14.6%。日本和中国香港报道,ETV治疗3年时的耐药率为1.7%和1.2%。TDF的2次Ⅲ期临床试验结果表明,426例慢性乙型肝炎患者(其中176例HBeAg阳性,250例HBeAg阴性)用TDF单药治疗至144周时,34例(8%)HBV DNA水平≥400/ml (69IU/m l),其中10例于32~120周间停用TDF,20例于72~96周间加用恩曲他滨,4例HBV DNA水平≥400/m l(69IU/ ml),但均未检测到相关的耐药位点突变。
目前,我国慢性乙型肝炎抗病毒治疗的耐药问题较为严重。如在NAs治疗中,存在多种不规范的治疗情况,包括单药随意序贯、短期内频繁换药或加药,以及耐药后不合理加药或换药等。在欧洲、美国、日本和韩国等国家和地区,NAs初治患者中,高效、低耐药NAs使用比例达80%~90%,而在我国大陆,81%的患者仍用低效、高耐药NAs初始治疗,其中30%使用LAM,35%使用国产ADV。对我国大陆110个城市741家医院的684份有效问卷分析显示,LAM经治慢性乙型肝炎患者占39.6%。这除与我国患者的经济条件有关外,还与医务人员对耐药重要性的认识不足有关。
NAs治疗长期抑制病毒复制,能减轻肝细胞炎症坏死及肝纤维化,从而延缓和减少肝脏失代偿、肝硬化、肝癌及并发症的发生。Sung等荟萃分析显示,与不治疗相比,用LAM治疗能使HCC发生风险降低78%(相对风险为0.22)。与未发生耐药患者比较,耐药不仅使已取得的治疗效果(如组织学改善)丧失,还可导致肝脏病变急剧恶化,使疾病加速进展为肝衰竭,增加肝移植率、HCC发生率和病死率。同时,交叉耐药、多药耐药等使后续治疗方案变得更为复杂和困难,并可能增加发生终末期肝病的风险。
2 核苷和核苷酸类药物耐药及应答的相关定义
2.1 原发耐药突变(primary drug resistancemutation)
药物作用靶点的基因及其编码的氨基酸发生突变,导致突变的病毒株对治疗药物的敏感性下降。原发耐药突变株对药物的敏感性降低,但其复制能力低于野毒株。
2.2 继发耐药突变 (secondary drug resistance mutation)
或代偿性耐药突变(compensatory drug resistance mutation)在原发耐药突变的基础上,突变病毒株在其他位点发生突变,使突变的病毒复制能力部分恢复并对药物的敏感性进一步降低。
2.3 基因型耐药(genotypic resistance)
在抗病毒治疗过程中,检测到与乙型肝炎病毒(HBV)耐药相关的位点突变。
2.4 表型耐药(phenotypic resistance)
在体外细胞复制系统中证实HBV基因组中1个或1个以上位点突变,使病毒对药物的敏感性降低(以EC50表示)。
2.5 交叉耐药(cross resistance)
针对1种抗病毒药物出现的耐药突变,导致病毒对另1种或几种抗病毒药物的敏感性也下降,甚至出现耐药。
2.6 多药耐药(multidrug resistance)
至少对2种无交叉耐药谱且是不同类别的NAs耐药。
2.7 原发无应答(primary non-response)
在依从性良好的情况下,用 NAs治疗 3个月(12周)时,HBV DNA下降<1log10 IU/ml。
2.8 部分病毒学应答(partial virological response)
在依从性良好的情况下,治疗至6个月(24周)时,仍能检测到HBV DNA,但下降 >1log10 IU/ml。判定部分病毒学应答的时间因NAs类别而异,对于低耐药基因屏障NAs,如LAM和LdT,判定时间为6个月(24周),而对于高耐药基因屏障NAs,如ETV和TDF,判定时间为12个月(48周)。
2.9 完全病毒学应答(complete virological response)
在抗病毒治疗时,用灵敏的实时PCR检测,HBV DNA检测不到或低于检测下限。
2.10 生化学应答(biochemical response)
在抗病毒治疗时,基线丙氨酸氨基转移酶(ALT)≥2倍正常值上限(ULN)患者,ALT降至正常。
2.11 病毒学突破(virological breakthrough)
在未更改治疗的情况下,获得部分或完全病毒学应答的患者,其HBV DNA水平较治疗中最低点上升1log10 IU/ml,并在间隔1个月以上的第2次检测证实。
2.12 生化学突破(biochemical breakthrough)
在未更改治疗的情况下,基线ALT≥2×ULN,且在治疗中ALT已降至正常的患者,ALT升至高于ULN。
2.13 病毒学反弹(virological rebound)
在未更改治疗的情况下,获得部分或完全病毒学应答的患者,其HBV DNA载量超过治疗前水平。
2.14 肝炎复燃(hepatitis flare)
在未更改治疗的情况下,获得生化学应答患者的血清ALT突然上升>5×ULN或>3倍基线ALT水平,并排除其他原因引起ALT升高的可能。
3 核苷和核苷酸类药物耐药机制及影响因素
3.1 耐药机制
病毒耐药是反映病毒为逃逸药物压力而发生的一系列适应性突变,最终导致病毒对药物的敏感性下降。在慢性乙型肝炎患者体内,HBV的复制效率很高,每天可产生1012~1013个病毒颗粒,较丙型肝炎病毒(HCV)和人类免疫缺陷病毒(HIV)分别高10倍和100倍,HBV聚合酶是一种反转录酶,缺乏校正能力,且错配率较高。据推算,HBV每年发生氨基酸置换位点为(1.4~3.2)×10-5。HBV复制的这一特点也决定其在同一患者体内的病毒构成并不均一,而是由基因序列存在差异的多种病毒株组成,这些序列不同的病毒群称为准种(quasispecies)。目前抗病毒治疗的NAs作用靶点均为病毒聚合酶基因,已知与耐药相关的突变均位于HBV聚合酶基因的反转录酶区(RT区),可分为原发耐药突变和继发或代偿性耐药突变。
根据药物分子结构,目前应用的NAs可分为L型核苷类(LAM和LdT)、D型环戊烷(烯)类(ETV)和无环磷酸盐类(ADV和TDF)。该3类5种NAs的原发耐药突变位点如图1所示。
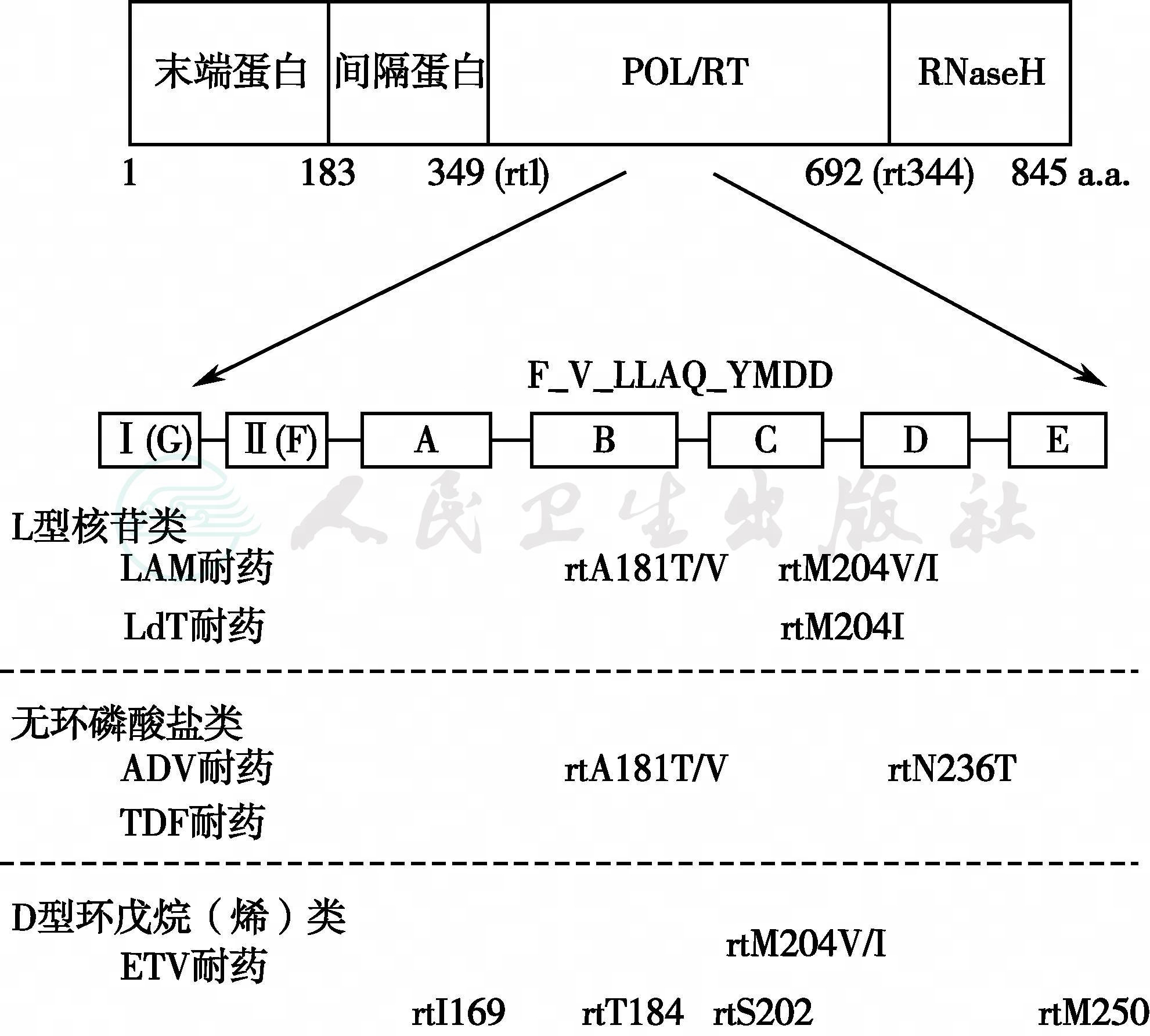
图1 核苷和核苷酸类药物常见原发性耐药突变位点
3.2 影响耐药的因素
在临床应用中,一种药物能否选择出耐药突变,受病毒、宿主和药物等多种因素影响。
3.2.1 病毒因素:
包括病毒的复制速度、病毒复制的保真性、基线的HBV DNA载量、准种、预存耐药突变、耐药突变株的适应性和复制空间等。如前所述,HBV的高复制率和较低的复制保真性等特点,决定其易发生耐药突变。此外,耐药的发生还与患者基线的病毒载量、准种的复杂度有关。LdT的GLOBE研究结果提示,基线HBV DNA较低的患者(HBV DNA<9log10/ml的 HBeAg阳性患者和 HBV DNA<7log10/ml的HBeAg阴性患者)2年的耐药发生率较低。抗病毒治疗中HBV准种的复杂度与耐药病毒株的选择有一定的相关性,特别是在抗病毒治疗中维持较高HBV准种复杂度的患者易发生耐药。有研究表明,一些慢性乙型肝炎患者在治疗前体内已有HBV耐药突变毒株,称为预存耐药。对一些NAs经治的慢性乙型肝炎患者,在选择后续的治疗方案前,应考虑其体内可能存在对经治药物的耐药突变株。
3.2.2 宿主因素:
包括既往抗病毒治疗史、依从性、机体免疫和代谢状况、药物遗传学和宿主的体重等。其中患者的依从性对耐药的发生尤为重要。据调查,40%的耐药患者与其依从性差有关。Chotiyaputta等对美国2007、2008和2009年1月接受LAM、ADV、ETV或TDF治疗的3个慢性乙型肝炎患者队列进行了依从性调查,随访1年结果表明,治疗时间短和治疗时间长的患者的依从性在95%日以上者仅为39.7%和46.1%。我国慢性乙型肝炎患者对抗病毒治疗的依从性更低。据调查,患者自行停药换药者为47% ~49%,其中治疗1年内自行停药换药者占19%~24%。因此,在临床实践中,应特别重视对上述依从性差并具有耐药高风险患者的治疗和管理策略。
3.2.3 药物因素:
包括药物的耐药基因屏障、抗病毒效力、剂量和化学结构等。药物的耐药基因屏障是指为显著降低抗病毒药物敏感性所需的位点突变数目,即出现原发耐药所需的位点突变数目。例如,在每个复制周期中,出现1个特定碱基错配的概率为10-5,同时出现2个和3个碱基错配的概率则分别为10-10和10-15。耐药基因屏障越高,所需同时出现的突变位点越多,发生耐药的风险也就越低。LAM、LdT和ADV为低耐药基因屏障药物,仅需出现1个原发耐药位点突变位点即可导致药物敏感性下降。ETV是目前耐药基因屏障最高的药物之一,需同时出现3个氨基酸位点突变才可导致药物敏感性下降。TDF与ADV存在一定程度的交叉耐药;在HIV和HBV共感染患者中,已发现 TDF基因型耐药突变(rtL180M、rtA194T和rtM204V),但在慢性乙型肝炎患者中尚未发现耐药病例,提示其具有较高耐药基因屏障。
交叉耐药可降低药物的耐药基因屏障。如LAM耐药患者仅需再出现1个位点突变即可对ETV耐药,已发生LAM耐药患者用ETV单药治疗5年,耐药发生率高达51%。
药物抑制病毒复制的能力是防止耐药发生的关键因素之一。抗病毒效力低的药物,其选择压力低,耐药发生率相对较低,如ADV。但抗病毒效力较强的药物,选择压力增强,如其耐药基因屏障低,可较快选择出耐药突变毒株,如LAM和LdT。当药物抗病毒效力很强,耐药基因屏障高,能完全抑制病毒复制,则选择压力较低,因为无病毒复制就不会有基因突变。此外,抗病毒效率还与药物剂量有关,如TDF与ADV的抗病毒活性相似,但由于TDF的临床应用剂量更大,其抗病毒效力更强。因此,为防止耐药突变株的发生,应最大限度地迅速抑制病毒复制,并在后续治疗中保持对病毒的持续抑制。
4 耐药突变与S基因突变
由于在HBV基因组中,病毒聚合酶编码基因与包膜蛋白编码基因(S)的开放读码框(ORF)存在重叠,S基因完全被聚合酶基因覆盖,NAs治疗诱导的聚合酶编码基因的耐药突变,可能使编码HBV表面抗原(HBsAg)的S基因发生突变,从而导致HB-sAg抗原性、结构或病毒适应性发生变化,产生免疫逃逸突变株等。
HBV聚合酶基因的耐药突变,如rtA181T和rtM204I,极少数可引起S基因的无义突变(分别对应sW172*和sW196*),在S基因上提前产生1个终止密码子,生成截短的S蛋白。体外细胞和动物研究显示,rtA181T/sW172*突变毒株病毒颗粒分泌异常,使截短的S蛋白在细胞内聚集,并使野生型毒株的分泌显著下降,导致细胞外低病毒载量,此时若仅根据血清病毒载量来判断病毒学突破,往往不能发现耐药相关突变。动物试验显示,截短的S蛋白具有潜在致癌性。
临床研究表明,抗病毒治疗慢性乙型肝炎患者可明显降低肝硬化和HCC的发生。慢性乙型肝炎患者只要有适应证,就应进行抗病毒治疗。但长期抗病毒治疗引起的突变,特别是引起前-S与S区突变的潜在致癌性值得进一步研究。至今尚无明确的临床研究证实抗病毒治疗耐药相关突变与致癌性有关。特别是近年关于rtA181T/sW172*突变毒株具有潜在致癌性的报道,多为体外细胞和动物试验结果;仅在有限的病例中进行的回顾性分析结果发现,该位点突变与较高的HCC发生有关,尚需进一步开展前瞻性临床研究证实。
5 耐药模式(通路)
目前主要的耐药模式(通路)有以下5种:
5.1 L型核苷耐药模式(通路) rt204位点突变。rtM204V/I可引起L型核苷类药物(如LAM和LdT)耐药,进一步促进D型环戊烷(烯)类药物(ETV)耐药。
5.2 无环磷酸盐耐药模式(通路) rt236位点突变。rtN236T可导致无环磷酸盐化合物ADV耐药,并降低TDF的敏感性。
5.3 共享(公共)耐药模式(通路) rt181位点突变。可导致L型核苷类药物和ADV耐药,并降低TDF的敏感性;这一模式可见于40%ADV治疗失败和5%LAM治疗失败患者。
5.4 双重耐药模式(通路) rtA181T/V+rtN236T位点突变。可显著降低TDF的抗病毒活性,导致持续的病毒血症。
5.5 ETV初治耐药模式 rtL180M+rtM204V/I+rtI169、rtT184、rtS202或rtM250任意1个或多个位点突变;3个突变同时发生可导致ETV耐药。
不同NAs可能有相同的耐药模式(通路),相互之间存在交叉耐药,见表1。
表1 最常见的HBV耐药突变株交叉耐药情况
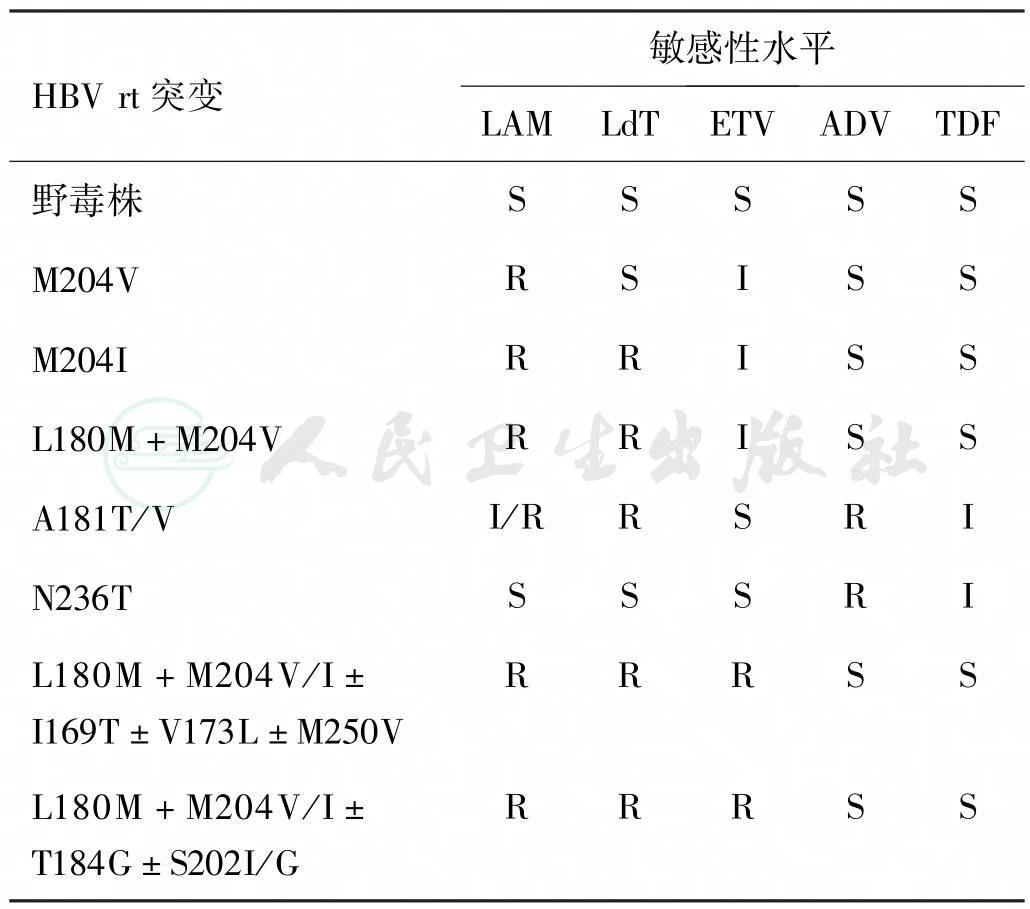
注:S:敏感;I:中度;R:耐药
6 多药耐药
在因耐药挽救治疗或因其他原因应用多种NAs治疗的患者体内,可能发生针对多种NAs的耐药突变。在使用有交叉耐药药物序贯治疗时更易发生耐药。研究还发现,即便采用“加药”策略,如果不能迅速抑制病毒,也可能选择出多药耐药突变。不同的耐药突变共存于同一病毒株,使该毒株对多种NAs耐药。Villet等在1例先后接受LAM及LAM联合ADV治疗的患者体内,检测到同时携带LAM耐药突变和ADV耐药突变的联合突变病毒株(rtV173L+L180M+A181V+N236T)。该病毒株对LAM单药、ADV单药和LAM联合ADV治疗的敏感性均显著下降,提示多药耐药的病毒株对联合用药的治疗效果也不佳。我国也报道有多药耐药的病例。
7 耐药的临床表现
病毒学突破是耐药最早的临床表现。发生病毒学突破后,90%以上的患者可出现生化学突破。如不及时挽救治疗,可发生病毒学反弹和肝炎发作,也可能出现肝脏功能失代偿、急性肝衰竭,甚至死亡。依从性差和(或)病毒耐药是NAs治疗时出现病毒学突破的主要因素。在病毒学突破前已可检测到基因型耐药和表型耐药。不是所有病毒学突破均由抗病毒耐药突变引起,必须进行确证。
8 耐药的评估
8.1 HBV DNA监测和随访
HBV DNA监测对评估治疗成败至关重要。无论是在基线评估,还是治疗应答评估,或者是病毒学突破判断,均应使用灵敏、特异和线性范围广的实时定量PCR方法检测HBV DNA水平,结果用国际单位(IU/ml)表示,国外试剂的1IU/ml约等于5~6/m l,但因试剂盒而异。国内试剂间的差异较大。为确保检测结果的稳定性和一致性,对于在同一个地方就诊的同一例患者,应坚持采取同一种检测方法进行评估。
开始NAs治疗前,应对患者进行基线HBV DNA定量检测,判断治疗适应证和预测疗效。在治疗期间,应至少每3个月检测1次HBV DNA。获得完全病毒学应答后,可隔3~6个月检测1次。
8.2 耐药位点检测
耐药突变一旦被选择出来,突变病毒准种会在患者体内长期存在。如在LAM耐药患者中,停用LAM 4年后,患者体内仍能检测到耐药突变株。由于NAs在临床中应用较为普遍,用1种以上NAs治疗过的患者越来越多。因而,对于因复发、耐药或其他原因再治疗的NAs经治患者,有条件者应进行耐药位点检测,以确定突变模式(通路),进行针对性治疗,临床上对既往有某种药物耐药史而停药或改为其他治疗的病例,用目前方法即使不能测出耐药,也应该按照耐药处理。对于原发无应答、部分病毒学应答或病毒学突破的患者,进行耐药位点检测则有助于指导治疗方案的调整。
目前我国尚缺乏规范、标准、统一的基因型耐药检测方法,不同的引物、不同的测序公司、不同的试剂盒,结果可能不同。因此,基因型耐药检测必须标准化、规范化,并用统一方法检测,根据患者的用药情况进行针对性的基因型耐药检测。只有用实时定量PCR法能检测到HBV DNA的患者,才有可能进行基因型耐药检测。
常用的基因型耐药检测方法有:
(1)PCR产物直接测序法:是最常用的基因型耐药检测方法之一,能测出所有突变位点,包括可能的代偿突变和新突变位点,对于新的治疗手段,或现行治疗的新耐药相关位点突变,需用体外表型分析法验证。PCR产物直接测序法灵敏度低,最低检测限为20%,即突变株数量需达到整个病毒群的20%时,才能检测到。
(2)PCR产物克隆测序法:是将PCR产物连接载体后转化至细菌,选10~30个阳性克隆进行测序,有助于发现混合株,并可大致确定不同序列毒株之间的相对比例,其灵敏度高于PCR产物直接测序法,但操作相对较复杂,费用较高,也比较费时。
(3)限制性片段长度多态性技术(RFLP):灵敏,最低检测限为5%,但必须针对每一个待测突变位点,分别设计特异性内切酶反应系列,仅适用于已知的耐药位点。一些突变可生成新的酶切位点,或破坏原酶切位点,此时必须谨慎看待检测结果。
(4)线性探针反向杂交法(INNO-LiPA):灵敏,最低检测限为5%,可检测单个核苷酸错配,仅适用于已知的耐药位点。
此外,还有基因芯片技术、限制性片段质谱多态性分析、焦磷酸测序法和深度测序法等。
9 耐药管理
9.1 原发无应答和部分病毒学应答的处理
9.1.1 原发无应答:
无论用哪种NAs治疗慢性乙型肝炎,发生原发无应答时均应检查患者的依从性。如确认依从性良好,可进行HBV RT区测序,以鉴定可能存在的耐药突变,针对性地早期更换成更有效的药物。如NAs初治患者,用ADV治疗时出现原发无应答,优先推荐改用ETV或TDF,或加用LAM 或LdT。用ETV、LAM、LdT治疗原发无应答者,可选择加用ADV,也可换用或加用TDF。需要说明的是,有关原发无应答的定义仍值得探讨,欧洲和美国指南中的描述稍有不同,而且未考虑到不同药物抗病毒效能的差异,需要更多的循证医学证据来证实是否应该进行个体化的调整策略。
9.1.2 部分病毒学应答:
所有NAs治疗时均可出现部分病毒学应答。同样,在出现部分病毒学应答时,首先需检查患者的依从性,随后根据药物的抗病毒疗效和耐药基因屏障,调整治疗方案。
对LAM、LdT治疗24周部分应答者,可加用ADV,或换用TDF。对ADV治疗48周时出现部分病毒学应答,必须考虑换用更强效的药物(优先选择无交叉耐药者)或加用另外1个无交叉耐药的NAs。值得注意的是,联合治疗后,如果不能迅速使HBV DNA降到不可测水平以下,发生耐药的风险仍然较大。
LAM和LdT治疗过程中早期病毒学指标可预测远期疗效,特别是24周HBV DNA的水平,可预测治疗2~4年的疗效。因此Keeffe等提出关于NAs治疗的“路线图概念”,根据治疗24 周HBV DNA水平优化治疗方案,以提高远期疗效,降低耐药的发生。由于“路线图概念”是基于以往几项研究的回顾性分析结果提出的,我国专家根据中国国情,设计前瞻性随机对照试验(EFFORT研究,NIH注册号:NCT00962533),在国际上首次验证了“路线图概念”。该研究初步结果显示:经过76周抗病毒治疗后,优化治疗组的疗效显著优于标准治疗组(病毒学应答率为 74.0%比 61.1%,P=0.001;耐药率为 1.4%比11.4%,P<0.001)。
对于强效、低耐药的药物(如ETV和TDF),治疗48周时出现部分病毒学应答的处理方法,目前仍有争议。可根据患者的基线HBV DNA水平、治疗48周的HBV DNA水平和治疗期间的HBV DNA动态变化综合考虑。如对于基线高病毒载量(如>2×107 IU/m l)、HBV DNA持续下降者可继续使用原药,随治疗时间延长,仍能获得病毒学应答,且耐药率很低。而对于依从性良好,但病毒不再持续下降,达到平台期的患者,应迅速调整治疗方案,优先考虑加用另外一种药物(ETV治疗时加用ADV 或TDF),有利于预防长期治疗中耐药的发生。TDF在我国尚未批准用于治疗乙型肝炎,对于ETV治疗出现部分病毒学应答的NAs初治患者,可加用ADV。
9.2 耐药的处理
由于病毒基因型耐药突变的发生早于生化学突破几个月,因此,早期发现耐药并及时处理可避免肝炎发作,这在使用免疫抑制剂治疗和肝硬化的患者中尤为重要。在依从性良好的患者中,一旦发现HBV DNA升高,应立即检查患者的依从性,并在1个月后复查HBV DNA,有条件者可进行基因型耐药检测。当检出基因型耐药或证实出现病毒学突破时,应立刻予以挽救治疗,选择加用无交叉耐药的抗病毒药,将多药耐药的风险降到最低。此外,NAs耐药患者亦可考虑加用聚乙二醇化干扰素(Peg IFN)治疗(但疗效不如初治患者)。因安全性原因,LdT不能与Peg IFN联合应用.。抗病毒耐药的挽救治疗见表2。
表2 抗病毒耐药挽救治疗
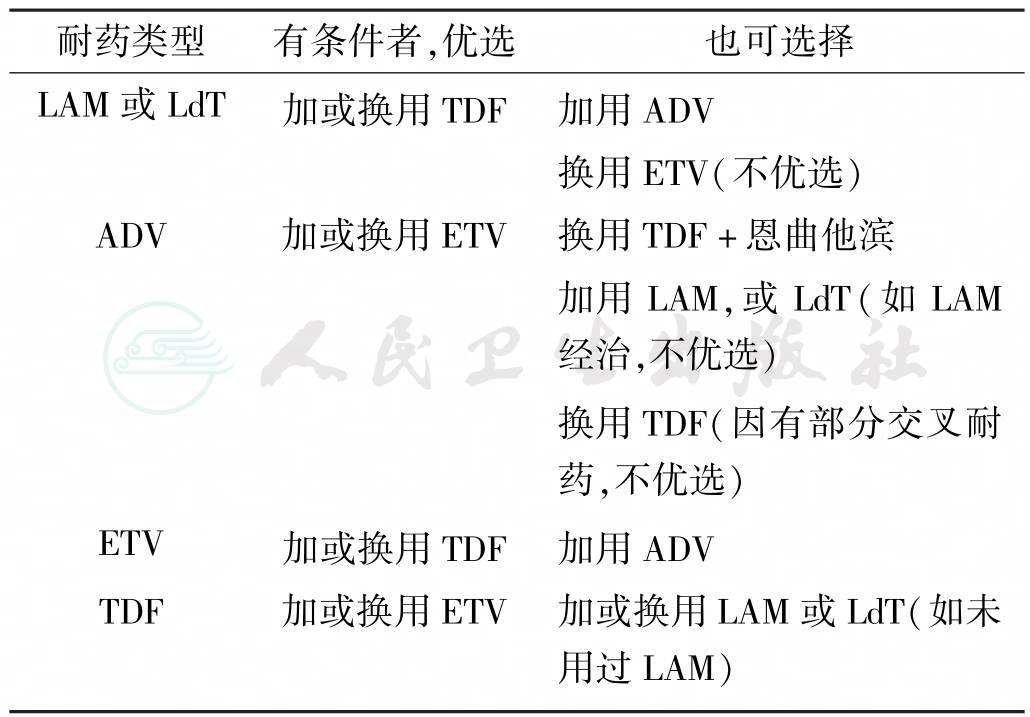
值得指出的是:虽然挽救治疗可较好抑制耐药株的复制,但也有增加多药耐药的风险。因此,在初始治疗药物选择时,应尽量选择高效、低耐药的NAs。
对于用LAM或LdT和ADV治疗失败的患者,怀疑多药耐药时,进行基因型耐药检测。对多药耐药患者,应联合使用NAs治疗,优先选择ETV联合TDF。多药耐药管理的关键在于预防,需反复强调初治药物选择和最大限度地抑制病毒复制的重要性,避免低耐药基因屏障药物的单药序贯治疗,尽量减少或避免多药耐药的发生。
10 耐药的预防
耐药的管理重在预防,必须强调和重视耐药相关知识的推广和教育,强化耐药的规范化管理,强调耐药检测和监测方法的规范化和标准化。
10.1 仔细了解患者既往治疗史
自1998年LAM在我国上市后,至今已有200余万慢性乙型肝炎患者接受过NAs治疗,因此,在应用NAs治疗前,应仔细了解患者既往NAs治疗史(包括NAs种类、疗程、疗效和耐药等),这对选择何种NAs药物治疗十分重要。
10.2 初始选用强效、高耐药基因屏障药物的单药长期治疗
对既往未接受过NAs治疗的患者,应选择强效、高耐药基因屏障的抗病毒药物。亚太、欧洲和美国肝病学会的慢性乙型肝炎诊疗共识或指南均推荐,NAs初治患者应选择强效、高耐药基因屏障的抗病毒药物,即ETV和TDF作为优选或一线单药治疗。我国指南也建议:“如条件允许,初始治疗时宜选用抗病毒作用强和耐药发生率低的药物”。初始选择高耐药基因屏障药物,不仅能降低耐药的发生,减少耐药相关的并发症,同时毋需在治疗前进行基因型耐药检测,减少治疗监测的次数,并降低挽救治疗的需求和节省相关成本。
目前对于中、低效NAs初始联合治疗是否优于单个高效低耐药物治疗,尚无充分的循证医学证据证实,且与单药治疗比较,初始联合治疗是否能增加疗效或改善临床预后,亦缺乏高级别的临床试验证据。尤其是考虑到近年来高效、低耐药NAs相继上市,应用ETV和TDF单药治疗即可达到持续抑制病毒复制及耐药发生率低的目的。目前初始联合治疗在欧洲和美国肝病学会制订的慢性乙型肝炎诊治指南中,不推荐作为一线治疗方案。
10.3 加强患者对疾病的认识和依从性教育
尽管病毒学突破是耐药的重要表现,但并非所有病毒学突破均由耐药导致。Hongthanakorn等队列研究表明,高达40%病毒学突破可能与耐药无关,而是由于患者的依从性差所致。对疾病的认知不足是导致依从性不佳的重要原因,对我国慢性乙型肝炎患者的一项认知程度调查显示,有22%~27%的患者对慢性乙型肝炎的危害性和长期治疗的必要性缺乏认识,仅有46.3%的患者认识到抗病毒治疗的重要性。另一项调查显示,我国LAM经治患者中,近半数患者曾有自行停药史。
由于NAs治疗通常需要长期治疗,坚持服药和遵照治疗方案对维持病毒的持久抑制非常重要。因此,需要加强对患者教育,治疗前应就疾病特点、治疗目的、治疗意义和治疗方案向患者进行充分的解释和说明,治疗中加强与患者的沟通和随访,帮助去除影响患者依从性的不良因素,注意纠正患者的不良用药习惯或自行调整治疗方案等。
10.4 避免低耐药基因屏障药物的单药序贯治疗
低耐药基因屏障药物的单药序贯治疗,可增加发生多药耐药和交叉耐药的风险,如LAM序贯LdT、LAM序贯ADV、LAM序贯ETV。过去临床上曾采用换用ADV序贯治疗的方法作为LAM耐药的挽救治疗。部分LAM耐药患者在换用ADV治疗后,随即也对ADV发生耐药。
10.5 严格掌握治疗适应证
为降低耐药风险,应严格掌握治疗适应证,避免不必要的治疗。如对于肝脏炎症病变轻微、难以取得持续应答的患者(如ALT正常、高病毒载量、HBeAg阳性的免疫耐受期患者),应当避免使用NAs治疗。
10.6 加强对医务人员抗病毒治疗耐药预防和管理的教育
我国慢性乙型肝炎患者的NAs治疗中,存在很多不规范治疗的情况,包括单药随意序贯治疗(多种药物序贯组合,占70.7%)、短期内频繁换药或加药,以及耐药后不合理加药或换药等。这些现象与我国医务人员对耐药重要性的认识不足有一定关系。因此,必须强调耐药规范化管理。对临床医师尤其是感染科及消化内科医师,应加强关于抗病毒耐药机制、预防、管理和救治的继续教育,进一步提高我国医务人员对抗病毒耐药的认识。同时,对患者也应加强教育,提升其对抗病毒治疗的依从性。
10.7 加强学术界、政府部门及医药企业之间的良性互动
在治疗慢性乙型肝炎过程中,NAs的正确应用不仅仅是一个科学问题,也受到社会经济水平的影响。虽然我国经济总量增长迅速,但人均收入水平仍属发展中国家,社会保障体系也有待进一步完善。为此,学术团体或其他非政府组织应当通过客观、公正的临床医学和卫生经济学研究,为政府部门制订新药审批、定价及医保支付政策提供可靠的药物经济学证据。应该建立政府主管部门、医疗保险管理机构、制药企业及医疗服务提供者之间的公平协商和价格谈判机制,从而为广大乙型肝炎患者提供效果可靠、价格合理、公平可及的优质医疗服务。
总之,在选择NAs治疗时,临床医生应认真考虑患者的具体病情、既往用药史、经济状况,以及不同地区的医疗保险制度和经济发展水平,充分与患者沟通,并根据自己的专业知识、临床经验和可利用的医疗资源,合理选择抗病毒治疗药物,规范治疗,并在治疗过程中及时监测,一旦发现原发无应答、部分应答或耐药突变,应迅速调整治疗。
[1]中华医学会肝病学分会,中华医学会感染病学分会.慢性乙型肝炎防治指南(2010年版)[J].中国病毒病杂志,2011,1 (1):9-23.
[2]European Association for the Study of the Liver.EASL clinical practice guidelines:managementof chronic hepatitis B virus infection[J].JHepatol,2012,57(1):167-185.
[3]Liaw YF,Kao JH,Piratvisuth T,et al.Asian-Pacific consensus statement on themanagementof chronic hepatitis B:a 2012 update[J].Hepatol Int,2012,6(3):531-561.
[4]Lok AS,McMahon BJ.Chronic hepatitis B:update 2009[J]. Hepatology,2009,50(3):661-662.
[5]乙型肝炎病毒耐药专家委员会.乙型肝炎病毒耐药专家共识.中华实验和临床感染病杂志(电子版)[J],2008,2(1):90-98.
[6]乙型肝炎病毒耐药专家委员会.乙型肝炎病毒耐药专家共识:2009年更新.中华实验和临床感染病杂志(电子版)[J],2009,3(1):72-79.
[7]Yao GB,Zhu M,Cui ZY.A 7-year study of lamivudine therapy for hepatitis B virus e antigen-positive chronic hepatitis B patients in China[J].JDig Dis,2009,10(2):131-137.
[8]Lai CL,Dienstag J,Schiff E,et al.Prevalence and clinical correlates of YMDD variants during lamivudine therapy for patients with chronic hepatitis B[J].Clin Infect Dis,2003,36(6):687-696.
[9]Papatheodoridis GV,Dimou E,Laras A,et al.Course of virologic breakthroughs under long-term lamivudine in HBeAg-negative precoremutant HBV liver disease[J].Hepatology,2002,36(1):219-226.
[10]Liaw YF,Gane E,Leung N,etal.2-Year GLOBE trial results:telbivudine is superior to lamivudine in patients with chronic hepatitis B[J].Gastroenterology,2009,136(2):486-495.
[11]LaiCL,Gane E,Liaw YF,etal.Telbivudine versus lamivudine in patientswith chronic hepatitis B[J].N Engl JMed,2007,357(25):2576-2588.
[12]Hadziyannis SJ,Tassopoulos NC,Heathcote EJ,et al.Longterm therapy with adefovir dipivoxil for HBeAg-negative chronic hepatitis B for up to 5 years[J].Gastroenterology,2006,131(6):1743-1751.
[13]Marcellin P,Chang TT,Lim SG,et al.Long-term efficacy and safety of adefovir dipivoxil for the treatment of hepatitis B e antigen-positive chronic hepatitis B[J].Hepatology,2008,48 (3):750-758.
[14]Zeng MD,Mao YM,Yao GB,etal.Five years of treatmentwith adefovir dipivoxil in Chinese patients with HBeAg-positive chronic hepatitis B[J].Liver Int,2012,32(1):137-146.
[15]Yokosuka O,Takaguchi K,Fujioka S,et al.Long-term use of entecavir in nucleoside-naïve Japanese patients with chronic hepatitis B infection[J].J Hepatology,2010,52(6):791-799.
[16]Yuen MF,Seto WK,Fung J,et al.Three years of continuous entecavir therapy in treatment-naïve chronic hepatitis B patients:viral suppression,viral resistance and clinical safety [J].Am JGastroenterol,2011,106(7):1264-1271.
[17]Snow-Lampart A,Chappell B,Curtis M,et al.No resistance to tenofovirdisoproxil fumarate detected after up to 144 weeks of therapy in patientsmonoinfected with chronic hepatitis B virus [J].Hepatology,2011,53(3):763-773.
[18]孙秘书,王贵强,张伟.拉米夫定经治慢性乙型肝炎患者治疗现状调查分析[J].中国预防医学杂志,2012,13(1):18-22.
[19]Suzuki F,Akuta N,Suzuki Y,et al.Selection of a virus strain resistant to entecavir in a nucleoside-naive patientwith hepatitis B of genotype H[J].JClin Virol,2007,39(2):149-152.
[20]Liaw YF,Sung JJ,Chow WC,et al.Lamivudine for patients with chronic hepatitis B and advanced liver disease[J].N Engl JMed,2004,351(15):1521-1531.
[21]Sung JJ,Tsoi KK,Wong VW,etal.Meta-analysis:treatment of hepatitis B infection reduces risk of hepatocellular carcinoma [J].Aliment Pharmacol Ther,2008,28(9):1067-1077.
[22]Di Marco V,Marzano A,Lampertico P,et al.Clinical outcome of HBeAg-negative chronic hepatitis B in relation to virological response to lamivudine[J].Hepatology,2004,40(4):883-919.
[23]Hadziyannis SJ,Papatheodoridis GV,Dimou E,et al.Efficacy of long-term lamivudinemonotherapy in patientswith hepatitis B e antigen-negative chronic hepatitis B[J].Hepatology,2000,32(4 Pt1):847-851.
[24]Rizzetto M,Tassopoulos NC,Goldin RD,et al.Extended lamivudine treatment in patients with HBeAg-negative chronic hepatitis B[J].JHepatol,2005,42(2):173-179.
[25]Gish R,Jia JD,LocarniniS,etal.Selection of chronic hepatitis B therapy with high barrier to resistance[J].Lancet Infect Dis,2012,12(4):341-353.
[26]Locarnini S.Primary resistance,multidrug resistance and cross-resistance pathways in HBV as a consequence of treatment failure[J].Hepatol Int,2008,2(2):147-151.
[27]Hongthanakorn C,Chotiyaputta W,Oberhelman K,et al.Virological breakthrough and resistance in patients with chronic hepatitis B receiving nucleos(t)ide analogues in clinical practice[J].Hepatology,2011,53(6):1854-1863.
[28]Pawlotsky JM,Dusheiko G,Hatzakis A,et al.Virologic monitoring of hepatitis B virus therapy in clinical trials and practice:recommendations for a standardized approach[J].Gastroenterology,2008,134(2):405-415.
[29]Liaw YF.Hepatitis flare and hepatitis B e antigen seroconversion:implication in anti-hepatitis B virus therapy[J].JGastroenterol Hepatol,2003,18(3):246-252.
[30]Locarnini S.Molecular virology of hepatitis B virus[J].Semin Liver Dis,2004,24(Suppl 1):S3-S10.
[31]Lok AS,Zoulim F,Locarnini S,et al.Antiviral drug-resistant HBV:standardization of nomenclature and assays and recommendations for management[J].Hepatology,2007,46(1):254-265.
[32]Zoulim F,Locarnini S.Management of treatment failure in chronic hepatitis B[J].J Hepatol,2012,56(Suppl 1):S112-S122.
[33]Ghany M,Liang TJ.Drug targets and molecularmechanisms of drug resistance in chronic hepatitis B[J].Gastroenterology,2007,132(4):1574-1585.
[34]Zoulim F.Mechanism of viral persistence and resistance to nucleoside and nucleotide analogs in chronic hepatitis B virus infection[J].Antiviral Res,2004,64(1):1-15.
[35]Locarnini S.Hepatitis B viral resistance:mechanisms and diagnosis[J].JHepatol,2003,39(Suppl1):S124-S132.
[36]Zeuzem S,Gane E,Liaw YF,etal.Baseline characteristics and early on-treatment response predict the outcomes of2 years of telbivudine treatment of chronic hepatitis B[J].J Hepatol,2009,51(1):11-20.
[37]Liu F,Chen L,Yu DM,et al.Evolutionary patterns of hepatitis B virus quasispecies under different selective pressures:correlation with antiviral efficacy[J].Gut,2011,60(9):1269-1277.
[38]Chen L,Zhang Q,Yu DM,et al.Early changes of hepatitis B virus quasispecies during lamivudine treatment and the correlation with antiviralefficacy[J].JHepatol,2009,50(5):895-905.
[39]Xu Z,Liu Y,Xu T,etal.Acute hepatitis B infection associated with drug-resistanthepatitis B virus[J].JClin Virol,2010,48 (4):270-274.
[40]Fung SK,Mazzulli T,Sherman M,et al.Pre-existing antiviral resistancemutations among treatment-naive HBV patients can be detected by a sensitive line probe assay[J].J Hepatol,2008,48(Suppl 2):S256.
[41]Chotiyaputta W,Hongthanakorn C,Oberhelman K,et al.Adherence to nucleos(t)ide analogues for chronic hepatitis B in clinical practice and correlation with virological breakthroughs [J].JViral Hepat,2012,19(3):205-212.
[42]Tenney DJ,Levine SM,Rose RE,et al.Clinical emergence of entecavir-resistant hepatitis B virus requires additional substitutions in virus already resistant to lamivudine[J].Antimicrob Agents Chemother,2004,48(9):3498-3507.
[43]Villet S,Ollivet A,Pichoud C,et al.Stepwise process for the development of entecavir resistance in a chronic hepatitis B virus infected patient[J].JHepatol,2007,46(3):531-538.
[44]van Bömmel F,de Man RA,Wedemeyer H,et al.Long-term efficacy of tenofovirmonotherapy for hepatitis B virus-monoinfected patients after failure of nucleoside/nucleotide analogues [J].Hepatology,2010,51(1):73-80.
[45]Patterson SJ,George J,Strasser SI,et al.Tenofovirdisoproxil fumarate rescue therapy following failure of both lamivudine and adefovir dipivoxil in chronic hepatitis B[J].Gut,2011,60 (2):247-254.
[46]Sheldon J,Camino N,Rodés B,et al.Selection of hepatitis B virus polymerasemutations in HIV-coinfected patients treated with tenofovir[J].Antivir Ther,2005,10(6):727-734.
[47]Reijnders JG,Deterding K,Petersen J,et al.Antiviral effect of entecavir in chronic hepatitis B:influence of prior exposure to nucleos(t)ide analogues[J].J Hepatol,2010,52(4):493-500.
[48]Locarnini S,Yuen L.Molecular genesis of drug-resistance and vaccine-escape HBV mutants[J].Antivir Ther,2010,15(3Pt B):451-461.
[49]Yeh CT.Development of HBV Sgenemutants in chronic hepatitis B patients receiving nucleotide/nucleoside analogue therapy[J].Antivir Ther,2010,15(3 Pt B):471-475.
[50]Torresi J,Earnest-Silveira L,Deliyannis G,et al.Reduced antigenicity of the hepatitis B virus HBsAg protein arising as a consequence of sequence changes in the overlapping polymerase gene that are selected by lamivudine therapy[J].Virology,2002,293(2):305-313.
[51]Kamili S,Sozzi V,Thompson G,et al.Efficacy of hepatitis B vaccine against antiviral drug-resistant hepatitis B virus mutants in the chimpanzee model[J].Hepatolgy,2009,49(5):1483-1491.
[52]Warner N,Lorcarnini S.The antiviral drug selected hepatitis B virus rtA181T/sW172*mutanbt has a dominant negative secretion defect and alters the typical profile of viral rebound [J].Hepatology,2008,48(1):88-98.
[53]LaiMW,Yeh CT.The oncogenic potential of hepatitis B virus rtA181T/surface truncationmutant[J].Antivir Ther,2008,13 (7):875-879.
[54]LaiMW,Huang SF,Hsu CW,et al.Identification of nonsense mutations in hepatitis B virus S gene in patients with hepatiocellullar carcinoma developed after lamivudine therapy[J]. Antivir Ther,2009,14(2):249-261.
[55]Yeh CT,Chen T,Hsu CW,et al.Emergence of the rtA181T/ sW172*mutant increased the risk of hepatoma occurrence in patients with lamivudine-resistant chronic hepatitis B[J]. BMCCancer,2011,11:398.
[56]Villet S,Pichoud C,Villeneuve JP,et al.Selection of amultiple drug-resistant hepatitis B virus strain in a liver-transplanted patient[J].Gastroenterology,2006,131(4):1253-1261.
[57]Yuen MF,Seto WK,Chow DH,et al.Long-term lamivudine therapy reduces the risk of long-term complications of chronic hepatitis B infection even in patientswithoutadvanced disease [J].Antivir Ther,2007,12(8):1295-1303.
[58]Liu Y,Wang C,Zhong Y,et al.Genotypic resistance profile of hepatitis B virus(HBV)in a large cohortof nucleos(t)ide analogue-experienced Chinese patients with chronic HBV infection[J].JViral Hepat,2011,18(4):e29-e39.
[59]Lok AS,Lai CL,Leung N,et al.Long-term safety of lamivudine treatment in patients with chronic hepatitis B[J].Gastroenterology,2003,125(6):1714-1722.
[60]Hongthanakorn C,Chotiyaputta W,Oberhelman K,et al.Virological breakthrough and resistance in patients with chronic hepatitis B receiving nucleos(t)ide analogues in clinical practice[J].Hepatology,2011,53(6):1854-1863.
[61]Allen MI,Gauthier J,DesLauriersM,etal.Two sensitive PCR-based methods for detection of hepatitis B virus variants associated with reduced susceptibility to lamivudine[J].J Clin Microbiol,1999,37(10):3338-3347.
[62]Yim HJ,Hussain M,Liu Y,et al.Evolution ofmulti-drug resistant hepatitis B virus during sequential therapy[J].Hepatology,2006,44(3):703-712.
[63]Kim HS,Han KH,Ahn SH,et al.Evaluation ofmethods formonitoring drug resistance in chronic hepatitis B patients during lamivudine therapy based onmass spectrometry and reverse hybridization[J].Antivir Ther,2005,10(3):441-449.
[64]Stuyver L,VanGeyt C,DeGendt S,et al.Line probe assay for monitoring drug resistance in hepatitis B virus-infected patients during antiviral therapy[J].JClin Microbiol,2000,38 (2):702-707.
[65]Lok AS,Zoulim F,Locarnini S,et al.Monitoring drug resistance in chronic hepatitis B virus(HBV)-infected patients during lamivudine therapy:evaluation of performance of INNO-Li-PA HBV DR assay[J].J Clin Microbiol,2002,40(10):3729-3734.
[66]HussainM,Fung S,Libbrecht E,et al.Sensitive line probe assay that simultaneously detectsmutations conveying resistance to lamivudine and adefovir[J].J Clin Microbiol,2006,44 (3):1094-1097.
[67]Keeffe EB,Dieterich DT,Han SH,et al.A treatment algorithm for the management of chronic hepatitis B virus infection in the United States:2008 update[J].Clin Gastroenterol Hepatol,2008,6(12):1315-1341.
[68]Hou J,Sun J,Xie Q,et al.Virological breakthrough and genotypic resistance in a randomized,controlled study on telbivudine treatment applying roadmap concept in CHB:W76 interim analysis of effort study[J].J Hepatol,2012,56(Suppl 2):S203-S204.
[69]Zoutendijk R,Reijnders JG,Brown A,et al.Entecavir treatment for chronic hepatitis B:adaptation is not needed for the majority of naïve patients with a partial virological response [J].Hepatology,2011,54(2):443-451.
[70]Sun J,Hou JL,Xie Q,et al.Randomised clinical trial:efficacy of peginterferon alfa-2a in HBeAg positive chronic hepatitis B patients with lamivudine resistance[J].Aliment Pharmacol T-her,2011,34(4):424-431.
[71]Marcellin P,Avila C,Wursthorn K,et al.Telbivudine(LDT)plus peg-interferon(PEGIFN)in HBeAg-positive chronic hepatitis B-very potent antiviral efhcacy but risk of peripheral neuropathy(PN)[J].JHepatol,2010,52(Suppl1):S6-S7.
[72]Keeffe EB,Dieterich DT,Pawlotsky JM,et al.Chronic hepatitis B:preventing,detecting,andmanaging viral resistance[J]. Clin Gastroenterol Hepatol,2008,6(3):268-274.
[73]Lau GK,Piratvisuth T,Luo KX,et al.Peginterferon Alfa-2a,lamivudine,and the combination for HBeAg-positive chronic hepatitis B[J].N Engl JMed,2005,352(26):2682-2695.
[74]Sung JJ,Lai JY,Zeuzem S,et al.Lamivudine compared with lamivudine and adefovir dipivoxil for the treatment of HBeAgpositive chronic hepatitis B[J].J Hepatol,2008,48(5):728-735.
[75]Lok AS,Trihn HN,CarosiG,et al.Entecavir(ETV)monotherapy for 96 weeks is comparable to combination therapy with ETV plus tenofovir(TDF)in nucleos(t)ide naive patientswith chronic hepatitis B:the BELOW study[J].Hepatology,2011,54(Suppl 1):471A.
[76]Terraut NA.Benefits and risks of combination therapy for hepatitis B[J].Hepatology,2009,49(5 Suppl):S122-S128.
[77]董南,何波,庄辉.慢性乙型肝炎患者对疾病和抗病毒治疗的认知程度调查[J].肝脏,2009,14(1):8-10.
[78]Wiersma ST,McMahon B,Pawlotsky JM,et al.Treatment of chronic hepatitis B virus infection in resource-constrained settings:expert panel consensus[J].Liver Int,2011,31(6):755-761.