 去看看
去看看


影像技术在脑血管病诊断、疗效评价、预后判断中具有不可取代的地位。在临床诊疗以及临床研究中通常所涉及的影像技术为:①电子计算机体层扫描(computerized tomographic scanning,CT):包括CT平扫(non-contrast CT,NCCT),CT增强扫描,CT灌注成像(CT perfusion,CTP)和CT动脉造影(CT angiography,CTA);②磁共振成像(magnetic resonance imaging,MRI):包括常规磁共振成像,弥散加权成像(diffusionweighted imaging,DWI),灌注加权成像(perfusion-weighted imaging,MRP或PWI),液体衰减反转恢复序列(fluid-attenuated inversion recovery,FLAIR),磁共振动脉造影(magnetic resonance angiography,MRA),磁共振静脉造影(magnetic resonance venography,MRV),磁共振波谱成像(magnetic resonance spectroscopy,MRS),弥散张量成像(diffusion tensor imaging,DTI),脑血氧水平依赖成像(blood oxygen level dependent,BOLD),磁敏感加权成像(sensitivity weighted imaging,SWI)等;③数字减影血管造影(digital substraction angiography,DSA)。为了让临床医师更加了解各种技术的特点,正确、有效地应用这些技术对不同脑血管病进行及时诊断、治疗方案的制订、疗效评价、预后判断以及临床研究,中华医学会神经病学分会脑血管病学组特制定中国脑血管病影像应用指南。本指南在全面复习国内外发表的神经血管影像研究结果及指南并结合我国实际情况的基础上进行编写,并经多次讨论达成共识。推荐强度与证据等级标准参考《中国急性缺血性脑卒中诊治指南2014》[1]。现将脑血管病相关影像技术从4个方面进行描述,即脑成像技术、脑灌注成像技术、脑血管成像技术和其他成像技术。有关脑血管超声技术请见相关指南。
一、脑成像技术
CT和MRI均可通过密度或信号强度用于脑实质以及解剖结构的成像。在急性脑血管病应用时主要满足以下需求:①判断是否有脑出血;②发现脑缺血;③排除临床卒中样发作的其他颅内疾病[2]。
(一)CT
1.CT是检测脑出血的“金标准”
NCCT因其检查时间短、扫描速度快、不受金属器械及移植物影响等优势,可确定出血部位,估计出血量,判定出血是否破入脑室,并判断有无脑疝形成,是目前临床确诊急性脑出血的首选方法(图16-1),也是急诊鉴别缺血性脑卒中和出血性脑卒中、溶栓前排除脑出血最常规的筛查方法[3]。NCCT可以显示直径>5mm呈高密度区的急性脑出血。急性期颅内出血,NCCT呈高密度,系血液中血红蛋白密度高于脑组织密度所致,多为圆形或卵圆形。约24小时后,高密度血肿周围常有一低密度环存在,由于血肿周围的水肿和析出的血浆,通常在出血第5天最明显。随着时间的推移,NCCT上的特征性高密度影逐渐减弱、消失,在8~10天后变为低密度影,通常出血1个月时,整个血肿呈等密度或低密度。所以,NCCT不能鉴别陈旧性出血与脑梗死。
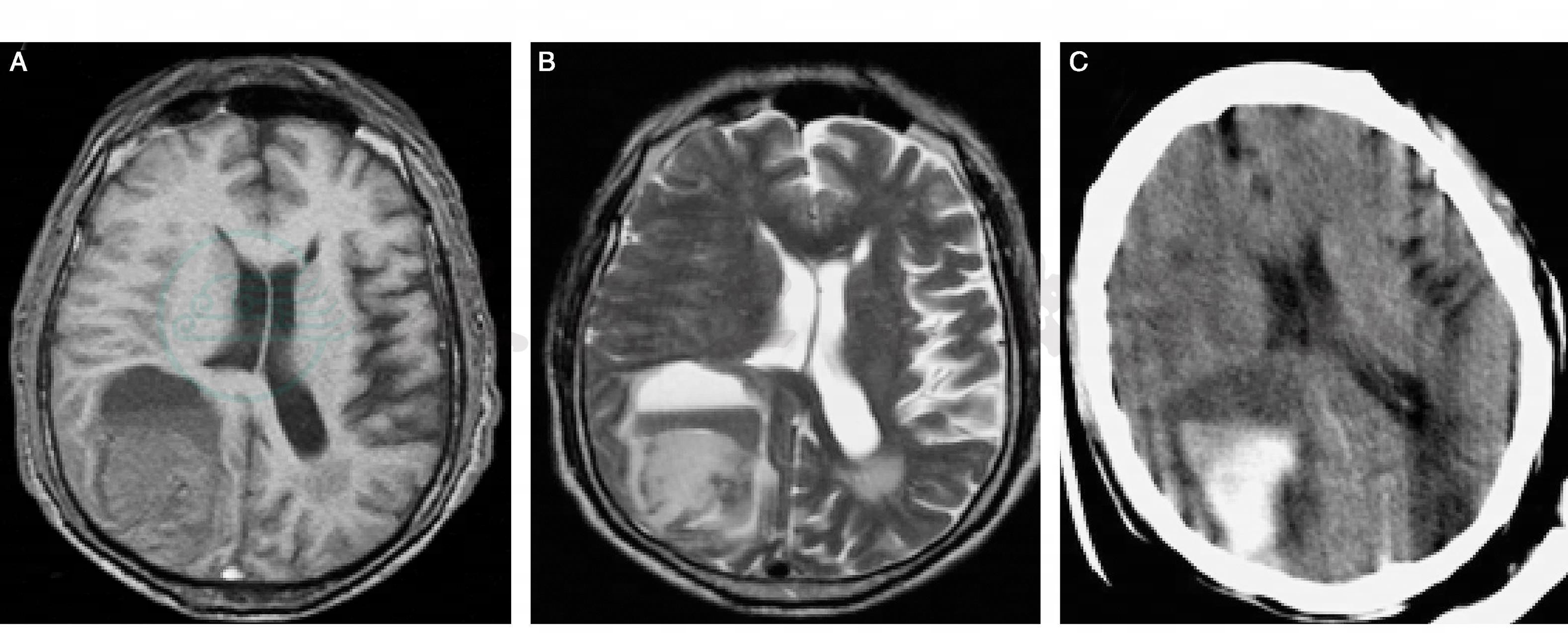
图16-1 脑出血的电子计算机体层扫描(CT)和磁共振成像(MRI)影像
患者,男性,74岁。清晨起床时发现左侧肢体无力2小时,左上肢肌力Ⅴ-级,左下肢肌力Ⅳ级,左侧巴宾斯基征(+)。A:MRIT1WI见右枕叶低信号影;B:T2WI见高信号,有液面;C:CT见右枕叶高密度影,周边有低密度的水肿带,明确脑出血
2.CT是诊断蛛网膜下腔出血(subarachnoid hemorrhage,SAH)的首选影像学手段
表现为蛛网膜下腔内高密度影。以脑脊液结果作为对照标准,SAH症状出现12小时内,十六排CT的诊断敏感度为91%~97%[4]。随着时间的延长,出血逐渐被吸收,NCCT上的高密度影逐渐减弱至消失。24小时后,NCCT诊断SAH的敏感度下降为81%~84%,1周后的敏感度更低,仅为50%[5]。综合研究报道,对于急性期SAH,NCCT诊断的敏感度为98%(95%CI 97%~99%),特异度为100%(95%CI 97%~100%)[6]。临床常根据出血部位推测颅内动脉瘤的位置,如鞍上池不对称积血提示颈内动脉段,外侧裂积血提示大脑中动脉段,前间裂基底部积血提示前交通动脉段,脚间池和环池出血常常无动脉瘤。
3.CT在缺血性脑卒中诊疗中的作用
目前,NCCT是临床上公认的急性缺血性脑卒中常规检查和首选检查手段。表现为低密度影,但在早期不一定都能显示低密度改变,故其重要作用是排除脑出血。在组织纤溶酶原激活物(tissue type plasminogen activator,t-PA)溶栓前采用NCCT排除颅内出血,是简便快捷的有效方法[7-8]。在部分患者脑卒中超急性期(<6小时),NCCT可表现为灰质与白质分界消失[9-10],在溶栓时间窗内的检出率低于67%[11-14];急性期(<3天)可出现血管源性水肿,在缺血区的边界显示欠清低密度影,病灶局部会出现脑沟、脑裂变浅,大面积梗死则可因脑水肿而出现占位效应,从而出现中线结构的移位;亚急性期(<2周)即模糊效应期;慢性期(1~2个月),由于病灶液化坏死,边界清楚的软化灶形成,而呈现出低密度影,病灶局部周围脑沟、脑池增宽,邻近脑室扩大,局部脑萎缩[15]。NCCT对急性缺血性脑卒中的敏感度取决于梗死灶的影像特点、临床检查的时间、研究人群以及其他因素,敏感度为12%~92%,通常起病24~36小时才出现低密度改变。美国神经病学会报道,NCCT对早期的脑梗死诊断的敏感度为31%[3]。而NCCT对脑梗死早期征象(early ischemic changes,EICs)的探讨一直是研究的热点,是否对溶栓治疗有预测价值存在争议[16-17]。EICs包括以下几点:①高密度的大脑中动脉/基底动脉征;②脑沟消失;③基底节/皮质下低信号;④皮质、灰质、白质界限消失。美国国立神经疾病和卒中研究所的NINDS研究发现EICs与脑卒中严重程度有关,而与溶栓治疗的不良预后无关[18]。2005年Wardlaw和Mielke[19]的一项系统回顾性研究发现,来自15项研究的3468例患者中,早期CT征象检出的敏感度和特异度分别为66%和87%,但未发现相关证据证实其与溶栓结果存在相关性,EICs总分10分[Alberta早期CT评分(ASPECTS)]。Dzialowski等[20]从欧洲-澳大利亚急性卒中研究(ECASSⅡ)数据中对ASPECTS与溶栓预后相关性进行了研究,发现ASPECTS与t-PA溶栓效果不相关,但ASPECTS≤7分与溶栓相关的脑实质出血密切相关。大脑中动脉高密度影(hyperdensemiddle cerebral artery sign,HMCAS)可作为NCCT早期征象的特异度表现,往往提示脑梗死面积大,预后不佳[21-22]。HMCAS与静脉溶栓后治疗效果不佳相关,提示早期即有神经损害以及功能缺损较严重[23-24]。
4.NCCT对缺血性脑水肿或出血转化的诊断
CT是对这两者随访最佳的影像方式。恶性脑水肿以及出血转化常为缺血性脑卒中不良预后的主要原因之一。脑卒中伴有恶性脑水肿患者病死率显著上升至40%~80%,其中10%~15%大脑中动脉阻塞的缺血性脑卒中可致恶性脑水肿。影像学表现为起病6小时以内出现明显的低密度影≥1/3大脑中动脉支配区,以及起病1~2天内出现HMCAS、中线移位大于5mm,常提示恶性脑水肿以及预后不良。
5.NCCT对短暂性脑缺血发作(transient ischemic attack,TIA)的诊断
NCCT不能直接诊断TIA,而是通过NCCT检查以排除颅内出血和脑梗死后,结合临床表现方能确诊TIA。因此,NCCT对TIA的诊断是起间接作用的。
6.NCCT对脑静脉窦血栓形成(cerebral venous and sinus thrombosis,CVST)的诊断
CVST在CT上可分为直接征象和间接征象,直接征象是指血栓本身征象,即静脉窦内三角形或条样高密度,20%~25%患者可出现,1~2周内消失。但这一征象的特异度并不高,青年人的高血红蛋白血症、红细胞增多症、脱水等均可出现这一征象[25]。间接征象是指血栓形成后的继发征象,包括脑水肿、脑梗死、脑出血、脑静脉扩张以及大脑镰、小脑幕异常强化等。法国一项多中心研究发现,螺旋NCCT出现的高密度征,当密度>70Hu,对静脉窦血栓诊断很有价值,但除外上矢状窦水平位的高密度征[26]。Linn等[27]的研究发现,NCCT上出现的皮质下对称性低密度水肿影或高密度出血影或细静脉征在大脑深静脉血栓形成中的敏感度和特异度分别为100.0%和99.4%(图16-2),而对于皮质静脉血栓形成的敏感度和特异度仅为64.6%和97.2%。
【推荐意见】
·NCCT是脑出血和蛛网膜出血的首选检查(Ⅰ级推荐,A级证据)。
·对急性缺血性脑卒中患者应首先完成急诊NCCT,以排除脑出血(Ⅰ级推荐,A级证据)。
· 在rt-PA溶栓治疗前,应完成NCCT检查,以排除脑出血(Ⅰ级推荐,A级证据)。
·NCCT是监测脑梗死后恶性脑水肿及出血转化的常用技术(Ⅰ级推荐,A级证据)。
·NCCT可作为CVST首选检查技术,当显示双侧大脑皮质及皮质下区脑水肿及脑出血时,应考虑CVST的可能(Ⅱ级推荐,B级证据)。
(二)MRI
常规MR扫描包括DWI、T1WI、T2WI和FLAIR。DWI利用分子布朗运动的原理,检测活体组织内水分子扩散运动。缺血组织在发病数分钟至数小时出现表面扩散系数下降,从而在DWI上表现出高信号。T1WI图像对不同软组织结构有良好的对比度,适于观察软组织的解剖结构;T2WI对显示病变的信号变化比较敏感,利于观察病理变化。两者结合有助于病变的定位、定量和定性诊断。FLAIR是一种特殊序列,使脑脊液呈低信号,避免脑脊液产生的部分容积效应及流动伪影的干扰,增加病灶与正常组织对比,因此可显示脑脊液边缘易重叠的脑梗死;常规MRI不易区别SAH与脑脊液,而FLAIR像上,血性脑脊液T2值大于脑实质,信号比脑实质高。尤其对后颅窝少量出血更有价值。FLAIR被广泛应用于颅脑各类疾病包括缺血性病变、外伤、出血、肿瘤、白质病变的诊断。
1.MRI在急性缺血性脑卒中诊断中的应用
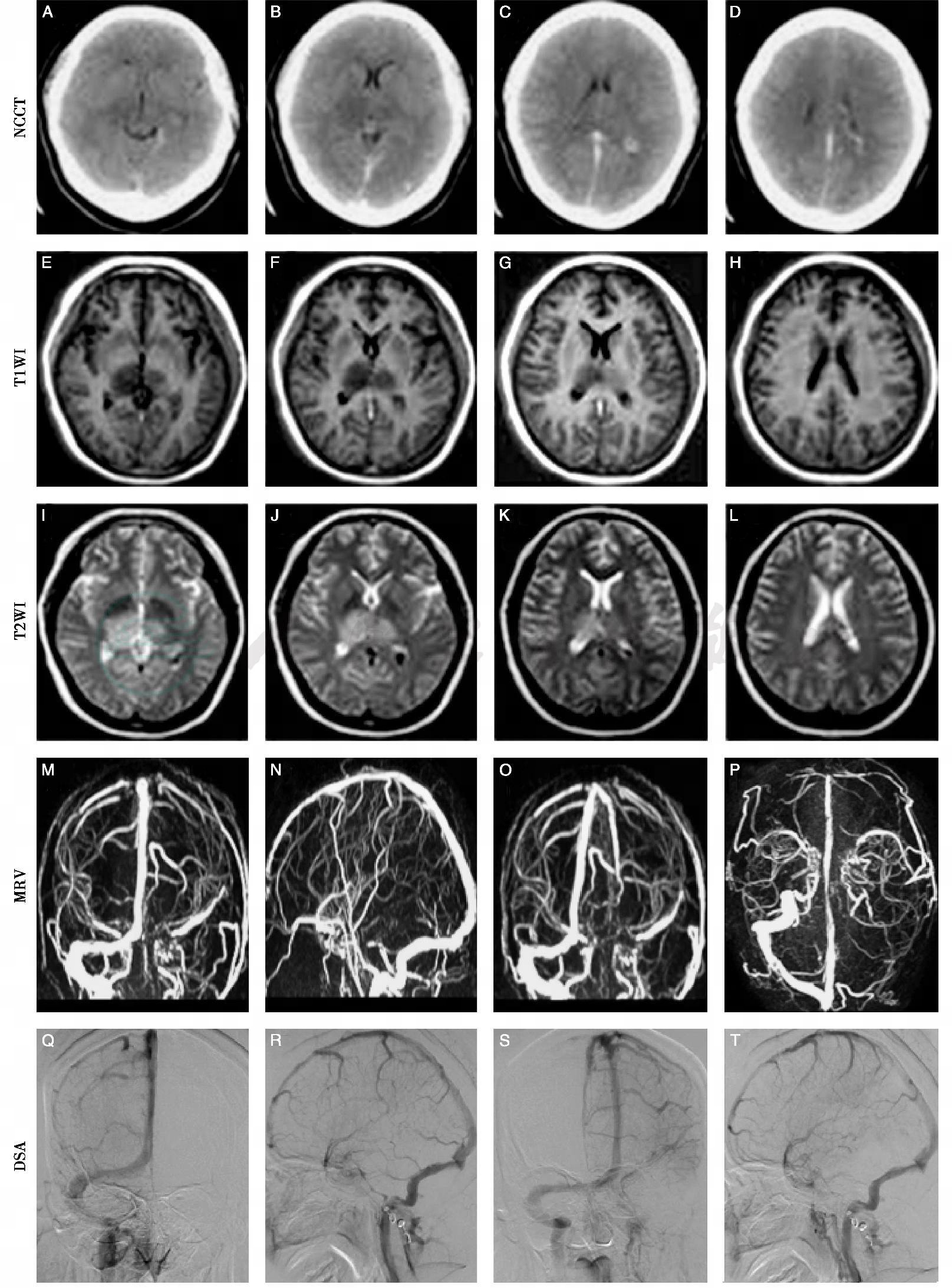
图16-2 静脉窦血栓形成影像
头颅电子计算机体层扫描平扫(NCCT)示蛛网膜下腔出血(A~D);磁共振成像显示双侧丘脑肿胀,考虑脑静脉窦血栓形成可能(E~L);磁共振静脉造影(MRV)(M~P)、数字减影血管造影(DSA)(Q~T)提示左侧横窦、下矢状窦、直窦血栓形成
MRI的DWI在缺血数分钟后即可出现异常高信号,是最精确诊断急性脑梗死病灶的技术。T2WI一般在6小时后出现病灶的高信号,T1WI出现病灶的低信号时间与NCCT相近。DWI可区分缺血性脑卒中新鲜病灶和陈旧病灶,起病2周内为高信号,之后逐渐降低,可利用这一特征很好地对位置相近的新老病灶进行鉴别。在卒中发生24小时内,DWI敏感度为80%~95%,同期CT敏感度却只有16%[28]。
DWI未显示出急性缺血性脑卒中病灶的可能是轻度脑卒中,脑干部位或病灶还未形成[29]。在脑卒中超急性期(发病<6小时)及急性期,MRI敏感度及特异度分别为91%和95%,敏感度由高到低的顺序为DWI>FLAIR>T2WI[30-31]。总结见表16-1。脑卒中患者标准的MRI检测序列应包括常规MRI(T1WI、T2WI和DWI)和三维时间飞跃法MRA(3D-TOF-MRA)。
表16-1 不同时期脑梗死在MRI的表现
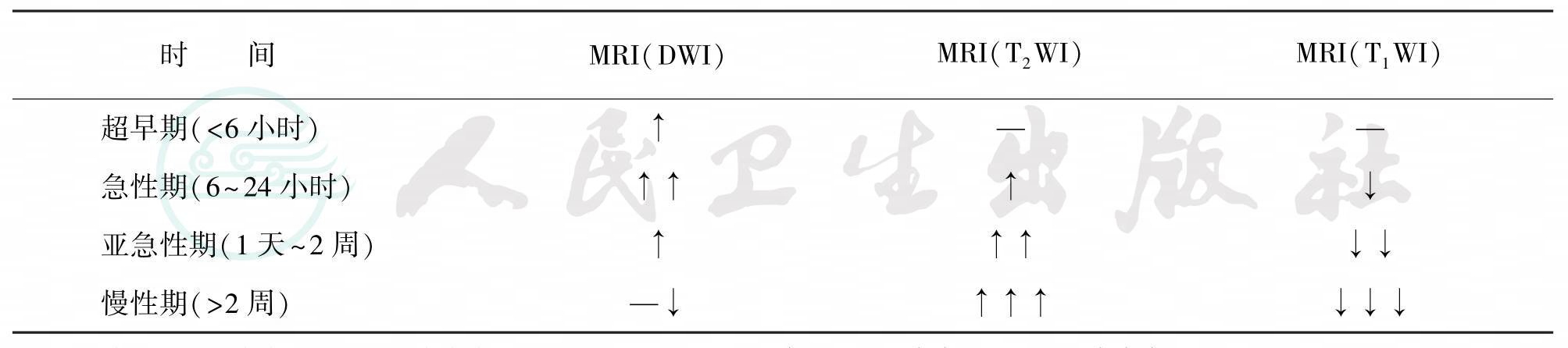
注:↑:高信号,↑↑:信号更高,↑↑↑:信号非常高;—:等信号;↓:低信号,↓↓:信号更低,↓↓↓:信号非常低
对于后循环梗死,DWI敏感度高达80%~95%,DWI成像被认为是疑似后循环缺血性脑卒中最敏感的影像方法,而MRI常规序列(T1WI/T2WI)敏感度较低,假阴性率高达19%[32]。
2.MRI在TIA诊断中的应用
基于DWI对梗死灶极高的敏感度,临床诊断TIA的患者也需要行MRI-DWI扫描,以排除脑梗死。临床研究表明,约50%的TIA患者在DWI图像上可见高信号改变,这一结果与组织缺血坏死程度有关[33-34]。2013年,Al-Khaled等[35]收集了1862例符合标准的TIA患者,并在发病后24小时进行了DWI序列的MRI检查,结果发现,11.1%的TIA患者被检测出DWI中急性梗死的征象,并与肢体无力、失语及NIHSS评分≥10分相关,提示TIA患者早期检测MRI-DWI对脑梗死预测的重要性。由于DWI在疑似TIA患者中发现梗死灶的高敏感度,其已经作为TIA急诊首要推荐检查,以排除脑梗死[36]。
3.MRI在脑出血诊断中的应用
MRI对于脑出血的诊断敏感度主要取决于出血时间及扫描序列,主要与血管内红细胞的完整性及血红蛋白的演变有关。MRI在脑出血急性期、亚急性期及晚期T1WI和T2WI均有一定程度的表现,但是由于缺乏特征性的表现,不建议用于早期脑出血的诊断。梯度回波成像技术通过检测脱氧血红蛋白这一顺磁性物质在磁敏感序列梯度回波T2WI像上的显像,可以在急性期观察到低信号区内混杂斑块状信号,用于脑出血的早期诊断。近期研究发现MRI和CT对急性脑出血的准确率均为96%,肯定了梯度回波序列对脑出血诊断的高敏感度和高特异度,与CT比较,还能检测到微出血病灶,获得更多的出血征象[37]。
关于MRI上发现的微出血灶是否为溶栓禁忌得到了普遍的关注,目前研究认为CT未能发现而MRI上可见的小于5个微出血灶并非溶栓禁忌,颅内出血率差异无统计学意义[38],多发微出血病灶(≥5个)是否增加溶栓出血风险仍缺少大样本研究。
4.MRI在SAH诊断中的应用
SAH亚急性期因脑池内血中含有正铁血红蛋白,可以在T1WI和FLAIR上表现为高信号。MRI的FLAIR序列可以通过抑制脑脊液信号从而得到抑水T2WI,对诊断SAH具有明显的特异度,在脑脊液和脑实质周围出现明显的高信号区域。FLAIR对于SAH诊断结果与CT和腰椎穿刺结果一致[39],目前尚需要进一步的证据证实其特异度及敏感度。
5.MRI在静脉窦血栓形成诊断中的应用
因血栓内的血红蛋白不断代谢,静脉窦血栓的信号特点复杂多变,诊断有一定困难,联合FLAIR、T2WI和DWI可提高其诊断率。起病早期血栓中的红细胞内以氧合血红蛋白、脱氧血红蛋白为主,T1WI呈现等信号,而T2WI及FLAIR为高信号,但早期敏感度不高,多数患者影像学表现与正常的静脉血流信号相似;1~2周后血栓成分转变为正铁血红蛋白,诊断的敏感度及特异度大大提高,MRI上表现为T1WI、T2WI及FLAIR的高信号;2周~2个月后静脉窦血栓出现再通,T1WI、T2WI及FLAIR再次还原成等信号[25]。Altinkaya等[40]通过对130例患者进行回顾性研究发现,T2WI对急性及亚急性的上矢状窦血栓、深静脉血栓及皮质静脉血栓诊断具有很高的价值,详见表16-2。
表16-2 不同时期的静脉窦血栓在MRI上的表现

【推荐意见】
·MRI-DWI诊断脑梗死的敏感度及特异度优于CT及MRI其他序列,有助于急性缺血性脑卒中的早期诊断(Ⅰ级推荐,A级证据)。
·急性缺血性脑卒中症状出现超过3.0小时或4.5小时,在不耽误静脉溶栓的情况下,推荐完善MRIDWI或血管成像及灌注成像,对于血管内治疗具有临床指导意义(Ⅰ级推荐,A级证据)。
·MRI-DWI可评估大脑前部的脑卒中严重程度和最终梗死体积,有助于预测最终的梗死灶大小(Ⅱ级推荐,B级证据)及临床预后(Ⅱ级推荐,C级证据)。
·对于脑卒中亚急性期、慢性期及缺血后出血,MRI检查明显优于CT(Ⅱ级推荐,B级证据)。
·MRI的梯度回波序列能够早期检测脑出血,对新发或陈旧的微出血灶的检测优于CT(Ⅱ级推荐,B级证据)。
二、血管成像技术
脑卒中和TIA与脑血管病变密切相关。血管影像可帮助我们了解血管闭塞部位、有无斑块及其性质、有无血管畸形、动脉瘤等。对确诊临床病因、制定精准化治疗方案、判断预后具有重要意义。本指南主要介绍CT血管成像[CTA和CT静脉造影(CT venography,CTV)]、MR血管成像(MRA和MRV)、DSA和高分辨磁共振成像(high-resolution MRI,HRMRI)的脑血管成像技术。
(一)CTA和CTV
CTA的空间分辨率较增强MRA高,对颅内外动脉狭窄情况的判断可靠性更高。比较CTA和DSA发现[41],CTA在诊断无症状性血管异常方面具有95%以上的敏感度和接近100%的特异度,阳性和阴性预测值均超过97%。然而,CTA影像在瞬时血管成像方面仍落后于DSA,在显示重要的供血动脉和畸形血管团时效果较差。新的多层CT已显著提高了瞬时图像的分辨率,但辐射的剂量也相应增加。多层CT的立体成像分辨率仍低于DSA。随着技术的进一步更新发展,CTA作为一个有效的脑血管病评估工具应用前景会更广阔,并有可能在未来替代DSA。
CTA检查的推荐参数:CTA检查参数取决于设备硬件和软件的进展。20世纪90年代主要使用单排CT,后来发展为螺旋CT,近10年已经进展到多排CT,目前常规使用的有16排、64排、128排CT,不同CT使用的造影剂容量、注射速度和延迟扫描时间或者造影剂跟踪方法都各有不同。1990年至2005年的CTA研究,主要使用单排或4排CT,目前本参数仍然适用于基层医院设备较差者。造影剂注射速度为3ml/s,造影剂用量为120~200m l,延迟扫描时间为20秒,或者小剂量(20ml)预试验以确定延迟时间,感兴趣区放置在颈总动脉分叉处[30,42]。近10年来,16排以上CT广泛应用,造影剂注射速度为4ml/s,造影剂用量为70~100ml,延迟扫描时间为20秒,或者小剂量(20ml)预试验以确定延迟时间,感兴趣区放置在颈总动脉分叉处;128排以上的CT可以采用自动触发扫描技术,即感兴趣区放置在主动脉弓或颈总动脉,阈值设定为CT值120Hu,分辨率可以达到1.25mm[43]。
1.CTA对颅内外动脉狭窄以及斑块的评估
Koelemay等[42]的荟萃分析提示,对于70%~99%的重度颈动脉狭窄,CTA检出的敏感度和特异度分别为85%和93%。对于颈动脉闭塞检出的敏感度和特异度为97%和99%。超声显示血管狭窄程度大于50%无临床症状或小于50%伴有症状的患者,建议使用CTA和MRA来确诊和准确地检测血管的狭窄程度[44]。Nguyen-Huynh等[43]研究表明,对于颅内大动脉闭塞CTA检出的敏感度和特异度均为100%;血管狭窄大于50%,其敏感度和特异度分别为97.1%和99.5%。CTA还可分析斑块形态及CT值,判断斑块性质,鉴别软、硬斑块以及混合斑块,对卒中风险评估及临床诊疗提供重要的帮助,CTA诊断软斑块的准确性为93%[45]。
2.CTA对颅内外动脉夹层的诊断
CTA原始图像可以看到颈内动脉夹层的狭窄管腔,轴位有半月形的壁间出血略呈高密度区,可以看到血管的逐渐闭塞(图16-3)。重建图像可以清楚看到狭窄的位置和长度,甚至可以看到夹层掀起的内膜,可见鼠尾状狭窄[46]。CTA诊断椎动脉夹层的敏感度和特异度分别为100%和98%[47]。由于解剖结构和解剖部位的特殊性,颅内椎动脉的动脉瘤样扩张通常发生在V4段,而颅外椎动脉夹层常发生在V3段。当出现特定的影像学征象,如假性动脉瘤、内膜片或双腔外观时,可明确诊断为椎动脉夹层,约<10%的椎动脉夹层会出现上述征象[48]。CTA在诊断颅颈动脉夹层时较MRA有如下优势:可用于夹层超急性期的诊断;动脉周围的静脉丛及脂肪不会干扰CTA;更高的空间分辨率可辨别微小动脉夹层[47,49]。
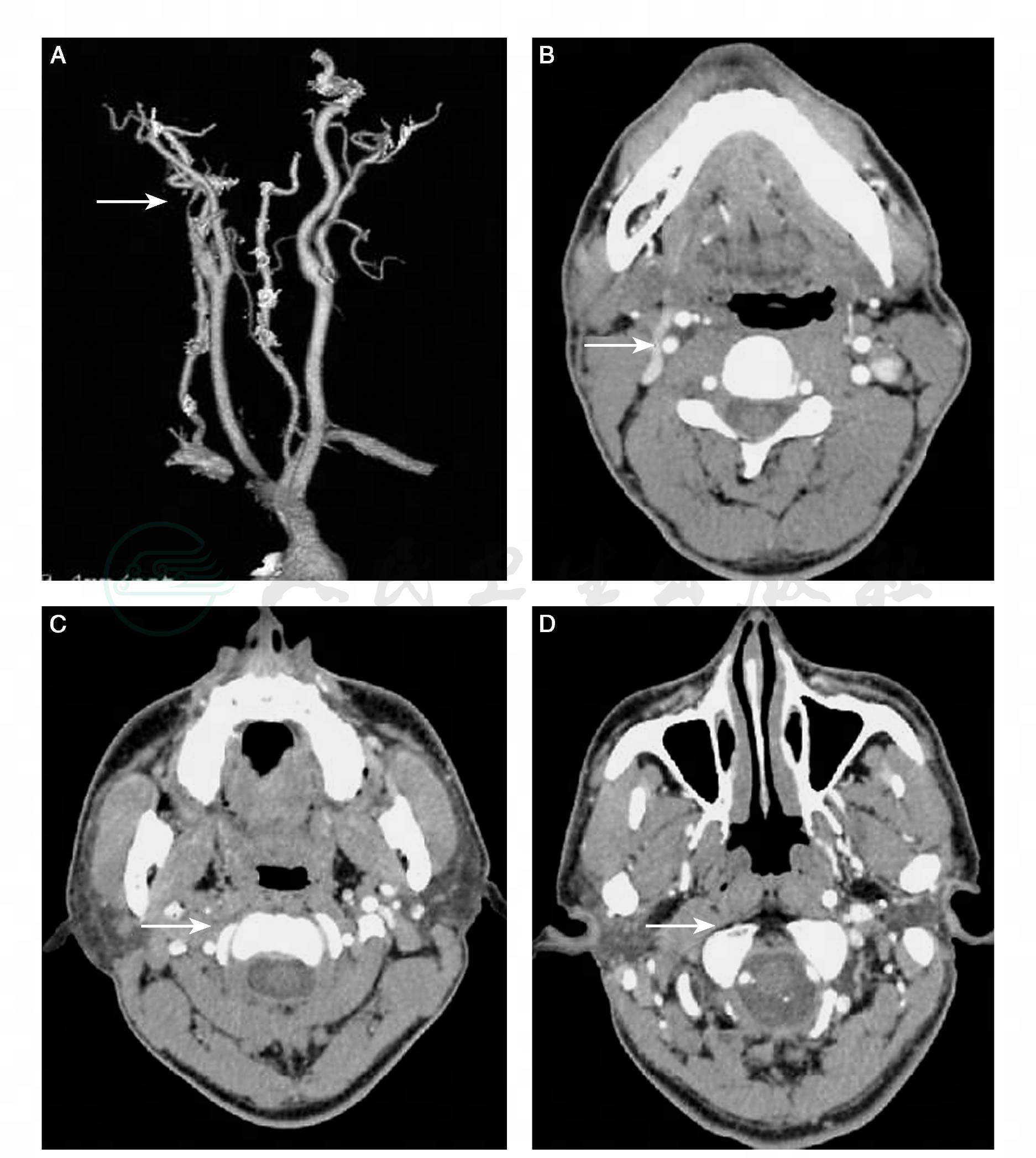
图16-3 电子计算机体层扫描动脉造影(CTA)示头颈动脉夹层
A:CTA可见鼠尾状狭窄(箭头);B~D:原始图像可以看到血管的逐渐闭塞(20%),壁间出血略高密度区(箭头)
3.CTA对脑动脉瘤的诊断
CTA在检测脑动脉瘤方面具有较高的敏感度、特异度及准确性,分别为96.3%、100.0%和94.6%。但对于直径<3mm的小动脉瘤的敏感度略低,为81.8%[50]。另外,CTA可以检测出动脉壁钙化和血栓,从而对治疗决策有指导作用。CTA的高敏感度与特异度的特征决定了它作为影像学检测脑动脉瘤的首选方法。
4.CTA对血肿扩大、预后的预测
CTA检查的对比剂外渗可提示活动性出血,表现为CTA影像上的“点样征”,是预测早期血肿扩大的重要影像学证据[51-52]。
5.CTV对静脉窦血栓的诊断
CTV对上矢状窦、直窦、横窦、乙状窦、大脑大静脉和大脑内静脉的敏感度可达100%;对下矢状窦、基底静脉、丘纹静脉、小脑中央前静脉、岩上窦及海绵窦的敏感度在90%以上;对终静脉、隔静脉及小脑上蚓静脉敏感度为70%~80%;对岩下窦和蝶顶窦敏感度为50%~60%以上[53]。CTV与MRV在脑静脉系统的显影上具有很好的一致性[5-7]。脑CTV除能显示MRV显示的大静脉(窦)外,还显示了更多的小静脉血管结构,如下蚓静脉,且比MRV伪影少。在静脉窦血栓中,慢血流的室管膜下静脉和侧支静脉用CTV比MRV显示得更好。CTV显示血管的对比剂,受血流速度和伪影影响甚少。但CTV的高辐射剂量,且对碘过敏及肾功能不全患者存在使用受限等问题,影响其广泛使用。
(二)MRA和MRV
MRA成像原理是利用流动血液的MR信号与周围静止组织的MR信号差异而建立图像对比的一种技术。目前的MRA序列技术包括三维TOF序列、多块重叠薄层采集和增强MRA(contrast-enhanced magnetic resonance angiography,CE-MRA)等。TOF序列能准确地评估颅内外血管狭窄程度,敏感度为60%~85%,特异度为80%~90%[32]。MRA对闭塞血管诊断的准确性高于CTA,约100%,但是对末梢血管的评估准确性不如CTA及DSA[33]。
1.MRA对颅内动脉瘤的诊断
能直接显示动脉瘤大小、部位、形状,能多方位多角度观察瘤体整体情况,局限性主要表现在空间分辨率低,对小动脉瘤的辨别存在困难。Sailer等[54]对1998年至2013年的960例颅内动脉瘤患者进行荟萃分析,认为MRA对颅内动脉瘤诊断的敏感度、特异度分别为95%、89%,假阴性和假阳性的动脉瘤主要位于颅底和大脑中动脉,三维重建后更有利于诊断。3T-CE-MRA在颅内动脉瘤破裂诊断上比3D-TOF-MRA更具有优势,能减少涡流等对血管显示的影响[55]。
2.MRA对动脉夹层的诊断
MRA对血管壁内血肿敏感度很高,而血管壁内血肿是动脉夹层诊断的重要判断依据,所以MRA几乎取代了DSA成为诊断颈动脉夹层的重要影像学检查[56]。MRA和MRI目前是欧洲神经病学会推荐的动脉夹层首选影像学检查[57]。MRI对椎动脉夹层诊断的敏感度低于对颈动脉夹层的诊断,而CT在椎动脉夹层的诊断上更有优势[58]。
MRA与先进的MRI方法结合可以检查动脉夹层的生理情况。MRI与MRA的联合使用不仅能提高诊断率,而且作为颈动脉夹层的非侵袭性检查,能够监测血管壁内血肿或并发症的进展与缓解。由于正常人的椎动脉直径偏小且多有变异,以至于MRI与MRA诊断椎动脉动脉夹层的敏感度与特异度较低。CEMRA可以显示血管腔的不规则,血管直径或血管阻塞的变化,以及假性动脉瘤的形成(图16-4)。CEMRA在空间和时间上的分辨力不如传统的影像学检查,但具有非侵袭性检查的特点。CE-MRA具有独特的优势,它可以补充T1加权、T2加权轴向图像,通过管腔狭窄段进一步明确动脉夹层,显示相关受损的脑组织,监测血管再通、血管阻塞的进程,对患者的后期管理提供更充分的依据[46]。
3.MRA对脑动脉炎的诊断
MRA可辅助脑动脉炎的诊断,可通过非对比技术、TOF-MRA、增强MRA实现,优点在于无创、操作简便。目前较多使用的1.5T和3.0T MRA仅能显示中等以上大小血管炎的典型病变,使用高于7T的MRA时可提供120μm以上的血管征象,但对于小血管炎无法检测[59]。脑动脉炎的MRA影像学表现类似于DSA,表现为单处或多处相互交替狭窄呈串珠样改变或者闭塞。目前MRA的时间分辨率低于DSA的时间分辨率,所提供的血流动力学的信息也相对局限。如MRA显示的血管异常与病变范围不一致时,可能为低灌注伴慢性代偿而引起的缺血而非真正梗死[60]。
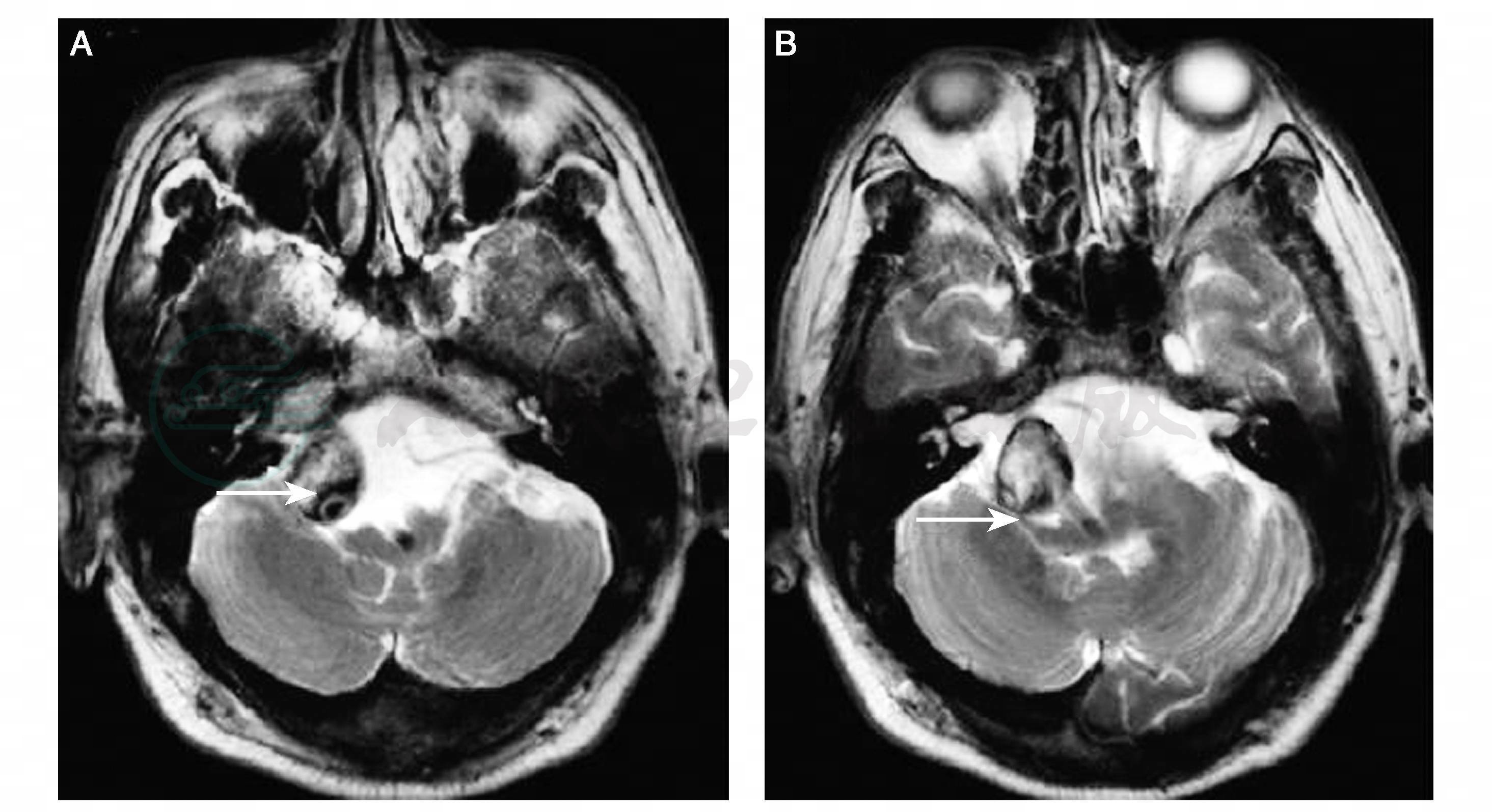
图16-4 磁共振动脉造影示头颈动脉夹层(箭头)。原始图像对壁间血肿尤其敏感,显示真假腔
4.MRV对颅内静脉血栓的诊断
MRV是静脉血流成像,明显受血流速度和伪影的影响,对血流慢的静脉窦和小静脉显示不准确,其信号的缺失有时并不意味血流停滞或血栓形成。但MRV无辐射和无须注射造影剂,临床应用方便,常规应用于静脉系统疾病的诊断,尤其孕妇、肾功能不全患者。CE-MRV能够弥补信号缺失的缺点,对静脉窦血栓的诊断价值更大。
(三)DSA
DSA通过对血管造影进行数字化处理,保留血管影像,从而可以清晰观察血管病变情况,为临床提供真实的立体图像,并为介入治疗提供依据,为目前脑血管病诊断和治疗不可或缺的一项影像技术,一直是多种脑血管疾病诊断的金标准,其准确性、敏感度、特异度均较无创性检查手段高[61-62]。但其缺点在于耗时长,患者及医务工作者同时受到电离辐射,并且因其有创性的操作可能导致严重的并发症甚至死亡,使DSA技术在临床应用中受到一定限制[63]。DSA能够清晰显示自主动脉弓至整个颅内各级血管及其分支的位置、形态等,能准确地评估血管狭窄、动脉瘤及侧支循环代偿(图16-5)。Agid等[64-66]建议对于CTA阴性的SAH患者,应完善DSA检查。
DSA的神经介入和治疗神经放射学会/介入放射学会(American Society of Interventional and Therapeutic Neuroradiology/Society of Interventional Radiology)侧支循环评估系统目前为国际上公认的评估方法,可以用来很好地预测脑卒中患者的病情进展及预后情况[67]。根据动态血流情况将侧支循环分为5级:0级,没有侧支血流到缺血区域;1级,缓慢的侧支血流到缺血周边区域,伴持续的灌注缺陷;2级,快速的侧支血流到缺血周边区域,伴持续的灌注缺陷,仅有部分到缺血区域;3级,静脉晚期可见缓慢但是完全的血流到缺血区域;4级,通过逆行灌注血流快速而完全地灌注到整个缺血区域。
1.DSA对颅内外动脉狭窄和动脉瘤的诊断
DSA能真实地显现脑血管形态、结构和循环时间,可清楚显示动脉管腔狭窄(见图16-5A~D)、闭塞以及侧支循环等情况,还能明确粥样硬化斑块表面是否有溃疡形成,以及各种动脉瘤(见图16-5E~H),对缺血性脑血管病患者以及动脉瘤是否采取介入治疗起着重要的指导作用。目前DSA仍是诊断颅内动脉狭窄或闭塞,以及动脉瘤的金标准,但由于各种非侵袭性检查技术的不断完善,在诊断颅内动脉狭窄方面有可能逐步取代DSA[68]。
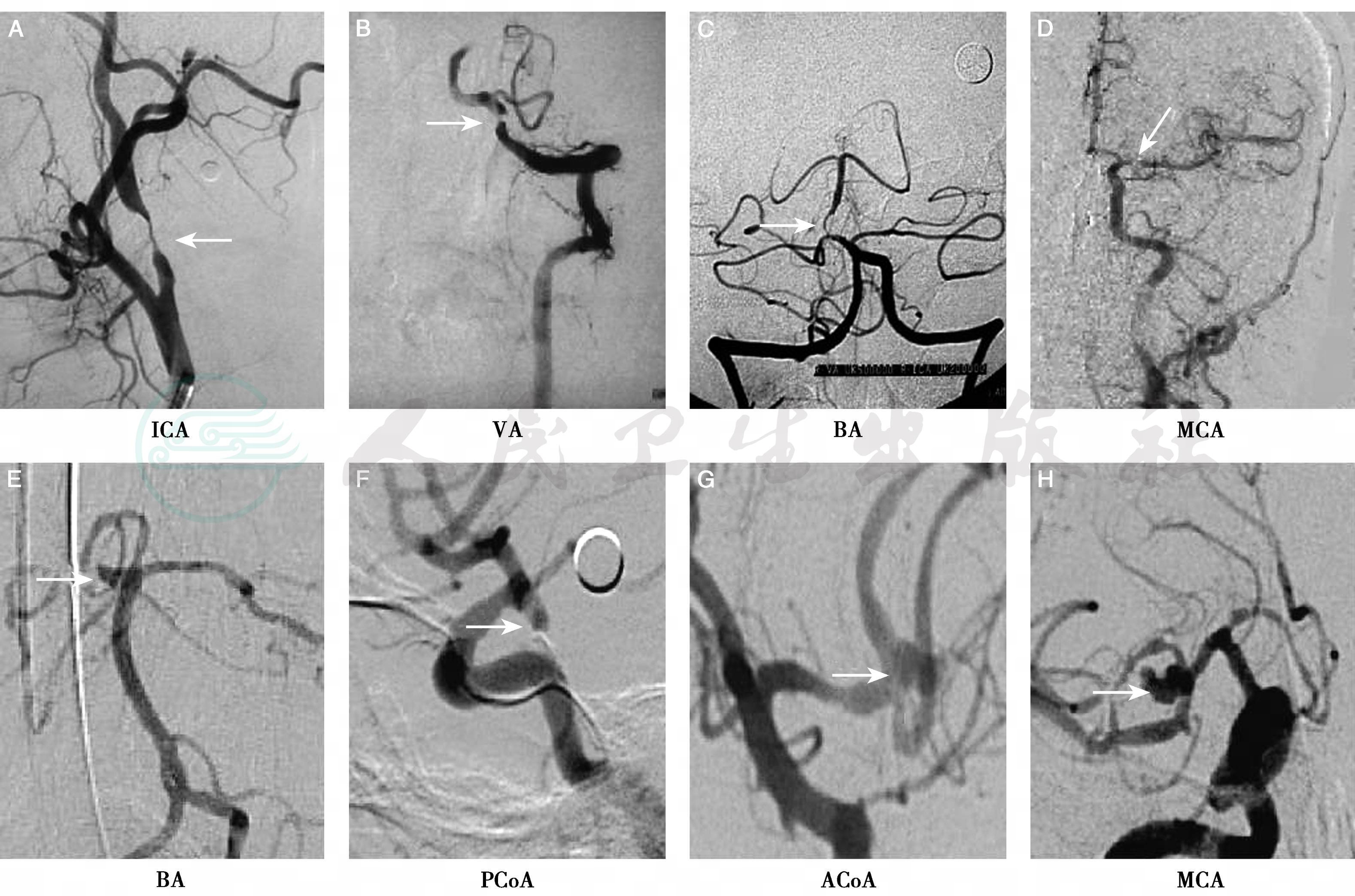
图16-5 数字减影血管造影对脑动脉狭窄和动脉瘤的诊断
A~D:不同部位的脑动脉狭窄(箭头);E~H:不同部位的动脉瘤(箭头)。ICA:颈内动脉;VA:椎动脉;BA:基底动脉;MCA:大脑中动脉;PCoA:后交通动脉;ACoA:前交通动脉
2.DSA对脑静脉窦血栓形成的诊断
经动脉顺行性造影,不仅能显示各静脉窦的充盈形态、病变静脉窦闭塞程度,还能通过对比剂测定静脉窦显影时间,一般超过6秒为静脉窦显影延迟[69]。
3.DSA对动脉夹层的诊断
DSA一直被认为是诊断和随访动脉夹层的“金标准”。然而,这种技术有时也不能给出动脉夹层的确切诊断,因为它不能显影动脉壁和管壁内血肿的形态[70]。DSA是诊断颈动脉夹层的可靠手段(图16-6)。影像学所显示的夹层部位和形态特征与患者的临床表现的关系具有一定的规律。DSA有其局限性,即动脉壁的厚度及外形不可见。最常见的是线样征,指从颈动脉窦远处长而逐渐变细的狭窄,通常为偏心且不规则,还有珍珠征(指管腔)、局灶性狭窄、远端扩张为夹层动脉瘤、火焰征(指管腔逐渐变细至闭塞)、夹层动脉瘤、管腔内血栓形成、血管串珠样狭窄(通常提示存在纤维及营养不良或其他血管病)[71]。
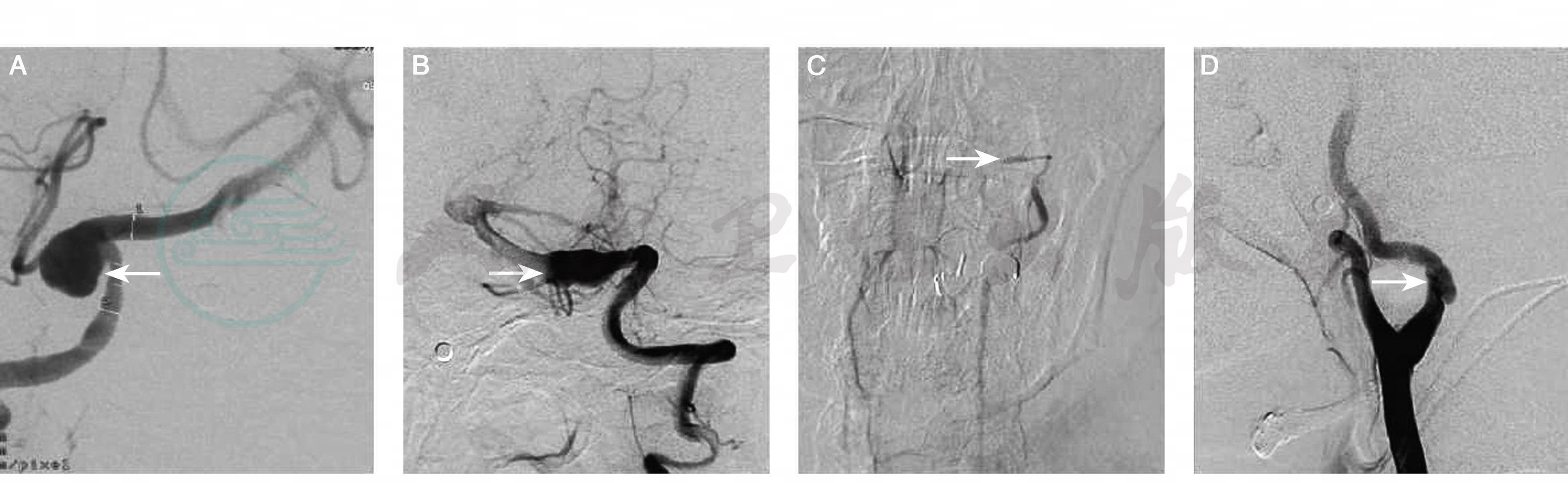
图16-6 头颈动脉夹层的数字减影血管造影表现(箭头)
A:囊状瘤样扩张;B:梭形扩张;C:珠线征;D:双腔征
(四)高分辨率血管壁MRI(HRMRI)
近年已应用于临床的3.0T HRMRI是新兴的血管成像技术,不仅可以进行管腔成像,而且能够直观显示管壁结构。高分辨率血管壁MR成像检查主要包括2D和3D序列两大类,2D序列即常规的黑血T1W加权成像;3D序列包括亮血的TOF-MRA、黑血的磁化准备快速梯度回波序列(magnetization prepared rapid acquisition gradientecho)、采用反转恢复和多回波来评估出血的扰相梯度回波脉冲序列(spoiled gradient recalled echo pulse sequence for hemorrhage assessment using inversion recovery and multiple echoes)、各向同性容积采集快速自旋回波(volumetric isotropic TSE acquisition)、三维运动敏感驱动快速梯度回波(3D motionsensitizing driven equilibrium rapid gradient echo sequence)、非对比血管成像与斑块内出血同时成像(simultaneous noncontrast angiography and intraplaquehemorrhage,SNAP)等[72]。
上述序列在相同的扫描时间下,2D和3D序列具有相似的信噪比及形态学测量(如管腔面积、管壁面积及厚度等),但也有着各自的优缺点。其中SNAP序列可以同时管腔和管壁成像,通过1次采集同时观察2个动脉粥样硬化的相关信息,即管腔狭窄情况及斑块内出血信息。SNAP是近年来出现的最新成像序列,主要用来观察血管壁斑块内出血,可通过提高动脉斑块出血、管壁及管腔的对比,以及增加血流抑制的效果,提高出血的检出率。在测量管腔大小方面,SNAP与3D-TOF具有很好的相关性,SNAP的空间分辨率近似于对比增强MRA技术,可以达到0.5mm3,同时对流动伪影敏感度较低,避免了慢血流带来的饱和效应。SNAP是观察颅内外血管壁斑块出血和管腔的首选序列[73]。
HRMRI目前已成熟应用于颅外颈动脉,可以准确评估颈动脉狭窄程度、血管夹层(图16-7)、动脉斑块的诊断[74]。3.0T的黑血HRMRI能够客观地显示多种类型的颈动脉系统斑块,对颈动脉系统斑块进行定量分析,从而达到评估黑血MRA的临床价值以及预防颈部斑块的形成。然而,黑血MRA在检测斑块时是有缺点的,如较长的扫描时间、无法重建图像、在异常部位对血管的检测范围受限。再者,黑血MRA在临床实践的功效也是有限的。因此,亮血与黑血MRA的联合使用被认为是鉴别脑血管斑块、血管腔狭窄、动脉粥样硬化斑块类型、斑块风险最有效的检查方法。这种组合检查方法为临床早期阶段的颈动脉系统斑块的治疗提供了可靠的方法[75]。
【推荐意见】
·CTA是颅内动脉瘤引起的自发性蛛网膜出血的首选检查(Ⅰ级推荐,B级证据),但“金标准”仍然是DSA(Ⅰ级推荐,A级推荐)。
·对急性脑梗死超过3小时的患者,特别是考虑血管内治疗的患者,可进行诊断性血管影像学检查(Ⅰ级推荐,A级证据)。
·CTA可以预测血肿扩大,CTP可以辅助评价周围血肿血流灌注情况(Ⅱ级推荐,B级证据)。
·MRI和MRV是诊断脑静脉窦血栓形成的无创、敏感和准确的首要检查方法,并且是随诊的主要检查方法(Ⅰ级推荐,A级推荐)。
·DSA是脑静脉窦血栓形成的诊断“金标准”,可作为MRI和MRV的补充检查手段(Ⅰ级推荐,A级推荐)。
·CE-MRA能准确地评估颅外血管的狭窄程度,同时可检测动脉瘤及动脉夹层(Ⅰ级推荐,A级推荐)。
·急性脑卒中后需根据患者情况行影像学检查(CTA、MRA、DSA、TCD、颈动脉超声等)评估颅内外血管情况(Ⅰ级推荐,A级推荐)。
三、脑灌注成像技术
利用CTP和MRP进行的灌注影像已经成为检查脑卒中患者脑血流灌注情况的常规手段。尽管还缺乏一定的证据证明灌注影像是脑卒中评估的一项必不可少的检查,多个中心已经开始利用灌注影像筛选患者进行血管重建。
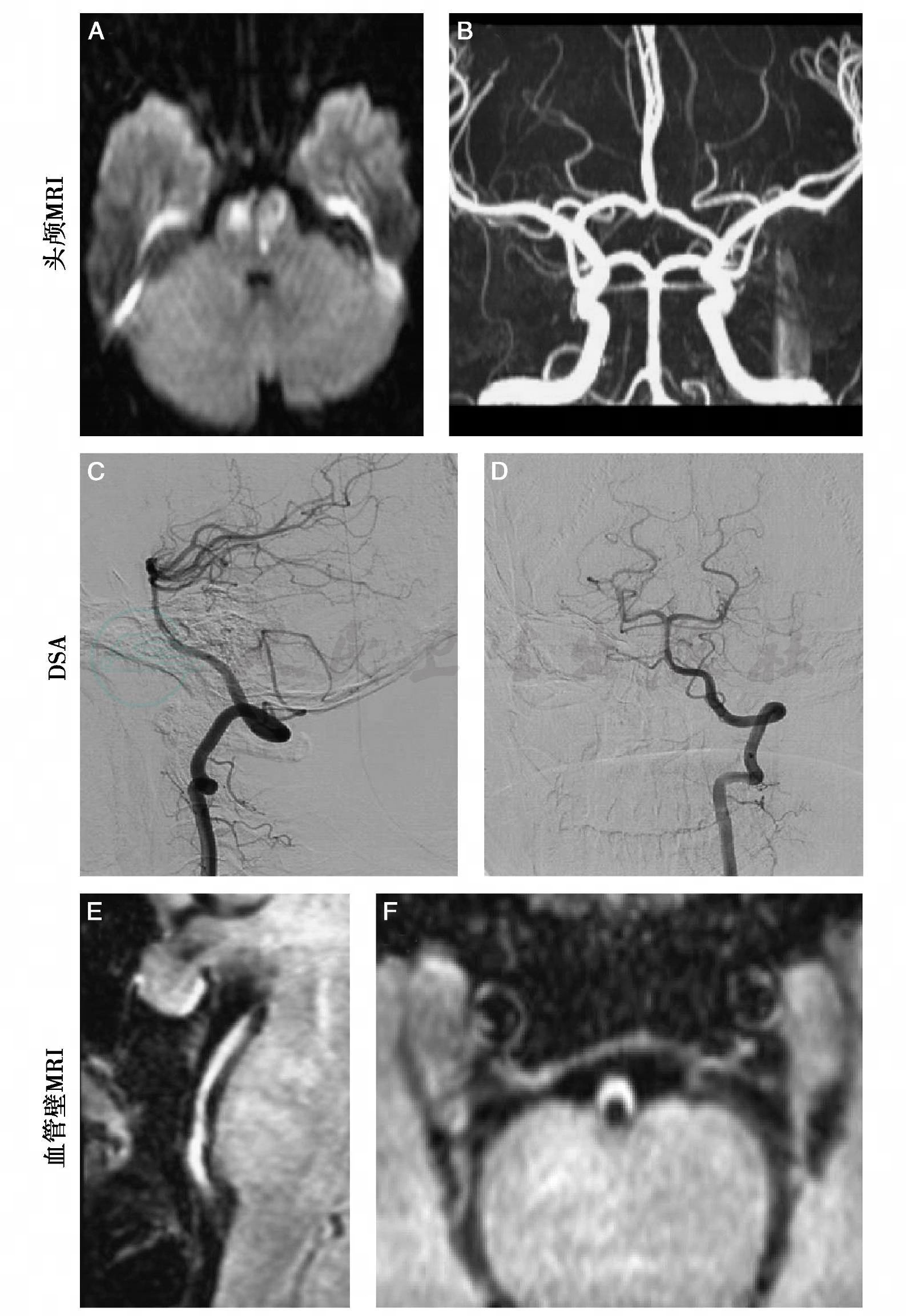
图16-7 椎基底动脉夹层的影像
患者,男性,31岁,突发失语伴头晕6小时。A:头颅磁共振成像(MRI)示脑干梗死;B:磁共振动脉造影(MRA)正常;C、D:MRA及数字减影血管造影(DSA)正常;E、F:高分辨血管壁MRI示椎基底动脉夹层,从右侧椎动脉V4段至基底动脉尖端
CTP检查的推荐参数:16排以上CT可以进行脑灌注成像,排数增加可以减少造影剂用量,并提高注射速度。320排CT中CTP的造影剂注射速度为5m l/s,造影剂用量为50m l,分辨率可以到0.5mm3,延迟扫描时间为4秒,含有25个动态[76]。
MRP检查的推荐参数:1.5T或者3T的MRI均可以进行全脑灌注成像,一般使用梯度回波平面成像,获得T2WI对比。造影剂注射速度为3~5ml/s,跟随15ml生理盐水团注。造影剂用量为15ml,如翻倍(30ml)使用造影剂则灌注信噪比明显提高。重复时间为2000ms,回波时间为60ms(3T中为回波时间为30ms),分辨率可以到2.5mm3,注射造影剂和扫描同时开始,含有25~40个动态[77-78]。
(一)CTP
CTP是指静脉注射造影剂的同时对选定的层面进行连续多次扫描,以获得该层面内每一个像素的时间-密度曲线。此项检查可限于一个感兴趣的区域,典型的有基底节区和侧脑室,因为其包含了前、中、后脑动脉供应的区域。在信号简化分析动静脉的时间减弱曲线之后,许多脑循环的参数可被定量地获得,包括脑血容量(cerebral blood volume)、脑血流量(cerebral blood flow)、对比剂平均通过时间(mean transit time,MTT)、峰值时间(time to peak)等。通过比较这些参数可将梗死灶和可逆转的缺血半暗带区分开来,从而选择更合适的治疗方案,使获益最大化且再灌注损伤最小化。
对脑灌注的评估是在中心体积原则即脑血流量=脑血容量/MTT基础上,应用于急性脑梗死是基于经验和理论得来的。按照这个模型,脑梗死病灶组织表现为严重的脑血流量(<30%)和脑血容量(<40%)降低并伴有MTT的延长,而半暗带区域表现为:①MTT延长伴有轻度的脑血流量降低(仍然>60%)且脑血容量正常或升高(80%~100%或更高);②MTT明显延长伴有显著的脑血流量降低(仍然>30%)和脑血容量轻微降低(>60%)[79]。
1.CTP对短暂性脑缺血发作(TIA)的诊断
随着CTP技术的发展,其联合CTA在TIA诊断中起到了重要的作用。多个临床研究发现TIA患者CTP异常的阳性率为35%[77,80]。2014年,Mehta等[81]就全脑灌注320排CT扫描在TIA患者中的应用得出结论,74.19%(46/62)患者TTP延长,并且CTP的结果与TIA患者危险因子评分(ABCD2评分)相关。同时联合应用CTA检查,还可以显示头颈动脉的狭窄或闭塞病变,发现TIA的病因。因此,应用多层螺旋CT(multi-slice CT,MSCT)一次检查即可获得解剖学、血流动力学和病因等多方面信息,对临床重新认识和及时治疗TIA同样具有重要价值,未来多模式CT对TIA的诊断价值还待挖掘[82]。
2.CTP检测缺血半暗带
CTP在检测缺血性脑损伤及区分梗死灶和缺血半暗带上准确性很高。CTP检测脑缺血和梗死灶的敏感度最低为67%[83]。根据梗死和缺血区域的匹配情况,将CTP图像分为两种模式:一是有利的“小梗死核心/大半暗带区域”的CT灌注图像模式,这些患者有可能受益于溶栓治疗;另外一个是不利的“大梗死核心/小半暗带区域”的CT灌注图像模式,此类患者对溶栓治疗获益率相比较低。然而最终的治疗疗效取决于是否及时实现再灌注。
另外,相关研究表明CTP检查可对血肿及其周边的局部血流动力学变化进行评估,从而辅助脑出血诊断及预后的判断[84-85]。
3.CTP在侧支循环中的应用
侧支循环与脑卒中的复发、预后、溶栓疗效以及出血转化密切相关[86]。CTP能定量反映侧支循环的情况。由于侧支循环的代偿血流回程路线较长,血流缓慢,峰值时间、MTT则表现出时间延长的特点,其中以TTP延长具有较高的敏感度[87-88]。临床上,CTA及CTP可以一次完成,CTA能够发现大血管狭窄或闭塞的情况,CTP能够反映缺血区域,对指导缺血性脑卒中的治疗价值很大。但CTP需要后处理,往往会耽误一定的时间。区域软脑膜评分(Regional Leptomeningeal Score,rLMC)系统简便,可操作性强,能够很好地预测急性缺血性脑卒中患者的预后。rLMC评分的总分为20分,17~20分患者总体预后很好,11~16分患者预后较好,而<11分患者预后较差,可进一步指导缺血性脑卒中的治疗[89]。
【推荐意见】
·CTP联合CTA检测可评估血管狭窄,根据峰值时间延迟等数据预测TIA危险分级(Ⅱ级推荐,B级证据)。
·CTP帮助临床区分永久性的梗死和可逆转的缺血半暗带存在,有助于溶栓和预后的判断(Ⅱ级推荐,B级证据)。
·CTP可以辅助评价周围血肿血流灌注情况(Ⅲ级推荐,B级证据)。
(二)MRP
MRP是一种通过注入造影剂来检查受损组织从而评估大脑微循环灌注的磁共振半定量方法,与CT灌注不同的是T2WI效应可导致信号强度的减弱因而无法提供定量数据,这些参数主要在MTT、脑血容量的脑血流量中呈现(见文末彩图16-8)。
相比多模式CT技术,MR需要更长的时间去操作、更昂贵的对比媒介(造影剂),并且很多急诊情况下无法使用(如没有可用的仪器或有禁忌证),但没有辐射是其优点。
1.MRP对TIA的诊断
MRP能判断缺血区域及程度,对识别低血流动力学TIA价值很大。
2.MRP对急性卒中的诊断
有研究对MRP不同参数对诊断卒中的敏感度、特异度进行比较,发现脑血容量敏感度、特异度分别为74%、100%;而对于脑血流量,MTT敏感度和特异度相同,分别为84%、96%;脑血容量对梗死病灶的判断更为准确[90]。
3.MRP对缺血半暗带的诊断
弥散与灌注错配的区域被考虑为缺血半暗带的MRI的表现,并且为医师提供了有关梗死灶进展的预测信息。在检测缺血半暗带时,MRP和DWI之间的区别可提供值得信赖的信息。当两个区域信号匹配时,则没有缺血半暗带。当DWI高信号区域大于MRP高信号区域时,存在缺血半暗带区域,可能从再灌注治疗中获益。弥散/灌注的有效性被许多研究所支持,也表明了有弥散与灌注错配区域的患者更易发生脑梗死的进展,这些患者也更容易从静脉溶栓或血管内治疗中获益。
【推荐意见】
·MRP识别低灌注区域优于CTP,有助于扩大时间窗溶栓患者的选择(Ⅱ级推荐,B级证据)。
·MRP可帮助诊断短暂性脑缺血发作(Ⅱ级推荐,B级证据)。
·基线MRP病变体积有助于预测临床卒中的严重程度(Ⅲ级推荐,C级证据)。
四、其他MRI成像技术的应用
(一)DTI
DTI是MR扩散加权成像基础上发展起来的一种新的成像方法,它通过在多个方向上施加弥散敏感梯度来测量水分子弥散的程度和方向性,比DWI的表观扩散系数(ADC)值更能准确并全面地反映弥散信息。DTI定量分析最常用的参数为各向异性分数、ADC、平均弥散率、弥散张量纤维束成像。DTI同普通DWI相比,不仅可以准确评价不同时期脑梗死时脑灰、白质内水分子弥散各向异性改变的特点,并且可以经过重建的特征矢量图,显示出慢性期脑梗死病灶远端神经纤维束走向的改变及其完整性(见文末彩图16-9),从而为神经轴突的完整性评价提供信息。研究证实发病24小时内的缺血性脑梗死中,病灶的扩散各向异性显著降低,可以根据降低程度来区别梗死核心区及缺血半暗带[91]。DTI不仅可以准确评价不同时期脑梗死水分子扩散各向异性改变的特点,还能通过纤维束示踪成像显示脑梗死病灶远端神经纤维束走向改变及其完整性,从而能评价脑梗死患者预后。Thomalla等[92]对发病2~16天内的亚急性期的轻、中度幕上缺血性脑卒中患者行DTI检查,认为DTI在变性程度的判断及患者运动功能转归的预测上具有一定的优势。
(二)BOLD
BOLD的序列通过检测大脑皮质组织磁特性的短暂变化,来研究在体脑的功能磁共振成像(functional magnetic resonance imaging)。目前已广泛用于脑的生理、病理及人的心理活动等研究领域,成为研究脑功能活动的一种重要的无损伤探测手段。
BOLD针对神经元活动伴随的大脑氧化代谢率及血流量的改变来识别功能区域,建立刺激与响应之间的联系,能显示不同脑区的功能、发生机制及异常表现。当大脑局部发生梗死时,缺血坏死灶及周围缺血半暗带均表现出BOLD信号的降低,降低程度与缺血程度呈正相关,因此可以根据BOLD信号下降水平来评估患者预后情况。除了对缺血性脑卒中的判断外,还可以通过BOLD序列观察到脑梗死患者早期的患侧手运动的兴奋区均位于同侧大脑[93]。康复过程中伴随着脑功能区的重建,通过BOLD对脑梗死康复功能区的定位进行影像学研究具有明显优势。Ono等[94]将BOLD序列与脑卒中恢复期患者偏瘫侧手的移动情况进行对应,发现其对于评估神经功能的恢复具有一致性。Tsai等[95]研究认为BOLD序列可以用来评估神经血管活动,并且对脑梗死病灶的活性进行判定。
(三)磁共振弹性成像
磁共振弹性成像(magnetic resonance elastography,MRE)是一种发展迅速的用来定量地测量组织力学特性的新型非创伤性的成像方法,主要通过评价机械波在组织中的传播,从而提供关于组织弹性的信息,是目前唯一能直观、准确并且定量反映脑组织弹性的无创性影像技术[96]。正常组织与病变组织的弹性存在很大差异。通过MRE测量与评判脑组织的弹性,能够为脑部疾病的诊断提供一定的帮助。目前已经有研究将MRE应用到脑肿瘤的鉴别诊断上[97],从而可以对病情的预后作出评估。徐磊等[98]研究发现,MRE的相位图可显示剪切波在脑组织内的传播,弹性图像显示了脑灰质与白质之间的弹性变化。现在MRE在人脑组织的研究刚刚起步,在脑肿瘤的临床诊断方面具有重要的潜在临床应用价值,是一种全新的反映脑组织生物力学特性的无创性成像方法。
(四)MRS
MRS利用质子在不同化合物中共振频率轻微不同(即化学位移现象),来测定化合物的组成成分及其含量,是目前唯一无损伤探测活体组织代谢物的影像学方法。MRS通过测定缺血脑组织代谢产物的浓度,直接反映脑组织的代谢状况。有多种核素能进行MRS检查,其中最常用者为质子磁共振波谱,可检测氮-乙酰天冬氨酸(NAA)、乳酸、胆碱、肌酸、磷酸肌酸等代谢产物。乳酸峰位于1.33ppm处,正常脑组织无乳酸峰,而脑缺血发生数分钟,线粒体功能出现障碍,糖代谢从有氧氧化转为无氧酵解而产生乳酸,此时MRS即可检测到乳酸峰(图16-10)。通常在超急性期乳酸即达到高峰,乳酸升高程度与组织的缺血坏死程度呈正相关,梗死核心区的乳酸升高程度明显。应用MRS除了能在超急性期评价缺血脑组织损伤的严重程度外,还能对患者的预后及治疗疗效进行评估。动物研究[99]及临床研究[100]先后证实了NAA是神经元存活的标志物,NAA峰的降低与神经元坏死密切相关,NAA峰值越低,患者的预后越差。MRS可作为常规MRI检查的补充手段,从代谢的角度对患者的病情进展、预后等进一步进行评估。
(五)SWI
SWI是一项新的对组织磁化率差异及血氧水平依赖效应敏感的对比增强技术,采用三维采集、薄层重建、完全流动补偿及长回波时间的梯度回波序列(图16-11)。磁敏感加权成像序列,可早期诊断脑出血,发现缺血性脑卒中出血转化及微出血,为缺血性脑卒中血流动力学改变提供信息。SWI对于出血性转化敏感,有研究认为其检出自发性出血性转化能力早于CT。Huang等[101]的一项纳入44例患者的研究表明,14例SWI检出微出血,19例检出磁敏感血管征。
静脉血栓形成在SWI图上能有很好的检出率,尤其是皮质静脉及静脉窦血栓形成。SWI序列检出1~3天内的静脉窦或静脉血栓形成的敏感度分别为90%[102]。
2011年,Ayaz等[103]研究轻度认知功能障碍患者,利用SWI检出了直径1mm的脑微出血。2014年的一项荟萃分析表明,相位成像(phase-sensitive imaging)或者SWI较T2WI检测脑微出血更为合适,并用该序列长期评估脑微出血可以更好地控制和管理烟雾病[104]。
【推荐意见】
有条件时可在研究或临床中使用以下技术:
·BOLD序列可评估神经血管功能,以及脑梗死病灶周围脑血流灌注情况(Ⅱ级推荐,B级证据)。
·MRS早期评价缺血脑组织的代谢改变、缺血组织损伤的严重程度,判断患者的预后、治疗效果(Ⅲ级推荐,C级证据)。
·SWI主要用于微出血诊断,也用于梗死性出血转化的判断和静脉或静脉窦血栓形成的诊断(Ⅱ级推荐,B级证据)。
(徐运)
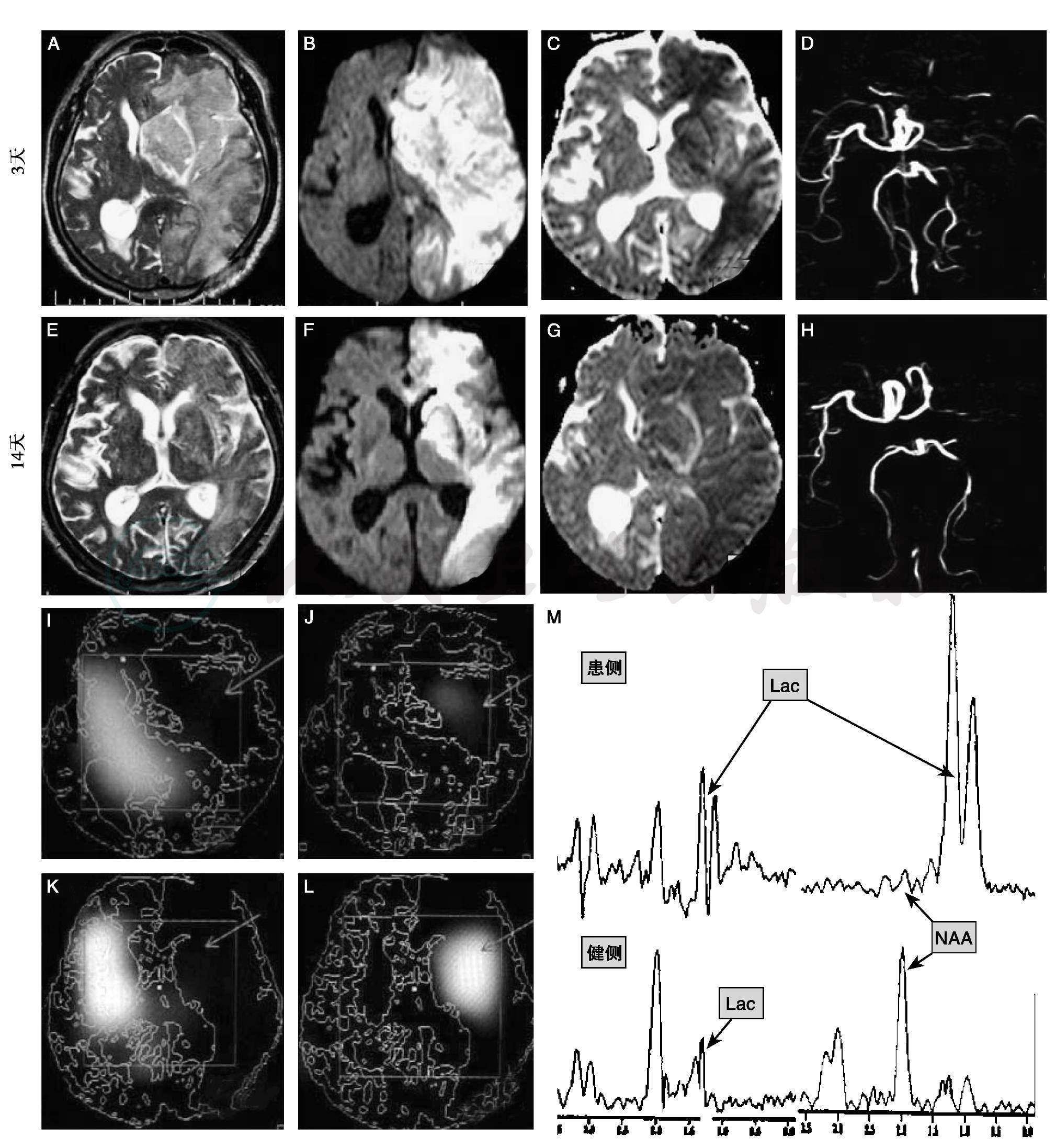
图16-10 磁共振成像-磁共振波谱成像(MRI-MRS)
患者右侧上下肢偏瘫、言语不清、昏迷3天入院。A~H:A和E为T2WI,B和F为弥散加权成像,C和G为表观扩散系数(ADC),D和H为磁共振动脉造影,分别提示病程3天和14天脑梗死和血管闭塞的情况;I:发病3天时的氮-乙酰天冬氨酸(NAA)-MRS图,病灶内NAA明显下降(箭头);J:发病3天时的乳酸(Lac)-MRS图,病灶内可以检测到乳酸,说明脑组织为缺血缺氧状态(箭头);K:发病14天时的NAA-MRS图,病灶内NAA明显下降,几乎全部消失,证明该区内神经组织已完全坏死(箭头);L:发病14天时的乳酸-MRS图,病灶内可以检测到大量乳酸,与发病3天时比较,明显升高,说明脑组织的缺血缺氧状态继续加重(箭头);M:分别是发病3天和14天时患、健侧的MRS线图,发病3天时对侧正常脑组织内亦检测到乳酸,说明对侧脑组织为代偿性缺血缺氧状态
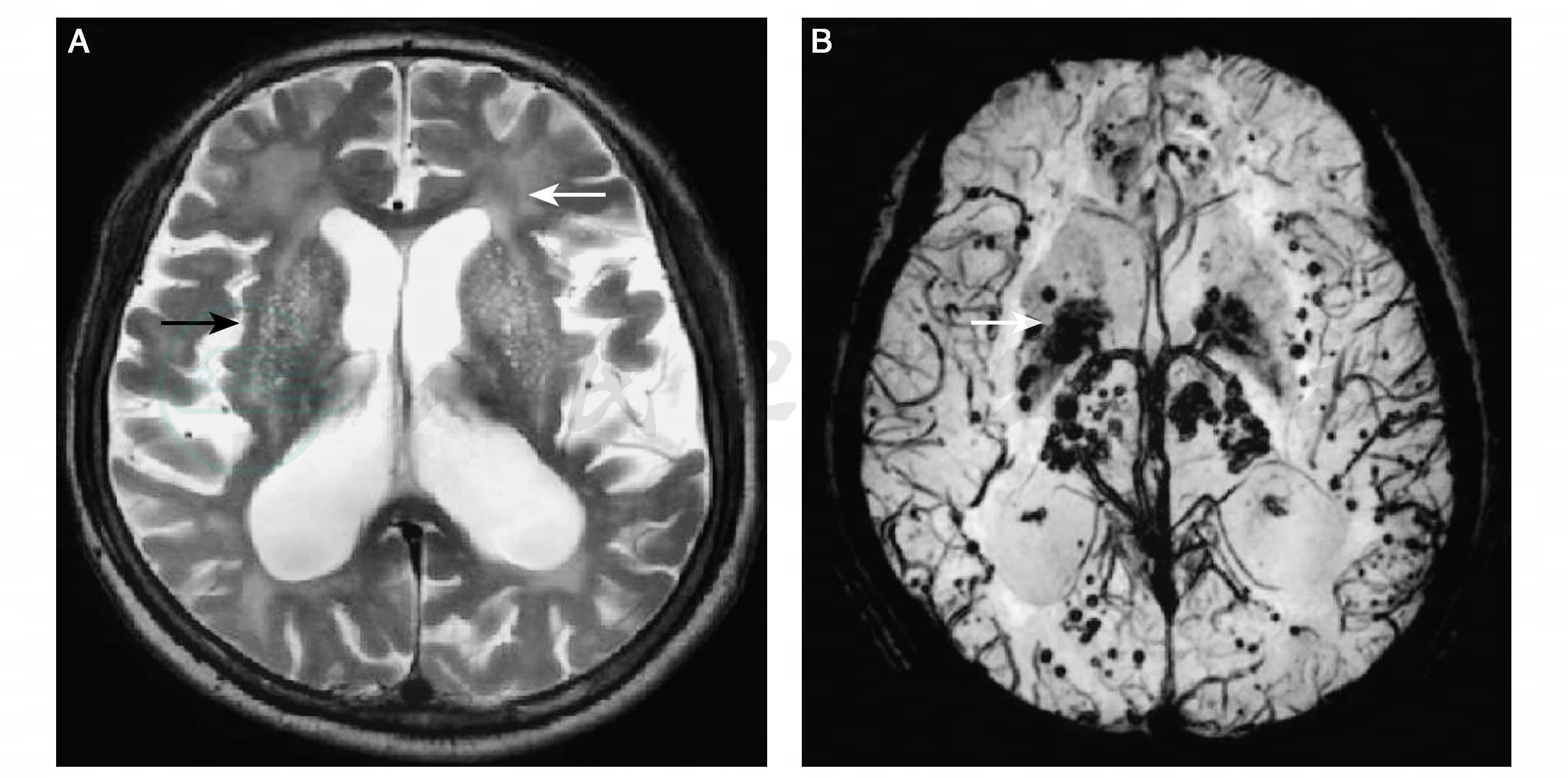
图16-11 磁敏感加权成像(SWI)
患者,男性,75岁,进展型血管性认知障碍并阿尔茨海默病。A:可见血管周围间隙(黑色箭头),广泛室周脱髓鞘改变(白色箭头);B:可见微出血(箭头)
[1]中华医学会神经病学分会,中华医学会神经病学分会脑血管病学组.中国急性缺血性脑卒中诊治指南2014[J].中华神经科杂志,2015,48(4):246-257.
[2]Latchaw RE,Alberts MJ,Lev MH,et al.Recommendations for imaging of acute ischemic stroke:a scientific statement from the American Heart Association[J].Stroke,2009,40(11):3646-3678.
[3]Khosravani H,Mayer SA,Demchuk A,et al.Emergency noninvasive angiography for acute intracerebral hemorrhage[J].AJNR Am JNeuroradiol,2013,34(8):1481-1487.
[4]Lourenco AP,Mayo-Smith WW,Tubbs RJ,et al.Does 16-detector computed tomography improve detection of non-traumatic subarachnoid hemorrhage in the Emergency Department[J].JEmerg Med,2009,36(2):171-175.
[5]Sidman R,Connolly E,Lemke T.Subarachnoid hemorrhage diagnosis:lumbar puncture is still needed when the computed tomography scan is normal[J].Acad Emerg Med,1996,3(9):827-831.
[6]Westerlaan HE,van Dijk JM,Jansen-van derWeide MC,etal.Intracranial aneurysms in patientswith subarachnoid hemorrhage:CT angiography as a primary examination tool for diagnosis-systematic review and meta-analysis[J].Radiology,2011,258(1):134-145.
[7]Cronin CA,Langenberg P,Dutta TM,etal.Transition of European Cooperative Acute Stroke StudyⅢresults to clinical practice:ninety-day outcomes in a US cohort[J].Stroke,2013,44(12):3544-3546.
[8]Cronin CA,Sheth KN,Zhao X,et al.Adherence to Third European Cooperative Acute Stroke Study 3-to 4.5-hour exclusions and association with outcome:data from Getwith the Guidelines-Stroke[J].Stroke,2014,45(9):2745-2749.
[9]Tomura N,Uemura K,Inugami A,et al.Early CT finding in cerebral infarction:obscuration of the lentiform nucleus[J].Radiology,1988,168(2):463-467.
[10]TruwitCL,Barkovich AJ,Gean-Marton A,etal.Loss of the insular ribbon:another early CT sign of acutemiddle cerebral artery infarction[J].Radiology,1990,176(3):801-806.
[11]von Kummer R,Holle R,Gizyska U,et al.Interobserver agreement in assessing early CT signs ofmiddle cerebral artery infarction[J].AJNR Am JNeuroradiol,1996,17(9):1743-1748.
[12]Grotta JC,Chiu D,Lu M,et al.Agreement and variability in the interpretation of early CT changes in stroke patients qualifying for intravenous rtPA therapy[J].Stroke,1999,30(8):1528-1533.
[13]Schriger DL,Kalafut M,Starkman S,et al.Cranial computed tomography interpretation in acute stroke:physician accuracy in determining eligibility for thrombolytic therapy[J].JAMA,1998,279(16):1293-1297.
[14]Roberts HC,Dillon WP,Furlan AJ,et al.Computed tomographic findings in patients undergoing intra-arterial thrombolysis for acute ischemic stroke due to middle cerebral artery occlusion:results from the PROACTⅡ trial[J].Stroke,2002,33(6):1557-1565.
[15]Lovblad KO,Baird AE.Computed tomography in acute ischemic stroke[J].Neuroradiology,2010,52(3):175-187.
[16]Lyden P.Earlymajor ischemic changes on computed tomography should not preclude use of tissue plasminogen activator[J].Stroke,2003,34(3):821-822.
[17]von Kummer R.Earlymajor ischemic changes on computed tomography should preclude use of tissue plasminogen activator[J].Stroke,2003,34(3):820-821.
[18]Patel SC,Levine SR,Tilley BC,et al.Lack of clinical significance of early ischemic changes on computed tomography in acute stroke[J].JAMA,2001,286(22):2830-2838.
[19]Wardlaw JM,Mielke O.Early signs of brain infarction at CT:observer reliability and outcome after thrombolytic treatment-systematic review[J].Radiology,2005,235(2):444-453.
[20]Dzialowski I,Hill MD,Coutts SB,et al.Extent of early ischemic changes on computed tomography(CT)before thrombolysis:prognostic value of the Alberta Stroke Program Early CT Score in ECASSⅡ[J].Stroke,2006,37(4):973-978.
[21]Tomsick T,Brott T,Barsan W,et al.Prognostic value of the hyperdensemiddle cerebral artery sign and stroke scale score before ultraearly thrombolytic therapy[J].AJNR Am JNeuroradiol,1996,17(1):79-85.
[22]Bastianello S,Pierallini A,Colonnese C,et al.Hyperdensemiddle cerebral artery CT sign.Comparison with angiography in the acute phase of ischemic supratentorial infarction[J].Neuroradiology,1991,33(3):207-211.
[23]Paliwal PR,Ahmad A,Shen L,et al.Persistence of hyperdensemiddle cerebral artery sign on follow-up CT scan after intravenous thrombolysis is associated with poor outcome[J].Cerebrovasc Dis,2012,33(5):446-452.
[24]Aries MJ,Uyttenboogaart M,Koopman K,et al.Hyperdensemiddle cerebral artery sign and outcome after intravenous thrombolysis for acute ischemic stroke[J].JNeurol Sci,2009,285(1-2):114-117.
[25]Bonneville F.Imaging of cerebral venous thrombosis[J].Diagn Interv Imaging,2014,95(12):1145-1150.
[26]Garetier M,Rousset J,Pearson E,et al.Value of spontaneous hyperdensity of cerebral venous thrombosis on helical CT[J].Acta Radiol,55(10):1245-1252.
[27]Linn J,Pfefferkorn T,Ivanicova K,et al.Noncontrast CT in deep cerebral venous thrombosis and sinus thrombosis:comparison of its diagnostic value for both entities[J].AJNR Am JNeuroradiol,2009,30(4):728-735.
[28]Bash S,Villablanca JP,Jahan R,etal.Intracranial vascular stenosis and occlusive disease:evaluation with CT angiography,MR angiography,and digital subtraction angiography[J].AJNR Am JNeuroradiol,2005,26(5):1012-1021.
[29]Edlow JA.Evidence-based guideline:the role of diffusion and perfusion MRI for the diagnosis ofacute ischemic stroke:reportof the Therapeutics and Technology Subcommittee of the American Academy of Neurology[J].Neurology,2011,76(23):2036.
[30]Perkins CJ,Kahya E,Roque CT,etal.Fluid-attenuated inversion recovery and diffusion-and perfusion-weighted MRIabnormalities in 117 consecutive patients with stroke symptoms[J].Stroke,2001,32(12):2774-2781.
[31]Wiener JI,King JT,Jr,Moore JR,etal.The value of diffusion-weighted imaging for prediction of lasting deficit in acute stroke:an analysis of 134 patients with acute neurologic deficits[J].Neuroradiology,2001,43(6):435-441.
[32]Merwick A,Werring D.Posterior circulation ischaemic stroke[J].BMJ,2014,348:g3175.
[33]Sanak D,Horak D,Herzig R,etal.The role ofmagnetic resonance imaging for acute ischemic stroke[J].Biomed Pap Med Fac Univ Palacky Olomouc Czech Repub,2009,153(3):181-187.
[34]Desmond PM,Lovell AC,Rawlinson AA,et al.The value of apparent diffusion coefficientmaps in early cerebral ischemia[J].AJNR Am JNeuroradiol,2001,22(7):1260-1267.
[35]Al-Khaled M,Matthis C,Munte TF,et al.The incidence and clinical predictors of acute infarction in patientswith transient ischemic attack using MRI including DWI[J].Neuroradiology,2013,55(2):157-163.
[36]Purroy F,Montaner J,Rovira A,etal.Higher risk of further vascular events among transient ischemic attack patientswith diffusion-weighted imaging acute ischemic lesions[J].Stroke,2004,35(10):2313-2319.
[37]Arnould MC,Grandin CB,Peeters A,et al.Comparison of CT and three MR sequences for detecting and categorizing early(48 hours)hemorrhagic transformation in hyperacute ischemic stroke[J].AJNR Am JNeuroradiol,2004,25(6):939-944.
[38]Boulanger JM,Coutts SB,Eliasziw M,et al.Cerebralmicrohemorrhages predict new disabling or fatal strokes in patients with acute ischemic stroke or transient ischemic attack[J].Stroke,2006,37(3):911-914.
[39]Noguchi K,Ogawa T,Inugami A,et al.Acute subarachnoid hemorrhage:MR imaging with fluid-attenuated inversion recovery pulse sequences[J].Radiology,1995,196(3):773-777.
[40]Altinkaya N,Demir S,Alkan O,et al.Diagnostic value of T2∗-weighted gradient-echo MRI for segmental evaluation in cerebral venous sinus thrombosis[J].Clin Imaging,2014,39(1):15-19.
[41]Tong E,Hou Q,Fiebach JB,et al.The role of imaging in acute ischemic stroke[J].Neurosurg Focus,2014,36(1):E3.
[42]Koelemay MJ,Nederkoorn PJ,Reitsma JB,et al.Systematic review of computed tomographic angiography for assessment of carotid artery disease[J].Stroke,2004,35(10):2306-2312.
[43]Nguyen-Huynh MN,Wintermark M,English J,et al.How accurate is CT angiography in evaluating intracranial atherosclerotic disease[J].Stroke,2008,39(4):1184-1188.
[44]Saba L,AnzideiM,Piga M,etal.Multi-modal CT scanning in the evaluation of cerebrovascular disease patients[J].Cardiovasc Diagn Ther,2014,4(3):245-262.
[45]Sameshima T,Futami S,Morita Y,et al.Clinical usefulness of and problems with three-dimensional CT angiography for the evaluation of arteriosclerotic stenosis of the carotid artery:comparison with conventional angiography,MRA,and ultrasound sonography[J].Surg Neurol,1999,51(3):301-308;discussion 308-309.
[46]Flis CM,Jager HR,Sidhu PS.Carotid and vertebral artery dissections:clinical aspects,imaging features and endovascular treatment[J].Eur Radiol,2007,17(3):820-834.
[47]Chen CJ,Tseng YC,Lee TH,etal.Multisection CT angiography compared with catheter angiography in diagnosing vertebral artery dissection[J].AJNR Am JNeuroradiol,2004,25(5):769-774.
[48]Provenzale JM.Dissection of the internal carotid and vertebral arteries:imaging features[J].AJR Am JRoentgenol,1995,165(5):1099-1104.
[49]Provenzale JM,Sarikaya B.Comparison of test performance characteristics of MRI,MR angiography,and CT angiography in the diagnosis of carotid and vertebral artery dissection:a review of the medical literature[J].AJR Am JRoentgenol,2009,193(4):1167-1174.
[50]Thompson BG,Brown RD Jr,Amin-Hanjani S,et al.Guidelines for the Management of Patients With Unruptured Intracranial Aneurysms:A Guideline for Healthcare Professionals From the American Heart Association/American Stroke Association[J].Stroke,2015,46(8):2368-2400.
[51]Delgado Almandoz JE,Yoo AJ,Stone MJ,et al.The spot sign score in primary intracerebral hemorrhage identifies patients at highest risk of in-hospitalmortality and poor outcome among survivors[J].Stroke,2010,41(1):54-60.
[52]Delgado Almandoz JE,Schaefer PW,Forero NP,et al.Diagnostic accuracy and yield ofmultidetector CT angiography in the evaluation of spontaneous intraparenchymal cerebral hemorrhage[J].AJNR Am JNeuroradiol,2009,30(6):1213-1221.
[53]Casey SO,Alberico RA,Patel M,et al.Cerebral CT venography[J].Radiology,1996,198(1):163-170.
[54]Sailer AM,Wagemans BA,Nelemans PJ,et al.Diagnosing intracranial aneurysms with MR angiography:systematic review and meta-analysis[J].Stroke,2014,45(1):119-126.
[55]Attali J,Benaissa A,Soize S,etal.Follow-up of intracranial aneurysms treated by flow diverter:comparison of three-dimensional time-of-flight MR angiography(3D-TOF-MRA)and contrast-enhanced MR angiography(CE-MRA)sequences with digital subtraction angiography as the gold standard[J].JNeurointerv Surg,2016,8(1):81-86.
[56]Schuster L,Hauser T,Essig M.Significance ofMR angiography for imaging diagnostics of carotid artery diseases[J].Radiology,2010,50(7):597-606.
[57]Masdeu JC,Irimia P,Asenbaum S,et al.EFNSguideline on neuroimaging in acute stroke.Reportof an EFNS task force[J].Eur JNeurol,2006,13(12):1271-1283.
[58]Vertinsky AT,Schwartz NE,Fischbein NJ,et al.Comparison ofmultidetector CT angiography and MR imaging of cervical artery dissection[J].AJNR Am JNeuroradiol,2008,29(9):1753-1760.
[59]Gomes LJ.The role of imaging in the diagnosis of central nervous system vasculitis[J].Curr Allergy Asthma Rep,2010,10(3):163-170.
[60]von Morze C,Purcell DD,Banerjee S,et al.High-resolution intracranial MRA at 7T using autocalibrating parallel imaging:initial experience in vascular disease patients[J].Magn Reson Imaging,2008,26(10):1329-1333.
[61]Ballotta E,Da Giau G,Baracchini C.Carotid angioplasty and stenting in high-risk patientswith severe symptomatic carotid stenosis[J].Stroke,2003,34(4):834-835.
[62]Abe T,Hirohata M,Tanaka N,et al.Clinical benefits of rotational 3D angiography in endovascular treatment of ruptured cerebral aneurysm[J].AJNR Am JNeuroradiol,2002,23(4):686-688.
[63]Cloft HJ,Joseph GJ,Dion JE.Risk of cerebral angiography in patients with subarachnoid hemorrhage,cerebral aneurysm,and arteriovenousmalformation:ameta-analysis[J].Stroke,1999,30(2):317-320.
[64]Agid R,Andersson T,Almqvist H,et al.Negative CT angiography findings in patients with spontaneous subarachnoid hemorrhage:When is digital subtraction angiography still needed[J].AJNR Am JNeuroradiol,2010,31(4):696-705.
[65]Connolly ES Jr,Rabinstein AA,Carhuapoma JR,etal.Guidelines for themanagementof aneurysmal subarachnoid hemorrhage:a guideline for healthcare professionals from the American Heart Association/american Stroke Association[J].Stroke,2012,43(6):1711-1737.
[66]Bakker NA,Groen RJ,FoumaniM,et al.Repeat digital subtraction angiography after a negative baseline assessment in nonperimesencephalic subarachnoid hemorrhage:a pooled datameta-analysis[J].JNeurosurg,2014,120(1):99-103.
[67]Higashida RT,Furlan AJ,Roberts H,etal.Trial design and reporting standards for intra-arterial cerebral thrombolysis for acute ischemic stroke[J].Stroke,2003,34(8):e109-e137.
[68]逯英,刘之荣,赵钢.颅内动脉狭窄的影像学诊断[J].国际脑血管病杂志,2010,18(5):352-357.
[69]张洪胜,于萍萍.脑静脉窦和静脉血栓形成的影像学诊断与分析[J].国际放射医学核医学杂志,2009,33(6):368-371.
[70]Takano K,Yamashita S,Takemoto K,et al.MRIof intracranial vertebral artery dissection:evaluation of intramural haematoma using a black blood,variable-flip-angle 3D turbo spin-echo sequence[J].Neuroradiology,2013,55(7):845-851.
[71]牛婧雯,徐蔚海.脑动脉夹层影像学诊断[J].中国实用内科杂志,2014,34(5):447-449.
[72]Balu N,Chu B,Hatsukami TS,et al.Comparison between 2D and 3D high resolution black blood techniques for carotid artery wall imaging in clinically significant atherosclerosis[J].JMagn Reson Imaging,2008,27(4):918-924.
[73]Wang J,Bornert P,Zhao H,et al.Simultaneous noncontrast angiography and intraPlaque hemorrhage(SNAP)imaging for carotid atherosclerotic disease evaluation[J].Magn Reson Med,2013,69(2):337-345.
[74]Ryu CW,Kwak HS,Jahng GH,et al.High-resolution MRIof intracranial atherosclerotic disease[J].Neurointervention,2014,9(1):9-20.
[75]Yang H,Zhu Y,Geng Z,et al.Clinical value of black-blood high-resolutionmagnetic resonance imaging for intracranial atherosclerotic plaques[J].Exp Ther Med,2015,10(1):231-236.
[76]Lin L,Bivard A,Parsons MW,et al.Perfusion patterns of ischemic stroke on computed tomography perfusion[J].Stroke,2013,15(3):164-173.
[77]Kleinman JT,Zaharchuk G,M lynash M,et al.Automated perfusion imaging for the evaluation of transient ischemic attack[J].Stroke,2012,43(6):1556-1560.
[78]Butcher K,Parsons M,Davis S,et al.Perfusion thresholds in acute stroke thrombolysis[J].Stroke,2003,34(9):2159-2164.
[79]Liebeskind DS,Alexandrov AV.Advancedmultimodal CT/MRIapproaches to hyperacute stroke diagnosis,treatment,andmonitoring[J].Ann N Y Acad Sci,2012,1268:1-7.
[80]Prabhakaran S,Patel SK,Samuels J,etal.Perfusion computed tomography in transient ischemic attack[J].Arch Neurol,2011,68(1):85-89.
[81]Mehta BK,Mustafa G,McMurtray A,et al.Whole brain CT perfusion deficits using 320-detector-row CT scanner in TIA patients are associated with ABCD2 score[J].Int JNeurosci,2014,124(1):56-60.
[82]Tung CE,Olivot JM,Albers GW.Radiological examinations of transient ischemic attack[J].Front Neurol Neurosci,2014,33(4):115-122.
[83]Sabarudin A,Subramaniam C,Sun Z.Cerebral CT angiography and CT perfusion in acute stroke detection:a systematic review of diagnostic value[J].Quant Imaging Med Surg,2014,4(4):282-290.
[84]Zhou J,Zhang H,Gao P,etal.Assessmentof perihematomal hypoperfusion injury in subacute and chronic intracerebral hemorrhage by CT perfusion imaging[J].Neurol Res,2010,32(6):642-649.
[85]Rosand J,Eskey C,Chang Y,et al.Dynamic single-section CT demonstrates reduced cerebral blood flow in acute intracerebral hemorrhage[J].Cerebrovasc Dis,2002,14(3):214-220.
[86]Wintermark M,Sanelli PC,Albers GW,etal.Imaging recommendations for acute stroke and transient ischemic attack patients:A joint statementby the American Society of Neuroradiology,the American College of Radiology,and the Society of NeuroInterventional Surgery[J].AJNR Am JNeuroradiol,2013,10(11):828-832.
[87]Shuaib A,Butcher K,Mohammad AA,et al.Collateral blood vessels in acute ischaemic stroke:a potential therapeutic target[J].Lancet Neurol,2011,10(10):909-921.
[88]Beyer SE,von Baumgarten L,Thierfelder KM,etal.Predictive value of the velocity of collateral filling in patientswith acute ischemic stroke[J].JCereb Blood Flow Metab,2015,35(2):206-212.
[89]Menon BK,Smith EE,Modi J,et al.Regional leptomeningeal score on CT angiography predicts clinical and imaging outcomes in patients with acute anterior circulation occlusions[J].AJNR Am JNeuroradiol,2011,32(9):1640-1645.
[90]Schaefer PW,Hunter GJ,He J,et al.Predicting cerebral ischemic infarct volume with diffusion and perfusion MR imaging[J].AJNR Am JNeuroradiol,2002,23(10):1785-1794.
[91]Bhagat YA,Hussain MS,Stobbe RW,et al.Elevations of diffusion anisotropy are associated with hyper-acute stroke:a serial imaging study[J].Magn Reson Imaging,2008,26(5):683-693.
[92]Thomalla G,Glauche V,Koch MA,etal.Diffusion tensor imaging detects early Wallerian degeneration of the pyramidal tractafter ischemic stroke[J].Neuroimage,2004,22(4):1767-1774.
[93]郑作锋,艾林,戴建平,等.功能磁共振成像在脑梗死患者运动功能评价中的作用探讨[J].中国卒中杂志,2008,3(10):735-742.
[94]Ono T,Tomita Y,Inose M,et al.Multimodal sensory feedback associated with motor attempts alters BOLD Responses to paralyzed hand movement in chronic stroke patients[J].Brain Topogr,2015,28(2):340-51.
[95]Tsai YH,Yuan R,Huang YC,et al.Altered resting-state FMRI signals in acute stroke patients with ischemic penumbra[J].PLoSOne,2014,9(8):e105117.
[96]Muthupillai R,Lomas DJ,Rossman PJ,et al.Magnetic resonance elastography by direct visualization of propagating acoustic strain waves[J].Science,1995,269(5232):1854-1857.
[97]Xu L,Lin Y,Xi ZN,et al.Magnetic resonance elastography of the human brain:a preliminary study[J].Acta Radiol,2007,48(1):112-115.
[98]徐磊,高培毅,林燕.人脑磁共振弹性成像的初步研究[J].中华放射学杂志,2007,41(3):300-303.
[99]Woo CW,Lee BS,Kim ST,et al.Correlation between lactate and neuronal cell damage in the rat brain after focal ischemia:An in vivo 1H magnetic resonance spectroscopic(1H-MRS)study[J].Acta Radiol,2010,51(3):344-350.
[100]Kubas B,Walecki J,Kulak W,et al.Metabolite profile in pyramidal tracts after ischemic brain stroke assessed by 1H MRS.A multicenter study[J].Neuroradiol J,2007,19(6):699-704.
[101]Huang P,Chen CH,Lin WC,et al.Clinical applications of susceptibility weighted imaging in patients with major stroke[J].J Neurol,2012,259(7):1426-1432.
[102]Idbaih A,Boukobza M,Crassard I,et al.MRI of clot in cerebral venous thrombosis:high diagnostic value of susceptibilityweighted images[J].Stroke,2006,37(4):991-995.
[103]Ayaz M,Boikov AS,Haacke EM,et al.Imaging cerebralmicrobleeds using susceptibility weighted imaging:one step toward detecting vascular dementia[J].JMagn Reson Imaging,2010,31(1):142-148.
[104]Qin Y,Ogawa T,Fujii S,et al.High incidence of asymptomatic cerebralmicrobleeds in patients with hemorrhagic onset-type moyamoya disease:a phase-sensitive MRI study and meta-analysis[J].Acta Radiol,2015,56(3):329-338.