 去看看
去看看


1 治疗前评估
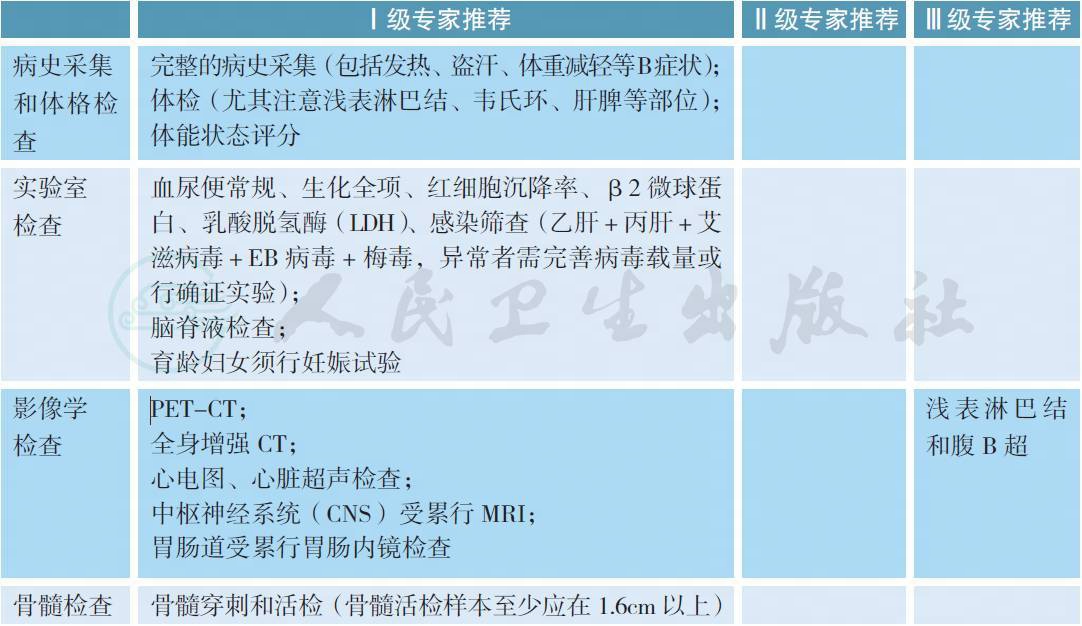
【注释】对于高危患者应行诊断性腰椎穿刺术检查。流式细胞术可以提高脑脊液中淋巴瘤细胞的检测率[1]。
2 病理学诊断
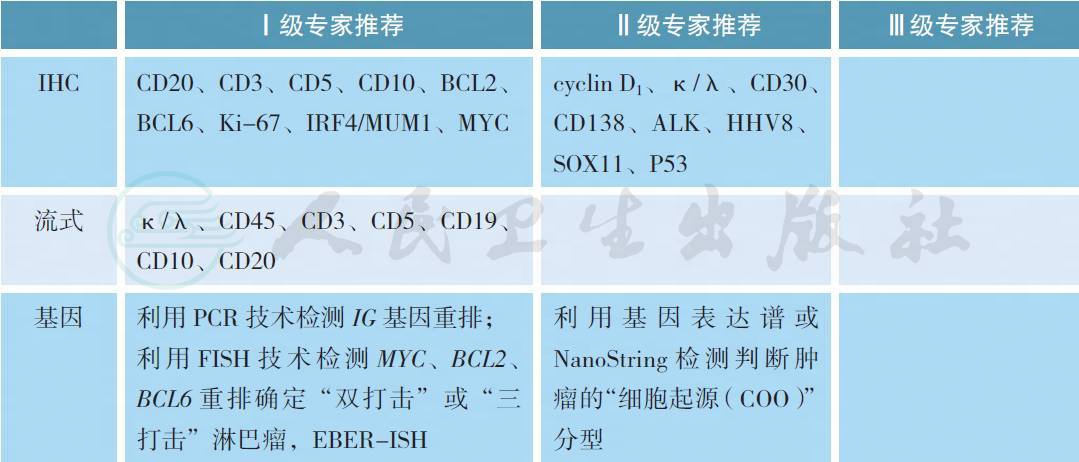
【注释】弥漫大B 细胞淋巴瘤(DLBCL) 依靠组织病理学和免疫组化分析明确诊断。CD20+、CD3- 是DLBCL 的典型免疫表型,其他免疫组化指标用于DLBCL 亚型的分类。
对DLBCL 亚型的诊断应遵循2016 版WHO 分类[2]。WHO 根据基因表达谱不同,将DLBCL 按细胞起源(COO) 分为3 类:生发中心B 细胞样(germinal center B-cell-like,GCB)、活化B 细胞样(activated B-cell-like,ABC) 和第三型DLBCL(Type 3 DLBCL),是影响DLBCL 预后的重要因素[3-5]。目前最为常用的是HANS 模型分类,通过检测生发中心B 细胞标志(CD10、BCL6) 和非生发中心B 细胞标志(IRF4/MUM1) 将DLBCL 分为GCB 样亚型和非GCB 样亚型。有条件的机构可根据基因表达谱或利用NanoString 检测来判断DLBCL 的COO 亚型。
对怀疑有病变的淋巴结或结外病灶实施切除或切取活检(或内镜下活检) 是明确诊断的最佳途径。在特定情况下,无法对可疑淋巴结进行切除活检时,亦可行空芯针穿刺活检,联合其他辅助检查技术(免疫组化、流式细胞术、PCR 技术扩增检测有无克隆性免疫球蛋白基因(IG) 和T 细胞受体(TCR)基因重排、FISH 和基因突变检测等对淋巴瘤进行诊断(参照2017 版NCCN 指南的建议)。
初发和治疗后复发的DLBCL 均推荐FISH 技术检测MYC、BCL2 和BCL6 重排。5% ~15%DLBCL 具有MYC 重排,可与BCL2 重排同时发生,也可与BCL6 重排同时发生,称作“双打击”或“三打击”淋巴瘤,提示预后不良,目前尚无有效的治疗措施[6-8]。30% ~35% DLBCL 表达MYC 蛋白,20% ~35%同时表达BCL2,但多数不携带MYC/BCL2 基因异常,称“双表达淋巴瘤”,提示预后不良[9-11]。
3 分期
参照2014 年Lugano 分期标准,见附录A。
附录A 2014 版Lugano 分期标准(CT、MRI 或PETCT作为分期检查方法)

【注释】
1.*.根据2014年Lugano改良分期标准,不再对淋巴瘤的大包块(bulky)病灶进行具体的数据限定,只需在病例中明确记载最大病灶之最大径即可;Ⅱ期伴有大肿块的患者,应根据病理类型及疾病不良预后因素而酌情选择治疗原则,如伴有大包块的惰性淋巴瘤患者可选择局限期治疗模式,但是伴有大包块的侵袭性淋巴瘤患者,则应选择进展期治疗模式。
2.AnnArbor分期对于淋巴结分布区域的定义(仍然适用于Lugano分期):膈上(共12个区域,由于不能被一个放射野涵盖,因此左右各为一个区域):韦氏环(Waldeyer环)(鼻咽及口咽部的淋巴组织环,包括腭扁桃体、咽后壁腺样体、舌扁桃体及其他该部位淋巴组织为一个区域)、左/右颈部(单侧耳前、枕部、颌下、颏下、颈内、锁骨上为一个区域)、左/右锁骨下、左/右腋窝(含胸部及内乳)、左/右滑车上(含肘窝)、纵隔(含气管旁、胸腺区域)、左/右肺门;膈下(共9个区域):脾脏、上腹部(脾门、肝门、腹腔)、下腹部(腹主动脉旁、腹膜后、肠系膜周围、腹部其他非特指淋巴结为一个区域)、左/右髂血管旁、左/右腹股沟(含股部)、左/右腘窝。
3.3.B症状主要在HL中有预后意义并需要记录;最新文献中B症状在NHL的价值较低,但是仍然建议在病例中记录。所谓B症状:不明原因体重下降10%(诊断前6个月内),发热>38℃并排除其他原因发热,盗汗(夜间大量出汗,需要更换衣服被褥)。
4.扁桃体、韦氏环、脾脏视为淋巴器官。
5.备注:淋巴瘤的分期尽管不断改良,但是争议持续存在,主要是对于分期的定义存在解读分歧,或者对特殊部位未能做出全面而明确的定义。正因如此,后续才建立了多种预后指数用于补充临床分期之不足,以指导临床治疗和判断预后。而且,不同于实体瘤的是,淋巴瘤的临床分期不是决定治疗和预后的最关键因素。
4 治疗
4.1 初治患者:基于年龄和预后的分层治疗。
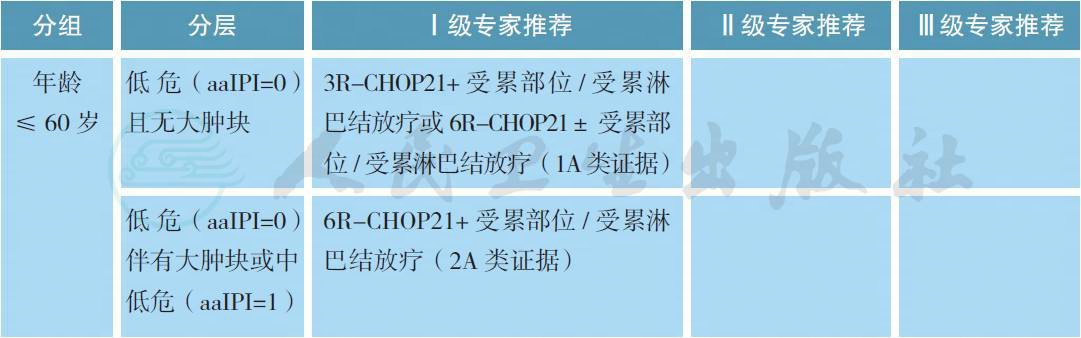
初治患者:基于年龄和预后的分层治疗(续)
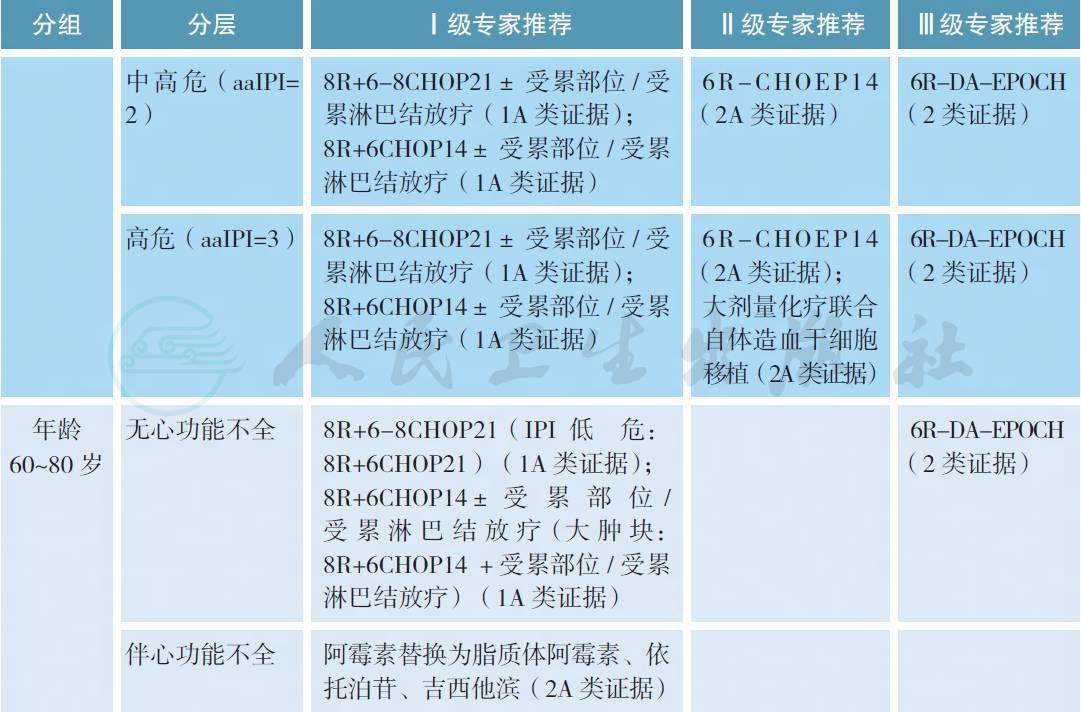

【注释】应根据患者年龄、IPI/aaIPI 评分以及剂量增加方案的可行性进行分层治疗。若条件允许,推荐进入临床试验研究。
对于年轻高危或中高危患者,目前尚无标准治疗方案,应首选进入临床试验研究。最常用的治疗为8R 联合6~8 个疗程CHOP21 方案。R-CEOP70 与R-CHOP21 等效[12]。年轻患者采用蒽环类加量的化疗方案R-CEOP90 可生存获益[13]。化疗前大肿块(≥ 7.5cm) 或结外器官受侵、化疗后未达CR 是放疗适应证[14,15]。局限期患者短程化疗后联合放疗可取得与长程单纯化疗相同的疗效[16],足量化疗后联合放疗可能进一步提高疗效[17]。化疗CR 后推荐放疗剂量为30~36Gy,化疗PR 或SD后剂量为30~40Gy,而在化疗后进展行挽救放疗时应给予更高剂量40~50Gy。大剂量化疗联合自体造血干细胞移植作为一线治疗可应用于高危患者,但仍需进一步试验。
对于双打击淋巴瘤患者, 通常采用强化治疗方案, 如R-HyperCVAD、R-DAEPOCH 等,R-DAEPOCH 方案作为一线治疗与R-CHOP 方案相比,显著延长PFS,但OS 无统计学差异[18]。这部分患者存在较高的CNS 复发风险,推荐进行CNS 预防性治疗。原发纵隔大B 细胞淋巴瘤的一线治疗推荐R-CHOP 方案联合放疗,或R-DAEPOCH 方案(如化疗后PET-CT 阴性则无需放疗)[19]。原发中枢神经系统DLBCL 推荐R-HD-MTX(≥ 3.0g/m2)为基础的化疗方案联合HD-Ara-C 静脉滴注,化疗达CR 后行可减量的全脑放疗[20],老年患者可不行全脑照射[21],未达CR 则行全脑照射和局部补量,或PR/SD 行挽救性放疗。原发睾丸化疗后行对侧睾丸预防放疗。
对于高肿瘤负荷的患者,应采取措施预防溶瘤综合征。所有患者治疗前都须进行HBV 标记物筛查,包括乙肝血清免疫学标志物和HBV DNA 检查。对于HBsAg 阳性的患者,无论其HBV DNA是否可测,需预防性抗病毒治疗。对于抗-HBc 阳性/HBsAg 阴性患者,需持续监测HBV DNA,或预防性抗病毒治疗,对于抗-HBs 阴性/HBV DNA 不可测的患者,需持续监测HBV DNA。
存在CNS 复发风险的患者应进行CNS 预防。由IPI 中的5 个危险因素和肾脏/ 肾上腺累及组成的CNS-IPI,将患者分为低危(0~1 分)、中危(2~3 分)、高危(4~6 分)[22],参照2017 版NCCN 指南,建议对CNS-IPI 高危、HIV 感染、双打击淋巴瘤、睾丸淋巴瘤的患者进行CNS 预防。此外,回顾性研究普遍认为,乳腺、子宫、副鼻窦、硬膜外、骨、骨髓的累及也是附加危险因素。推荐这些患者进行鞘内注射甲氨蝶呤(MTX)± 阿糖胞苷(Ara-C)或HD-MTX(≥ 3.0g/m2)静脉滴注作为预防;若患者同时存在CNS 实质受累,应考虑将HD-MTX(≥ 3.0g/m2) 加入治疗方案。
4.2 复发/ 难治患者(适用于初发时接受足量利妥昔单抗和蒽环类化疗的患者)
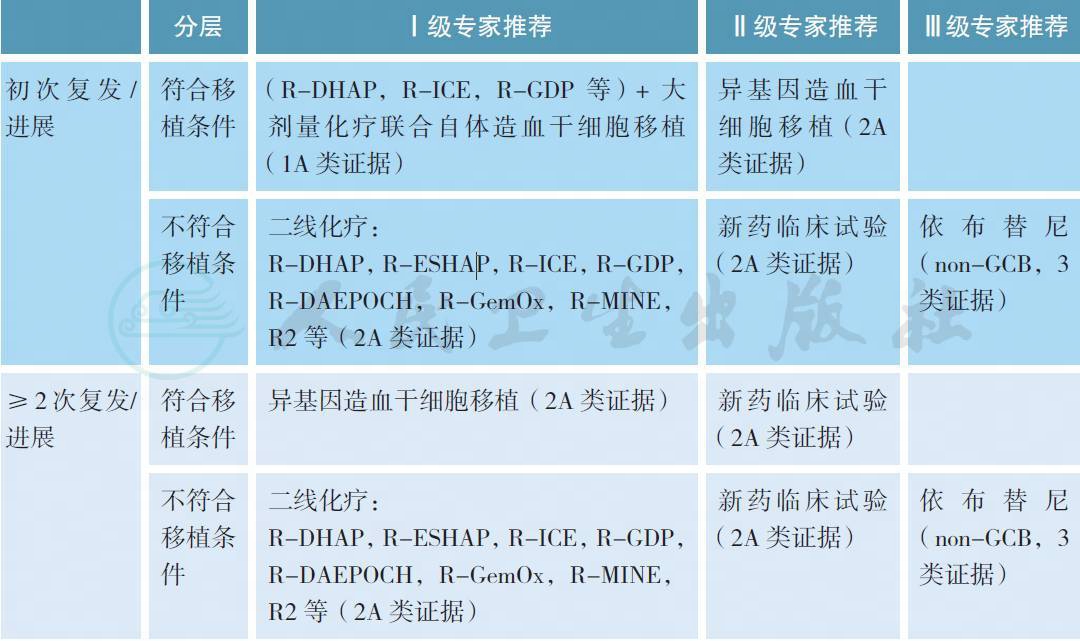
【注释】选择其他与CHOP 无交叉耐药的药物即二线方案化疗或个体化方案。如有条件,推荐进入新药临床研究。如患者具备移植条件且达CR 或PR,则于化疗后行造血干细胞移植;如患者不具备移植条件或治疗后仍为SD 或PD,则进入临床试验或行最佳支持治疗。
4.3 附录:治疗方案汇总

【注释】
(1)R-CHOP 方案
利妥昔单抗375mg/m1,d0
环磷酰胺750mg/m2,d1
多柔比星40~50mg/m2,d1
长春新碱1.4mg/m2,d1(最大剂量2mg)
泼尼松100mg,d1-5
每21d 重复。
(2)R-CHOEP 方案
利妥昔单抗375mg/m2,d0
环磷酰胺750mg/m2,d1
长春新碱1.4mg/m2,d1
多柔比星40~50mg/m2,d1
依托泊苷100mg/m2,d1-3
泼尼松100mg,d1-5
每21d 重复。
(3)R-DA-EPOCH 方案
利妥昔单抗375mg/m2,d0
依托泊苷50mg/(m2·d),d1-4,96h 连续输注
长春新碱0.4mg/(m2·d),d1-4,96h 连续输注
多柔比星10mg/(m2·d),d1-4,96h 连续输注
环磷酰胺750mg/m2,d5
泼尼松60mg/(m2·d),d1-5
每21d 重复。
DA-EPOCH 剂量调整原则
1) 每次化疗后都需预防性使用粒细胞集落刺激因子。
2) 如果上周期化疗后中性粒细胞减少未达Ⅳ度,可以在上一周期化疗剂量基础上将依托泊苷、多柔比星和环磷酰胺的剂量上调20%。
3) 如果上周期化疗后中性粒细胞减少达Ⅳ度,但在1 周内恢复,保持原剂量不变。
4) 如果上周期化疗后中性粒细胞减少达Ⅳ度,且持续时间超过1 周,或血小板下降达Ⅳ度,在上一周期化疗剂量基础上将依托泊苷、多柔比星和环磷酰胺的剂量下调20%。
5) 剂量调整如果是在起始剂量以上,则上调时依托泊苷、多柔比星和环磷酰胺一起上调;剂量调整如果是在起始剂量以下,则下调时仅下调环磷酰胺


【注释】
(1)R-DHAP 方案
利妥昔单抗375mg/m2,d0
地塞米松40mg/d,d1-4(原方案为该剂量,各中心可酌情调整)
顺铂100 mg/m2,24h 连续输注,d1
阿糖胞苷2g/m2,q12h,d2
每21d 重复。
(2)R-ICE 方案
利妥昔单抗375mg/m2,d0
异环磷酰胺5g/m2,d2(100%剂量美司钠解救)
卡铂(按照AUC=5 计算,单次剂量≤ 800mg),d2
依托泊苷100mg/m2,d1-3
每21d 重复。
(3)R-GDP 方案
利妥昔单抗375mg/m2,d0
吉西他滨1000mg/m2,d1,d8
顺铂75mg/m2,d1
地塞米松40mg,d1-4
每21d 重复。
(4)R-ESHAP 方案
利妥昔单抗375mg/m2,d0
依托泊苷60mg/m2,d1-4
甲泼尼龙500mg,d1-4
顺铂25mg/m2,96h 连续输注,d1-4
阿糖胞苷2g/m2,d5
每21d 重复。
(5)R-GemOx 方案
利妥昔单抗375mg/m2,d0
吉西他滨1000mg/m2,d1
奥沙利铂100mg/m2,d1
每14d 重复。
(6)R-MINE 方案
利妥昔单抗375mg/m2,d0
异环磷酰胺1.33g/m2,d1-3(100%剂量美司钠解救)
米托蒽醌8mg/m2,d1
依托泊苷65mg/m2,d1-3
每21d 重复。
(7)R2 方案
利妥昔单抗375mg/m2,d0
来那度胺20-25mg,d1-21
每28d 重复。
[1]Benevolo G,Stacchini A,Spina M,et al. Final results of a multicenter trial addressing role of CSF flowcytometric analysis in NHL patients at high risk for CNS dissemination[J]. Blood,2012,120(16):3222-3228. doi:10.1182/blood-2012-04-423095.
[2]Swerdlow SH,Campo E,Pileri SA,et al. The 2016 revision of the World Health Organizationclassification of lymphoid neoplasms[J]. Blood,2016,127(20):2375-2390. doi:10.1182/blood-2016-01-643569.
[3]Lenz G,Wright GW,Emre NC,et al. Molecular subtypes of diffuse large B-cell lymphoma arise bydistinct genetic pathways[J]. Proc Natl Acad Sci USA,2008,105(36):13520-13525. doi:10.1073/pnas.0804295105.
[4]Scott DW,Wright GW,Williams PM,et al. Determining cell-of-origin subtypes of diffuse large B-celllymphoma using gene expression in formalin-fixed paraffin-embedded tissue[J]. Blood,2014,123(8):1214-1217. doi:10.1182/blood-2013-11-536433.
[5]Wright G,Tan B,Rosenwald A,et al. A gene expression-based method to diagnose clinically distinctsubgroups of diffuse large B cell lymphoma[J]. Proc Natl Acad Sci USA,2003,100(17):9991-doi:10.1073/pnas.1732008100.
[6]Savage KJ,Johnson NA,Ben-Neriah S,et al. MYC gene rearrangements are associated with a poorprognosis in diffuse large B-cell lymphoma patients treated with R-CHOP chemotherapy[J]. Blood,2009,114(17):3533-3537. doi:10.1182/blood-2009-05-220095.
[7]Barrans S,Crouch S,Smith A,et al. Rearrangement of MYC is associated with poor prognosis inpatients with diffuse large B-cell lymphoma treated in the era of rituximab[J]. Journal of clinicaloncology :official journal of the American Society of Clinical Oncology,2010,28(20):3360-3365.doi:10.1200/jco.2009.26.3947.
[8]Lin P,Dickason TJ,Fayad LE,et al. Prognostic value of MYC rearrangement in cases of B-celllymphoma,unclassifiable,with features intermediate between diffuse large B-cell lymphoma andBurkitt lymphoma[J]. Cancer,2012,118(6):1566-1573. doi:10.1002/cncr.26433.
[9]Green TM,Young KH,Visco C,et al. Immunohistochemical double-hit score is a strong predictor ofoutcome in patients with diffuse large B-cell lymphoma treated with rituximab plus cyclophosphamide,doxorubicin,vincristine,and prednisone[J]. Journal of clinical oncology :official journal of theAmerican Society of Clinical Oncology,2012,30(28):3460-3467. doi:10.1200/jco.2011.41.4342.
[10]Johnson NA,Slack GW,Savage KJ,et al. Concurrent expression of MYC and BCL2 in diffuselarge B-cell lymphoma treated with rituximab plus cyclophosphamide,doxorubicin,vincristine,and prednisone[J]. Journal of clinical oncology :official journal of the American Society of ClinicalOncology,2012,30(28):3452-3459. doi:10.1200/jco.2011.41.0985.
[11]Horn H,Ziepert M,Becher C,et al. MYC status in concert with BCL2 and BCL6 expression predictsoutcome in diffuse large B-cell lymphoma[J].Blood,2013,121(12):2253-2263.doi:10.1182/blood-2012-06-435842.
[12]Xue K,Gu JJ,Zhang Q,et al. Cardiotoxicity as indicated by LVEF and troponin T sensitivityfollowing two anthracycline-based regimens in lymphoma:Results from a randomized prospectiveclinical trial[J]. Oncotarget,2016,7(22):32519-32531. doi:10.18632/oncotarget.8685.
[13]Cai QC,Gao Y,Wang XX,et al. Long-term results of the R-CEOP90 in the treatment of youngpatients with chemotherapy-naive diffuse large B cell lymphoma:a phase Ⅱ study[J]. Leukemia &lymphoma,2014,55(10):2387-2388. doi:10.3109/10428194.2013.876632.
[14]Held G,Murawski N,Ziepert M,et al. Role of radiotherapy to bulky disease in elderly patientswith aggressive B-cell lymphoma[J]. Journal of clinical oncology :official journal of the AmericanSociety of Clinical Oncology,2014,32(11):1112-1118. doi:10.1200/jco.2013.51.4505.
[15]Pfreundschuh M,Kuhnt E,Trumper L,et al. CHOP-like chemotherapy with or without rituximab inyoung patients with good-prognosis diff use large-B-cell lymphoma:6-year results of an open-labelrandomised study of the MabThera International Trial (MInT) Group[J].The Lancet Oncology,2011,12(11):1013-1022.doi:10.1016/s1470-2045(11)70235-2.
[16]Stephens DM,Li H,LeBlanc ML,et al. Continued risk of relapse independent of treatment modalityin limited-stage diffuse large B-cell lymphoma:final and long-term analysis of Southwest Oncology31Group Study S8736[J]. Journal of clinical oncology :official journal of the American Society ofClinical Oncology,2016,34(25):2997-3004. doi:10.1200/JCO.2015.65.4582.
[17]Vargo JA,Gill BS,Balasubramani GK,et al. Treatment selection and survival outcomes in earlystagediffuse large B-cell lymphoma:do we still need consolidative radiotherapy?[J]. Journal ofclinical oncology :official journal of the American Society of Clinical Oncology,2015. doi:10.1200/JCO.2015.61.7654.
[18]Cunningham D,Hawkes EA,Jack A,et al. Rituximab plus cyclophosphamide,doxorubicin,vincristine,and prednisolone in patients with newly diagnosed diffuse large B-cell non-Hodgkinlymphoma:a phase 3 comparison of dose intensification with 14-day versus 21-day cycles[J].Lancet,2013,381(9880):1817-1826. doi:10.1016/s0140-6736(13)60313-x.
[19]Dunleavy K,Pittaluga S,Maeda LS,et al. Dose-adjusted EPOCH-rituximab therapy in primarymediastinal B-cell lymphoma[J]. The New England journal of medicine,2013,368(15):1408-1416. doi:10.1056/NEJMoa1214561.
[20]Morris PG,Correa DD,Yahalom J,et al. Rituximab,methotrexate,procarbazine,and vincristinefollowed by consolidation reduced-dose whole-brain radiotherapy and cytarabine in newly diagnosedprimary CNS lymphoma:final results and long-term outcome[J]. Journal of clinical oncology :official journal of the American Society of Clinical Oncology,2013,31(31):3971-3979. doi:10.1200/JCO.2013.50.4910.
[21]Thiel E,Korfel A,Martus P,et al. High-dose methotrexate with or without whole brain radiotherapyfor primary CNS lymphoma (G-PCNSL-SG-1):a phase 3,randomised,non-inferiority trial[J].The Lancet Oncology,2010,11(11):1036-1047. doi:10.1016/S1470-2045(10)70229-1.
[22]Schmitz N,Zeynalova S,Nickelsen M,et al. CNS international prognostic index:a risk model forCNS relapse in patients with diffuse large B-cell lymphoma treated with R-CHOP[J]. Journal ofclinical oncology :official journal of the American Society of Clinical Oncology,2016,34(26):3150-3156. doi:10.1200/jco.2015.65.6520.
[23]Hagberg H,Gisselbrecht C,CORAL study group. Randomised phase Ⅲ study of R-ICE versus R-DHAPin relapsed patients with CD20 diffuse large B-cell lymphoma (DLBCL) followed by high-dosetherapy and a second randomisation to maintenance treatment with rituximab or not:an update of theCORAL study. Ann Oncol,2006 May,17 Suppl 4:iv31-32.
[24]Shen QD,Zhu HY,Wang L,et al. Gemcitabine-oxaliplatin plus rituximab (R-GemOx) as firstlinetreatment in elderly patients with diffuse large B-cell lymphoma:a single-arm,open-label,phase 2 trial. Lancet Haematol,2018 Jun,5(6):e261-e269. doi:10.1016/S2352-3026(18)30054-1.
[25]Crump M,Kuruvilla J,Couban S,et al. Randomized comparison of gemcitabine,dexamethasone,and cisplatin versus dexamethasone,cytarabine,and cisplatin chemotherapy before autologous stemcelltransplantation for relapsed and refractory aggressive lymphomas:NCIC-CTG LY.12. J Clin3Oncol,2014 Nov 1;32(31):3490-3496. doi:10.1200/JCO.2013.53.9593.
[26]Rodriguez MA,Cabanillas FC,Velasquez W,et al. Results of a salvage treatment program forrelapsing lymphoma:MINE consolidated with ESHAP. J Clin Oncol,1995 Jul,13(7):1734-1741.
[27]Wiernik PH,Lossos IS,Tuscano JM,et al. Lenalidomide monotherapy in relapsed or refractoryaggressive non-Hodgkin’s lymphoma. J Clin Oncol,2008 Oct 20,26(30):4952-4957. doi:10.1200/JCO.2007.15.3429.
[28]Witzig TE,Vose JM,Zinzani PL,et al. An international phase Ⅱ trial of single-agent lenalidomidefor relapsed or refractory aggressive B-cell non-Hodgkin’s lymphoma. Ann Oncol,2011 Jul,22(7):1622-1627. doi:10.1093/annonc/mdq626.
[29]Wang M,Fowler N,Wagner-Bartak N,et al. Oral lenalidomide with rituximab in relapsed orrefractory diffuse large cell,follicular and transformed lymphoma:a phase Ⅱ clinical trial. Leukemia,2013 Sep,27(9):1902-1909. doi:10.1038/leu.2013.95.