 去看看
去看看


颅内血管破裂后,血液流入蛛网膜下腔称为蛛网膜下腔出血(subarachnoid hemorrhage,SAH),临床上将SAH分为外伤性与非外伤性两大类。非外伤性SAH又称为自发性SAH,是一种常见且致死率极高的疾病,病因主要是动脉瘤,约占全部病例的85%,其他病因包括中脑周围非动脉瘤性出血(perimesencephalic nonaneurysmal subarachnoid hemorrhage,PNSH)、血管畸形、硬脑膜动-静脉瘘(dural arteriovenous fistula,DAVF)、凝血功能障碍、吸食可卡因和垂体卒中等。近年来,血管介入技术、诊断方法与围术期处理均有较大进展。但是,SAH患者的预后仍然较差,病死率高达45%,且存活者的残障率也较高。中华医学会神经病学分会脑血管病学组2007年出版的《中国脑血管病防治指南》中包含有SAH的章节[1]。中华医学会神经外科学分会曾于2006年出版《临床诊疗指南:神经外科学分册》一书,其中也包含了SAH诊疗指南。近几年来不断有新的临床研究和相应的国际指南发表,几个多中心、前瞻性、随机对照试验和前瞻性队列研究对SAH的治疗提出了新的方法,因此,中华医学会神经病学分会及其脑血管病学组组织了对2007版指南的重新修订,形成新版指南以指导临床医师的操作实践。由于其他原因导致的SAH的资料相对缺乏,故本指南主要是针对非外伤性、动脉瘤性SAH制定的。
一、流行病学与危险因素
(一)发病率
自然人群的SAH发病率和患病率尚不明确,目前只有动脉瘤性SAH的流行病学资料,而其他原因导致的自发性SAH资料非常少,需要加强观察与研究。SAH的好发年龄在40~60岁(平均≥50岁),也可以发生在童年或老年,男女比例为1∶1.6,其差异可能与激素水平相关,晚育及月经来潮较晚的女性患SAH风险较低。
一项由WHO组织的大型多中心研究发现,根据年龄调整的SAH年发病率在各地区间相差10倍之多,中国仅为2.0/10万,而在芬兰可达22.5/10万[2]。日本发病率约为20/10万,其他地区的发病率约为9.1/10万。
SAH发病也存在着人种的差异,如美国黑种人较白种人更易发生SAH,太平洋毛利人较新西兰白人风险更高[3-4]。人群调查揭示,SAH发病率在过去的40年中没有明显变化,在有些国家,如新西兰从20世纪80年代至90年代发病率稍有下降。
使用磁共振血管成像技术(MRA)检查8680例无症状人群发现,动脉瘤发病率为7.0%,而具有SAH家族史的人,动脉瘤的发病率升高至10.5%[5]。另一项研究表明散发的SAH患者,其亲属中MRI检查发现仅4%存在动脉瘤[6]。
(二)患病率
美国脑血管疾病患者中约5%为SAH,动脉瘤性SAH的患病率为80/10万。动脉瘤治疗后每年新生动脉瘤的比例为1%~2%。多发性颅内动脉瘤的患者更易生成新的动脉瘤,尚不明确是基因还是外界因素导致动脉瘤的生成。
(三)病死率
动脉瘤性SAH患者再破裂危险性较高,如2周内的再破裂出血率达22%,1个月内为33%,但1个月后再出血的危险减低,不过,每年仍有3%的再出血风险。血管造影中造影剂外渗是预示再出血及预后不良的征象。动脉瘤性SAH患者的病死率较高,在出血第1周高达27%,二次出血的病死率可达70%。在发病3个月内病死率为45%~49%[7]。伴有巨大动脉瘤或伴有神经功能缺失者预后更差。存活者中50%留有残疾,动脉瘤治疗后出院回家的患者中64%的生活质量未恢复到病前水平。
影响病死率的因素可分为三类:患者因素、动脉瘤因素、医疗机构因素。患者因素包括早期出血的严重程度、年龄、性别、就诊时间及并发症,例如高血压、心房颤动、充血性心力衰竭、冠状动脉病变、肾脏疾病等。动脉瘤因素包括大小、形态及是否位于后循环。医疗机构因素包括是否有介入治疗技术、SAH患者接诊量及首选的检查。每年诊治SAH<10例的医院30天病死率远远高于诊治35例以上的医院(分别为39%、27%;OR=1.4)[8]。
病死率与种族也有相关性,美国白种人相对于美国黑种人、西班牙裔、印第安/阿拉斯加土著族人、亚裔/太平洋岛居民,SAH病死率偏低。
(四)危险因素
动脉瘤的危险因素分为三类:动脉瘤发生的危险因素,动脉瘤增大和形态改变的危险因素,动脉瘤破裂的危险因素。动脉瘤发生的危险因素包括不可调节和可调节两种。不可调节的因素包括高龄、女性、动脉瘤或SAH家族史和合并有相关疾病的高危人群。高危人群包括常染色体显性多囊肾病、Ⅳ型Ehlers-Danlos综合征、马方综合征、主动脉狭窄、遗传性出血性毛细血管扩张症、肌纤维发育不良、动静脉畸形等。
多变量模型研究发现高血压、吸烟、酗酒均为SAH的独立危险因素[9-10]。拟交感神经药包括可卡因和苯丙醇胺与SAH的发病相关。而这些SAH的危险因素恰巧也是多发性动脉瘤的危险因素(如吸烟、女性、高血压、脑血管病家族史及绝经期后)。
另外,天气和时间对于SAH的发病也有重要的影响。冬季和春季更易发病,也有研究发现气压与血压变化存在一定的联系,且与SAH的每天发病例数相关。
(五)预防措施
目前尚无随机、对照试验提示哪种方法能降低SAH的发病率,观察性队列研究资料表明,对于年轻人来说,严格控制主要危险因素的效果较年老者好。尽管高血压是出血性脑卒中的危险因素之一,但缺乏控制血压对SAH发病率影响的研究资料。一项由117 006名女性参加的前瞻性研究提示,戒烟可减少患SAH的风险,且戒烟时间与SAH风险呈负相关。
如果一级亲属中有2例以上动脉瘤性SAH者,建议做CT动脉造影(CTA)或MRA进行动脉瘤筛查。
【推荐意见】
·SAH病死率很高,应该尽快行脑血管检查,以明确病因,及时治疗(Ⅰ级推荐,B级证据)。
·动脉瘤、高血压、吸烟、酗酒等为SAH的独立危险因素,滥用多种药物,如可卡因和苯丙醇胺与SAH的发病相关(Ⅰ级推荐,B级证据)。
·如果一级亲属中有2例以上动脉瘤性SAH者,建议做CTA或MRA进行动脉瘤筛查(Ⅲ级推荐,C级证据)。
二、急诊诊断、评估和处理
(一)SAH临床诊断和评估
大多数SAH患者因剧烈头痛急诊求医。头痛、脑膜刺激征阳性及头颅CT提示蛛网膜下腔呈高密度影是经典的诊断标准。SAH患者的急诊诊断和处理与患者的预后密切相关,且需要神经内、外科医师和放射科医师共同合作完成早期的诊断,以免漏诊和误诊,贻误治疗。
1.临床表现
患者常在体力劳动或激动时发病,主要表现为突然剧烈头痛,可伴恶心、呕吐、癫痫和脑膜刺激征,严重者可有意识障碍甚至很快死亡。少数表现不典型且头痛不严重的病例,容易导致延误诊断。
2.影像学检查
(1)头颅CT平扫:
CT是SAH诊断的首选。在SAH发病后12小时内,CT的敏感度高达98%~100%,24小时内逐渐降至93%,6天内降至57%~85%[11]。CT可发现脑池和脑沟内的高密度影,有时脑室也有高密度出血影。但出血10天后或出血量较少时,CT检查可阴性。
(2)CTA:
CTA诊断动脉瘤的敏感度为77%~100%,特异度为79%~100%[12]。动脉瘤的大小、部位和影像设备质量影响着CTA检查的敏感度及特异度。当动脉瘤直径≥5mm时,CTA的敏感度可达95%~100%,若动脉瘤直径<5mm,则敏感度仅为64%~83%[13-14]。干扰CTA特异度的因素主要是血管管腔过于迂曲,可被误诊为颅内动脉瘤,多见于大脑中动脉分支区域、前交通动脉及小脑后下动脉。Velthuis等[15]调查发现80%~83%的病例中CTA与DSA效果相同。经CTA检查后再行DSA检查,74%的患者结果相同。因此,凭CTA结果施行常规手术的做法是合理的,若因未行DSA而耽搁手术的做法缺乏依据。
CTA还可弥补DSA的不足,对于动脉瘤壁钙化、动脉瘤腔内血栓、动脉瘤导致脑实质出血的倾向及动脉瘤与骨性结构的关系等CTA具有一定优势。CTA具有快速成像、普及率广等优点,适用于急性重症患者。而CTA的缺点主要在于需使用碘造影剂、骨性伪影对成像质量产生干扰、对远端小血管尚不可及。CTA的伪影主要归咎于金属物质,因此动脉瘤已置入血管夹或弹簧圈的患者可能影响结果。随着CTA技术的不断完善,其将更好地用于急性SAH的无创性诊断。
(3)MRI和MRA:
MRI也是确诊SAH的主要辅助诊断技术。FLAIR序列、质子密度成像、DWI、梯度回波序列有助于诊断。MRI在急性期的敏感度与CT相近,但随着病程的发展,其敏感度优于CT[16-17]。因许多医院未开展急诊MRI检查、部分急症患者不配合检查、运动伪影、检查时间较长、费用高等问题限制其应用。
在SAH后的不同时间,MRI各序列的表现不同。发病数小时,T1WI为等或低信号,T2WI为等信号或高信号。发病24小时后,出血处T1WI高信号、T2WI低或高信号、FLAIR、DWI均为高信号,而梯度回波或磁敏感加权成像(SWI)为低信号。
MRA尚不能在动脉瘤定位、定性方面替代DSA。三维时间飞跃法MRA诊断颅内动脉瘤的敏感度可达55%~93%。动脉瘤的大小决定了敏感度的高低,若动脉瘤直径≥5mm,敏感度可达85%~100%;而若<5mm,则敏感度降至56%[18-20]。MRA对于判断动脉瘤颈与所属血管的关系也存在着局限性。但MRA无须碘造影、无离子辐射,适用于孕妇,可用于SAH的病因筛查。
(4)DSA:
DSA是明确SAH病因、诊断颅内动脉瘤的“金标准”。首次DSA阴性的患者占20%~25%[21],1周后再行DSA,有1%~2%患者发现之前未发现的动脉瘤[22]。但是因为DSA有一定风险且费用偏高,是否一定行二次检查应因人而异。
3.实验室和其他检查
若怀疑SAH,但急性期CT阴性,可行腰椎穿刺检查,如存在均匀血性脑脊液,可协助诊断少量的SAH。发病1周后,脑脊液黄变,显微镜下见大量皱缩红细胞,并可见吞噬了血红蛋白或含铁血黄素的巨噬细胞。
心电图检查有助于发现SAH引起的心肌受损,如P波高尖、QT间期延长和T波增高[23]。血常规、血糖、出凝血功能、血气分析、心肌酶谱、心肌标志物、钩端螺旋体抗体等检查有助于判断病情及相关病因。
临床病程与体温和白细胞相关。入院时白细胞计数高于15×109/L或体温高于37.5℃,患者的病死率为55%~60%,上述两种情况发生血管痉挛的风险高,低于上述指标的患者,病死率为25%~35%。病程中可发生低钠血症,继发于抗利尿激素分泌不足,引起尿中的水和钠丢失,从而导致血容量减少和利尿性低钠血症。对血小板计数、出血时间、凝血参数均应记录。血黏度增高伴血细胞比容超过40%,血清纤维蛋白原超过250mg,高渗透压等与预后不良有关。
4.诊断和鉴别诊断
突发剧烈头痛,并伴有恶心、呕吐、意识障碍、癫痫、脑膜刺激征阳性及头颅CT检查发现蛛网膜下腔呈高密度影,即可确诊SAH。若头痛不严重,脑膜刺激征不明显,头颅CT检查未发现异常,但仍怀疑SAH,则尽早行腰椎穿刺检查,腰椎穿刺结果提示为均匀血性脑脊液,亦可确诊SAH。
SAH需要与脑膜炎、偏头痛发作鉴别。此外,有些颅内静脉窦血栓形成的患者,CT扫描有纵裂或横窦区域的高密度影,容易误判为SAH。
5.病情评估和临床分级
SAH患者的临床分级评分标准有多个版本,包括Hunt-Hess量表(表8-1)、改良Fisher量表(主要评估血管痉挛的风险,表8-2)、格拉斯哥昏迷量表评分等。尽管如何选择量表仍存争议,但仍推荐急诊时使用至少一种上述量表对患者进行评分并记录在案。
表8-1 Hunt-Hess量表

注:对于严重的全身性疾病(例如高血压肾病、糖尿病、严重动脉硬化、慢性阻塞性肺疾病)或血管造影发现严重血管痉挛者,评分加1分
表8-2 改良Fisher量表

判断SAH患者预后常使用格拉斯哥预后评分,世界神经外科医师联盟(World Federation of Neurological Surgeons,WFNS)量表(表8-3)以及动脉瘤性SAH入院患者预后(Prognosis on Admission of Aneurysmal Subarachnoid Haemorrhage,PAASH;表8-3)量表评分。
表8-3 WFNS和PAASH量表

注:WFNS:世界神经外科医师联盟,PAASH:动脉瘤性蛛网膜下腔出血入院患者预后,GSC:格拉斯哥预后评分
患者就诊后应全面采集病史及完善相关体检,了解有无SAH危险因素、有无药物滥用史,年轻患者应予毒物筛查等。影响预后的相关因素如年龄、既往高血压史、就诊时间、入院时血压等均应记录在案。
6.SAH诊断和处理流程图
SAH是神经科急症之一,需要迅速、正确地诊断和处理(图8-1)。
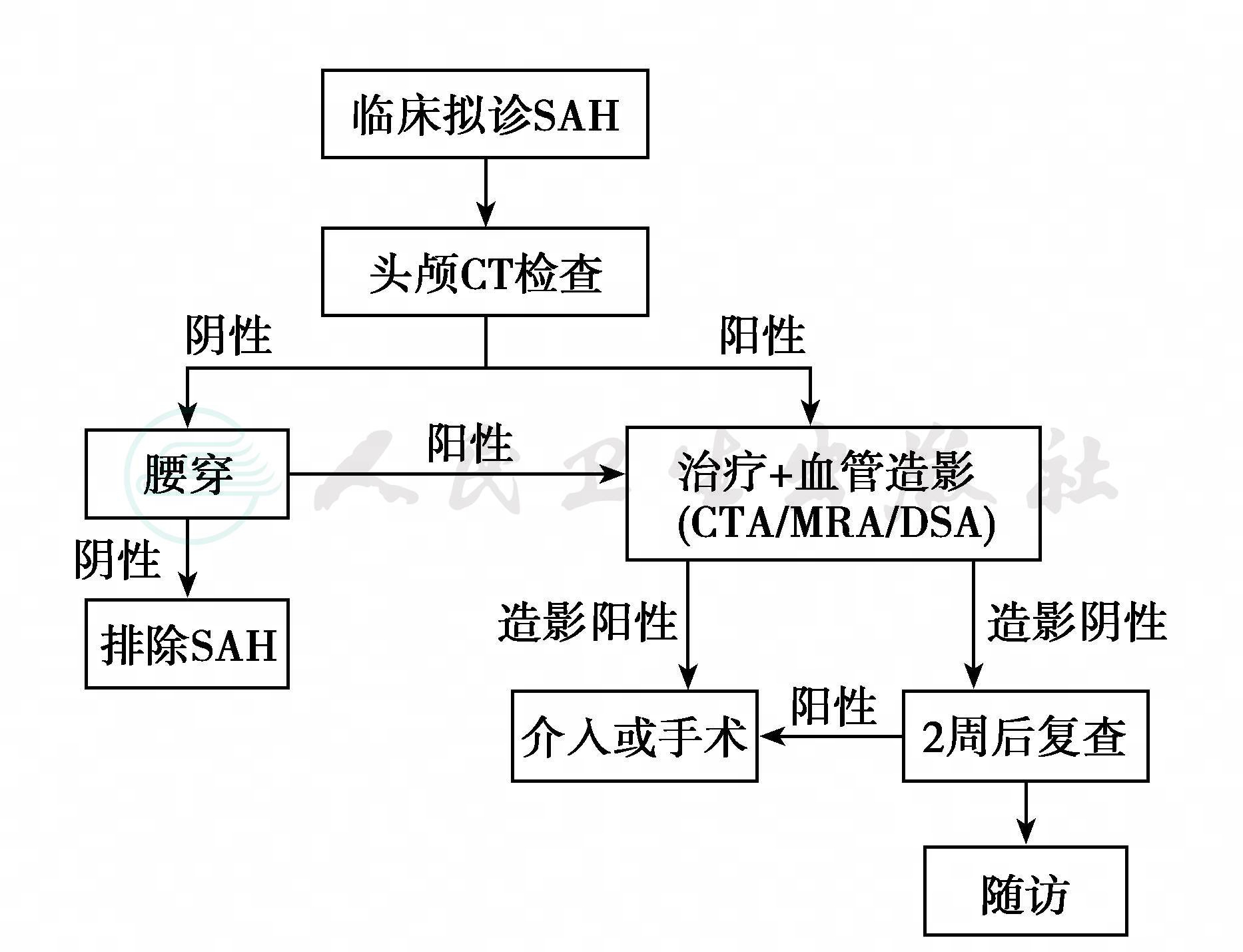
图8-1 蛛网膜下腔出血(SAH)的诊断和处理流程
【推荐意见】
·突发剧烈头痛伴脑膜刺激征阳性的患者应高度怀疑SAH诊断(Ⅰ级推荐,B级证据)。
·对可疑SAH患者应首选CT检查。当CT结果阴性时,腰椎穿刺检查有助于进一步提供诊断信息(Ⅰ级推荐,B级证据)。
·对于SAH患者宜早期行DSA检查,以明确有无动脉瘤(Ⅰ级推荐,B级证据)。
在DSA不能及时实施时,可予CTA或MRA检查(Ⅱ级推荐,B级证据)。
·动脉瘤介入治疗后,同时再做血管造影,以判断动脉瘤治疗的效果(Ⅰ级推荐,B级证据)。
·SAH评分有助于判断预后及采取不同的治疗手段。SAH早期应该使用GCS等工具进行评价(Ⅱ级推荐,B级证据)。Hunt-Hess量表简单方便,临床常用于选择手术时的参考。在预后评估方面,PAASH评分比WFNS评分的效能更好。
(二)SAH的监测和一般处理
SAH患者可能会出现各种并发症,如发热、血压和血糖升高,有意识障碍的患者还可能出现误吸及呼吸道阻塞等,其与预后相关,需要密切监测和治疗。
1.呼吸管理
保持呼吸道通畅,给予吸氧。虽然多数SAH患者不表现出气道受阻症状,但潜在的神经损伤可继发相关疾病,因此呼吸监护仍为第一要务。如果呼吸功能障碍,有必要进行气管插管,以维持气道通畅,保持正常血氧饱和度。
2.血压管理
SAH并发高血压的管理应更为严格,应该及时使用效果较强的药物,静脉推注或持续滴注,控制血压。但血压过低容易诱发缺血性损伤。因此,血压控制的变异性大,不同病因、不同并发症状态下的处理不同。
至今尚无病例对照研究明确急性SAH患者控制血压对再出血的影响。一项综述分析发现服用降压药的患者其再出血风险降低,再出血可能与血压波动的关系较血压本身更密切[24]。一项针对179例SAH患者的回顾性研究发现,在发病24小时内入院的SAH患者中,17%的再出血患者收缩压曾达150mmHg(1mmHg=0.133kPa)。救护车上或初级医院中发病2小时内的患者,再出血率为13.6%,且收缩压高于160mmHg的患者更易再出血。但有一项大型回顾性研究报道入院后再出血率为6.9%,且与血压无明显关联。由于这些研究观察时间不同,使用的抗高血压药物各异,结果存在差异[25-26]。当血压偏高时,应予静脉持续给药,例如尼卡地平、拉贝洛尔及艾斯洛尔等。
3.心电监护
国内学者回顾性研究800例SAH患者发现,发病3天内的患者66%出现心电图异常,主要表现为ST段抬高、水平下移或T波深度倒置。患者年龄、发病时意识障碍、Fisher分级以及合并脑疝、脑积水、脑血管痉挛等因素均与心电图异常相关,心电图异常与预后显著相关[27]。因此建议对于急性SAH患者,应重视心电监护,采取积极的预防措施,保护心功能,改善患者的预后。
4.水和电解质平衡
据报道,SAH后发生低钠血症的概率为10%~30%。低钠血症在前交通动脉瘤、脑积水等临床情况较差的病例中更为普遍。前瞻性、非对照研究提示低钠血症与过度的尿钠排泄和低血容量相关。延迟性缺血性神经功能缺损的发病率上升与体液减少相关,而且后者与脑血管痉挛也存在一定联系。两项随机对照研究证明了氟氢可的松可纠正低钠血症及体液平衡,因为激素能够纠正水钠负平衡,其次激素可减少对液体的需求并提高血钠浓度[27]。另一项回顾性研究提出3%的氯化钠溶液可有效改善低钠血症,5%的白蛋白也有同样的作用。
5.其他并发症
发热是SAH最常见的并发症,中枢性发热与病情的严重程度、出血量、血管痉挛的发展有关。发热是存活患者认知功能减退的独立预测因素。治疗发热能够改善患者的预后。但亚低温治疗却未能显示改善预后的治疗作用。
血糖的增高也是SAH患者预后不良的相关因素。控制血糖能改善预后。但是评分差的危重SAH患者,即使血糖正常,也存在脑内能量代谢危机和乳酸-丙酮酸比值的增高。一般建议空腹血糖控制在10mmol/L以下。
贫血也是SAH常见的一个并发症,前瞻性研究发现,高血红蛋白的患者预后较好。输注单采红细胞能提高SAH患者脑氧运输和脑氧利用率。但具体的血红蛋白水平尚未得知。
肝素诱发的血小板减少症发生率约为5%,但其发生与预防深静脉血栓时使用的肝素无关,而是与造影过程中使用的肝素量有关。发生肝素诱发的Ⅱ型血小板减少症的患者更容易发生血栓类的并发症和症状性血管痉挛或迟发性脑缺血,病死率更高、预后更差。针对此并发症,似乎只能减少肝素的使用,改为使用其替代物。
深静脉血栓形成和肺栓塞是SAH尤其是有意识障碍的危重患者的常见并发症。可以使用弹力袜。高危患者可使用间断的充气压力装置进行预防。但是预防血栓需要使用低分子肝素的时间应控制在动脉瘤手术或栓塞12小时以后。
严重头痛影响患者的情绪和睡眠,甚至促进血压升高。必要时可给予止痛剂治疗。
【推荐意见】
·注意保持呼吸道通畅(Ⅰ级推荐,B级证据)。
·注意监测血压,保持收缩压<160mmHg和平均动脉压>90mmHg(Ⅰ级推荐,C级证据)。
·重视心电监护,采取积极的预防措施,保护心功能(Ⅱ级推荐,B级证据)。
·注意诊治低钠血症(Ⅰ级推荐,B级证据)。
·空腹血糖需控制在10mmol/L以下。
·治疗发热,但是亚低温(33℃)治疗存在争议。
三、动脉瘤介入和外科手术治疗
(一)动脉瘤介入治疗
Guglielmi等[28]于1991年报道可通过血管介入技术放置铂制电离可脱弹簧圈栓塞动脉瘤,弹簧圈可导致血栓形成,将动脉瘤与循环阻隔开来。但是弹簧圈栓塞过程中存在动脉瘤穿孔、缺血等风险[29-30]。动脉瘤SAH研究(International Subarachnoid Aneurysm Trial,ISAT)报道[31]介入治疗2个月内的病死率及致残率总和为25.4%。影响栓塞治疗效果的因素为再出血率及栓塞是否完全。
(二)动脉瘤手术治疗
手术治疗能降低再出血风险。动脉瘤夹闭术的效果与夹闭是否完全有关。Brilstra等[32]研究发现,与保守治疗相比,动脉瘤夹闭术可使再出血风险下降19%。国际合作动脉瘤手术时机研究[33]显示SAH的手术时间与术前再出血密切相关(0~3天,5.7%;4~6天,9.4%;7~10天,12.7%;11~14天,13.9%;15~32天,21.5%),延迟手术影响预后。
(三)手术与栓塞治疗的比较
对一个具体的患者来说,选择合适的治疗方法对预后有重要的影响。
1.如何选择动脉瘤治疗的方法
动脉瘤的部位与采取何种治疗方法有关。大脑中动脉的动脉瘤由于其形态不一,所以使用弹簧圈栓塞有一定困难,而外科手术夹闭的治疗效果则较其他部位相对更好。但大脑后循环动脉的动脉瘤尤其是基底动脉顶端动脉瘤则较难手术治疗,这些部位的动脉瘤用弹簧圈栓塞更佳。
并发症和患者病情将影响治疗方式的选择,例如,大面积的实质血肿具有占位效应时,医师会倾向于用开颅减压术去除血肿以降低颅内压,若是神经功能较差或有明确的脑肿胀但没有占位效应的患者,医师会倾向于介入治疗。联合使用栓塞术和减压手术可以得到良好的效果。弹簧圈栓塞不能完全治愈的,需采用手术治疗。
危重患者特别是老年危重患者更适合介入手术治疗。
医师及医院的医疗水平对于治疗方式的选择也有着深远的影响。栓塞技术依赖于操作者的经验,应该有一套专业的训练项目。条件允许时,年治疗SAH例数<10例的医院最好把患者转给年治疗SAH例数>35例的医疗机构。
2.介入治疗与手术治疗比较
目前比较介入与手术治疗效果的大型、前瞻性、随机对照试验是ISAT[31,34],从9559例SAH患者中入选2143例,术前评估,然后随机分为介入或手术治疗组,1年后评估。下面为两组比较的结果。但这些结果的前提是患者年轻、清醒、为前循环动脉瘤,尚不能普及到其他不同情况。
(1)病死率:
两组没有明显差异(介入组和手术组分别为8.1%、10.1%)。
(2)致残率:
手术组高于介入组(分别为21.6%、15.6%),综合显示手术治疗比介入治疗可能带来更高的致死、致残率(分别为30.9%、23.5%,绝对危险增加7.4%,P=0.0001)。
(3)再出血率:
介入组为2.9%,而手术组为0.9%。
(4)未完全性闭塞率及动脉瘤复发率:
手术组均显著低于介入组。
(5)手术时间:
理论上,介入治疗可在诊断性造影的同时进行,既节省时间也不会增加风险。介入治疗距发病的平均时间为1.1天,而外科手术为1.8天。这项研究中介入治疗组几乎没有术前出血。
【推荐意见】
·外科手术夹闭或弹簧圈栓塞均可降低动脉瘤再破裂出血的风险(Ⅰ级推荐,B级证据)。
·应尽可能选择完全栓塞治疗动脉瘤(Ⅰ级推荐,B级证据)。
·动脉瘤的治疗方案应由经验丰富的神经外科与神经介入医师根据患者病情与动脉瘤情况共同商讨后决定(Ⅰ级推荐,C级证据)。
·对于同时适用于介入栓塞及外科手术的动脉瘤患者,应首先考虑介入栓塞(Ⅰ级推荐,A级证据)。
·支持手术夹闭的因素:年轻、合并血肿且有占位效应以及动脉瘤的因素[位置:大脑中动脉(MCA)和胼胝体周围血管的动脉瘤;宽颈动脉瘤;动脉分支直接从动脉瘤囊发出];支持栓塞的因素:年龄>70岁,无具有占位效应的血肿存在,动脉瘤因素(后循环、窄颈动脉瘤、单叶型动脉瘤),WFNS评分为Ⅳ级和Ⅴ级的危重患者(Ⅱ级推荐,C级证据)。
·早期治疗可降低再出血风险,球囊辅助栓塞、支架辅助栓塞和血流导向装置等新技术可提高早期动脉瘤治疗的有效性(Ⅱ级推荐,B级证据)。
四、预防再出血的药物和其他治疗
(一)止血的药物治疗
1967年首次应用抗纤溶药物防止再出血。迄今为止,在30篇发表的著作中,仅一半是随机对照研究,11项研究是近似随机分组。Adams等[35]综述了3项研究(2个随机研究,1个前瞻性Ⅳ期研究)结果,显示抗纤溶治疗组与对照组相比,再出血的风险显著降低。但近1/3的治疗组患者在发病2周时的状况较入选时恶化。多中心、随机、双盲、安慰剂对照研究发现,使用氨甲环酸治疗组再出血风险减少60%,但增加了脑梗死风险,抵消了其益处[36]。加强早期动脉瘤治疗结合预防性治疗脑血管痉挛,可减少因抗纤溶药物带来的缺血损害,发挥其减少术前再出血的作用。
Hillman等[37]根据氨甲环酸的特性,使用抗纤溶药物以降低早期转运中再出血的风险。他们随机选择505例发病48小时内的SAH患者,首先给予1g的氨甲环酸,随后每6小时给予1g,直到动脉瘤得到治疗,最长治疗时间不超过72小时。结果发现这种早期、短疗程、足量的止血治疗能够使患者早期再出血率从10.8%降至2.4%,且病死率也下降80%之多。
(二)其他措施
包括卧床休息,直到病因解除(例如动脉瘤处理),其他情况的卧床时间尚无定论,可个体化处理。控制血压也是防止再出血的措施之一。一般情况下,收缩压低于160mmHg是合理的治疗目标,但要注意保持脑灌注压。
SAH患者常有明显的头痛,可使用吗啡、布桂嗪等镇痛剂治疗,烦躁不安的患者可适当使用镇静剂,如氟哌啶醇5mg,肌内注射。保持大、小便通畅。
(三)去除病因
预防再出血最根本的措施是针对病因治疗,去除动脉瘤等潜在的风险。
【推荐意见】
·针对病因治疗是预防再出血的根本措施(Ⅰ级推荐,A级证据)。
·卧床休息有助于减少再出血,但需结合其他治疗措施(Ⅱ级推荐,B级证据)。
·早期、短疗程抗纤溶药物如氨基己酸或氨甲环酸治疗可减少再出血的发生(Ⅱ级推荐,B级证据)。
五、血管痉挛的监测和治疗
(一)血管痉挛的判断和监测
脑血管痉挛是颅内动脉由于SAH后痉挛变细,影像学上可见相应动脉远端受累,脑血流灌注减低。动脉瘤性SAH发生后,血管造影可发现30%~70%患者出现血管痉挛。就目前的医疗水平,仍有15%~20%的患者因血管痉挛导致脑卒中或死亡。50%做过手术但仍旧死亡的患者死因与血管痉挛有关。
1.血管痉挛的临床表现
大约一半的SAH患者因为血管痉挛而发生迟发性、缺血性神经功能缺损,其临床表现与脑梗死过程类似,可出现偏瘫、感觉障碍、语言甚至意识障碍,在排除脑积水或再出血后应考虑血管痉挛。此时血压可能升高。昏迷患者没有明显症状,因此,对于评分较差的患者需加强观察。CT或MRI灌注成像可以明确脑缺血的范围。
2.DSA判断血管痉挛的标准
DSA过程中发现大脑中动脉主干或大脑前动脉A1段直径<1mm,或大脑中动脉和大脑前动脉的远端支直径<0.5mm,可判断发生了血管痉挛。
3.经颅彩色多普勒(TCD)的判断标准
TCD判断血管痉挛的标准是血流速度超过100~120cm/s。典型患者在出血后第4天出现血流速度增快,在第11~18天达高峰,到第3~4周恢复正常。血流速度增快通常发生在延迟性缺血性神经功能缺失出现之前,与血管造影上血管痉挛期相对应。用扩容疗法减轻血管痉挛可导致血液稀释,减少循环颗粒密度,改善血流,但由于血细胞比容减少引起多普勒速度增快,有时会被误认为血管痉挛逐渐加重。
TCD的绝对值受到血压、血容量、血流动力学方面的影响导致其存在偏差。但Lindegaard比值(目标脑血管血流速度与同侧颈内动脉颅外段血流速度的比值)在下列情况下具有临床意义:若颈内动脉鞍上段、大脑前动脉、中动脉、椎-基底动脉系统比值在5~6之间,说明存在重度血管痉挛,需根据临床情况进行治疗。
【推荐意见】
· 血管痉挛在出血后的3~5天内开始出现,5~14天达到高峰,2~4周后逐渐缓解。
·新发的局灶性神经功能缺损,难以用脑积水或再出血解释时,应首先考虑为症状性血管痉挛。平均动脉压增高可能间接提示血管痉挛的发生。
·DSA判断血管痉挛的标准是大脑中动脉主干或大脑前动脉A1段直径<1mm,或大脑中动脉和大脑前动脉的远端支直径<0.5mm(Ⅰ级推荐,A级证据)。
·TCD判断标准为TCD平均流速超过120cm/s或二次检查增加20cm/s与血管痉挛相关(Ⅱ级推荐,B级证据)。
·推荐CT或MRI灌注成像明确脑缺血的范围(Ⅱ级推荐,B级证据)。
(二)血管痉挛的治疗
治疗血管痉挛的原则是通过控制颅内压、减少需氧量、增加脑血流量达到减轻缺血性损害的目的。既往使用“3H”方法(即血液稀释、高血压、高血容量)治疗脑血管痉挛[38]。但通过进一步观察发现等容量、高血压方法似乎更为有效[39]。
如果诱导高血压治疗血管痉挛无效,可以选用球囊血管扩张术治疗突发的血管痉挛[40],可以通过DSA在痉挛血管处行球囊扩张,并使用减轻血管痉挛的药物,多为钙离子拮抗剂,一氧化氮发生器也可能有效。不主张使用罂粟碱,因为其具有神经毒性。
预防全身性和代谢性损伤,对预防脑血管痉挛和避免不可逆的缺血性损伤十分重要,如高血糖、酸中毒、电解质紊乱、缺氧、高热、脓毒血症。白蛋白可防止因脑盐耗综合征导致的水、电解质缺失;发热是影响预后的独立危险因素;高血糖需胰岛素静脉滴注治疗。另外,SAH患者常发生低镁血症,与血管痉挛、预后差相关。大样本、安慰剂对照试验发现镁剂静脉滴注持续14天,可使迟发性脑缺血下降34%,3个月时的预后不良率下降23%,预后良好率增加3.4倍(95%CI为1.3~8.9)[41]。
钙离子拮抗剂特别是尼莫地平,可降低病死率、改善患者神经功能[42-43],其用法是60mg,每4小时口服一次,持续3周。如果不能口服,可以鼻饲。对于不能进食的患者,可选择静脉用药,但具体的剂量并不明确。由于在血管造影中未发现尼莫地平具有显著的血管扩张作用,所以其对改善预后的机制尚未明确。有趣的是,尼卡地平作为与其类似的L型钙离子通道阻断剂,通过静脉给药可减少30%的血管痉挛,但对预后却没有改善。
头部振颤法有助于血块溶解,通过对230例患者进行试验发现,该方法可降低永久缺血性神经损伤8.8%~2.5%,Rankin量表显示对预后的改善具有统计学意义[44]。
其他如依布硒啉、内皮素1a拮抗剂和硝酸甘油贴膜治疗血管痉挛具有一定前景。除此之外,还有他汀类初步试验(辛伐他汀及普伐他汀)都提示具有减少血管痉挛、提高生存率的可能。
球囊扩张血管成形术通过扩张近端大血管改善远端血管的血流,但不良反应较多,如血管阻塞、血管破裂、血栓形成以及动脉瘤易位等。早期治疗(<2小时)可改善血流分布,而更重要的是可使院内病死率降低16%[40]。
【推荐意见】
·常规口服或静脉滴注尼莫地平,可有效防止动脉痉挛(Ⅰ级推荐,A级证据)。
·维持有效的循环血容量可预防迟发性缺血(Ⅰ级推荐,B级证据)。不推荐预防性应用高容量治疗和球囊扩张(Ⅲ级推荐,B级证据)。
·动脉瘤治疗后,如发生动脉痉挛性脑缺血,可以诱导血压升高,但若血压已经很高或心脏情况不允许时则不能进行(Ⅰ级推荐,B级证据)。
·如动脉痉挛对高血压治疗没有反应,可酌情选择脑血管成形术和(或)动脉内注射血管扩张剂治疗(Ⅲ级推荐,B级证据)。
六、脑积水的治疗
急性脑积水(72小时内脑室扩张)发生率为15%~87%,临床评分或Fisher评分较差的病例更易出现急性脑积水。约1/3的急性脑积水患者没有症状,大约1/2的患者在24小时内脑积水会自发缓解。但如果脑积水导致病情恶化或有脑疝风险,需要尽快行脑室外引流或者腰椎穿刺放液治疗,使颅内压维持在10~20mmHg。在脑室引流后,有40%~80%意识水平下降的患者有不同程度的改善。脑室引流与再出血的相关性尚未确定。
8.9%~48.0%慢性脑室扩大的患者需行永久性分流术。手术适合于年龄较大、早期脑室扩大、脑室内出血、临床情况差的患者以及女性。外科手术和介入治疗患者,其慢性脑积水的发生率差异无统计学意义。脑室分流术、脑室腹膜分流术、椎管腹膜分流术均可改善患者的临床症状。
有颅内压升高的时候,可以使用甘露醇、高渗盐水、甘油果糖等渗透性脱水剂治疗,血渗透压应维持在300~320mOsm/L。用法:20%甘露醇250ml静脉快速滴注,每天2~4次。与呋塞米(速尿)合用,可增加疗效。甘油果糖250m l缓慢静脉滴注,每日2次或23.4%高渗盐水30m l团注。
如果颅内压仍高于20mmHg,可以使用止痛和镇静治疗,如异丙酚、依托咪酯、咪达唑仑、吗啡、阿芬他尼,或者使用神经肌肉阻滞治疗。
【推荐意见】
·伴第三、四脑室积血的急性脑积水患者可考虑行脑室引流(Ⅰ级推荐,B级证据)。
·伴有症状的慢性脑积水患者可行临时或永久的脑脊液分流术(Ⅰ级推荐,C级证据)。
七、癫痫样发作的治疗
已证实SAH后癫痫样发作与动脉瘤破裂有关,最近的回顾性研究报道癫痫样发作的发生率为6%~26%。大多数发作发生于就诊之前,在入院后予抗癫痫药物治疗后则几乎不发作,迟发性癫痫约占7%,回顾性研究发现其相关因素包括大脑中动脉动脉瘤、出血的厚度、伴发实质血肿、再出血、脑梗死、评分差以及有高血压病史。但目前尚缺乏癫痫样发作对预后影响的研究,所以不清楚其是否与预后不佳相关。
SAH患者也可表现为无阵挛性癫痫。一组选择性观察研究发现,通过脑电图监测可以探查到19%因SAH昏迷或意识不清的患者,存在无阵挛性癫痫,可持续约18天,这些患者均使用了预防性的抗癫痫药物治疗,但均死亡。几个研究结果显示,围术期使用预防性抗癫痫药物也未能显示对预后的改善作用。一项非随机研究结果显示,开颅手术患者预防性应用抗癫痫药物有益,但病例很少。血管内弹簧圈栓塞在操作前后未诱发癫痫性发作,但迟发性癫痫发生率为3%。根据ISAT(International Subarachnoid Aneurysm Trial)随访结果,血管内弹簧圈治疗的患者癫痫性发作率更低。还有研究显示预防性抗癫痫药物苯妥英钠的浓度与SAH后3个月时的认知功能低下独立相关。综上所述,关于SAH继发性癫痫样发作的研究还需完善。
【推荐意见】
·有明确癫痫发作的患者必须用药治疗,但是不主张预防性应用(Ⅱ级推荐,B级证据)。
·不推荐长期使用抗癫痫药物(Ⅲ级推荐,B级证据);但对既往有癫痫、脑出血、脑梗死、大脑中动脉动脉瘤破裂的癫痫样发作的高风险人群,可考虑长期使用抗癫痫药物(Ⅱ级推荐,B级证据)。
[1]饶明俐.中国脑血管病防治指南[M].北京:人民卫生出版社,2007.
[2]Ingall T,Asplund K,Mahonen M,et al.A multinational comparison of subarachnoid hemorrhage epidemiology in the WHO MONICA stroke study[J].Stroke,2000,31(5):1054-1061.
[3]Broderick JP,Brott T,Tomsick T,et al.The risk of subarachnoid and intracerebral hemorrhages in blacks as compared with whites[J].N Engl JMed,1992,326(12):733-736.
[4]Ayala C,Greenlund KJ,Croft JB,et al.Racial/ethnic disparities in mortality by stroke subtype in the United States,1995-1998[J].Am JEpidemiol,2001,154(11):1057-1063.
[5]Kojima M,Nagasawa S,Lee YE,et al.Asymptomatic familial cerebral aneurysms[J].Neurosurgery,1998,43(4):776-781.
[6]Raaymakers TW.Aneurysms in relatives of patients with subarachnoid hemorrhage:frequency and risk factors:MARS Study Group:Magnetic Resonance Angiography in Relatives of Patients with Subarachnoid Hemorrhage[J].Neurology,1999,53(5):982-988.
[7]Broderick JP,Brott TG,Duldner JE,et al.Initial and recurrent bleeding are themajor causes of death following subarachnoid hemorrhage[J].Stroke,1994,25(7):1342-1347.
[8]Cross DT 3rd,Tirschwell DL,Clark MA,et al.Mortality rates after subarachnoid hemorrhage:variations according to hospital case volume in 18 states[J].JNeurosurg,2003,99(5):810-817.
[9]Qureshi AI,Suri MF,Yahia AM,et al.Risk factors for subarachnoid hemorrhage[J].Neurosurgery,2001,49(3):607-612.
[10]Taylor CL,Yuan Z,SelmanWR,etal.Cerebral arterialaneurysm formation and rupture in 20,767 elderly patients:hypertension and other risk factors[J].JNeurosurg,1995,83(5):812-819.
[11]van Gijn J,van Dongen KJ.The time course of aneurysmal haemorrhage on computed tomograms[J].Neuroradiology,1982,23(3):153-156.
[12]Vieco PT,Shuman WP,Alsofrom GF,et al.Detection of circle ofWillis aneurysms in patientswith acute subarachnoid hemorrhage:a comparison of CT angiography and digital subtraction angiography[J].AJR Am JRoentgenol,1995,165(2):425-430.
[13]Korogi Y,Takahashi M,Katada K,et al.Intracranial aneurysms:detection with three-dimensional CT angiography with volume rendering:comparison with conventional angiographic and surgical findings[J].Radiology,1999,211(2):497-506.
[14]Alberico RA,Patel M,Casey S,et al.Evaluation of the circle ofWillis with three-dimensional CT angiography in patientswith suspected intracranial aneurysms[J].AJNR Am JNeuroradiol,1995,16(8):1571-1578;discussion 1579-1580.
[15]Velthuis BK,Rinkel GJ,Ramos LM,et al.Subarachnoid hemorrhage:aneurysm detection and preoperative evaluation with CT angiography[J].Radiology,1998,208(2):423-430.
[16]Fiebach JB,Schellinger PD,Geletneky K,et al.MRI in acute subarachnoid haemorrhage:findings with a standardised stroke protocol[J].Neuroradiology,2004,46(1):44-48.
[17]Kidwell C,Wintermark M.Imaging of intracranial haemorrhage[J].Lancet Neurol,2008,7(3):256-267.
[18]Huston J 3rd,Nichols DA,Luetmer PH,et al.Blinded prospective evaluation of sensitivity of MR angiography to known intracranial aneurysms:importance of aneurysm size[J].AJNR Am JNeuroradiol,1994,15(9):1607-1614.
[19]Schuierer G,Huk WJ,Laub G.Magnetic resonance angiography of intracranial aneurysms:comparison with intra-arterial digital subtraction angiography[J].Neuroradiology,1992,35(1):50-54.
[20]Anzalone N,Triulzi F,Scotti G.Acute subarachnoid haemorrhage:3D time-of-flight MR angiography versus intra-arterial digital angiography[J].Neuroradiology,1995,37(4):257-261.
[21]Cioffi F,Pasqualin A,Cavazzani P,et al.Subarachnoid haemorrhage of unknown origin:clinical and tomographical aspects[J].Acta Neurochir(Wien),1989,97(1-2):31-39.
[22]Forster DM,Steiner L,Hakanson S,etal.The value of repeatpan-angiography in cases ofunexplained subarachnoid hemorrhage[J].JNeurosurg,1978,48(5):712-716.
[23]刘建仁,冷冰,宋冬雷,等.自发性蛛网膜下腔出血患者心电图异常的影响因素及其与预后的关系[J].国际脑血管病杂志,2007,15(7):514-518.
[24]Stornelli SA,French JD.Subarachnoid hemorrhage:factors in prognosis and management[J].J Neurosurg,1964,21(9):769-780.
[25]Fujii Y,Takeuchi S,Sasaki O,et al.Ultra-early rebleeding in spontaneous subarachnoid hemorrhage[J].JNeurosurg,1996,84(1):35-42.
[26]Naidech AM,Janjua N,Kreiter KT,et al.Predictors and impact of aneurysm rebleeding after subarachnoid hemorrhage[J].Arch Neurol,2005,62(3):410-416.
[27]Hasan D,Lindsay KW,Wijdicks EF,et al.Effect of fludrocortisone acetate in patients with subarachnoid hemorrhage[J].Stroke,1989,20(9):1156-1161.
[28]GuglielmiG,Vinuela F,Dion J,et al.Electrothrombosis of saccular aneurysms via endovascular approach,part 2:preliminary clinical experience[J].JNeurosurg,1991,75(1):8-14.
[29]Brilstra EH,Rinkel GJ,van der Graaf Y,et al.Treatment of intracranial aneurysms by embolization with coils:a systematic review[J].Stroke,1999,30(2):470-476.
[30]Wiebers DO,Whisnant JP,Huston J 3rd,et al,for the International Study of Unruptured Intracranial Aneurysms Investigators.Unruptured intracranial aneurysms:natural history,clinical outcome,and risks of surgical and endovascular treatment[J].Lancet,2003,362(9378):103-110.
[31]Molyneux A,Kerr R,Stratton I,et al,for the International Subarachnoid Aneurysm Trial(ISAT)Collaborative Group.International Subarachnoid Aneurysm Trial(ISAT)of neurosurgical clipping versus endovascular coiling in 2143 patients with ruptured intracranial aneurysms:a randomised trial[J].Lancet,2002,360(9342):1267-1274.
[32]Brilstra EH,Algra A,Rinkel GJ,et al.Effectiveness of neurosurgical clip application in patients with aneurysmal subarachnoid hemorrhage[J].JNeurosurg,2002,97(5):1036-1041.
[33]Kassell NF,Torner JC,Jane JA,et al.The International Cooperative Study on the Timing of Aneurysm Surgery,part 2:surgical results[J].JNeurosurg,1990,73(2):37-47.
[34]Molyneux AJ,Kerr RS,Yu LM,et al,for the International Subarachnoid Aneurysm Trial(ISAT)Collaborative Group.International Subarachnoid Aneurysm Trial(ISAT)of neurosurgical clipping versus endovascular coiling in 2143 patients with ruptured intracranial aneurysms:a randomised comparison of effects on survival,dependency,seizures,rebleeding,subgroups,and aneurysm occlusion[J].Lancet,2005,366(9488):809-817.
[35]Adams HP Jr,Nibbelink DW,Torner JC,et al.Antifibrinolytic therapy in patientswith aneurysmal subarachnoid hemorrhage:a report of the Cooperative Aneurysm Study[J].Arch Neurol,1981,38(1):25-29.
[36]Torner JC,Kassell NF,Wallace RB,et al.Preoperative prognostic factors for rebleeding and survival in aneurysm patients receiving antifibrinolytic therapy:report of the Cooperative Aneurysm Study[J].Neurosurgery,1981,9(5):506-513.
[37]Hillman J,Fridriksson S,Nilsson O,et al.Immediate administration of tranexamic acid and reduced incidence of early rebleeding after aneurysmal subarachnoid hemorrhage:a prospective randomized study[J].JNeurosurg,2002,97(4):771-778.
[38]Lennihan L,Mayer SA,Fink ME,et al.Effect of hypervolemic therapy on cerebral blood flow after subarachnoid hemorrhage:a randomized controlled trial[J].Stroke,2000,31(2):383-391.
[39]Dankbaar JW,Slooter AJ,Rinkel GJ,et al.Effect of different components of triple-H therapy on cerebral perfusion in patients with aneurysmal subarachnoid haemorrhage:a systematic review[J].Crit Care,2010,14(1):1-10.
[40]Appelboom G,Strozyk D,Hwang BY,et al.Bedside use of a dual aortic balloon occlusion for the treatment of cerebral vasospasm[J].Neurocrit Care,2010,13(3):385-388.
[41]van den Bergh WM,Algra A,van Kooten F,et al,for the MASH Study Group.Magnesium sulfate in aneurysmal subarachnoid hemorrhage:a randomized controlled trial[J].Stroke,2005,36(2):1011-1015.
[42]Dorhout Mees SM,Rinkel GJ,Feigin VL,et al.Calcium antagonists for aneurysmal subarachnoid haemorrhage[J].Cochrane Database Syst Rev,2007(3):CD000277.
[43]Allen GS,Ahn HS,Preziosi TJ,et al.Cerebral arterial spasm:a controlled trial of nimodipine in patients with subarachnoid hemorrhage[J].N Engl JMed,1983,308(11):619-624.
[44]Kawamoto S,Tsutsumi K,Yoshikawa G,et al.Effectiveness of the head-shakingmethod combined with cisternal irrigation with urokinase in preventing cerebral vasospasm after subarachnoid hemorrhage[J].JNeurosurg,2004,100(2):236-243.