 去看看
去看看


1954年美国成功实施了首例同卵双生兄弟间活体供肾移植,此后经历半个多世纪的发展,活体肾移植成为终末期肾病(end-stage renal disease,ESRD)患者的重要治疗手段[1-2]。1972年12月中山医学院第一附属医院(现中山大学附属第一医院)外科完成了我国首例亲属活体供肾移植[3]。同济医科大学附属同济医院(现华中科技大学同济医学院附属同济医院)于1999年完成我国首例同卵双生姐妹间活体供肾移植[4]。
尽管近年来我国公民逝世后器官捐献得到长足进步,但仍然难以满足需求。在此情况下,亲属活体供肾移植重新成为移植界关注的焦点[5]。借鉴国外移植领域的经验,亲属活体器官捐献肾移植作为家庭自救的主要方式之一,已成为我国尿毒症患者日益重要的治疗手段[6-7]。
2009年,基于我国器官移植的法律法规,总结我国和国外活体供肾移植的临床经验,借鉴循证医学证据,中华医学会组织专家制订了《中国活体供肾移植指南》。此后6年间,国际和我国活体肾移植领域无论在法律法规还是临床研究方面均有所进展,为进一步规范我国活体肾移植,我们组织专家对2009年的指南进行更新。
本指南中所涉及的诊断和治疗策略绝大部分有循证医学证据支持。根据循证医学证据的质量等级标准分为:1级为多个随机对照试验的系统综述,2级为单个随机对照试验,3级为单个队列试验或病例对照试验;4级为多个非试验性研究、专家意见、描述性研究。本指南中的推荐意见的推荐等级分为:A级为高质量循证医学证据支持;B级为中等质量循证医学证据支持;C级为低质量循证医学证据支持,或该治疗的不良反应大于其疗效;D级为中等质量循证医学证据反对;E级为高质量循证医学证据反对。
1 活体肾移植的优势
确凿证据显示,活体供肾移植的人、肾长期存活率均明显优于尸体供肾移植[8]。与尸体供肾移植相比,活体供肾移植主要具有以下优势:①扩大供肾来源,缩短受者等待时间;②亲属活体供肾比尸体供肾更容易获得较为理想的人类白细胞抗原(HLA)配型,可降低术后出现排斥反应的可能性;③术前可以全面评估供肾质量,并选择恰当的手术时机;④冷、热缺血时间明显缩短,可减少缺血-再灌注损伤导致的移植肾不良事件;⑤便于在供者健康状况允许的条件下,在移植术前对受者进行免疫干预。
2 相关法律原则和伦理学
2.1 法律原则
世界卫生组织在1991年颁布了《人体器官移植指导原则》,内容包括器官捐献的自愿原则、非商业化原则、公平原则等,以此构成国际器官移植的基本准则[9]。我国在2007年颁布实施了《人体器官移植条例》(《条例》),这是我国首个关于器官移植的法律文件。2009年又制定了《关于规范活体器官移植的若干规定》[10]。依据上述两个文件,我国对活体器官移植规定如下:开展活体肾移植的医疗机构仅限于卫生部指定机构;活体器官捐献者必须自愿、无偿,年满18周岁且具有完全民事行为能力;活体器官捐献人和接受人限于以下关系:①配偶(仅限于结婚3年以上或者婚后已育有子女);②直系血亲或者三代以内旁系血亲;③因帮扶等形成亲情关系(仅限于养父母和养子女之间的关系、继父母与继子女之间的关系)。
2.2 伦理学
按《条例》规定,实施活体器官移植的医疗机构必须成立“人体器官移植技术临床应用和伦理委员会”,在摘取活体器官前,负责人体器官移植的执业医师应当向所在医疗机构的人体器官移植技术临床应用与伦理委员会提出摘取人体器官审查申请。人体器官移植技术临床应用与伦理委员会收到申请后,应当对下列事项进行审查,并出具同意或者不同意的书面意见:①人体器官捐献人的捐献意愿是否真实;②有否买卖或者变相买卖人体器官的情形;③人体器官的配型和接受人的适应证是否符合伦理原则和人体器官移植技术管理规范。经全体委员同意,人体器官移植技术临床应用与伦理委员会方可出具同意摘取人体器官的书面意见。人体器官移植技术临床应用与伦理委员会不同意摘取人体器官的,医疗机构不得作出摘取人体器官的决定,医务人员不得摘取人体器官。从事活体器官移植的医疗机构在伦理委员会出具同意摘取活体器官的书面意见后,应将相关材料上报省级卫生行政部门,根据回复意见实施。
3 知情同意
各移植中心必须履行充分的活体供肾移植相关事项的告知义务。
推荐意见:
1.活体肾移植的开展必须遵循中国的法律法规,并符合伦理要求(未分级)。
2.移植中心需履行告知义务,包括治疗方式可以选择尸体供肾移植或其他肾脏替代治疗、手术的近远期风险、移植的近远期效果、捐献者可以中途退出等(未分级)。
4 供者医疗评估
活体肾移植供者评估的首要目的是为了确保供者捐献肾脏的适合性,最核心的是供者的安全性问题。对活体供者的全面评估,主要目的在于确保供者在心理、生理上符合肾脏捐献的要求,保障供者的长期健康,同时兼顾受者的移植效果。
推荐意见:
3.以快速、安全的方式确定意向供者是否适合捐献以及相关风险,快速确定不适合的供者可以让新的意向供者进入评估程序(未分级)。
4.1 ABO血型
ABO血型的相容性是首要鉴别条件,《条例》规定不相容者不能捐献。大样本研究表明ABO血型不相容肾移植可以取得和血型相容移植一致的临床效果[11]。国内由于器官短缺,部分移植中心已成功开展了ABO血型不相容肾移植,但总体而言仍属探索阶段,宜谨慎进行。
推荐意见:
4.首选ABO相容的供者-受者(1-A)。
5.只有在没有血型相合供者,且受者病情不允许等待尸体移植时才可考虑血型不相容肾移植,且应充分告知风险(1-A)。
4.2 组织相容性检测
组织相容性评估包含3个要素:确定供者-受者HLA相合状态;检测受者抗体;供受者交叉配型。受者具有供体特异性抗体(donor specific antibody,DSA)是确定的危险因素。在活体移植前,可对受者进行降敏处理,据处理结果决定是否移植。多数研究表明,经过适当的降敏治疗,具有DSA的受者在移植后的短期效果令人鼓舞,但长期效果不如没有DSA的受者[12]。因此,从提高患者远期存活率考虑,进行此类移植应谨慎。另一方面,大样本研究显示,即使是具有DSA的受者,其移植后的存活率也高于继续透析或等待尸体移植的患者。因此,对没有替代活体供者,尸体移植也难以找到匹配供者的高致敏患者,预处理后的活体移植也不失为一种选择,但应充分告知患者风险。
推荐意见:
6.所有供受者均应检测组织相容性,有多个供者时原则上选择组织相容性更好的供者(1-B)。
7.尽量避免DSA阳性的活体移植,对没有替代活体供者、尸体移植也难以找到匹配供者的高致敏患者,可在预处理结果满意的情况下进行,但应充分告知患者风险(1-B)。
8.移植前14d内收集血清样本必须通过敏感的交叉配型检测,若交叉配型阳性,移植通常不应进行(1-B)。
4.3 全身情况的医学鉴定
4.3.1 病史和体格检查
推荐意见:
9.应详细询问意向供者病史(表1),并完成体格检查(1-A)。
4.3.2 临床检查项目
推荐意见:
10.严格完成临床检查,详见表2(1-B)。
4.4 肾脏解剖学评估
肾脏解剖学评估包括:双肾体积、肾血管以及其他解剖变异(如重复肾、重复肾盂、肾盂输尿管交接部狭窄等)。推荐CT三维重建或MRI取代传统的静脉尿路造影术(intravenous urography,IVU)和血管造影[13]。原则上,双侧变异者不能用于供肾。对于单侧变异,如果已有病理改变者不能用于供肾;如尚无病理改变,则可作为活体供肾的相对禁忌。只有在没有选择,受者不能耐受透析的情况下,选取存在解剖异常的一侧作为供肾,并在术前与供受者充分沟通。
多支血管严格说来属于解剖变异,而非异常。对训练有素、具有血管处理经验的医师而言,多支血管的处理并非难事,不应作为手术禁忌。但手术医师应接受过血管外科的相关培训,必要时可与血管外科医师共同手术,保障供受者的安全。
推荐意见:
11.CT三维重建是肾脏解剖学评估的标准方式,也可选择MRI(1-B)。
12.慎重选择存在解剖异常的供者,根本出发点是保障供者安全(1-B)。
13.多支血管并非禁忌,但应由血管处理经验丰富的医师施行手术(1-A)。
4.5 肾功能评估
肾功能的评估主要是测定肾小球滤过率(glomerular filtration rate,GFR)。标准方法为测定菊粉清除率,此法昂贵而繁琐,目前很少使用。常用方法为收集24h尿液检测肌酐清除率,也可采用放射性核素等方法。目前公认的GFR下限为80ml/(min·1.73m2)。少数中心以90ml/(min·1.73m2)为标准,主要原因在于现有慢性肾病2期的定义为GFR 60~89ml/(min·1.73m2)。 正常成人40岁以后平均每年下降0.9ml/(min·1.73m2)[14],因此随年龄增长,供者GFR的安全临界值也逐年下降。应用英国核医学协会GFR指南推荐的检测方法(51Cr-ETDA)对428例活体捐肾者的GFR检测分析结果显示,中青年安全临界值为86ml/(min·1.73m2),至80岁下降至50ml/(min·1.73m2)[15]。 然而,考虑到受者的肾功能恢复,宜将供者GFR标准定为80ml/(min·1.73m2)以上。
表1 需要了解供肾意向供者的病史内容

注:HIV为人类免疫缺陷病毒;HTLV为人类T淋巴细胞病毒
表2 供肾意向供者的常规筛查项目

续表
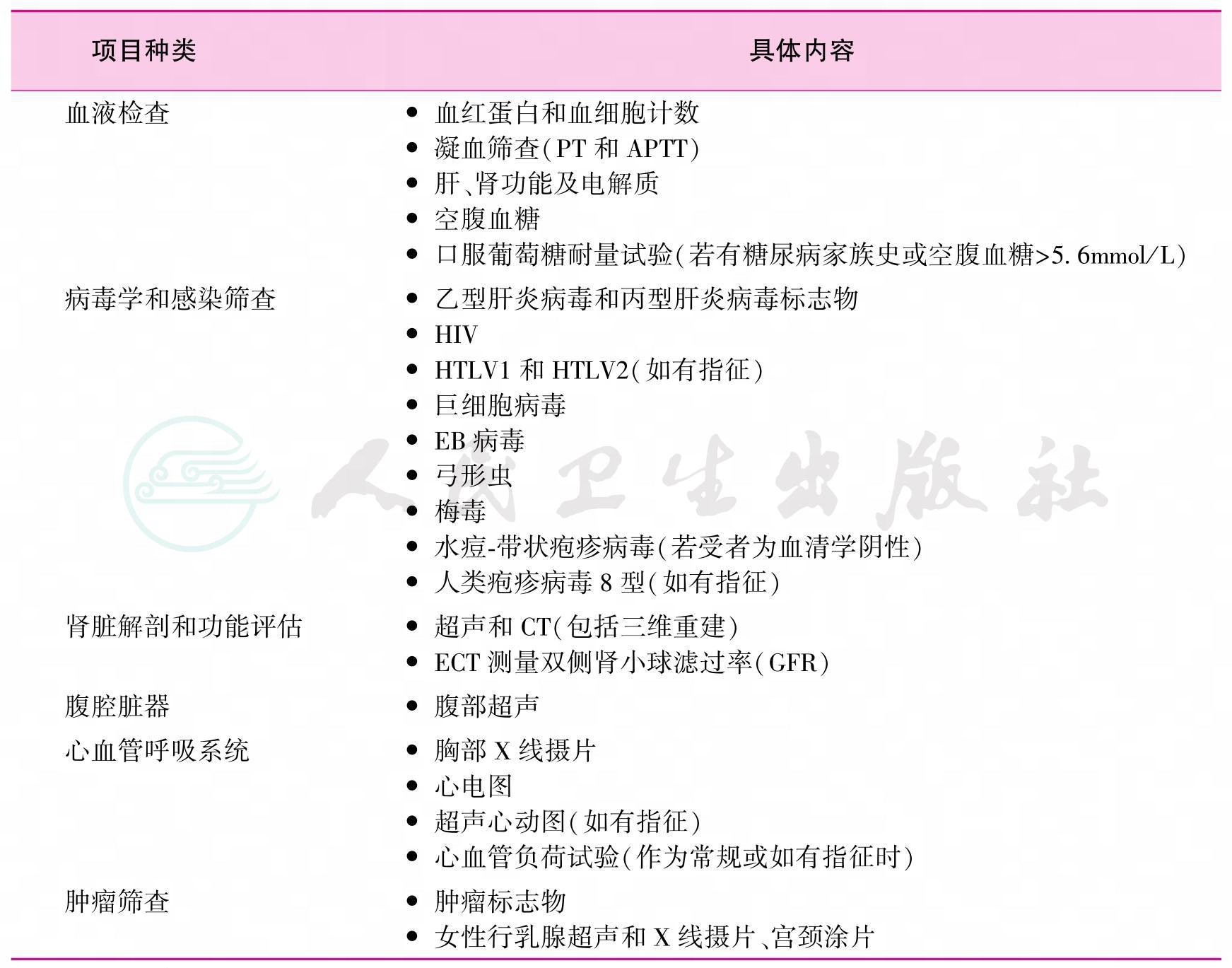
注:BMI为体质量指数;PT为凝血酶原时间;APTT为活化部分凝血活酶时间;HIV为人类免疫缺陷病毒;HTLV为人类T淋巴细胞病毒;ECT为发射型计算机断层摄影术
值得注意的是,总肾功能达标,但有一侧肾功能受损的情况并非罕见。对分肾功能的测定,目前欧美活体肾移植指南均未提及,也缺乏可靠的实验研究。建议进行放射性同位素扫描,单侧肾脏的CFR均应≥40ml/(min·1.73m2)。
推荐意见:
14.测定GFR的标准方法为测定菊粉清除率,而临床常用方法为收集24h尿液检测肌酐清除率或放射性核素,供者需GFR≥80ml/(min·1.73m2)(1-B)。
15.建议进行放射性同位素扫描,单侧肾脏的GFR均应≥40ml/(min·1.73m2)(2-B)。
4.6 年龄
我国法律规定,供者必须年满18岁。对供者的年龄上限,国际上并无统一标准[16]。考虑到供者的围手术期安全,≤65岁可能是目前比较适宜的标准。对年龄>65岁的供者,不仅应进行活体供肾的相关评估,还应对手术相关项目进行全面检查,同时应充分告知供受者,高龄供者围手术期风险远大于年轻供者,且受者的长期肾功能有可能不如年轻供者,对年轻受者可能更是如此。
推荐意见:
16.老龄单因素并非捐献的绝对禁忌证,但针对老龄供者必须进行特别严格的医学检查,以确保其适合捐献(1-A)。
17.应告知供者和受者,供者年龄越大,围手术期并发症风险越高,而且移植物功能及受者长期生存可能受到影响(1-B)。
4.7 体质量指数
肥胖供者的代谢性疾病、心血管疾病以及呼吸系统和肾脏疾病发生率高,捐献肾脏对其有更多的短长期风险。目前对肥胖供者的应用趋于谨慎。1995年的美国只有16%的移植中心排除肥胖的意向供者,而2007年有52%的移植中心排除了体质量指数(BMI)>35kg/m2的意向供者,10%的中心排除了BMI>30kg/m2的意向供者。国内绝大多数移植中心认为BMI>35kg/m2为肾脏捐献的绝对禁忌证,BMI>30kg/m2的供者需进行仔细的术前评估,并建议达到理想体质量后再考虑捐献[17]。
推荐意见:
18.供者的理想BMI应<30kg/m2(1-B)。
19.中度肥胖(BMI为30~35kg/m2)的意向供者应全面评估,并建议其捐献前减重,捐献后维持理想体质量(1-B)。
20.重度肥胖(BMI>35kg/m2)通常不适合供肾(2-C)。
4.8 高血压
高血压可导致供者包括肾脏在内的多器官损害,目前的共识是药物不能控制的高血压不适合捐献。对药物可控的高血压,由于缺乏前瞻性研究,暂无统一标准。有移植中心排除所有高血压供者,也有中心认为只用1种药物就能控制血压的供者也可接受,还有中心接受2种药物可以控制血压的供者。尚需大样本的长期研究才能明确各种程度的高血压对供者的影响[18]。
推荐意见:
21.药物不能控制的高血压不适合捐肾(1-B)。
22.需关注高血压对供者影响的研究进展(未分级)。
4.9 糖尿病
现有绝大部分国际指南认为,明确诊断为1型或2型糖尿病患者不能捐献。空腹血糖受损者(6.1~7.0mmol/L)如有一级亲属2型糖尿病病史,不适合捐献。如没有家族史,需行标准的口服葡萄糖耐量试验(oral glucose tolerance test,OGTT)。餐后2h血糖>11.1mmol/L为糖尿病,禁忌捐赠;>7.8mmol/L为葡萄糖耐量降低,需结合供者血糖控制的依从性以及受者手术的急迫程度综合分析。
推荐意见:
23.明确诊断为糖尿病的患者不能捐献(1-B)。
24.空腹血糖受损:
(1)如一级亲属有2型糖尿病病史,不适合捐献(1-B)。
(2)一级亲属没有2型糖尿病病史需行OGTT,如为糖尿病则禁忌捐献,如为OGTT降低,可据情况综合评估(1-B)。
4.10 心血管评估
年轻供者如无明确心血管疾病历史,只需进行常规心电图检查。50岁以上或40岁以上伴有冠状动脉粥样硬化性心脏病(冠心病)危险因素如吸烟、高血压、心电图异常或者有明确冠心病家族史的意向供者都必须接受心脏应激试验检查。心脏发现杂音者应当行超声心动图检查。有昏厥、头晕或者心悸病史的供者应该接受超声心动图和动态心电图检查。
推荐意见:
25.对以下意向供者需行全面的心血管评估:有心脏疾病病史;具有心血管疾病危险因素;老年供者(1-B)。
26.筛查意向供者心血管疾病时,应设置较低阈值以作为排除标准(1-B)。
4.11 蛋白尿
蛋白尿是慢性肾脏疾病(chronic kidney disease,CKD)的重要标志。24h尿蛋白测定是目前评估尿蛋白的标准方法。多数中心以24h尿蛋白<300mg为标准,超过者是肾脏捐献禁忌,但也有少数中心以150mg为标准[16]。目前也有报道认为尿白蛋白测定比总蛋白更为敏感,但尚未广泛用于供者评估方面。生理性蛋白尿并非捐献禁忌。
推荐意见:
27.24h尿蛋白>150mg者禁忌捐献(1-B)。
28.尿白蛋白用于供者评估的价值尚待进一步研究(2-C)。
4.12 镜下血尿
剧烈运动、外伤等可以引起镜下血尿,并非捐献禁忌。如反复镜下血尿,又不能排除泌尿系肿瘤、结石、感染、慢性肾病等疾病者,不应作为供者。检查包括尿红细胞形态、泌尿系统影像学检查、细胞学检查、膀胱镜检以及肾活检。
推荐意见:
29.存在病理性或不明原因镜下血尿的供者不宜捐献(1-B)。
4.13 尿路感染
单纯尿路感染,常规治疗后痊愈者不是捐献禁忌。反复尿路感染的意向供者应当行泌尿系影像学、膀胱镜检和尿流动力学检测以排除隐匿性疾病、解剖畸形或者神经源性膀胱,此类供者不宜捐献。
推荐意见:
30.经常规治疗痊愈的单纯尿路感染不影响捐献,对复杂性尿路感染,除非能治愈原发疾病以及感染,通常不适合捐献(1-B)。
4.14 感染
患有可通过器官移植传播的传染性疾病的供者通常不适合捐献,包括病毒、细菌、真菌和寄生虫感染,最主要的是病毒和结核分枝杆菌。同时,受者存在活动性感染时也不宜接受移植。
供者人类免疫缺陷病毒(human immunodeficiency virus,HIV)感染是捐献肾脏的绝对禁忌证。丙型肝炎病毒(hepatitis C virus,HCV)感染既往也属禁忌,但近年来新型药物大大提高了HCV治愈率,可建议供者在治愈后捐献。存在病毒复制的乙型肝炎病毒(hepatitis B virus,HBV)的供者不能捐献,对没有病毒复制者,目前多认为传染风险极小,对有保护性抗体的受者尤其如此。但应和供受者充分沟通,告知理论上仍有传播风险,并可在术中术后使用抗病毒药物或HBV免疫球蛋白。供者血清学巨细胞病毒(cytomegalovirus,CMV)和EB病毒阳性而受者阴性时,是移植后受者感染的高危因素。在国内此类情况少见,即使如此也非移植禁忌,但在移植后需严密监测病毒复制并使用针对性药物预防。
管理细菌感染的重点是排除结核分枝杆菌感染,尤其应重视来自结核疫区或者高危人群的供者。注意病史采集和影像学检查,结合结核菌素试验或者γ-干扰素释放实验进行结核筛查。活动的结核分枝杆菌感染或曾经发生泌尿系结核者不应作为供者。受者在结核活动期也不能接受移植,对经过正规治疗的非活动性结核,移植后应预防性使用抗结核药物6个月。
推荐意见:
31.患有可通过器官移植传播的传染性疾病的供者通常不适合捐献,受者存在活动性感染时也不宜接受移植(1-B)。
32.意向供者病毒感染:
(1)HIV感染为活体捐献的绝对禁忌证(1-B)。
(2)供者HCV感染可在治愈后捐献;活动性HBV不适合捐献,但无病毒复制活跃证据的供者,如受者也为HBV感染或HBV表面抗体阳性也可以考虑(1-C)。
4.15 肾结石
肾结石病史不是捐献的绝对禁忌证。既往有肾结石病史者,确认无高钙血症、高尿酸血症、代谢性酸中毒,以及无胱氨酸尿症或高草酸尿,无泌尿系感染和无肾脏钙质沉着,并且得到供受者的同意后方可捐献。单侧的单纯肾结石,可以将结石侧作为供肾,手术切取后行工作台腔内取石或碎石。对供受者术后均应注意结石的预防和随访。双侧结石和易复发结石者通常不宜作为供者[19]。
推荐意见:
33.肾结石不是捐献的绝对禁忌证(1-A)。
34.双侧结石、易复发结石者通常不宜作为供者(1-B)。
4.16 家族性肾病
如受者的ESRD是由于遗传性肾病所致或存在肾病家族史时,对有亲缘关系的意向供者进行彻底调查非常重要。包括生化、影像学以及组织学检查。详细家谱也很有意义,若确认存在家族性突变,意向供者应进行基因检测。
常染色体显性成人多囊肾病(autosomal dominant polycystic kidney disease,ADPKD)是最常见的遗传性肾病,有ADPKD表现的意向供者禁忌捐献。对具有ADPKD家族史的意向供者,年龄≥30岁且无任何临床和影像学相关表现,可以作为供者。如年龄<30岁,应行基因检测,如具有基因突变,不适合作为供者。
家族性溶血性尿毒综合征、家族性局灶性节段性肾小球硬化(focal and segmental glomerulosclerosis,FSGS)、Alport综合征及家族性肾病综合征等不适合作为供者。
推荐意见:
35.已知有肾病的家族成员应尽可能确诊。这可能有助于受者的诊断、明确遗传模式以及识别风险家族成员(1-A)。
36.当受者肾衰竭归因于遗传因素时,应排除意向供者的遗传性疾病(1-A)。
37.很多遗传肾病比较罕见,应及早请遗传学专业人士参与评估家族成员的可能风险(2-B)。
4.17 恶性肿瘤
原则上,未临床治愈的恶性肿瘤患者均不能作为供者[20]。必须对意向供者进行缜密地评估,了解恶性肿瘤既往史,通过查体排除浅部肿瘤,血液检查排除血液系统肿瘤,并行胸腹部的影像学检查。年龄>50岁的供者,男性需检查前列腺特异性抗原,女性需行宫颈细胞涂片及排除乳腺肿瘤。
已经治愈的无转移癌症,如结肠癌(Dukes A,>5年),宫颈原位癌、低度恶性非黑色素瘤皮肤癌可以作为供者[21]。同意接受癌症患者捐献肾脏前必须进行包括供、受者在内的讨论,告知不能完全排除癌转移的可能性。
推荐意见:
38.恶性肿瘤原则上是活体捐献的禁忌证,但临床治愈的低度恶性肿瘤患者经过仔细评估和讨论后可考虑捐献(2-B)。
4.18 肾血管平滑肌脂肪瘤
双肾血管平滑肌脂肪瘤者不适合作为供肾。单侧肾脏血管平滑肌脂肪瘤如瘤体可完整切除,且剩余肾脏体积正常可考虑作为供肾。如因肿瘤位置或大小导致不能切除,或预期切除后剩余肾组织不能满足需求者不宜捐献。
5 活体肾移植受者的评估
受者评估原则上与尸体肾移植相同。但需注意,部分肾脏疾病选择亲属肾移植有可能增加肾病复发的风险,如局灶节段性肾小球硬化等。需在术前与供受者沟通说明。
6 活体供肾摘取原则
通常情况下肾脏切除并不困难。但与普通肾切除不同,供肾切取有着更高的要求:(1)是为拯救别人而给一个健康人施行手术,必须最大程度地降低死亡率和并发症发生率;(2)切取的肾脏将用于移植,必须保证其解剖完整,并尽可能缩短缺血时间,保护肾功能;(3)移植科医师应提高技术,缩短手术时间,尽量减少供者创伤。
6.1 活体供肾的侧别选择
供者两侧肾脏在解剖和功能上不尽相同,侧别选择的基本原则是将相对更好的肾脏留给供者,同时兼顾供受者的手术安全。建议如下:①分侧肾脏的GFR相差10%以上者,选用GFR较低一侧作为供肾;②选择血管简单的一侧作为供肾;③若供者为有生育计划的女性,宜取右肾,因为妊娠时合并右肾积水的可能性大于左肾;④既往腹部手术史、外伤史可能导致肾周粘连,应结合其他情况综合考虑;⑤当两侧肾脏各方面条件相当时,由于右肾静脉短可导致供受者手术相对困难,通常选择切取左肾。
6.2 围手术期处理
活体供肾者术前应禁食、禁饮至少6~8h。麻醉诱导前充分补液并留置尿管。麻醉通常采用静脉基础麻醉联合气管内麻醉,这可为侧卧体位的供者提供充分的通气,并可对抗腹腔镜气腹引起的腹压增加。在手术过程中保持良好的肌松可帮助手术视野的显露,并方便小切口取出供肾。目前无证据表明术中使用肝素、呋塞米以及甘露醇等药物能使供受者获益,可根据各中心的经验自行选择。术前单次预防性使用肾毒性较小的广谱抗生素,如第二代头孢菌素,术后不再使用。清醒后可饮水及进食流质,肠道排气后正常饮食。术后1d便可拔除尿管,鼓励早期下床活动。腹腔镜取肾的受者可在术后3~4d出院,开放手术适当延长。
6.3 活体供肾切除
目前供肾切取有标准开放手术、小切口开放供肾切取术(mini-open donor nephrectomy,MODN)、腹腔镜手术以及机器人辅助供肾切取。手术方式的选择以保障供受者安全为第一要务,可根据各中心情况决定[22]。
开放供肾切取术:按入路不同分为经腰入路和经腹入路,大多数中心采用经腰入路。术式简单、安全可靠、热缺血时间短。缺点是通常切口较长,术后切口疼痛、恢复时间相对较长。
腹腔镜活体供肾切取术:腹腔镜供肾切取按入路不同分为经腹腔入路和经后腹腔入路,按是否手辅助分为手助腹腔镜和全腹腔镜供肾切取。西方国家多采用经腹腔入路,国内以后腹腔入路更为多见。随着技术的进步和经验积累,腹腔镜手术除具有与传统开放手术同样的安全性外,还可以缩短住院时间、减轻术后伤口疼痛,使供者能更快的康复、更早的恢复正常工作和生活,并能使伤口更为美观,同时不影响供肾的功能和其存活率。目前腹腔镜供肾切取已成为发达国家活体供肾获取的标准术式。
机器人辅助腹腔镜手术:可以降低传统腹腔镜手术的操作难度,缩短学习曲线。机器人手术系统推广的主要障碍之一是费用昂贵。此外,机器人辅助的主要优势是深部手术或需要大量缝合的手术,对取肾而言似乎没有技术优势。
近年也有单孔腹腔内镜手术(laparoendoscopic single-site surgery,LESS)、经自然腔道内镜手术(natural orifice transluminal endoscopic surgery,NOTES)等的报道,尚需更大样本的随机对照试验证实其有效性和安全性。
推荐意见:
39.无论是取肾侧别还是手术方式的选择,最主要的考量因素是保障供者的短、长期安全,兼顾受者的手术效果。建议选用本移植中心最为熟悉的手术方式,以减少术中及术后的并发症,保证供受者的安全[22](1-B)。
7 活体供肾移植的不良事件与并发症
7.1 供体围手术期并发症
有研究显示活体供肾切除围手术期并发症平均发生率为32%,严重围手术期并发症发生率4.4%[23]。供者死亡是最严重并发症,近30年来的多项研究显示,肾移植供者的围手术期死亡率(术后90d)约为0.03%。死亡原因包括肺栓塞、心肌梗死等心血管事件以及血管夹脱落导致的大出血。大样本的对照研究表明,供者术后1年的死亡率与对照相当,提示死亡的主要原因可能是伴随疾病而非手术本身[22]。尽管围手术期死亡率极低且具有一定的不可预知性,由于其严重后果,仍需从供者评估、改进手术、完善围手术期管理和术后随访等多方面努力,最大程度减少并发症发生率。
7.2 供体远期并发症
活体供者的长期安全性是目前器官移植界最为关注的问题之一,涉及器官移植的基本决策。理论上,随机对照试验是研究供者长期风险的最佳方式,但由于伦理问题而几乎不可能实现。目前的结果主要来自于回顾性研究,由于样本量、随访时间以及对照人群的不同,对结果的判定需要仔细分析。
7.2.1 供者远期死亡率
现有研究普遍支持肾脏捐献并不增加供者远期死亡率,即使以按供者条件筛选的健康人群为对照,结论也是如此。然而,随访时间不长是这些研究的共同缺点,肾脏捐献对供者死亡率的确切影响尚待进一步研究[24-26]。
7.2.2 供者终末期肾病
肾脏捐献使供者失去了大约50%的肾单位,GFR也随之下降。健存的对侧肾脏具有一定的代偿能力,同时可能伴有超滤过损害。来自美国和挪威的大样本研究显示,肾脏捐献会增加供者ESRD发生率,黑种人、年轻人是主要危险因素。然而,供者ESRD的发生率仍然很低,以供者存活到80岁计算,供者发生ESRD的估计终生风险为0.9%,明显高于健康对照(0.14%),但同时显著低于普通人群(3.26%)[27-29]。
7.2.3 供者妊娠相关并发症
育龄期女性在捐献肾脏后的妊娠安全是目前普遍关心的问题。Garg等研究了加拿大安大略的85例捐肾后怀孕妇女,按1∶6比例与510名健康孕妇配对比较。结果显示,与健康孕妇相比,捐肾后怀孕女性出现妊娠高血压的风险比为2.5,先兆子痫的风险比为2.4。但其他主要指标,包括早产、低体重儿、胎儿和母亲死亡率等两组没有差异。其他两项研究结论与之类似。表明在发达地区,供者术后妊娠总体安全[29]。
推荐意见:
40.现有证据表明肾移植供者的近、远期并发症发生率均低,不需改变支持活体肾移植的临床实践(1-B)。
41.供者ESRD发生风险增加,尤其年轻供者,因此对年轻供者捐献的风险及收益应更为慎重的评估(1-B)。
42.年轻未育女性通常不宜作为供者(2-C)。
8 供者的长期随访
供者的长期随访有利于早期发现供者的健康问题并及时治疗。而完整收集供者的长期数据也可准确评估供者的长期风险,以此为制定器官捐献相关政策的依据。随访时间通常认为应该在术后6、12、24个月,此后随访间隔时间可据情况适当延长。随访内容至少应包括供者的存活状态、肾功能、尿蛋白、血压以及糖尿病和心血管疾病的发生率。其次还应了解供者的长期健康相关的生活质量和心理健康状况。此外,捐献对供者的社会经济学状态的长期影响也应该纳入随访内容[28]。
随着活体供者器官移植的发展和累计供者日益增多,很多国家高度重视对供者的随访。《阿姆斯特丹“关注活体供肾者会议”纪要及评估细则》建议,应该就活体肾脏捐献后出现的“警惕性事件”(包括捐献者死亡、术后透析、肾移植)建立国际化的注册机构。欧洲11个国家联合成立了“欧洲活体捐献和公共健康项目”,要求各移植中心必须报告供者的注册和随访资料。同时还成立了“欧洲活体供者心理随访项目”,对供者的心理健康和生活质量进行长期随访。1994年,美国要求所有移植中心报告供者信息;1999年,要求报告供者6个月和12个月的随访信息;而到2008年,要求所有移植中心及时、完整地填报供者术后6个月、1年及2年的随访数据。英国也在2000年建立了活体供者的随访系统,所有移植中心都需向系统提供全部供体资料。
尽管经过多年努力,供者随访状况仍然堪忧。最主要的原因包括供者依从性和经费缺乏[29]。对发达国家,解决上述困难最理想的方法是成立独立于移植中心的国家随访系统,由国家承担费用。而对发展中国家,至少应成立活体供者的登记系统,强制要求各中心填报数据,但应提供相应的经费支持。
推荐意见:
43.应对供者长期随访,尤其是关注肾功能及相关疾病(1-A)。
利益声明:本指南的发布不存在与任何公司、机构或个人之间的利益冲突。
[1]Legendre Ch,Kreis H.A tribute to Jean Hamburger’s contribution to organ transplantation[J].Am J Transplant,2010,10(11):2392-2395.
[2]Murray JE,Tilney NL,Wilson RE.Renal transplantation:a twenty-five year experience[J].Ann Surg,1976,184(5):565-73.
[3]中山医学院第一附属医院外科.同种异体肾移植一例临床报道[J].新医学,1974,5(12):593-596.Department of Surgery in the First Affiliated Hospital of Zhongshan Medical College.Clinical report of allograft renal transplantation in 1 case[J].New Med,1974,5(12):593-596.
[4]林正斌,曾凡军,刘斌,等.同卵孪生姐妹间肾移植一例报告[J].中华器官移植杂志,2000,21(1):33-34.Lin ZB,Zeng FJ,Liu B,et al.One case report:renal transplantation between the identical-twin sister[J].Chin J Organ Transplant,2000,21(1):33-34.
[5]石炳毅,蔡明,钱叶勇,等.亲属活体供肾移植的相关伦理学问题与实践[J].中华医院管理杂志,2007,23(12):839-842.Shi BY,Cai M,Qian YY,et al.Living-related donor kidney transplantation:ethical problems and practice[J]. Chin J Hosp Admin,2007,23(12):839-842.
[6]Ethics Committee of the Transplantation Society.The consensus statement of the amsterdam forum on the care of the live kidney donor[J].Transplantation,2004,78(4):491-492.
[7]陈忠华.提倡亲属活体肾移植力推“家庭内自救”方案[J].肾脏病与透析肾移植杂志,2006,15(1):47-48.Chen ZH.Encouraging living-related kidney transplantation and promoting family-salvage program[J].Chin J Nephrol Dial Transplant,2006,15(1):47-48.
[8]Matas AJ,Smith JM,Skeans MA,et al.OPTN/SRTR 2013 Annual Data Report:kidney[J].Am J Transplant,2015,15(Suppl 2):1-34.
[9]Kohei N,Hirai T,Omoto K,et al.Chronic antibody-mediated rejection is reduced by targeting B-cell immunity during an introductory period[J].Am J Transplant,2012,12(2):469-476.
[10]Lefaucheur C,Loupy A,Hill GS,et al.Preexisting donor-specific HLA antibodies predict outcome in kidney transplantation[J].J Am Soc Nephrol,2010,21(8):1398-1406.
[11]el-Diasty TA,Shokeir AA,el-Ghar ME,et al.Contrast enhanced spiral computerized tomography in live kidney donors:a single session for anatomical and functional assessment[J].J Urol,2004,171(1):31-34.
[12]Grewal GS,Blake GM.Reference data for 51Cr-EDTA measurements of the glomerular filtration rate derived from live kidney donors[J].Nucl Med Commun,2005,26(1):61-65.
[13]Fleming JS,Zivanovic MA,Blake GM,et al.Guidelines for the measurement of glomerular filtration rate using plasma sampling[J].Nucl Med Commun,2004,25(8):759-769.
[14]Mandelbrot DA,Pavlakis M,Danovitch GM,et al.The medical evaluation of living kidney donors:a survey of US transplant centers[J].Am J Transplant,2007,7(10):2333-2343.
[15]Working Party of the British Transplantation Society and the Renal Association.United Kingdom guidelines for living donor kidney transplantation[M].3rd ed.London:British Transplantation Society,2011.
[16]Tangdhanakanond K,Mandelbrot D.Evaluation of high-risk living kidney donors[J].Front Biosci,2015,7:158-167.
[17]Delmonico F,Council of the Transplantation Society.A report of the amsterdam forum on the care of the live kidney donor:data and medicalguidelines[J].Transplantation,2005,79(6 Suppl):S53-S66.
[18]中华医学会.临床技术操作规范器官移植分册[M].北京:人民军医出版社,2010:10-11.
[19]Moore DR,Feurer ID,Zaydfudim V,et al.Evaluation of living kidney donors:variables that affect donation [J].Prog Transplant,2012,22(4):385-392.
[20]中华医学会器官移植学分会,中华医学会泌尿外科学分会肾移植学组.“活体供肾移植”博鳌会议共识[M].香港:华夏科学出版社,2008.
[21]Matas AJ,Bartlett ST,Leichtman AB,et al.Morbidity and mortality after living kidney donation,1999-2001:survey of United States transplant centers[J].Am J Transplant,2003,3(7):830-834.
[22]Segev DL,Muzaale AD,Caffo BS,et al.Perioperative mortality and long-term survival following live kidney donation[J].JAMA,2010,303(10):959-966.
[23]Ibrahim HN,Foley R,Tan L,et al.Long-term consequences of kidney donation[J].N Engl J Med,2009,360(5):459-469.
[24]Fehrman-Ekholm I,Elinder CG,Stenbeck M,et al.Kidney donors live longer[J].Transplantation,1997,64(7):976-978.
[25]Mjøen G,Hallan S,Hartmann A,et al.Long-term risks for kidney donors[J].Kidney Int,2014,86(1):162-167.
[26]Muzaale AD,Massie AB,Wang MC,et al.Risk of end-stage renal disease following live kidney donation[J]. JAMA,2014,311(6):579-586.
[27]Garg AX,Nevis IF,McArthur E,et al.Gestational hypertension and preeclampsia in living kidney donors[J]. N Engl J Med,2015,372(2):124-133.
[28]Living Kidney Donor Follow-Up Conference Writing Group,Leichtman A,Abecassis M,et al.Living kidney donor follow-up:state-of-the-art and future directions,conference summary and recommendations[J].Am J Transplant,2011,11(12):2561-2568.
[29]Schold JD,Buccini LD,Rodrigue JR,et al.Critical factors associated with missing follow-up data for living kidney donors in the United States[J].Am J Transplant,2015,15(9):2394-2403.