 去看看
去看看


近年来,区域麻醉,尤其是外周神经阻滞在临床应用上发展很快。同时,随着心脑血管疾病发病率的升高,平时服用抗凝药物预防血栓的患者也越来越多,其造成的凝血异常增加了区域麻醉的风险。本专家共识参考国内外相关指南和众多麻醉专家的临床经验,结合近年来预防及治疗心脑血管及深静脉血栓的用药趋势和区域麻醉的应用趋势,给予密切结合临床的建议,供各位麻醉医生和相关医务人员参考。
在凝血功能正常的患者,区域麻醉导致严重并发症的概率很低。但对于使用抗凝药的患者,区域麻醉导致血肿的风险有所增加。一旦发生椎管内血肿或深部血肿,可能造成严重的不良后果,如截瘫、神经损伤、大量失血、压迫气管等。
对于围手术期使用抗凝药的患者,应用区域麻醉的时机很重要。麻醉医生应该掌握常用抗凝药的基本药理,选择合适的时机,将该类患者应用区域麻醉的风险降到最低。但不同的患者对药物的代谢有区别,所以凝血功能检查也很重要。结合抗凝药的药理和凝血功能的检查指标有助于麻醉医生做出更加正确的选择。
一、常用抗凝药的基本药理
临床常用抗凝药可分为抗凝血酶药,抗血小板药及纤维蛋白溶解药。中草药和抗抑郁药也有改变凝血功能的作用。下面简述各类药的基本药理作用。
(一)抗凝血酶药
1.间接凝血酶抑制剂
(1)肝素(UFH):
主要通过与抗凝血酶Ⅲ(AT-Ⅲ)结合,增强后者对活化的Ⅱ、Ⅸ、Ⅹ、Ⅺ和Ⅻ凝血因子的抑制作用。其后果涉及阻止血小板凝集和破坏,妨碍凝血激活酶的形成:阻止凝血酶原变为凝血酶;抑制凝血酶,从而妨碍纤维蛋白原变成纤维蛋白。可被鱼精蛋白中和而失去抗凝活性。UFH在低剂量(≤5000U)使用时即可抑制Ⅸa,因此监测活化部分凝血活酶时间(aPTT)可以了解其抗凝程度。此外,UFH可能会引起血小板减少,长时间使用时需复查血小板计数。血管外科及心脏外科手术中常用药物。
(2)低分子肝素(LMWH):
低分子肝素具有很高的抗凝血因子Ⅹa活性和较低的抗凝血因子Ⅱa活性。针对不同适应证的推荐剂量,低分子肝素不延长出血时间。在预防剂量,它不显著改变aPTT。既不影响血小板聚集也不影响纤维蛋白原与血小板的结合。临床应用无需常规监测aPTT,如需监测,使用抗因子Ⅹa活性单位。较少诱发血小板减少症。临床应用广泛,如急性冠脉综合征治疗、心血管介入治疗、血液透析的抗凝、缺血性脑梗死治疗、下肢深静脉血栓的预防以及肺栓塞的治疗。常用的LMWH制剂有克塞、法安明和速碧林等。
(3)选择性因子Ⅹa抑制剂:
磺达肝癸钠(Fondaparinux)、利伐沙班(Rivaroxaban,拜瑞妥)、阿哌沙班(Apixaban)
a. 磺达肝癸钠:磺达肝癸钠是一种人工合成的选择性因子Ⅹa抑制剂。磺达肝癸钠不能灭活凝血酶,并对血小板没有作用。磺达肝癸钠在2.5mg剂量时,不影响常规凝血实验如aPTT,活化凝血时间(ACT)或者凝血酶原时间(PT)/国际标准化比值(INR),也不影响出血时间或纤溶活性。抗凝效果更可预测。已被批准用于骨科手术中静脉血栓栓塞症(VTE)的预防。较低分子肝素可降低50%VTE的风险。
b. 利伐沙班(Rivaroxaban,拜瑞妥):利伐沙班是一种高选择性,直接抑制因子Xa的新型口服药物。通过抑制因子Xa可以中断凝血瀑布的内源性和外源性途径,抑制凝血酶的产生和血栓形成。利伐沙班并不抑制凝血酶,也并未证明其对于血小板有影响。可延长PT及aPTT。在临床常规使用利伐沙班时不需要监测凝血参数。
2.维生素K拮抗剂(AVKs)
常用药物:华法林属香豆素类抗凝药,通过抑制肝脏维生素K依赖的凝血因子Ⅱ、Ⅶ、Ⅸ、Ⅹ的合成发挥作用。还具有降低凝血酶诱导的血小板聚集反应的作用,因而具有抗凝和抗血小板聚集功能。华法林的最大疗效多于连续服药4~5d后达到,停药5~7d后其抗凝作用才完全消失。可用INR监测。大多数手术可以在INR1.4时进行,术前需停药4~5d。
3.直接凝血酶(因子Ⅱa)抑制剂
(1)重组水蛭素衍生物(地西卢定、来匹卢定、比伐卢定):
可逆地抑制游离和结合凝血酶。是肝素替代药物,可用于不稳定型心绞痛患者行经皮冠状动脉介入的治疗。其较肝素引起大量出血的风险低。
(2)阿加曲班(Argatroban):
阿加曲班是L-精氨酸衍生物,通过可逆地抑制凝血酶催化或诱导的反应,包括血纤维蛋白的形成,凝血因子Ⅴ、Ⅷ和ⅩⅢ的活化,蛋白酶C的活化,及血小板聚集发挥其抗凝血作用。可延长PT及aPTT。药物消除半衰期为21min,停药2小时后aPTT可恢复正常。
(3)达比加群(Dabigatran):
是强效、竞争性、可逆性、直接凝血酶抑制剂,也是血浆中的主要活性成分。达比加群可抑制游离凝血酶、与纤维蛋白结合的凝血酶和凝血酶诱导的血小板聚集。达比加群可延长凝血酶时间(TT)和aPTT。
(二)抗血小板药
1.NSAIDS
常用药物为阿司匹林,其不可逆地抑制环氧合酶(COX)的合成,从而抑制血小板血栓素A2(TXA2)的生成及抑制TXA2诱导的血小板聚集。由于该抑制不可逆,在血小板的生存期内(7~10d),其功能始终处于抑制状态,直至有新产生的血小板,才能够维持环氧化酶功能正常。临床应用十分广泛。
2.ADP受体抑制剂
如氯吡格雷(Clopidogrel,波立维)、噻氯匹定(Ticlopidin,抵克力得)、普拉格雷、替卡格雷等
氯吡格雷的活性代谢产物选择性地抑制二磷酸腺苷(ADP)与其血小板P2Y12受体的结合及继发的ADP介导的糖蛋白GPⅡb/Ⅲa复合物的活化,因此抑制血小板聚集。由于结合不可逆,暴露于氯吡格雷的血小板的剩余寿命(大约为7~10d)受到影响。氯吡格雷较阿司匹林延长出血时间。患者可能发生紫癜、鼻衄甚至严重出血。
3.GP Ⅱb/Ⅲa抑制剂
如阿昔单抗(abciximab)、依替巴肽(Eptifibatide)、替罗非班(Tirofiban)。
依替巴肽是通过阻止纤维蛋白原、血管假性血友病因子和其它粘连的配体与GP IIb/IIIa的结合来可逆地抑制血小板聚集。当静脉给药时,依替巴肽抑制离体血小板聚集呈剂量和浓度依赖性。依替巴肽静脉滴注停止后血小板聚集抑制是可逆的。
4.其他抗血小板药
如双嘧达莫(潘生丁):双嘧达莫抑制血小板聚集,高浓度可抑制血小板释放。它往往与阿司匹林合用于中风的预防和短暂性脑缺血发作的治疗。
(三)纤维蛋白溶解药
为这类药物包括链激酶(Streptokinase)、尿激酶(Urokinase)、瑞替普酶(Reteplase)、拉诺替普酶(Lanoteplase)、葡激酶(Staphylokinase)、替奈普酶(Tenecteplase)。
1.链激酶
为外源性纤溶系统激活剂,具有激活体内纤溶系统作用,可与纤溶酶原结合,能促进体内纤维蛋白溶解系统的活力,使纤维蛋白溶酶原转变为活性的纤维蛋白溶酶,引起血栓内部崩解和血栓表面溶解。
2.尿激酶
直接作用于内源性纤维蛋白溶解系统,能催化裂解纤溶酶原成纤溶酶,后者不仅能降解纤维蛋白凝块,亦能降解血循环中的纤维蛋白原、凝血因子Ⅴ和凝血因子Ⅷ等,从而发挥溶栓作用。
(四)中草药
一些草本药物如大蒜、银杏、人参可能会引起出血。大蒜不可逆地抑制血小板聚集并具有纤溶活性。银杏可抑制血小板活化因子。人参干扰血小板聚集。其他一些草药类抗凝血剂还包括小白菊、绿茶、七叶树、猫爪草、姜、胡芦巴和甘菊。鱼油补充剂已经被报道显著提高出血风险。虽然目前没有良好的对照研究为其提供确凿的证据,但临床医生应警惕这些药物可能的出血风险。
(五)选择性血清素再摄取抑制剂(SSRIs)和其他抗抑郁药
SSRIs选择性抑制突触前膜对羟色胺(5-HT)的回收,这类药物包括氟西汀(百忧解)、氟伏沙明(兰释)、帕罗西汀、舍曲林(左洛复)、西酞普兰、氯米帕明、曲唑酮。非选择性血清素再摄取抑制剂包括阿米替林、丙咪嗪、多虑平。这些药物通常用于抗抑郁、焦虑等心理状况。研究已经表明,SSRIs与NSAIDs、阿司匹林或其他抗凝药合用时可增加出血风险。
二、常用凝血功能检测指标
患者术前服用了影响凝血的药物,或既往有出血疾病史时,应做必要的实验室检查来监测患者凝血状态。凝血功能检测也应该是大手术前的常规检查项目。常用凝血功能检查指标:
1.凝血酶原时间(PT)
PT是检查外源性凝血因子的一种过筛试验,是用来检查先天性或获得性纤维蛋白原、凝血酶原、和凝血因子Ⅴ、Ⅶ、Ⅹ的缺陷。
2.PT的国际化比值(INR)
INR是凝血酶原时间与正常对照凝血酶原时间之比的ISI 次方(ISI:国际敏感度指数)。采用INR使不同实验室和不同试剂测定的PT具有可比性。目前国际上强调用INR来监测口服抗凝剂的用量。
3.活化部分凝血活酶时间(aPTT)
aPTT检查内源性凝血因子的一种过筛试验,用来证实先天性或获得性凝血因子Ⅷ、Ⅸ、Ⅺ的缺陷或是否存在它们相应的抑制物。同时,aPTT也可用来检测凝血因子Ⅻ、激肽释放酶原和高分子量激肽释放酶原是否缺乏。由于aPTT的高度敏感性和肝素的作用途径主要是内源性凝血途径,所以aPTT成为监测普通肝素首选指标。
4.血小板计数(PLT)
正常值为100~300× 109/L。血小板的功能为保护毛细管完整性并参与凝血过程。它在止血生理过程和血栓栓塞的发病中有重要的意义。如果血小板计数>50×109/L,且血小板功能正常,则手术麻醉过程不至于出现大量出血;当血小板计数<50×109/L时,轻度损伤引起皮肤黏膜紫癜,手术麻醉后可能出血;当血小板计数<20×109/L时,常有自发性出血。
通过监测凝血指标,以评估患者行区域麻醉的风险性,见表13-1。
表13-1 实验室检查与区域麻醉技术

*以各医院正常值为准,仅供参考
三、使用抗凝药行区域麻醉的风险评估及建议
使用抗凝药时,可导致患者不同程度凝血功能异常。出现血肿是该类患者拟行区域麻醉的主要风险,风险的大小和阻滞部位,身体状况等也密切相关。
出现血肿,尤其是椎管内血肿会导致严重的不良后果。为了减少这种风险,需重点考虑两个时间点:阻滞前抗凝药需停药时间以及阻滞后抗凝药再次用药时间(表13-2)。由于拔除硬膜外镇痛导管导致出血的风险不亚于穿刺时的风险,所以拔管前需停药时间及拔管后再次用药时间可分别参考阻滞前需停药时间及阻滞后用药时间,必要时结合凝血功能的检查做出选择。
表13-2 常用抗凝药区域麻醉前停用及再次用药时间
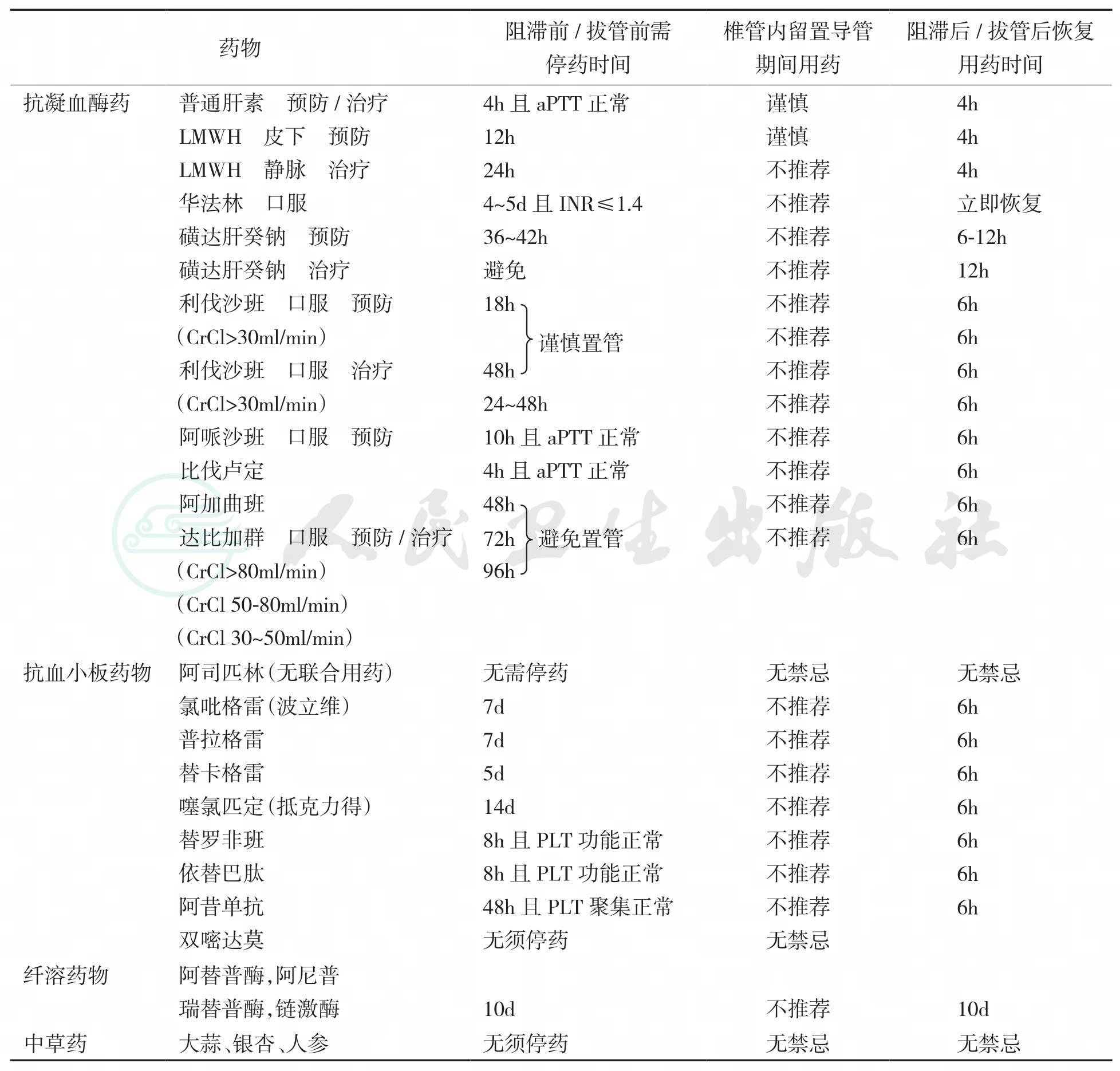
值得注意的是:
1.阿司匹林
大量研究已证明单独服用阿司匹林不增加施行椎管内麻醉的风险。尽管如此,对未停用阿司匹林的患者行椎管内麻醉时,应该尽可能减少穿刺次数和损伤,术中严格控制血压,术后密切监测周围神经功能。谨慎起见,择期手术患者在术前可考虑停用阿司匹林7d。另外一些急性冠脉综合征(ACS)与冠状动脉支架置入术(PCI)后的患者需用双联抗血小板治疗(阿司匹林加氯吡格雷;金属裸支架4周,药物洗脱支架6~12个月)。当阿司匹林与其他NSAIDs、氯吡格雷、华法林、LMWH、肝素合用时,出血风险增加。接受双联抗血小板治疗的患者方案调整取决于外科手术的紧急程度和患者发生血栓和出血的风险,需要多学科(心脏专科医师、麻醉医师、血液科和外科医师)会诊选择优化治疗策略。如未停药,则应避免椎管内麻醉。
2.普通肝素
无论是皮下预防还是静脉治疗时,都应在行椎管内麻醉前停用4h并监测aPTT正常。在血管及心脏手术中,腰麻或硬膜外置管后短时间内静脉应用普通肝素较为常见。此时应当遵循指南建议时间,置管后4h可恢复肝素治疗,停药4h后可撤管。期间严密监测是否有进展为椎管内血肿的指征,保持高度警惕。如肝素使用超过4d,则椎管内阻滞和撤管前还需检查血小板计数。
3.低分子肝素(LMWH)
行区域麻醉前,预防剂量的LMWH需停药至少12h,治疗剂量的LMWH需停药至少24h。麻醉后的12h内不继续LMWH治疗。但如果阻滞或置管较困难,出血偏多的话,需延迟到24h。建议施予神经阻滞后的头24h内只给予单次预防剂量的LMWH。撤管前需停药12h。
4.华法林
口服华法林治疗的患者,一般需要在阻滞前4-5d停用,使INR降低至1.4以下。若INR>1.4但患者需要及早手术,可予患者口服小剂量(1-2mg)维生素K,使INR尽快恢复正常。对于植入机械心脏瓣膜或存在房颤等血栓高危因素的患者,围手术期的抗凝治疗尚存争议,一般认为应停用华法林并使用LMWH或普通肝素进行过渡性抗凝治疗,再按照LMWH和肝素术前停药的方法进行,同时监测INR和aPTT。如果有必要在术后镇痛留置导管期间使用预防剂量的华法林,则需每天监测INR及神经症状。INR≤1.4时可移除置管,INR 在1.5~3时撤管需谨慎,INR >3时暂缓撤管并将华法林减量。
5.ADP受体抑制剂
如氯吡格雷(波立维)行区域麻醉前应停用至少7d,噻氯匹定(抵克力得)需停药14d。
6.GP IIb/IIIa抑制剂
行区域麻醉前应停药,使血小板功能恢复(替罗非班和依替巴肽为8h,阿昔单抗为24~48h)。
7.溶栓/纤溶药物
出血的风险极高,应避免椎管内麻醉。根据阻滞部位谨慎应用外周神经阻滞。
不同的阻滞部位风险不同,椎管内麻醉的风险最大,需非常谨慎。表浅的部位麻醉易于压迫预防血肿,即便形成血肿后也易于减压,风险相对较低。不易压迫的部位如颅内,眼内等,一旦形成血肿可能导致严重的不良后果,需严格掌握适应证。阻滞部位血管丰富时,穿破血管形成血肿的风险较大,反之,风险较小。
区域麻醉时,按阻滞部位考虑,风险由高到低的顺序为:留置导管的硬膜外麻醉,单次硬膜外麻醉,蛛网膜下腔麻醉,椎旁神经阻滞(椎旁神经阻滞、腰丛神经阻滞、颈丛深丛阻滞),深层神经阻滞(近端坐骨神经阻滞等),浅表血管周围神经阻滞(股神经阻滞,腋路臂丛神经阻滞等),筋膜神经阻滞(髂腹股沟神经阻滞,髂腹下神经阻滞,腹横肌平面阻滞等),浅表神经阻滞(颈丛浅丛阻滞等)。留置导管技术较单次阻滞风险更高。同时要重视移除导管时可能出现血肿的风险。由经验丰富的临床医生施行超声引导下的区域麻醉,可降低穿破血管的几率。
在某些情况下,即使患者没有抗凝药应用史,术前也可能因为合并疾病存在凝血功能障碍。对这类患者拟行区域麻醉时,需考虑在穿刺部位形成血肿压迫神经及周围组织的可能。尤其是术后留置导管镇痛时,要充分考虑在留置导管期间患者凝血功能的变化。合并以下疾病的患者常伴有凝血功能障碍:
1.创伤
当发生重大创伤时,由于组织创伤、休克、血液稀释、低温、酸中毒等因素,患者往往伴有凝血功能障碍。所以拟行区域麻醉时应对凝血功能障碍进行评估。拟行留置导管进行术后镇痛时要考虑留置导管期间患者凝血功能的变化,慎重选择拔除导管时间。
2.败血症
在败血症的不同时间可能出现高凝或低凝状态。对这类患者,严禁行椎管内麻醉,因为硬膜外脓肿和脑膜炎的发生率可能增加。拟行其他区域麻醉如外周神经阻滞时,应根据阻滞部位和当时的凝血功能评估风险。
3.尿毒症
尿毒症患者往往伴发贫血,血小板减少。慢性尿毒症患者定期透析时常使用肝素。对该类患者术前需关注血小板数量和凝血功能。必要时进行肝素拮抗。对尿毒症患者谨慎使用留置导管的术后镇痛。
4.肝功能障碍
由于除凝血因子Ⅷ之外的所有凝血因子均在肝脏中合成,而脾功能亢进可能造成血小板减少和血小板功能异常。所以对于肝功能障碍的患者,拟行区域麻醉之前需评估肝功能状态和凝血功能。
5.大量输血
大量输血时因为血液稀释和消耗凝血因子导致凝血功能障碍。施行区域麻醉前需评估凝血功能。术中发生大量输血时,应监测凝血功能,避免在凝血功能异常时拔除导管。
弥散性血管内凝血(DIC):发生DIC时,机体伴有消耗性凝血障碍。对于DIC的患者不宜施行神经阻滞。如必须行外周神经阻滞,最好行单次神经阻滞并在可压迫的位置进行。不宜留置导管。
综上所述,在越来越多的患者因为并存的疾病需要于围手术期进行抗凝和(或)抗血小板治疗时,麻醉医生应该了解这些药物对凝血功能造成的影响,并结合患者的个体情况,认真权衡风险与收益,为患者选择最佳的麻醉方法及时机。
1. The Association of Anaesthetists of Great Britain & Ireland,The Obstetric Anaesthetists’ Association,Regional Anaesthesia UK.Guidelines:Regional anaesthesia and patients with abnormalities of coagulation.Anaesthesia,2013.68:966-972.
2. Final(May,2012)ASRA 3rd Consensus Practice Advisory on Regional Anesthesia and Anticoagulation.
3. Erik Vandermeulen. Regional anaesthesia and anticoagulation. Best Practice & Research Clinical Anaesthesiology,2010,24:121-131.
4. Alan David Kaye,Richard D.Urman,Nalini Vadivelu. Essentials of regional anesthesia.
5. 2013 抗血小板治疗中国专家共识.
6. 朱斌,叶铁虎,华宝来.抗凝药物和抗血小板药物与硬膜外麻醉.中华麻醉学杂志,2006,26(3):433-435.