 去看看
去看看


第一章 循证共识的制定
一、背景
根据中国抗癌协会肿瘤营养与支持治疗专业委员会一项大样本临床调查报告(n=15112)显示,我国恶性肿瘤患者营养不良发生率高达67%[1]。营养不良可导致患者对肿瘤治疗的耐受性、敏感性下降,进而造成不良临床结局,如并发症发生及死亡风险上升,住院时间延长、再住院频率增加、医疗费用增加。因此近年来肿瘤患者的营养不良成为临床广泛关注的问题,营养治疗成为肿瘤治疗的一个重要部分。因此,中国抗癌协会肿瘤营养与支持治疗专业委员会主任委员石汉平教授明确提出:营养治疗应该成为肿瘤患者的基本治疗措施。
营养不良的规范治疗应该遵循五阶梯治疗原则[2],即随患者营养不良程度由轻到重、实际进食量由多到少,营养治疗应依次选择营养教育、饮食+口服营养补充(oral nutritional supplements,ONS)、全肠内营养、部分肠外营养、全肠外营养。营养治疗的通路包括鼻胃、鼻肠、造口、经外周静脉中心静脉置管(PICC)等置管方式。然而,由于恶性肿瘤的病理特点,很多常规操作方式并不适用,如营养不良性水肿或癌性胸水/腹水可能给穿刺、置管带来困难,肿瘤恶病质可能导致患者置管困难、严重消化吸收不良等,肿瘤组织的增生/压迫/浸润、手术引起的解剖结构改变、放疗引起的黏膜损伤、化疗药物对食物消化吸收代谢的不良影响等因素都可能导致患者无法经正常途径进食或置管。另外,如果穿刺、置管部位是位于病变器官或其邻近组织,某些常规操作方法可能会引起肿瘤细胞的播散。因此,恶性肿瘤患者营养治疗通路的建立原则与操作方法与非肿瘤患者的不尽相同,临床医师应该重视这一特殊性,并努力为肿瘤患者建立最适宜的营养治疗通路。
目前国内外尚未发布专门针对恶性肿瘤营养治疗通路制定的指南、共识。为提高临床医师对恶性肿瘤营养治疗通路建立的重视程度、规范恶性肿瘤营养通路的建立,更好地发挥建立营养治疗通路在恶性肿瘤治疗中的作用,中国抗癌协会肿瘤营养与支持治疗专业委员会肿瘤营养通路学组结合国内外现有证据和临床经验,特制定本共识。
二、证据分级与推荐意见的形成
在制定本共识的过程中,首先参照世界卫生组织(World Health Organization,WHO)出版的《WHO指南编写指南》[3]和AGREE协作网(Appraisal of Guideline Research and Evaluation)[4]发展的临床指南编写的方法学原则,结合中国现况,建立制定本共识的方法学,将2009年更新后的AGREE Ⅱ协作网推出的指南方法学质量评价标准作为质控标准[5]。2016年5月,成立了中国恶性肿瘤营养治疗通路专家共识(以下简称“共识”)撰写证据方法学小组,负责起草方法学工作方案,并协助编委会进行证据评价的相关工作。
1.文献检索策略
经方法学小组集体讨论决定,证据检索所需要的数据库见表1-1。
2.证据级别与推荐意见分级标准的制定
表1-2列出本共识中推荐的意见标准。
表1-1 证据检索——数据库和关键词

3.“共识”产生的分析、质控与工作过程
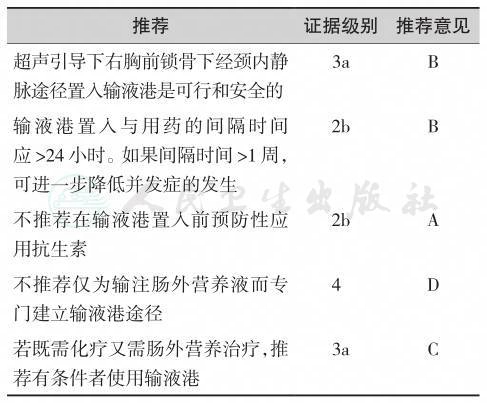
“共识”所应用的分级系统基于证据力度,结合研究设计、质量控制以及临床一致性和实用性评估,把证据等级转化成推荐意见分级。最高等级(A)的推荐至少有一项随机对照研究和/或一项大数据研究,但应强调凡归入最高等级推荐的证据,其原始数据必须开源、可重复检验,以备能够证明其结论与统计模型相适合[6]。最低等级(D)的推荐以专家观点为基础,包括无研究证据的专家共识。
表1-2 共识证据分级和推荐意见整合体系

AGREE Ⅱ质控标准:对每条推荐意见,均应由至少两位质控专家共同对6大方法学领域的23个具体议题打分,并经过加权计算后,得出推荐意见的质量水平。本共识的方法学专家组决定,参照此方法,设立质控组,每一章节均应由质控组两位或两位以上专家参照上述标准进行推荐意见质控。总体共识编写流程见图1-1。
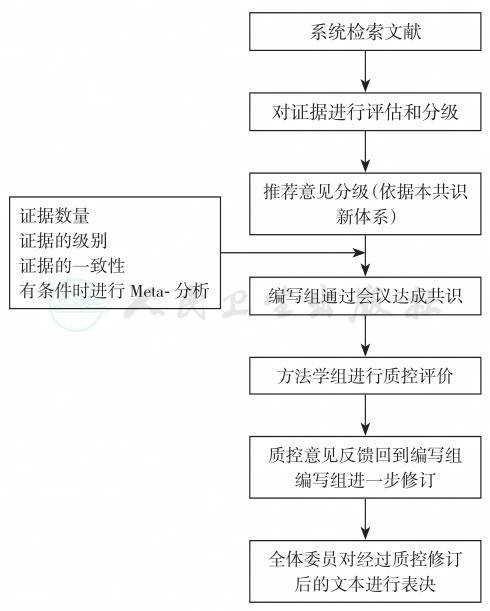
图1-1 共识编写流程图
三、共识委员会组织机构
由中国抗癌协会肿瘤营养与支持治疗专业委员会肿瘤营养通路学组专家构成了本制订工作委员会的人员框架。专委会主任委员与学组组长共同担任“共识”的负责人,其余由志愿专家构成编写组。“共识”证据方法学小组负责制定方法学体系。经肿瘤内科学、肿瘤外科学、护理学、临床营养学等相关学科专家审阅后定稿。所有参与指南编写的人员均基于志愿工作。
1.“专家共识编写组”人员构成
“共识”执笔者(以姓氏汉语拼音为序):陈洪生、樊跃平、关志宇、江华、刘明、罗玉明、石汉平、孙文彦、孙晓梅、汪志明、王凯、吴明、吴紫祥、杨志勇、庄则豪、张军、周春凌。
“共识”推荐意见及意见级别经过中国抗癌协会肿瘤营养支持与治疗专业委员会肿瘤营养通路学组委员讨论、修改后投票通过。
2.证据方法学小组人员
江华(成都)、石汉平(北京)、刘明(哈尔滨)、汪志明(江苏)、庄则豪(福建)、孙文彦(北京)。
3.质控专家组人员
刘明(哈尔滨)、江华(成都)、周春凌(哈尔滨)。
四、“专家共识”目标及愿景
我们期望,通过“共识”的撰写与发布,提高建立营养治疗通路对肿瘤治疗的重要性认识,合理把握建立营养治疗通路的适应证与禁忌证,规范建立肿瘤营养治疗通路的操作,以便更好地为肿瘤整体治疗服务。
1.“共识”的出版与发行
本共识可以单行本的方式发行,也将在相关专业期刊及公开发行的报纸、刊物中发表。
2.“共识”的定期更新和普及教育工作
出版后的每一年,证据方法学小组的审核人员将对共识的每一章节进行合理性的再评估,同时进行普及教育工作。按照循证医学“与时俱进”的原则及通行的循证指南更新标准[7],“共识”每四年更新一次,每一年审议和后效评估一次。四年之内如果相关领域中出现大量新证据、有改变原有结论的可能,制订工作委员会将随时对“共识”进行修正、补充,提前进行更新工作。
3.利益冲突声明
所有参编人员均声明:未接受任何利益相关公司的支持。未持有任何与本共识涉及领域的专利。
第二章 鼻胃管
【背景】
肠内营养(enteral nutrition,EN)因其具有符合人体生理过程、并发症少及营养供给全面等优点,是目前国内外一致推荐的营养治疗首选方案[1]。肠内营养可选的路径包括口服和管饲两大类,管饲路径又包括鼻胃管(naso-gastric tube,NGT)、鼻肠管(naso-intestinal tube,NIT)、咽造口、胃造口及空肠造口等[2]。鼻胃管是传统的肠内营养管饲路径,管径较粗,通常不易引起堵塞,具有操作简便及易于开展等优点[3]。然而,应用鼻胃管的患者胃潴留发生率较高,且部分疾病(重型颅脑外伤)导致胃排空障碍,更是增加了呕吐、误吸及吸入性肺炎等风险[4]。所以,虽然鼻胃管置管简单,对于其选用,依然需要根据循证医学原则进行个性化选择。
【证据】
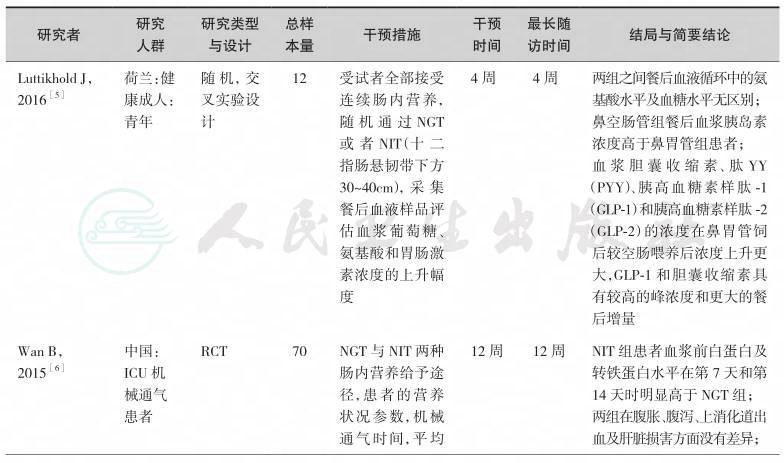
目前,针对不同疾病条件下鼻胃管路径在肠内营养治疗中的应用,已经有很多项临床研究发表,形成了较为坚实的临床循证实践基础。按照本共识的方法学原则通过系统检索,并经由专家组评估,我们纳入如下临床研究作为制定本节共识的证据基础(表2-1)。
综上研究发现,鼻胃管作为肠内营养的传统给予途径,不同口径大小的鼻胃管对机械通气患者的病死率并无影响。鼻胃管作为克罗恩病连续肠内营养治疗的主要方式,能够有效降低其复发率及肠瘘发生率。但是,胃造口管与鼻胃管相比,能降低那些需要长期管饲营养治疗患者的远期病死率,早期运用胃造口管进行肠内营养效果优于鼻胃管。多项RCT研究针对不同疾病进行对早期肠内营养给予途径(鼻胃管和鼻肠管)进行了比较,在营养治疗时间、ICU住院时间、病死率及医源性肺炎方面两者之间并无差异,但是鼻肠管能减少胃肠道并发症。
表2-1 高质量的肠内营养给予途径研究一览表
续表

续表

续表

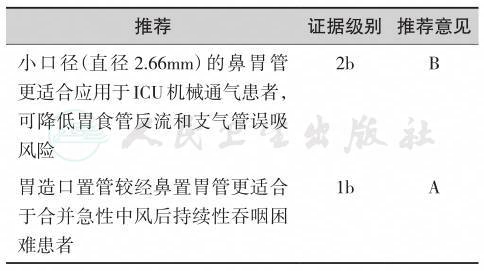
【推荐意见】
第三章 鼻肠管
【背景】
肠内营养因其具有符合人体生理过程、并发症少及营养供给全面等优点,是目前国内外一致推荐的营养治疗首选方案[1]。对于肠内营养的给予途径,一般采取鼻胃管、鼻肠管、咽造口、胃造口及空肠造口等[2]。不同的肠内营养途径会产生不同的置管相关并发症,如反流、腹胀、腹泻、呕吐及误吸等。但是,选择何种营养治疗途径仍然是当前临床上需要解决的问题。鼻肠管是目前肠内营养治疗的理想给予途径,不论是胃镜下引导置管,还是术中经鼻置管均可在无创条件下进行。鼻肠管是在幽门后置管喂养。它直接通过幽门进入十二指肠或者空肠,使反流和误吸发生率大大降低,患者对肠内营养耐受性增加[3]。经鼻肠管行早期肠内营养治疗具有操作简便,创伤小,效果可靠等优点,利于患者术后快速康复[4]。因其导致胃潴留的发生率极低,所以减少了呕吐、误吸及吸入性肺炎等风险[5,6]。目前,随着新型聚氟酯材质的螺旋形鼻肠管的广泛使用,其逐渐成为临床上主要的肠内营养支持治疗途径。
【证据】
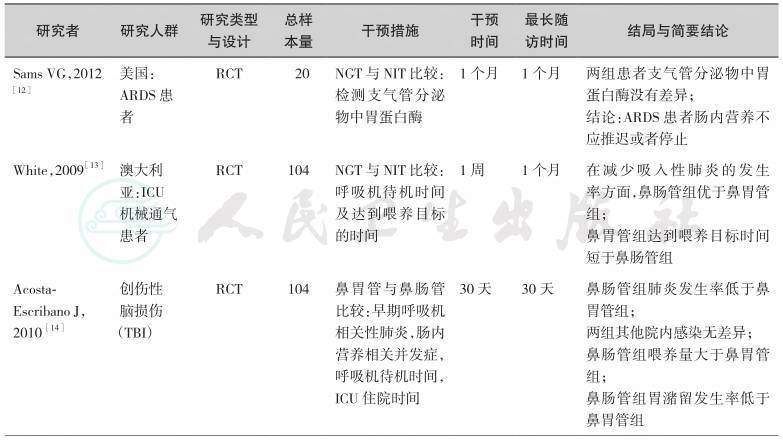
目前,国外与国内针对不同疾病给予肠内营养治疗的不同途径开展了多项研究,形成了较为坚实的临床循证实践基础。通过系统检索以及综合评估,我们纳入如下临床研究作为制定本节共识的证据基础(表3-1)。
综上所述,鼻肠管作为肠内营养的一种给予途径,随着不同类型及不同口径大小的鼻肠管的出现,在临床上越来越多应用于危重患者肠内营养治疗。多项RCT研究针对不同疾病对早期肠内营养给予途径(鼻胃管和鼻肠管)进行了比较,在营养治疗时间、ICU时间、病死率及医源性肺炎方面两者之间并无差异,但是鼻肠管能减少胃潴留及并发症的发生率。鼻空肠管与空肠造口管相比,能降低呼吸机相关性肺炎发生率,缩短机械通气时间和入住ICU的天数,更快地达到肠内营养治疗目标,有效缩短喂养管移除时间,且更安全。但是,在晚期肿瘤患者中,经皮内镜下胃造口空肠置管术(PEG-J)与鼻肠管比较,两组患者病死率无差异,但是行PEG-J肠内营养治疗患者并发症发生率明显低于鼻肠管,且PEG-J组患者家庭肠内营养(HEN)支持率高于鼻肠管组。就目前纳入的研究,样本量不大且干预时间较短,随访时间也不长,还欠缺长时间的干预性研究。
表3-1 高质量的肠内营养给予途径研究一览表

续表

续表

续表
续表

【推荐意见】
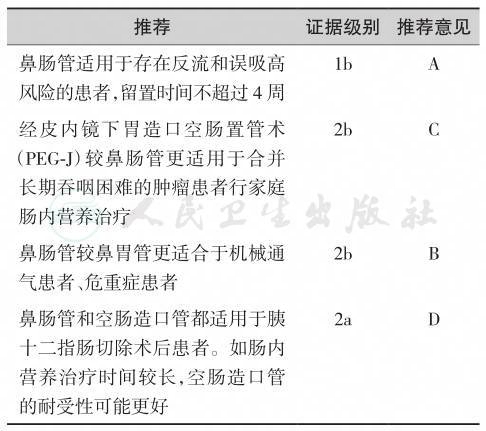
第四章 食管支架
【背景】
恶性肿瘤是威胁人类健康最主要的疾病之一,恶性肿瘤患者往往出现营养不良,尤其是食管肿瘤可导致食管狭窄、瘘等情况,患者表现为吞咽困难,不能进食固体、甚至流质食物。因为长期不能进食,患者生活质量明显下降,出现营养不良,加速了患者死亡。食管支架置入作为能缓解吞咽困难的一种姑息有效的手段,可用于食管恶性肿瘤导致的狭窄、漏和瘘口的封堵,也可用于其他恶性肿瘤(包括肺癌、纵隔肿瘤、转移性肿瘤)导致的食管外压性狭窄及难治性良性狭窄、瘘、漏的治疗[1]。关于支架的选择,要根据情况选用与病情相符合的支架,依然需要根据循证医学原则进行个性化选择。
【证据】
目前,国内外针对食管支架展开了大量的临床研究,形成了坚实的临床循证实践基础。通过系统检索及综合评估,我们纳入如下临床研究作为制定本节共识的证据基础(表4-1~表4-3)。
【推荐意见】

表4-1 不同类型食管支架用于食管肿瘤研究一览表
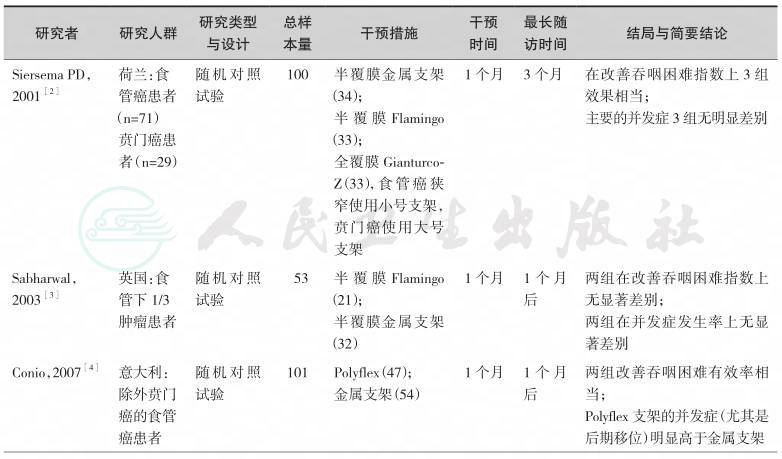
续表
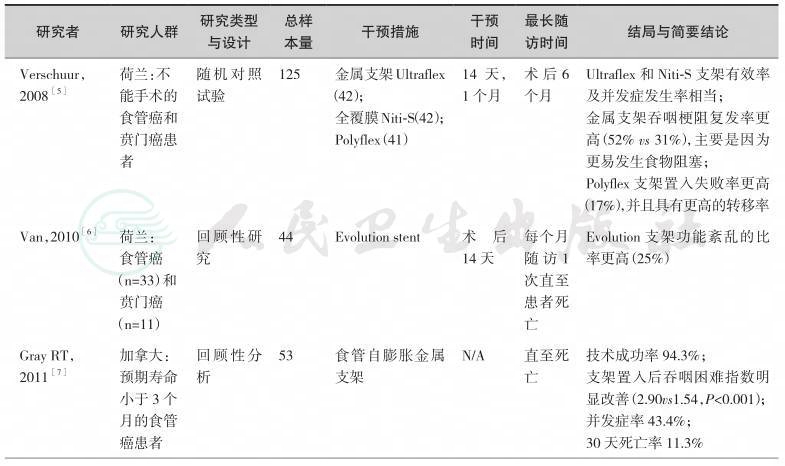
续表

表4-2 不同类型食管支架用于食管气管瘘研究一览表

续表
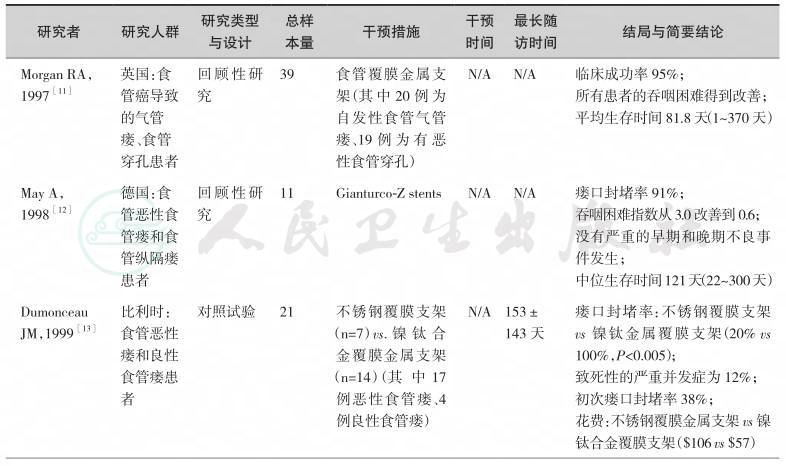
续表

续表

表4-3 食管支架置入后并发症研究一览表

续表

第五章 经皮内镜下胃空肠造口术
【背景】
自1980年Gauderer等[1]首先报道了经皮内镜下胃造口术(percutaneous endoscopic gastrostomy,PEG)以来,经历了三十多年的发展,PEG的操作方式及手术成功率已得到了极大的提高。
PEG是内镜下经腹壁穿刺胃腔,置入导丝,应用导丝引导胃造口管经口腔、食管进入胃腔的微创造口手术,可以对不能经口进食的患者行肠内营养或胃肠减压。经皮内镜下空肠造口术(percutaneous endoscopic jejunostomy,PEJ)是另一种造口方法。这两个手术以操作简便易行、并发症少、耐受性好等优势广泛应用于欧美国家,美国胃肠协会已经把PEG/J作为首选的营养治疗通路为长期不能经口进食的患者提供营养[2,3]。作为一项有创操作,PEG存在一定的并发症,但是随着综合技术的发展和操作熟练程度的提高,这些并发症的发生率也在降低。
目前,PEG、PEJ已经逐渐在全国范围内广泛实施,亟待相关临床实践指南来指导全国PEG、PEJ工作更规范、安全、有效地开展。本文期待为我国PEG、PEJ工作的规范化开展提供指引。
【证据】
目前,国外与国内针对PEG/J的临床应用开展了多项研究,形成了较为坚实的临床循证实践基础。通过系统检索以及综合评估,我们纳入如下临床研究作为制定本节共识的证据基础。
1.PEG/J的适应证(表5-1)
2.PEG/J的禁忌证(表5-2)
3.PEG/J的术前检查及准备(表5-3)
4.PEG/J的操作方法(表5-4)
5.PEG/J置管术后护理(表5-5)
6.PEG/J喂养方式(表5-6)
综上研究发现,传统肠内营养途径主要是经鼻胃管(nasogastric tube,NGT)进行喂食,此方法操作简便,患者易于接受。但是,长时间应用同样会使患者产生恶心、反酸、口腔及鼻黏膜损伤、反流性误吸等并发症,其中因误吸引起肺炎是导致患者病情加重且最终死亡的最常见并发症。因此,PEG/J目前已成为需要长期肠内营养患者的首选和主要方法。与传统的手术胃/肠造口相比,PEG/J具有操作简单、快速安全、不需特殊麻醉、可以在患者床边放置、术后并发症少等优点,同时术后易于护理、患者易于接受、痛苦少。另外,采用PEJ技术能快速建立经空肠的营养通路,避免营养液对胃、十二指肠和胰腺的刺激,用于重症胰腺炎、十二指肠瘘或梗阻以及胃潴留等患者,具有明显的优势。然而,目前全国各个中心在PEG/J的操作与管理中尚无统一标准,且相关学科间缺乏交流与合作。本共识的发布将为中国PEG/J的临床实践提供理论指导,对提高我国PEG/J的整体水平有着重要意义。我们相信在广大学者与同行的共同努力下,中国的PEG/J操作的整体水平将会进一步提高。
表5-1 经皮内镜下胃/空肠造口术(PEG/J)适应证研究一览表

表5-2 经皮内镜下胃/空肠造口术(PEG/J)禁忌证研究一览表
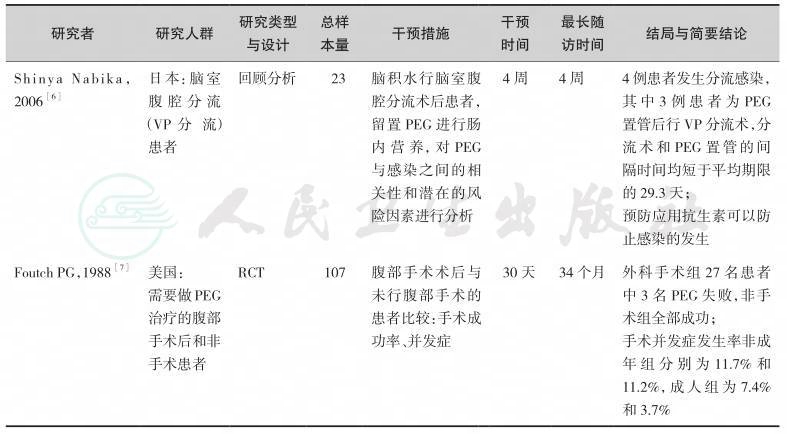
表5-3 经皮内镜下胃/空肠造口术(PEG/J)术前检查及准备研究一览表

表5-4 经皮内镜下胃/空肠造口术(PEG/J)操作方法研究一览表

表5-5 经皮内镜下胃/空肠造口术(PEG/J)术后护理研究一览表

表5-6 经皮内镜下胃/空肠造口术(PEG/J)喂养方式研究一览表

【推荐意见】

续表

续表

第六章 非外科空肠造口术
【背景】
通过外科手术空肠造口已有超过100年的历史,最晚在1878年已有相关报道。目前外科空肠造口已发展出多种术式,包括腹腔镜下空肠造口术(percutaneous laparoscopic jejunostomy,PLJ)、穿刺针导管空肠造口(needle catheter jejunostomy,NCJ)、隧道式空肠造口和Roux-en-Y空肠造口等。随着技术的进步,临床上建立空肠管饲的非外科途径越来越多,为患者提供了更多接受个性化肠内营养的选择。影像介入技术已被用于空肠造口,包括经皮超声引导下空肠造口术(percutaneous sonographic jejunostomy,PSJ)和经皮透视引导下空肠造口术(percutaneous fluoroscopic jejunostomy,PFJ)等[1,2]。通过内镜造口技术进行空肠置管的报道最早见于1984年,尽管当时实际上指的是经皮内镜下胃造口后,经胃造口管置入空肠延长管,但常常被称为经皮内镜下空肠造口术(percutaneous endoscopic jejunostomy,PEJ)[3]。 真正意义上的内镜下经皮直接空肠造口是在1987年由Shike[4]等报道,为区别于PEJ,这种经内镜引导经皮直接穿透空肠壁的造口方法后来被称为直接法经皮内镜空肠造口术(direct percutaneous endoscopic jejunostomy,DPEJ),而 PEJ也被称为经皮内镜下胃空肠造口术(percutaneous endoscopic gastrojejunostomy,PEG-J)或间接法经皮内镜下空肠造口术。对于需空肠造口置管建立长期EN支持途径的患者,应根据其临床状况的不同,选用适当的个性化EN通路。
【证据】
内镜下或影像学辅助下进行的空肠造口均较胃造口有更高的技术难度和设备要求,其在EN中的应用远不如胃造口普遍,但其具有可为胃切除术后、高误吸风险、胃内喂养不耐受、胃瘫等患者建立EN通路的独特优势,并且可显著减少呕吐、反流、误吸的风险,因此近年来,关于空肠造口临床应用的研究报道逐渐增多。按照本共识的方法学原则通过系统检索,并经由专家组评估,我们纳入如下临床研究作为制定本节共识的证据基础(表6-1~表6-3)。
中华医学会肠外肠内营养学分会(CSPEN)指南认为,对于接受腹部手术并且术后需要较长时间EN治疗的患者,可以考虑术中进行空肠造口,放置空肠营养管;实施近端胃肠道吻合术且需要EN治疗的患者,应当经吻合口远端进行空肠造口喂养[25]。中国抗癌协会临床肿瘤学协作专业委员会(CSCO)共识意见亦认为腹部大手术患者术中置经皮空肠穿刺放置喂养管是安全的,在所有接受腹部手术的需管饲营养的患者中,可考虑术中放置较细的空肠造口管[26]。由于放疗可导致严重的口腔和咽喉放射线炎性反应,欧洲临床营养和代谢学会(ESPEN)指南将PEG/J作为放疗患者EN的首选途径[27]。因此,临床应用中,腹部手术患者可以在术中接受空肠造口置管,对于非腹部手术或其他原因需要长期EN(﹥30天)的患者,且口咽、食管无完全性梗阻内镜可通过时,则优先考虑建立PEG通路,当患者满足PEG适应证,但无法施行PEG或PEG无效时,需考虑建立PEG-J/DPEJ通路[25,27]。限制患者接受PEG的原因主要包括:胃或残胃排空障碍;患者无法耐受胃内喂养,即反复出现无法控制的恶心、呕吐、胃食管反流症状或由此导致的吸入性肺炎[28];胃壁无法获得穿刺点等;胃流出道(即幽门、十二指肠或术后胃肠吻合口)梗阻,这种情况下若内镜无法通过则PEG-J/DPEJ亦有困难,但可先予扩张或在X线造影辅助下操作。PEG-J操作成功率尽管可高达89.7%~92.5%[8,13],现有最大样本量(n=307)的文献报道DPEJ操作成功率为68%[11],远低于PEG-J。目前已有少数的透视或超声等影像学手段辅助下可一定程度上提高DPEJ操作成功率的文献报道[29,30]。单气囊小肠镜(SBE)或双气囊小肠镜(DBE)进行DPEJ较易成功,一项小样本研究提示SBE-DPEJ成功率为92%[17],多篇临床研究显示DBE-DPEJ成功率可达90%~100%[15,16,18]。然而小肠镜对人员和设备均有较高要求,尚不能广泛开展,因此被认为是常规内镜DPEJ失败时的补救措施[16]。PEG-J/DPEJ术后并发症大致同PEG,主要包括切口感染、导管移位、造口旁渗漏、导管堵塞、切口血肿、吸入性肺炎、胃肠道出血、腹膜炎等[28,31],CSPEN指出对于经肠喂养患者,管饲在肠道内位置越低,反流误吸的风险也越低[32]。目前尚无在肿瘤患者中PEG-J与DPEJ应用情况比较的高级别大样本RCT研究,现有的临床研究显示,两者造口旁渗漏、切口血肿、出血等近期并发症相当,但DPEJ远期并发症更少,其导管通畅时间更长,PEG-J发生导管移位显著多于DPEJ[8,13]。一项小样本对比研究认为PEG-J的再次干预率明显高于DPEJ,DPEJ能提供更为稳定持久的长期EN支持[12]。当患者出现口咽、食管恶性梗阻,内镜无法通过时,可考虑应用外科空肠造口或其他影像介入技术建立空肠管饲通路[28],包括经皮影像辅助胃空肠造口术(PRGJ)和直接法经皮影像下空肠造口术(DPRJ)等,先前的报道中,透视引导下直接空肠造口的技术成功率为85%~96%[20,21],影像技术辅助的空肠造口术适应证和禁忌证与PEJ相似,对于部分无法接受内镜插管的患者,若条件允许可考虑[28,33]。
表6-1 传统内镜下空肠造口建立肠内营养通路研究一览

续表

续表

续表

表6-2 气囊小肠镜下空肠造口建立肠内营养通路研究一览
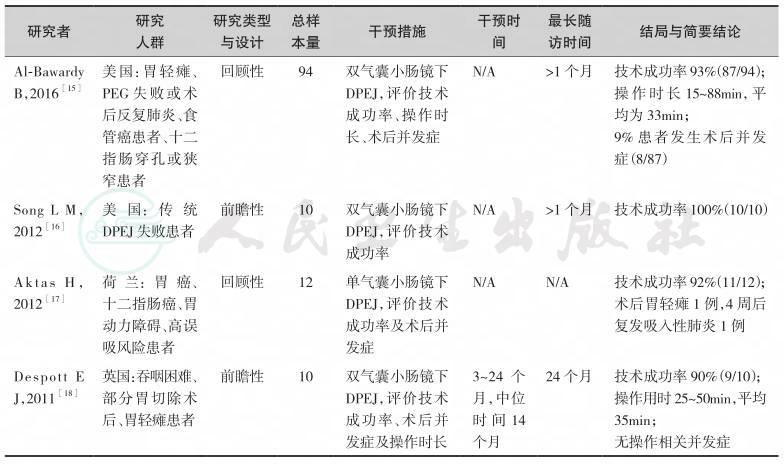
表6-3 影像辅助空肠造口建立肠内营养通路研究一览
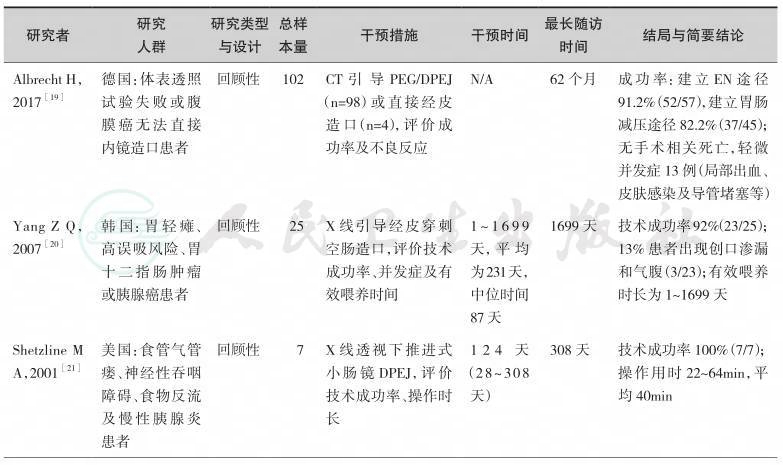
续表

【推荐意见】

第七章 外科空肠造口术
【背景】
通过外科手术空肠造口已有超过100年的历史。目前,外科空肠造口已发展出多种术式,包括隧道式空肠造口术(Witzel空肠造口术)、Rouxen-Y空肠造口术、穿刺针导管空肠造口术(needle catheter jejunostomy,NCJ)以及腹腔镜下空肠造口术(percutaneous laparoscopic jejunostomy,PLJ)[1,2]。随着微创技术和材料装备的进步与普及,PLJ已较为成熟并广泛在临床开展,近些年国内外已有单孔造口的报道[3,4]。与开腹手术相比,PLJ的优势在于其切口更小、术后康复更快、住院时间缩短、发生切口感染和切口疝的概率明显下降,因而应用最为广泛。各种外科空肠造口术均可能发生肠梗阻、腹壁感染、肠外瘘、造口管移位滑脱等并发症。对于需外科空肠造口置管建立长期EN支持途径的患者,应根据其临床状况的不同,选用适当的个体化EN通路。
【证据】
近年来,关于外科空肠造口置管建立长期EN支持,已经有多项临床研究发表,形成了较为坚实的临床循证实践基础。按照本共识的方法学原则通过系统检索,我们纳入如下临床研究作为制定本节共识的证据基础(表7-1)。
综上研究发现,由于肿瘤对于消化功能的影响,上消化道肿瘤患者多伴长期进食受限,加之肿瘤本身的消耗,患者往往存在不同程度的营养不良。如果患者术后短期之内无法进食,再加上手术创伤性应激反应,全身营养情况将进一步恶化。因此,围手术期的营养支持显得尤为重要。外科空肠造口使得上消化道肿瘤术后患者可以早期并长期接受肠内营养,补充患者因进食困难及术后早期禁食或者进食量少所引起的营养不足。同时,空肠管的管道耐受性较好,反流、误吸等并发症发生率较低。对于术前已经存在严重营养不良,或者术后出现感染、吻合口瘘等严重并发症患者,术中放置空肠造口管可长时间带管,保证这类患者有足够的营养摄入,有利于患者康复;同时,通过空肠造口管可对患者进行安全、有效的家庭肠内营养,且护理较为方便。
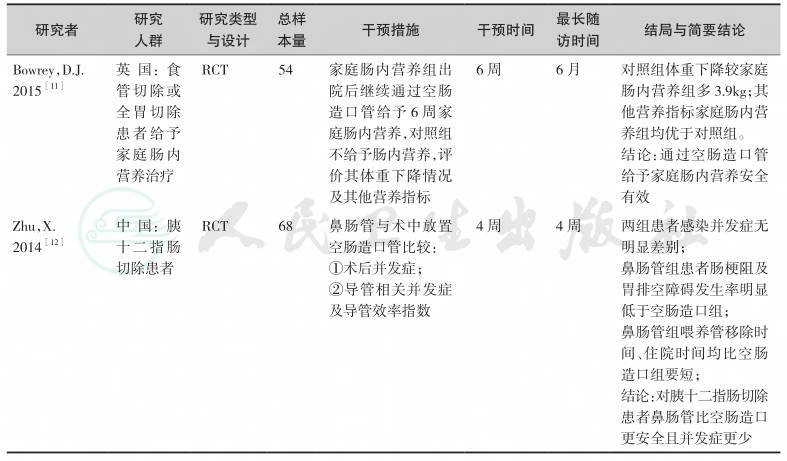
表7-1 外科空肠造口营养通路研究一览表
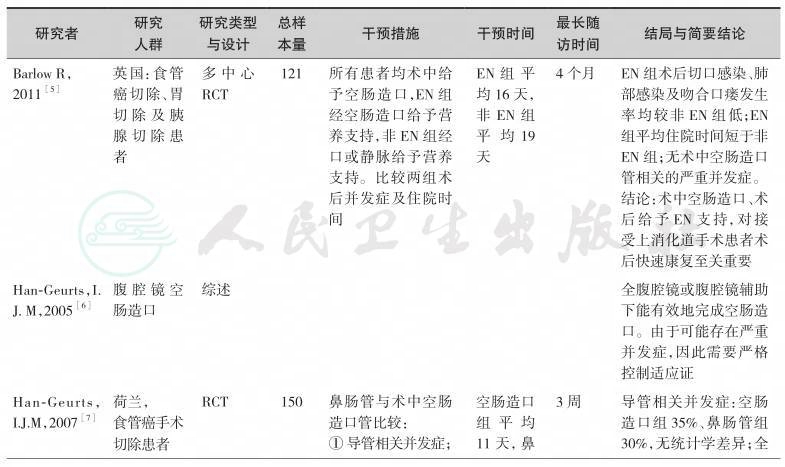
续表

续表

续表
【推荐意见】

第八章 中心静脉置管
【背景】
肠外营养是胃肠道功能障碍患者进行营养治疗的重要手段[1,2]。肠外营养输注的静脉通路分为中心静脉置管(CVC)和外周静脉置管(PVC)。中心静脉置管包括:经外周置入中心静脉导管(PICC),经锁骨下静脉、颈内静脉(IJV)、股静脉(FV)途径置管,导管尖端经上腔静脉(SCV)入心房。锁骨下静脉导管性感染及血栓性并发症的发生率低于颈内静脉和股静脉,并且随着穿刺技术及设备的进步,其机械性损伤的发生率也大大降低,故对于肠道功能障碍,需要部分或完全肠外营养的危重患者建议使用此途径予以营养治疗[3,4]。然而,中心静脉置管对穿刺技术、无菌操作要求和并发症的发生率较外周静脉高,因此管路需要经过培训的专业人员进行管理和维护。具体选择何种置管方式,尚需综合考虑患者的病情、预计营养治疗天数、血管条件及操作者的熟练程度。
【证据】
肠外营养输液途径的选择一直是临床研究争论的焦点。目前,中心静脉导管的应用越来越普遍,近年来,随着多项相关临床研究的发表,更进一步奠定了其坚实的临床循证医学基础。按照本共识的方法学原则通过系统检索,并经由专家组评估,我们纳入如下临床研究作为制定本节共识的证据基础(表8-1)。
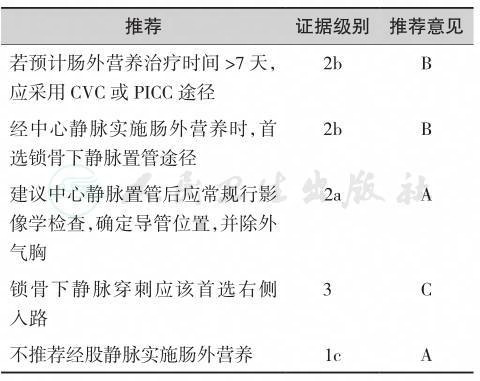
综上所述,经中心静脉肠外营养治疗推荐首选右侧锁骨下静脉途径,并且其导管尖端应接近于上腔静脉,以降低血栓形成的风险[12,13,14]。虽然PICC近年来临床应用日益广泛,但几个RCT和非RCT的研究结果表明,PICC的血栓性静脉炎、未达到预定穿刺部位的发生率、导管折断/渗漏及穿刺难度较其他中心静脉导管更高,而在感染的发生率方面则各有不同的结果[15]。中心静脉置管后应常规接受影像学检查,明确导管尖端的位置[16]。另外,在置管和导管的维护费用方面CVC则更具有优势,有良好的成本-效应比,更加适用于经济欠发达的地区和人群。因此,具体途径的选择还需综合考虑患者的病情,血管条件,预计输液天数,操作者的熟练程度,甚至患者的经济条件谨慎而定。
表8-1 肠外营养给予途径研究一览表

续表

【推荐意见】
第九章 经外周静脉置管
【背景】
机体需要营养治疗时首选肠内营养治疗,但是当经肠内途径无法给予营养或营养给予量不足时应考虑肠外营养治疗。经肠外途径营养治疗总的来说有两种形式,即经外周静脉肠外营养(peripheral parenteral nutrition,PPN)治疗及经中心静脉肠外营养治疗,其中PPN仍然是肠外营养治疗的主要方式之一。PPN的概念首先是由Brunschwing及其同事于1945年提出的,当时他们给一名多发肠外瘘的患者经外周静脉输注水解蛋白及10%葡萄糖长达8周。PPN的临床应用具有一定的优势,如操作简便、护理方便、营养给予及时、可避免经中心静脉途径的各种并发症、费用较低等等;同时PPN的应用也存在一些限制因素,如不能长时间应用,营养液渗透压过高及pH较低时应用受限,不能提供充足的能量、氮量及液体量,可出现液体外溢及血栓性周围静脉炎并发症。
【证据】
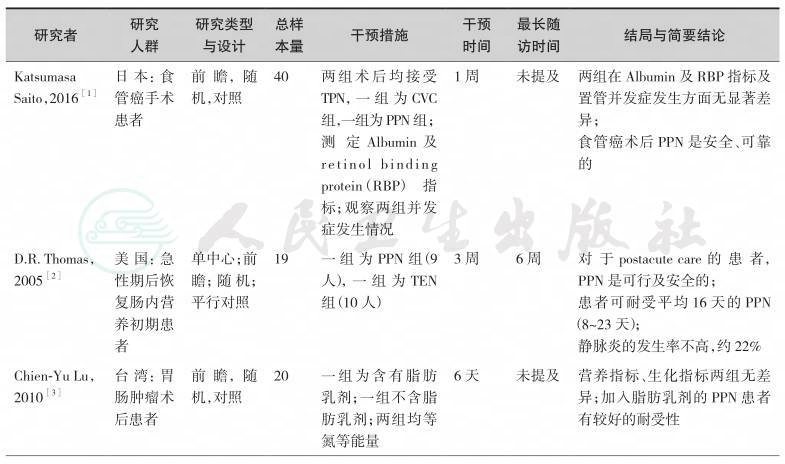
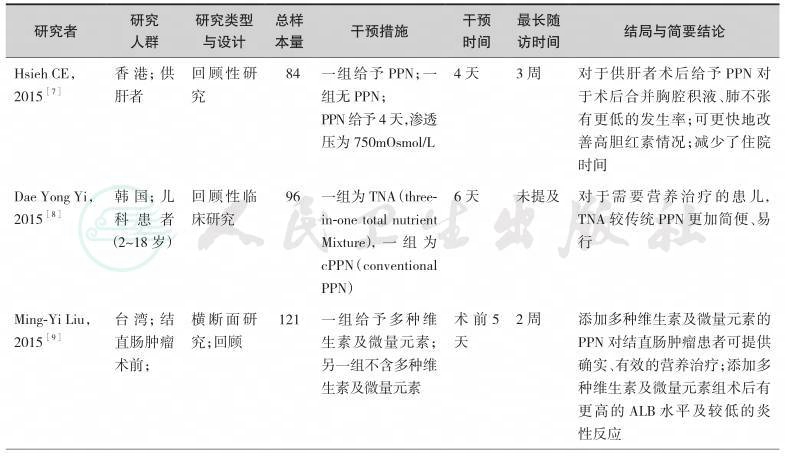
关于PPN的应用已经有很多项临床研究、指南、病例报告及综述发表,提供了较为坚实的临床循证实践基础。我们检索了近15年的中英文文献,并经由专家组评估,最终纳入如下临床研究作为制定本节共识的证据基础(表9-1)。
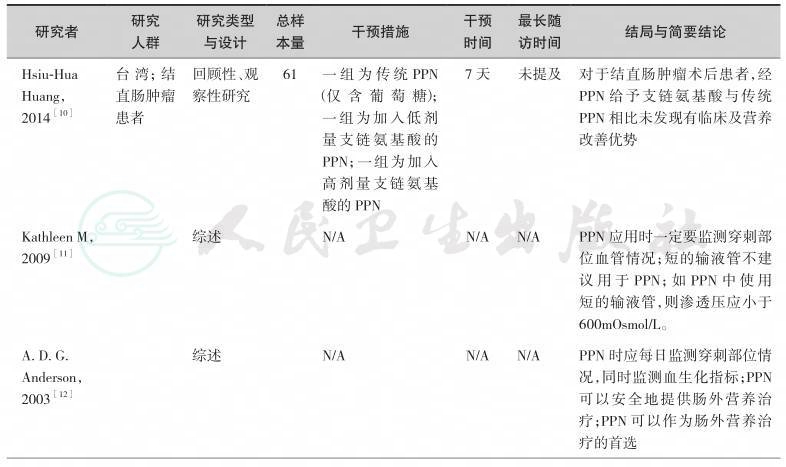
综上研究发现,围术期给予患者短时期(7~10天)的PPN是安全的、可行的,甚至可以是首选的肠外营养治疗方式;但是,为减少PPN的并发症如液体外溢及穿刺部位血栓性静脉炎,每日对穿刺、输液部位的监测是必要的;另外,还要考虑到输注液体的渗透压、pH值、输液器材质选择、输液器管径大小及患者血管情况等因素。PPN的优势之一为可避免经中心静脉途径给予营养的一系列并发症。
表9-1 经外周静脉肠外营养治疗研究一览表
续表

续表
续表
续表

【推荐意见】

第十章 经外周静脉中心静脉置管
【背景】
肠外营养治疗通常根据患者的治疗方案、药物性质、治疗时间等因素综合进行评估,选择最适合的静脉输液工具,一般可分为外周静脉导管(PVC)和中心静脉导管(CVC),中心静脉导管又包括传统的中心静脉(锁骨下、颈内和股静脉)导管、外周置入中心静脉导管(PICC)和输液港(PORT)。目前,PICC置管技术是唯一一项可由护士独立操作完成的中心静脉置管技术,具有置管安全性较高,可留置时间长(1年),并发症相对较少等优点,在临床中广泛应用,然而,PICC置管技术操作复杂,导管费用高,对于疾病复杂、血管条件差、身体机能差的患者,仍然存在较大难度,应根据循证护理进行主动评估,选择最佳输液途径。
【证据】
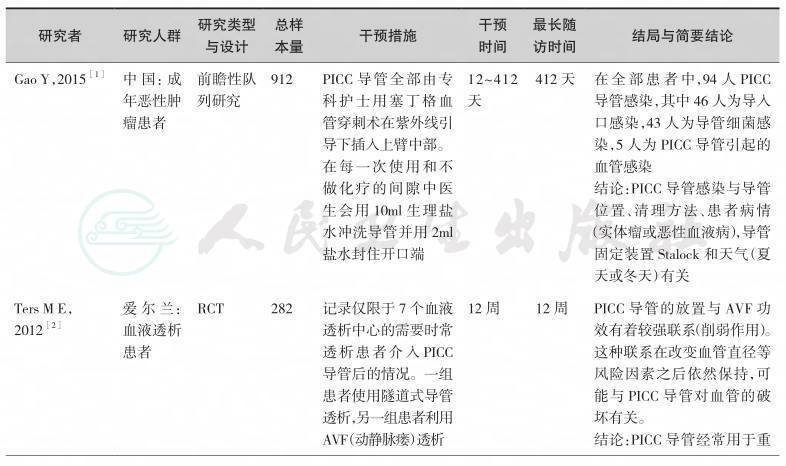
目前,在临床中PICC导管在不同人群、疾病静脉药物治疗中的应用,已经有很多项临床研究论文发表,形成了较为坚实的临床循证实践基础,但关于PICC应用于营养治疗的文献非常少。按照本共识的方法学原则通过系统检索,并经由专家组评估,我们纳入如下以PICC置管技术为主的临床研究作为制定本共识的证据基础(表10-1)。
【推荐意见】

表10-1 PICC导管置入技术研究一览表
续表

续表

续表

续表

第十一章 输液港
【背景】
肠外营养治疗通路分为外周静脉置管(peripheral venous catheter,PVC)与中心静脉置管(central venous catheter,CVC)。中心静脉置管又分为经外周穿刺置入中心静脉导管(peripherally inserted central venous catheter,PICC)、直接经皮穿刺中心静脉置管、隧道式中心静脉置管(central venous tunnel catheter,CVTC)及完全植入式输液港(totally implantable venous access ports,TIVAP)。1982 年,美国MD安德森肿瘤研究中心的Niederhuber等首先应用外科技术将完全植入式静脉输液港通过头静脉置入中心静脉[1]。1992年,Morris通过介入手段完成了TIVAP手术[2]。输液港为长期输入化疗药物、长期应用肠外营养、慢性病长期输液患者提供了安全、方便、美观和可长期携带的血管通道[3]。输液港很少影响患者的日常生活及运动,具有较高的舒适度、满意度和良好生活质量[4]。输液港在发达国家及国内经济发达地区应用比较广泛。
【证据】
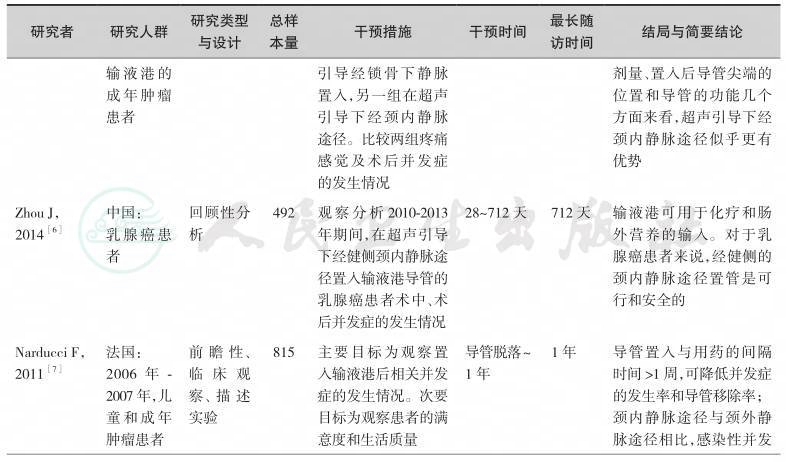
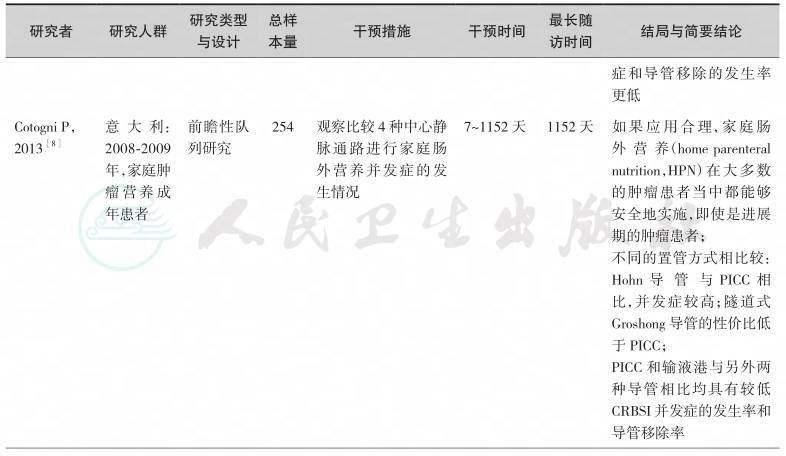
输液港应用于临床已30余年,全面查阅了目前关于输液港临床应用研究的英文文献200余篇。按照本共识的方法学原则,通过系统检索,并经由专家组评估,我们纳入如下临床研究作为制定本节共识的证据基础(表11-1)。
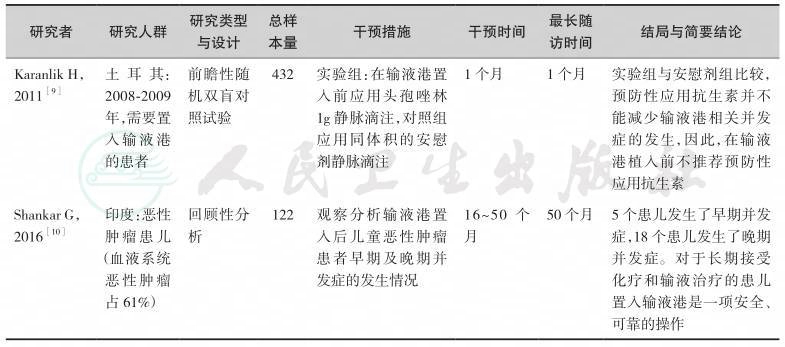
输液导管植入的途径包括经锁骨下静脉、颈内静脉、颈外静脉、头静脉和贵要静脉。与X线引导下经锁骨下静脉途径相比,超声引导下经颈内静脉的置入途径具有较低并发症的发生率,少受X线辐射,术后导管尖端的位置较好,因此输液港的置入方式首选在超声引导下经右侧颈内静脉途径[5,6]。如果锁骨下的皮肤因放疗、近期手术、感染而受到损害时,置输液港的位置可以选择经斜方肌途径[11]。导管置入与用药的间隔时间超过1周,可降低并发症的发生率和导管移除率[7]。输液港的临床应用研究表明,与PICC及CVC相比,其留置时间更长,感染性并发症的发生率更低[12,13]。输液港与Hohn导管和隧道式Groshong导管相比均具有较低导管相关血流感染(incidence of catheterrelated bloodstream infections,CRBSI)并发症的发生率和导管移除率[8]。预防性应用抗生素并不能减少输液港相关并发症的发生,因此,在输液港植入前不推荐预防性应用抗生素[9]。由于小儿及儿童患者依从性差,应用PICC和CVC被拔出的可能性增加,另外,输液港的管理相对容易,且护理频率较PICC和CVC低,故小儿及儿童患者需要长期化疗或肠外营养时,可选择置入输液港[10]。但输液港置入费用较高是制约其广泛应用的主要原因。输液港适用于长期间歇性静脉输注的患者,若静脉置管单纯为输注肠外营养通常不推荐采用输液港[14]。因此,对于肿瘤营养治疗通路的选择需要综合考虑患者的病情、置港处皮肤条件、血管条件、预期生存时间、预计输液时间、操作者资质与技术熟练程度以及患者的经济条件,进行个性化选择。
表11-1 高质量的输液港临床应用研究一览表

续表
续表
续表
【推荐意见】
第一章 询证共识的制定
1.石汉平,李增宁,王昆华,等.营养管理新模式——HCH.肿瘤代谢与营养电子杂志,2015,3(2):23-26.
2.石汉平.肿瘤营养疗法.中国肿瘤临床,2014,41(18):1141-1145.
3.World Health Organization. Guidelines for WHO guidelines. EIP/GPE/EQC/2003.1. World Health Organization. Geneva,Switzerland,2003.
4.Website of AGREE Collaboration. https://www.agreetrust. org/
5.Brouwers M,Kho ME,Browman GP,et al. AGREE Ⅱ:Advancing guideline development,reporting and evaluation in healthcare. Can Med Assoc J,2010,182(18):E839-842.
6.江华,杨浩,彭谨,等. 循证医学方法学在人工智能时代背景下面临的挑战. 中华危重病急救医学杂志,2015(9):709-711.
7.Shekelle P,Eccles MP,Grimshaw JM,Woolf SH. When should clinical guidelines be updated? BMJ. 2001;323(7305):155-157. doi:http://dx.doi.org/10.1136/bmj.323.7305.155 PMID:11463690.
第二章 鼻胃管
1.何振扬. 欧洲肠外肠内营养学会重症患者肠外肠内营养指南简介[J]. 中华普通外科学文献(电子版),2010(02):173-175.
2.吴樱,杜长虹. 鼻胃管和螺旋型鼻肠管在重症颅脑疾病患者中引起反流误吸风险的对比研究[J]. 护士进修杂志,2014(24):2213-2215.
3.覃英容,黄业清,黄向华. 危重患者不同肠内营养置管支持的对比研究[J]. 中华全科医学,2013(10):1557-1558.
4.曾玉琼.重型颅脑外伤患者行鼻胃管与鼻肠管肠内营养的对比研究[J]. 中国医学创新,2016(08):125-128.
5.Luttikhold J,van Norren K,Rijna H,et al. Jejunal feeding is followed by a greater rise in plasma cholecystokinin,peptide YY,glucagon-like peptide 1,and glucagon-like peptide 2 concentrations compared with gastric feeding in vivo in humans:a randomized trial[J]. Am J Clin Nutr,2016,103(2):435-443.
6.Wan B,Fu H,Yin J. Early jejunal feeding by bedside placement of a nasointestinal tube significantly improves nutritional status and reduces complications in critically ill patients versus enteral nutrition by a nasogastric tube[J]. Asia Pac J Clin Nutr,2015,24(1):51-57.
7.Sams V G,Lawson C M,Humphrey C L,et al. Effect of rotational therapy on aspiration risk of enteral feeds[J]. Nutr Clin Pract,2012,27(6):808-811.
8.Yamamoto T,Nakahigashi M,Umegae S,et al. Impact of longterm enteral nutrition on clinical and endoscopic recurrence after resection for Crohn’s disease:A prospective,non-randomized,parallel,controlled study[J]. Aliment Pharmacol Ther,2007,25(1):67-72.
9.Davies A R,Froomes P R,French C J,et al. Randomized comparison of nasojejunal and nasogastric feeding in critically ill patients[J]. Crit Care Med,2002,30(3):586-590.
10.Montejo J C,Grau T,Acosta J,et al. Multicenter,prospective,randomized,single-blind study comparing the efficacy and gastrointestinal complications of early jejunal feeding with early gastric feeding in critically ill patients[J]. Crit Care Med,2002,30(4):796-800.
11.Ibanez J,Penafiel A,Marse P,et al. Incidence of gastroesophageal reflux and aspiration in mechanically ventilated patients using small-bore nasogastric tubes[J]. JPEN J Parenter Enteral Nutr,2000,24(2):103-106.
12.Norton B,Homer-Ward M,Donnelly M T,et al. A randomised prospective comparison of percutaneous endoscopic gastrostomy and nasogastric tube feeding after acute dysphagic stroke[J]. BMJ,1996,312(7022):13-16.
13.Park R H,Allison M C,Lang J,et al. Randomised comparison of percutaneous endoscopic gastrostomy and nasogastric tube feeding in patients with persisting neurological dysphagia[J]. BMJ,1992,304(6839):1406-1409.
第三章 鼻肠管
1.何振扬. 欧洲肠外肠内营养学会重症患者肠外肠内营养指南简介[J]. 中华普通外科学文献(电子版),2010(02):173-175.
2.吴樱,杜长虹. 鼻胃管和螺旋型鼻肠管在重症颅脑疾病患者中引起返流误吸风险的对比研究[J]. 护士进修杂志,2014(24):2213-2215.
3.Nally D M,Kelly E G,Clarke M,et al. Nasogastric nutrition is efficacious in severe acute pancreatitis:a systematic review and meta-analysis[J]. Br J Nutr,2014,112(11):1769-1778.
4.覃英容,黄业清,黄向华. 危重患者不同肠内营养置管支持的对比研究[J]. 中华全科医学,2013(10):1557-1558.
5.曾玉琼. 重型颅脑外伤患者行鼻胃管与鼻肠管肠内营养的对比研究[J]. 中国医学创新,2016(08):125-128.
6.孙大力,徐鹏远,岑云云,等. PEJ和鼻肠管置管在晚期上消化道恶性肿瘤病人家庭肠内营养的应用[J]. 肠外与肠内营养,2016(02):103-106.
7.Luttikhold J,van Norren K,Rijna H,et al. Jejunal feeding is followed by a greater rise in plasma cholecystokinin,peptide YY,glucagon-like peptide 1,and glucagon-like peptide 2 concentrations compared with gastric feeding in vivo in humans:a randomized trial[J]. Am J Clin Nutr,2016,103(2):435-443.
8.程兮,杨卫平,罗茜,等. 螺旋型鼻肠管在胃癌根治术加速康复中的临床价值[J]. 中华消化外科杂志,2015,14(1):61-65.
9.安玉玲,熊亮,刘剑戎,等. 鼻肠管肠内营养在重型颅脑损伤患者中的作用[J]. 中国脑血管病杂志,2016(03):128-133.
10.李冰,李鹏,巩方明,等. 鼻空肠管和空肠造瘘管置入术的疗效对比[J]. 中国肿瘤临床,2014(18):1163-1165.
11.Zhu X,Wu Y,Qiu Y,et al. Comparative analysis of the efficacy and complications of nasojejunal and jejunostomy on patients undergoing pancreaticoduodenectomy[J]. JPEN J Parenter Enteral Nutr,2014,38(8):996-1002.
12.Sams V G,Lawson C M,Humphrey C L,et al. Effect of rotational therapy on aspiration risk of enteral feeds[J]. Nutr Clin Pract,2012,27(6):808-811.
13.White H,Sosnowski K,Tran K,et al. A randomised controlled comparison of early post-pyloric versus early gastric feeding to meet nutritional targets in ventilated intensive care patients[J]. Crit Care,2009,13(6):R187.
14.Acosta-Escribano J,Fernandez-Vivas M,Grau C T,et al. Gastric versus transpyloric feeding in severe traumatic brain injury:a prospective,randomized trial[J]. Intensive Care Med,2010,36(9):1532-1539.
15.Davies A R,Froomes P R,French C J,et al. Randomized comparison of nasojejunal and nasogastric feeding in critically ill patients[J]. Crit Care Med,2002,30(3):586-590.
16.Montejo J C,Grau T,Acosta J,et al. Multicenter,prospective, randomized,single-blind study comparing the efficacy and gastrointestinal complications of early jejunal feeding with early gastric feeding in critically ill patients[J]. Crit Care Med,2002,30(4):796-800.
第四章 食管支架
1.Didden P,Spaander MC,Bruno MJ,et al. Esophageal stents in malignant and benign disorders [J]. Curr Gastroenterol Rep,2013,15(4):319.
2.Siersema PD,Hop WC,van Blankenstein M,et al. A comparison of 3 types of covered metal stents for the palliation of patients with dysphagia caused by esophagogastric carcinoma:a prospective,randomized study [J]. Gastrointest Endosc,2001,54:145-153.
3.Sabharwal T,Hamady MS,Chui S,et al. A randomised prospective comparison of the Flamingo Wallstent and Ultraflex stent for palliation of dysphagia associated with lower third oesophageal carcinoma [J]. Gut,2003,52:922-926.
4.Conio M,Repici A,Battaglia G,et al. A randomized prospective comparison of self-expandable plastic stents and partially covered self-expandable metal stents in the palliation of malignant esophageal dysphagia [J]. Am J Gastroenterol,2007,102:2667-2677.
5.Verschuur EM,Repici A,Kuipers EJ,et al. New design esophageal stents for the palliation of dysphagia from esophageal or gastric cardia cancer:a randomized trial [J]. Am J Gastroenterol,2008,103:304-312.
6.Van Boeckel PG,Repici A,Vleggaar FP,et al. A new metal stent with a controlled-release system for palliation of malignant dysphagia:a prospective,multicenter study [J]. Gastrointest Endosc,2010,71:455-460.
7.Gray RT,O’Donnell ME,Scott RD,et al. Self-expanding metal stent insertion for inoperable esophageal carcinoma in Belfast:an audit of outcomes and literature review [J]. Dis Esophagus,2011,24(8):569-574.
8.Van Heel NC,Haringsma J,Boot H,et al. Comparison of 2 expandable stents for malignant esophageal disease:a randomized controlled trial [J]. Gastrointest Endosc,2012,76:52-58.
9.Do YS,Song HY,Lee BH,et al. Esophagorespiratory fistula associated with esophageal cancer:treatment with a Gianturco stent tube [J]. Radiology,1993,187:673-677.
10.Bethge N,Sommer A,Vakil N. Treatment of esophageal fistulas with a new polyurethane-covered,self-expanding mesh stent:a prospective study [J]. Am J Gastroenterol,1995,90:2143-2146.
11.Morgan RA,Ellul JP,Denton ER,et al. Malignant esophageal fistulas and perforations:management with plastic-covered metallic endoprostheses [J]. Radiology,1997,204:527-532.
12.May A,Ell C. Palliative treatment of malignant esophagorespiratory fistulas with Gianturco-Z stents. A prospective clinical trial and review of the literature on covered metal stents [J]. Am J Gastroenterol,1998,93:532-535.
13.Dumonceau JM,Cremer M,Lalmand B,et al. Esophageal fistula sealing:choice of stent,practical management,and cost [J]. Gastrointest Endosc,1999,49:70-78.
14.Shin JH,Song HY,Ko GY,et al. Esophagorespiratory fistula:long-term results of palliative treatment with covered expandable metallic stents in 61 patients [J]. Radiology,2004,232:252-259.
15.Boyd M,Rubio E. The utility of stenting in the treatment of airway gastric fistula after esophagectomy for esophageal cancer [J]. J Bronchology Interv Pulmonol.,2012,19(3):232-236.
16.Homs MY,Steyerberg EW,Kuipers EJ,et al. Causes and treatment of recurrent dysphagia after self-expanding metal stent placement for palliation of esophageal carcinoma [J]. Endoscopy,2004,36:880-886.
17.Homann N,Noftz MR,Klingenberg-Noftz RD,et al. Delayed complications after placement of self-expanding stents in malignant esophageal obstruction:treatment strategies and survival rate [J]. Dig Dis Sci,2008;53:334-340.
18.Hirdes MM,Siersema PD,Houben MH,et al. Stent-instent technique for removal of embedded esophageal selfexpanding metal stents [J]. Am J Gastroenterol,2011,106:286-293.
19.Didden P,Kuipers EJ,Bruno MJ,et al. Endoscopic removal of a broken self-expandable metal stent using the stent-instent technique [J]. Endoscopy,2012,44(S 02):E232.
第五章 经皮内镜下胃空肠造口术
1.Gauderer MW,Ponsky JL,Izant RJ,Jr. Gastrostomy without laparotomy:a percutaneous endoscopic technique. J Pediatr Surg,1980,15:872-875.
2.Loser C,Aschl G,Hebuterne X,Mathus-Vliegen EM,Muscaritoli M,Niv Y,et al. ESPEN guidelines on artificial enteral nutrition—percutaneous endoscopic gastrostomy(PEG). Clin Nutr,2005,24:848-861.
3.Roche V. Percutaneous endoscopic gastrostomy. Clinical care of PEG tubes in older adults. Geriatrics,2003,58:22-26,28-29.
4.Ha L,Hauge T. Percutaneous endoscopic gastrostomy(PEG) for enteral nutrition in patients with stroke. Scand J Gastroenterol,2003,38:962-966.
5.江志伟,汪志明,丁凯,等. 头颈部恶性肿瘤患者经皮内镜下胃造口途径进行肠内营养的临床研究. 解放军医学杂志,2006,31(1):67-68.
6.Nabika S,Oki S,Sumida M,Isobe N,Kanou Y,Watanabe Y. Analysis of risk factors for infection in coplacement of percutaneous endoscopic gastrostomy and ventriculoperitoneal shunt. Neurol Med Chir (Tokyo),2006,46:226-229; discussion 229-230.
7.Foutch PG,Talbert GA,Waring JP,Sanowski RA. Percutaneous endoscopic gastrostomy in patients with prior abdominal surgery:virtues of the safe tract. Am J Gastroenterol,1988,83:147-150.
8.藤本一真ほか:抗血栓薬服用者に対する消化器内視鏡診療ガイドライン . Gastroenterol Endosc,54:2073-2103,2012.
9.Committee ASoP,Acosta RD,Abraham NS,Chandrasekhara V,Chathadi KV,Early DS,et al. The management of antithrombotic agents for patients undergoing GI endoscopy. Gastrointest Endosc,2016,83:3-16.
10.Lipp A,Lusardi G. Systemic antimicrobial prophylaxis for percutaneous endoscopic gastrostomy. Cochrane Database Syst Rev,2013:CD005571.
11.Ellrichmann M,Sergeev P,Bethge J,Arlt A,Topalidis T,Ambrosch P,et al. Prospective evaluation of malignant cell seeding after percutaneous endoscopic gastrostomy in patients with oropharyngeal/esophageal cancers. Endoscopy,2013,45:526-531.
12.Metheny N,Eisenberg P,McSweeney M. Effect of feeding tube properties and three irrigants on clogging rates. Nurs Res,1988,37:165-169.
13.Scheidbach H,Horbach T,Groitl H,et al. Percutaneous endoscopic gastrostomy/jejunostomy (PEG/PEJ) for decompression in the upper gastrointestinal tract. Surgical Endoscopy,1999,13:1103-1105.
第六章 非外科空肠造口术
1.Löser C,Aschl G,Hé buterne X,et al. ESPEN guidelines on artificial enteral nutrition-percutaneous endoscopic gastrostomy(PEG). Clin Nutr,2005,24(5):848-861.
2.Preshaw R M. A percutaneous method for inserting a feeding gastrostomy tube. Surg Gynecol Obstet,1981,152(5):658-660.
3.Ponsky J L,Aszodi A. Percutaneous endoscopic jejunostomy. Am J Gastroenterol,1984,79(2):113-116.
4.Shike M,Schroy P,Ritchie M A,et al. Percutaneous endoscopic jejunostomy in cancer patients with previous gastric resection. Gastrointest Endosc,1987,33(5):372-374.
5.Toh Yoon EW,Yoneda K,Nakamura S,et al. Percutaneous endoscopic transgastric jejunostomy (PEG-J):a retrospective analysis on its utility in maintaining enteral nutrition after unsuccessful gastric feeding. BMJ Open Gastroenterol,2016,3(1):e000098.
6.Strong AT,Sharma G,Davis M,et al. Direct Percutaneous Endoscopic Jejunostomy (DPEJ) Tube Placement:A Single Institution Experience and Outcomes to 30 Days and Beyond. J Gastrointest Surg,2017,21(3):446-452.
7.Lim A H,Schoeman M N,Nguyen N Q. Long-term outcomes of direct percutaneous endoscopic jejunostomy:a 10-year cohort. Endosc Int Open,2014,146(5):42-44.
8.Zopf Y,Rabe C,Bruckmoser T,et al. Percutaneous Endoscopic Jejunostomy and Jejunal Extension Tube through Percutaneous Endoscopic Gastrostomy:A Retrospective Analysis of Success,Complications and Outcome. Digestion,2009,79(2):92-97.
9.Panagiotakis P H,Disario J A,Hilden K,et al. DPEJ tube placement prevents aspiration pneumonia in high-risk patients. Nutr Clin Pract,2008,23(2):172-175.
10.Delegge M,Buck G,Fang J,et al. Randomized Prospective Comparison of Direct Percutaneous Endoscopic Jejunoscopy(DPEJ) Feeding Tube Placemnt Versus Percutaneous Endsocpic Gastrostomy Feeding Tube Placement with Jejunal Extension (PEG-J),for Enteral Feeding. Gastrointest Endosc,2006;63:AB160.
11.Maple J T,Petersen B T,Baron T H,et al. Direct percutaneous endoscopic jejunostomy:outcomes in 307 consecutive attempts. Am J Gastroenterol,2005,100(12):2681-2688.
12.DeLegge M,McClave S,Ginsberg G,et al. Randomized prospective comparison of direct percutaneous endoscopic jejunostomy vs. percutaneous endoscopic gastrostomy with jejunal extension feeding tube placement for enteral feeding. Gastrointest Endosc,2004,59(5):P158.
13.Fan A C,Baron T H,Rumalla A,et al. Comparison of direct percutaneous endoscopic jejunostomy and PEG with jejunal extension. Gastrointest Endosc,2002,56(6):890-894.
14.Barrera R,Schattner M,Nygard S,et al. Outcome of direct percutaneous endoscopic jejunostomy tube placement for nutritional support in critically ill,mechanically ventilated patients. J Crit Care,2001,16(4):178-181.
15.Al-Bawardy B,Gorospe E C,Alexander J A,et al. Outcomes of double-balloon enteroscopy-assisted direct percutaneous endoscopic jejunostomy tube placement. Endoscopy,2016,48(06):552-556.
16.Song L M,Baron T H,Saleem A,et al. Double-balloon enteroscopy as a rescue technique for failed direct percutaneous endoscopic jejunostomy when using conventional push enteroscopy (with video). Gastrointest Endosc,2012,76(3):675-679.
17.Aktas H,Mensink P B,Kuipers E J,et al. Single-balloon enteroscopy-assisted direct percutaneous endoscopic jejunostomy. Endoscopy,2012,44(2):210-212.
18.Despott E J,Gabe S,Tripoli E,et al. Enteral access by double-balloon enteroscopy:an alternative method of direct percutaneous endoscopic jejunostomy placement. Dig Dis Sci,2011,56(2):494-498.
19.Albrecht H,Hagel A F,Schlechtweg P,et al. Computed Tomography-Guided Percutaneous Gastrostomy/Jejunostomy for Feeding and Decompression. Nutr Clin Pract,2017,32(2):212-218.
20.Yang Z Q,Shin J H,Song H Y,et al. Fluoroscopically guided percutaneous jejunostomy:outcomes in 25 consecutive patients. Clin Radiol,2007,62(11):1066-1068.
21.Shetzline M A,Suhocki P V,Workman M J. Direct percutaneous endoscopic jejunostomy with small bowel enteroscopy and fluoroscopy. Gastrointest Endosc,2001,53(6):633-638.
22.Hoffer E K,Cosgrove J M,Levin D Q,et al. Radiologic gastrojejunostomy and percutaneous endoscopic gastrostomy:a prospective,randomized comparison. J Vasc Interv Radiol,1999,10(4):413-420.
23.Cope C,Davis A G,Baum R A,et al. Direct percutaneous jejunostomy:techniques and applications—ten years experience. Radiology,1998,209(3):747-754.
24.Seitz J,Gmeinwieser J,Strotzer M,et al. Computer tomographyguided gastrostomy,jejunostomy and gastrojejunostomy. A reliable non-surgical method also for contraindications and failure of percutaneous endoscopic gastrostomy. Dtsch Med Wochenschr,1997,122(44):1337-1342.
25.蒋朱明. 临床诊疗指南:肠外肠内营养学分册(2008版).北京:人民卫生出版社,2009.
26.CSCO肿瘤营养治疗专家委员会. 恶性肿瘤患者的营养治疗专家共识 . 临床肿瘤学杂志,2012,17(1):59-73.
27.Bozzetti F,Arends J,Lundholm K,et al. ESPEN guidelines on parenteral nutrition:non-surgical oncology. Clinl Nutr,2006,25(2):245-259.
28.Westaby D,Young A,O’Toole P,et al. The provision of a percutaneously placed enteral tube feeding service. Gut,2010,59(12):1592-1605.
29.Velázquez-Aviña J,Beyer R,Díaz-Tobar CP,et al. New method of direct percutaneous endoscopic jejunostomy tube placement using balloon-assisted enteroscopy with fluoroscopy. Dig Endosc,2015;27(3):317-322.
30.Sharma V K,Close T,Bynoe R,et al. Ultrasound-assisted direct percutaneous endoscopic jejunostomy (DPEJ) tube placement. Surg Endosc,2000,14(2):203-204.
31.石汉平. 中国肿瘤营养治疗指南(2015版). 北京:人民卫生出版社,2015.
32.中华医学会肠外肠内营养学分会. 成人围手术期营养支持指南 . 中华外科杂志,2016,54(9):641-657.
33.李烽,程英升. 在内镜或影像引导下建立微创介入途径实现肠内营养 . 介入放射学杂志,2010,19(1):79-82.
第七章 外科空肠造口术
1.王嘉锋与章琎,空肠造瘘术的并发症. 中国普通外科杂志,2007,16(9):901-903.
2.Allen J.W.,et al.,Totally laparoscopic feeding jejunostomy. Surgical Endoscopy,2002,16(12):p. 1802-1805.
3.Liu Y.,et al.,Single-Incision Laparoscopic-Assisted Jejunostomy Tube Placement. Journal of Laparoendoscopic & Advanced Surgical Techniques,2014,24(1):p. 22-27.
4.Mohiuddin S.S. and C.E. Anderson,A novel application for single-incision laparoscopic surgery (SILS):SIL jejunostomy feeding tube placement. Surgical Endoscopy,2011,25(1):p. 323-327.
5.Barlow R.,et al.,Prospective multicentre randomised controlled trial of early enteral nutrition for patients undergoing major upper gastrointestinal surgical resection. Clinical Nutrition,2011,30(5):p. 560-566.
6.Han-Geurts I.J.M.,et al.,Laparoscopic feeding jejunostomy:A systematic review. Surgical Endoscopy,2005,19(7):p. 951-957.
7.Han-Geurts I.J.,et al.,Randomized clinical trial comparing feeding jejunostomy with nasoduodenal tube placement in patients undergoing oesophagectomy. Br J Surg,2007,94(1):p. 31.
8.Gupta V.,Benefits Versus Risks:A Prospective Audit. World Journal of Surgery,2009,33(7):p. 1432-1438.
9.Torres Júnior L.G.,F.A. de Vasconcellos Santos and M.I.T.D. Correia,Randomized Clinical Trial:Nasoenteric Tube or Jejunostomy as a Route for Nutrition After Major Upper Gastrointestinal Operations. World Journal of Surgery,2014,38(9):p. 2241-2246.
10.Ryan A.M.,et al.,Post-oesophagectomy early enteral nutrition via a needle catheter jejunostomy:8-year experience at a specialist unit. Clinical Nutrition,2006,25(3):p. 386-393.
11.Bowrey D.J.,et al.,A randomised controlled trial of six weeks of home enteral nutrition versus standard care after oesophagectomy or total gastrectomy for cancer:report on a pilot and feasibility study. Trials,2015,16(1).
12.Zhu X.,et al.,Comparative Analysis of the Efficacy and Complications of Nasojejunal and Jejunostomy on Patients Undergoing Pancreaticoduodenectomy. Journal of Parenteral and Enteral Nutrition,2014,38(8):p. 996-1002.
第八章 中心静脉置管
1.Dhaliwal R,Cahill N,Lemieux M,Heyland DK. The Canadian critical care nutrition guidelines in 2013:an update on current recommendations and implementation strategies. NutrClinPract,2014 Feb,29(1):29-43.
2.ASPEN Board of Directors and the Clinical Guidelines Task Force.Guidelines for the use of parenteral and enteral nutrition in adult and pediatric patients.JPEN J Parenter Enteral Nutr,2002 Jan-Feb,26(1 Suppl):1SA-138SA.
3.Loris Pironi,Jann Arends,Federico Bozzetti,Cristina Cuerda,Lyn Gillanders,Palle Bekker Jeppesen,Francisca Joly,Darlene Kelly,Simon Lal,Michael Staun,Kinga Szczepanek,Andre Van Gossum,Geert Wanten,Stephane Michel Schneider,the Home Artificial Nutrition & Chronic Intestinal Failure Special Interest Group of ESPEN. ESPEN guidelines on chronic intestinal failure in adults. Clinical Nutrition,2016,35:247-307.
4.Singer P,Berger MM,Van den Berghe G,Biolo G,Calder P,Forbes A,Griffiths R,Kreyman G,Leverve X,Pichard C. ESPEN Guidelines on Parenteral Nutrition:intensive care. Clin Nutr,2009 Aug,28(4):387-400.
5.Katsumasa Saito,Yasuaki Nakajima,Kenro Kawada,Yutaka Tokairin,Tatsuyuki Kawano. Is a Central Venous Catheter Necessary for the Perioperative Management of Esophagectomy? A Prospective Randomized Pilot Study Comparing Two Different Perioperative Regimens. Digestive Surgery,2016,33:478-487.
6.Ge X,Cavallazzi R,Li C,Pan SM,Wang YW,Wang FL.Central venous access sites for the prevention of venous thrombosis,stenosis and infection.Cochrane Database Syst Rev,2012 Mar,14;(3):CD004084.
7.Biffi R1,Orsi F,Pozzi S,Pace U,Bonomo G,Monfardini L,Della Vigna P,Rotmensz N,Radice D,Zampino MG,Fazio N,de Braud F,Andreoni B,Goldhirsch. ABest choice of central venous insertion site for the prevention of catheterrelated complications in adult patients who need cancer therapy:a randomized trial. AnnOncol,2009,20(5):935-940.
8.Safdar N,Maki DG. Risk of catheter-related bloodstream infection with peripherally inserted central venous catheters used in hospitalized patients. Chest,2005,128(2):489-495.
9.Alonso-Echanove J,Edwards JR,Richards MJ,Brennan P,Venezia RA,Keen J,Ashline V,Kirkland K,Chou E,Hupert M,Veeder AV,Speas J,Kaye J,Sharma K,Martin A,Moroz VD,Gaynes RP. Effect of nurse staffing and antimicrobialimpregnated central venous catheters on the risk for bloodstream infections in intensive care dunits.Infect Control HospEpidemiol,2003 Dec,24(12):916-925.
10.Merrer J,De Jonghe B,Golliot F,Lefrant JY,Raffy B,Barre E,Rigaud JP,Casciani D,Misset B,Bosquet C,Outin H,Brun-Buisson C,Nitenberg G;French Catheter Study Group in Intensive Care. Complications of femoral and subclavian venous catheterization in critically illpatients:a randomized controlled trial. JAMA,2001 Aug 8,286(6):700-707.
11.Cowl CT,Weinstock JV,Al-Jurf A,Ephgrave K,Murray JA,Dillon K. Complications and cost associated with parenteral nutrition delivered to hospitalized patients through either subclavian or peripherally-inserted central catheters. ClinNutr,2000 Aug,19(4):237-243.
12.Verso M,Agnelli G,Kamphuisen PW,Ageno W,Bazzan M,Lazzaro A,et al. Risk factors for upper limb deep vein thrombosis associated with the use ofcentral vein catheter in cancer patients. Intern Emerg Med,2008,3:117-122.
13.Petersen J,Delaney JH,Brakstad MT,Rowbotham RK, Bagley Jr CM. Silicone venous access devices positioned with their tips high in the superior venacava are more likely to malfunction. Am J Surg,1999,178:38-41.
14.Cadman A,Lawrance JA,Fitzsimmons L,Spencer-Shaw A,Swindell R. To clot or not to clot? That is the question in central venous catheters. ClinRadio,2004,59(4):349-355.
15.Duerksen DR,Papineau N,Siemens J,Yaffe C. Peripherally inserted central catheters for parenteral nutrition:a comparison with centrally inserted catheters. JPEN J Parenter Enteral Nutr,1999 Mar-Apr,23(2):85-89.
16.ASPEN Board of Directors and the Clinical Guidelines Task Force. Guideline for the use of parenteral and enteral nutrition in adult and pediatric patients. JPEN J Parenter Enteral Nutr,2002,26(1 Suppl):ISA-137SA.
第九章 经外周静脉置管
1.Katsumasa Saito,Yasuaki Nakajima,Kenro Kawada,et al. Is a Central Venous Catheter Necessary for the Perioperative Management of Esophagectomy? A Prospective Randomized Pilot Study Comparing Two Different Perioperative Regimens. Dig Surg,2016,33:478-487.
2.D.R. Thomas,C.D. Zdrodowski,M.-M. Wilson,et al. A Prospective,Randomized Clinical Study of Adjunctive Peripheral Parenteral Nutrition in Adult Subacute Care Patients. The Journal of Nutrition,2005,9(5):321-325.
3.Chien-Yu Lu,Hung-Yi Chuang,Fang-Jung Yu,et al. Hypocaloric peripheral parenteral nutrition with lipid emulsion in postoperative gastrointestinal cancer patients. World J Gastrointest Oncol,2010,2(1):51-55.
4.Cooper SC,Hulley CM,Grimley CE,et al. Perioperative peripheral parenteral nutrition for patients undergoing esophagectomy for cancer:a pilot study of safety,surgical,and nutritional outcomes. Int Surg,2006,91(6):358-64.
5.Li-Chu Sun,Chien-Yu Lu,Fang-Ming Chen,et al. Randomized Controlled Study of Glycerol Versus Dextrose in Postoperative Hypocaloric Peripheral Parenteral Nutrition. Journal of Investigative Surgery. 2006,19:381-385.
6.M. I. T. D. Correia,J. Guimarâes,L. Cirino de Mattos,et al. Peripheral parenteral nutrition:an option for patients with an indication for short-term parenteral nutrition. Nutr Hosp,2004,19:14-18.
7.Hsieh CE,Lin KH,Lin CC,et al. Comparative Factor Analysis of the Effect of Postoperative Peripheral Parenteral Nutrition on Recovery of Right Lobe Liver Donors. Exp Clin Transplant,2015,13(2):157-162.
8.Dae Yong Yi,Hye Ran Yang. Comparison of a three-in-one total nutrient mixture with conventional peripheral parenteral nutrition in children. Asia Pac J Clin Nutr,2015,24(1):44-50.
9.Ming-Yi Liu,Hsiu-Chih Tang,Shu-Hui Hu. Influence of Preoperative Peripheral Parenteral Nutrition with Micronutrients after Colorectal Cancer Patients. BioMed Research International,2015,2015:1-6.
10.Hsiu-Hua Huang,Pi-Chuan Wu,Shiu-Ping Kang,et al. Postoperative Hypocaloric Peripheral Parenteral Nutrition with Branched-Chain-Enriched Amino Acids Provides No Better Clinical Advantage Than Fluid Management in Nonmalnourished Colorectal Cancer Patients. Nutrition and Cancer,2014,66(8):1269-1278.
11.Kathleen M. Gura. Is There Still a Role for Peripheral Parenteral Nutrition? Nutrition in Clinical Practice,2009,24(6):709-717.
12.A. D. G. Anderson,D. Palmer and J. MacFie. Peripheral parenteral nutrition. British Journal of Surgery,2003,90:1048-1054.
13.Dan L. Waitzberg,Caio Plopper,Ricardo M. Terra. Access Routes for Nutritional Therapy. World J. Surg,2000,24:1468-1476.
14.K. W. Jauch,W. Schregel,Z. Stanga,et al. Access technique and its problems in parenteral nutrition-Guidelines on Parenteral Nutrition,Chapter 9. German Medical Science,2009,7:1-18.
第十章 经外周静脉中心静脉置管
1.Gao Y,Liu Y,Ma X,et al. The incidence and risk factors of peripherally inserted central catheter-related infection among cancer patients[J]. Therapeutics & Clinical Risk Management,2015,11:863-871.
2.Mireille El Ters,Gregory J. Schears,Sandra J. Taler,Amy W. Association Between Prior Peripherally Inserted Central Catheters and Lack of Functioning Arteriovenous Fistulas:A Case-Control Study in Hemodialysis Patients[J]. American Journal of Kidney Diseases the Official Journal of the National Kidney Foundation,2012,60(4):601-608.
3.Advani S,Reich N G,Sengupta A,et al. Central Line-Associated Bloodstream Infection in Hospitalized Children with Peripherally Inserted Central Venous Catheters:Extending Risk Analyses Outside the Intensive Care Unit[J]. Clinical Infectious Diseases,2011,52(9):1108-1115.
4.Milstone A M,Reich N G,Advani S,et al. Catheter dwell time and CLABSIs in neonates with PICCs:a multicenter cohort study.[J]. Pediatrics,2013,132(6):1609-1615.
5.Liu Y,Gao Y,Wei L,et al. Peripherally inserted central catheter thrombosis incidence and risk factors in cancer patients:a double-center prospective investigation.[J]. Therapeutics & Clinical Risk Management,2015,11(1):153-160.
6.Paolo Cotogni,Cristina Barbero,Cristina Garrino,et al. Peripherally inserted central catheters in non-hospitalized cancer patients:5-year results of a prospective study[J]. Support Care Cancer,2015,23:403-409.
7.Valobousquest Schneider L,Duron S,Arnaud FX,et al. Evaluation of PICC complications in orthopedic inpatients with bone infection for long-term. J Vasc Access,2015,16(4):299-308.
8.Ahn D H,Illum H B,Wang D H,et al. Upper extremity venous thrombosis in patients with cancer with peripherally inserted central venous catheters:a retrospective analysis of risk factors.[J]. Journal of Oncology Practice,2013,9(1):8-12.
9.Austin R E,Shahrokhi S,Bolourani S,et al. Peripherally Inserted Central Venous Catheter Safety in Burn Care:A Single-Center Retrospective Cohort Review.[J]. Journal of Burn Care & Research Official Publication of the American Burn Association,2014,36(1):111-117.
第十一章 输液港
1.Niederhuber JE,Ensminger W,Gyves JW,Liepman M,Doan K,Cozzi E. Totally implanted venous and arterial access system to replace external catheters in cancer treatment. Surgery 1982,92(4):706-712.
2.Morris SL,Jaques PF,Mauro MA. Radiology-assisted placement of implantable subcutaneous infusion ports for long-term venous access. Radiology,1992,184(1):149-151.
3.Kock HJ,Pietsch M,Krause U,Wilke H,Eigler FW. Implantable vascular access systems:experience in 1500 patients with totally implanted central venous port systems. World J Surg,1998,22(1):12-16.
4.Paleczny J,Banys-Jafernik B,Gazurek K,Kierpiec K,Szczerba H,Zipser P. Long-term totally implantable venous access port systems—one center experience. Anaesthesiol Intensive Ther,2013,45(4):215-222.
5.Plumhans C,Mahnken AH,Ocklenburg C,Keil S,Behrendt FF,Gunther RW,Schoth F. Jugular versus subclavian totally implantable access ports:catheter position,complications and intrainterventional pain perception. Eur J Radiol,2011,79(3):338-342.
6.Zhou J,Qian S,He W,Han G,Li H,Luo R. Implanting totally implantable venous access port via the internal jugular vein guided by ultrasonography is feasible and safe in patients with breast cancer. World J Surg Oncol,2014,12:378.
7.Narducci F,Jean-Laurent M,Boulanger L,El Bedoui S,Mallet Y,Houpeau JL,Hamdani A,Penel N,Fournier C. Totally implantable venous access port systems and risk factors for complications:a one-year prospective study in a cancer centre. Eur J Surg Oncol,2011,37(10):913-918.
8.Cotogni P,Pittiruti M,Barbero C,Monge T,Palmo A,Boggio Bertinet D. Catheter-related complications in cancer patients on home parenteral nutrition:a prospective study of over 51,000 catheter days. JPEN J Parenter Enteral Nutr,2013,37(3):375-383.
9.Karanlik H,Kurul S,Saip P,Unal ES,Sen F,Disci R,Topuz E. The role of antibiotic prophylaxis in totally implantable venous access device placement:results of a single-center prospective randomized trial. Am J Surg,2011,202(1):10-15.
10.Shankar G,Jadhav V,Ravindra S,Babu N,Ramesh S. Totally Implantable Venous Access Devices in Children Requiring Long-Term Chemotherapy:Analysis of Outcome in 122 Children from a Single Institution. Indian J Surg Oncol,2016,7(3):326-331.
11.Hill S. Trapezius placement of implanted ports:understanding the procedure. Br J Nurs,2016,25 Suppl 2:S9-S15.
12.Maki DG,Kluger DM,Crnich CJ. The risk of bloodstream infection in adults with different intravascular devices:a systematic review of 200 published prospective studies. Mayo Clin Proc,2006,81(9):1159-1171.
13.Loveday HP,Wilson JA,Pratt RJ,Golsorkhi M,Tingle A,Bak A,Browne J,Prieto J,Wilcox M,Health UKDo. epic3:national evidence-based guidelines for preventing healthcare-associated infections in NHS hospitals in England. J Hosp Infect,2014,86 Suppl 1:S1-70.
14.Koletzko B,Goulet O,Hunt J,Krohn K,Shamir R. 1. Guidelines on Paediatric Parenteral Nutrition of the European Society of Paediatric Gastroenterology,Hepatology and Nutrition (ESPGHAN) and the European Society for Clinical Nutrition and Metabolism (ESPEN),Supported by the European Society of Paediatric Research(ESPR). J Pediatr Gastroenterol Nutr,2005,41 Suppl 2:S1-87.