 去看看
去看看


一、乳腺癌的诊断及检查
(一)早期乳腺癌确诊检查

【注释】
1.乳腺磁共振检查可用于分期评估,以确定同侧乳腺肿瘤范围、多灶及多中心性肿瘤,或在初诊时筛查对侧乳腺肿瘤;有助于评估术前治疗前后的肿瘤范围及疗效评估;有助于制定手术计划前评价肿瘤对周围软组织的浸润情况,并且判定能否行保乳手术;有助于发现一些其他检查未发现的隐匿性癌肿。需要注意,乳腺MRI有一定假阳性,不能仅凭MRI结果决定手术,建议先对可疑病灶行活检[1,2]。
2.治疗前原发灶和区域淋巴结的病理学检查至关重要,推荐在超声或X线立体定向引导下行空芯针穿刺,可大幅度提高活检准确性。部分高度考虑为良性的肿物、难以穿刺的散在钙化灶等情况,可首选肿物切除活检[3]。一些簇状分布的可疑钙化灶,可在X线引导下金属丝定位行病灶切除活检。
3.建议对高度怀疑恶性的区域淋巴结进行病理学检查,推荐行空芯针活检,淋巴结较小者难以操作时可选细针穿刺。另外,对于原发灶已经明确诊断为乳腺癌的病例,淋巴结的细针穿刺也被大部分专家所认可。
4.建议对确诊乳腺癌患者行胸部CT检查,特别是肿瘤分期较晚,具有高复发危险因素的患者。
5.建议确诊患者先行腹部超声检查,怀疑脏器转移时再行腹部CT或MRI检查。
6.骨放射性核素扫描(ECT)是最常用于初筛骨转移的方法,其优点是灵敏度高,缺点是特异性较低、无法显示骨破坏程度。临床分期ⅢA期以上患者建议进行ECT筛查。临床分期Ⅰ~ⅡB期患者如出现骨痛,发生病理骨折,碱性磷酸酶升高或高钙血症等可疑骨转移时应考虑进行ECT检查[4]。
7.在常规分期检查结果难以判断或者存在疑问,特别是在局部晚期或转移性患者中,PET/CT联合常规的分期检查方法,可以有效地协助诊断。但其并不常规推荐用于临床Ⅰ、Ⅱ期乳腺癌的分期诊断[5]。
(二)病理学诊断

【注释】
1.组织学病理检测标本包括粗针穿刺活检标本、真空辅助微创活检标本、乳腺肿物切除标本、乳腺病变保乳切除标本、全乳切除标本(包括单纯切除术和改良根治术)、前哨淋巴结活检标本及腋窝淋巴结标本。标本的固定、取材和大体描述规范详见《肿瘤病理诊断规范(乳腺癌)》[6]。
2.浸润性乳腺癌的病理报告应包括与患者治疗和预后相关的所有内容,如肿瘤大小、组织学类型、组织学分级、有无脉管侵犯、有无合并原位癌、切缘和淋巴结情况等。若为治疗后乳腺癌标本,则应对治疗反应进行评估。导管原位癌的病理诊断应报告核级别、有无坏死及手术切缘情况。对保乳标本的评价宜包括显微镜检查中肿瘤距切缘最近处的距离,若切缘阳性应注明切缘处肿瘤的类型[6]。
3.如浸润性癌和原位癌混合存在时,需明确浸润灶的范围,浸润灶最大径。
4.组织学类型宜参照《WHO乳腺肿瘤分类》[7],某些组织学类型的准确区分需行免疫组化检测后确认。组织学分级参照“乳腺癌组织学分级(改良Scarff-Bloom-Richardson分级系统)”[6]。
5.多基因表达谱分型可为临床病理分型提供信息,已有大量循证医学证实了其在乳腺癌预后评估和疗效预测中的作用。目前国际上常用的多基因表达谱检测包括:21基因表达复发风险评估(Oncotype DX®)、MammaPrint ®、PAM-50 ROR®、EndoPredict ®以及Breast Cancer Index®等,用于早期患者标准治疗后5年内的预后评估。根据国际临床数据,目前21基因表达复发风险评估(Oncotype DX®)可用于对激素受体阳性、HER-2阴性、淋巴结阴性、传统病理因素评估预后良好(T1-2N0M0)的患者,在标准辅助内分泌治疗上是否进行辅助化疗的决策参考。但目前基于华裔人群基因检测数据较少,国内缺乏相应的行业标准与共识,因此我们并不提倡所有患者都进行基因检测,应根据不同危险度合理选择。
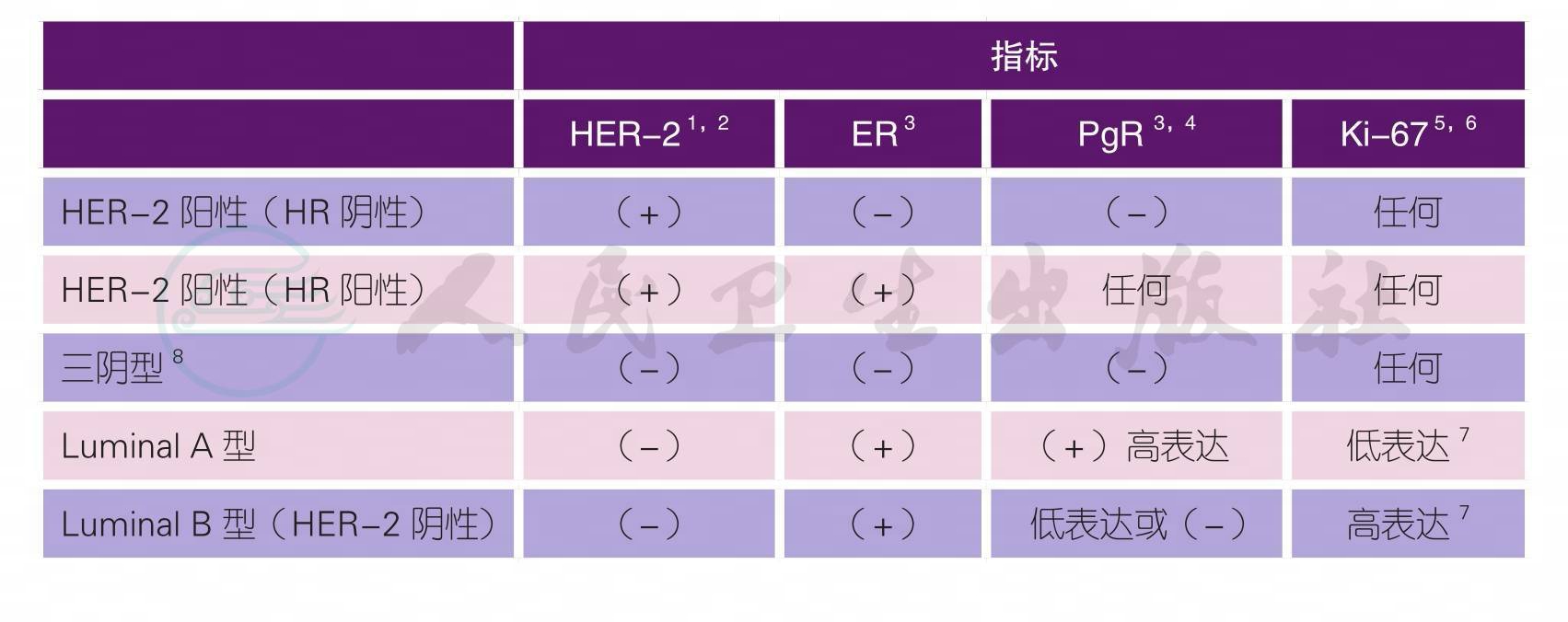
(三)分子分型诊断
随着驱动基因重要性的不断增强,明确判断HER-2状态成为分子分型诊断的重要原则。
【注释】
1.HER-2检测参考我国《乳腺癌HER-2检测指南(2014版)》[10]和《人表皮生长因子受体2阳性乳腺癌临床诊疗专家共识2016》[11]。应当对所有乳腺浸润性癌进行HER-2状态检测。HER-2的检测须在资质良好的病理实验室进行免疫组织化学(IHC)检测或原位杂交(ISH)检测。当临床医师对患者既往HER-2检测结果存在疑虑时(如检测时间早于全国推行标准化检测,或检测机构无资质认可,或检测机构的检测经验较少等),建议重新检测并以最新结果为参考。
2.HER-2阳性定义:免疫组化结果为+++或ISH阳性。具体判读方法如下:

3.雌、孕激素受体检测参考我国《乳腺癌雌、孕激素受体免疫组织化学检测指南(2015版)》。应对所有的乳腺浸润性癌和非浸润性癌进行激素受体状态检测。ER检测中有循证医学证据的是ERα抗体,建议使用国家食品药品监督管理总局(CFDA)认证批准的检测试剂。建议将ER、PR免疫组织化学检测的阳性阈值定为≥1%,阳性应报告染色强度和阳性肿瘤细胞的百分比[8]。
4.专家普遍认同PgR是重要的乳腺癌预后指标,建议将PgR 20%阳性作为Luminal A型和Luminal B 型的临界值[9]。
5.应对所有乳腺浸润性癌病例进行Ki-67的检测,并对癌细胞核中阳性染色细胞所占的百分比进行报告,阳性的强弱并不是目前的评估参数。在评估区域选择方面,对于阳性细胞分布较均匀的肿瘤细胞,只需随机选取3个或以上浸润性癌高倍镜视野计数,得出平均Ki-67指数;对于阳性细胞分布不均匀的肿瘤细胞,建议对阳性细胞热点区域的3个或以上浸润性癌高倍镜视野进行评估[12]。
6.2011年“乳腺癌ki-67国际工作组推荐评估指南”建议应在评估整张切片后,选取有代表区域的1000个浸润性癌细胞进行计数,不能少于500个癌细胞。基于日常工作中每张切片计数500个以上癌细胞的可行性,建议对ki-67指数为10%~30%的临界状态时,尽量评估500个以上癌细胞,提高准确性[13]。
7.Ki-67临界值定义应根据各实验室具体情况,大部分中国专家认同<15%为低表达;>30%为高表达[14]。当Ki-67为15%~30%时,建议再次行病理会诊或依据其他指标进行临床决策。
8.建议对初次检测为三阴性乳腺癌,重新复核免疫组化指标。
二、乳腺癌的术前新辅助治疗
(一)治疗前检查

【注释】
1.肿瘤临床分期参考美国癌症联合委员会(American Joint Committee on Cancer,AJCC)编写的《第8版AJCC癌症分期手册》。临床腋淋巴结阴性患者,术前治疗前后均可进行前哨淋巴结活检,以确定腋窝状况及后续处理;临床腋淋巴结阳性患者,术前治疗后临床腋窝转阴性患者前哨淋巴结活检具有一定的假阴性率,其临床应用目前尚存在争议。
2.病理检查详见本指南的“乳腺癌病理诊断”相关内容。
3.在术前治疗前,需要对原发灶肿物进行瘤床定位,可在肿瘤内放置标志物或是对肿瘤表面皮肤进行标记,为后续手术范围提供依据;术前穿刺阳性的腋淋巴结亦应放置标志物进行标记。
4.需详细评估患者一般状况,评估其对治疗的耐受性,综合制定治疗方案。
(二)术前新辅助治疗适应证[3]
满足以下条件之一者可选择术前新辅助药物治疗:
(1)肿块较大(>5cm);
(2)腋窝淋巴结转移;
(3)HER-2 阳性;
(4)三阴性;
(5)有保乳意愿,但肿瘤大小与乳房体积比例大难以保乳者。
【注释】
1.术前药物治疗包括术前化疗、术前靶向治疗及术前内分泌治疗,详见本部分相关章节。
2.如肿物>3cm,可综合其他危险因素选择是否进行药物治疗。
3.大部分中国专家认同,以仅有HER-2阳性或三阴性作为乳腺癌术前新辅助药物治疗选择的标准时,肿瘤应大于2cm,或可以加入临床研究。
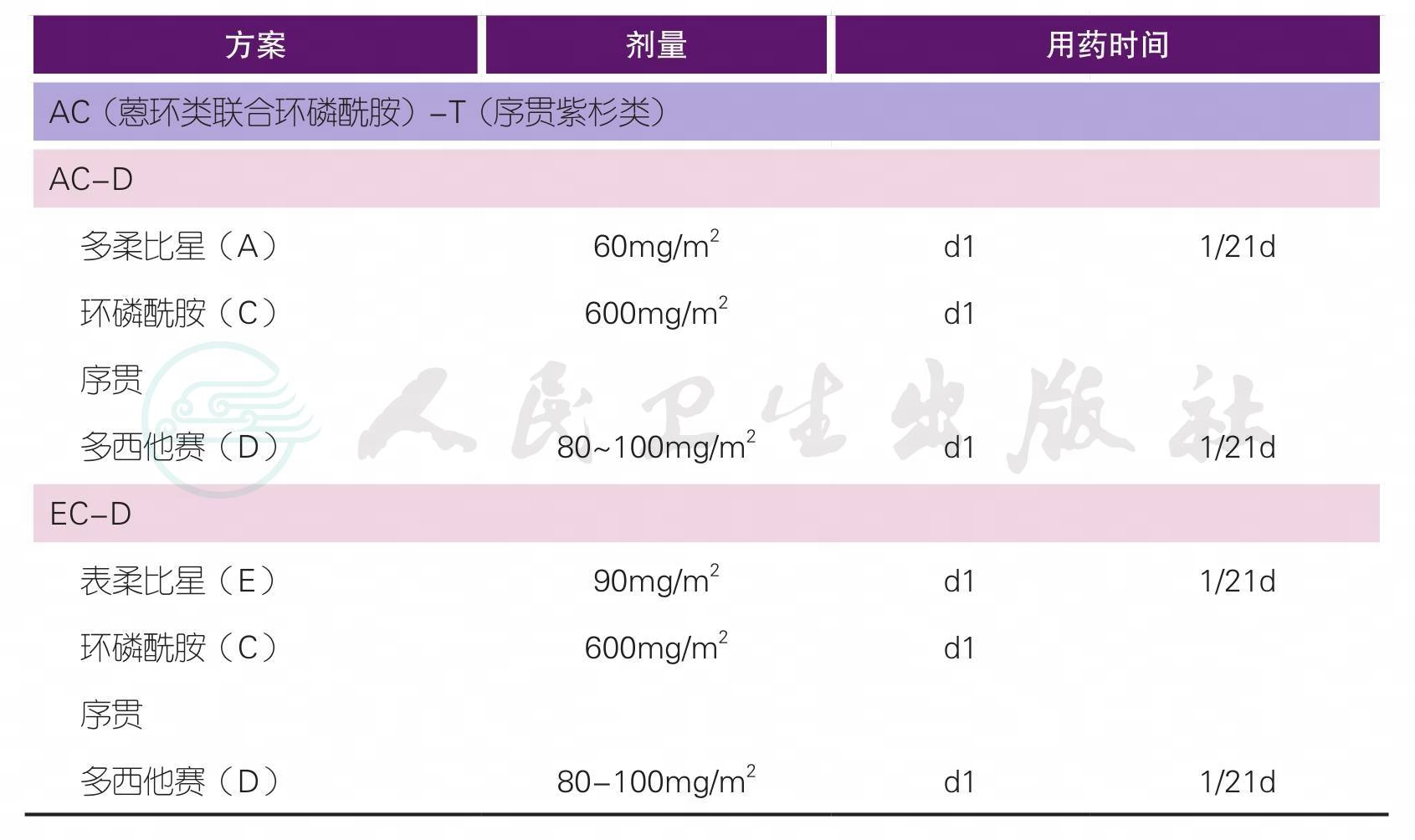
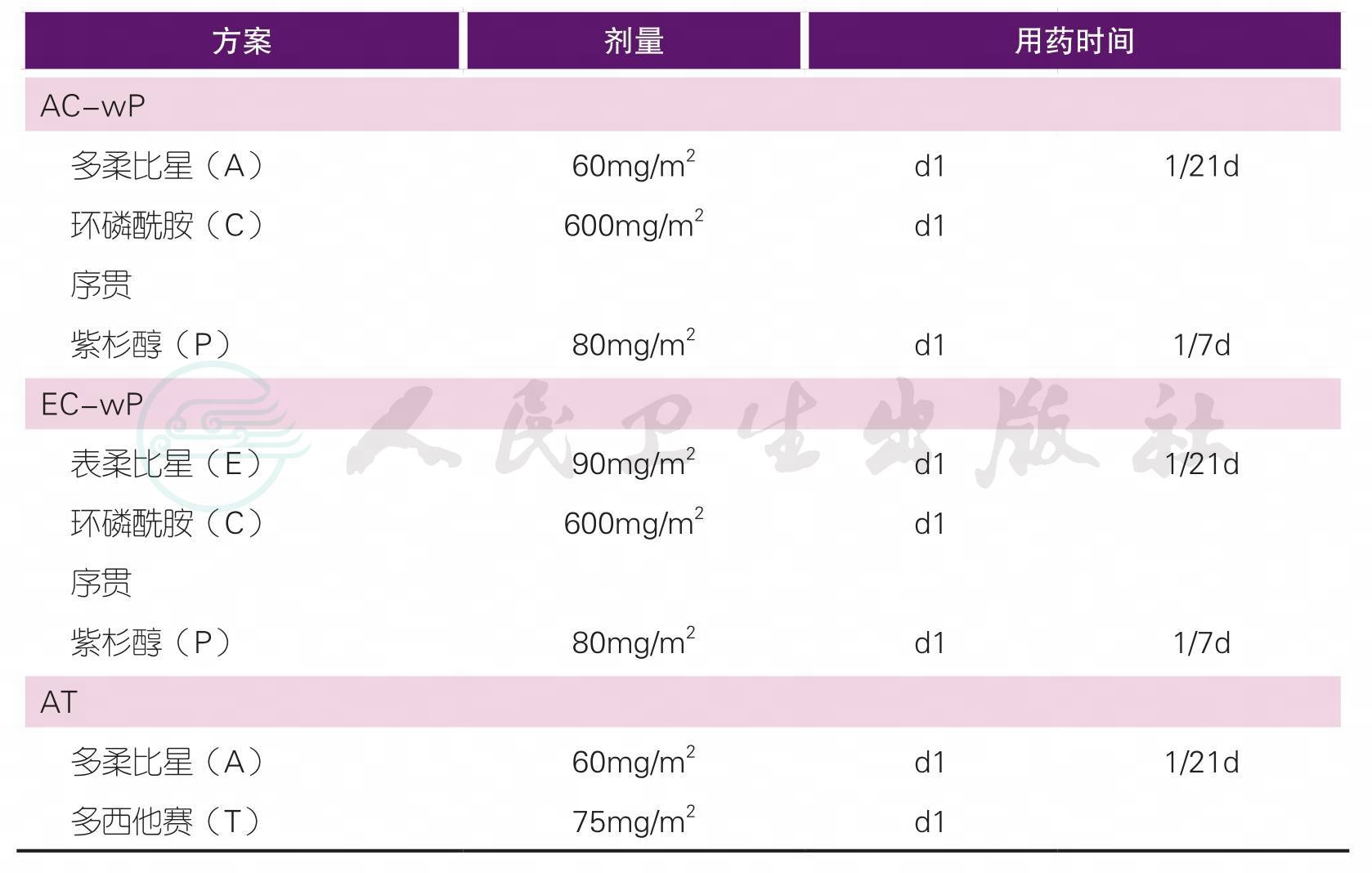
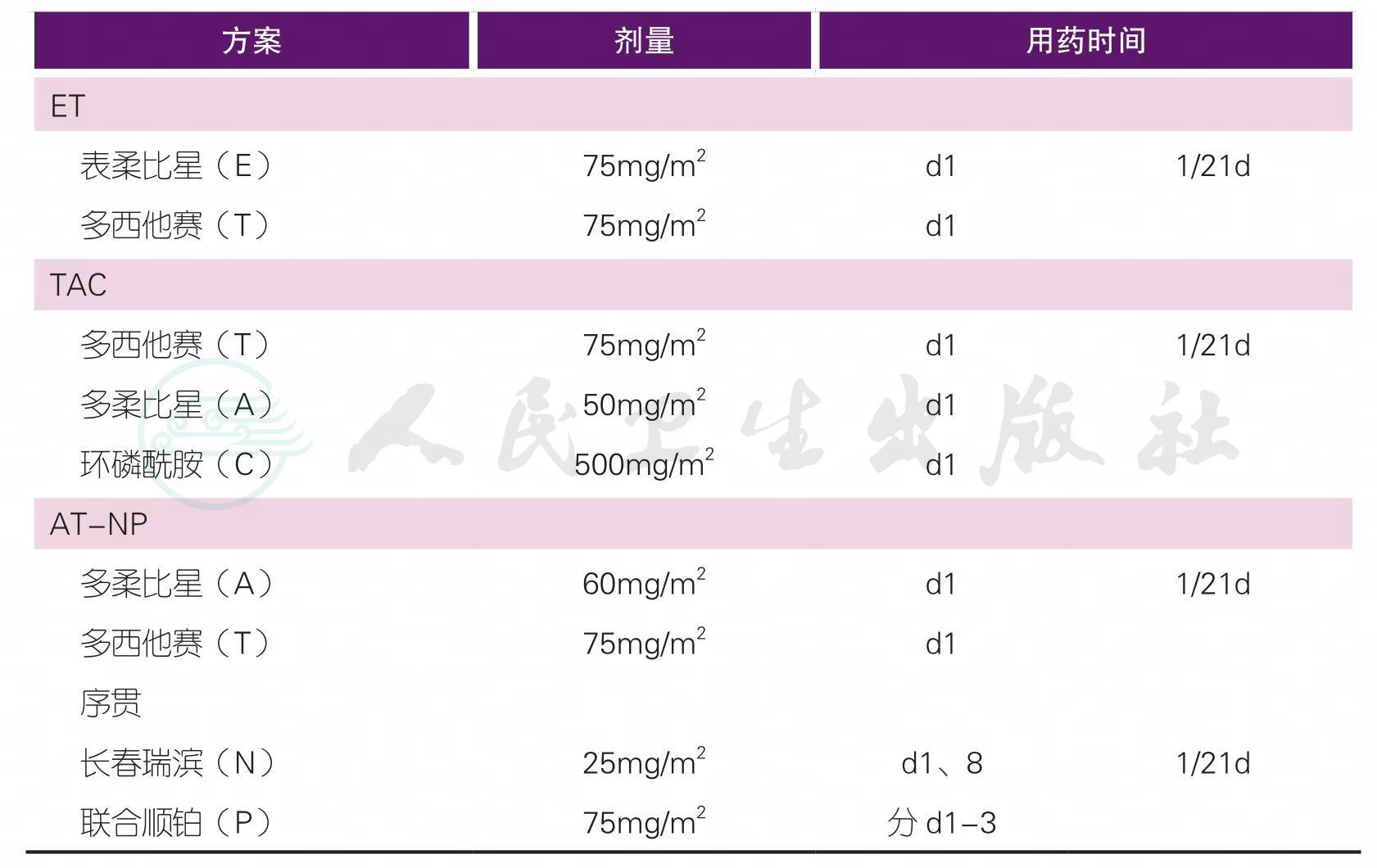
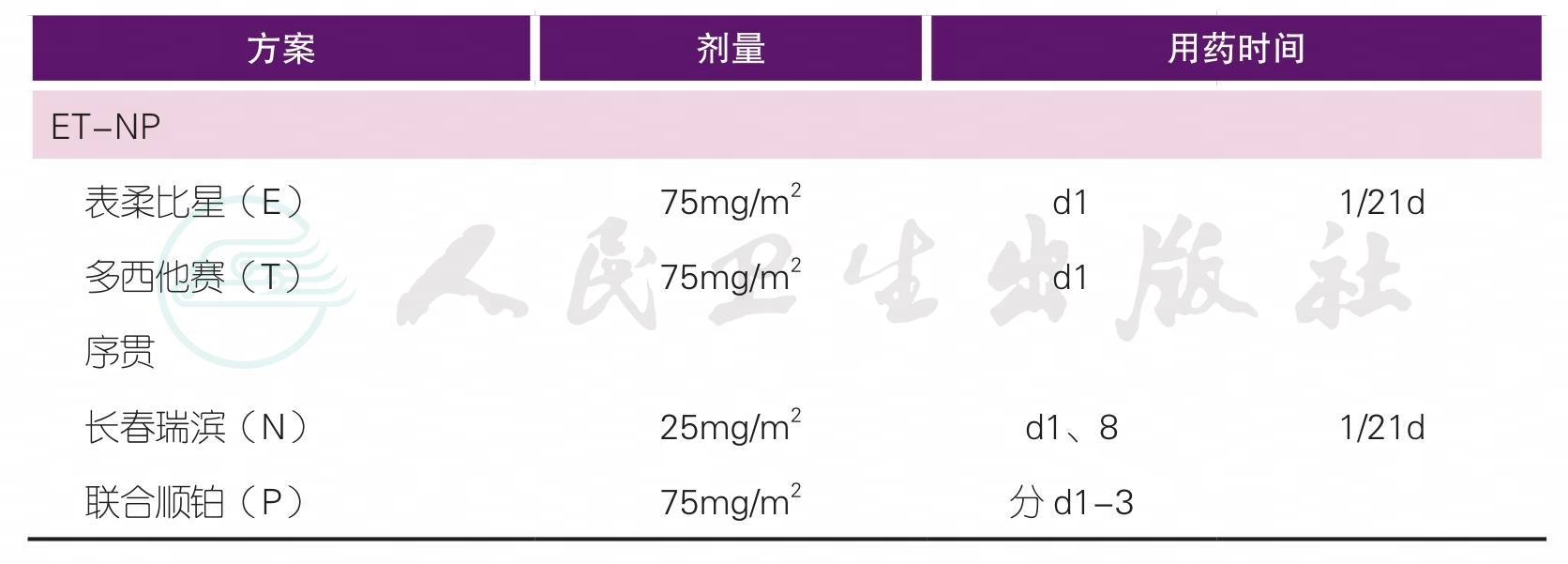
(三)术前化疗

注1:
T:紫杉类,包括紫杉醇、多西他赛、白蛋白紫杉醇
A:蒽环类,包括表柔比星、吡柔比星、多柔比星
C:环磷酰胺
N:长春瑞滨
P:铂类
注2:辅助化疗方案药物及剂量请详见下方注释
【注释】
1.新辅助化疗是指在手术前,首先进行全身化疗,其后再进行手术和局部治疗的方法。完成治疗前检查(详见“治疗前检查”相关内容)评估患者的情况,制定科学合理的治疗方案至关重要。应根据不同的治疗目的,在新辅助化疗前决定治疗方案及周期数。
2.使用乳腺钼钯、B超和MRI在治疗前后对肿瘤进行测量和评价,原则上每个周期通过查体和B超评价肿瘤大小,每两个周期通过乳腺钼钯或MRI评价肿瘤大小,根据通行的评价标准(参考实体瘤疗效评价标准RECIST 1.1版本)进行疗效评估,原则上应持续使用同一检查方法进行评价。
3.原则上,按照疗效评估标准进行评估,治疗有效者应于术前按照既定方案及周期完成新辅助化疗,并及时讨论进行手术治疗的时机和合理的手术治疗方式。使用初选新辅助化疗方案肿瘤未缓解时应及时调整治疗方案和治疗周期,仍疗效欠佳者应考虑手术治疗。
4.手术病理是术前新辅助化疗疗效评估的最佳手段,术后患者是否达病理学完全缓解(pCR)对治疗具有重要意义。pCR的定义有两种:①一般是指乳腺原发灶中找不到恶性肿瘤的组织学证据,或仅存原位癌成分;②严格意义上是指乳腺原发灶和转移的区域淋巴结均达到pCR。应注意,pCR是术前化疗的有效评价手段,但要避免为了追求更多的pCR而过度延长化疗周期。
5.经新辅助化疗后患者的术后辅助治疗:
(1)激素受体阳性患者经充分新辅助化疗后,进行手术,大多数未达到pCR患者,应及时开始辅助内分泌治疗。
(2)HER-2阳性患者无论是否达到pCR,推荐术后应继续使用曲妥珠单抗,总疗程达1年(新辅助及辅助抗HER-2治疗详见相关章节)。
(3)三阴性患者经术前新辅助化疗后未达pCR的患者,根据术前分期、病理细胞学分级,经充分考虑后,可给予术后辅助卡培他滨治疗(2B类证据)。
(4)新辅助化疗未足疗程的患者,需根据治疗前和术后病理情况,讨论决定辅助化疗的方案和周期数。
6.治疗方案中的蒽环类药物(简称A)包括多柔比星、表柔比星;治疗方案中的紫杉类药物(简称T)包括紫杉醇、多西他赛,也可考虑白蛋白紫杉醇。吡柔比星的国际循证医学数据有限,但考虑到药物可及性,在我国临床实践中蒽环类药物也可以考虑选择吡柔比星,推荐剂量为50mg/m2。
7.铂类在术前化疗中的地位仍待确定,目前已有少量研究显示铂类可以提高三阴性乳腺癌患者术前化疗的pCR率[16,17],但由于缺乏随机对照的Ⅲ期临床研究数据,目前并不能常规推荐含铂方案作为三阴性乳腺癌的优选方案。如临床研究方案中涉及含铂类的化疗方案,研究设计应符合科学性和伦理要求。
8.术前化疗常用方案用法用量
术前化疗常用方案用法用量(续表)
术前化疗常用方案用法用量(续表)
术前化疗常用方案用法用量(续表)
注:化疗过程中需要注意避免骨髓功能抑制,合理的预防性使用CSF(详见七、乳腺癌的治疗管理)
(四)HER-2阳性乳腺癌术前治疗

注1:
A:蒽环类,包括表柔比星、吡柔比星、多柔比星
C:环磷酰胺
T:紫杉类,包括紫杉醇、多西他赛、白蛋白紫杉醇
Cb:卡铂
H:曲妥珠单抗
P:帕妥珠单抗
注2:术前靶向治疗方案药物及剂量请详见下方注释6
【注释】
1.临床研究证明,HER-2阳性患者新辅助治疗,曲妥珠单抗联合化疗与单用化疗相比能够显著提高pCR率,奠定了曲妥珠单抗在HER-2阳性乳腺癌新辅助治疗中的标准地位[18,19]。
2.HER-2阳性乳腺癌术前靶向治疗原则:
(1)鼓励研究者设计符合科学性和伦理学要求的临床研究。
(2)术前新辅助治疗用过曲妥珠单抗的患者,无论是否达到pCR,目前指南推荐术后应继续使用曲妥珠单抗,总疗程达1年。
3.Buzdar等的新辅助治疗试验中,曲妥珠单抗联合紫杉醇序贯CEF化疗的pCR率显著高于单纯化疗组[18];Ⅲ期NOAH研究结果进一步证实了曲妥珠单抗新辅助治疗的获益,pCR率、五年无事件生存率和总生存率均显著提高[19]。因此,曲妥珠单抗为基础的方案成为HER-2阳性乳腺癌的标准新辅助治疗方案。AC-TH与TCbH方案参考辅助治疗研究,均可作为新辅助治疗的推荐方案[20-21],但考虑到先用曲妥珠单抗可能可以达到快速缩瘤、防止肿瘤进展的作用,因此推荐更早使用含有曲妥珠单抗的方案,例如TCbH。
4.HER-2阳性患者应首选含曲妥珠单抗治疗,TH治疗后,无论患者是否手术,都可以换用AC治疗。尽管蒽环类药物存在心脏毒性,一般不与曲妥珠单抗联用,但两者联用可获得更高的有效率,且在有限的蒽环治疗周期下,药物的心脏毒性可控,因此,多西他赛+蒽环类+曲妥珠单抗的TAH方案也是可以选择的。
5.曲妥珠单抗联用帕妥珠单抗的双靶向抗HER-2治疗也是可选的治疗策略。Neosphere研究证实了曲妥珠单抗和帕妥珠单抗与多西他赛联合进一步提高了pCR率[22]。
6.HER-2阳性乳腺癌术前靶向治疗常用方案用法用量

HER-2阳性乳腺癌术前靶向治疗常用方案用法用量(续表)

(五)激素受体阳性乳腺癌术前内分泌治疗
术前内分泌治疗的适宜人群:需要术前治疗而又无法适应化疗的、暂时不可手术或无需手术的激素受体阳性患者,可考虑术前内分泌治疗。
1.绝经后激素受体阳性患者的术前内分泌治疗推荐使用第三代芳香化酶抑制剂类药物,包括阿那曲唑、来曲唑、依西美坦。绝经前激素受体阳性患者的术前内分泌治疗可选卵巢功能抑制联合芳香化酶抑制剂。
2.术前内分泌治疗一般应每2个月进行一次疗效评价,治疗有效且可耐受患者,可持续治疗至6个月。完成术前内分泌治疗后,接受手术治疗,术后进行辅助内分泌治疗(方案详见辅助内分泌治疗部分)。
3.绝经前患者术前内分泌治疗与术前化疗比较的临床研究结果尚有限,除临床研究外,目前原则上不推荐对绝经前患者采用术前内分泌治疗。
三、乳腺癌的术后辅助治疗
(一)辅助治疗前评估及检查

【注释】
1.肿瘤临床和病理分期。肿瘤临床分期参考美国癌症联合委员会(American Joint Committee on Cancer,AJCC)编写的《第8版AJCC癌症分期手册》,对于手术后的患者,应依据手术后的病理情况进行TNM分期,包括肿块数目、位置、最大径和区域淋巴结状况及切缘情况。远处病灶评估(M分期)详见早期乳腺癌确诊检查相关内容。
2.详见指南“病理学诊断”及“分子分型诊断”相关内容。
3.需详细评估患者一般状况,评估其对治疗的耐受性,综合制定治疗方案。
4.国外指南推荐多基因检测作为部分Luminal型患者选择辅助化疗的重要依据,但目前基于中国人群的多基因检测相关研究仍然较少,国内缺乏相应的行业标准与共识,因此目前并不常规推荐。
(二)HER-2阳性乳腺癌的辅助治疗

注1:
H:曲妥珠单抗
P:帕妥珠单抗
A:蒽环类,包括表柔比星、吡柔比星、多柔比星
C:环磷酰胺
T:紫杉类,包括紫杉醇、多西他赛
Cb:卡铂
注2:辅助化疗方案药物及剂量请详见下方注释9
【注释】
1.腋窝淋巴结阴性的HER-2阳性乳腺癌患者曲妥珠单抗辅助治疗适应证
(1)T1c及以上患者应该接受曲妥珠单抗辅助治疗。
(2)T1b患者可推荐曲妥珠单抗辅助治疗。
(3)T1a患者可考虑曲妥珠单抗辅助治疗,尤其伴高危因素患者,如激素受体阴性、分级差、Ki-67高等。
2.HERA研究证实曲妥珠单抗用于HER-2阳性早期乳腺癌术后辅助治疗,显著提高HER-2阳性早期乳腺癌治愈机会,显著降低复发和病死风险[23],是HER-2阳性早期乳腺癌辅助治疗标准药物。由于曲妥珠单抗可能增加心脏毒性,不建议与蒽环类化疗药同时使用;但可与紫杉类化疗合用;还可与辅助放疗、辅助内分泌治疗同时使用。
3.B-31/NSABP-9831确立了AC-TH(蒽环联合环磷酰胺序贯紫杉类药物联合曲妥珠单抗)优于常规AC-T化疗[20]。
4.BCIRG 006确立了TCbH方案(多西他赛、卡铂联合曲妥珠单抗)也优于AC-T,可作为辅助治疗方案的另一个选择,该研究10年长期随访显示TCbH和AC-TH两种方案的远期疗效相似,但TCbH方案心功能不全发生率较低,因此对于心脏安全性要求更高的患者,可以选择TCbH方案[21]。
5.APHINITY研究结果显示,与使用含曲妥珠单抗的方案相比,使用含帕妥珠单抗和曲妥珠单抗的双靶向?