 去看看
去看看


1.焦虑障碍
1.1 背景
恶性肿瘤是一个重大的负性事件和应激事件,患者不得不面对恶性肿瘤给自己生活带来的巨大变化,有部分患者在面对恶性肿瘤时会伴随有精神障碍。其中,焦虑障碍(anxiety disorders)在恶性肿瘤患者中很常见。在面对威胁生命的疾病时,焦虑是一种正常的反应,它通常在两周内逐渐消失。若焦虑症状持续存在,则会发展为焦虑障碍。焦虑障碍是一组障碍,包含广泛性焦虑障碍、惊恐障碍、广场恐怖、特殊恐怖症、社交焦虑障碍、急性应激障碍和创伤后应激障碍。国外研究发现,恶性肿瘤患者焦虑障碍的患病率远高于健康人群,Fallowfield [1]等1994年对216名乳腺癌患者进行了观察性研究,结果发现焦虑障碍的患病率为17%~23%。Kissane等[2]1998年进行的一项观察性研究也发现,303名乳腺癌患者中1.7%患有广泛性焦虑障碍,6.9%患有恐怖症,1.3%患有惊恐障碍,3.9%患有适应障碍。Linden W等调查了10 153名不同类型的恶性肿瘤患者,结果显示19%的患者存在有临床意义的焦虑症状,22.6%存在亚临床焦虑,其中妇科肿瘤、白血病及肺部肿瘤患者焦虑水平较高,皮肤肿瘤和前列腺肿瘤患者焦虑水平较低[3]。国内张金芳等调查了住院、门诊及抗癌康复会247名恶性肿瘤患者的情绪状态,结果发现恶性肿瘤患者焦虑的患病率与病种及患者的治疗状况有关,其中焦虑患病率为13.36%[4],与国外研究相近。
1.2 证据
1.2.1 病因
对于多数患者来说,焦虑症状是对恶性肿瘤本身及其治疗的反应。某些恶性肿瘤本身,如神经内分泌肿瘤(如嗜铬细胞瘤)、小细胞肺癌、甲状腺癌均可引起焦虑[5]。而恶性肿瘤的诊断、治疗亦会引起患者的焦虑情绪[6],导致心理痛苦水平增高。放疗和化疗的不良反应,如恶心呕吐、疲乏等症状,常常加重患者的焦虑情绪[7,8]。此外,
[9,10]多种常用药物也可以引起不同程度的焦虑 ,如干扰素可以导致焦虑和惊恐发作。短期应用类固醇激素可以引起情绪不稳和躁动不安。某些止吐药物如异丙嗪和甲氧氯普胺,抗精神病药物如氟哌啶醇、氯丙嗪、利培酮可引起静坐不能。精神兴奋药如哌甲酯,免疫抑制剂如环孢霉素,支气管扩张剂如沙丁胺醇气雾剂,突然停用大剂量酒精、麻醉性镇痛剂、镇静催眠剂等都可引起焦虑。周期性化疗中会出现预期性恶心呕吐[11(]anticipatory nausea and vomiting, ANV)。
1.2.2 评估工具
医院焦虑抑郁量表(Hospital Anxiety Depression Scale, HADS)[12]具有良好的信度和效度,广泛应用于综合医院患者焦虑和抑郁情绪的筛查和研究。国内常用的中文版医院焦虑抑郁量表经翻译并校对后在我国综合医院患者中开始应用[13],研究以9分为分界点,焦虑和抑郁分量表敏感度均为100%,特异性分别为90%和100%。Mitchell AJ等[14]2010年对45个短或超短评估工具进行了综述分析,结果显示在肿瘤临床中使用HADS既能保证结果的有效性,也能确保临床应用的可接受性。
广泛性焦虑自评量表(General Anxiety Disorder-7, GAD-7)包含7个条目,每个条目评分为0~3分;制订者推荐≥5分,≥10分和≥15分分别代表轻、中和重度焦虑[15]。我国综合医院普通门诊患者的研究中以10分为临界值,灵敏度和特异度分别为86.2%和95.5%,具有较好的信效度[16]。肖水源等[17]研究发现GAD-7在恶性肿瘤患者的应用中有较好的信效度,能有效地筛查和评估恶性肿瘤患者中广泛性焦虑的状况。
汉密尔顿焦虑量表(Hamilton Anxiety Scale, HAMA)由Hamilton于1959年编制,用于评定焦虑症状的严重程度[18]。HAMA是精神科临床和科研领域对焦虑症状进行评定的应用最广泛的他评量表,具有良好的信效度[19],广泛应用于肿瘤临床[20]。
1.2.3 焦虑的干预
对恶性肿瘤患者焦虑最有效的干预应包含心理干预和药物干预。Traeger L等[21]2012年对恶性肿瘤患者进行一项Meta分析,结果发现基于证据的文献均支持使用社会心理和精神药理的干预方式来预防或减轻焦虑症状。由于恶性肿瘤本身和治疗导致的躯体症状常常与焦虑产生的躯体症状并存,因此需早期识别焦虑障碍,焦虑障碍的治疗,应整合到恶性肿瘤的治疗中,作为综合治疗干预手段的一部分。
(1)心理干预
针对恶性肿瘤患者的心理干预方法有很多,一些新患者和接受化疗前患者的治疗方向是减轻焦虑,增强自我效能[22,23]。更多针对焦虑障碍的心理干预方式包括教育和精神疗法、压力管理以及支持性心理咨询。教育和精神疗法,包括认知行为和支持表达疗法,是心理干预的重要组成部分[24]。
在临床上,支持性心理治疗简单实用,是最常用的方法,可以由大多数临床肿瘤医生提供。支持性心理治疗的关键是耐心倾听、有效沟通、教育患者。支持性心理治疗反映非定向的方法,允许患者加工他们与恶性肿瘤相关的经验。放松训练可以单独使用或整合到多模式的干预[24]。肿瘤化疗患者焦虑的心理干预方式有许多,由天辉等[25]进行的一项随机对照研究发现,与常规健康教育相比,认知行为干预模式在减轻或消除乳腺癌化疗患者的焦虑情绪方面效果明显。Bulfone等[26]对60例乳腺癌术后化疗1~2个疗程的患者实施随机对照研究,结果发现音乐治疗可以缓解患者的焦虑状态。Mehnert等[27]对化疗后4周的原发非转移性乳腺癌患者进行随机对照研究,结果发现接受运动疗法的干预组患者的焦虑、抑郁状况有显著改善。Schnerider等[28]研究发现,女性化疗患者在使用虚拟现实装置后,焦虑和抑郁心理均有所减轻,由化疗引起的相关症状困扰也得到缓解。
(2)药物干预
一般而言,通过焦虑症状的严重程度来决定是否使用药物来治疗焦虑。轻度焦虑患者使用支持性治疗或行为治疗已足够,但对于持续恐惧和焦虑的患者需要药物治疗,药物治疗疗效显著且起效较快。苯二氮类药物常用于肿瘤患者,来治疗焦虑,特别是惊恐发作,也用于治疗恶心和失眠。应用抗焦虑药时需考虑抗焦虑药物和恶性肿瘤治疗药物之间可能存在相互作用,药物从小剂量开始服用,如果耐受好再逐渐增加剂量。由于恶性肿瘤患者的代谢状态发生了改变,药物维持剂量要比健康个体低。表7-1列出了常用于恶性肿瘤患者的抗焦虑药[29-31]。
表7-1 常用于恶性肿瘤患者的抗焦虑药
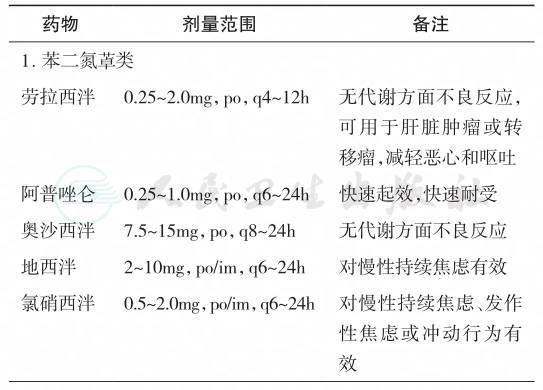
续表

po=口服;im=肌内注射
表7-2列出了基于证据的恶性肿瘤患者服用抗焦虑药的疗效。
表7-2 基于证据的恶性肿瘤患者服用抗焦虑药的疗效

续表
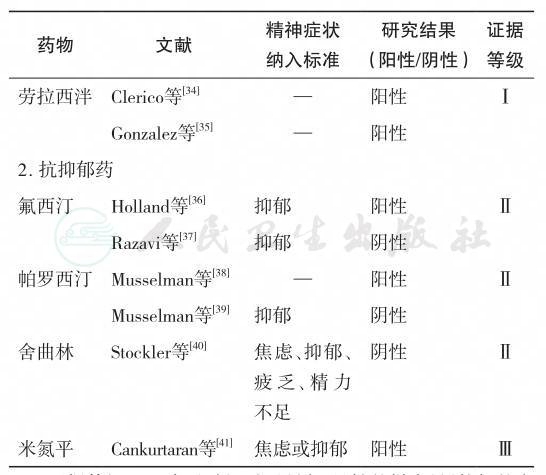
证据等级:Ⅰ,多元随机对照研究,足够的样本量(较好的安慰剂对照研究);Ⅱ,至少有一个随机对照(较好的安慰剂对照研究);Ⅲ,前瞻性研究、病例分析或高质量的回顾性研究。
1.3 推荐意见
1.3.1 肿瘤患者焦虑障碍的评估工具推荐使用医院焦虑抑郁量表。(强烈推荐,高质量证据)
1.3.2 肿瘤患者焦虑障碍的评估可选用广泛性焦虑自评量表。(强烈推荐,中等质量证据)
1.3.3 恶性肿瘤患者的焦虑障碍推荐心理干预联合药物干预。(强烈推荐,高质量证据)
1.3.4 推荐使用个体心理干预改善恶性肿瘤患者的焦虑症状。(强烈推荐,中等质量证据)
1.3.5 推荐使用认知行为治疗短期改善恶性肿瘤患者的焦虑症状。(强烈推荐,高质量证据)
1.3.6 对于持续恐惧和焦虑的患者,一线药物是苯二氮类药物。(强烈推荐,高质量证据)
1.3.7 推荐使用阿普唑仑改善患者焦虑症状。(强烈推荐,中等质量证据)
1.3.8 推荐使用劳拉西泮改善患者焦虑症状。(强烈推荐,高质量证据)
1.3.9 推荐使用舍曲林改善患者焦虑、抑郁、疲乏、精力不足的症状。(强烈推荐,中等质量证据)
1.3.10 推荐使用米氮平改善患者焦虑或抑郁症状。(强烈推荐,低质量证据)
2.抑郁障碍
2.1 背景
肿瘤的发生发展与心理社会因素有着不可忽视的联系,其情绪反应以抑郁最为常见。抑郁是伴随负性生活事件(如肿瘤诊断和治疗应激)的正常心理体验,但如果人们不能良好地应对肿瘤这个疾病,肿瘤就会明显影响他们的生活、工作和社会功能,从而导致抑郁障碍的发生[5]。Derogatis等[42]进行的一项随机研究,调查了215例住院及门诊恶性肿瘤患者,其中47%的患者出现精神症状,在这47%的患者中,有13%的患者伴有重度抑郁。一项调查了130例晚期恶性肿瘤患者的研究发现,抑郁的患病率为13%~26%[43]。我国Zhao L等调查了460例住院的恶性肿瘤患者,结果发现重度抑郁的患病率为25.9%(21.9%~29.9%)[44],与国外研究相近。由于不同地区的肿瘤类型分布不同,因此抑郁的患病率也有所不同。抑郁障碍的发生与肿瘤的发展进程相关,Meyer等[45]对628例晚期恶性肿瘤患者抑郁的患病率进行了调查,结果发现相比早期肿瘤,晚期肿瘤患者更易出现抑郁。肿瘤相关性抑郁(cancer-related depression, CRD)是指由肿瘤诊断、治疗及其并发症等,导致患者失去个人精神常态的情绪病理反应[25]。
2.2 证据
2.2.1 诊断依据
目前临床主要使用的诊断标准是国际疾病分类第10版(ICD-10)中精神和行为障碍的分类,是世界卫生组织170多个成员国家共同使用的现行分类系统,是临床上经常使用的诊断标准[46]。诊断中需要注意,抑郁障碍的临床症状与临床疾病本身的症状很相似[47],如自主神经功能症状(如食欲缺乏、胃肠功能紊乱、性欲下降等)可能为肿瘤本身引起的,而非抑郁障碍的症状。某些抗癌药物也可以引起抑郁障碍,如干扰素、白介素-2和类固醇激素等。
2.2.2 评估工具
目前还没有明确的适用于肿瘤临床的评估工具。临床或科研中常采用的筛查评估工具是医院焦虑抑郁量表(HADS),这是较完整的评估工具,具有良好的信效度,至少可以推荐用于晚期恶性肿瘤或姑息治疗的患者[48]。
贝克抑郁自评量表(Beck Depression Inventory, BDI)被广泛运用于临床流行病学调查,它更适用于不同类型及不同分期的恶性肿瘤患者,能更好地用于筛查恶性肿瘤患者的抑郁症状[48]。
患者健康问卷-9(Patient Health Questionnaire-9, PHQ-9)内容简单且操作性强,被广泛用于精神疾病的筛查和评估[49]。国内肖水源等[17]将该量表用于恶性肿瘤患者的抑郁筛查,证实该量表具有良好的信度和效度,是可操作性强,简单方便的抑郁筛查量表。
为了避免自评量表在筛查方法上的偏差,临床和科研中一般会同时选用两种以上的量表或问卷[50]。
2.2.3 抑郁的干预
抑郁障碍的治疗包含精神药物治疗和心理治疗。对于轻到中度抑郁障碍可选择心理治疗,而重度抑郁障碍则首选药物治疗。大多数情况下,可选择两者联合治疗抑郁障碍。
(1)药物治疗
临床上,抗抑郁治疗药物已经被广泛用来治疗各种躯体疾病伴发的抑郁障碍,而且研究表明抗抑郁药物对肿瘤相关性抑郁同样有效[51,52]。选择性5-羟色胺(5-HT)再摄取抑制剂是近年临床上广泛应用的抗抑郁药,主要药理作用是选择性抑制5-HT再摄取,使突触间隙5-HT含量升高而达到治疗抑郁障碍的目的,具有疗效好,不良反应少,耐受性好,服用方便等特点。主要包括氟西汀、舍曲林、帕罗西汀、西酞普兰和艾司西酞普兰。Fisch MJ等[53]一项随机双盲对照研究,163名伴有抑郁症状的晚期恶性肿瘤患者分别服用氟西汀(20mg/d)和安慰剂治疗12周,结果发现服用氟西汀可以提高患者的生活质量,减轻抑郁症状,且氟西汀的耐受情况良好。此外,Morrow GR等[54]进行的一项随机双盲对照研究发现,帕罗西汀能改善恶性肿瘤患者的抑郁情绪,但对化疗患者的疲乏没有显著改善。
新型抗抑郁药文拉法辛、度洛西汀和米氮平是具有5-HT和去甲肾上腺素(NE)双重作用的新药。Cankurtaran
[55]等 的一项研究对米氮平和丙咪嗪的疗效进行了对比,将伴有重度抑郁障碍的恶性肿瘤患者分为3组,分别给予米氮平、丙咪嗪及安慰剂治疗,结果发现米氮平可以有效地改善恶性肿瘤患者的抑郁和失眠,其疗效优于丙咪嗪。此外,部分学者研究发现,米氮平还能改善恶性肿瘤患者恶病质、恶心和潮红等症状[56-58]。表7-3列出了肿瘤患者常用的抗抑郁药[59-61]。
表7-3 肿瘤患者常用的抗抑郁药物

续表

续表

(2)心理治疗
对于肿瘤患者的抑郁障碍,可采取个体心理治疗或团体治疗的方式。常用的心理治疗方法有:支持性心理治疗、认知行为治疗等。一般而言,支持性心理治疗可帮助患者减少孤独感,学习应对技巧。认知行为治疗可以缓解患者特殊的情绪、行为和社会问题,以获得减轻焦虑、抑郁和痛苦。国内的团体心理治疗比较成熟,洪晔等[62]对133例乳腺癌患者进行了随机对照研究,结果发现乳腺癌患者团体心理干预改善生活质量的效果在干预后3个月得以显现,团体心理干预对生活质量较差的乳腺癌患者更有效。李金江等[63]对59例门诊的肺癌患者进行了开放对照试验,结果发现团体心理干预可提高肺癌患者
[64]的社会功能,减轻抑郁情绪。王亚朋等 采用开放对照试验对54例胃癌患者进行了研究,结果发现团体心理干预能改善胃癌患者的生活质量及焦虑抑郁情绪,促进康复。易鸣等[65]也采用开放对照研究,调查了67例早中期结直肠癌患者,结果发现团体心理干预有助于降低早中期结直肠癌患者焦虑及抑郁水平,提高生活质量。
2.3 推荐意见
2.3.1 选择性5-HT再摄取抑制剂在临床上应用广泛,具有疗效好,不良反应少,耐受性好,服用方便等特点。(强烈推荐,高质量证据)
2.3.2 推荐使用氟西汀减轻恶性肿瘤患者的抑郁症状,提高生活质量,且氟西汀的耐受情况良好。(强烈推荐,高质量证据)
2.3.3 推荐使用帕罗西汀改善恶性肿瘤患者的抑郁情绪,但帕罗西汀对化疗患者的疲乏没有显著改善。(强烈推荐,高质量证据)
2.3.4 推荐使用米氮平改善恶性肿瘤患者的抑郁和失眠,其疗效优于丙咪嗪。(强烈推荐,中等质量证据)
2.3.5 推荐使用米氮平改善恶性肿瘤患者恶病质、恶心和潮红等症状。(强烈推荐,高质量证据)
2.3.6 抗抑郁药应从小剂量开始使用,逐渐加量,密切注意药物的不良反应。(强烈推荐,高质量证据)
2.3.7 推荐运用团体心理治疗技术改善恶性肿瘤患者的情绪状况和生活质量。(强烈推荐,高质量证据)
3.谵妄
3.1 背景
谵妄(Delirium)是恶性肿瘤患者,特别是晚期恶性肿瘤患者常见的一种精神症状。它是一种短暂的,通常可以恢复的,以认知功能损害和意识水平下降为特征的脑器质性综合征,通常急性发作,多在晚间加重,持续时间数小时到数日不等。在住院的恶性肿瘤患者中,谵妄的患病率大约在15%~30%[66],终末期患者则达到85%[67],谵妄的发生将影响患者的疾病进程,延长住院时间,甚至会影响其生存期,增加死亡危险,并给家属造成沉重的护理负担和心理压力。
3.2 证据
3.2.1 评估工具
近年来有很多针对谵妄的评估工具用于肿瘤临床,但目前尚缺乏对于这些评估工具收益与负担的准确评估。理想的评估工具应根据治疗目标、临床情况以及使用者(医生或护士)的情况进行选择。
研究表明,简明精神状态检查量表(Mmini-Mental State Examination, MMSE)可用于肿瘤临床的筛查,可有效的检测到认知损害,但缺乏诊断效力。MMSE简单且评分容易,但是它不能区分痴呆和谵妄[68],而且MMSE存在较高的假阴性率,尤其是针对局部脑外伤和轻度认知功能障碍者。文化程度和MMSE得分成正相关,即文化程度越低,MMSE得分越低。
护理谵妄筛查量表(Nursing Delirium Screening Scale, Nu-DESC)常用于围术期谵妄筛选,其最大的特征是其便携性和易用性,利用与患者简单交流得到的信息就能完成评估,适用于护理人员对住院患者的日常评估,但敏感性和特异性略低[69]。
谵妄评定量表(The Delirium Rating Scale, DRS)用于临床工作者评定躯体疾病的患者发生谵妄及其严重程度的量表。DRS的评定基于对患者24小时的观察,所有与患者的访谈、精神状态检查、护士观察和家属报告的有用信息都对DRS的评分有帮助[70,71]。
Sands等开发出仅有一个问题的筛查工具(single question in delirium, SQiD),由护理人员询问照顾者,研究表明具有良好的信效度,可推荐用于我国肿瘤临床[72]。
3.2.2 谵妄的处理
(1)非药物干预
1)非药物干预预防谵妄:
Inouye[73]等1999年在《新英格兰医学杂志》上发表的一项多因素非药物干预研究,发现通过干预谵妄的6个核心风险因素(认知损害、睡眠剥夺、活动受限、视觉受损、听觉受损以及脱水)后,以发生谵妄作为结局指标,住院老年患者的谵妄发生率在干预组为10%,对照组为15%,谵妄的持续时间以及谵妄的发作次数,干预组显著低于对照组,但是两组在谵妄的严
[74]重程度上没有显著差异。2015年Hshieh等对谵妄的多因素非药物干预的作用进行了Meta分析,结果表明非药物干预可有效减少谵妄的发病率。
在肿瘤临床中,Gagnon[75]等使用简化的多因素非药物干预用于终末期恶性肿瘤患者,通过对医生(关注谵妄风险因素)、患者(重新定向)以及家属(宣教)的干预,发现干预组与对照组在谵妄发生率、严重程度以及谵妄时间上没有显著差异,研究者对此的解释为使用的干预方法过于简单,而研究对象是终末期的恶性肿瘤患者,从而未能达到相应的效果。此外,该研究还存在很多方法学上的局限,需要更进一步的研究,特别是针对肿瘤临床特征性的风险因素进行干预。我国学者使用多因素非药物干预老年口腔癌患者,发现术后谵妄发生率和持续时间均低于对照组[76]。
2)非药物干预治疗谵妄:
Cole等[77,78]针对老年谵妄患者开展的两项随机临床试验,使用系统监测与多学科照料,发现干预组在约束情况、住院时间、死亡率以及受照顾的情况与对照组相比没有显著差异,仅仅在谵妄的严重程度上比对照组低一些。Flaherty等[79]对148例65岁以上的恶性肿瘤患者进行了观察性研究,其中谵妄的患病率为16.2%。给予这些患者使用谵妄专用病房(无约束并提供24小时护理),结果发现使用谵妄专用病房的患者在日常生活功能上有所改善。
(2)药物干预
1)药物干预预防谵妄:
Boogaard等[80]对ICU中有高度谵妄风险的患者预防性给予氟哌啶醇(每8小时给予1mg),结果发现对于高危患者小剂量使用氟哌啶醇是有益的,但该实验需要随机对照研究来进一步确认。我国学者在一项前瞻性、随机、双盲、安慰剂对照的研究中也发现,对于术后ICU患者静脉给予小剂量氟哌啶醇可显著降低术后谵妄的发生率[81]。但目前在肿瘤临床中还没有类似的研究,缺乏相应证据。
2)药物治疗谵妄:
抗精神病药物可以控制恶性肿瘤患者的谵妄症状,但目前FDA尚未批准任何一种药物用于治疗和预防谵妄。有很多研究关注非典型抗精神病药物和典型抗精神病药物治疗谵妄,但是研究人群主要集中于老年患者、围术期及ICU患者,专门针对恶性肿瘤患
[82]者的研究不多。Breitbart等 一项开放性研究,79名住院的晚期恶性肿瘤谵妄患者,给予奥氮平(2.5~5mg,日最高剂量20mg)治疗,76%的患者得到有效缓解,最常见的不良反应是镇静,疗效不佳的主要因素包括年龄大于70岁、痴呆病史以及活动减少型谵妄。Kim等[83]一项开放性研究,对12名恶性肿瘤谵妄患者给予喹硫平治疗(平均剂量93.75mg/d,平均治疗时间5.91天),DRS评分从18.25分降至8分,没有发现帕金森样的不良反应,镇静与生动的梦境是报告的不良反应。
尽管关于抗精神病药物治疗谵妄的研究有很多,但应该注意到这些研究的局限性。表7-4列出了恶性肿瘤患者谵妄的常用药物[84]。当患者过度激越、精神症状突出或者对自身及他人有潜在危险时,应予药物治疗。氟哌啶醇是最常用的抗精神病药物[85],有报道表明,新型抗精神病药物利培酮、奥氮平等对谵妄亦有效[86]。
表7-4 恶性肿瘤患者谵妄的常用药物

续表

po=口服;im=肌内注射;iv=静脉滴注
3.3 推荐意见
3.3.1 短期使用小剂量抗精神病药物治疗恶性肿瘤患者谵妄症状,密切监测可能的不良反应,特别是老年患者。(强烈推荐,高质量证据)
3.3.2 氟哌啶醇是临床和研究经验最多的药物,推荐使用低剂量(0.5~2mg)氟哌啶醇减轻患者的谵妄症状。(强烈推荐,高质量证据)
3.3.3 目前的证据并不支持使用抗精神病药物预防恶性肿瘤患者的谵妄。(弱推荐,中等质量证据)
3.3.4 强烈推荐对于存在谵妄风险的患者提供非药物干预。(强烈推荐,高质量证据)
3.3.5 当患者发生谵妄时,首先要对谵妄进行评估,寻找并纠正可能导致谵妄的原因,如感染、代谢紊乱、恶性肿瘤治疗、相关疾病、疼痛及药物等。(强烈推荐,高质量证据)
3.3.6 环境干预有助于治疗谵妄,减轻患者的焦虑和定向力障碍。(强烈推荐,高质量证据)
3.3.7 保持良好睡眠模式与睡眠节律,监测营养状况,监测感知缺陷,提供视觉和听觉帮助,鼓励活动(尽可能减少使用尿管、静脉输液以及躯体限制),鼓励认知刺激性活动可以预防谵妄。(强烈推荐,高质量证据)
1.Fallowfield LJ, Hall A, Maguire P, et al. Psychological effects of being offered choice of surgery for breast cancer. BMJ, 1994, 309: 448.
2.Kissane DW, Clarke DM, Ikin J, et al. Psychological morbidity and quality of life in Australian women with early-stage breast cancer: a cross-sectional survey. Med J Aust, 1998, 69(4): 192-196.
3.Linden W, Vodermaier A, Mackenzie R, et al Anxiety and depression after cancer diagnosis: prevalence rates by cancer type, gender, and age. J Affect Disord, 2012, 141: 343-351.
4.张金芳,刘淑俊,张继平等.247例恶性肿瘤患者抑郁和焦虑的发病调查.中国肿瘤临床与康复,2002,9(6):56-59.
5.唐丽丽,王建平.心理社会肿瘤学.北京:北京大学医学出版社.2012.
6.郑世利,张红,杨红.恶性肿瘤患者门诊化疗的心理护理.中国肿瘤临床与康复,2015,(08)598-601.
7.李淑芳,王燕,辛士珍,等.化疗对肺癌患者生活质量及焦虑情绪的影响及分析.中国肺癌杂志,2012,(08).
8.Ferrandina G, Mantegna G, Petrillo M, et al. Quality of life and emotional distress in early stage and locally advanced cervical cancer patients: a prospective, longitudinal study. Gynecol Oncol. 2012. 124(3): 389-394.
9.吉米·霍兰.癌症人性的一面.唐丽丽,译.北京:中国国际广播出版社.2007:82-83.
10.Fleishman SB, Lavin MR, Sattler M, et al. Antiemetic-induced akathisia in cancer patients receiving chemotherapy. Am J Psychiatry, 1994, 151(5): 763-765.
11.Schnell FM. Chemotherapy-induced nausea and vomiting: the importance of acute antiemetic control. Oncologist, 2003, 8(2): 187-198.
12.Zigmond AS, Snaith RP. The hospital anxiety and depression scale. Acta Psychiatr Scand. 1983. 67(6): 361-370.
13.Aktas A, Walsh D, Kirkova J. The psychometric properties of cancer multisymptom assessment instruments: a clinical review. Support Care Cancer, 2015, 23(7): 2189-2202.
14.Mitchell AJ. Short screening tools for cancer-related distress: a review and diagnostic validity meta-analysis. J Natl Compr Canc Netw, 2010, 8(4): 487-494.
15.Spitzer RL, Kroenke K, Williams JB, et al. A brief measure for assessing generalized anxiety disorder: the GAD-7. Arch Intern Med, 2006, 166(10): 1092-1097.
16.何筱衍,李春波,钱洁,等.广泛性焦虑量表在综合性医院的信度和效度研究.上海精神医学,2010,(04):200-203.
17.王贝蒂.PHQ-9和GAD-7在恶性肿瘤患者中的应用研究.中南大学公共卫生学院,2013:23.
18.Hamilton M. The assessment of anxiety states by rating. Br J Med Psychol, 1959, 32(1): 50-55.
19.汪向东,王希林,马弘.汉密尔顿焦虑量表.心理卫生评定量表手册.1999.中国心理卫生杂志.253-256.
20.Greer JA, Traeger L, Bemis H, et al. A pilot randomized controlled trial of brief cognitive-behavioral therapy for anxiety in patients with terminal cancer. Oncologist, 2012, 17(10): 1337-1345.
21.Traeger L, Greer JA, Fernandez-Robles C, et al. Evidence-based treatment of anxiety in patients with cancer. J Clin Oncol, 2012, 30(11): 1197-1205.
22.McQuellon RP, Wells M, Hoffman S, et al. Reducing distress in cancer patients with an orientation program. Psycho-Oncology, 1998, 7(3): 207-217.
23.Jacobs C, Ross RD, Walker IM, et al. Behavior of cancer patients: a randomized study of the effects of education and peer support groups. Am J Clin Oncol, 1983, 6(3): 347-353.
24.Moyer A, Sohl SJ, Knapp-Oliver SK, et al. Characteristics and methodological quality of 25 years of research investigating psychosocial interventions for cancer patients. Cancer Treat Rev, 2009, 35(5): 475-484.
25.邹建军,郑莹,许青等.影响恶性肿瘤患者抑郁状况的因素研究.肿瘤,2005,25(2):186-191.
26.Bulfone T, Quattrin R, Zanotti R, et al. Effectiveness of music therapy for anxiety reduction in women with breast cancer in chemotherapy treatment. Holist Nurs Pract, 2009, 23(4): 238-242.
27.Mehnert A, Veers S, Howaldt D, et al. Effects of a physical exercise rehabilitation group program on anxiety, depression, body image, and health-related quality of life among breast cancer patients. Onkologie, 2011, 34(5): 248-253.
28.Schneider SM, Prince-Paul M, Allen MJ, et al. Virtual reality as a distraction intervention for women receiving chemotherapy. Oncol Nurs Forum, 2004, 31(1): 81-88.
29.Stiefel F, Berney A, Mazzocato C. Psychopharmacology in supportive care in cancer: a review for the clinician. I. Benzodiazepines. Support Care Cancer, 1999, 7(6): 379-385.
30.Berney A, Stiefel F, Mazzocato C, et al. Psychopharmacology in supportive care of cancer: a review for the clinician. III. Antidepressants. Support Care Cancer. 2000. 8(4): 278-286.
31.Buclin T, Mazzocato C, Berney A, et al. Psychopharmacology in supportive care of cancer: a review for the clinician. IV. Other psychotropic agents. Support Care Cancer, 2001, 9(4): 213-222.
32.Holland JC, Morrow GR, Schmale A, et al. A randomized clinical trial of alprazolam versus progressive muscle relaxation in cancer patients with anxiety and depressive symptoms. J Clin Oncol, 1991, 9(6): 1004-1011.
33.Wald TG, Kathol RG, Noyes R Jr, et al. Rapid relief of anxiety in cancer patients with both alprazolam and placebo. Psychosomatics, 1993, 34(4): 324-332.
34.Clerico M, Bertetto O, Morandini MP, et al. Antiemetic activity of oral lorazepam in addition to methylprednisolone and metoclopramide in the prophylactic treatment of vomiting induced by cisplatin. A double-blind, placebo-controlled study with crossover design. Tumori, 1993, 79(2): 119-122.
35.Gonzalez BM, Chacon JI, Garcia GC, et al. Antiemetic regimens in outpatients receiving cisplatin and non-cisplatin chemotherapy. A randomized trial comparing high-dose metoclopramide plus methylprednisolone with and without lorazepam. Acta Oncol, 1991, 30(5): 623-627.
36.Holland JC, Romano SJ, Heiligenstein JH, et al. A controlled trial of fluoxetine and desipramine in depressed women with advanced cancer. Psycho-Oncology, 1998, 7(4): 291-300.
37.Razavi D, Allilaire JF, Smith M, et al. The effect of fluoxetine on anxiety and depression symptoms in cancer patients. Acta Psychiatr Scand, 1996, 94(3): 205-210.
38.Musselman DL, Lawson DH, Gumnick JF, et al. Paroxetine for the prevention of depression induced by high-dose interferon alfa. N Engl J Med, 2001, 344(13): 961-966.
39.Musselman DL, Somerset WI, Guo Y, et al. A double-blind, multicenter, parallel-group study of paroxetine, desipramine, or placebo in breast cancer patients( stages Ⅰ, Ⅱ, Ⅲ, and Ⅳ) with major depression. J Clin Psychiatry, 2006, 67(2): 288-296.
40.Stockler MR, O'Connell R, Nowak AK, et al. Effect of sertraline on symptoms and survival in patients with advanced cancer, but without major depression: a placebo-controlled double-blind randomised trial. Lancet Oncol, 2007, 8(7): 603-612.
41.Cankurtaran ES, Ozalp E, Soygur H, et al. Mirtazapine improves sleep and lowers anxiety and depression in cancer patients: superiority over imipramine. Support Care Cancer, 2008, 16(11): 1291-1298.
42.Derogatis LR, Morrow GR, Fetting J, et al. The prevalence of psychiatric disorders among cancer patients. JAMA, 1983, 249(6): 751-757.
43.Chochinov HM, Wilson KG, Enns M, et al. Prevalence of depression in the terminally ill: effects of diagnostic criteria and symptom threshold judgments. Am J Psychiatry, 1994, 151(4): 537-540.
44.Zhao L, Li X, Zhang Z, et al. Prevalence, correlates and recognition of depression in Chinese inpatients with cancer. Gen Hosp Psychiatry, 2014, 36(5): 477-482.
45.Meyer F, Fletcher K, Prigerson HG, et al. Advanced cancer as a risk for major depressive episodes. Psychooncology, 2015, 24(9): 1080-1087.
46.沈渔邨.精神病学(第5版).北京:人民卫生出版社.2008:562.
47.Jacobsen PB, Donovan KA, Weitzner MA. Distinguishing fatigue and depression in patients with cancer. Semin Clin Neuropsychiatry, 2003, 8(4): 229-240.
48.Wakefield CE, Butow PN, Aaronson NA, et al. Patient-reported depression measures in cancer: a meta-review. Lancet Psychiatry, 2015, 2(7): 635-647.
49.Spitzer RL, Kroenke K, Williams JB. Validation and utility of a self-report version of PRIME-MD: the PHQ primary care study. Primary Care Evaluation of Mental Disorders. Patient Health Questionnaire. JAMA, 1999, 282(18): 1737-1744.
50.Meader N, Moe-Byrne T, Llewellyn A, et al. Screening for poststroke major depression: a meta-analysis of diagnostic validity studies. J Neurol Neurosurg Psychiatry, 2014, 85(2): 198-206.
51.Hart SL, Hoyt MA, Diefenbach M, et al. Meta-analysis of efficacy of interventions for elevated depressive symptoms in adults diagnosed with cancer. J Natl Cancer Inst. 2012. 104(13): 990-1004.
52.Laoutidis ZG, Mathiak K. Antidepressants in the treatment of depression/depressive symptoms in cancer patients: a systematic review and meta-analysis. BMC Psychiatry, 2013, 13: 140.
53.Fisch MJ, Loehrer PJ, Kristeller J, et al. Fluoxetine versus placebo in advanced cancer outpatients: a double-blinded trial of the Hoosier Oncology Group. J Clin Oncol, 2003, 21(10): 1937-1943.
54.Morrow GR, Hickok JT, Roscoe JA, et al. Differential effects of paroxetine on fatigue and depression: a randomized, double-blind trial from the University of Rochester Cancer Center Community Clinical Oncology Program. J Clin Oncol, 2003, 21(24): 4635-4641.
55.Cankurtaran ES, Ozalp E, Soygur H, et al. Mirtazapine improves sleep and lowers anxiety and depression in cancer patients: superiority over imipramine. Support Care Cancer, 2008, 16(11): 1291-1298.
56.Kim SW, Shin IS, Kim JM, et al. Effectiveness of mirtazapine for nausea and insomnia in cancer patients with depression. Psychiatry Clin Neurosci, 2008, 62(1): 75-83.
57.Riechelmann RP, Burman D, Tannock IF, et al. Phase II trial of mirtazapine for cancer-related cachexia and anorexia. Am J Hosp Palliat Care, 2010, 27(2): 106-110.
58.Biglia N, Kubatzki F, Sgandurra P, et al. Mirtazapine for the treatment of hot flushes in breast cancer survivors: a prospective pilot trial. Breast J. 2007. 13(5): 490-495.
59.Bruera E, Neumann CM. The uses of psychotropics in symptom management in advanced cancer. Psychooncology, 1998, 7(4): 346-358.
60.Joshi N, Breibart WS. Psychopharmacologic management during cancer treatment. Semin Clin Neuropsychiatry, 2003, 8(4): 241-252.
61.Mazzocato C, Stiefel F, Buclin T, et al. Psychopharmacology in supportive care of cancer: a review for the clinician: Ⅱ. Neuroleptics. Support Care Cancer, 2000, 8(2): 89-97.
62.洪晔,王建平,梅艳丽,等.集体心理干预改善乳腺癌患者的生活质量.中国心理卫生杂志,2010,(12):903-907.
63.李金江,庞英,唐丽丽.团体心理治疗改善肺癌患者生活质量及情绪状态的开放对照研究.中国心理卫生杂志,2014,(09)657-662.
64.王亚朋,庞英,唐丽丽.团体心理治疗对胃癌患者生活质量及情绪状况的效果.中国心理卫生杂志,2013,(07).490-495
65.易鸣,庞英,唐丽丽.早中期结直肠癌患者情绪及生活质量的10周团体心理治疗.中国心理卫生杂志,2015,(07).491-496
66.Fann JR SAK. Delirium in the course of cancer treatment. Semin Clin Neuropsychiatry, 2003, 8(4): 217-228.
67.Centeno C, Sanz A, Bruera E. Delirium in advanced cancer patients. Palliat Med, 2004, 18(3): 184-194.
68.Folstein MF, Folstein SE, McHugh PR. "Mini-mental state". A practical method for grading the cognitive state of patients for the clinician. J Psychiatr Res, 1975, 12(3): 189-198.
69.梅伟,刘尚昆,张治国等.中文版护理谵妄筛查量表的信度和效度研究.中华护理杂志,2010,45(2).101-104
70.Trzepacz PT, Baker RW, Greenhouse J. A symptom rating scale for delirium. Psychiatry Res, 1988, 23(1): 89-97.
71.Rosen J, Sweet RA, Mulsant BH, et al. The Delirium Rating Scale in a psychogeriatric inpatient setting. J Neuropsychiatry Clin Neurosci, 1994, 6(1): 30-35.
72.Sands MB, Dantoc BP, Hartshorn A, et al. Single Question in Delirium( SQiD): testing its efficacy against psychiatrist interview, the Confusion Assessment Method and the Memorial Delirium Assessment Scale. Palliat Med, 2010, 24(6): 561-565.
73.Inouye SK, Bogardus ST Jr, Charpentier PA, et al. A multicomponent intervention to prevent delirium in hospitalized older patients. N Engl J Med, 1999, 340(9): 669-676.
74.Hshieh TT, Yue J, Oh E, et al. Effectiveness of multicomponent nonpharmacological delirium interventions: a meta-analysis. JAMA Intern Med, 2015, 175(4): 512-520.
75.Gagnon P, Allard P, Gagnon B, et al. Delirium prevention in terminal cancer: assessment of a multicomponent intervention. Psychooncology, 2012, 21(2): 187-194.
76.Guo Y, Sun L, Li L, et al. Impact of multicomponent, nonpharmacologic interventions on perioperative cortisol and melatonin levels and postoperative delirium in elderly oral cancer patients. Arch Gerontol Geriatr, 2016, 62: 112-117.
77.Cole MG, McCusker J, Bellavance F, et al. Systematic detection and multidisciplinary care of delirium in older medical inpatients: a randomized trial. CMAJ, 2002, 167(7): 753-759.
78.Cole MG, Primeau FJ, Bailey RF, et al. Systematic intervention for elderly inpatients with delirium: a randomized trial. CMAJ, 1994, 151(7): 965-970.
79.Flaherty JH, Steele DK, Chibnall JT, et al. An ACE unit with a delirium room may improve function and equalize length of stay among older delirious medical inpatients. J Gerontol A Biol Sci Med Sci, 2010, 65(12): 1387-1392.
80.Van Den, Boogaard M, Schoonhoven L, et al. Haloperidol prophylaxis in critically ill patients with a high risk for delirium. Crit Care, 2013, 17(1): 9.
81.Wang W, Li HL, Wang DX, et al. Haloperidol prophylaxis decreases delirium incidence in elderly patients after noncardiac surgery: a randomized controlled trial. Crit Care Med, 2012, 40(3): 731-739.
82.Breitbart W, Tremblay A, Gibson C. An open trial of olanzapine for the treatment of delirium in hospitalized cancer patients. Psychosomatics, 2002, 43(3): 175-182.
83.Kim KY, Bader GM, Kotlyar V, et al. Treatment of delirium in older adults with quetiapine. J Geriatr Psychiatry Neurol, 2003, 16(1): 29-31.
84.Gleason OC. Delirium. Am Fam Physician, 2003, 67(5): 1027-1034.
85.Akechi T, Uchitomi Y, Okamura H, et al. Usage of haloperidol for delirium in cancer patients. Support Care Cancer, 1996, 4(5): 390-392.
86.Kim SW, Yoo JA, Lee SY, et al. Risperidone versus olanzapine for the treatment of delirium. Hum Psychopharmacol, 2010, 25(4): 298-302.