 去看看
去看看


1胰腺癌的MDT诊疗模式
胰腺癌的MDT诊疗模式a

【注释】
a. 胰腺癌诊疗应高度重视MDT的作用,推荐有条件的单位将尽可能多的胰腺癌患者进行MDT。MDT实施过程中由多个学科专家共同分析患者的临床症状、体征、影像、病理、分子检测等资料,对患者的体能状态、疾病诊断、分期、侵犯范围、发展趋向和预后等作出全面的评估,并根据国内外治疗规范/指南/循证医学证据,结合现有的治疗手段,制定科学、合理的诊疗计划,积极应用手术、化疗、放疗、介入以及分子靶向药物等手段进行综合治疗,以期达到治愈或控制肿瘤,延长生存期和提高生活质量的目的。
胰腺癌患者常具有以下特点:①胰腺具有外分泌和内分泌两方面的重要功能,因此胰腺癌患者80%具有营养不良、消化和吸收障碍,以及血糖调节异常;②胰腺癌具有嗜神经性,患者常出现疼痛;③胰腺癌常同时伴有HBV感染和/或胆道感染病史。因此,在MDT过程中,应同样重视营养科、内分泌科、疼痛科和消化科的参与。
b. 考虑到胰腺癌手术的复杂性,建议胰腺癌的首次诊断和手术治疗应在一定规模的胰腺癌诊治中心进行(胰腺癌手术量至少20台/年)。
c. 胰腺癌放疗的要求技术含量高、提高剂量放疗可以获得局控率和生存率改善[1.2] ,建议胰腺癌放疗在有高质量影像诊断技术、图像引导调强放疗系统或立体定向放射治疗技术的放疗中心进行。
2胰腺癌的诊断原则
2.1 胰腺癌的诊疗总则
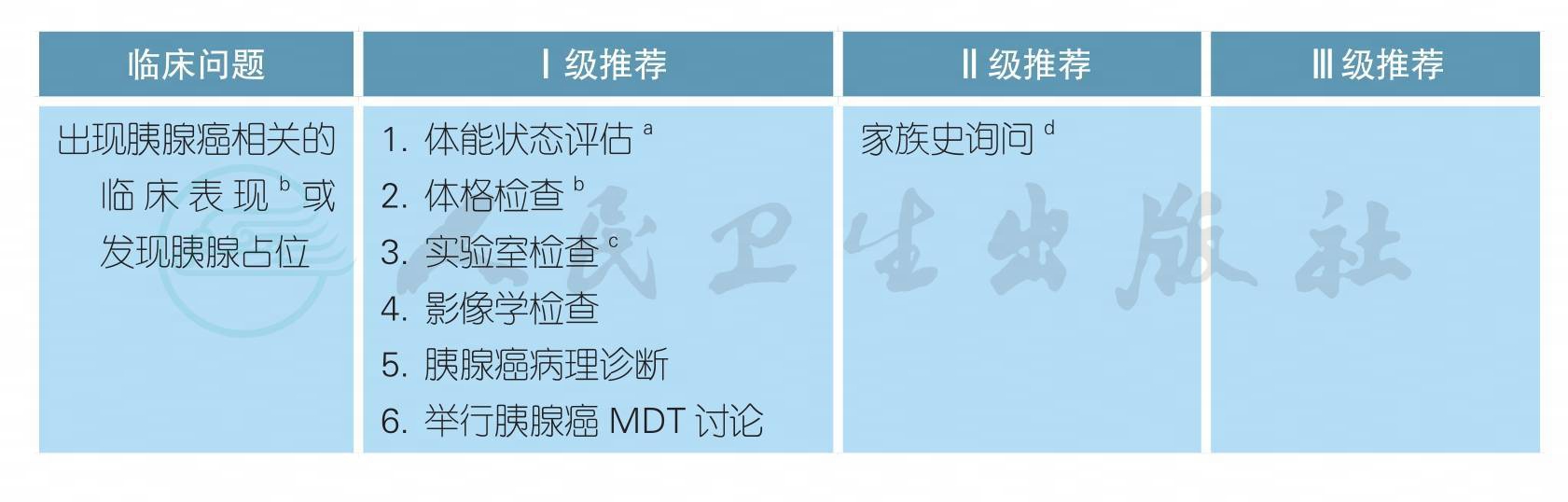
【注释】
a. 胰腺癌有别于其他肿瘤,体能状况评估尤为重要,决定了整个治疗策略的制定。全面体能状态评估应该包括体能状态评分(performance status,PS)、疼痛、胆道梗阻和营养状况四个方面。体能状态良好标准如下:①ECOG评分≤2分;②疼痛控制良好,疼痛数字分级法(NRS)评估值≤3;③胆道通畅;④体重稳定。
b. 多数胰腺癌患者起病隐匿,可表现为上腹部不适、隐痛、消化不良或腹泻,需与其他消化系统疾病鉴别诊断。在体格检查方面,一般无明显体征,当疾病处于进展期时,可出现黄疸、肝脏增大、胆囊肿大、上腹部肿块以及腹腔积液等阳性体征。
c. 实验室检查:①肿瘤标志物检查:与胰腺癌诊断相关肿瘤标志物有糖类抗原CA 19-9、癌胚抗原CEA、糖类抗原CA 125等。其中CA 19-9是胰腺癌患者最重要的肿瘤标志物(见附-2)。②生化检查:关注肝功能的变化,特别是肿瘤阻塞胆管时。
d. 如果被诊断为胰腺癌,对于那些年轻患者应详细询问家族史,必要时进行遗传筛查。
2.1.1 胰腺癌相关影像学诊断a
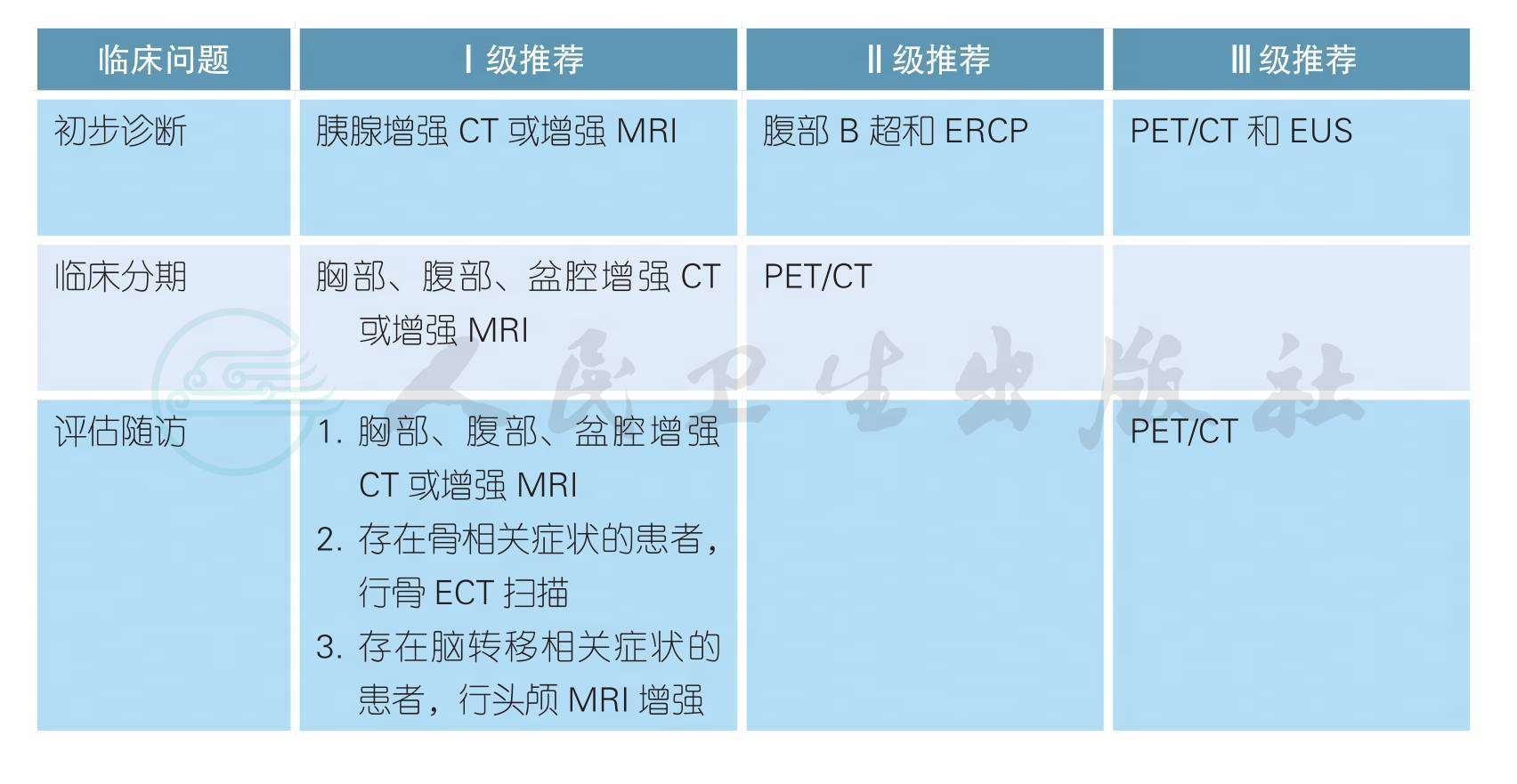
【注释】
a. 影像学主要用于胰腺癌的初步诊断、术前分期和评估随访。协助诊断胰腺癌的医学影像学技术和手段较多,包括B超、CT、MRI、ERCP、PET/CT和EUS等,其特点各不相同。由于各种检查技术的特点不同,选择时应遵循“完整(显示整个胰腺)、精细(层厚2~3mm的薄层扫描)、动态(动态增强、定期随访)、立体(多轴面重建,全面了解毗邻关系)”的基本原则。不推荐PET/CT作为胰腺癌诊断的常规检查手段,对疑似有远处转移而高质量的CT/MRI 检查仍无法确诊的患者,推荐进行PET/CT扫描检查。如果影像学和多学科讨论难以初步诊断或分期的患者,可考虑EUS-FNA、腹腔镜或开放手术探查。根据影像学可初步分为:可切除胰腺癌、临界可切除胰腺癌、局部晚期胰腺癌和转移性胰腺癌。
2.1.2 胰腺癌病理学诊断

【注释】
a. 组织病理学和/或细胞学是确诊胰腺癌的唯一依据,应尽可能在抗肿瘤治疗前获得病理学检查结果。考虑临床实际情况,有时无法获得组织病理学或细胞学依据,可结合病史、临床表现、实验室检查和影像学检查,由MDT讨论后慎重作出临床初步诊断。如MDT不能作出一致性诊断时,建议动态观察,严密随访复查。
b. 获取组织病理学和/或细胞学诊断的方法:①手术活检:是获取组织病理学诊断的可靠方法;②穿刺活检术:对无法手术获得组织的患者,建议影像引导下经皮穿刺或超声内镜引导下穿刺,获得组织病理学或细胞学标本。对有转移病灶的患者,原发病灶获取和诊断困难,推荐对转移病灶活检;③脱落细胞学检查:通过胰管细胞刷检、胰液收集检查、体腔积液化验等方法获得细胞病理资料。
c. 鉴于胰腺癌患者获得标本困难,临床医生应与病理科医生讨论确定标准操作流程,以提高检测阳性率。推荐流程:所有标本应及时固定(离体30min内固定最佳),使用新鲜的3.7%中性缓冲甲醛固定液,固定液的量应为组织的10倍,固定8~48h。标本需完整送检,手术外科医生做好淋巴结的分组。
d. 拟行R0手术的患者,只要诊断依据(临床、实验室检查、影像学表现)充分,不需先获得病理学诊断支持。
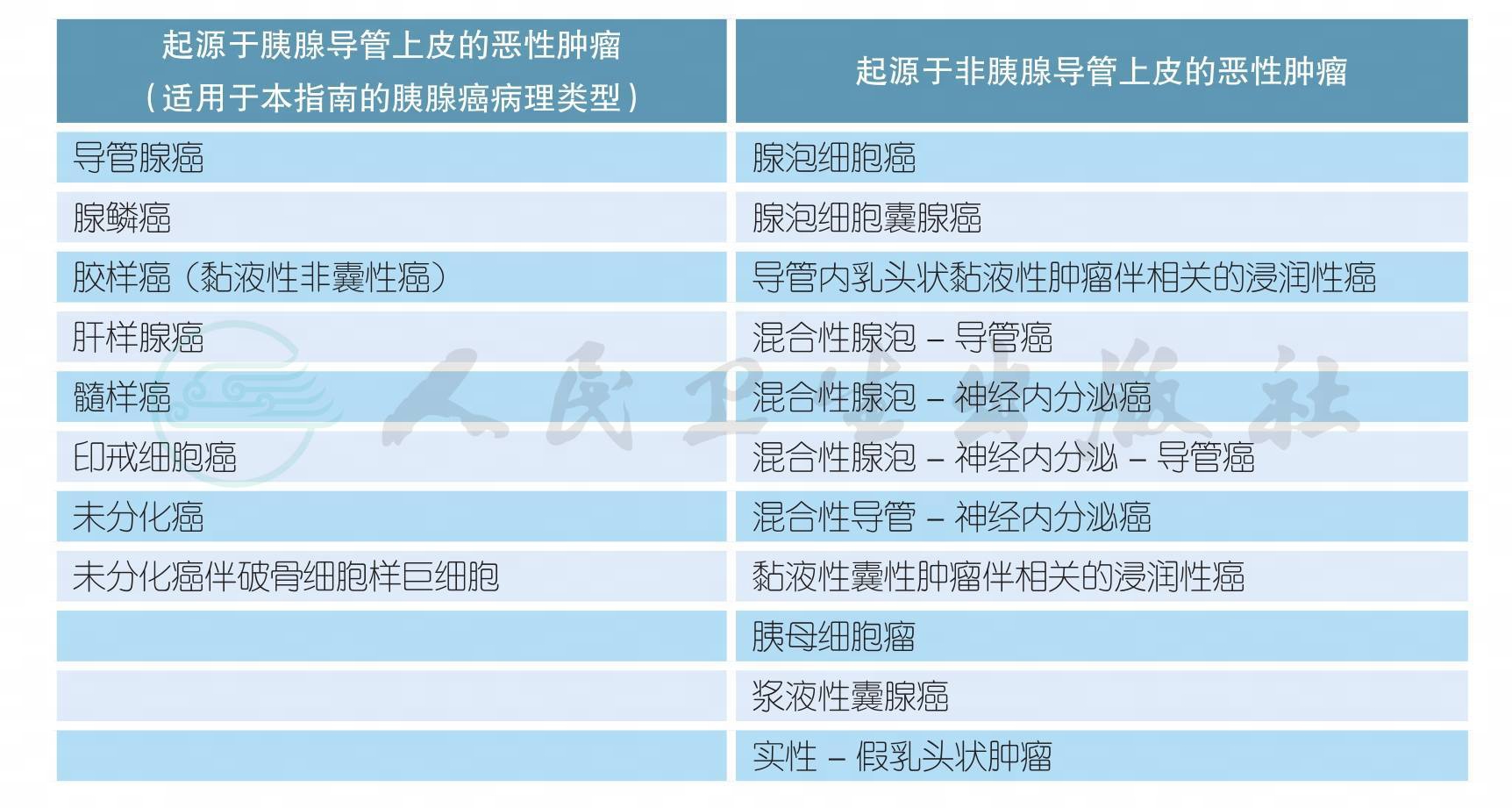
e. 胰腺癌组织学分型参考WHO消化系统肿瘤分类2010版,详见附录1。本《指南》仅适用于胰腺实质外分泌细胞起源的胰腺导管上皮腺癌,不包括神经内分泌肿瘤、淋巴瘤、转移瘤等恶性肿瘤和实性假乳头状瘤、囊腺瘤、IPMN等良性/或潜在恶性肿瘤。
f. TNM病理分期(pTNM)采用AJCC/UICC第8版,详细参见附录2。TNM前加前缀c、p、m、r和y分别代表临床、组织病理学、多发性原发肿瘤、复发性肿瘤和治疗后肿瘤的TNM分期。
g. 胰腺癌能否达到R0切除是影响胰腺癌预后的重要因素,国内外学界达成共识,切缘肿瘤侵犯采用欧洲标准即“1mm 原则”为判断R0 切除或R1 切除的标准,切缘1mm以上无肿瘤细胞方为R0切除,否则为R1切除。胰腺癌切缘详见附录3。
2.2 附录
2.2.1 附录1 胰腺癌WHO组织学分型(2010年第4版)
2.2.2 附录2 胰腺癌病理分期
本指南采用UICC/AJCC TNM分期系统(2017年第8版)[1],详细内容如下:
T、N、M的定义
T-原发肿瘤
Tx 原发肿瘤无法评价
T0 无原发肿瘤证据
Tis 原位癌(包括高级别的胰腺上皮内瘤变(PanIN-3)导管内乳头状黏液性肿瘤伴高度异型增生、 导管内管状乳头状肿瘤伴高度异型增生和胰腺黏液性囊性肿瘤伴高度异型增生)
T1 肿瘤最大径≤2 cm
T1a 肿瘤最大径≤ 0.5cm
T1b 肿瘤最大直径>0.5cm且<1cm
T1c 肿瘤最大直径≥1cm且≤2cm
T2 肿瘤最大径2cm<最大径≤4cm
T3 肿瘤最大径>4cm
T4 肿瘤不论大小,侵及腹腔干、肠系膜上动脉、和/或肝总动脉
N-区域淋巴结
Nx 区域淋巴结无法评估
N0 无区域淋巴结转移
N1 1~3个区域淋巴结转移
N2 ≥4个区域淋巴结转移
M-远处转移
M0 无远处转移
M1 有远处转移
病理分期
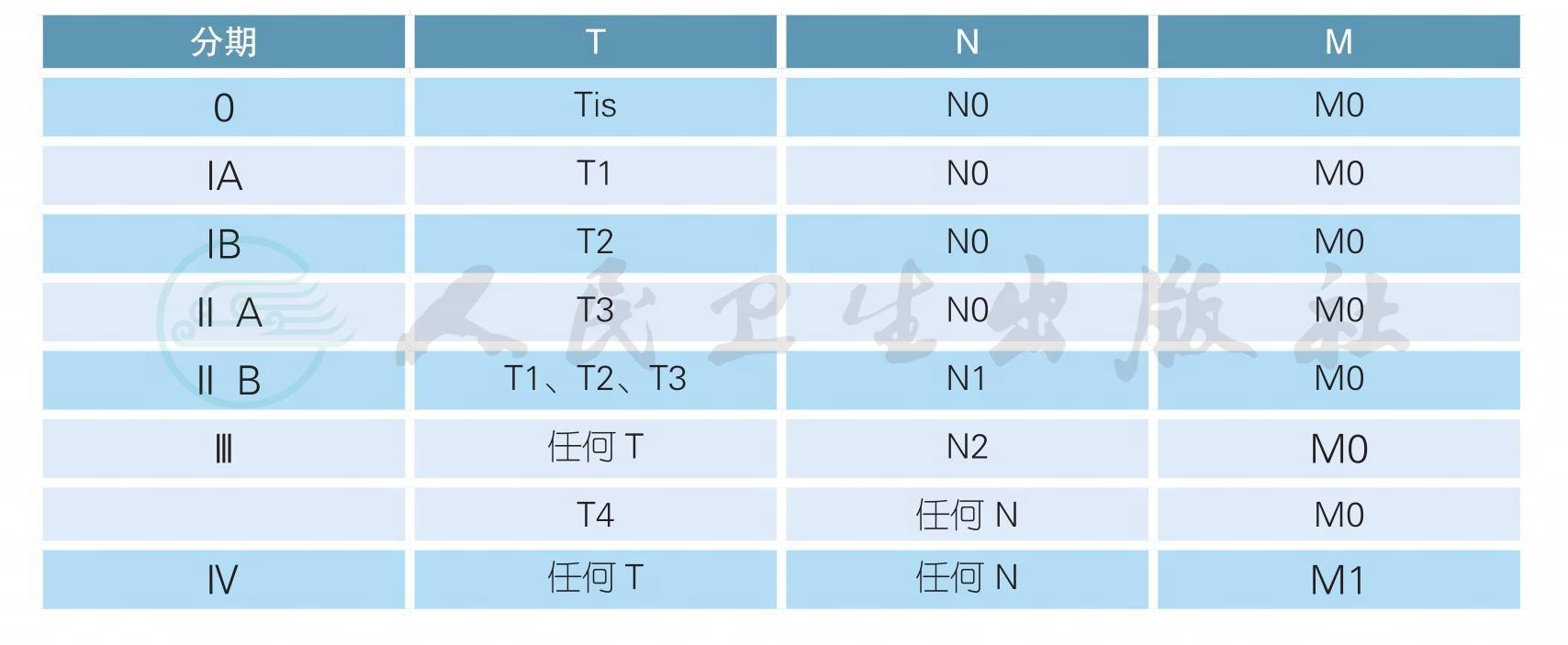
2.2.2 附录2 胰腺癌病理分期
1. Allen PJ,Kuk D,Castillo CF,et al. Multi-institutional Validation Study of the American Joint Commission on Cancer(8th Edition)Changes for T and N Staging in Patients with Pancreatic Adenocarcinoma [J]. Annals of Surgery. 265(1):185-191,JAN 2017.
2.2.3 附录3 胰腺癌切缘

3胰腺癌的治疗原则
3.1 可切除胰腺癌的治疗原则
3.1.1 可切除胰腺癌的外科治疗原则a

【注释】
a. 手术目的是实施R0切除术[1]。切缘的相关定义详见2.1.2胰腺癌病理学诊断。根据综合诊治的原则,术前应该进行MDT讨论,充分评估R0切除的可能性,明确肿瘤是否有远处转移和合并症(基线评估)。
b. 针对胰体尾癌的腹腔镜胰体尾切除在技术上是安全可行的,但是否可达到与开腹手术一样的肿瘤R0切除效果,仍存争议。现有的小样本前瞻性研究和回顾性分析显示,腹腔镜远端胰腺切除并发症少、术后恢复快,但仍需大样本、前瞻性、随机、对照研究[2-4]。
c. 扩大区域淋巴结清扫不能改善患者的预后,不常规推荐[5]。
d. 对于可手术切除局限性胰腺癌,因医学原因、患者自身意愿或高龄等原因,不能耐受或不适合手术切除。
e. 体能状态良好的患者,可采用以放疗为主的综合治疗,通过提高局控率转化为生存率,可获长期生存机会[6-7]。推荐采用图像引导IMRT或SBRT技术,仅照射原发灶和转移淋巴结,不做相邻区域淋巴结预防照射,剂量模式根据设备技术和可选范围40Gy~70Gy/5~30次。
3.1.2 可切除胰腺癌的辅助治疗原则

【注释】
a. 明确可切除的胰腺癌患者,新辅助化疗不常规推荐,仅在临床研究中推荐。但对于有高危因素的患者(非常高的CA19-9、肿瘤原发灶巨大、巨大的区域淋巴结转移、严重的体重丢失和极度疼痛)可考虑行新辅助治疗,但化疗前需明确细胞学或病理学诊断。新辅助化疗可降低肿瘤分期,同时也是对肿瘤生物学行为的筛选。应进一步组织前瞻性、多中心、随机对照临床研究。
b. 术后辅助放疗尚存争议[1-4],尚缺乏高级别的循证医学依据,建议积极参与临床试验。与单独化疗相比,在体能状态良好和R1切除的患者,采用辅助性放化疗可能改善预后肿瘤局部复发率。
3.1.2.1 可切除胰腺癌的辅助化疗a
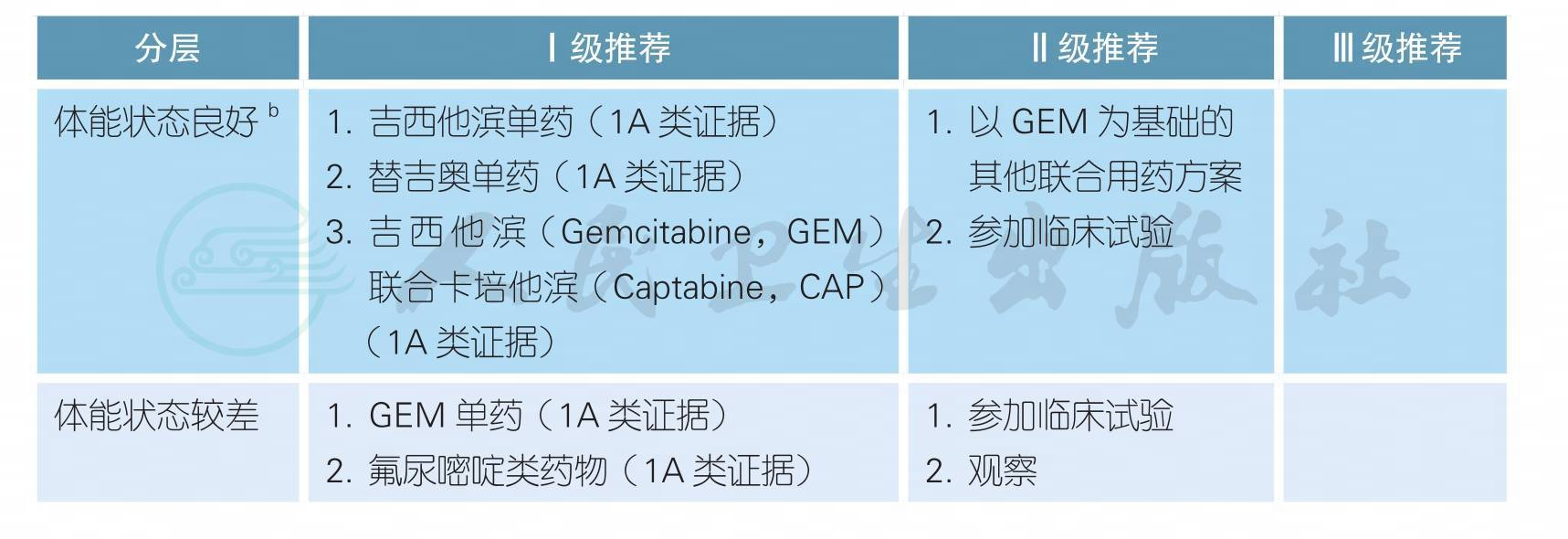
【注释】
a. 与单纯手术相比,术后辅助化疗具有明确的疗效,可以防止或延缓肿瘤复发,提高术后长期生存率,因此,积极推荐术后实施辅助化疗。
b. 术后辅助化疗方案推荐GEM单药或氟尿嘧啶类药物(包括替吉奥、卡培他滨以及5-FU/LV)治疗(附录4);对于体能状态良好的患者,可以考虑联合化疗(附录4)。此处体能状态良好标准同前(见2.1胰腺癌的诊疗总则)。
3.1.2.2 可切除胰腺癌的辅助放疗a

【注释】
a. 辅助放疗的治疗体积应基于手术前CT扫描结果或手术置入的银夹来确定。标准放疗体积CTV应包括原发肿瘤床和区域高危淋巴结区。对残端阳性部位建议适度提高剂量。
b. 随机对照研究显示,放化疗在欧美的研究结果有差异,国内研究证据级别相对较低,因此缺乏足够的循证医学证据,建议开展多中心临床研究。
3.1.2.3 附录
附录4 胰腺癌辅助化疗方案
GEM单药方案[1]
GEM 1000mg/m2静脉输注超过30min d1 qw×7,休1周
此后qw×3,休1周,给药至6个月
可调整GEM单药方案
GEM1000mg/m2静脉输注超过30min d1、8,每3周重复,给药至6个月
替吉奥单药方案[2]
替吉奥80mg/日口服 d1-28,每6周重复,给药至6个月
可调整替吉奥单药方案
替吉奥60~120mg/日口服 d1-14,每3周重复,给药至6个月
氟尿嘧啶单药方案[3]
5-FU 425mg/m2静脉输注 d1-5
LV 20mg/m2静脉输注 d1-5
每4周重复给药,至6周期
可调整氟尿嘧啶单药方案
LV 400 mg/m2静脉输注 2h,d1
5-FU 400 mg/m2静冲 d1 然后2400 mg/m2,持续静脉输注46h
每2周重复,给药至6个月
GEM联合CAP方案[4]
GEM1000mg/m2静脉输注超过30min d1、8、15,每4周重复,共6个周期
CAP1660mg/m2/日,口服,d1-21,每4周重复,共6个周期
可调整GEM联合CAP方案
GEM 1000mg/m2,静脉输注超过30min d1、8,每3周重复,共 6~8 个周期
卡培他滨825~1000mg/m2,口服,一日两次,d1-14,每3周重复,共6~8 个周期
3.2 临界可切除胰腺癌的治疗原则a

【注释】
a. 临界可切除胰腺癌定义:①肿瘤无远处转移;②肠系膜上静脉-门静脉系统肿瘤侵犯有节段性狭窄、扭曲或闭塞,但切除后可安全重建;③胃十二指肠动脉侵犯达肝动脉水平,但未累及腹腔干;④肿瘤侵犯肠系膜上动脉未超过周径的180度。
b. 对于临界可切除的胰腺癌诊疗,缺乏大型临床研究数据,因此建议开展多中心临床研究。
c. 最佳支持治疗应贯穿胰腺癌治疗的整个过程中。对体能状态差,无法耐受手术、放疗和化疗的患者,建议仅行最佳支持治疗(见附-1)。
d. 对于胰头部临界可切除胰腺癌,患者可能存在黄疸,在接受新辅助化疗等治疗前,建议行介入治疗(放置支架等)解除黄疸。
e. 对于临界可切除的胰腺癌新辅助化疗、放化疗可能提高R0切除率,并可改善患者生存[1-2],但缺乏高级别的循证医学依据,且方案选择尚无标准,建议开展临床研究。对体能状况良好患者,推荐采用联合化疗(客观有效率较高)的方案进行术前治疗(附录5),降期后再行手术切除。新辅助化疗一般推荐2~4周期,根据密切复查结果,进行调整。通过新辅助治疗不能手术切除者或不能耐受的患者,即采用晚期胰腺癌的一线化疗方案(见附录9),不能耐受或不愿接受全身化疗的患者,可行选择性的动脉灌注化疗。
f. 外科手术治疗:联合静脉切除如能达到R0 切除,则患者的预后与静脉未受累及的患者相当,联合动脉切除不能改善患者的预后 [6]
g. 新辅助放化疗的联合方案尚无标准,可采用氟尿嘧啶类 [3]或GEM方案放疗[5],或诱导化疗有效后采用含5-FU 或含GEM方案的同步放化疗[6]。对以动脉血管受侵明显的局限性胰腺癌,新辅助放化疗难以转化为手术切除者,推荐采用放疗策略 [6]。放射疗治疗的照射剂量和范围,详见3.3 局部进展期胰腺癌的治疗原则。
h. 诱导治疗4~6周期,疾病控制后,可行不可逆电穿孔消融治疗(详见附录7)。
3.2.1 附录
附录5 新辅助化疗方案
FOLFIRINOX 方案[1]
奥沙利铂85mg/m2静脉输注2h,d1
伊立替康180mg/m2静脉输注大于30~90min,d1
LV 400mg/m2静脉输注2h,d1
5-FU 400mg/m2静冲 d1 然后2400mg/m2,持续静脉输注46h
每2周重复
可调整FOLFIRINOX方案[2]
奥沙利铂68mg/m2静脉输注2h,d1
伊立替康135mg/m2静脉输注大于30~90min,d1
LV 400mg/m2静脉输注2h,d1
5-FU 2400mg/m2,持续静脉输注46h
每2周重复
GEM+白蛋白结合型紫杉醇方案[3]
白蛋白结合型紫杉醇125mg/m2静脉输注,d1、8、15
GEM 1000mg/m2静脉输注大于30min,d1、8、15
每4周重复1次
可调整GEM+白蛋白结合型紫杉醇方案
白蛋白结合型紫杉醇125mg/m2静脉输注,d1、8
GEM 1000mg/m2静脉输注大于30min,d1、8
每3周重复1次
GEM联合替吉奥方案[4]
GEM 1000mg/m2,静脉输注超过30min d1、8
替吉奥60~100mg/d,口服,一日两次,d1-14
每3周重复
可调整GEM联合替吉奥方案
GEM 1000mg/m2,静脉输注超过30min d1、8
替吉奥 40~60mg/d,口服,一日两次,d1-14,
每3周重复
3.3 局部进展期胰腺癌的治疗原则a

【注释】
a. 局部进展期胰腺癌:①肿瘤无远处转移;②肠系膜上静脉-门静脉系统肿瘤侵犯有节段性狭窄、扭曲或闭塞,但切除后可安全重建;③胃十二指肠动脉侵犯达肝动脉水平,但未累及腹腔干;④肿瘤侵犯肠系膜上动脉未超过周径的180度。
b. 局部晚期胰腺癌预后差,且没有客观有效率高的治疗方案,因此建议参加临床试验。
c. 最佳支持治疗应贯穿胰腺癌治疗的整个过程中(详见附-1)。
d. 晚期姑息化疗详见转移性胰腺癌治疗原则。
e. 转化化疗方案详见附录5新辅助化疗常用方案。
f. 对于全身状况良好的局部晚期胰腺癌,采用常规剂量放疗同步化疗[1]或序贯放化疗[2,3]可缓解症状和改善患者生存期[4]。高剂量放疗较常规剂量放疗提高局部控制率,可延长患者总生存时间[5]。高剂量少分次放疗采用IMRT或SBRT 推荐仅照射原发肿瘤和转移淋巴结,不包括高危淋巴结引流区,详见附录6。
g. 介入治疗详见临界可切除胰腺癌治疗原则。
h. 中医药详见附录8。
i. 对于转化治疗有效且体能状态良好的患者,可参照3.2 临界可切除胰腺癌的治疗原则。对于转化治疗后,仍不能切除或体能状态较差的患者,转入晚期姑息治疗。
j. 诱导治疗4~6周期,疾病控制后,可行不可逆电穿孔消融治疗(详见附录7)。
k. 对于不耐受放化疗的局部晚期胰腺癌患者,推荐可通过照射原发灶或转移灶,实施缓解梗阻、压迫或疼痛为目的的减症治疗,以提高患者生存质量。
3.3.1 附录
附录6 同步放化疗或序贯放化疗方案
(1)同步放化疗中常规放疗总量为50~54Gy,每次剂量为1.8~2.0Gy[1]。高剂量少分次放疗采用IMRT或SBRT尚无统一剂量模式标准,目前剂量模式根据设备技术可选范围为4~70Gy/5~30f不等[2-11]。
(2)化疗方案单药可采用GEM或氟尿嘧啶类(5-FU持续静脉滴注,或卡培他滨,或替吉奥),多药联合可采用GEM或氟尿嘧啶类为基础的方案[12,13]。
(3)术中放疗(IORT)通常在剖腹探查术中发现肿瘤无法切除或术中肿瘤切缘较近或切缘阳性时采用[9]。剖腹探查时,术中无法彻底切除或无法手术切除者,有术中照射设备的单位建议术中电子线照射放疗15~20Gy,术后(1个月内)补充外照射(EBRT)30Gy/10f或40Gy/20f。
附录7 不可逆电穿孔消融治疗
不可逆电穿孔(纳米刀)治疗是一种全新的肿瘤消融技术,它通过释放高压脉冲在肿瘤细胞上形成纳米级永久性穿孔,破坏细胞内平衡,使细胞快速凋亡,特点:①消融具有选择性:只破肿瘤细胞,不伤及血管壁、神经、气管和支气管、胆管、肠管、输尿管,消融区界限清楚;②消融不产生热量,不受邻近的大血管血流所影响;③导致细胞凋亡;④激发抗肿瘤免疫反应;⑤治疗时间极短;⑥消融过程可在超声、CT或MRI上清楚显示。2012年FDA批准用于肿瘤消融治疗,2015年6月CFDA批准用于临床,适用于肝肿瘤和胰腺肿瘤的消融,主要适用于局部晚期胰腺癌[1,2]。对于局部晚期胰腺癌或经新辅助化疗后仍不能切除的临界可切除胰腺癌患者,经过4-6周期诱导化疗(吉西他滨为基础的单药或联合化疗方案、或FOLFIRINOX方案)仍稳定的患者,可使用不可逆电穿孔消融治疗。
附录8 中医中药治疗
中医中药治疗可贯穿胰腺癌诊疗整个过程中,是胰腺癌综合治疗的方法之一,与西医药相比,并非着眼于直接杀灭癌细胞,而是注重于“扶正”调理。中医药有助于增强机体免疫功能,与放、化疗联合提高协同抗癌能力,降低放、化疗的毒性,改善临床症状,提高患者生活质量,并有可能延长生存期,可以作为胰腺癌的重要辅助治疗手段;对于失去手术机会或无法放、化疗的患者中医药可以作为主要手段发挥扶正抗癌作用。
近期在美国开展的一项Ⅱ期临床研究显示,康莱特联合吉西他滨较吉西他滨单药可显著延长胰腺癌患者PFS和OS(ⅡB类证据)[1]。另外,华蟾素、消癌平等,对于胰腺癌有一定控制进展、减轻患者症状和改善生活质量的作用,可以酌情选择使用,但是这些药物治疗胰腺癌循证医学证据不多,尚缺乏高级别的证据加以支持,需要临床上进一步观察和研究,从而为中医药规范治疗胰腺癌提供客观依据。
3.4 转移性胰腺癌的治疗原则a

【注释】
a. 转移性胰腺癌治疗目的和原则:①对于转移性胰腺癌,以化学治疗为基础的综合治疗有利于减轻症状、延长生存期和提高生活质量;②对于寡转移胰腺癌,以化疗为基础,放疗对病灶选择性治疗的综合治疗更有利减症、提高局控和延长生存。
b. 一线化疗方案的选择应根据患者体能状态进行选择,对于体能状态良好的患者可考虑联合方案,体能状态较差患者选择单药化疗或最佳支持治疗(详见附录9和附-1)。胰腺癌的总体治疗效果较差,本指南推荐开展多中心临床研究,以延长患者生存期和发现新的有效药物。
c. 对于一线化疗后体能状态仍能耐受化疗的患者,推荐二线化疗。
d. 二线化疗后,无循证医学证据表明多线化疗可延长生存,也无明确的有效药物,但对体能状态良好患者,可将一线未使用药物用于后线治疗(详见附录9)。
e. 对于伴有肝转移、肺转移等的患者,可在全身肿瘤控制良好的情况下,对转移灶和原发灶选择性的进行动脉栓塞化疗、射频消融等介入治疗。
f. 对于远处转移(转移灶数目及器官有限)的胰腺癌患者,可通过照射原发灶或转移灶,实施缓解梗阻、压迫或疼痛以及提高肿瘤局部控制为目的的放射治疗[1]。仅照射原发灶及引起症状的转移病灶,照射剂量根据病变大小、位置及耐受程度判定给予常规剂量或高剂量。
3.4.1 转移性胰腺癌的一线治疗
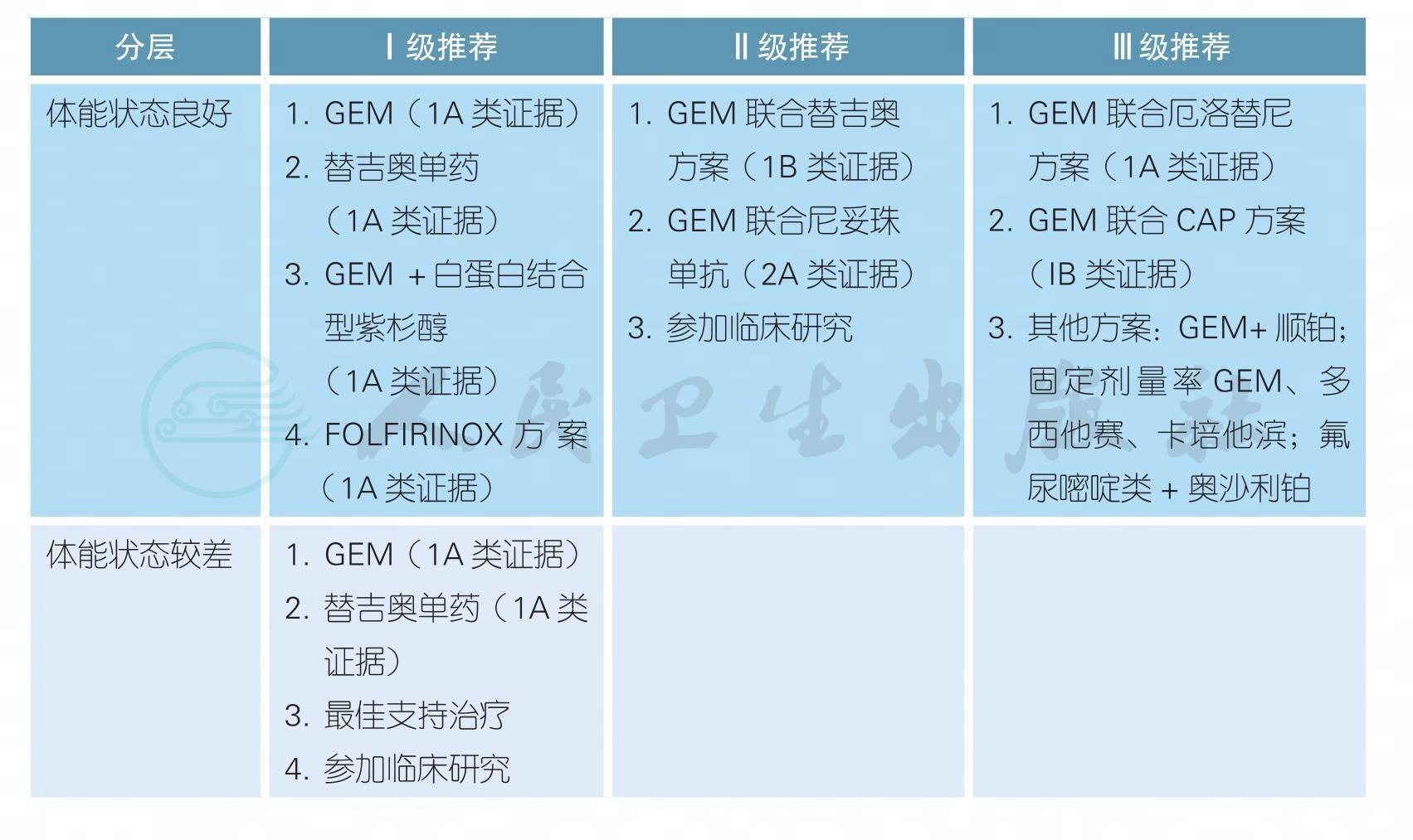
3.4.2 转性胰腺癌的二线治疗

3.4.3 附录
附录9 一线化疗方案
GEM+白蛋白结合型紫杉醇方案a
白蛋白结合型紫杉醇125mg/m2静脉输注,d1、8、15
GEM 1000 mg/m2静脉输注大于30min,d1、8、15
每4周重复1次
可调整GEM+白蛋白结合型紫杉醇方案
白蛋白结合型紫杉醇125mg/m2静脉输注,d1、8
GEM 1000 mg/m2静脉输注大于30min,d1、8
每3周重复1次
FOLFIRINOX方案b
奥沙利铂85mg/m2 静脉输注2h,d1
伊立替康180mg/m2 静脉输注大于30-90min,d1
LV 400mg/m2静脉输注2h,d1
5-FU 400mg/m2 静冲 d1 然后2400mg/m2,持续静脉输注46h
每2周重复
GEM联合替吉奥方案c
GEM 1000mg/m2,静脉输注超过30min d1、8
替吉奥 60~100mg/d,口服,一日两次,d1-14
每3周重复
可调整GEM联合替吉奥方案
GEM 1000mg/m2,静脉输注超过30min d1、8
替吉奥 40~60mg/d,口服,一日两次,d1-14
每3周重复
GEM联合厄洛替尼方案d
GEM 1000mg/m2 静脉输注超过30min d1 qw×7,休1周,此后qw×3,休1周
厄洛替尼 100或150mg/d 口服 每日
可调整GEM联合厄洛替尼方案
GEM 1000mg/m2,静脉输注超过30min d1、8 ,每三周重复
厄洛替尼 100mg/d 口服 每日
GEM联合尼妥珠单抗方案e
GEM 1000mg/m2,静脉输注超过30min d1、8 、15,每4周重复
尼妥珠单抗 400mg,静脉输注30min qw
可调整GEM联合尼妥珠单抗方案
GEM 1000mg/m2,静脉输注超过30min d1、8,每3周重复
尼妥珠单抗 400mg,静脉输注30min qw
GEM联合CAP方案f
GEM1000mg/m2 静脉输注超过30min d1、8、15
CAP1660mg/m2/日,口服,d1-21
每4周重复
可调整GEM联合CAP方案
GEM1000mg/m2 静脉输注超过30min d1、8
CAP825-1000mg/m2/日,口服,一日两次,d1-14
每3周重复
GEM单药方案g
GEM 1000mg/m2 静脉输注超过30min d1 qw×7,休1周,此后qw×3,休1周
可调整GEM单药方案
GEM1000mg/m2 静脉输注超过30min d1、8,每3周重复
替吉奥单药方案h
替吉奥 80mg/日 口服 d1-28,每6周重复
可调整替吉奥单药方案
替吉奥 40~60mg/d,口服,一日两次,d1-14,每3周重复
其他方案
1. GEM+顺铂(特别是对于可能存在BRCA1/BRCA2或者其他DNA修复基因突变的遗传性肿瘤患者)[8]
2. 固定剂量率GEM、多西他赛、卡培他滨(GTX 方案)[9]
3. 氟尿嘧啶+奥沙利铂(例如:5-FU/LV/奥沙利铂[10]或CapeOx[11])
【注释】
a. MPACT(Ⅲ期临床试验)[1]:861例转移性胰腺癌患者,随机接受白蛋白结合型紫杉醇联合GEM 或GEM 单药治疗。结果显示,GEM+白蛋白结合型紫杉醇的 mOS为8.7个月,GEM单药为6.6 个月(HR=0.72,95% CI:0.62~0.83;P<0.001),两组差异有统计学意义,在转移性胰腺癌初治患者中,GEM联合白蛋白结合型紫杉醇的mOS较GEM单药明显延长,且耐受性良好。该研究人群为高加索人群,但在国内已广泛使用,故作为Ⅰ级推荐。
b. 奥沙利铂+伊立替康+5-FU/亚叶酸钙联合方案(FOLFIRINOX)[2]:324例PS0~1 转移性胰腺癌患者,随机采用FOLFIRINOX 或GEM 方案,比较评估其疗效。FOLFIRINOX 的mOS 为11.1个月,GEM 组为6.8 个月(P<0.001)。与GEM治疗相比,FOLFIRINOX方案的毒性反应发生率较高,是体力状况良好的转移性胰腺癌患者的治疗选择之一。该研究人群为高加索人群,但在国内已广泛使用,故作为Ⅰ级推荐。
c. GEM+替吉奥[3]: 随机对照Ⅲ期临床研究GEST试验,结果:与GEM单药相比,GS方案在总生存期方面并无优势,GS组的mOS为10.1 个月,GEM组为8.8 个月,但在PFS和RR率方面存在优势。此研究在亚洲人群开展,但鉴于此研究并无生存期方面获益,故作为Ⅱ级推荐。
d. GEM+厄洛替尼[4]:569 例晚期或转移性胰腺癌患者,随机分组接受厄洛替尼联合GEM 或GEM 单药治疗。结果:与GEM 单药治疗组相比,厄洛替尼联合GEM组在mOS(HR=0.82,P=0.038)和mPFS(HR=0.77,P=0.004)方面均显示出有统计学意义的改善。厄洛替尼联合GEM 组的mOS 为6.24 个月,1 年生存率为23%,而GEM单药治疗组分别为5.91个月和17%。该研究人群为高加索人群,且实际获益有限,故作为Ⅲ级推荐。
e. GEM+尼妥珠单抗[5]:随机对照Ⅱ期临床研究,结果:与GEM 单药相比,GEM联合尼妥珠单抗组的mOS延长,分别为8.7个月和6.0个月(P=0.21),mPFS分别为5.4 个月和3.7个月(P=0.06)。对于≥62 岁的患者(占入组患者的60%),GEM 联合尼妥珠单抗较GEM 单药治疗获益明显,mOS 分别为8.8 个月和5.2个月(P=0.034),mPFS分别为5.5 个月和3.2个月(P=0.0096)。亚组分析显示,在KRAS野生型患者对比KRAS突变型患者mOS改善更显著,分别为11.6个月和5.6个月。基于此,目前正在国内进行“尼妥珠单抗联合吉西他滨对比安慰剂联合吉西他滨治疗K-RAS野生型局部晚期或转移性胰腺癌的前瞻性、随机对照、双盲、多中心的注册临床研究”。因此本指南推荐对于KRAS 野生型的胰腺癌患者,可推荐使用GEM+尼妥珠单抗。此研究为Ⅱ期临床研究,但获益明确,且胰腺癌中靶向治疗选择较少,故作为Ⅱ级推荐。
f. GEM+CAP[6]:533例晚期胰腺癌患者随机分为GEM单药组和GEM联合CAP组。GEM+CAP显著提高了ORR(19.1% vs 12.4%,P=0.034)和PFS(HR0.78,P=0.004),OS也有延长趋势。此为Ⅲ期临床研究,但最终结果为阴性,且研究人群为高加索人群,故作为Ⅲ级推荐。
g. GEM单药[7]:GEM对比5-FU治疗无法切除的晚期胰腺癌患者的Ⅲ期临床研究。结果:GEM组与5-FU 组相比,mOS 显著延长,分别为5.65 个月和 4.41个月(P=0.0025),症状缓解也有显著改善。此方案已在亚洲人群广泛使用,故作为Ⅰ级推荐。
h. 替吉奥单药[3]:随机对照Ⅲ 期临床研究GEST 试验,结果:S-1单药对比GEM 单药的总生存风险比为HR=0.96(97.5%CI:0.78~1.18),S-1 单药用于局部晚期或转移性胰腺癌患者的总生存期不劣于GEM单药治疗。此研究人群为亚洲人群,且达到研究终点,故作为Ⅰ级推荐。
附录10 二线化疗方案
纳米脂质体伊立替康+5-FU/LV方案a
纳米脂质体伊立替康80mg/m2,静脉注射大于90min,d1
LV 400mg/m2静脉输注大于30min,d1
5-FU 2400mg/m2,持续静脉输注46h
每2周重复
【注释】
a. 纳米脂质体伊立替康+5-FU/LV[1]: 随机对照Ⅲ期临床研究。纳米脂质体伊立替康+5-FU/LV的mOS为6.1个月,5-FU/LV为4.2个月(HR=0.67,95% CI:0.49-0.92;P=0.012),两组差异有统计学意义。3~4级毒副反应多发生于联合组,粒细胞减少症(27%),腹泻(13%),呕吐(11%)和乏力(14%)。因纳米脂质体伊立替康在中国尚未上市,且研究人群均为高加索人种,故作为Ⅱ级推荐。
4胰腺癌患者随访
胰腺癌患者随访
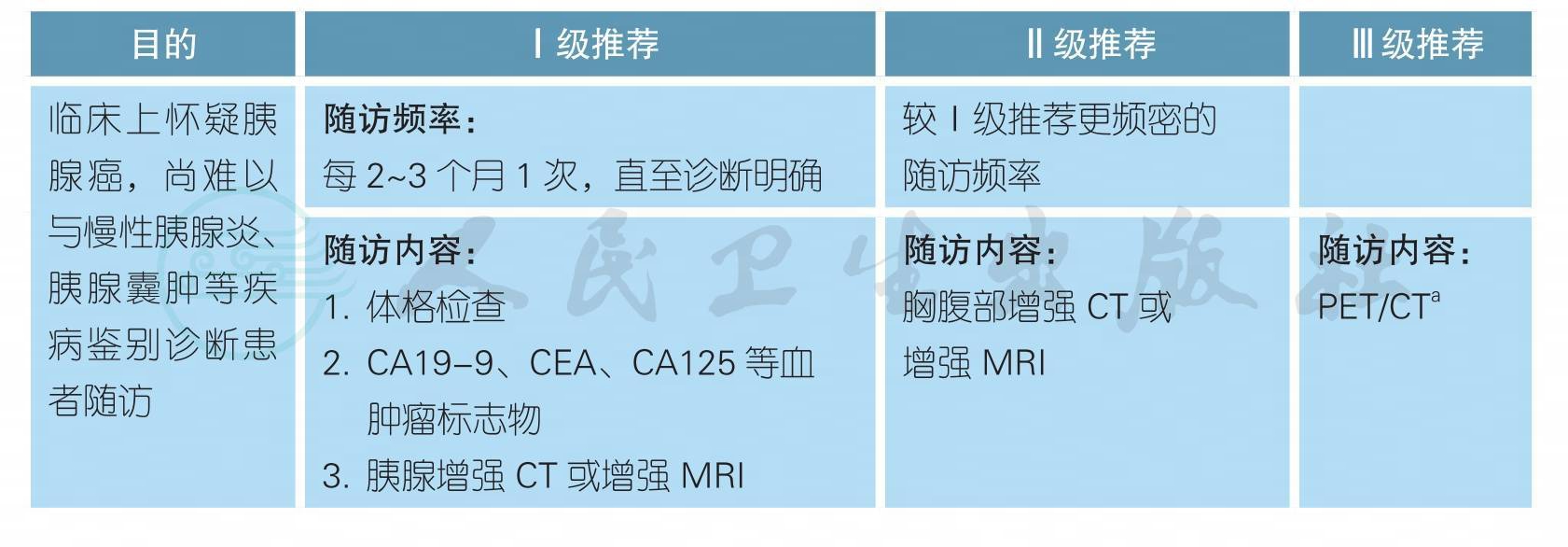
胰腺癌患者随访(续)
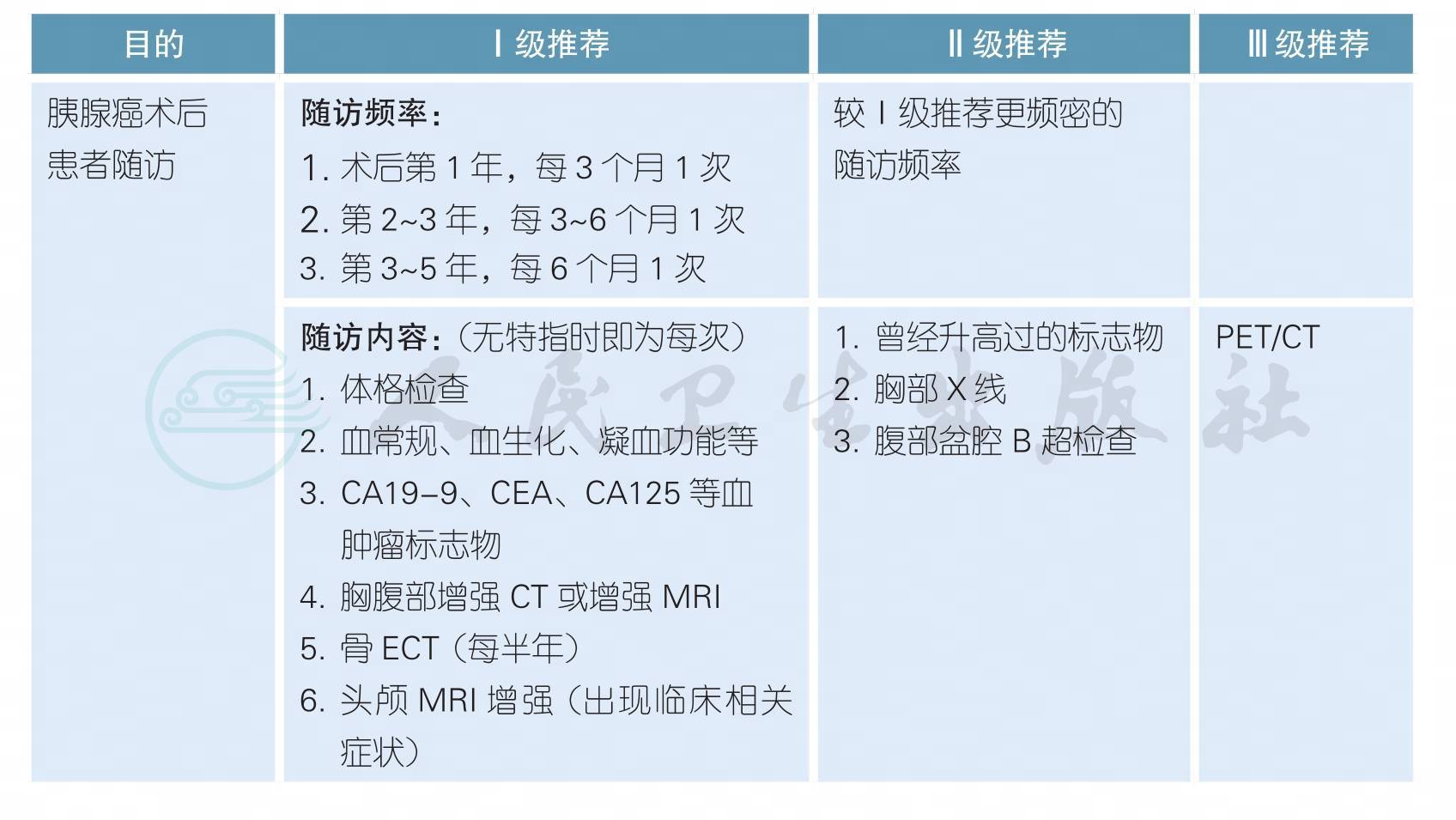
胰腺癌患者随访(续)

【注释】
a. PET/CT仅推荐用于临床怀疑复发,但常规影像学阴性的时候,比如持续CA19-9升高;不推荐将PET列为常规随访/监测手段。
附-1 最佳支持治疗
提高胰腺癌患者的生活质量是最佳支持治疗的首要目标。最佳支持治疗应贯穿胰腺癌治疗的始终,尤以终末期患者为主,其目的是减轻临床症状和提高患者生活质量。终末期肿瘤患者的症状可以大致归为两类,一类是疼痛,包括肿瘤引起的癌痛和器官累及引起的其他疼痛,如消化道中胆道梗阻引起的痉挛痛等;另一类是乏力相关症状,主要是由于营养摄入不足或代谢异常引起的营养不良。
疼痛是胰腺癌最常见的症状之一,疼痛控制良好也是患者体能状况较好的标志之一。在明确疼痛的原因和排除外科急症后,要明确是否为癌痛。考虑癌痛者,根据WHO三阶梯镇痛的五大原则予以足量镇痛。
营养不良甚至恶液质在胰腺癌终末期患者中极为多见。应首先对患者进行恶液质的诊断与分期:①恶液质前期,即体重下降≤5%并存在厌食或糖耐量下降等;②恶液质期,即6个月内体重下降>5%,或基础BMI<20 者体重下降>2%,或有肌肉减少症者体重下降>2%;③难治期,即预计生存<3月,PS评分低,对抗肿瘤治疗无反应的终末状态[1]。
在判定全身营养状况和患者胃肠道功能状况基础上制订营养治疗计划。生命体征平稳而自主进食障碍者,如患者有意愿时应予营养治疗,其中存在胃肠道功能者以肠内营养为主[2]。无胃肠道功能者可选择胃肠外营养,一旦肠道功能恢复,或肠内营养治疗能满足患者能量及营养素需要量,即停止胃肠外营养治疗。营养治疗同时应监测24h出入量、水肿或脱水、血电解质等。生命体征不稳和多脏器衰竭者原则上不考虑系统性的营养治疗。
糖皮质激素类药物和醋酸甲地孕酮能够增加食欲[3]。酌情选用能够逆转恶液质异常代谢的代谢调节剂,目前使用的药物包括鱼油不饱和脂肪酸(EPA)、二十二碳六烯酸(DHA)和非甾体类抗炎药沙利度胺等[4-6]。
附-2 胰腺癌与CA19-9
CA19-9是一种粘蛋白型的糖类蛋白肿瘤标志物,为细胞膜上的糖脂质,分子量大于1000kD。是迄今报道的对胰腺癌敏感性最高的标志物[1]。在血清中它以唾液粘蛋白形式存在,分布于正常胎儿胰腺、胆囊、肝、肠和正常成年人胰腺、胆管上皮等处。
大部分胰腺癌患者血清CA199水平明显增高。如果以正常参考范围上限(37U/mL)为诊断标准,敏感性和特异性均可达90%以上;CA19-9水平与胰腺癌的发展阶段有关,血清中含量的高低往往提示手术的难易程度;术前CA19-9水平对预后有一定提示作用,低者预后好;术后CA19-9水平降至正常者生存期长于未下降者;肿瘤复发时,CA19-9可再度升高,并且发生于影像学诊断之前[2]。因此可用作监测肿瘤的复发。但同时应注意,其他恶性肿瘤也可出现CA19-9升高,包括卵巢癌、淋巴瘤、胃癌、肝癌、食管癌、乳腺癌、结直肠癌和胆道系统肿瘤等。同时一些良性疾病,例如胰腺炎、胆道系统炎症、肠道炎症也可出现CA199的升高。胰腺癌患者常存在胆道系统炎症,因此CA19-9升高提示胰腺癌复发或进展可能,但不能作为复发、转移、肿瘤进展和更换化疗药物的主要依据,仍应以影像学证据为主,对于不能确定的患者应密切随访。
附-3 胰腺癌诊治流程图
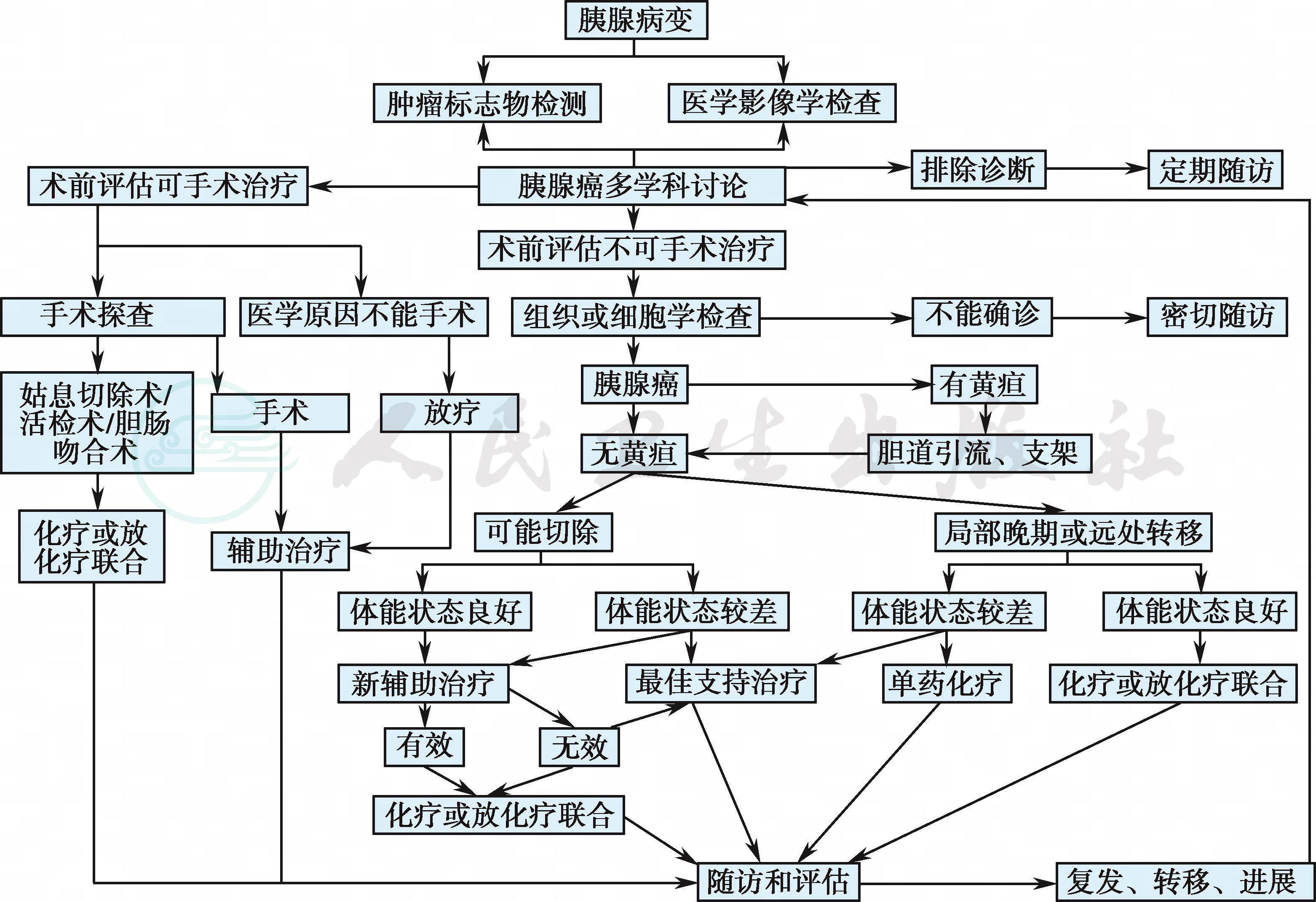
1 胰腺癌的MDT诊疗模式
1. Ren G,Xia T,Wang Y. IMRT with capecitabine in advanced pancreatic cancer. In regard to Passoni et al. Int J RadiatOncolBiol Phys,2014,89:431.
2. De Geus SWL,Eskander MF,Kasumova GG,et al. Stereotactic body radiotherapy for unresected pancreatic cancer: A nationwide review. Cancer,2017,123:4158-4167.
3.1.1 可切除胰腺癌的外科治疗原则
1. Konstantinidis IT,Warshaw AL,Allen JN,et al. Pancreatic ductal adenocarcinoma: is there a survival difference for R1 resections versus locally advanced unresectable tumors? What is a “true” R0 resection?[J]. Ann Surg,2013,257(4): 731-736.
2. de Rooij T,van Hilst J,Busch OR,et al. Laparoscopic Distal Pancreatectomy for PancreaticDuctal Adenocarcinoma: Time for a Randomized Controlled Trial? Results of an All-inclusive National Observational Study [J]. Ann Surg,2016.
3. Baker MS,Bentrem DJ,Ujiki MB,et al. A prospective single institution comparison of peri-operative outcomes for laparoscopic and open distal pancreatectomy [J]. Surgery,2009,46(4): 635-43,643-645.
4. Nigri GR,Rosman AS,Petrucciani N,et al. Metaanalysis of trials comparing minimally invasive and open distal pancreatectomies [J]. Surg Endosc,2011,25(5): 1642-1651.
5. Iqbal N,Lovegrove RE,Tilney HS,et al. A comparison of pancreaticoduodenectomy with extended pancreaticoduodenectomy: a meta-analysis of 1909 patients [J]. Eur J Surg Oncol,2009,35(1):79-86.
6. Wang J,Xia T,Wang Y,et al. Long-term Results of Gamma Ray-based Stereotactic Body Radiation Therapy in Treatment of Medically Unfit or Inoperable Nonmetastatic Pancreatic Adenocarcinoma [J].Int J Radiat Oncol Biol Phys,2012,84(3): S815-16.
7. 常冬妹,夏廷毅,李平,等。全身γ刀治疗局限期胰腺癌临床结果分析[J]. 中华放射肿瘤学杂志,2009,18(6): 470-473.
3.1.2 可切除胰腺癌的辅助治疗原则
1. Stocken DD,B ü chler MW,Dervenis C,et al. Meta-analysis of randomised adjuvant therapy trials for pancreatic cancer [J]. Brit J Cancer,2005,92(8): 1372-1381.
2. Smeenk HG,van Eijck CH,Hop WC,et al. Long-term survival and metastatic pattern of pancreatic and periampullary cancer after adjuvant chemoradiation or observation: long-term results of EORTC trial 40891. [J]. Ann Surg,2007,246(5): 734-740.
3. Schmidt J,Abel U,Debus J,et al. Open-label,multicenter,randomized phaseⅢ trial of adjuvant chemoradiation plus interferon Alfa-2b versus fluorouracil and folinic acid for patients with resected pancreatic adenocarcinoma. [J]. J Clin Oncol,2012,30(33): 4077-4083.
4. Van Laethem JL,Hammel P,Mornex F,et al. Adjuvant gemcitabine alone versus gemcitabine-based chemoradiotherapy after curative resection for pancreatic cancer: a randomized EORTC-40013-22012/FFCD-9203/GERCOR phase Ⅱ study. [J]. J Clin Oncol,2010,28(29):31/334450-56.
3.1.2.2 可切除胰腺癌的辅助放疗
1. Smeenk HG,van Eijck CH,Hop WC,et al. Long-term survival and metastatic pattern of pancreatic and periampullary cancer after adjuvant chemoradiation or observation: long-term results of EORTC trial 40891. [J]. Ann Surg,2007,246(5): 734-740.
2. WF R,KA W,RA A,et al. Fluorouracil vs Gemcitabine Chemotherapy Before and After Fluorouracil-Based Chemoradiation Following Resection of Pancreatic Adenocarcinoma: A Randomized Controlled Trial [J]. JAMA,2008,299(9): 1019-1026.
3. Van Laethem JL,Hammel P,Mornex F,et al. Adjuvant gemcitabine alone versus gemcitabine-based chemoradiotherapy after curative resection for pancreatic cancer: a randomized EORTC-40013-22012/FFCD-9203/GERCOR phase Ⅱ study. [J]. J Clin Oncol,2010,28(29):31/334450-56.
4. Gian Carlo Mattiucci,Edy Ippolito,Giuseppe Roberto D’Agostino,et al. Long-term analysis of gemcitabine-based chemoradiation after surgical resection for pancreatic adenocarcinoma. Annals of Surgical Oncology. 2013 Feb;20(2):423-429.
附录4 胰腺癌辅助化疗方案
1. Oettle H,Neuhaus P,Hochhaus A,et al. Adjuvant chemotherapy with gemcitabine and long-term outcomes among patients with resected pancreatic cancer: the CONKO-001 randomized trial [J].JAMA,2013,310(14): 1473-1481.
2. Uesaka K,Boku N,Fukutomi A,et al. Adjuvant chemotherapy of S-1 versus gemcitabine for resected pancreatic cancer: a phase 3,open-label,randomised,non-inferiority trial(JASPAC 01)[J].Lancet,2016,388(10041): 248-257.
3. Neoptolemos JP,Stocken DD,Friess H,et al. A randomized trial of chemoradiotherapy and chemotherapy after resection of pancreatic cancer [J]. N Engl J Med,2004,350(12): 1200-1210.
4. Neoptolemos JP,Palmer DH,Ghaneh P,et al. Comparison of adjuvant gemcitabine and capecitabine with gemcitabine monotherapy in patients with resected pancreatic cancer(ESPAC-4): a multicentre,open-label,randomised,phase 3 trial.Lancet. 2017 Mar 11;389(10073):1011-1024.
3.2 临界可切除胰腺癌的治疗原则
1. Gillen S,Schuster T,Meyer ZBC,et al. Preoperative/neoadjuvant therapy in pancreatic cancer: a systematic review and meta-analysis of response and resection percentages [J]. PLoS Med,2010,7(4): e1000267.
2. Roland CL,Yang AD,Katz MH,et al. Neoadjuvant therapy is associated with a reduced lymph node ratio in patients with potentially resectable pancreatic cancer [J]. Ann Surg Oncol,2015,22(4):1168-1175.
3. Mollberg N,Rahbari NN,Koch M,et al. Arterial resection during pancreatectomy for pancreatic cancer: a systematic review and meta-analysis [J]. Ann Surg,2011,254(6): 882-893.
4. Scodan RL,Mornex F,Girard N,et al. Preoperative chemoradiation in potentially resectable pancreatic adenocarcinoma: feasibility,treatment effect evaluation and prognostic factors,analysis of the SFROFFCD 9704 trial and literature review [J]. Ann Oncol,2009,20(8): 1387-1396.
5. DB E,GR V,CH C,et al. Preoperative gemcitabine-based chemoradiation for patients with resectable adenocarcinoma of the pancreatic head. [J]. J Clin Oncol,2008,26(26): 3496-502.
6. Varadhachary GR,Wolff RA,Crane CH,et al. Preoperative Gemcitabine and Cisplatin Followed by Gemcitabine-Based Chemoradiation for Resectable Adenocarcinoma of the Pancreatic Head [J]. J Clin Oncol,2008,26(26): 3487-3495.
附录5 新辅助化疗方案
1. Theodoros Michelakos,Ilaria Pergolini,Carlos Ferna'ndez-del Castillo,et al. Predictors of Resectability and Survival in Patients with Borderline and Locally Advanced Pancreatic Cancer who Underwent Neoadjuvant Treatment with FOLFIRINOX. Ann Surg. 2017 Dec 7.
2. Bai X,Su R,Ma T,Shen S,Li G,Lou J,Gao S,Que R,Yuan Y,Yu R,Wei Q,Liang T. Modified FOLFIRINOX for advanced pancreatic cancer: a tertiary center experience from China. Zhonghua Wai Ke Za Zhi. 2016 Apr 1;54(4):270-5.
3. Okada Kl,Shimokawa T,Hirono,et al. Effect of Neoadjuvant Nab-Paclitaxel plus Gemcitabine Therapy on Overall Survival in Patients with Borderline Resectable Pancreatic Cancer: A Prospective Multicenter Phase Ⅱ Trial(NAC-GA Trial). Oncology. 2017;93(5):343-346.
4. Toshihiko Masui,Ryuichiro Doi,Yoshiya Kawaguchi,et al. Concurrent gemcitabine+S-1 neoadjuvant chemotherapy contributes to the improved survival of patients with small borderline-resectable pancreatic cancer tumors. Surg Today. 2016 Nov;46(11):1282-1289.
3.3 局部进展期胰腺癌的治疗原则
1. Ikeda M,Ioka T,Ito Y,et al. A Multicenter Phase Ⅱ Trial of S-1 With Concurrent RadiationTherapy for Locally Advanced Pancreatic Cancer [J]. Int J Radiat Oncol Biol Phys,2013,85(1):163-169.
2. Krishnan S,Chadha AS,Suh Y,et al. Focal Radiation Therapy Dose Escalation Improves Overall Survival in Locally Advanced Pancreatic Cancer Patients Receiving Induction Chemotherapy and Consolidative Chemoradiation [J]. Int J Radiat Oncol,2016,94(4): 755-765.
3. Hammel P,Huguet F,van Laethem JL,et al. Effect of Chemoradiotherapy vs Chemotherapy on Survival in Patients With Locally Advanced Pancreatic Cancer Controlled After 4 Months of Gemcitabine With or Without Erlotinib: The LAP07 Randomized Clinical Trial. [J]. JAMA,2016,315(17): 1844-1853.
4. Sr PJL,Yang F,Cardenes H,et al. Gemcitabine Alone Versus Gemcitabine Plus Radiotherapy in Patients With Locally Advanced Pancreatic Cancer: An Eastern Cooperative Oncology Group Trial [J].J Clin Oncol,2011,29(31): 4105-4112.
5. de Geus SWL,Eskander MF,Kasumova GG,et al: Stereotactic body radiotherapy for unresected pancreatic cancer: A nationwide review. Cancer 2017 ,123:4158-4167.
附录6 同步放疗或序贯放化疗方案
1. Huguet F,Goodma KA,Azria D,et al. Radiotherapy technical considerations in the management of locally advanced pancreatic cancer: American-French consensus recommendations [J]. Int J Radiat Oncol Biol Phys,2012,83(5): 1355-1364.
2. Wang J,Xia T,Wang Y,et al. Long-term Results of Gamma Ray-based Stereotactic Body Radiation Therapy in Treatment of Medically Unfit or Inoperable Nonmetastatic Pancreatic Adenocarcinoma [J].Int J Radiat Oncol Biol Phys,2012,84(3): S815-16.
3. 常冬妹,夏廷毅,李平,et al. 全身γ刀治疗局限期胰腺癌临床结果分析[J]. 中华放射肿瘤学杂志,2009,18(6): 470-473.
4. Ren G,Xia T,Di Y,et al. Hypofractionated and Simultaneous Integrated Boost Radiation Therapy for Locally Advanced Pancreatic Cancer With Helical Tomotherapy [J]. Int J Radiat Oncol Biol Phys,2015,93(3): E149-50.
5. Xia T,Chang D,Wang Y,et al. Dose Escalation to Target Volumes of Helical Tomotherapy for Pancreatic Cancer in the Phase 1-2 Clinical Trial [J]. Int J Radiat Oncol Biol Phys,2013,87(2):S303
6. Crane CH. Hypofractionated ablative radiotherapy for locally advanced pancreatic cancer [J].J Radiat Res,2016,57 Suppl 1: i53-57.
7. Herman JM,Chang DT,Goodman KA,et al. Phase 2 multi-institutional trial evaluating gemcitabine and stereotactic body radiotherapy for patients with locally advanced unresectable pancreatic adenocarcinoma[J]. Cancer,2015,121(7): 1128-1137.
8. Krishnan S,Chadha AS,Suh Y,et al. Focal Radiation Therapy Dose Escalation Improves Overall Survival in Locally Advanced Pancreatic Cancer Patients Receiving Induction Chemotherapy and Consolidative Chemoradiation [J]. Int J Radiat Oncol Biol Phys,2016,94(4):755-765.
9. Jingu K,Tanabe T,Nemoto K,et al. Intraoperative radiotherapy for pancreatic cancer: 30-year experience in a single institution in Japan [J]. Int J Radiat Oncol Biol Phys,2012,83(4):e507-11.
10. Zimmermann FB,Jeremic B,Lersch C,et al. Dose escalation of concurrent hypofractionated radiotherapy and continuous infusion 5-FU-chemotherapy in advanced adenocarcinoma of the pancreas[J]. Hepatogastroenterology,2005,52(61): 246-250.
11. de Geus SWL,Eskander MF,Kasumova GG,et al: Stereotactic body radiotherapy for unresected pancreatic cancer: A nationwide review. Cancer 2017 ,123:4158-4167
12. Ikeda M,Ioka T,Ito Y,et al. A Multicenter Phase Ⅱ Trial of S-1 With Concurrent RadiationTherapy for Locally Advanced Pancreatic Cancer [J]. Int J Radiat Oncol Biol Phys,2013,85(1):163-169.
13. Hammel P,Huguet F,van Laethem JL,et al. Effect of Chemoradiotherapy vs Chemotherapy on Survival in Patients With Locally Advanced Pancreatic Cancer Controlled After 4 Months of Gemcitabine With or Without Erlotinib: The LAP07 Randomized Clinical Trial. [J]. JAMA,2016,315(17):1844-1853.
附录7 不可逆电穿孔消融治疗
1. Martin RN,McFarland K,Ellis S,et al. Irreversible electroporation in locally advanced pancreatic cancer: potential improved overall survival [J]. Ann Surg Oncol,2013,20 Suppl 3:S443-449.
2. Martin RN,Kwon D,Chalikonda S,et al. Treatment of 200 locally advanced(stage Ⅲ)pancreatic adenocarcinoma patients with irreversible electroporation: safety and efficacy [J].Ann Surg,2015,262(3): 486-494.
附录8 中医中药治疗
1. Schwartzberg LS,Arena FP,Bienvenu BJ,et al. A Randomized,Open-Label,Safety and Exploratory Efficacy Study of Kanglaite Injection(KLTi)plus Gemcitabine versus Gemcitabine in Patients with Advanced Pancreatic Cancer. J Cancer. 2017 Jul 3;8(10):1872-1883.
3.4 转移性胰腺癌的治疗原则
1. Zimmermann FB,Jeremic B,Lersch C,et al. Dose escalation of concurrent hypofractionated radiotherapy and continuous infusion 5-FU-chemotherapy in advanced adenocarcinoma of the pancreas[ J].Hepatogastroenterology,2005,52(61): 246-250.
附录9 一线化疗方案
1. Von Hoff DD,Ervin T,Arena FP,et al. Increased survival in pancreatic cancer with nab-paclitaxel plus gemcitabine [J]. N Engl J Med. 2013 Oct 31;369(18):1691-1703.
2. Conroy T,Desseigne F,Ychou M,et al. FOLFIRINOX versus gemcitabine for metastatic pancreatic cancer [J]. N Engl J Med,2011,364(19): 1817-1825.
3. Ueno H,Ioka T,Ikeda M,et al. Randomized phase Ⅲ study of gemcitabine plus S-1,S-1 alone,or gemcitabine alone in patients with locally advanced and metastatic pancreatic cancer in Japan and Taiwan: GEST study [J]. J Clin Oncol,2013,31(13): 1640-1648.
4. Moore MJ,Goldstein D,Hamm J,et al. Erlotinib plus gemcitabine compared with gemcitabine alone in patients with advanced pancreatic cancer: a phase Ⅲ trial of the National Cancer Institute of Canada Clinical Trials Group [J]. J Clin Oncol,2007,25(15): 1960-1966.
5. Strumberg D,Schultheis B,Ebert MP,et al. Phase Ⅱ,randomized,double-blind placebo-controlled trial of nimotuzumab plus gemcitabine compared with gemcitabine alone in patients(pts)with advanced pancreatic cancer(PC). [J]. ASCO Annual Meeting,Abstract No:4009,2013.
6. Cunningham D,Chau I,Stocken DD,et al. Phase Ⅲ randomized comparison of gemcitabine versus gemcitabine plus capecitabine in patients with advanced pancreatic cancer [J]. J Clin Oncol,2009,27(33): 5513-5518.
7. Burris HR,Moore MJ,Andersen J,et al. Improvements in survival and clinical benefit with gemcitabine as first-line therapy for patients with advanced pancreas cancer: a randomized trial [J]. J Clin Oncol,1997,15(6): 2403-2413.
8. U.S. National Library of Medicine-Key MEDLINEIndicators.Available at:http://www.nlm.nih.gov/bsd/bsd_key.html. Accessed July 24,2014.
9. Anderson MA,Zolotarevsky E,Cooper KL,et al. Alcohol and tobacco lower the age of presentation in sporadic pancreatic cancer in a dose-dependent manner: a multicenter study. Am J Gastroenterol 2012;107:1730-1739.
10. Bosetti C,Lucenteforte E,Silverman DT,et al. Cigarette smoking and pancreatic cancer: an analysis from the International Pancreatic Cancer Case-Control Consortium(Panc4). Ann Oncol 2012;23:1880-1888.
11. Hassan MM,Bondy ML,Wolff RA,et al. Risk factors for pancreatic cancer: case-control study. Am J Gastroenterol 2007;102:2696-2707.
附录10 二线化疗方案
1. Wang-Gillam A,Li CP,Bodoky G,et al. Nanoliposomal irinotecan with fluorouracil and folinic acid in metastatic pancreatic cancer after previous gemcitabine-based therapy(NAPOLI-1): a global,randomised,open-label,phase 3 trial [J]. Lancet,2016,387(10018): 545-557.
附-1 最佳支持治疗
1. Fearon K,Strasser F,Anker SD,et al. Definition and classification of cancer cachexia: aninternational consensus [J]. Lancet Oncol,2011,12(5): 489-495.
2. Lundholm K,Daneryd P,Bosaeus I,et al. Palliative nutritional intervention in addition to cyclooxygenase and erythropoietin treatment for patients with malignant disease: Effects on survival,metabolism,and function [J]. Cancer,2004,100(9): 1967-1977.
3. Ruiz-Garcia V,Juan O,Perez HS,et al. [Megestrol acetate: a systematic review usefulness about the weight gain in neoplastic patients with cachexia] [J]. Med Clin(Barc),2002,119(5):166-170.
4. Babcock T,Helton WS,Espat NJ. Eicosapentaenoic acid(EPA): an antⅡ nflammatory omega-3 fat with potential clinical applications [J]. Nutrition,2000,16(11-12): 1116-1118.
5. Ferreri NR,McGiff JC,Carroll MA,et al. Renal COX-2,cytokines and 20-HETE: tubular and vascular mechanisms [J]. Curr Pharm Des,2004,10(6): 613-626.
6. Gordon JN,Trebble TM,Ellis RD,et al. Thalidomide in the treatment of cancer cachexia: arandomised placebo controlled trial [J]. Gut,2005,54(4): 540-545.
附-2 胰腺癌与CA19-9
近期研究表明 CA125[3]、CEA[4]、CA50[5]、CA242[6]、CA724[7]等肿瘤标志物也与胰腺癌相关。
1. Root A,Allen P,Tempst P,et al.Protein Biomarkers for Early Detection of Pancreatic Ductal Adenocarcinoma: Progress and Challenges. Cancers(Basel). 2018 Mar 7;10(3).
2. O' Brien DP, Sandanayake NS,Jenkinson C,et al. Serum CA19-9 is significantly upregulated up to 2 years before diagnosis with pancreatic cancer: implications for early disease detection. Clin Cancer Res. 2015 Feb 1;21(3):622-631.
3. Meng Q,Shi S,Liang C,et al. Diagnostic Accuracy of a CA125-Based Biomarker Panel in Patients with Pancreatic Cancer: A Systematic Review and Meta-Analysis. J Cancer. 2017 Oct 9;8(17):3615-3622.
4. Xu HX,Liu L,Xiang JF,et al. Postoperative serum CEA and CA125 levels are supplementary to perioperative CA19-9 levels in predicting operative outcomes of pancreatic ductal adenocarcinoma.Surgery. 2017 Feb;161(2):373-384.
5. Pasquali C,Sperti C,D' Andrea AA,et al. CA50 as a serum marker for pancreatic carcinoma:comparison with CA19-9. Eur J Cancer. 1994;30A(7):1042-1043.
6. Lei XF,Jia SZ,Ye J,et al. Application values of detection of serum CA199,CA242 and CA50 in the diagnosis of pancreatic cancer. J Biol Regul Homeost Agents. 2017 Apr-Jun;31(2):383-388.
7. Liu P,Zhu Y,Liu L. CA724 is a novel factor for predicting the unresectability in pancreatic adenocarcinoma.Int J Clin Exp Pathol. 2015 Nov 1;8(11):15112-15117.