 去看看
去看看


美国糖尿病学会(American Diabetes Association,ADA)制定的“ 糖尿病医学诊疗标准”自1989年起发布至今,已成为指导临床医师、护理人员等进行糖尿病管理临床实践的权威指南之一。近日,ADA依据最新循证证据对指南进行了更新,并于Diabetes Care增刊上发布了《2019年ADA糖尿病医学诊疗标准》,该诊疗标准继续强调以患者为中心的理念,对于糖尿病的管理、治疗等方案进行了完善,同时对日新月异的糖尿病诊治新技术给予了更多关注。本文就其中热点问题及重要更新内容进行解读。
近日,美国糖尿病学会(American Diabetes Association, ADA)在Diabetes Care增刊上发布了2019年糖尿病医学诊疗标准(Standards of Medical Care in Diabetes,以下简称2019年ADA标准)[1],该标准共分为16个章节:S1.提高群体诊疗和促进人群健康;S2.糖尿病的分类和诊断;S3.预防或延缓2型糖尿病;S4.综合医学评估和合并症评估;S5.生活方式管理;S6.血糖控制目标; S7.糖尿病技术;S8.2型糖尿病治疗的肥胖管理; S9.降糖药物治疗方案;S10.心血管疾病及危险因素管理;S11.微血管并发症和糖尿病足护理; S12.老年糖尿病管理;S13.儿童和青少年糖尿病管理;S14.妊娠合并糖尿病管理;S15.院内糖尿病管理;S16.糖尿病的倡议。
2019年ADA标准在2018年ADA标准的基础上,新增了“糖尿病技术”这一章节(第7章节)。该章节主要关注胰岛素输注、自我血糖监测(self-monitoring of blood glucose,SMBG)、持续葡萄糖监测(continuous glucose monitoring,CGM)以及胰岛素闭环系统等四个方面,纳入了既往已有章节的部分内容并添加了新的建议。同时,2019年ADA标准将“预防或延缓2型糖尿病”移至第3章节(2018 年ADA标准为第5章节),以在逻辑层面上更好地反映2型糖尿病的进展。本文现就2019年ADA标准的热点问题及重要更新内容进行解读。
1 S2.糖尿病的分类和诊断
2019年ADA标准在既往诊断标准的基础上,进行了补充修订。主要是针对无明确高血糖的情况,目前规定需要两次不同样本的检测结果均达到诊断切点。本次新增也可以是同一样本的两种检测结果达到诊断切点[2],例如同一样本的空腹血糖(fasting plasma glucose,FPG)≥7.0 mmol/L和糖化血红蛋白(glycated hemoglobin A1c,HbA1c)≥6.5%(表1)。这一修订主要是基于最新的研究数据,Selvin等[2] 对社区动脉粥样硬化风险(atherosclerosis risk in communities,ARIC)研究这一前瞻性队列研究的分析表明,可以使用同一血样的HbA1c和FPG来诊断糖尿病,具有较高的特异性,且与患者再次随访采血以明确诊断相比,其成本效益更佳。

同时,2019年ADA标准明确了可能影响HbA1c检测准确性的其他情况。在镰状细胞病、妊娠(妊娠中期和晚期及产后阶段)、葡萄糖-6-磷酸脱氢酶缺乏症、艾滋病、血液透析、近期失血或输血、促红细胞生成素治疗等情况下,红细胞更新速度加快,应仅以血糖标准来诊断糖尿病[3]。尤其在产后阶段[4-6]、特定药物治疗艾滋病[7]以及缺铁性贫血[8]等情况下,HbA1c的可靠性低于血糖指标。
2 S3.预防或延缓2型糖尿病
2019年ADA标准将此章节提前至第3章节(2018年ADA标准为第5章节),置于“生活方式管理”章节之前,以更好地反映2型糖尿病的进展。
2019年ADA标准延续了2018年ADA标准对于糖尿病前期患者的建议,指出糖尿病前期患者每年至少检测1次血糖相关指标,以明确糖尿病前期是否进展为糖尿病;应强化生活方式干预,达到并维持7%的减重目标,并将中等强度体力活动(例如快走)的时间增加至≥150 min/周;根据患者自身意愿,选择糖尿病相关辅助技术如智能手机应用程序、线上网络课程等也可有效预防2型糖尿病。在营养指导部分,2019年ADA标准指出同时包括低热量食谱以及运动的减重方案,对于超重和肥胖的糖尿病前期患者尤为重要。根据研究证据,对糖尿病前期患者可能有帮助的饮食方式包括地中海饮食[9-12]和低热量低脂饮食[13],而低碳饮食对于糖尿病前期患者是否有益还有待进一步研究[14]。研究证据表明,短期内低碳饮食能够有效减重并降低心血管疾病发生风险,但长期低碳饮食者体重会出现反弹,所以仍需大型的临床研究以明确低碳饮食的长期效果。吸烟会增加2型糖尿病患病风险,因此,本章节新增了有关烟草使用和戒烟建议的内容。已戒烟的糖尿病前期患者戒烟后一段时期内糖尿病患病风险仍增加,应关注糖尿病相关指标的动态变化并采取预防糖尿病的干预措施。
3 S4.综合医学评估和合并症评估
3.1 以患者为中心的综合管理
2019年ADA标准进一步强调了以患者为中心的理念,在该部分增加了ADA-欧洲糖尿病研究协会(European Association for the Study of Diabetes,EASD)共识[15]中的2型糖尿病血糖管理决策环流程图,强调持续评估和共同决策的必要性,以实现卫生保健目标并避免临床实践的惰性。2019年ADA标准指出,糖尿病治疗目标是预防或延缓并发症以及保证生活质量;治疗目标以及方案的制订需以患者的个人偏好、价值观和目标为基础;管理方案必须考虑患者的各个方面,如年龄、认知能力、糖尿病并发症、合并症、病程等;应该应用不同的策略和技术以支持患者的自我管理成果,提供糖尿病管理各方面相关问题的教育。同时,该部分指出语言对行为和认知有重要影响,有力的语言应用在糖尿病管理与教育中可发挥积极作用,并新增了相关内容以指导医疗人员、糖尿病患者及专业人员的沟通。此外,2019年ADA标准明确指出糖尿病多学科小组在糖尿病诊疗过程中的重要性,该小组成员可包括初级保健医师、专科医师、医师助理、护士、营养师、运动专家、药剂师、牙科医师、足科医生及精神卫生专业人员等。
3.2 综合医学评估
2019年ADA标准更新了《综合医学评估表》,将评估与规划单独列为新的表格,分为糖尿病并发症风险评估、目标设定及治疗规划三部分(表2)。在制订个体化血糖目标、血压和血脂管理目标、降糖药物和降压药物的选择以及他汀类药物治疗强度的选择时,应考虑动脉粥样硬化性心血管疾病(arteriosclerotic cardiovascular disease, ASCVD)和心力衰竭(heart failure,HF)的风险、慢性肾脏病(chronic kidney disease,CKD)分期以及治疗相关的低血糖风险,且同时将10年ASCVD 风险纳入总体风险评估。该部分也列出了增加治疗相关低血糖的风险因素(表3)。


4 S6.血糖控制目标
2019年ADA标准在本章节的开始即对HbA1c检测进行了讨论,进一步强调了HbA1c在血糖管理中的中心地位以及在糖尿病并发症预测中的重要价值。沿用既往标准的推荐:治疗达标(和血糖控制稳定)的患者应每年检测HbA1c至少2次;更改治疗方案或血糖控制未达标的患者应每3个月检测1次HbA1c ;即时/床旁检测(point-of-care testing,POCT)HbA1c有助于及时调整治疗方案。
2019年ADA标准指出应及时调整在糖尿病初期制订的个体化血糖控制目标。随着糖尿病的进展以及患者年龄的增长,糖尿病患者出现合并症的可能性增加,其预期寿命以及对于强化治疗的获益均会减少;与此同时,病程的延长导致病情更加难以控制,增加了治疗风险和患者的经济负担。因此,应该不断对血糖目标进行个体化的评估及调整,以平衡各种因素变化带来的风险和收益。
低血糖是影响糖尿病患者血糖控制的重要因素之一。2019年ADA标准对低血糖的定义进行了更新(表4)。低血糖1级定义为血糖水平<3.9 mmol/L但≥3.0 mmol/L;低血糖2级定义为血糖水平<3.0 mmol/L,此时开始出现低血糖导致的神经症状,需要立即采取措施以解除低血糖;低血糖3级定义为与严重认知功能障碍相关的低血糖症,需要他人援助。

5 S7.糖尿病技术
糖尿病技术是1年ADA标准新增的章节,本章节集中提供了糖尿病技术相关的最新信息及研究证据。糖尿病技术是指糖尿病患者用于糖尿病管理相关的硬件、设备及软件,能够帮助患者控制血糖、预防并发症、减轻生活负担并提高其生活质量。近年来,糖尿病技术迅速发展,在糖尿病预防和诊治方面发挥了重要作用,尤其是CGM、胰岛素闭环系统等技术的不断革新,为临床工作者及患者提供了解和控制血糖更直观、更简单的方式。本章节主要着眼于糖尿病监测和胰岛素治疗两方面,分为四部分:胰岛素输注、SMBG、CGM及胰岛素闭环系统。今后此章节的内容将会扩展至更广泛的领域,如医疗相关软件、隐私保护、成本、技术辅助的糖尿病教育和支持、远程医疗以及诊疗过程中使用糖尿病技术时遇到的其他问题等。
5.1 胰岛素输注
该部分主要对胰岛素注射器、胰岛素笔以及胰岛素泵等进行了讨论。糖尿病患者最常用于胰岛素输注的是胰岛素注射器或胰岛素笔,2019年ADA标准指出在选择种类时应考虑患者的偏好、胰岛素类型和给药方案、成本及自我管理能力等方面。同时,有灵活度问题或视力损害的患者,可使用胰岛素笔或胰岛素注射辅助装置(如国外已上市有语音提示的胰岛素注射器、帮助准确吸取胰岛素的“胰岛素帽”等产品),从而精确给药剂量。有关胰岛素泵治疗,2019年ADA标准建议大部分成年、儿童及青少年1型糖尿病患者接受胰岛素强化治疗(每天多次注射或使用胰岛素泵)。对于所有儿童和青少年,尤其是7岁以下的儿童,可选择胰岛素泵治疗,但由于尚无足够的循证证据, 未提供具体的治疗方案建议。
5.2 自我血糖监测
2019年ADA标准继续强调了SMBG在糖尿病管理中的重要性(该部分内容在 2018年ADA标准中体现在“血糖控制目标”一章)。多项纳入胰岛素治疗患者的临床试验应用SMBG,证实了强化降糖治疗对于糖尿病并发症的预防和延缓作用[22]。因此,SMBG是胰岛素治疗的患者获得有效治疗的重要组成部分之一。然而,基于最新研究证据,对于不使用胰岛素治疗的2型糖尿病患者,常规SMBG的额外临床获益有限。
5.3 持续葡萄糖监测
该部分对于CGM的应用提供了较为全面的建议。CGM检测的是组织间液葡萄糖浓度,可反映机体葡萄糖代谢情况。CGM分为实时CGM和间歇性扫描式CGM(intermittently scanning continuous glucose monitoring,isCGM)。对于儿童和青少年1型糖尿病患者,无论是每日多次注射或胰岛素泵治疗,均可使用实时CGM以改善血糖控制和降低低血糖风险。对于部分成年1型糖尿病患者,正确使用实时CGM联合胰岛素强化治疗,能够有效降低HbA1c水平。实时CGM对于无症状低血糖和(或)频发低血糖的患者中也是一种有效的工具。同时,实时CGM可有效改善妊娠合并1型糖尿病妊娠女性HbA1c水平以及新生儿的结局。对于需要频繁进行血糖检测的成人糖尿病患者, isCGM可作为SMBG的替代方法。
5.4 胰岛素闭环系统
目前的胰岛素闭环系统可根据葡萄糖水平调整胰岛素剂量,以维持生理性胰岛素水平。该系统由胰岛素泵、CGM传感器及胰岛素输注算法组成。通过胰岛素闭环系统不仅可以停止胰岛素的输注,还可以根据传感器获得的葡萄糖值来调整胰岛素的输注剂量。新的研究证据表明,胰岛素闭环系统的应用可以降低运动相关的低血糖风险[23],并具有社会心理学效益,能帮助使用者减轻心理负担以及缓解对糖尿病的焦虑[24-27]。此外, 2019年ADA标准指出儿童(> 7岁)和成人1型糖尿病患者可应用胰岛素半闭环系统改善血糖控制。
6 S8.2型糖尿病治疗的肥胖管理
本章节为2型糖尿病患者的肥胖管理以及降糖方案提供了在减重治疗方面的建议,包括饮食、行为控制、药物及手术干预等。肥胖管理不仅能延缓糖尿病前期患者向2型糖尿病发展,同时能够改善超重和肥胖的2型糖尿病患者的血糖水平。2019年 ADA标准指出,已有大量的临床研究证据表明与生活方式或药物相比,代谢手术能够有效改善2型糖尿病肥胖患者的血糖控制并降低其心血管疾病发生风险[28]。但对于糖尿病患者是否需要代谢手术治疗,临床团队在考虑糖尿病病情的同时,应更加关注合并症。研究发现,术前可应用某些临床指标进行手术疗效的预测,如年龄小、病程短(< 8年)、未使用胰岛素及血糖控制较好的患者,其术后缓解率高,体重反弹风险小。在此部分,引用了来自中国的循证证据,于浩泳等[29]研究结果表明在中国2型糖尿病患者中,基线腹部内脏脂肪含量较高的患者术后糖尿病缓解率高。
7 S9.降糖药物治疗方案
此章节分为三部分,包括1型糖尿病的药物治疗、1型糖尿病的外科治疗(胰腺和胰岛移植手术)及2型糖尿病的药物治疗,重点是糖尿病药物治疗部分。
对于1型糖尿病的药物治疗,此部分新增胰岛素注射技术内容,强调了胰岛素注射技术在胰岛素剂量和避免并发症(如脂肪营养不良等)方面的重要性。恰当的胰岛素注射技术包括注射合适的部位、注射部位的轮换及对注射部位进行护理以避免感染或其他并发症,同时应避免肌内注射。同时,此部分对于1型糖尿病非胰岛素药物治疗进行了简化,由此更突出了胰岛素在1型糖尿病治疗中的主要作用。
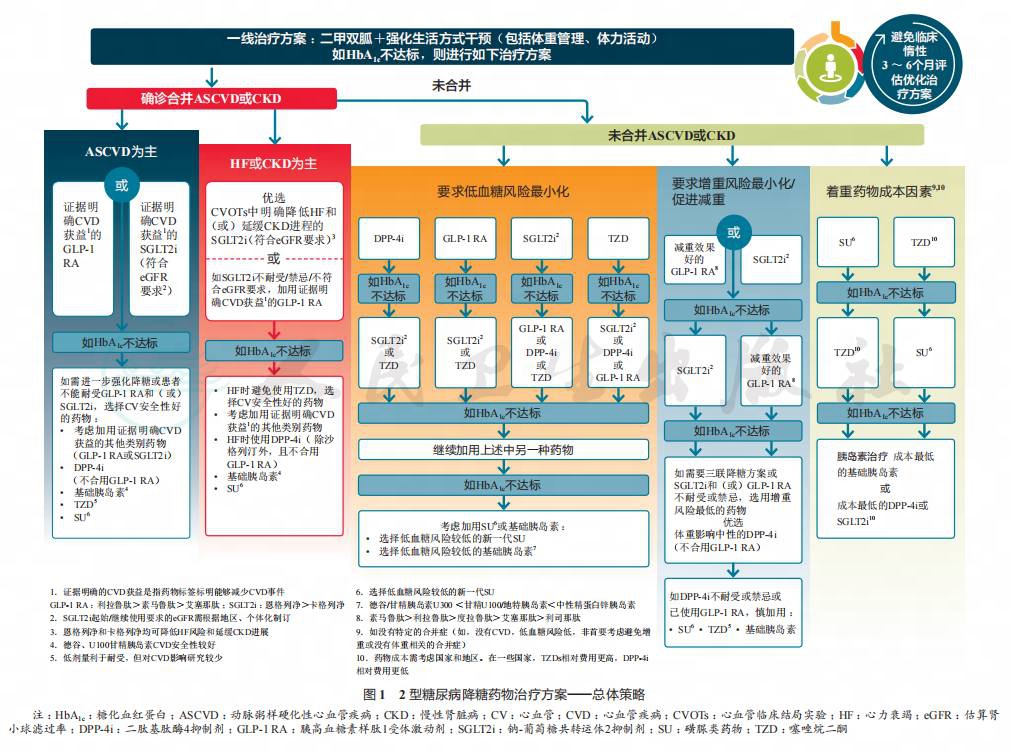
对于2型糖尿病的药物治疗,2019年ADA标准依据2018年10月ADA-EASD 2型糖尿病高血糖管理共识[15]做出了更新(图1),再次强调了以患者为中心的理念,在选择治疗方案时应考虑如下重要因素:①重要合并症,如ASCVD、CKD及HF ;②低血糖风险;③对体重的影响;④不良反应;⑤费用;⑥患者偏好。
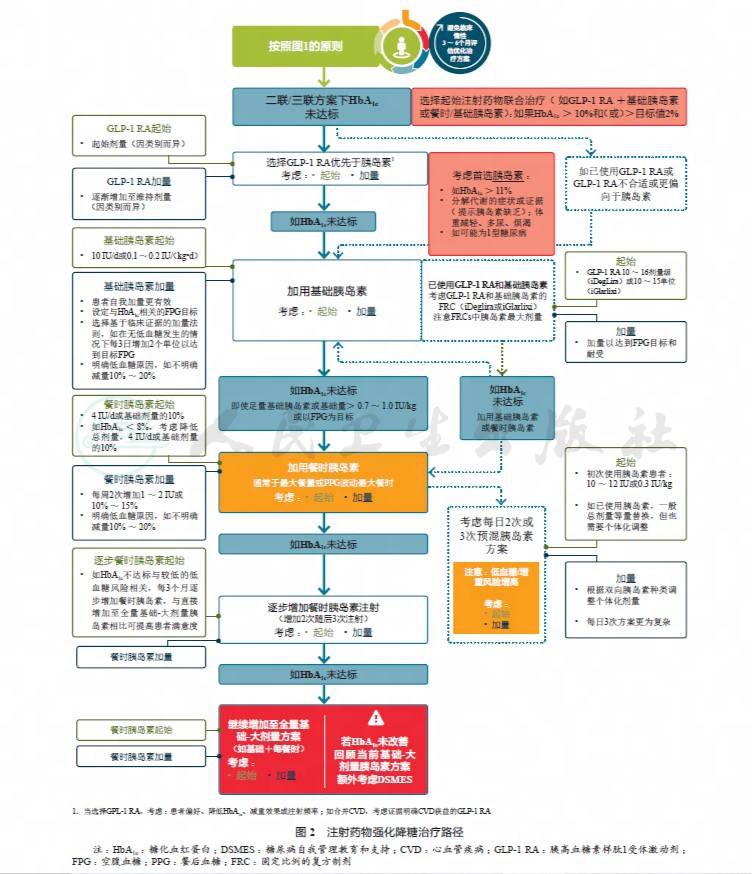
同时,2019年ADA标准更新了注射药物强化降糖治疗路径(图2)。与胰岛素相比,胰高血糖素样肽1受体激动剂(glucagon-like peptide 1 receptor agonists,GLP-1 RAs)虽然有一定的胃肠道不良反应,但其低血糖发生风险较小且能够减轻患者体重。基于研究证据,建议对于需要更有效的注射药物治疗的患者,应在胰岛素前首选GLP-1 RAs。然而,成本较高和耐受问题是GLP-1 RAs推广使用的主要障碍。
8 S10.心血管疾病及危险因素管理
ASCVD是造成糖尿病患者致死、致残的首要因素,并为糖尿病患者带来沉重的经济负担。2019年 ADA标准提出ASCVD风险计算公式的使用(计算公式将糖尿病作为一项风险因素),并指出在确定最佳治疗方案时,应将10年ASCVD风险纳入总体风险评估。另外,基于最新证据,2019年ADA标准指出HF也是导致糖尿病患者死亡的主要心血管疾病之一。
8.1 高血压/血压管理
2019年ADA标准在2018年ADA标准的基础上,完善了降压目标的推荐,强调在制订个体化血压目标时需考虑心血管风险。推荐指出,对于糖尿病伴高血压患者,应通过一项更全面的决策过程来制订个体化的血压目标,需同时考虑心血管风险、降压药物的不良反应以及患者偏好等方面。对于具有较高心血管风险(现有ASCVD 或10年ASCVD风险> 15%)的糖尿病合并高血压患者,降压目标为< 130/80 mmHg ;对于心血管疾病风险较低的患者(10年ASCVD风险< 15%),降压目标为< 140/90 mmHg。延续2018年ADA标准,对于糖尿病合并慢性高血压的妊娠女性,降压目标为120 ~ 160/80 ~ 105 mmHg。
8.2 抗血小板药物
2019年ADA标准沿用2018年ADA标准,推荐将小剂量阿司匹林(75 ~ 162 mg/d)作为有ASCVD病史的糖尿病患者的二级预防策略,若患者对阿司匹林过敏,则可用氯吡格雷(75 mg/d)替代;急性冠状动脉综合征发生后,推荐进行为期 1年的双联抗血小板药物治疗(低剂量阿司匹林和氯吡格雷)。此外,2019年ADA标准指出对于心血管风险增加的1型或2型糖尿病患者,可用阿司匹林进行一级预防(75 ~ 162 mg/d),但需考虑出血风险。
8.3 心血管疾病
2019年ADA标准将该部分由“冠心病”改为“心血管疾病”。根据ADA-EASD共识[15],增加了治疗部分的相关推荐:对于有ASCVD的2 型糖尿病患者,可在降糖治疗中使用钠-葡萄糖共转运体2(sodium–glucose cotransporter 2,SGLT2)抑制剂或GLP-1 RAs ;对于有ASCVD并可能发生 HF的高危患者或已合并HF的患者,首选SGLT2抑制剂。
9 S13.儿童和青少年糖尿病管理
2019年ADA标准强调儿童和青少年糖尿病管理不可按照成人糖尿病的管理方法。儿童及青少年糖尿病的流行病学、病理生理学、疾病发展及治疗效果与成人糖尿病不同,且对于儿童和青少年,1 型糖尿病与2型糖尿病的管理与治疗也有许多不同之处。
1型糖尿病是儿童和青少年最常见的糖尿病类型[30]。在2019年ADA标准中,关于儿童与青少年1 型糖尿病的相关内容包括糖尿病自我管理教育及支持、营养治疗、体力活动与锻炼、学校和儿童护理、社会心理问题、血糖控制、自身免疫情况、心血管疾病风险因素管理以及微血管并发症。青少年1型糖尿病患者出现饮食行为紊乱及障碍的风险增加,这将严重影响糖尿病的治疗以及患者整体的健康。因此,2019年ADA标准建议对青少年1型糖尿病患者从10 ~ 12岁开始进行饮食失调筛查,可利用如糖尿病饮食问题调查问卷-修订版(Diabetes Eating Problems Survey-Revised,DEPS-R)等工具进行早期诊断和干预[31-34]。
2019年ADA标准对于儿童和青少年2型糖尿病的许多细节进行了更新与完善。在诊断和筛查方面,推荐可能诊断为2型糖尿病的超重/肥胖儿童和青少年检测胰腺自身抗体谱,以排除自身免疫性1型糖尿病。同时,该部分新增了有关儿童和青少年2型糖尿病血糖控制目标的内容。2019年ADA标准建议家庭SMBG方案应依据患者药物治疗方案进行个体化定制,且每3个月检测1次HbA1c。对于大多数单纯应用口服药物治疗的儿童和青少年2型糖尿病患者,合理目标为HbA1c < 7%。对于下列情况:糖尿病病程较短、β细胞功能障碍程度轻以及仅调整生活方式或应用二甲双胍治疗体重显著改善的患者,在无低血糖或其他治疗不良反应的情况下,可制订更严格的目标,如HbA1c < 6.5%。同时,对于胰岛素治疗的青少年2型糖尿病患者,由于低血糖发生率相对较低,HbA1c目标应个体化。2019年 ADA标准对于超重青少年糖尿病管理提供了相关指导,超重和肥胖的青少年糖尿病的初始治疗必须纳入考虑范围,由于不同类型糖尿病存在相似的临床表现,一部分青少年2型糖尿病也会出现临床症状严重的酮症酸中毒,因此,在治疗初期往往无法确定糖尿病分型。但无论最终的糖尿病分型如何,初始治疗均应针对高血糖等代谢紊乱,一旦恢复机体代谢平衡并获得胰岛自身抗体结果等临床资料,应及时调整治疗方案。
2019年ADA标准继续强调以患者为中心的理念,提倡在共同决策、综合评估的基础上进行糖尿病患者的个体化管理,且对糖尿病领域应用的新技术予以更多关注,以期为临床医师、研究人员及患者等提供更加科学全面的糖尿病预防、诊治及管理工具。
[1] American Diabetes Association. Standards of Medical Care in Diabetes-2019[J]. Diabetes Care, 2019, 42(Suppl 1):S1-S193.
[2] Selvin E, Wang D, Matsushita K, et al. Prognostic implications of single sample confirmatory testing for undiagnosed diabetes: a prospective cohort study[J]. Ann Intern Med, 2018, 169(3):156-164.
[3] Picón MJ, Murri M, Muñoz A, et al. HemoglobinA1c versus oral glucose tolerance test in postpartum diabetes screening[J]. Diabetes Care, 2012, 35(8):1648-1653.
[4] Göbl CS, Bozkurt L, Yarragudi R, et al. Is early postpartum HbA1c an appropriate risk predictor after pregnancy with gestational diabetes mellitus?[J]. Acta Diabetol, 2014, 51(5):715-722.
[5] Megia A, Näf S, Herranz L, et al. The usefulness of HbA1c in postpartum reclassification of gestational diabetes[J]. BJOG, 2012, 119(7):891-894.
[6] Welsh KJ, Kirkman MS, Sacks DB. Role of Glycated Proteins in the Diagnosis and Management of Diabetes: Research Gaps and Future Directions[J]. Diabetes Care, 2016, 39(8):1299-1306.
[7] Eckhardt BJ, Holzman RS, Kwan CK, et al. Glycated hemoglobin A(1c) as screening for diabetes mellitus in HIV-infected individuals[J]. AIDS Patient Care STDS, 2012, 26(4):197-201.
[8] Kim C, Bullard KM, Herman WH, et al. Association between iron deficiency and A1C levels among adults without diabetes in the National Health and Nutrition Examination Survey, 1999-2006[J]. Diabetes Care, 2010, 33(4):780-785.
[9] Salas-Salvadó J, Bulló M, Babio N, et al. Reduction in the incidence of type 2 diabetes with the Mediterranean diet: results of the PREDIMED-Reus nutrition intervention randomized trial[J]. Diabetes Care, 2011, 34(1):14-19.
[10] Salas-Salvadó J, Guasch-Ferré M, Lee CH, et al. Protective Effects of the Mediterranean Diet on Type 2 Diabetes and Metabolic Syndrome[J]. J Nutr, 2016, 146:920S-927S.
[11] Bloomfield HE, Koeller E, Greer N, et al. Effects on Health Outcomes of a Mediterranean Diet With No Restriction on Fat Intake: A Systematic Review and Meta-analysis[J]. Ann Intern Med, 2016, 165(7):491-500.
[12] Estruch R, Ros E, Salas-Salvadó J, et al. PREDIMED Study Investigators. Primary Prevention of Cardiovascular Disease with a Mediterranean Diet Supplemented with Extra-Virgin Olive Oil or Nuts[J]. N Engl J Med, 2018, 378(25):e34.
[13] Diabetes Prevention Program Research Group. Long-term effects of lifestyle intervention or metformin on diabetes development and microvascular complications over 15-year followup: the Diabetes Prevention Program Outcomes Study[J]. Lancet Diabetes Endocrinol, 2015, 3(11):866-875.
[14] Noto H, Goto A, Tsujimoto T, Noda M. Long-term lowcarbohydrate diets and type 2 diabetes risk: a systematic review and meta-analysis of observational studies[J]. J Gen Fam Med, 2016, 17:60-70.
[15] Davies MJ, D'Alessio DA, Fradkin J, et al. Management of Hyperglycemia in Type 2 Diabetes, 2018. A consensus report by the American Diabetes Association (ADA) and the European Association for the Study of Diabetes (EASD)[J]. Diabetes Care, 2018, 41(12):2669-2701.
[16] Lipska KJ, Ross JS, Wang Y, et al. National trends in US hospital admissions for hyperglycemia and hypoglycemia among Medicare beneficiaries, 1999 to 2011[J]. JAMA Intern Med, 2014, 174(7):1116-1124.
[17] Shorr RI, Ray WA, Daugherty JR, et al. Incidence and risk factors for serious hypoglycemia in older persons using insulin or sulfonylureas[J]. Arch Intern Med, 1997, 157(15):1681-1686.
[18] Abdelhafiz AH, Rodríguez-Mañas L, Morley JE, et al. Hypoglycemia in older people-a less well recognized risk factor for frailty[J]. Aging Dis, 2015, 6(2):156-167.
[19] Yun JS, Ko SH, Ko SH, et al. Presence of macroalbuminuria predicts severe hypoglycemia in patients with type 2 diabetes: a 10-year follow-up study[J]. Diabetes Care, 2013, 36(5):1283-1289.
[20] Chelliah A, Burge MR. Hypoglycaemia in elderly patients with diabetes mellitus: causes and strategies for prevention[J]. Drugs Aging, 2004, 21(8):511-530.
[21] Agiostratidou G, Anhalt H, Ball D, et al. Standardizing Clinically Meaningful Outcome Measures Beyond HbA1c for Type 1 Diabetes: A Consensus Report of the American Association of Clinical Endocrinologists, the American Association of Diabetes Educators, the American Diabetes Association, the Endocrine Society, JDRF International, The Leona M. and Harry B. Helmsley Charitable Trust, the Pediatric Endocrine Society, and the T1D Exchange[J]. Diabetes Care, 2017, 40(12):1622-1630.
[22] Diabetes Control and Complications Trial Research Group, Nathan DM, Genuth S, et al. The effect of intensive treatment of diabetes on the development and progression of long-term complications in insulin-dependent diabetes mellitus[J]. N Engl J Med, 1993, 329(14):977-986.
[23] Sherr JL, Cengiz E, Palerm CC, et al. Reduced hypoglycemia and increased time in target using closed-loop insulin delivery during nights with or without antecedent afternoon exercise in type 1 diabetes[J]. Diabetes Care, 2013, 36(10):2909-2914.
[24] Troncone A, Bonfanti R, Iafusco D, et al. Evaluating the Experience of Children With Type 1 Diabetes and Their Parents Taking Part in an Artificial Pancreas Clinical Trial Over Multiple Days in a Diabetes Camp Setting[J]. Diabetes Care, 2016, 39(12):2158-2164.
[25] Barnard KD, Wysocki T, Allen JM, et al. Closing the loop overnight at home setting: psychosocial impact for adolescents with type 1 diabetes and their parents[J]. BMJ Open Diabetes Res Care, 2014, 2(1):e000025.
[26] Barnard KD, Wysocki T, Thabit H, et al. Psychosocial aspects of closed- and open-loop insulin delivery: closing the loop in adults with type 1 diabetes in the home setting[J]. Diabet Med, 2015, 32(5):601-608.
[27] Weissberg-Benchell J, Hessler D, Polonsky WH, et al. Psychosocial Impact of the Bionic Pancreas During Summer Camp[J]. J Diabetes Sci Technol, 2016, 10(4):840-844.
[28] Schauer PR, Bhatt DL, Kirwan JP, et al. Bariatric surgery versus intensive medical therapy for diabetes--3-year outcomes[J]. N Engl J Med, 2014, 370(21):2002-2013.
[29] Yu H, Di J, Bao Y, et al. Visceral fat area as a new predictor of short-term diabetes remission after Roux-en-Y gastric bypass surgery in Chinese patients with a body mass index less than 35 kg/m2[J]. Surg Obes Relat Dis, 2015, 11(1):6-11.
[30] Mayer-Davis EJ, Lawrence JM, Dabelea D, et al. SEARCH for Diabetes in Youth Study. Incidence Trends of Type 1 and Type 2 Diabetes among Youths, 2002-2012[J]. N Engl J Med, 2017, 376(15):1419-1429.
[31] Markowitz JT, Butler DA, Volkening LK, et al. Brief screening tool for disordered eating in diabetes: internal consistency and external validity in a contemporary sample of pediatric patients with type 1 diabetes[J]. Diabetes Care, 2010, 33(3):495-500.
[32] Goebel-Fabbri AE. Disturbed eating behaviors and eating disorders in type 1 diabetes: clinical significance and treatment recommendations[J]. Curr Diab Rep, 2009, 9(2):133-139.
[33] Atik Altınok Y, Özgür S, Meseri R, et al. Reliability and Validity of the Diabetes Eating Problem Survey in Turkish Children and Adolescents with Type 1 Diabetes Mellitus[J]. J Clin Res Pediatr Endocrinol, 2017, 9(4):323-328.
[34] Saßmann H, Albrecht C, Busse-Widmann P, et al. Psychometric properties of the German version of the Diabetes Eating Problem Survey-Revised: additional benefit of disease-specific screening in adolescents with Type 1 diabetes[J]. Diabet Med, 2015, 32(12):1641-1647.