 去看看
去看看


紫杉类药物是肿瘤化学治疗的基石药物,可用于包括乳腺癌在内的多种肿瘤的治疗。紫杉类药物相关周围神经病变是紫杉类药物的常见不良反应,可导致药物治疗中止,影响药物治疗结局,且严重影响患者的生活质量。《 紫杉类药物相关周围神经病变规范化管理专家共识》针对紫杉类药物相关周围神经病变的发病机制、临床特点、相关危险因素、诊断评估、预防和治疗等展开阐述和推荐。希望可以规范当前国内紫杉类药物相关周围神经病变的管理,提高临床医生对紫杉类药物相关周围神经病变的认识,从而改善患者的治疗结局,提高患者生活质量。
紫杉类药物的抗肿瘤作用于1962年被发现,经历长达30年的研究后,自1992年12月29日起,由美国食品药品监督管理局(Food and Drug Administration,FDA)正式批准用于治疗晚期卵巢癌等多种肿瘤。在中国,获批用于临床的紫杉类药物包括紫杉醇注射液、多西他赛、紫杉醇脂质体和注射用紫杉醇(白蛋白结合型)(以下简称“白蛋白紫杉醇”)。2005年,白蛋白紫杉醇被美国FDA批准用于晚期乳腺癌的治疗,2009年在中国获批上市,是第一个被美国FDA批准的用于乳腺癌治疗的纳米技术药物。临床实践中,紫杉类药物可用于多种肿瘤的治疗,如乳腺癌、卵巢癌、肺癌、胰腺癌等,是肿瘤化学治疗的基石药物。紫杉类药物的出现显著提高了肿瘤患者的生存率,然而,其在治疗过程中也会带来多种短期和长期不良反应,严重影响患者的生活质量,进而影响药物使用的依从性,导致减量或停药,对治疗结局产生不利影响。鉴于此,规范化管理紫杉类药物在肿瘤治疗过程中的毒性至关重要。
化疗致周围神经病变(chemotherapy-induced peripheral neuropathy,CIPN)是化疗药物对周围神经功能造成的损伤,以及产生的一系列神经功能紊乱症状和体征[1]。CIPN是紫杉类药物的常见不良反应,对临床医生和患者都是一种巨大的挑战[2]。即使停止紫杉类药物治疗后,紫杉类药物相关周围神经病变仍可能继续恶化,这一过程被称为“滑行”现象[3]。周围神经病变导致的疼痛、麻木、无力等症状严重影响患者日常生活,降低患者总体生活质量。因此,为帮助临床医生更好地管理紫杉类药物相关周围神经病变,减轻其对患者治疗结局的影响,提高患者的依从性,改善患者生活质量,紫杉类药物相关周围神经病变规范化管理专家共识专家委员会回顾了国际和国内有关紫杉类药物相关周围神经病变的研究资料,广泛征求肿瘤学、神经病学等相关领域专家意见,达成《紫杉类药物相关周围神经病变规范化管理专家共识》(以下简称“本共识”)。
1 紫杉类药物相关周围神经病变的发病机制和临床特点
共识观点:
紫杉类药物相关周围神经病变的发病机制目前尚未完全清楚;已知微管结构紊乱、神经元和非神经元的线粒体受损均与CIPN的发生密切相关。
紫杉类药物相关周围神经病变以感觉症状较为常见,首先出现于足部和手部,主要表现为麻木和刺痛等;运动和自主神经功能损伤的发生率相对较低;各种紫杉类药物相关周围神经病变发生率和缓解时间有所差异。
1.1 发病机制
对于紫杉类药物相关周围神经病变为代表的CIPN,目前研究提示可能的发病机制如下。
1.1.1微管结构紊乱
抑制微管是紫杉类药物抗癌作用的主要机制[4]。紫杉类药物通过抑制微管蛋白解聚,可干扰包括神经元轴突在内的微管稳定性。该机制与CIPN的发生、发展明显相关。
1.1.2 神经元和非神经元的线粒体受损
也是CIPN发生的重要机制[5-10]。紫杉醇可诱发线粒体结构肿胀、空泡形成和结构缺失。
1.1.3轴索变性
研究显示,紫杉类药物可导致周围神经直接损伤、神经纤维缺失和脱髓鞘的发生[4,11-15]。
1.1.4内环境中的钙失衡
紫杉类药物能够使线粒体通透性转换孔激活并导致快速的线粒体去极化,从而干扰线粒体和内质网的Ca2+释放[16,17],进一步导致神经元损伤。
此外,周围神经兴奋性改变[18-21]、免疫过程和神经炎症[22]、背根神经节改变[3]等病理变化均可导致感觉功能障碍和疼痛,参与CIPN的发生。
1.2 临床特点
临床上,紫杉类药物相关周围神经病变主要表现为感觉、运动和自主神经功能缺陷[23]。其中,感觉症状较常见,首先出现于足部和手部,表现为部分感觉异常,如麻木、刺痛、振动觉受损和触觉改变等。此外,自发性的烧灼样、放射性、电击样疼痛,以及机械性/热性痛觉异常或痛觉过度敏感也经常发生[3]。运动症状包括肢体远端无力、精细运动受损和行走不稳。紫杉类药物治疗导致的无力通常会影响四肢。虽然运动症状较感觉症状罕见,但运动障碍可发展为瘫痪并导致显著的生活能力下降。自主神经症状异常的发生率较低,通常表现为直立性低血压、便秘、性功能障碍和排尿困难[24]。
1.3 周围神经病变发生率和缓解时间
临床试验报道显示紫杉类药物说明书获批剂量相关重度(3 级和4级)周围神经病变的发生率为2% ~ 33%[25-33]。一项荟萃分析纳入16项随机对照研究共1340例患者,结果提示紫杉醇脂质体与溶剂型紫杉醇治疗乳腺癌总有效率相当,但紫杉醇脂质体导致的神经系统毒性(周围神经炎)的发生率低于溶剂型紫杉醇(P< 0.05)[34]。重度周围神经病变缓解时间在不同紫杉类药物中有较大差异。周围神经病变症状的快速改善可使患者更快地恢复化疗,因此在选择治疗方案时,外周神经病变的恢复时间也应纳入考虑范围。据报道,白蛋白紫杉醇外周神经病变由3级改善至2级的中位时间为20 ~ 22 d ;多西他赛中位时间为41 d[35] ;紫杉醇注射液中位时间为15 ~ 57 d。
2 紫杉类药物相关周围神经病变的相关危险因素
2.1 药物相关因素
紫杉类药物相关周围神经病变的严重程度与多种因素有关,包括溶剂、剂量和用法等。紫杉醇难溶于水,其溶剂为聚氧乙基代蓖麻油。聚氧乙基代蓖麻油在体内降解时能释放组胺,导致严重的过敏反应。临床前研究已证实聚氧乙基代蓖麻油可导致轴突肿胀、变性和脱髓鞘[36]。这种损伤可能与紫杉醇注射液引起的持续性神经病变有关。紫杉醇脂质体不使用聚氧乙基代蓖麻油作为溶剂,可在一定程度上避免部分溶剂所致神经病变。多西他赛的溶剂为聚山梨酯80(或吐温®80)。聚山梨酯80也可导致神经元囊泡变性[37],诱发神经病变。白蛋白紫杉醇则利用人源白蛋白作为载体,白蛋白浓度与人体浓度相似,增加了紫杉醇的吸收利用度,减少助溶剂引起的毒性,这可能与其降低神经毒性不良反应相关。由于去除了容易引起过敏反应和神经毒性的有机溶剂,白蛋白紫杉醇的用药剂量有了较大增加,且给药时间缩短至30 min。研究证实高的剂量水平和更短的输注时间亦可能增加周围神经病变发生风险[38]。除外溶剂、单次给药剂量和给药时间,治疗持续时间和累积剂量水平等亦与周围神经病变的发生相关[38]。
共识观点:
药物所使用溶剂,如聚氧乙基代蓖麻油和聚山梨酯80与神经毒性发生相关;此外,紫杉类药物的剂量水平(单次和累积剂量)、输注时间和治疗持续时间均与周围神经病变发生相关;年龄、合并症(如糖尿病、甲状腺功能亢进等)、肥胖、吸烟史、饮酒史和神经系统疾病病史等均可能与周围神经病变风险增加相关;
基于目前的研究,尚未有公认的分子生物标志物可以预测CIPN的高危人群。
2.2 患者基线特征相关因素
年龄、合并症(如糖尿病、甲状腺功能亢进等)、肥胖、吸烟史、饮酒史和神经系统疾病病史等均可能与周围神经病变风险增加相关。ECOG 5103研究结果显示,神经病变与患者年龄显著相关(年龄每增加10岁,神经病变风险增加12.9%)[39]。一项针对接受含紫杉类药物辅助治疗乳腺癌患者的ECOG 1199研究发现高血糖和肥胖均与神经病变风险增加相关[40]。众所周知,高血糖会导致周围神经病变。因此,糖尿病患者接受与周围神经病变相关的化疗药物治疗(如紫杉类药物),其发生周围神经病变的风险更高。一项针对晚期非小细胞肺癌患者的Ⅲ期探索性试验发现,合并糖尿病的患者接受紫杉类药物治疗后周围神经毒性发生率显著升高(P < 0.001)[41]。
2.3 遗传和分子标志物
识别神经毒性高风险患者的遗传或分子标志物可能用于预测CIPN的发生,改善患者生活质量。研究发现SK3、NR1I3和UGT2B7 的基因多态性均与紫杉类药物相关神经毒性相关[42,43]。CALGB 40101试验的另一项全基因组关联研究显示FGD4多态性与紫杉类药物治疗患者早期发生周围神经病变有关。在同一研究中,EPHA5 和FZD3也被确定为外周感觉神经病变发病和严重程度的潜在相关危险因素[44]。此外,ABCB1、GSTP1、 CYP2C8、CYP3A4、CYP3A5和FGD4等基因的多态性均可能与CIPN风险增加相关[45,46]。然而,基于目前的研究,尚未有公认可靠的生物标志物来预测哪些患者是CIPN的高危人群。
3 紫杉类药物相关周围神经病变的诊断和评估
共识观点:
紫杉类药物治疗开始前,须记录患者既往史、合并症及其治疗情况;此外,还需进行神经系统检查,记录可能存在的任何感觉和运动异常。紫杉类药物相关周围神经病变主要临床特征包括:①肢体远端感觉受累为主,符合长度依赖性特点(例如手套和长袜分布);②病变出现与紫杉类药物使用有时相关系,包括用药后发病、停药减轻、再用加重;③紫杉类药物相关周围神经病变需与多种其他原因导致的周围神经病相鉴别。
紫杉类药物相关周围神经病变严重程度评估包括基于医生的评估和基于患者的评估两方面。
3.1 诊断和鉴别诊断
一般来说,CIPN的发生是逐渐进展的,但也有部分患者在接受化疗后突然发病。紫杉类药物相关周围神经病变的主要临床特征如下[47]。①远端受累为主的多发性周围神经病变,符合长度依赖性特点(例如手套和长袜分布);②病变呈对称性分布;③在给予神经毒性化疗药物后发病,临床过程表现为:起病缓慢,病初感觉症状可有暂时性缓解,之后可表现为进行性加重(轴突损害)或感觉症状在开始化疗后急性发生、发展(神经元病);④临床主要表现为感觉神经受累的症状和体征,包括感觉异常、感觉迟钝、感觉减退、感觉过敏和疼痛;⑤运动功能相对保留,部分患者可伴有轻度至中度肢体无力,在感觉病变分布区可有肌肉萎缩。周围神经病变的出现与紫杉类药物使用的时相关系,包括用药后发病、停药减轻、再用药时加重等,是确诊紫杉类药物引起周围神经病变的主要依据。
神经电生理的发展使CIPN的诊断和评估有了更为客观的指标,但是CIPN的诊断还需结合患者临床症状、体征和神经电生理结果综合分析。神经电生理评估一般包括神经传导(nerve conduction study,NCS)和针电极肌电图,其中NCS具有更高的诊断价值。NCS对感觉和运动纤维病变的评估具有无创性、标准化、敏感度高的特点。因此,NCS 是CIPN综合诊断中的一种方法[48]。
紫杉类药物相关周围神经病变须与多种其他原因导致的周围神经病相鉴别。①肿瘤本身相关的副肿瘤综合征:可表现为感觉神经元病或慢性感觉运动性周围神经病。②营养缺乏相关周围神经病:由于肿瘤消耗或其他因素导致的营养摄入不足,也可导致多发性远端型周围神经病的发生。③糖尿病性周围神经病变:由于糖尿病患病率较高,肿瘤患者常可伴有糖尿病,部分患者在肿瘤发生前可能已经存在周围神经病,也需加以鉴别[47](主要鉴别要点见表1)。

因此,在开始紫杉类药物化疗前,应充分评估患者是否存在可能混淆或加重CIPN严重程度的既往史和合并症,包括糖尿病、人类免疫缺陷病毒感染、营养缺乏、酒精中毒、周围神经病病史、遗传性周围神经病家族史等。既往药物治疗史和合并治疗用药史也很重要,许多常见的药物,包括甲硝唑、秋水仙碱、柳氮磺吡啶、他克莫司、核苷类似物、肼屈嗪和双硫仑等均有导致周围神经病变的报道[47]。此外,在开始紫杉类药物化疗前,医生需对患者进行神经系统检查,记录可能存在的任何感觉和运动异常并作为基线资料。在已有神经系统疾病的患者中,神经科医生的专科评价可能对这类患者的未来管理非常重要。
3.2 紫杉类药物相关周围神经病变的评估
3.2.1 基于医生的评估
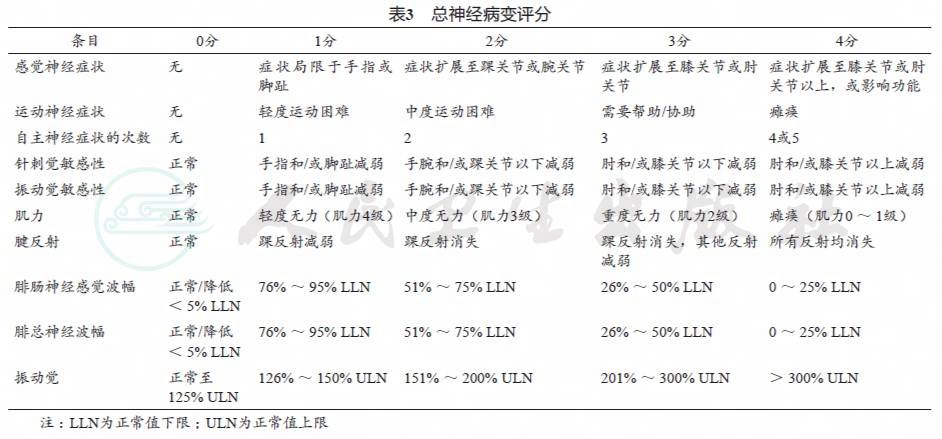
临床常使用量表对CIPN进行评估,最常见基于临床医生的CIPN评估采用美国国家癌症研究所常见不良反应术语评定标准(National Cancer Institute-Common Terminology Criteria for Adv erse Events,NCI-CTCAE)(表2)。然而NCI-CTCAE 尚存在不足之处,包括缺乏对具有临床意义的CIPN 描述的参考,以及未能给出每个等级区分的具体标准或参数来进行分级。也有学者担心,该量表不能充分记录CIPN的某些方面,如CIPN相关疼痛。总神经病变评分(total neuropathy score,TNS)由约翰霍普金斯大学研发(表3),是一项较大范围(0~40 分)的综合评分,该量表将症状评分与感觉缺失和神经电生理参数的客观评分相结合进行评价。

3.2.2 基于患者的评估
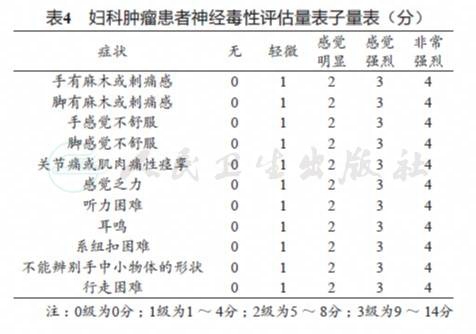
较常用于评估紫杉类药物诱导的周围神经病变的患者评估量表包括妇科肿瘤患者神经毒性评估量表(functional assessment of cancer therapy/gynaecologic oncology group-neurotoxicity,FACT/GOG-Ntx)(表4)和患者神经毒性问卷(patient neurotoxicity questionnaire,PNQ)(表5)。FACT/GOG-Ntx一般与生活质量评估量表(functional assessment of cancer therapy/gynaecologic oncology group-neurotoxicity-general,FACT-G)联合使用。FACT/GOG-Ntx包括11个条目,总分为44分,是专门测量化疗引起的神经毒性工具。PNQ包括2 个条目,分别主观描述感觉和运动神经障碍的发生率和严重程度,评分分为A ~ E,其中得分在D之后,则表明神经毒性症状影响日常生活活动。此外,数字评价量表(numerical rating scale,NRS)评分也可用于患者外周神经毒性的评估。NRS将疼痛程度用0~10共11个数字表示,0表示无痛,10表示最痛。被测者根据个人疼痛感受选择一个数字代表其疼痛程度。

4 紫杉类药物相关周围神经病变的预防
4.1 加压手套/冰手套
根据1725例丹麦早期乳腺癌患者关于周围神经病变的研究分析表明,治疗期间使用冰手套和袜子,其周围神经病变发生率显著降低(OR = 0.56 ;95%CI :0.38 ~ 0.81)[49]。另一项多中心Ⅱ期临床试验分析了外科手套的作用,其对比了穿戴双层小一码的外科手套(SG)和双层合适外科手套或不穿戴外科手套的周围神经病变发生率。结果显示,受SG保护的试验手较对照手神经毒性发生率明显降低(感觉神经病变:21.4% ∶76.1%;运动神经病变:26.2% ∶ 57.1%)[50]。另外,2018年圣安东尼奥乳腺癌研讨会上发布的纳入16家临床试验机构的研究摘要亦证实穿戴冰手套/袜子治疗患者CIPN发生率显著降低[51]。
共识观点:
已有研究证实加压手套/冰手套可显著减少周围神经病变的发生,且患者耐受性良好,可用于紫杉类药物相关周围神经病变的预防;药物预防目前尚缺乏大型随机对照试验证据。
4.2 药物预防
早期关于紫杉类药物致周围神经病变预防相关的药物研究主要包括乙酰左旋肉碱、谷胱甘肽、维生素E等。然而这些药物在预防CIPN 的研究中尚存在很多局限性,包括证据级别低、样本量小、缺乏安慰剂对照以及在某些情况下为非随机研究设计,甚至不同临床试验的数据是相互矛盾的。目前仍有大量研究致力于发现可用于预防CIPN 的药物。目前许多针对新的有前景的靶点的临床试验正在进行中,乙氧基鸟苷通过HSP 90调节防止紫杉醇和顺铂诱导的远端轴突变性[52],而不影响抗肿瘤疗效,目前正在进行临床试验。此外,Bcl2蛋白家族,包括Bclw,可能在紫杉醇引起的轴突变性中发挥作用。Bclw可通过影响神经元上的IP3受体活性而预防化疗诱导的神经变性。因此,调节Bclw水平可能是预防CIPN的另一种新的治疗策略[53]。有研究显示氨磷汀[54]、单唾液酸四己糖神经节苷脂(monosialotetrahexosylganglioside,GM1)对减轻神经毒性有一定作用[55,56],但GM1不良反应多,临床使用尚需更多研究证实。此外,中医在CIPN的预防中也有一定作用。张振等[57]证实补阳还五汤膏剂可减轻紫杉醇方案化疗致外周神经毒性。补阳还五汤为中医益气活血的代表方剂,临床可用于气虚血瘀证CIPN患者。
5 紫杉类药物相关周围神经病变的处理
5.1 紫杉类药物剂量调整
周围神经病变的主要管理方法为降低化疗药物剂量和/或延长用药间隔周期。如果周围神经病变不可耐受,则需停止用药。调整剂量和用药时间是最主要的干预措施。紫杉类药物治疗期间患者出现1级或2级周围神经病变一般无需调整剂量,如出现3级以上周围神经病变可以个体化判断是否需要停止治疗,直至恢复至2级或小于2级,并需在后续治疗中降低用药剂量。对于经紫杉醇注射液治疗发生重度周围神经病变的患者,建议所有后续疗程的剂量降低20%。对于经多西他赛治疗发生3/4级周围神经病变的患者,多西他赛的剂量应由100 mg/m2减至75 mg/m2和/或由75 mg/m2减至60 mg/m2。若患者在60 mg/m2剂量时仍出现重度周围神经病变,则应停止治疗。白蛋白紫杉醇260 mg/m2 3周方案治疗乳腺癌的剂量调整方法为:初次出现严重感觉神经病变,后续疗程减量至220 mg/m2;再次出现严重感觉神经病变,后续疗程减量至180 mg/m2。白蛋白紫杉醇100 mg/m2单周方案治疗非小细胞肺癌和125 mg/m2单周方案治疗胰腺癌时,如患者出现重度周围神经病变,建议所有后续疗程的剂量降低25 mg/m2。
共识观点:
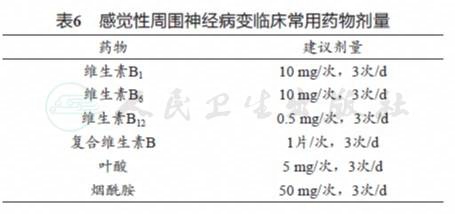
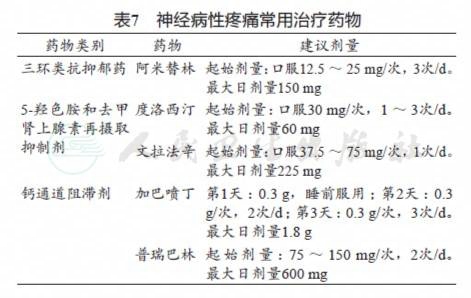
1级或2级周围神经病变一般无需调整剂量,3级或4级周围神经病变主要管理方法为降低化疗药物剂量和/或延长用药间隔周期。感觉异常周围神经病可使用的药物包括B族维生素(维生素B1、B6、B12和复合维生素B)、叶酸和烟酰胺。神经病理性疼痛可使用的药物包括三环类抗抑郁药(阿米替林)、5-羟色胺和去甲肾上腺素再摄取抑制剂(度洛西汀和文拉法辛)和钙通道阻滞剂(加巴喷丁和普瑞巴林)。
5.2 药物治疗
外周神经病变的症状主要为感觉异常和神经病理性疼痛。感觉异常周围神经病通常使用营养神经药物改善临床症状。虽然神经营养类药物在治疗紫杉类药物引起的感觉异常周围神经病中的作用仍存争议,但临床有一定治疗效果。感觉异常周围神经病患者可用药物包括B族维生素(维生素B1、B6、B12和复合维生素B)、叶酸和烟酰胺(表6)。神经病理性疼痛推荐药物包括三环类抗抑郁药(阿米替林)、5-羟色胺、去甲肾上腺素再摄取抑制剂(度洛西汀和文拉法辛)和钙通道阻滞剂(加巴喷丁和普瑞巴林)(表7)[58]。神经痛的治疗对于改善患者生活质量非常重要,美国临床肿瘤学会(American Society of Clinical Oncology,ASCO)指南认为度洛西汀治疗CIPN相关神经性疼痛可获得目前最佳的数据支持[59]。Smith等[60]在一项多中心、随机、双盲、交叉试验研究中证实初始接受度洛西汀治疗的患者疼痛评分显著低于初始接受安慰剂治疗的患者。基于此项临床研究结果,ASCO临床实践指南适度推荐度洛西汀用于治疗CIPN。近期在中国开展的一项前瞻性研究亦证实度洛西汀在预防 CIPN方面具有很好的效果(OR = 5.426 ;95%CI : 1.898 ~ 15.514 ;P = 0.002)[61]。目前一些新的治疗神经痛的药物也在研发中。氯沙坦是一种血管紧张素Ⅱ1型受体拮抗剂,在大鼠模型中已证实其可通过抑制背根神经节中的炎性细胞因子产生,减轻化疗诱导的神经性疼痛[62]。此外,电针也被证实可减轻紫杉醇化疗引起的神经性疼痛。然而,新的治疗方法仍需大型对照研究证实[63]。
5.3 其他
现代中医学家认为CIPN相当于“ 痹证”,治法以益气温经、养血活血、逐瘀通络、健脾益肾等为主,包括口服中药、静脉滴注等内治法和中药熏洗、针灸等外治及内外治结合的方法。近期亦有研究证实针灸可减轻紫杉醇化疗引起的周围神经病变的严重程度。该研究中37例患者进展为Ⅱ级CIPN,28例进入干预阶段,其中1例因违背方案而剔除。在接受针灸治疗的27例患者中,26例完成紫杉醇治疗,均未发生Ⅲ级CIPN[64]。然而该研究仍存在一定的局限性,其为非随机对照试验,且未观察在重度CIPN患者中针灸是否可改善CIPN症状。目前中医治疗CIPN也处于探索阶段。
6 紫杉类药物相关周围神经病变的教育和护理
共识观点:
通过患者教育以减轻神经病变引起的继发性损伤。鼓励患者在接受治疗时,有任何手足麻木、刺痛症状及时向医生报告。周围神经病变会增加患者跌倒风险,应做好防跌倒教育和护理。
由于缺乏有效的CIPN治疗方法,因此患者教育策略成为更多关注的焦点,以减轻神经病变引起的继发性损伤。目前,鼓励患者在接受治疗时,有任何手足麻木、刺痛症状及时向医生报告,对于防止神经病变加重十分重要。教育患者发现早期周围神经病变的方法以避免因感觉缺失、位置觉减退、感觉性共济失调引起摔伤。对于手足麻木患者需教育其做到五防:防跌倒、防磕碰、防烫伤、防冻伤、防锐器伤。预防意外发生的教育主要包括:①鞋和衣裤选择。鞋,外出和居室内均选择包住足趾和足跟的平底鞋,禁止穿高跟鞋、松糕鞋或拖鞋外出;裤,长短、肥瘦适中,腰带松紧适度,防止过长、脱落绊倒。②预防烫伤。避免接触热源(开水、热锅、明火等),使用热水可以让家属协助,无人协助时先倒入凉水,再兑入热水,夏季中午炎热时避免长时间在户外,防止晒伤。③预防冻伤。冬季保暖,洗漱尽量使用温水,外出可以戴手套、穿厚袜子,禁止长时间触摸冷冻的物品,寒冷地方减少直接接触铁质物品。④防锐器伤。避免使用剪刀、水果刀等锐器,必须使用时可以让家属帮助。⑤饮食。选择易于消化并富有营养的软食,补充维生素B1含量高的食物,如胚粉、大麦、青稞、小米等杂粮,大豆等豆类,白菜和坚果等。
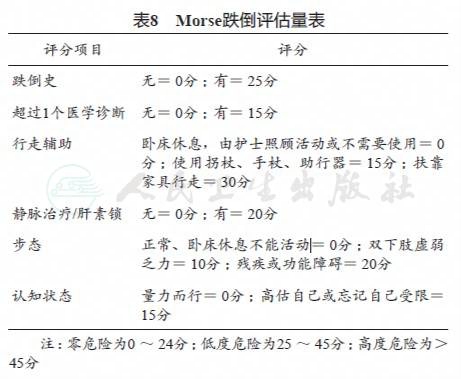
此外,CIPN是增加跌倒风险的重要因素,20% 的患者在化疗期间可发生跌倒。发生跌倒的患者报告的神经病变症状更严重,伴有与神经病变程度相关的更严重的功能障碍。推荐使用Morse跌倒评估量表(表8)对患者进行跌倒评估。对于有跌倒风险的患者实施如下护理,①一般护理措施:加强巡视,及时发现并满足患者需求;固定床、轮椅、座椅等设施;指导患者正确用药,告知用药后的反应;告知患者寻求帮助的方法。②环境预防:提供足够的灯光;将物品放置于患者易取处;保持房间地面清洁干燥;清除病房、床旁和通道障碍。③健康教育:穿着舒适的鞋和衣裤;患者活动时有人陪伴;指导渐进下床的方法;告知安全使用便器的方法;指导呼叫器使用。
参与共识编写和讨论的专家(按姓氏拼音排序):
曹文明 浙江省肿瘤医院
崔丽英 中国医学科学院北京协和医院
崔久嵬 吉林大学第一医院
杜彩文 中国医学科学院肿瘤医院深圳医院
樊 英 国家癌症中心/中国医学科学院肿瘤医院
冯继锋 江苏省肿瘤医院
关 印 首都医科大学附属北京朝阳医院
何 蕾 中山大学孙逸仙纪念医院
侯 炜 中国中医科学院广安门医院
胡夕春 复旦大学附属肿瘤医院
霍 明 日本姬路独协大学
贾 旺 首都医科大学附属北京天坛医院
姜 愚 四川大学华西医院
黎 莉 山东大学齐鲁医院
李 冰 北京大学第六医院
李 青 国家癌症中心/中国医学科学院肿瘤医院
李德岭 首都医科大学附属北京天坛医院
李国辉 国家癌症中心/中国医学科学院肿瘤医院
李惠平 北京大学肿瘤医院
刘 慧 河南省人民医院
刘 健 福建省肿瘤医院
刘明生 中国医学科学院北京协和医院
罗 扬 国家癌症中心/中国医学科学院肿瘤医院
罗志国 复旦大学附属肿瘤医院
马 飞 国家癌症中心/中国医学科学院肿瘤医院
梅志红 国家癌症中心/中国医学科学院肿瘤医院
牛婧雯 中国医学科学院北京协和医院
欧阳取长 湖南省肿瘤医院
彭 英 中山大学孙逸仙纪念医院
孙 涛 辽宁省肿瘤医院
孙晓莹 国家癌症中心/中国医学科学院肿瘤医院
佟仲生 天津医科大学肿瘤医院
万冬桂 中日友好医院
王树森 中山大学肿瘤防治中心
王先明 深圳市第二人民医院
王晓稼 浙江省肿瘤医院
徐兵河 国家癌症中心/中国医学科学院肿瘤医院
杨 谨 西安交通大学第一附属医院
杨俊兰 中国人民解放军总医院
姚和瑞 中山大学孙逸仙纪念医院
殷咏梅 江苏省人民医院
袁中玉 中山大学肿瘤防治中心
张清媛 哈尔滨医科大学附属肿瘤医院
赵 林 中国医学科学院北京协和医院
赵久达 青海大学附属医院
共识执笔人:
马 飞 国家癌症中心/中国医学科学院肿瘤医院
刘明生 中国医学科学院北京协和医院
王佳妮 国家癌症中心/中国医学科学院肿瘤医院
李逸群 国家癌症中心/中国医学科学院肿瘤医院
[1] Trecarichi A, Flatters SJL. Mitochondrial dysfunction in the pathogenesis of chemotherapy-induced peripheral neuropathy[J]. Int Rev Neurobiol, 2019, 145:83-126.
[2] Zang X, Lee JB, Deshpande K, et al. Prevention of paclitaxel-induced neuropathy by formulation approach[J]. J Control Release, 2019, 303:109-116.
[3] Flatters SJL, Dougherty PM, Colvin LA. Clinical and preclinical perspectives on Chemotherapy-Induced Peripheral Neuropathy (CIPN): a narrative review[J]. Br J Anaesth, 2017, 119(4):737-749.
[4] Gornstein EL, Schwarz TL. Neurotoxic mechanisms of paclitaxel are local to the distal axon and independent of transport defects[J]. Exp Neurol, 2017, 288:153-166.
[5] Flatters SJ, Bennett GJ. Studies of peripheral sensory nerves in paclitaxel-induced painful peripheral neuropathy: evidence for mitochondrial dysfunction[J]. Pain, 2006, 122(3):245-257.
[6] Xiao WH, Bennett GJ. Effects of mitochondrial poisons on the neuropathic pain produced by the chemotherapeutic agents, paclitaxel and oxaliplatin[J]. Pain, 2012, 153(3):704-709.
[7] Areti A, Yerra VG, Naidu V, et al. Oxidative stress and nerve damage: role in chemotherapy induced peripheral neuropathy[J]. Redox Biol, 2014, 2:289-295.
[8] Bulua AC, Simon A, Maddipati R, et al. Mitochondrial reactive oxygen species promote production of proinflammatory cytokines and are elevated in TNFR1-associated periodic syndrome (TRAPS)[J]. J Exp Med, 2011, 208(3):519-533.
[9] Griffiths LA, Flatters SJ. Pharmacological Modulation of the Mitoch ondrial Electron Transport Chain in Paclitaxel-Induced Painful Peripheral Neuropathy[J]. J Pain, 2015, 16(10):981-994.
[10] Duggett NA, Griffiths LA, Flatters SJL. Paclitaxel-induced painful neuropathy is associated with changes in mitochondrial bioenergetics, glycolysis, and an energy deficit in dorsal root ganglia neurons[J]. Pain, 2017, 158(8):1499-1508.
[11] Sahenk Z, Barohn R, New P, et al. Taxol neuropathy. Electrodiagnostic and sural nerve biopsy findings[J]. Arch Neurol, 1994, 51(7):726-729.
[12] Boehmerle W, Huehnchen P, Peruzzaro S, et al. Electrophy-siological, behavioral and histological characterization of paclitaxel, cisplatin, vincristine and bortezomib-induced neuropathy in C57Bl/6 mice[J]. Sci Rep, 2014, 4:6370.
[13] Siau C, Xiao W, Bennett GJ. Paclitaxel- and vincristine-evoked painful peripheral neuropathies: loss of epidermal innervation and activation of Langerhans cells[J]. Exp Neurol, 2006, 201(2):507-514.
[14] Gornstein E, Schwarz TL. The paradox of paclitaxel neurotoxicity: Mechanisms and unanswered questions[J]. Neuropharmacology, 2014, 76 Pt A:175-183.
[15] Boyette-Davis J, Xin W, Zhang H, et al. Intraepidermal nerve fiber loss corresponds to the development of taxol-induced hyperalgesia and can be prevented by treatment with minocycline[J]. Pain, 2011, 152(2):308-313.
[16] Kidd JF, Pilkington MF, Schell MJ, et al. Paclitaxel affects cytosolic calcium signals by opening the mitochondrial perme ab ility transition pore[J]. J Biol Chem, 2002, 277(8):6504-6510.
[17] Mironov SL, Ivannikov MV, Johansson M. [Ca2+]i signaling between mitochondria and endoplasmic reticulum in neurons is regulated by microtubules. From mitochondrial permeability transition pore to Ca2+-induced Ca2+ release[J]. J Biol Chem, 2005, 280(1):715-721.
[18] Li Y, North RY, Rhines LD, et al. DRG Voltage-Gated Sodium Channel 1.7 Is Upregulated in Paclitaxel-Induced Neuropathy in Rats and in Humans with Neuropathic Pain[J]. J Neurosci, 2018, 38(5):1124-1136.
[19] Aromolaran KA, Goldstein PA. Ion channels and neuronal hyperexcitability in chemotherapy-induced peripheral neuropathy; cause and effect?[J]. Mol Pain, 2017, 13:1744806917714693.
[20] Ghelardini C, Desaphy JF, Muraglia M, et al. Effects of a new potent analog of tocainide on hNav1.7 sodium channels and in vivo neuropathic pain models[J]. Neuroscience, 2010, 169(2):863-873.
[21] Zhang H, Dougherty PM. Enhanced excitability of primary sensory neurons and altered gene expression of neuronal ion channels in dorsal root ganglion in paclitaxel-induced peripheral neuropathy[J]. Anesthesiology, 2014, 120(6):1463-1475.
[22] Zaks-Zilberman M, Zaks TZ, Vogel SN. Induction of proinflammatory and chemokine genes by lipopolysaccharide and paclitaxel (Taxol) in murine and human breast cancer cell lines[J]. Cytokine, 2001, 15(3):156-165.
[23] De Iuliis F, Taglieri L, Salerno G, et al. Taxane induced neuropathy in patients affected by breast cancer: Literature review[J]. Crit Rev Oncol Hematol, 2015, 96(1):34-45.
[24] Mols F, van de Poll-Franse LV, Vreugdenhil G, et al. Reference data of the European Organisation for Research and Treatment of Cancer (EORTC) QLQ-CIPN20 Questionnaire in the general Dutch population[J]. Eur J Cancer, 2016, 69:28-38.
[25] Mahner S, Meier W, du Bois A, et al. Carboplatin and pegylated liposomal doxorubicin versus carboplatin and paclitaxel in very platinum-sensitive ovarian cancer patients: results from a subset analysis of the CALYPSO phase Ⅲ trial[J]. Eur J Cancer, 2015, 51(3):352-358.
[26] Winer EP, Berry DA, Woolf S, et al. Failure of higher-dose paclitaxel to improve outcome in patients with metastatic breast cancer: cancer and leukemia group B trial 9342[J]. J Clin Oncol, 2004, 22(11):2061-2068.
[27] Rivera E, Mejia JA, Arun BK, et al. Phase 3 study comparing the use of docetaxel on an every-3-week versus weekly schedule in the treatment of metastatic breast cancer[J]. Cancer, 2008, 112(7):1455-1461.
[28] 张丹华,周恩相.紫杉醇注射液、紫杉醇脂质体以及多西他赛治疗乳腺癌的疗效及安全性[J].中国癌症杂志,2013,23(12):1014-1016.
[29] Van Cutsem E, Moiseyenko VM, Tjulandin S, et al. Phase Ⅲ study of docetaxel and cisplatin plus fluorouracil compared with cisplatin and fluorouracil as first-line therapy for advanced gastric cancer: a report of the V325 Study Group[J]. J Clin Oncol, 2006, 24(31):4991-4997.
[30] Gradishar WJ, Tjulandin S, Davidson N, et al. Phase Ⅲ trial of nanoparticle albumin-bound paclitaxel compared with polyethylated castor oil-based paclitaxel in women with breast cancer[J]. J Clin Oncol, 2005, 23(31):7794-7803.
[31] Socinski MA, Bondarenko I, Karaseva NA, et al. Weekly nab-paclitaxel in combination with carboplatin versus solvent-based paclitaxel plus carboplatin as first-line therapy in patients with advanced non-small-cell lung cancer: final results of a phase Ⅲ trial[J]. J Clin Oncol, 2012, 30(17):2055-2062.
[32] Xu R, Yu X, Hao J, et al. Efficacy and safety of weekly nab-paclitaxel plus gemcitabine in Chinese patients with metastatic adeno carcinoma of the pancreas: a phase Ⅱ study[J]. BMC Cancer, 2017, 17(1):885.
[33] Tabernero J, Climent MA, Lluch A, et al. A multicentre, rando-mised phase Ⅱ study of weekly or 3-weekly docetaxel in patients with metastatic breast cancer[J]. Ann Oncol, 2004, 15(9):1358-1365.
[34] 田璐,谭力铭,王宏强.紫杉醇脂质体与紫杉醇治疗乳腺癌有效性和安全性的Meta分析[J].中国药师,2019,22(1):97-101,105.
[35] Gradishar WJ, Krasnojon D, Cheporov S, et al. Phase Ⅱ trial of nab-paclitaxel compared with docetaxel as first-line chemotherapy in patients with metastatic breast cancer: final analysis of overall survival[J]. Clin Breast Cancer, 2012, 12(5):313-321.
[36] Windebank AJ, Blexrud MD, de Groen PC. Potential neurotoxicity of the solvent vehicle for cyclosporine[J]. J Pharmacol Exp Ther, 1994, 268(2):1051-1056.
[37] ten Tije AJ, Verweij J, Loos WJ, et al. Pharmacological effects of formulation vehicles: implications for cancer chemot herapy[J]. Clin Pharmacokinet, 2003, 42(7):665-685.
[38] Park SB, Goldstein D, Krishnan AV, et al. Chemotherapyinduced peripheral neurotoxicity: a critical analysis[J]. CA Cancer J Clin, 2013, 63(6):419-437.
[39] Rivera E, Cianfrocca M. Overview of neuropathy associated with taxanes for the treatment of metastatic breast cancer[J]. Cancer Chemother Pharmacol, 2015, 75(4):659-670.
[40] Schneider BP, Zhao F, Wang M, et al. Neuropathy is not associated with clinical outcomes in patients receiving adjuvant taxane-containing therapy for operable breast cancer[J]. J Clin Oncol, 2012, 30(25):3051-3057.
[41] Hirsh V, Owen S, Ko A, et al. Nab-paclitaxel in combination with carboplatin as first-line therapy in diabetic patients with advanced non-small cell lung cancer (NSCLC)[J]. J Thoracic Oncol, 2013, 8:S584.
[42] Rua C, Gueguinou M, Soubai I, et al. SK3 Gene Polymorphism Is Associated with Taxane Neurotoxicity and Cell Calcium Homeostasis[J]. Clin Cancer Res, 2018, 24(21):5313-5320.
[43] Arbitrio M, Scionti F, Altomare E, et al. Polymorphic Variants in NR1I3 and UGT2B7 Predict Taxane Neurotoxicity and Have Prognostic Relevance in Patients With Breast Cancer: A CaseControl Study[J]. Clin Pharmacol Ther, 2019, 106(2):422-431.
[44] Baldwin RM, Owzar K, Zembutsu H, et al. A genome-wide association study identifies novel loci for paclitaxel-induced sensory peripheral neuropathy in CALGB 40101[J]. Clin Cancer Res, 2012, 18(18):5099-5109.
[45] Brewer JR, Morrison G, Dolan ME, et al. Chemotherapyinduced peripheral neuropathy: Current status and progress[J]. Gynecol Oncol, 2016, 140(1):176-183.
[46] Mir O, Alexandre J, Tran A, et al. Relationship between GSTP1 Ile(105)Val polymorphism and docetaxel-induced peripheral neuropathy: clinical evidence of a role of oxidative stress in taxane toxicity[J]. Ann Oncol, 2009, 20(4):736-740.
[47] Hausheer FH, Schilsky RL, Bain S, et al. Diagnosis, management, and evaluation of chemotherapy-induced peripheral neuropathy[J]. Semin Oncol, 2006, 33(1):15-49.
[48] England JD, Gronseth GS, Franklin G, et al. Distal symmetric polyneuropathy: a definition for clinical research: report of the American Academy of Neurology, the American Association of Electrodiagnostic Medicine, and the American Academy of Physical Medicine and Rehabilitation[J]. Neurology, 2005, 64(2):199-207.
[49] Eckhoff L, Knoop AS, Jensen MB, et al. Risk of docetaxelinduced peripheral neuropathy among 1,725 Danish patients with early stage breast cancer[J]. Breast Cancer Res Treat, 2013, 142(1):109-118.
[50] Tsuyuki S, Senda N, Kanng Y, et al. Evaluation of the effect of compression therapy using surgical gloves on nanoparticle albumin-bound paclitaxel-induced peripheral neuropathy: a phase Ⅱ multicenter study by the Kamigata Breast Cancer Study Group[J]. Breast Cancer Res Treat, 2016, 160(1):61-67.
[51] Yamashita T, Hattori M, Nakada T, et al. Subjective and objective assessment of efficacy of frozen gloves and socks to prevent nab-paclitaxel-induced peripheral neuropathy in patients with breast cancer[EB/OL]. [2020-01-15] https:// cancerres.aacrjournals.org/content/79/4_Supplement/P4-11-02.
[52] Zhu J, Carozzi VA, Reed N, et al. Ethoxyquin provides neuroprotection against cisplatin-induced neurotoxicity[J]. Sci Rep, 2016, 6:28861.
[53] Pease-Raissi SE, Pazyra-Murphy MF, Li Y, et al. Paclitaxel Reduces Axonal Bclw to Initiate IP3R1-Dependent Axon Degeneration[J]. Neuron, 2017, 96(2):373-386. e6.
[54] Penz M, Kornek GV, Raderer M, et al. Subcutaneous administration of amifostine: A promising therapeutic option in patients with oxaliplatin related peripheral senstive neuropathy[J]. Ann Oncol, 2001, 2(3):421-422.
[55] Su Y, Huang J, Wang S, et al. The Effects of GangliosideMonosialic Acid in Taxane-induced Peripheral Neurotoxicity in Patients with Breast Cancer: A Randomized Trial[J]. J Natl Cancer Inst, 2019. [Epub ahead of print]
[56] Zhu Y, Yang J, Jiao S, et al. Ganglioside-monosialic acid (GM1) prevents oxaliplatin-induced peripheral neurotoxicity in patients with gastrointestinal tumors[J]. World J Surg Oncol, 2013, 11:19.
[57] 张振,孙亚红,安玉姬,等.补阳还五汤膏剂防治含紫杉醇方案化疗致外周神经毒性临床研究[J].山东中医杂志,2017,36(5):383-384,389.
[58] 陈瑞,姚广裕,陈路嘉,等.紫杉烷类抗肿瘤药物所致外周神经毒性相关研究进展[J].中国生化药物杂志,2015,35(4):185-188.
[59] Hershman DL, Lacchetti C, Dworkin RH, et al. Prevention and management of chemotherapy-induced peripheral neuropathy in survivors of adult cancers: American Society of Clinical Oncology clinical practice guideline[J]. J Clin Oncol, 2014, 32(18):1941-1967.
[60] Smith EM, Pang H, Cirrincione C, et al. Effect of duloxetine on pain, function, and quality of life among patients with chemotherapy-induced painful peripheral neuropathy: a randomized clinical trial[J]. JAMA, 2013, 309(13):1359-1367.
[61] Wang J, Li Q, Xu B, et al. Efficacy and safety of duloxetine in Chinese breast cancer patients with paclitaxel-induced peripheral neuropathy[J]. Chin J Cancer Res, 2017, 29(5):411-418.
[62] Kim E, Hwang SH, Kim HK, et al. Losartan, an Angiotensin Ⅱ Type 1 Receptor Antagonist, Alleviates Mechanical Hyperalgesia in a Rat Model of Chemotherapy-Induced Neuropathic Pain by Inhibiting Inflammatory Cytokines in the Dorsal Root Ganglia[J]. Mol Neurobiol, 2019, 56(11):7408-7419.
[63] Zhao X, Liu L, Wang Y, et al. Electroacupuncture enhances antioxidative signal pathway and attenuates neuropathic pain induced by chemotherapeutic paclitaxel[J]. Physiol Res, 2019, 68(3):501-510.
[64] Bao T, Seidman AD, Piulson L, et al. A phase Ⅱ A trial of acupu- ncture to reduce chemotherapy-induced peripheral neur opathy severity during neoadjuvant or adjuvant weekly paclita xel chemotherapy in breast cancer patients[J]. Eur J Cancer, 2018, 101:12-19.