 去看看
去看看


慢性阻塞性肺疾病全球创议(global initiative for chronic obstructive lung disease,GOLD)2018年修订版于 2017 年 11 月 15 日世界慢阻肺日发布,相对于 GOLD 2017,该版内容并没有太大修改。本文对于新增加的关于慢阻肺的危险因素、肺功能随访、急性加重频率的波动、药物治疗及非药物治疗等方面的内容进行简介和解读。
1998 年慢性阻塞性肺疾病(慢阻肺)全球创议(global initiative for chronic obstructive lung disease,GOLD)启动,其目标是根据已发表的最佳研究结果制定慢阻肺的管理推荐。第 1 版慢阻肺诊断、治疗及预防全球策略于 2001 年发布,2006 年和 2011 年分别根据已发表的研究进行了全面修订 [1]。GOLD 2011 修订版的修订分别于 2013 年 1 月、2014 年 1 月、2015 年 1 月及 2016 年 1 月发布,国内呼吸领域相关专家亦分别对其进行了解读 [2-5]。2015—2016 年,GOLD 科学委员会发现,关于慢阻肺的病理生理、诊断、评估及治疗方法有较多的新内容出现,因此需要进行全面修订,并由写作委员会制订各章节大纲。2016 年 9 月,GOLD 科学委员会对各章节进行审阅,然后送至 GOLD 委员会之外的 10 名专家处,提出建议并进行修改。GOLD 2017 作为第 4 次全面修订,于 2016 年 11 月 16 日在美国费城举行的 GOLD 慢阻肺全程管理会议上发布,笔者对其进行了详细解读 [6]。GOLD 2018检索了2016年1月至2017年7月发表的文章,新增 42 篇,其中有 5 篇来自中国学者的研究,于 2017 年 11 月 15 日世界慢阻肺日发布,其第四章(慢阻肺稳定期管理)和第六章(慢阻肺合并症)无修改,其他章节仅对 GOLD 2017 做少许修改 [7]。本文对其重要更新内容进行简介和解读。
1 第一章:定义与概述
1.1 吸烟与生命早期不良接触史的协同作用对肺功能的影响
认识慢阻肺的危险因素有助于采取一级预防措施干预其发生。生命早期不良接触史和成年吸烟是影响慢阻肺发生的危险因素。GOLD 2018 引用了英国医学研究委员会国家卫生与发展调查队列研究,观察成年吸烟是否与生命早期不良接触史(婴儿期呼吸道感染、父亲从事体力劳动、生命早期家庭居住环境拥挤、大气污染)协同影响肺功能下降,结果发表于 Am J Respir Crit Care Med [8]。该队列研究自 1946 年 3 月同一周出生的人群开始入组,共 5362 例,经过近 70 年的随访,约 2172 例纳入分析。研究发现,与不吸烟者比较,吸烟者与婴儿期呼吸道感染协同交互作用,使患者在 43 岁时的第一秒用力呼气容积(forced expiratory volume in first second,FEV1)下降 108.2 ml,吸烟与生命早期家庭居住环境拥挤协同作用,使 FEV1 下降 89.2 ml ;同时,吸烟会加速 FEV1 的下降。这项研究进一步解释了为何吸烟者肺功能下降存在异质性,也有助于识别易发生慢阻肺的危险人群。
1.2 大气颗粒物污染与慢阻肺
越来越多的中国研究被 GOLD 作为循证医学证据收录。GOLD 2018 增加了 2 项来自中国学者关于大气颗粒物污染与慢阻肺患病率、住院率及病死率的研究。来自中国广州呼吸疾病研究所冉丕鑫教授团队的一项横截面研究发表于 Thorax [9]。在广东四城市,采用多阶段整群抽样方法,研究大气颗粒物水平与慢阻肺患病率的相关性。与细颗粒物(fine particles,PM2.5)< 35 μg/mm3 比较,PM2.5 为 35 ~ 75 μg/mm3 的慢阻肺患病率 OR 为 2.416,PM2.5 > 75 μg/mm3 的慢阻肺患病率 OR 为 2.53。与 PM10 < 50 μg/mm3 比较,PM10 为 50 ~ 150 μg/mm3 的慢阻肺患病率 OR 为 2.442。 PM2.5 每增加 10 μg/mm3,FEV1 下降 26 ml,用力肺活量(forced vital capacity,FVC)下降 28 ml, FEV1 占 FVC 百分比(FEV1/FVC)下降 0.09%。 PM10 每增加 10 μg/mm3,FEV1 下降 14 ml,FVC 下降 16 ml,FEV1/FVC 下降 0.024%。需要进一步研究大气颗粒物不同成分的易感性、个体暴露差异以及引起慢阻肺发生的病理机制。上海肺科医院徐金富教授团队一项研究发表于 Chest [10]。该研究纳入 12 项关于短期暴露 PM2.5 与慢阻肺急性加重住院率的研究,6 项关于短期暴露 PM2.5 与慢阻肺病死率的研究。 Meta 分析结果表明,PM2.5 每增加 10 μg/m3,慢阻肺住院率增加 3.1%(95%CI :1.6% ~ 4.6%),病死率增加 2.5%(95%CI :1.5% ~ 3.5%)。需要进一步研究二者因果关系以及 PM2.5 促进慢阻肺急性加重的发病机制。
1.3 慢阻肺发病机制与病理生理
气道炎症在慢阻肺发病机制中发挥重要作用,小气道黏膜表面免疫屏障对于维持内环境稳定发挥重要作用。发表于 Am J Respir Crit Care Med 的研究发现,慢阻肺既往吸烟者小气道局部免疫球蛋白 A(immunoglobulin,IgA)分泌不足,驱动细菌移位,促进核因子κB (nuclear factor-κB,NF-κB)增加,巨噬细胞和中性粒细胞浸润,从而导致小气道炎症和气道重塑。肺气肿可以促进血管结构紊乱,但血管内皮功能紊乱及病理改变是否可以发生于肺气肿之前,CT 肺灌注成像检查有助于明确这一问题。研究发现,即使是轻度慢阻肺或易患肺气肿的吸烟者,其肺部微血管血流也会出现显著异常,并随疾病进展而恶化。这项检查将有助于区分哪些患者容易发生肺气肿。
2 第二章:慢阻肺诊断与评估
2.1 肺功能随访在慢阻肺诊断中的价值
肺功能是诊断慢阻肺的金标准,但不能仅依赖一次肺功能检查,需要动态随访。发表于 Am J Respir Crit Care Med 的一项研究通过 2 个北美前瞻性随访队列 [ 肺健康研究队列(lung health study,LHS),5861 例,随访 5 年;加拿大阻塞性肺疾病研究队列(Canadian cohort of obstructive lung disease,CanCOLD),1561 例,随访 4 年 ] 观察到慢阻肺诊断存在不稳定性(包括 2 种情况:患者初始诊断为慢阻肺,随访肺功能正常,然后又出现肺功能下降;或患者初始正常,随访肺功能下降达到慢阻肺诊断标准,然后肺功能又正常)和逆转性(患者初始诊断为慢阻肺,随访结束后恢复正常)[11]。该研究发现,轻 - 中度慢阻肺患者经常会出现诊断波动,LHS 研究约占 19.5%, CanCOLD 研究占 6.4%。部分慢阻肺发生逆转, LHS 占 12.6%,CanCOLD 占 27.2%。出现诊断波动的风险是患者吸入支气管扩张剂后 FEV1/FVC 接近诊断阈值,而诊断逆转的风险是患者在研究期间戒烟。
发表于 NPJ Prim Care Respir Med 的研究观察到同样的现象 [12]。共 2352 例研究对象入选,分别于基线、第 1 年及第 2 年测定 3 次肺功能。以正常下限(lower limit of normal,LLN)判断阻塞,约32.2% 的患者存在阻塞,其中 32.2% 在随访第 1 年和(或)第 2 年不存在阻塞;以固定比率(< 70%)判断阻塞,46.6% 的患者存在阻塞,其中 23.8% 在随访第 1 年和(或)第 2 年不存在阻塞。由阻塞变为不阻塞的患者多为高体质指数(body mass index,BMI)、基线应用短效β受体激动剂,较少为老年患者、 FEV1 占预计值百分比(FEV1% 预计值)低、基线吸入激素、在第 1 年为现在吸烟者、应用短效β受体激动剂。由不阻塞变为阻塞的患者多为男性、老年、现在吸烟者、FEV1% 预计值低,较少为高 BMI。
因此,GOLD 2018 指出,评估是否存在气流受限时,单次使用支气管扩张剂后 FEV1/FVC 为 0.6~0.8时,应在另一场所重复肺功能检查以确诊。因为在某些情况下,间隔一段时间后,由于个体差异,FEV1/FVC 可能会发生改变。若初始使用支气管扩张剂后,FEV1/FVC < 0.6,不太可能升至 0.7 以上。
2.2 慢阻肺急性加重频率的波动性及影响因素
既往大规模队列研究发现频发急性加重的发生率为 14% ~ 34%。对于急性加重风险的判断可以依据肺功能气流受限严重程度分级、既往 1 年急性加重频率以及外周血嗜酸细胞计数等。ECLIPSE 研究证明,频发急性加重随时间变化保持稳定,在未来的随访期仍然频发急性加重。发表于 Lancet Respir Med 的 SPIROMICS 研究,共 1105 例慢阻肺患者有完整的 3 年随访数据,538 例(49%)在 3 年随访中至少发生 1 次急性加重,567 例(51%)未发生急性加重,82 例(7%)每年至少发生 1 次急性加重,23 例(2%)每年发生 2 次及以上急性加重;约 456 例(41%)患者急性加重的发生存在不持续性(某些年发生急性加重,某些年未发生急性加重);发生持续急性加重(3 年中每年发生急性加重事件≥1 次)的危险因素包括:基线症状多、既往急性加重史、CT 检查显示小气道功能异常、白介素(interleukin,IL)-15 水平低、IL-8 水平高 [13]。该研究发现慢阻肺急性加重频率存在波动性和不稳定性。因此,目前关于急性加重风险的判断方法对于识别高风险人群并给予个体化治疗策略也许并不是最好的选择。
2.3 慢阻肺新病情评估分布及意义
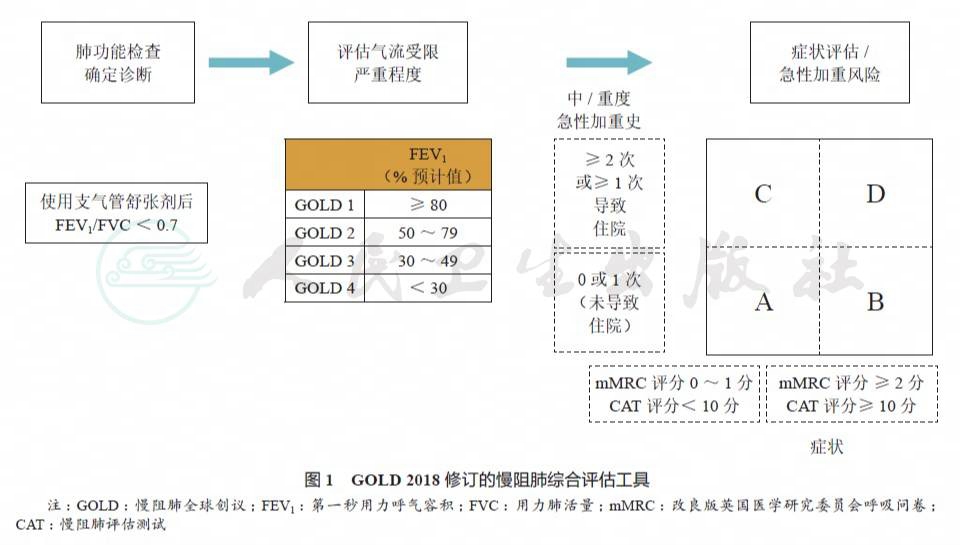
GOLD 2017 将肺功能检查在慢阻肺整体管理中的作用主要定位于慢阻肺的诊断、气流受限严重程度评估及随访评估,依据症状和急性加重频率对慢阻肺进行综合评估后分为 A、B、C、D 四组,既往 1 年发生 2 次及以上急性加重或有至少 1 次住院史即为高风险患者。GOLD 2018 仍然沿用 GOLD 2017 的评估工具,但对于急性加重史的判断修改为中度或重度急性加重,需要应用短效支气管扩张剂以及抗生素和(或)激素治疗为中度急性加重,需要住院或急诊就诊为重度急性加重,通常伴有急性呼吸衰竭(图 1)。对急性加重的判断缺乏一定的客观指标,而中重度急性加重相对较好判断,有助于识别高风险患者,可操作性强。
Tan 等 [14] 对 40 岁以上人群的 CanCOLD 非干预研究队列进行分析,该研究正在进行随访,已完成 18 个月共 4 次随访。717 例患者入选,485 例完成第 2 次随访,395 例完成第 3 次随访,40% 为女性,超过 50% 的患者为轻度气流受限(GOLD 1 级)。采用慢阻肺评估测试(COPD assessment test,CAT)进行分组,69%(11/16)由 GOLD 2011 的 C 组移至 GOLD 2017 的 A 组,64%(25/39)由 GOLD 2011 的 D 组移至 GOLD 2017 的 B 组。可见,GOLD 2017 新病情评估分组的分布与 GOLD 2011 存在差别,整体上高风险组患者更多地转移到了低风险组。各组肺功能平均下降速率为:A 组 36.7 ml/yr,B 组 40.3 ml/yr,C 组 31.2 ml/yr,D 组 68 ml/yr。校正协变量(年龄、性别、BMI、吸烟、FEV1 与时间的交互作用)后,B 组和 D 组 FEV1 平均下降率超过 A 组。与 FEV1 下降速率显著相关的病情评估指标为 CAT 评分≥10 分(β=-13.8,P = 0.001),改良版英国医学研究委员会呼吸问卷(modified British Medical Research Council,mMRC)评分≥2 分(β= 0.30,P = 0.970),急性加重≥2/yr(β=-2.0, P = 0.861)。在病情评估各项指标中,影响 FEV1 下降速率的指标是 CAT 评分、圣乔治问卷(the St George's Respiratory Questionnaire,SGRQ)评分,而单独的呼吸困难或急性加重史则不影响。近期已有新病情评估方法各组临床特征、对治疗的影响及预后的指导意义的文献报道,但并未收录入 GOLD 2018。
3 第三章:慢阻肺预防和维持治疗证据
3.1 慢阻肺稳定期药物治疗
GOLD 2018 增加了药物临床研究证据,包括双支气管扩张剂、吸入激素联合双支气管扩张剂、罗氟司特、大环内酯类抗生素。
3.1.1 长效β2 受体激动剂 / 长效 M 受体阻断剂双支气管扩张剂
目前已有的在一种装置中的长效双支气管扩张剂包括福莫特罗 / 阿地溴铵 [12/400 μg,干粉吸入器(dry powder inhales,DPI),作用 12 小时 ]、福莫特罗 / 格隆溴铵 [9.6/18 μg,4.8/9 μg,定量吸入气雾剂(metered dose inhalers,MDI),作用 12 小时 ]、茚达特罗 / 格隆溴铵(27.5/15.6 μg, 110/50 μg,DPI,作用 12 ~ 24 小时)、维兰特罗 / 乌地溴铵(25/62.5 μg,DPI,作用 24 小时)、奥达特罗 / 噻托溴铵 [5/5 μg,软雾吸入剂(soft mist inhaler,SMI),作用 24 小时 ]。一项Ⅲ期临床药物试验发现,格隆溴铵 / 福莫特罗联合使用 24 周,与单支气管扩张剂或安慰剂相比,可明显改善中 - 极重度慢阻肺患者的肺功能。事后研究分析,对于 CAT 评分较高的患者,格隆溴铵 / 福莫特罗联合使用可极大改善患者的生活质量,同时减少急救药使用,降低急性加重风险 [15]。
3.1.2 吸入激素联合双支气管扩张剂三联治疗
GOLD 在慢阻肺稳定期管理中指出,对于症状多、高风险的慢阻肺患者,当使用双支气管扩张剂或吸入糖皮质激素(inhaled corticosteroid,ICS)/ 长效 β2 受体激动剂(long acting β2 adrenceptor agonist, LABA)仍然不能改善临床症状和其他结局指标时,推荐应用吸入激素联合双支气管扩张剂三联治疗。来自英国和美国的研究发现 25.5% ~ 46% 的患者在 2 年内改为三联治疗。GOLD 2018 增加了 2 项三联治疗在一个装置中的比较研究。TRINITY 是一项双盲、平行、随机对照研究 [16]。该研究将有症状(CAT > 10 分)、FEV1% 预计值< 50%,既往 1 年至少有 1 次中 - 重度急性加重史的慢阻肺患者分为三组:固定剂量的三联疗法(超细颗粒二丙酸倍氯米松 / 福莫特罗 / 格隆溴铵 100/6/12.5 μg,每次 2 吸,每天 2 次,压力定量气雾剂吸入)、开放的三联疗法(超细颗粒二丙酸倍氯米松 / 福莫特罗 100/6 μg,每次 2 吸,每天 2 次,压力定量气雾剂吸入,联合噻托溴铵 18 μg,每天 1 次,干粉吸入)与单用噻托溴铵(18 μg,每天 1 次,干粉吸入),主要观察终点为中 - 重度急性加重频率,次要终点为治疗 52 周结束后吸入支气管扩张剂前 FEV1 的变化。结果发现固定剂量的三联疗法在减少中 重度急性加重和改善肺功能方面均优于噻托溴铵。 FURFIL 研究则比较了另外一种三联制剂(氟替卡松 / 芜地溴铵 / 维兰特罗 100/62.5/25 μg,每天 1 次)和 ICS/LABA(布地奈德 / 福莫特罗 400/12 μg,每天 2 次),入选的慢阻肺患者为 GOLD D 组:CAT 评分≥10 分,FEV1% 预计值< 80%,既往 1 年至少≥2 次中度急性加重或≥1 次重度急性加重,主要观察终点为治疗 24 周 FEV1 谷浓度和 SGRQ 评分的变化。研究指出,ICS/LABA/LAMA 三联治疗组 FEV1 较基线增加了 142 ml(95%CI : 126 ~ 158),ICS/LABA 组减少了 29 ml(95%CI :-46 ~-13),SGRQ 评分较基线分别下降了 6.6 单位(95%CI :-7.4 ~-5.7)和 4.3 单位(95%CI :-5.2 ~-3.4),三联治疗组中 - 重度急性加重较 ICS/LABA 组降低了 35%(95%CI :14 ~ 51)[17]。对于症状多、高风险的慢阻肺患者,吸入三联药物较 ICS/LABA 有更多获益。
3.1.3 磷酸二酯酶抑制剂
茶碱是一种非选择性磷酸二酯酶抑制剂。体外研究发现通过增加组蛋白去乙酰化酶(histone deacetylase,HDAC)的活性可改善激素抵抗。一项随机双盲安慰剂研究发现,在氟替卡松联合沙美特罗的基础上联合小剂量茶碱(100 mg,每天 2 次)治疗重度慢阻肺 52 周,测定患者血单核细胞和痰巨噬细胞 HDAC 活性、血和痰 IL-6、IL-8、IL-1β、肿瘤坏死因子 -α(tumor necrosis factor-α,TNF-α)水平及急性加重频率,发现小剂量茶碱并没有增加吸入激素的抗炎活性,也没有降低急性加重频率。目前,茶碱在中国慢阻肺患者中的应用较为普遍,但循证医学证据有限,且结论不一致,需要进一步研究。
罗氟司特是一种选择性磷酸二酯酶 4 抑制剂。对于存在慢性支气管炎、重度至极重度慢阻肺、既往有急性加重史的患者,罗氟司特降低了需糖皮质激素治疗的中重度慢阻肺急性加重的发生率。 GOLD 2018 对 REACT 研究进行事后分析发现,罗氟司特的获益在有急性加重住院史的慢阻肺患者中更为明显。
3.1.4 抗生素
与常规治疗相比,阿奇霉素(每次 250 mg,每天 1 次,或每次 500 mg,每天 1 次,每周服用 3 天)或红霉素(每次 250 mg,每天 2 次)治疗 1 年,可降低易发生急性加重患者的急性发作风险。阿奇霉素与细菌耐药性增加和听力受损增加相关。事后分析表明主动吸烟者获益较小。没有数据显示阿奇霉素长期治疗 1 年以上用于预防慢阻肺急性加重的有效性或安全性。
3.2 慢阻肺稳定期非药物治疗
3.2.1 戒烟干预
戒烟作为慢阻肺的一级预防和二级预防,除个体主动戒烟外,GOLD 2018 引用了发表于 Cochrane Database Syst Rev 的研究,指出立法戒烟可有效增加戒烟率和减少二手烟暴露。电子烟作为烟草替代物,近年来在吸烟或不吸烟的年轻人中得到广泛应用。大家普遍认为电子烟无害,在一些医疗机构中甚至将其作为戒烟辅助措施。 GOLD 2018 引用了发表于 Am J Respir Crit Care Med 的文章 [18]。该文首次研究指出电子烟对人体气道存在不利影响。研究数据显示,电子烟可以改变吸烟者的肺固有免疫反应,增加中性粒细胞炎性反应和黏蛋白的分泌,吸电子烟者出现了与吸烟者气道类似的病理改变。这对使用电子烟作为辅助戒烟策略提出了挑战。
3.2.2 肺康复
慢阻肺肺康复在国内逐渐受到重视。不同国家出版了相应的肺康复指南。GOLD 2018 指出:肺康复可在很多场所进行。对慢阻肺患者而言,家庭康复可以替代门诊康复。家庭康复可能是许多远离有康复设施场所患者的一种解决方案。另一个挑战是,随着时间的推移,康复的获益往往会减少。虽然一项研究显示,在随访期间肺康复获益减少,但在初次完成肺康复计划后长期维持肺康复可以持续获益。目前,国内需要建立慢阻肺全程肺康复干预策略研究,开展从轻度至极重度,从稳定期至急性加重期,从医院至居家康复的模式、方法及技术研究。
3.2.3 氧疗
长期氧疗的适应证已非常明确:①静息时氧分压(partial pressure of oxygen,PaO2)< 55 mmHg。②静息时二氧化碳分压(partial pressure of carbon dioxide,PaCO2)为 55 ~ 60 mmHg,伴缺氧导致的下列问题:肺动脉高压 / 肺源性心脏病;充血性心力衰竭 / 心律失常;红细胞增多(血细胞比容> 55%)。氧疗对于静息状态下中度缺氧(氧饱和度为 89% ~ 93%)或运动诱发的中度缺氧(6 分钟步行试验中氧饱和度为 80% 并持续 5 分钟及以上,或氧饱和度< 90% 持续 10 分钟及以上)的患者是否获益,在 2017 年美国胸科学会年会上进行了这一话题的正反方辩论。正方观点指出:符合此研究入选标准和排除标准的患者并没有从长期氧疗中获益,但长期氧疗应个体化,给予死亡风险增加和(或)因重度慢阻肺急性加重而反复住院、合并睡眠呼吸暂停综合征即使给予无创通气治疗仍有夜间低氧和日间症状、经过充分治疗仍有呼吸困难的中度低氧的慢阻肺患者。GOLD 2018 引用了一项发表于 Cochrane Database Syst Rev 的研究 [19]。该研究指出即使是不具有家庭氧疗指征的患者,在运动期间给予氧疗,也可以改善有轻度低氧血症或非低氧血症患者的呼吸困难。但也有研究显示,氧疗不会改善日常生活中出现的呼吸困难,对健康相关的生活质量也没有任何获益。任何一项临床研究都有严格的入选标准和排除标准,在临床实践中需要根据患者情况,选择个体化的治疗策略。
3.2.4 无创正压通气
GOLD 2017 在第六章(慢阻肺合并症)中增加了慢阻肺合并睡眠呼吸暂停综合征。GOLD 2018 指出对于合并阻塞性睡眠呼吸暂停(obstructive sleep apnea,OSA)的慢阻肺患者,进行连续气道正压通气(continuous positive airway pressure,CPAP)有明显获益,可以改善患者的生存质量,降低住院风险。然而,慢阻肺合并 OSA 存在不同的表型,如何区别给予不同的治疗策略在 GOLD 2018 并未见详细的阐述。在临床实践中,对于以 OSA 为主(中重度)、轻度慢阻肺患者,主要治疗睡眠呼吸暂停,以无创通气治疗为主;按照 GOLD 方案治疗慢阻肺和监测、预防慢阻肺急性加重。以慢阻肺为主(中重度)、轻度 OSA 患者,以治疗慢阻肺为主,达到减少慢阻肺急性加重、提高生活质量、延缓慢阻肺进展的目的;需要者(夜间低氧、呼吸衰竭)进行无创通气或氧疗。对于同时存在中重度慢阻肺和 OSA 的患者,需要强化对两种疾病的联合治疗,保证患者的通气量和对氧的需求,预防、减少及治疗合并症。
是否可以在家长期使用无创正压通气(noninvasive positive pressure ventilation,NPPV)治疗因慢性呼吸衰竭急性发作出院的慢阻肺患者仍存在争议。GOLD 2018引用了发表于JAMA的一项研究 [20]。该研究是一项针对因慢阻肺急性发作在出院 2 ~ 4 周后持续高碳酸血症(PaCO2 > 53 mmHg)的慢阻肺患者(116 例)进行的多中心(13 个中心)前瞻性随机对照研究,比较家庭无创通气联合氧疗与家庭氧疗对患者再次入院或死亡的影响,排除 BMI > 35 kg/m2、阻塞性睡眠呼吸暂停综合征或其他呼吸衰竭原因患者。筛选的 2021 例患者中,仅 124 例(6%)符合入组条件。结果显示,家庭无创通气联合氧疗显著延长 12 个月内患者自基线处至再次入院或死亡的时间。2 项回顾性研究和 3 项随机对照试验中的 2 项研究显示,出院后使用 NPPV 可降低再次入院率和病死率。不同研究结果存在差异的原因可能在于:患者入选标准不同、样本量不足、NPPV 设定参数不能达到足够通气、患者对 NPPV 的依从性差。因此,GOLD 2018 指出当有指征应用 NPPV 时,应在有经验的医务人员指导下实施并进行监测。
4 第五章:慢阻肺急性加重期管理
4.1 呼吸困难与慢阻肺急性加重频率
目前对于慢阻肺急性加重的定义主要依据患者感知的呼吸道症状加重。慢阻肺患者急性加重个体易感性增加的具体原因尚不清楚。既往的急性加重频率是患者未来急性加重频率的最重要预测因素。GOLD 2018 引用了一项发表于 Thorax 的研究 [21]。该研究发现频发急性加重的慢阻肺患者呼吸困难感知高于非频发急性加重患者,同时口腔阻断压(P0.1)增加,二氧化碳通气反应增加,重复呼吸 Borg 评分峰值和变化值增加。这说明呼吸困难的感知可能会促进急性加重症状,而非仅仅生理或致病因素发挥作用。
4.2 不明原因慢阻肺急性加重中肺栓塞的发生率和发生部位
30% 的慢阻肺急性加重找不到明确病因。炎症与血栓之间存在相互关联。发表于 Chest 的一项 Meta 分析收集了在慢阻肺急性加重期间行 CT 肺动脉造影明确诊断肺栓塞的前瞻性和横断面研究,共 880 例患者入选,发现不明原因慢阻肺急性加重中肺栓塞的发生率为 16.1%(95%CI : 8.3% ~ 25.8%),68% 的栓子位于主肺动脉、叶动脉或叶间动脉,住院天数和病死率均增加,这些患者最常出现的症状是胸膜炎样胸痛和心力衰竭,而较少出现呼吸道感染征象 [22]。临床上应对此类患者提高警惕,进一步检查明确诊断,并给予抗凝治疗。
4.3 健康教育
慢阻肺急性加重对患者的预后造成不良影响,并带来巨大的经济负担。因此,需要对患者进行健康教育,教会患者早期识别急性加重并给予早期干预。最近,发表于 Cochrane Database Syst Rev 的一项研究发现,实施一次短期教育干预的慢阻肺急性加重行动计划,并给予持续支持,可以减少住院医疗资源的使用。研究者还发现,短期教育干预有助于早期识别和干预需要用激素和抗生素治疗的慢阻肺急性加重。
4.4 降钙素原指导的抗生素应用
慢阻肺急性加重患者如果存在呼吸困难加重、痰量增多、脓性痰这 3 种基本症状,或含脓性痰增多在内的 2 种基本症状,或需要有创或无创机械通气治疗,就应接受抗生素治疗。但在临床实践中存在抗生素滥用现象,因此需要研究能反映慢阻肺急性加重气道细菌感染的生物标志物。降钙素原(procalcitonin,PCT)是细菌感染比较特殊的标志物,可能有助于决定是否使用抗生素。中日友好医院曹彬教授团队研究发现,457 例慢阻肺急性加重患者中 194 例 PCT 水平< 0.1 ng/ml,将这些患者随机分为抗生素治疗组和对照组,并未发现抗生素能够改变治疗终点,年龄> 75 岁是需要用抗生素的危险因素 [23]。Meta 分析表明,基于 PCT 策略可以减少抗生素处方,降低总体暴露水平,但不影响临床结局(治疗失败率、住院天数、病死率)[24]。由于研究方法的局限性和样本量不足,证据等级低 - 中,需要设计研究进一步验证。
4.5 慢阻肺急性加重患者的氧疗方法——经鼻高流量氧疗
氧疗是慢阻肺急性加重住院治疗的关键部分,调节氧流量以改善患者低氧血症,保证氧饱和度为 88% ~ 92%。氧疗开始后要频繁监测动脉血气分析,以保证合适的氧合,且无二氧化碳潴留和(或)恶化的酸中毒。与鼻导管相比, Venturi 面罩(高流量装置)提供的氧流量更精准和可控。GOLD 2018 提出了经鼻高流量氧疗(high-flow oxygen therapy by nasal cannula,HFNC)在慢阻肺急性加重氧疗中的应用。对于急性低氧性呼吸衰竭患者,HFNC 可能是标准氧疗或 NPPV 的替代方案。研究显示,HFNC 可降低低氧血症和急性呼吸衰竭患者的插管需求或死亡率。迄今为止,在慢阻肺患者氧疗研究中入选患者的基础疾病都非常严重。对 30 例慢阻肺稳定期患者进行的随机交叉研究设计,分为长期氧疗(long-term oxygen therapy, LTOT)(2 ~ 4 L/min)和 HFNC(30 L/min)治疗 20 分钟,发现短期 HFNC 能够改善通气,减少高碳酸血症 [25]。中国福建医科大学研究团队发表于 Respir Med 的对急性低氧血症呼吸衰竭患者的随机对照系统回顾研究表明,与常规氧疗或无创机械通气相比,HFNC 有降低插管率的趋势,但并未达到统计学显著性,对死亡率没有影响。但是,此研究并未纳入由慢阻肺急性加重导致的急性呼吸衰竭患者,需要设计良好的随机多中心试验来探讨 HFNC 对慢阻肺患者急性低氧性呼吸衰竭的影响 [26]。
5 小结
GOLD 2018 仍然强调慢阻肺的综合评估和个体化治疗。新评估方法带来的对患者治疗策略的改变和对预后的影响仍然缺乏前瞻性研究支持。近期有几篇文献进行了报道,其中包括来自中国的研究 [27]。GOLD 2018 对于临床关注的问题仍然没有给予明确的阐述,例如对于急性加重风险的判断以及基于慢阻肺患者临床表型的个体化治疗。2017 年西班牙指南关于慢阻肺评估和药物治疗也进行了更新,简化了风险分层标准,将患者分为低风险和高风险 [28]。风险评估中考虑的因素包括:使用支气管扩张剂后 FEV1% 预计值评估气流受限程度;用 mMRC 评价呼吸困难程度和急性加重史。 FEV1% 预计值为 50% 认为是区分重度、极重度、轻中度气流受限的界值;经治疗 mMRC 评分≥2 分或未经治疗 mMRC 评分> 2 分认为呼吸困难程度高;中度急性加重 [ 至少需要全身激素和(或)抗生素门诊治疗 ] 次数≥2 次或因急性加重而住院治疗,认为将来急性加重风险更高。仅在高危患者中确定临床表型,将慢阻肺表型分为四种:①非急性加重表型;②哮喘 - 慢阻肺重叠;③急性加重肺气肿型;④急性加重慢性支气管炎型。对初始治疗策略和随访期治疗进行了更新,更加适用于临床实践。临床表型的提出是慢阻肺个体化治疗的一大进步,但无论是 GOLD、西班牙指南还是中国指南,已知的临床表型都具有局限性,不能囊括所有慢阻肺患者,也不能显示慢阻肺合并症,对未来急性加重的判断也不精确。随着国内外慢阻肺研究的不断深入,今后将会有更多包括中国研究在内的循证医学证据被写入 GOLD。
[1] Global strategy for the diagnosis, management and prevention of chronic obstructive pulmonary disease (revised 2011) [EB/ OL]. (2011-11) [2012-01-02]. http://www.goldcopd.org/guid elinespocket-guide-to-copd-diagnosis.html.
[2] 黄俊,王广发.慢性阻塞性肺病全球倡议慢性阻塞性肺病指南(2013 更新版)解读 [J].中国医学前沿杂志(电子版), 2013,5(3):58-60.
[3] 金哲,王广发.慢性阻塞性肺疾病全球倡议(2014 更新版)解读 [J].中国医学前沿杂志(电子版),2014,6(2):94-97.
[4] 陈亚红,王辰.2015 年更新版 GOLD 慢性阻塞性肺疾病诊断、治疗和预防的全球策略简介 [J].中国医学前沿杂志(电子版),2015,7(2):34-39.
[5] 庞红燕,杨汀,王辰.2016 年更新版 GOLD 慢性阻塞性肺疾病诊断、治疗和预防的全球策略简介 [J].中国医学前沿杂志(电子版),2016,8(7):30-34.
[6] 陈亚红.2017 年 GOLD 慢性阻塞性肺疾病诊断、治疗及预防的全球策略解读 [J].中国医学前沿杂志(电子版),2017,9(1):37-47.
[7] Global initiative for chronic obstructive lung disease. Global strategy for the diagnosis, management, and prevention of chronic obstructive pulmonary disease 2018 report[EB/OL]. (2017-12) [2017-12-05]. http://www.goldcopd.org.
[8] Allinson JP, Hardy R, Donaldson GC, et al. Combined Impact of Smoking and Early-Life Exposures on Adult Lung Function Trajectories[J]. Am J Respir Crit Care Med, 2017, 196(8):1021-1030.
[9] Liu S, Zhou Y, Liu S, et al. Association between exposure to ambient particulate matter and chronic obstructive pulmonary disease: results from a cross-sectional study in China[J]. Thorax, 2017, 72(9):788-795.
[10] Li MH, Fan LC, Mao B, et al. Short-term Exposure to Ambient Fine Particulate Matter Increases Hospitalizations and Mortality in COPD: A Systematic Review and Meta-analysis[J]. Chest, 2016, 149(2):447-458.
[11] Aaron SD, Tan WC, Bourbeau J, et al. Diagnostic Instability and Reversals of Chronic Obstructive Pulmonary Disease Diagnosis in Individuals with Mild to Moderate Airflow Obstruction[J]. Am J Respir Crit Care Med, 2017, 196(3):306-314.
[12] Schermer TR, Robberts B, Crocket AJ, et al. Should the diagnosis of COPD be based on a single spirometry test?[J]. NPJ Prim Care Respir Med, 2016, 26:16059.
[13] Han MK, Quibrera PM, Carretta EE, et al. Frequency of exacerbations in patients with chronic obstructive pulmonary disease: an analysis of the SPIROMICS cohort[J]. Lancet Respir Med, 2017, 5(8):619-626.
[14] Tan WC, Bourbeau J, Aaron SD, et al. GOLD 2017 Classification and Lung Function Decline in Chronic Obstructive Pulm onary Disease[J]. Am J Respir Crit Care Med, 2017. [Epub ah ead of print]
[15] Martinez FJ, Fabbri LM, Ferguson GT, et al. Baseline Symptom Score Impact on Benefits of Glycopyrrolate/Formoterol Metered Dose Inhaler in COPD[J]. Chest, 2017. [Epub ahead of print]
[16] Vestbo J, Papi A, Corradi M, et al. Single inhaler extrafine triple therapy versus long-acting muscarinic antagonist therapy for chronic obstructive pulmonary disease (TRINITY): a doubleblind, parallel group, randomised controlled trial[J]. Lancet, 2017, 389(10082):1919-1929.
[17] Lipson DA, Barnacle H, Birk R, et al. FULFIL Trial: OnceDaily Triple Therapy for Patients with Chronic Obstructive Pulmonary Disease[J]. Am J Respir Crit Care Med, 2017, 196(4):438-446.
[18] Reidel B, Radicioni G, Clapp P, et al. E-Cigarette Use Causes a Unique Innate Immune Response in the Lung Involving Increased Neutrophilic Activation and Altered Mucin Secretion[J]. Am J Respir Crit Care Med, 2017. [Epub ahead of print]
[19] Ekström M, Ahmadi Z, Bornefalk-Hermansson A, et al. Oxygen for breathlessness in patients with chronic obstructive pulmonary disease who do not qualify for home oxygen therapy[J]. Cochrane Database Syst Rev, 2016, 11:CD006429.
[20] Murphy PB, Rehal S, Arbane G, et al. Effect of Home Noninvasive Ventilation With Oxygen Therapy vs Oxygen Therapy Alone on Hospital Readmission or Death After an Acute COPD Exacerbation: A Randomized Clinical Trial[J]. JAMA, 2017, 317(21):2177-2186.
[21] Scioscia G, Blanco I, Arismendi E, et al. Different dyspnoea perception in COPD patients with frequent and infrequent exacerbations[J]. Thorax, 2017, 72(2):117-121.
[22] Aleva FE, Voets LWLM, Simons SO, et al. Prevalence and Localization of Pulmonary Embolism in Unexplained Acute Exacerbations of COPD: A Systematic Review and Metaanalysis[J]. Chest, 2017, 151(3):544-554.
[23] Wang JX, Zhang SM, Li XH, et al. Acute exacerbations of chronic obstructive pulmonary disease with low serum procalc itonin values do not benefit from antibiotic treatment: a prospective randomized controlled trial[J]. Int J Infect Dis, 2016, 48:40-45.
[24] Mathioudakis AG, Chatzimavridou-Grigoriadou V, Corlateanu A, et al. Procalcitonin to guide antibiotic administration in COPD exacerbations: a meta-analysis[J]. Eur Respir Rev, 2017, 26(143). pii: 160073.
[25] Fraser JF, Spooner AJ, Dunster KR, et al. Nasal high flow oxygen therapy in patients with COPD reduces respiratory rate and tissue carbon dioxide while increasing tidal and end-expiratory lung volumes: a randomised crossover trial[J]. Thorax, 2016, 71(8):759-761.
[26] Lin SM, Liu KX, Lin ZH, et al. Does high-flow nasal cannula oxygen improve outcome in acute hypoxemic respiratory failure? A systematic review and meta-analysis[J]. Respir Med, 2017, 131:58-64.
[27] Sun L, Chen Y, Wu R, et al. Changes in definition lead to changes in the clinical characteristics across COPD categories according to GOLD 2017: a national cross-sectional survey in China[J]. Int J Chron Obstruct Pulmon Dis, 2017, 12:3095-3102.
[28] Miravitlles M, Soler-Cataluña JJ, Calle M, et al. Spanish Guidelines for Management of Chronic Obstructive Pulmonary Disease (GesEPOC) 2017. Pharmacological Treatment of Stable Phase[J]. Arch Bronconeumol, 2017, 53(6):324-335.