 去看看
去看看


妇科恶性肿瘤主要包括子宫颈癌、子宫内膜癌和卵巢癌等,化学治疗(以下简称“化疗”)是其主要的辅助治疗措施,其中以铂类为基础的联合化疗,尤其是联合紫杉类药物,是妇科恶性肿瘤的基本化疗方案。紫杉类药物分为紫杉醇(溶剂型紫杉醇、紫杉醇脂质体和紫杉醇白蛋白结合型)和多烯紫杉醇(多西他赛)两类。在妇科恶性肿瘤治疗方面,国内外缺乏紫杉类药物临床应用专家共识,为使临床医师合理应用紫杉类药物,规范诊疗行为,中华医学会妇科肿瘤学分会组织专家讨论并形成以下共识。
1 紫杉类药物分类和药理特点
1.1 溶剂型紫杉醇
溶剂型紫杉醇(以下简称紫杉醇)是半化学合成药物,其抗肿瘤机制是通过促进微管蛋白二聚体的聚合并阻止其解聚达到稳定微管的作用,从而抑制分裂间期和有丝分裂细胞微管网的正常动态重组,同时导致微管束的排列异常,影响肿瘤细胞分裂。紫杉醇体内代谢呈非线性药代动力学特征,静脉给药后其浓度在血浆中呈现双相降低曲线,在体内分布尚未完全阐明,主要以非肾性清除。其系聚氧乙基代蓖麻油溶剂形成胶束包裹紫杉醇,水溶性相对较差,主要不良反应包括过敏反应、骨髓抑制、肌肉关节疼痛、肝毒性、神经毒性反应(神经轴突变性和脱髓鞘反应)等。因此,临床使用前需行糖皮质激素预处理。
1.2 紫杉醇脂质体
紫杉醇脂质体系由磷脂、胆固醇等材料构成的类似于细胞膜磷脂双分子层结构的脂质体(liposome)包载紫杉醇,旨在提高水溶性且无需添加聚氧乙基代蓖麻油。经静脉给药后药物血浆浓度呈双相曲线,血浆清除与剂量和静脉滴注时间相关。血浆蛋白结合率为89% ~ 98%,尿中仅有少量原型药排出。紫杉醇脂质体是一种微米级、甚至纳米级的微粒,注射进入血液后,易被网状内皮系统摄取,富集于网状内皮系统较丰富的器官,如肝脏、脾脏和淋巴结中分布最高,而在心脏、肾脏分布较少,表明紫杉醇脂质体较普通紫杉醇更易从血管渗透入肿瘤组织,具有淋巴结和网状内皮系统组织器官被动靶向性,治疗作用增强,心、肾毒性降低等优点。紫杉醇脂质体过敏反应少见,具有较好的安全性。
1.3 紫杉醇白蛋白结合型
紫杉醇白蛋白结合型是应用纳米技术将疏水性紫杉醇与人血清白蛋白载体相结合,在体内较溶剂型紫杉醇更易分解,可经过胞吞作用将紫杉醇转运至肿瘤组织,具有相对靶向性。其主要药物代谢特点为线性药代动力学,静脉注射后浓度呈现双相下降曲线,肾脏不是其主要代谢途径,经粪便排泄占20%。与传统溶剂型紫杉醇相比,其临床剂量范围较大(80 ~ 375 mg/m2)。本品过敏反应少见,临床用药前无需行糖皮质激素预处理,输注时间短,临床用药方便。
1.4 多西他赛
多西他赛抗肿瘤机制与紫杉醇类似。药代动力学研究显示符合三室药代动力学模型。多西他赛及其代谢产物经粪和尿排出分别占剂量的 75%和6%。多西他赛溶于吐温® 80,溶剂为13% w/w 的注射用乙醇水溶液。鉴于其有过敏反应、体液潴留、皮肤不良反应等,临床使用前需行糖皮质激素预处理。
2 临床应用循证证据和适用人群
2.1 卵巢恶性肿瘤
主要包括上皮性卵巢癌、生殖细胞恶性肿瘤和性索间质肿瘤等类型。其治疗主要采取手术和化疗,化疗不仅是主要的辅助治疗手段,且在综合治疗中与手术具有几乎同等重要的地位。化疗分为术后的初始化疗(一线化疗)、术前的新辅助化疗、缓解期的维持化疗和复发后的挽救化疗(二线/多线化疗)等。紫杉类药物广泛应用于上述各种化疗中。
2.1.1初始化疗
上皮性卵巢癌/输卵管癌/原发性腹膜癌( 以下统称“ 卵巢癌”)首次手术后需要进行以铂类为基础的联合化疗者[1],首选静脉化疗,亦可联合腹腔化疗。多项前瞻性随机对照Ⅲ期临床试验研究确立了铂类( 卡铂/顺铂)联合紫杉类药物( 紫杉醇/多西他赛)静脉全身化疗(3周疗法)作为卵巢癌标准化疗方案的地位[2-4]。早期高危患者化疗3~6个疗程,浆液性癌患者需行6个疗程化疗,晚期卵巢癌患者一般常规进行6个疗程的化疗。与标准3周疗法相比,单周疗法具有等效性且患者生活质量较好,老年人(>70岁)和/或有合并症、对标准化疗方案不能耐受者可选择紫杉醇低剂量3周疗法或单周疗法。糖尿病或并发神经毒性患者使用紫杉醇脂质体更具优势。由于卵巢癌腹腔播散的特点,铂类联合紫杉醇腹腔化疗和热灌注化疗在理想肿瘤细胞减灭术后显示有生存获益[5-7],但需关注改变用药途径后的紫杉醇过敏问题和不良反应加重问题。恶性卵巢性索间质肿瘤术后初始化疗推荐选用铂类联合紫杉类药物方案。生殖细胞恶性肿瘤初始化疗能否应用铂类联合紫杉类药物方案替代经典的BEP方案目前正在临床试验中。
2.1.2新辅助化疗
新辅助化疗在卵巢癌中的应用虽有争议[8],但对于肿瘤较大、初次手术无法达到R0或手术风险较大的Ⅲ~Ⅳ期患者可以考虑新辅助化疗,化疗前须有明确的病理诊断结果(可通过细针抽吸、活检或腹腔积液穿刺获得标本)。各种铂类联合紫杉类药物化疗方案均可用于新辅助化疗。
2.1.3维持化疗
缓解期给予化疗旨在延迟复发,是为维持化疗。大多数维持化疗随机对照临床试验研究未能显示患者获益,仅有一项研究显示紫杉醇维持化疗12周期方案的无进展生存时间较3周期方案延长[9],但因其较重的不良反应和其他研究未能显示疗效等问题,目前不推荐其作为临床实践应用方案。
2.1.4挽救化疗
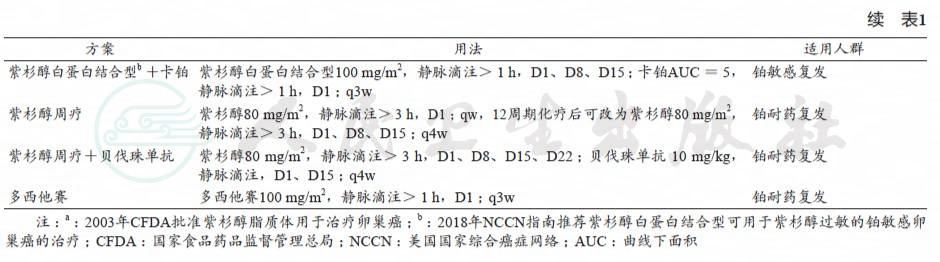
卵巢癌复发分为铂敏感复发和铂耐药复发两种类型。铂敏感复发患者化疗首选以铂类为基础的联合化疗,主要包括含紫杉类药物方案。铂耐药复发不推荐使用含铂化疗,紫杉类药物加或不加靶向药物是常用方案。
以上具体方案见表1。

2.2子宫颈癌
早期存在高危因素(盆腔淋巴结阳性、切缘阳性、宫旁浸润)之一的宫颈癌手术后建议补充盆腔外照射放疗+同期化疗±阴道近距离放疗;存在中危因素(淋巴脉管间隙浸润、深层间质浸润和原发肿瘤较大)者按Sedlis标准放疗±同期化疗;晚期、转移和复发患者应行全身化疗或同期放化疗。宫颈腺癌是中危因素之一,需根据四因素(肿瘤直径> 3 cm、淋巴脉管间隙浸润、外1/3 间质浸润、腺癌)模型决定治疗方式,若存在任意 2个因素应行放疗。对于局部晚期宫颈癌,新辅助化疗存在较大争议[10],目前仅推荐在临床试验和缺乏放疗条件的情况下应用。紫杉类药物单药或联合用药主要用于晚期、转移、复发患者的化疗[11-13]。
以上具体方案见表2。

2.3 子宫体恶性肿瘤
子宫体恶性肿瘤主要有子宫内膜癌、子宫肉瘤等,需要根据分期和组织学类型分级等进行放疗、化疗和内分泌治疗等相结合的辅助治疗[14]。
2.3.1子宫内膜癌
Ⅰ期子宫内膜样腺癌术后应根据有无高危因素和组织学分级决定辅助治疗方式。其高危因素包括:年龄≥60岁、深肌层浸润和/或淋巴脉管间隙浸润,补充治疗以放疗为主。ⅠA期 G1/2/3和ⅠB期G1/2患者术后存在高危因素时,需行阴道近距离照射,但ⅠB期G3患者术后无论是否存在高危因素,均建议行阴道近距离照射和/或外照射±化疗;Ⅱ期G3仅全子宫切除患者建议术后行外照射±阴道近距离照射±化疗;ⅢA ~ⅣA期患者术后以化疗为主±阴道近距离照射,或外照射±阴道近距离照射±化疗,ⅣB期患者建议行化疗±外照射±阴道近距离照射。特殊类型子宫内膜癌如浆液性腺癌、透明细胞癌、未分化/去分化癌、癌肉瘤等ⅠA期患者可行化疗+阴道近距离照射,ⅠB~Ⅳ期患者建议行化疗±外照射±阴道近距离照射。紫杉类药物联合铂类或单药化疗可用于上述有化疗指征的患者。复发性子宫内膜癌患者的治疗与复发部位、既往是否接受过放疗有关,经常辅以化疗,化疗方案推荐紫杉类药物联合或单药治疗[15,16]。
2.3.2子宫肉瘤
术后辅助治疗需要根据肿瘤的类型、组织学分级和分期综合考虑。Ⅰ期子宫平滑肌肉瘤患者术后可观察或化疗;Ⅱ、Ⅲ期患者可化疗和/或外照射;ⅣA期患者可化疗和/或外照射,ⅣB期患者建议化疗±姑息性放疗。高级别子宫内膜间质肉瘤和未分化子宫肉瘤患者术后需要化疗±放疗。多西他赛联合吉西他滨为子宫肉瘤术后首选方案之一[17]。局部复发的子宫肉瘤患者应根据先前是否行放疗选择手术±放疗±全身治疗,播散性复发转移者建议行全身化疗±姑息性外照射放疗和支持治疗。
以上具体方案见表3。

2.4妊娠滋养细胞肿瘤
妊娠滋养细胞肿瘤以化疗为主,根据国际妇产科联盟/世界卫生组织(FIGO/WHO)评分,低危患者(≤ 6分)首选甲氨蝶呤或放线菌素D单药化疗,高危患者(> 6分)首选依托泊苷+甲氨蝶呤+放线菌素D/环磷酰胺+长春新碱(EMA-CO)方案联合化疗。能否应用铂类+紫杉醇(TP)方案作为一线化疗替代EMA-CO方案目前正在临床试验中。含紫杉类药物的化疗方案主要用于复发、耐药患者的挽救治疗。TP/TE(紫杉醇+顺铂/紫杉醇+依托泊苷)和EMA/EP( 更生霉素+依托泊苷+甲氨蝶呤/依托泊苷+顺铂)是最常用的挽救化疗方案,研究显示TP/TE的耐受性可能较EMA-EP更好[18,19]。具体方案见表4。

2.5外阴癌和阴道癌
外阴癌和阴道癌以手术治疗为主,放疗为辅。目前关于外阴癌和阴道癌的化疗方案及其效果尚无明确标准和指南。建议前哨淋巴结或腹股沟/股淋巴结阳性或肿瘤超出骨盆的晚期患者可考虑辅助化疗,推荐的一线化疗方案包括顺铂、卡铂、顺铂+紫杉醇、卡铂+紫杉醇、顺铂+紫杉醇+贝伐珠单抗等。
3不良反应及其管理
3.1常见不良反应
3.1.1过敏反应
紫杉醇的溶媒和紫杉醇均可引起过敏反应。因紫杉醇分子结构的疏水性,故在制备时使用聚氧乙基代蓖麻油(国产)或聚氧乙基-35蓖麻油(进口)为溶媒,该溶媒分子结构中存在某些非离子嵌段共聚物,可通过两种不同机制导致肥大细胞和/或嗜碱性粒细胞活化:①直接激活补体,产生过敏毒素,激活嗜碱性粒细胞、肥大细胞[20] ; ②通过IgE介导的免疫机制[21]。此外,紫杉醇药物本身也可通过以下途径引起过敏反应:①直接激活嗜碱性粒细胞(而非肥大细胞),引起组胺释放[22]; ②IgE介导的免疫机制[23-26] ;③IgG介导的免疫机制,通过作用于免疫复合物引起补体激活,导致过敏毒素C3a和C5a的产生,进而通过其表面受体激活嗜碱性粒细胞和肥大细胞[27]引起过敏反应。紫杉类药物所致过敏反应系Ⅰ型过敏反应[28],多发生于前两个疗程开始输注的2 ~ 10 min内,在紫杉醇治疗过程中,约20%的疗程和41%的患者出现过敏反应,其中2%的患者出现严重超敏反应,表现为呼吸困难、喉头水肿、过敏性休克等重度症状,甚至危及生命。多西他赛过敏反应发生率低于紫杉醇,且症状较轻;而紫杉醇脂质体、紫杉醇白蛋白结合型则很少发生过敏反应。
临床上需将过敏反应与输液反应相鉴别。
3.1.1.1预防
预处理可以明显减轻紫杉醇的过敏反应。紫杉醇3周方案预处理推荐:治疗开始前12 h 和6 h口服20 mg地塞米松,治疗前30 min给予H1受体拮抗剂(如苯海拉明50 mg或异丙嗪25 mg静脉输注)及H2受体拮抗剂(如西咪替丁300 mg或法莫替丁20 mg或雷尼替丁50 mg静脉输注),静脉输注地塞米松10 ~ 20 mg。紫杉醇周疗的预处理方案缺乏大样本研究数据,但频繁输注以上预处理药物可能导致严重的淋巴细胞减少症、皮炎、血栓性静脉炎、卡氏肺囊虫肺炎等不良反应[29],临床需密切关注。
尽管进行了预处理,但仍有部分患者发生过敏反应,因此,在紫杉醇输注时需要密切观察与监护,特别是开始输注的前10 min,需严密监测患者生命体征;输注期间加强巡视。
3.1.1.2处理
①立即停止紫杉醇输注,更换输液器和输液瓶,确保静脉通路通畅。②保持呼吸道通畅,吸氧,及时清除呼吸道分泌物,必要时气管插管。③抗过敏治疗:静脉推注地塞米松5 ~ 10 mg,或静脉滴注氢化可的松200 mg。④严密监测生命体征,评估循环和意识水平。
轻度过敏反应经上述处理,患者生命体征平稳 2 ~ 3 h后可采用脱敏疗法和缓慢输注的方式继续尝试紫杉醇治疗。再次发生过敏反应者,可改用紫杉醇脂质体或紫杉醇白蛋白结合型,或非紫杉类药物。
3.1.1.3 重度和危及生命时的抢救
一旦发生应立即停药,迅速进行抗休克、抗过敏等治疗:①第一时间给予0.1%肾上腺素肌内注射 ,成人最大剂量为 1 mg,每15 ~ 30 min重复1次;开通第2条静脉通路,实施液体复苏,前5 ~ 10 min以5 ~ 10 ml/kg的速率快速补充0.9%氯化钠溶液,保证足够的组织灌注。②若患者出现严重低血压或心搏骤停,心肺复苏的同时给予0.1%肾上腺素溶液1 mg静脉注射。当肾上腺素升压无效时可静脉滴注多巴胺溶液,以 1 ~ 5 μg/(kg•min)开始静脉注射,10 min内按1 ~ 4 μg/(kg•min)递增,根据血压情况进行剂量调整。也可将20 mg多巴胺加入200 ~ 300 ml的5%葡萄糖溶液中以75 ~ 100 μg/min的速率开始滴注,最大不得超过500 μg/min,密切观察。③维持呼吸,吸氧。呼吸抑制时注射尼可刹米(皮下注射、肌内注射或静脉注射。成人常用量0.25 ~ 0.5 g/次,必要时1 ~ 2 h 重复用药,极量1.25 g/次)、洛贝林(肌内注射或皮下注射,成人3 ~ 10 mg/次,极量20 mg/次)等呼吸兴奋剂,喉头水肿影响呼吸时,行气管插管或气管切开,如发生呼吸心跳骤停,立即行心肺复苏。④抗过敏治疗:a.糖皮质激素:静脉推注地塞米松 5 ~ 10 mg,或静脉滴注氢化可的松200 mg或甲泼尼龙1 ~ 2 mg/kg(最高可至125 mg);b.H1/H2受体拮抗剂:苯海拉明50 mg(或异丙嗪25 ~ 50 mg)+雷尼替丁50 mg静脉注射;神志清醒者可口服西替利嗪20 mg或氯雷他定10 mg ;⑤其他:补充血容量,纠正酸中毒,静脉注射10%葡萄糖酸钙溶液10 ~ 20 ml。密切观察生命体征,记录液体出入量。
严重超敏反应患者不建议再次尝试普通紫杉类药物。观察24 h后可在密切监护下尝试使用紫杉醇脂质体和紫杉醇白蛋白结合型,或非紫杉类药物。
3.1.2 骨髓抑制
紫杉类药物为细胞周期特异性药物,所致骨髓抑制系剂量限制毒性,含紫杉醇的方案系发生骨髓抑制的中-高风险方案[30]。中性粒细胞绝对值(absolute neutrophil count,ANC)7 ~ 14 d 降至最低,15 ~ 20 d基本恢复,当ANC < 1.5× 109/L时即可诊断为中性粒细胞减少症。12% ~ 20% 的患者在使用紫杉醇过程中可发生中性粒细胞减少性发热(febrile neutropenia,FN),即ANC < 1000 个/mm3伴单次体温> 38.3℃,或持续体温≥38℃ 超过1 h。FN为中性粒细胞减少症中最严重的临床事件,严重者甚至发生感染和死亡。在使用紫杉醇的患者中[31],30%的患者和9%的疗程中可能因此发生感染,最常见的感染是泌尿道和上呼吸道感染, 1%的患者可发生致死性感染,必须引起高度重视。此外,还有7%的患者可出现3级及以上血小板减少(血小板< 50×109/L),4%的疗程和14%的患者有血小板减少所致局部出血。78%的患者治疗中可出现贫血,其中16%的患者血红蛋白< 80 g/L,即3 级或以上贫血。
3.1.2.1预防
紫杉醇治疗过程中应动态监测血液学毒性。发生血液学毒性应按照相关指南[30]进行处理,按不良反应级别对紫杉醇进行减量,根据患者情况必要时输注成分血或全血、预防/治疗性使用抗生素等。
3.1.2.2处理
粒细胞集落刺激因子(granulocyte colony stimulating factor,G-CSF)的剂量及用法:①短效G-CSF[重组人粒细胞集落刺激因子(recombinant human granulocyte colony stimulating factor, rhG-CSF)] :化疗结束24 h后使用,剂量为5 μg/kg,皮下或静脉注射,1次/d ;若为治疗性用药,需使用到ANC达到或接近正常水平。②长效G-CSF[聚乙二醇化重组人粒细胞集落刺激因子(polyethylene glycol recombinant human granulocyte colony stimulating factor,PEG-rhG-CSF)]:化疗结束后24 h使用,剂量为6 mg或100 μg/kg皮下注射1次;不建议同时加用rhG-CSF[32],但若ANC < 0.5×109/L持续时间≥3d,可以使用rhG-CSF进行补救治疗。紫杉醇周疗方案如何规范使用G-CSF目前尚无足够证据,有待进一步研究。关于FN患者是否使用抗生素预防感染有一定争议。通常需先按照国际癌症支持治疗学会风险评估表进行评分,≥21分者系感染低风险患者[33],可口服抗生素预防感染;感染高风险(< 21分)患者需静脉使用抗生素,降低或避免威胁生命的感染性疾病。
3.1.3 神经毒性
发生机制不清,紫杉类药物抑制微管蛋白解聚所致的微管功能障碍可能是导致神经毒性的主要原因,轴突转运需要完整的微管,神经元的存活和功能依赖于轴突的转运。此外,紫杉醇急性疼痛综合征的发生机制可能与炎症相关因子有关。
临床表现为急性暂时性神经毒性和慢性长期性神经毒性两种类型。患者通常以感觉神经病变为主要表现,包括运动和感觉神经病变,呈剂量依赖性和累积性特点,部分可以逆转[34]。当单次剂量> 175 mg/m2时即可发生神经毒性反应,主要表现为肢体麻木、触觉丧失、疼痛灼热,呈手套-袜套样改变,罕见癫痫大发作、晕厥、共济失调[35],当剂量累积达400 mg/m2时可能发生严重外周神经毒性。紫杉醇较多西他赛更具神经毒性[35],任意级别神经病变的总体发生率分别为57% ~ 60%和11% ~ 64% ;紫杉醇发生严重(3或4级)的感觉性神经病较多西他赛常见,分别为2% ~ 33%和3% ~ 14%。紫杉醇脂质体联合卡铂在降低相关不良反应发生率方面明显优于普通紫杉醇联合卡铂[36]。
3.1.3.1预防
尚无生物学标志物可以预测神经毒性的发生。总体来说,神经毒性的发生主要与累积剂量和强度有关,紫杉醇和多西他赛所致神经毒性的起始剂量分别为100 ~ 300 mg/m2和75 ~ 100 mg/m2。此外,还与年龄、种族、肿瘤大小、是否合并使用同样有神经毒性的药物以及是否有其他基础神经疾病等有关[34]。
3.1.3.2处理
加强患者教育和医患沟通,及时处理。目前辅助治疗药物包括:①谷胱甘肽:阻止药物在后跟神经节聚集[37] ;②钙镁合剂:螯合奥沙利铂的代谢产物草酸盐,降低其对神经细胞膜离子通道的影响[38] ;③钠离子通道阻滞剂:卡马西平[39] ;④氨磷汀(阿米斯汀):细胞保护剂[40];⑤度洛西汀:明显改善紫杉醇所致急性疼痛综合征[34]。
3.1.4 脱发
紫杉醇常见不良反应,发生率高达80%,原因不明,影响患者生活质量,增加患者自卑感。但迄今为止,尚无高证据级别的有效预防方法。
3.2 少见的严重不良反应[31]
紫杉醇少见的严重不良反应文献多为个例报道,心血管系统相关的严重不良反应有晕厥、心律失常(室上性心动过速、二联律、完全性房室传导阻滞)、高血压和静脉血栓。消化系统的严重不良反应有胃肠道穿孔、肠梗阻、胰腺炎、肝坏死、致死性肝性脑病等。呼吸系统严重不良反应有肺间质纤维化、肺栓塞、胸腔积液和呼吸衰竭等。另外,多西他赛有罕见重度手足综合征、狼疮性皮炎、大疱状皮疹的报道。
紫杉醇输注前应仔细询问患者病史,包括既往史、家族史,评估患者基线情况。治疗前与患者、家属和/或监护人充分沟通,做好患者教育;输注时建立外周或中心静脉通道,使用心电监护仪,加强医护巡视,及时发现不良反应。一旦发生严重不良反应,应立即停止药物输注,严密监测患者生命体征,常需多学科专家团队共同参与,积极救治,并告知患者及其家属不得再次使用紫杉类药物。
综上所述,紫杉类药物是妇科恶性肿瘤常用化疗药物,广泛用于卵巢癌、宫颈癌、子宫内膜癌和其他一些罕见肿瘤的辅助治疗,其与铂类联合使用是妇科恶性肿瘤的基本化疗方案。与其他化疗药物相比,紫杉类药物适应证较广,有效率较高,患者对其不良反应的耐受性较好。除与其他化疗药物共有的血液学毒性之外,过敏反应与神经毒性的防治应引起临床医师的高度重视。
共识执笔人:李小平 姜 洁 尹如铁 鹿 欣 李秀琴 张国楠 孔北华
共识专家组成员(按姓氏笔画排序):
万小平 上海市第一妇婴保健院
马 丁 华中科技大学同济医学院附属同济医院
王丹波 辽宁省肿瘤医院
王世宣 华中科技大学同济医学院附属同济医院
王建六 北京大学人民医院
王新宇 浙江大学医学院附属妇产科医院
尹如铁 四川大学华西第二医院
孔北华 山东大学齐鲁医院
曲芃芃 天津市中心妇产科医院
向 阳 中国医学科学院北京协和医院
刘继红 中山大学肿瘤防治中心
李小平 北京大学人民医院
李秀琴 中国医科大学附属盛京医院
杨兴升 山东大学齐鲁医院
杨佳欣 中国医学科学院北京协和医院
吴小华 复旦大学附属肿瘤医院
吴令英 中国医学科学院肿瘤医院
沈 铿 中国医学科学院北京协和医院
宋 坤 山东大学齐鲁医院
张国楠 四川省肿瘤医院
赵 霞 四川大学华西第二医院
哈春芳 宁夏医科大学总医院
姜 洁 山东大学齐鲁医院
徐丛剑 复旦大学附属妇产科医院
高雨农 北京大学肿瘤医院
郭瑞霞 郑州大学第一附属医院
崔 恒 北京大学人民医院
康 山 河北医科大学第四医院
鹿 欣 复旦大学附属妇产科医院
梁志清 陆军军医大学第一附属医院
程文俊 江苏省人民医院
谢 幸 浙江大学医学院附属妇产科医院
[1] National Comprehensive Cancer Network. NCCN clinical practice guidelines in Oncology: Ovarian Cancer including fallopian tube cancer and primary peritoneal cancer(2019. V1)[OL]. (2019-03-08)[2019-04-30]. https://www.nccn.org/ professionals/physician_gls/pdf/ovarian.pdf.
[2] Burger RA, Brady MF, Bookman MA, et al. Incorporation of bevacizumab in the primary treatment of ovarian cancer[J]. N Engl J Med, 2011, 365(26):2473-2483.
[3] Perren TJ, Swart AM, Pfisterer J, et al. A phase 3 trial of bevacizu mab in ovarian cancer[J]. N Engl J Med, 2011, 365(26): 2484-2496.
[4] Vasey PA, Jayson GC, Gordon A, et al. PhaseⅢ randomized trial of docetaxel-carboplatin versus paclitaxel-carboplatin as first-line chemotherapy for ovarian carcinoma[J]. J Natl Cancer Inst, 2004, 96(22):1682-1691.
[5] Marchetti C, De Felice F, Perniola G, et al. Role of intrape r itoneal chemotherapy in ovarian cancer in the platinum-taxanebased era: A meta-analysis[J]. Crit Rev Oncol Hematol, 2019, 136:64-69.
[6] van Driel WJ, Koole SN, Sikorska K, et al. Hyperthermic Intraperitoneal Chemotherapy in Ovarian Cancer[J]. N Engl J Med, 2018, 378(3):230-240.
[7] Moore K, Stone R, Walter A. Society of Gynecologic Oncology 2016 Annual Meeting: Highlights and context[J]. Gynecol Oncol, 2016, 141(3):416-420.
[8] Chi DS, Musa F, Dao F, et al. An analysis of patients with bulky advanced stage ovarian, tubal, and peritoneal carcinoma treated with primary debulking surgery (PDS) during an identical time period as the randomized EORTC-NCIC trial of PDS vs neoadjuvant chemotherapy (NACT)[J]. Gynecol Oncol, 2012, 124(1):10-14.
[9] Markman M, Liu PY, Wilczynski S, et al. Phase Ⅲ randomized trial of 12 versus 3 months of maintenance paclitaxel in patients with advanced ovarian cancer after complete response to platinum and paclitaxel-based chemotherapy: a Southwest Oncology Group and Gynecologic Oncology Group trial[J]. J Clin Oncol, 2003, 21(13):2460-2465.
[10] Gupta S, Parab P, Kerkar R, et al. Neoadjuvant chemotherapy followed by surgery (NACT-surgery) versus concurrent cisplatin and radiation therapy (CTRT) in patients with stageⅠB2 toⅡB squamous carcinoma of cervix: A randomized controlled trial (RCT)[J]. Ann of Oncol, 2017, 28(suppl_5).
[11] National Comprehensive Cancer Network. NCCN clinical practice guidelines in Oncology: Cervical Cancer (2019. V4)[OL]. (2019-03-29)[2019-04-30]. https://www.nccn.org/ professionals/physician_gls/pdf/cervical.pdf.
[12] Tewari KS, Sill MW, Penson RT, et al. Bevacizumab for advanced cervical cancer: final overall survival and adverse event analysis of a randomised, controlled, open-label, phase 3 trial (Gynecologic Oncology Group 240)[J]. Lancet, 2017, 390(10103):1654-1663.
[13] Kitagawa R, Katsumata N, Shibata T, et al. Paclitaxel Plus Carboplatin Versus Paclitaxel Plus Cisplatin in Metastatic or Recurrent Cervical Cancer: The Open-Label Randomized Phase Ⅲ Trial JCOG0505[J]. J Clin Oncol, 2015, 33(19):2129-2135.
[14] National Comprehensive Cancer Network. NCCN clinical practice guidelines in Oncology: Uterine Neoplasms (2019. V3)[OL]. (2019-02-11)[2019-04-30]. https://www.nccn.org/ professionals/physician_gls/pdf/uterine.pdf.
[15] de Boer SM, Powell ME, Mileshkin L, et al. Toxicity and quality of life after adjuvant chemoradiotherapy versus radiotherapy alone for women with high-risk endometrial cancer (PORTEC-3): an open-label, multicentre, randomised, phase 3 trial[J]. Lancet Oncol, 2016, 17(8):1114-1126.
[16] Simpkins F, Drake R, Escobar PF, et al. A phaseⅡ trial of paclit axel, carboplatin, and bevacizumab in advanced and recurrent endometrial carcinoma (EMCA)[J]. Gynecol Oncol, 2015, 136(2): 240-245.
[17] Powell MA, Filiaci VL, Rose PG, et al. Phase Ⅱ evaluation of paclitaxel and carboplatin in the treatment of carcinosarcoma of the uterus: a Gynecologic Oncology Group study[J]. J Clin Oncol, 2010, 28(16):2727-2731.
[18] Ngan HYS, Seckl MJ, Berkowitz RS, et al. Update on the diagnosis and management of gestational trophoblastic disease[J]. Int J Gynaecol Obstet, 2018, 143(Suppl 2):79-85.
[19] Alazzam M, Tidy J, Osborne R, et al. Chemotherapy for resistant or recurrent gestational trophoblastic neoplasia[J]. Cochrane Database Syst Rev, 2016(1):CD008891.
[20] Szebeni J, Muggia FM, Alving CR. Complement activation by Cremophor EL as a possible contributor to hypersensitivity to paclitaxel: an in vitro study[J]. J Natl Cancer Inst, 1998, 90(4):300-306.
[21] Ebo DG, Piel GC, Conraads V, et al. IgE-mediated anaphylaxis after first intravenous infusion of cyclosporine[J]. Ann Allergy Asthma Immunol, 2001, 87(3):243-245.
[22] Essayan DM, Kagey-Sobotka A, Colarusso PJ, et al. Successful parenteral desensitization to paclitaxel[J]. J Allergy Clin Immunol, 1996, 97(1 Pt 1):42-46.
[23] Prieto García A, Pineda de la Losa F. Immunoglobulin E-mediated severe anaphylaxis to paclitaxel[J]. J Investig Allergol Clin Immunol, 2010, 20(2):170-171.
[24] Picard M, Castells MC. Re-visiting hypersensitivity reactions to taxanes: a comprehensive review[J]. Clin Rev Allergy Immunol, 2015, 49(2):177-191.
[25] Madrigal-Burgaleta R, Berges-Gimeno MP, Angel-Pereira D, et al.Hypersensitivity and desensitization to antineoplastic agents: outcomes of 189 procedures with a new short protocol and novel diagnostic tools assessment[J]. Allergy, 2013, 68(7):853-861.
[26] Gastaminza G, de la Borbolla JM, Goikoetxea MJ, et al. A new rapid desensitization protocol for chemotherapy agents[J]. J Investig Allergol Clin Immunol, 2011, 21(2):108-112.
[27] Italian Association of Aerobiology. An epidemiological survey of Cupressaceae pollenosis in Italy[J]. J Investig Allergol Clin Immunol, 2002, 12(4):287-292.
[28] Rowinsky EK, Donehower RC. Paclitaixel (Taxol)[J]. N Engl J Med, 1995, 332(15):1004-1014.
[29] Reckzeh B, Merte H, Pflüger KH, et al. Severe lymphocytopenia and interstitial pneumonia in patients treated with paclitaxel and simultaneous radiotherapy for non-small-cell lung cancer[J]. J Clin Oncol, 1996,14(4):1071-1076.
[30] National Comprehensive Cancer Network. NCCN Clinical Practice Guidelines in Oncology: Hematopoietic growth factor (2019.V2)[OL]. (2019-03-27)[2019-04-30]. https://www.nccn. org/professionals/physician_gls/pdf/growthfactors.pdf.
[31] Anon. Taxol toxicology data network[OL]. (2009-01-05) [2019-05-20]. https://toxnet.nlm.nih.gov/cgi-bin/sis/search/ a?dbs+hsdb:@term+@DOCNO+6839
[32] Johnstone E, Crawford J, Blackwell S, et al. Randomized, doseescalation study of SD/01 compared with daily filgrastim in patients receiving chemotherapy[J]. J Clin Oncol, 2000, 18(13):2522-2528.
[33] Klastersky J, de Naurois J, Rolston K, et al. Management of febrile neutropaenia: ESMO Clinical Practice Guidelines[J]. Ann Oncol, 2016, 27(suppl5):v111-v118.
[34] Velasco R, Bruna J. Taxane-Induced Peripheral Neurotoxicity[J]. Toxics, 2015, 3(2):152-169.
[35] Freilich RJ, Balmaceda C, Seidman AD, et al. Motor neuropathy due to docetaxel and paclitaxel[J]. Neurology, 1996, 47(1):115-118.
[36] 卢佳,芦芸,杨永秀,等.紫杉醇脂质体联合卡铂治疗卵巢癌疗效及安全性的系统评价[J].中国循证医学杂志,2012,12(1):42-48.
[37] Caxciru S, CataLano V, Condella L, et al. Neuroprotective effect of reduced glutathione on oxaliplatin-based chemotherapy in advanced cobrectal cancer a randomized,double-blind, placebocontrolled trial[J]. J Clin Oncol, 2002, 20(16):3478-3483.
[38] Gamelin L, Boisdron-Celle M, Delva R, et al. Prevention of oxaliplatin-related neurotoxicity by calcium and magnesium infusions: a retrospective study of 161 patients receiving oxaliplatin combined with 5-Fluorouracil and leucovorin for advanced colorectal cancer[J]. Clin Cancer Res, 2004, 10(12 Pt 1):4055-4061.
[39] Zhou M, Chen N, He L, et al. Oxcarbazepine for neuropathic pain[J]. Cochrane Database Syst Rev, 2017, 12:CD007963.
[40] Penz M, Kornek GV, Raderer M, et al. Subcutaneous administration of amifostine: A promising therapeutic option in patients with oxaliplatin related peripheral senstive neuropathy[J]. Ann Oncol, 2001, 2(3):421-422.
[1] National Comprehensive Cancer Network. NCCN clinical practice guidelines in Oncology: Ovarian Cancer including fallopian tube cancer and primary peritoneal cancer(2019. V1)[OL]. (2019-03-08)[2019-04-30]. https://www.nccn.org/ professionals/physician_gls/pdf/ovarian.pdf.
[2] Burger RA, Brady MF, Bookman MA, et al. Incorporation of bevacizumab in the primary treatment of ovarian cancer[J]. N Engl J Med, 2011, 365(26):2473-2483.
[3] Perren TJ, Swart AM, Pfisterer J, et al. A phase 3 trial of bevacizu mab in ovarian cancer[J]. N Engl J Med, 2011, 365(26): 2484-2496.
[4] Vasey PA, Jayson GC, Gordon A, et al. PhaseⅢ randomized trial of docetaxel-carboplatin versus paclitaxel-carboplatin as first-line chemotherapy for ovarian carcinoma[J]. J Natl Cancer Inst, 2004, 96(22):1682-1691.
[5] Marchetti C, De Felice F, Perniola G, et al. Role of intrape r itoneal chemotherapy in ovarian cancer in the platinum-taxanebased era: A meta-analysis[J]. Crit Rev Oncol Hematol, 2019, 136:64-69.
[6] van Driel WJ, Koole SN, Sikorska K, et al. Hyperthermic Intraperitoneal Chemotherapy in Ovarian Cancer[J]. N Engl J Med, 2018, 378(3):230-240.
[7] Moore K, Stone R, Walter A. Society of Gynecologic Oncology 2016 Annual Meeting: Highlights and context[J]. Gynecol Oncol, 2016, 141(3):416-420.
[8] Chi DS, Musa F, Dao F, et al. An analysis of patients with bulky advanced stage ovarian, tubal, and peritoneal carcinoma treated with primary debulking surgery (PDS) during an identical time period as the randomized EORTC-NCIC trial of PDS vs neoadjuvant chemotherapy (NACT)[J]. Gynecol Oncol, 2012, 124(1):10-14.
[9] Markman M, Liu PY, Wilczynski S, et al. Phase Ⅲ randomized trial of 12 versus 3 months of maintenance paclitaxel in patients with advanced ovarian cancer after complete response to platinum and paclitaxel-based chemotherapy: a Southwest Oncology Group and Gynecologic Oncology Group trial[J]. J Clin Oncol, 2003, 21(13):2460-2465.
[10] Gupta S, Parab P, Kerkar R, et al. Neoadjuvant chemotherapy followed by surgery (NACT-surgery) versus concurrent cisplatin and radiation therapy (CTRT) in patients with stageⅠB2 toⅡB squamous carcinoma of cervix: A randomized controlled trial (RCT)[J]. Ann of Oncol, 2017, 28(suppl_5).
[11] National Comprehensive Cancer Network. NCCN clinical practice guidelines in Oncology: Cervical Cancer (2019. V4)[OL]. (2019-03-29)[2019-04-30]. https://www.nccn.org/ professionals/physician_gls/pdf/cervical.pdf.
[12] Tewari KS, Sill MW, Penson RT, et al. Bevacizumab for advanced cervical cancer: final overall survival and adverse event analysis of a randomised, controlled, open-label, phase 3 trial (Gynecologic Oncology Group 240)[J]. Lancet, 2017, 390(10103):1654-1663.
[13] Kitagawa R, Katsumata N, Shibata T, et al. Paclitaxel Plus Carboplatin Versus Paclitaxel Plus Cisplatin in Metastatic or Recurrent Cervical Cancer: The Open-Label Randomized Phase Ⅲ Trial JCOG0505[J]. J Clin Oncol, 2015, 33(19):2129-2135.
[14] National Comprehensive Cancer Network. NCCN clinical practice guidelines in Oncology: Uterine Neoplasms (2019. V3)[OL]. (2019-02-11)[2019-04-30]. https://www.nccn.org/ professionals/physician_gls/pdf/uterine.pdf.
[15] de Boer SM, Powell ME, Mileshkin L, et al. Toxicity and quality of life after adjuvant chemoradiotherapy versus radiotherapy alone for women with high-risk endometrial cancer (PORTEC-3): an open-label, multicentre, randomised, phase 3 trial[J]. Lancet Oncol, 2016, 17(8):1114-1126.
[16] Simpkins F, Drake R, Escobar PF, et al. A phaseⅡ trial of paclit axel, carboplatin, and bevacizumab in advanced and recurrent endometrial carcinoma (EMCA)[J]. Gynecol Oncol, 2015, 136(2): 240-245.
[17] Powell MA, Filiaci VL, Rose PG, et al. Phase Ⅱ evaluation of paclitaxel and carboplatin in the treatment of carcinosarcoma of the uterus: a Gynecologic Oncology Group study[J]. J Clin Oncol, 2010, 28(16):2727-2731.
[18] Ngan HYS, Seckl MJ, Berkowitz RS, et al. Update on the diagnosis and management of gestational trophoblastic disease[J]. Int J Gynaecol Obstet, 2018, 143(Suppl 2):79-85.
[19] Alazzam M, Tidy J, Osborne R, et al. Chemotherapy for resistant or recurrent gestational trophoblastic neoplasia[J]. Cochrane Database Syst Rev, 2016(1):CD008891.
[20] Szebeni J, Muggia FM, Alving CR. Complement activation by Cremophor EL as a possible contributor to hypersensitivity to paclitaxel: an in vitro study[J]. J Natl Cancer Inst, 1998, 90(4):300-306.
[21] Ebo DG, Piel GC, Conraads V, et al. IgE-mediated anaphylaxis after first intravenous infusion of cyclosporine[J]. Ann Allergy Asthma Immunol, 2001, 87(3):243-245.
[22] Essayan DM, Kagey-Sobotka A, Colarusso PJ, et al. Successful parenteral desensitization to paclitaxel[J]. J Allergy Clin Immunol, 1996, 97(1 Pt 1):42-46.
[23] Prieto García A, Pineda de la Losa F. Immunoglobulin E-mediated severe anaphylaxis to paclitaxel[J]. J Investig Allergol Clin Immunol, 2010, 20(2):170-171.
[24] Picard M, Castells MC. Re-visiting hypersensitivity reactions to taxanes: a comprehensive review[J]. Clin Rev Allergy Immunol, 2015, 49(2):177-191.
[25] Madrigal-Burgaleta R, Berges-Gimeno MP, Angel-Pereira D, et al.Hypersensitivity and desensitization to antineoplastic agents: outcomes of 189 procedures with a new short protocol and novel diagnostic tools assessment[J]. Allergy, 2013, 68(7):853-861.
[26] Gastaminza G, de la Borbolla JM, Goikoetxea MJ, et al. A new rapid desensitization protocol for chemotherapy agents[J]. J Investig Allergol Clin Immunol, 2011, 21(2):108-112.
[27] Italian Association of Aerobiology. An epidemiological survey of Cupressaceae pollenosis in Italy[J]. J Investig Allergol Clin Immunol, 2002, 12(4):287-292.
[28] Rowinsky EK, Donehower RC. Paclitaixel (Taxol)[J]. N Engl J Med, 1995, 332(15):1004-1014.
[29] Reckzeh B, Merte H, Pflüger KH, et al. Severe lymphocytopenia and interstitial pneumonia in patients treated with paclitaxel and simultaneous radiotherapy for non-small-cell lung cancer[J]. J Clin Oncol, 1996,14(4):1071-1076.
[30] National Comprehensive Cancer Network. NCCN Clinical Practice Guidelines in Oncology: Hematopoietic growth factor (2019.V2)[OL]. (2019-03-27)[2019-04-30]. https://www.nccn. org/professionals/physician_gls/pdf/growthfactors.pdf.
[31] Anon. Taxol toxicology data network[OL]. (2009-01-05) [2019-05-20]. https://toxnet.nlm.nih.gov/cgi-bin/sis/search/ a?dbs+hsdb:@term+@DOCNO+6839
[32] Johnstone E, Crawford J, Blackwell S, et al. Randomized, doseescalation study of SD/01 compared with daily filgrastim in patients receiving chemotherapy[J]. J Clin Oncol, 2000, 18(13):2522-2528.
[33] Klastersky J, de Naurois J, Rolston K, et al. Management of febrile neutropaenia: ESMO Clinical Practice Guidelines[J]. Ann Oncol, 2016, 27(suppl5):v111-v118.
[34] Velasco R, Bruna J. Taxane-Induced Peripheral Neurotoxicity[J]. Toxics, 2015, 3(2):152-169.
[35] Freilich RJ, Balmaceda C, Seidman AD, et al. Motor neuropathy due to docetaxel and paclitaxel[J]. Neurology, 1996, 47(1):115-118.
[36] 卢佳,芦芸,杨永秀,等.紫杉醇脂质体联合卡铂治疗卵巢癌疗效及安全性的系统评价[J].中国循证医学杂志,2012,12(1):42-48.
[37] Caxciru S, CataLano V, Condella L, et al. Neuroprotective effect of reduced glutathione on oxaliplatin-based chemotherapy in advanced cobrectal cancer a randomized,double-blind, placebocontrolled trial[J]. J Clin Oncol, 2002, 20(16):3478-3483.
[38] Gamelin L, Boisdron-Celle M, Delva R, et al. Prevention of oxaliplatin-related neurotoxicity by calcium and magnesium infusions: a retrospective study of 161 patients receiving oxaliplatin combined with 5-Fluorouracil and leucovorin for advanced colorectal cancer[J]. Clin Cancer Res, 2004, 10(12 Pt 1):4055-4061.
[39] Zhou M, Chen N, He L, et al. Oxcarbazepine for neuropathic pain[J]. Cochrane Database Syst Rev, 2017, 12:CD007963.
[40] Penz M, Kornek GV, Raderer M, et al. Subcutaneous administration of amifostine: A promising therapeutic option in patients with oxaliplatin related peripheral senstive neuropathy[J]. Ann Oncol, 2001, 2(3):421-422.