 去看看
去看看


2019年8月,日本高血压学会(Japanese Society of Hypertension,JSH)修订了2014年日本高血压管理指南(JSH 2014)[1],并发表了2019年日本高血压管理指南(JSH 2019)[2]。JSH 2019英文版共 14章247页,引用参考文献1700篇,内容详尽丰富。新指南采用了两种描述方法,即除常规教科书描述方法外,还根据Minds指南手册确定了与高血压管理相关的17项临床问题,并通过系统综述阐明证据予以回答,给出最终建议。其中很多系统综述论文已发表于Hypertension Research,未发表的系统综述和相关数据可于JSH网站查看。这种临床问题解答的方式便于更好地认识指南并指导临床医生工作,对我国高血压的管理具有重要的参考价值。本文结合JSH 2014、美国心脏协会(American Heart Association,AHA) 2017[3]、欧洲心脏病学会(European Society of Cardiology,ESC)2018[4]和中国高血压防治指南(2018年修订版)[5],对JSH 2019核心内容进行简要概述,与大家共勉。
1 日本高血压流行病学
2017年统计数据显示,日本的高血压患者人数为4300万,与2010年相比无显著变化。日本每年因高血压导致的心血管疾病死亡人数为10万人,居所有心血管疾病死亡人数之首,约50%的心血管疾病患者死亡是由血压> 120/80 mmHg导致的。值得注意的是,日本在过去36年中,高血压治疗率持续上升,60 ~ 69岁人群高血压治疗率超过50%,70 ~ 79岁超过60% ;男性高血压控制率约为40%,女性约为45%。在过去的60年间,日本高血压患者的平均收缩压在每个年龄组均有明显下降趋势。这得益于日本近年来出台的一系列防治高血压的公共卫生措施。
2 高血压检查和诊断
2.1 推荐使用电子生成压力柱血压计
根据《关于汞的水俣公约》,日本从2021年开始将禁止制造和进口水银血压计,因此指南不推荐使用水银血压计。作为水银血压计的替代品,建议使用电子生成压力柱(electronically generated pressure column,EPC)血压计测量血压。除诊室血压外,家庭血压监测(home blood pressure monitoring,HBPM)和24 h动态血压监测(ambulatory blood pressure monitoring, ABPM)可用于诊断高血压、白大衣性高血压和隐蔽性高血压,以及评估药物疗效及其持续时间。
2.2 血压水平分类更加积极
JSH 2019血压水平分类和定义如下:诊室血压< 120/80 mmHg为正常血压,120 ~ 129/ < 80 mmHg为正常高值血压, 130 ~ 139/80 ~ 89 mmHg为血压升高。更改了JSH 2014 中血压水平分类的方法:去除了诊室血压< 140/90 mmHg被视为正常范围血压的概念和< 120/80 mmHg 为最佳血压的表达,将原来采用的“正常血压(120 ~ 129/80 ~ 84 mmHg)”和“正常高值血压(130 ~ 139/85 ~ 89 mmHg)”分别更改为“正常高值血压”和“血压升高”,这两类舒张压范围分别更改为< 80 mmHg 与80 ~ 89 mmHg,以便与新指南中降压治疗目标值一致。这一更新主要是基于欧美和日本的研究结果:血压为120 ~ 129/80 ~ 84 mmHg和血压为 130 ~ 139/85 ~ 89 mmHg的个体心血管疾病发病率高于血压< 120/80 mmHg的个体。
2.3 高血压诊断标准未变
高血压诊断标准因诊室血压、HBPM和ABPM而异,诊室血压≥140/90 mmHg、HBPM≥135/85 mmHg、平均24 h ABPM≥130/80 mmHg均被认为是高血压,与JSH 2014诊断标准相同,并未同AHA 2017高血压指南一样将诊室血压诊断标准下调至130/80mmHg。专家组认为 AHA 2017高血压指南诊断标准参考的随机对照研究(randomized controlled trial,RCT)中基于日本高血压人群的研究证据并不充分(表1)。
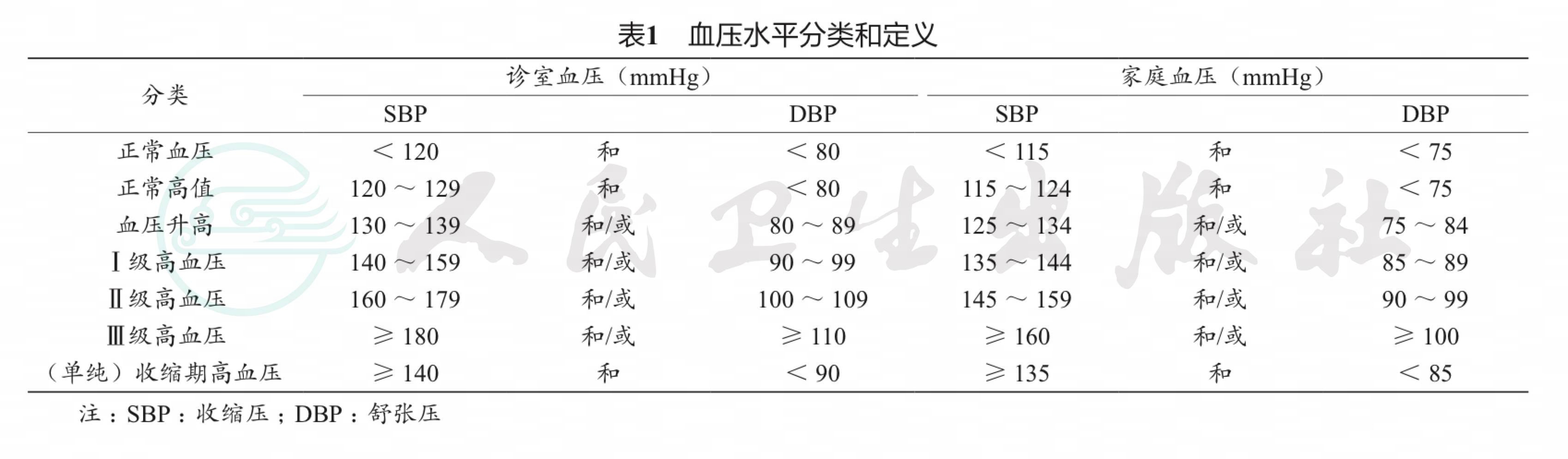
2.4 首次提出根据家庭血压监测进行高血压分级的标准
日本家庭血压计应用极为广泛,据统计,有77%的高血压患者和40%的非高血压人群拥有血压计并进行HBPM。因此,JSH 2019根据HBPM对高血压进行了分级,这也是第一部提出根据HBPM 进行高血压分级的指南(表1)。同时,指南进一步强调了HBPM的重要性,建议当诊室血压和HBPM诊断不一致时,优先考虑HBPM,并且应根据HBPM 进行降压治疗。HBPM测量不仅有利于诊断白大衣性高血压和隐蔽性高血压,而且对判断降压效果和提高患者依从性也有一定作用。
3 高血压的风险分层
ESC 2018和AHA 2017高血压指南中心血管疾病的总体风险是基于欧洲和美国队列研究结果评估的绝对风险,如动脉粥样硬化性心血管疾病(arteriosclerotic cardiovascular disease,ASCVD)和冠状动脉风险评估系统(systematic coronary risk evaluation,SCORE)风险评分,但是在这些国家和地区,高血压对冠状动脉疾病的影响大于对卒中的影响,而日本卒中发生率更高。因此,JSH 2019 按照日本的心血管疾病总体风险,即采用JALS(Japan Arteriosclerosis Longitudinal Study)和Hisayama研究中的评分方法评估心血管疾病风险,其基本原则是:使用日本的证据,根据风险因素计算绝对风险,再根据计算的绝对风险进行风险分层。指南建议血压≥130/80 mmHg或更高分类的个体,应根据血压水平和影响预后的其他因素分为高危、中危和低危3个危险组。影响预后用于危险分层的因素有心血管疾病、高龄(65岁及以上)、性别(男性)、吸烟、血脂异常、糖尿病、脑出血、脑梗死、心肌梗死、非瓣膜病性心房颤动(房颤)和蛋白尿(表2)。与 JSH 2014相比,JSH 2019增加了血压升高组的危险分层,并特别指出男性、非瓣膜病性房颤被用于危险分层。对有心血管疾病病史、房颤、慢性肾脏病(chronic kidney disease,CKD)伴蛋白尿、糖尿病、终末期肾病者均评定为高风险人群。

1 降压治疗策略
降压治疗大致可分为非药物治疗和药物治疗。非药物治疗包括饮食疗法(重点是减少盐摄入)、改变生活方式(例如锻炼、限制饮酒、减轻肥胖)和机械干预,如持续气道正压通气用于睡眠呼吸暂停综合征,肾动脉介入治疗或肾上腺肿瘤切除术用于继发性高血压。JSH 2019强调应根据高血压个体的风险分层制订降压策略。
对于正常血压水平的个体建议继续适当的生活方式;血压在正常高值的个体应改善生活方式3 ~ 6 个月;在血压升高的低风险或中等风险个体中,应尝试调整生活方式约3个月,如此期间未观察到血压改善,则强化生活方式调整措施;对血压升高的高风险个体和高血压水平的低风险或中等风险个体,应对其生活方式进行精心策划的干预,并在1 个月后重新评估,如未见改善则应考虑更强的非药物治疗并开始降压药物治疗。有心血管疾病病史的患者风险较高,需要对其生活方式进行计划周密的干预,同时开始降压药物治疗,还应进行相应心血管疾病的二级预防,例如降脂治疗、糖尿病治疗、戒烟和抗栓治疗。这与ESC 2018高血压指南推荐的启动降压药物治疗原则基本相同(图1)。

2 降压靶目标
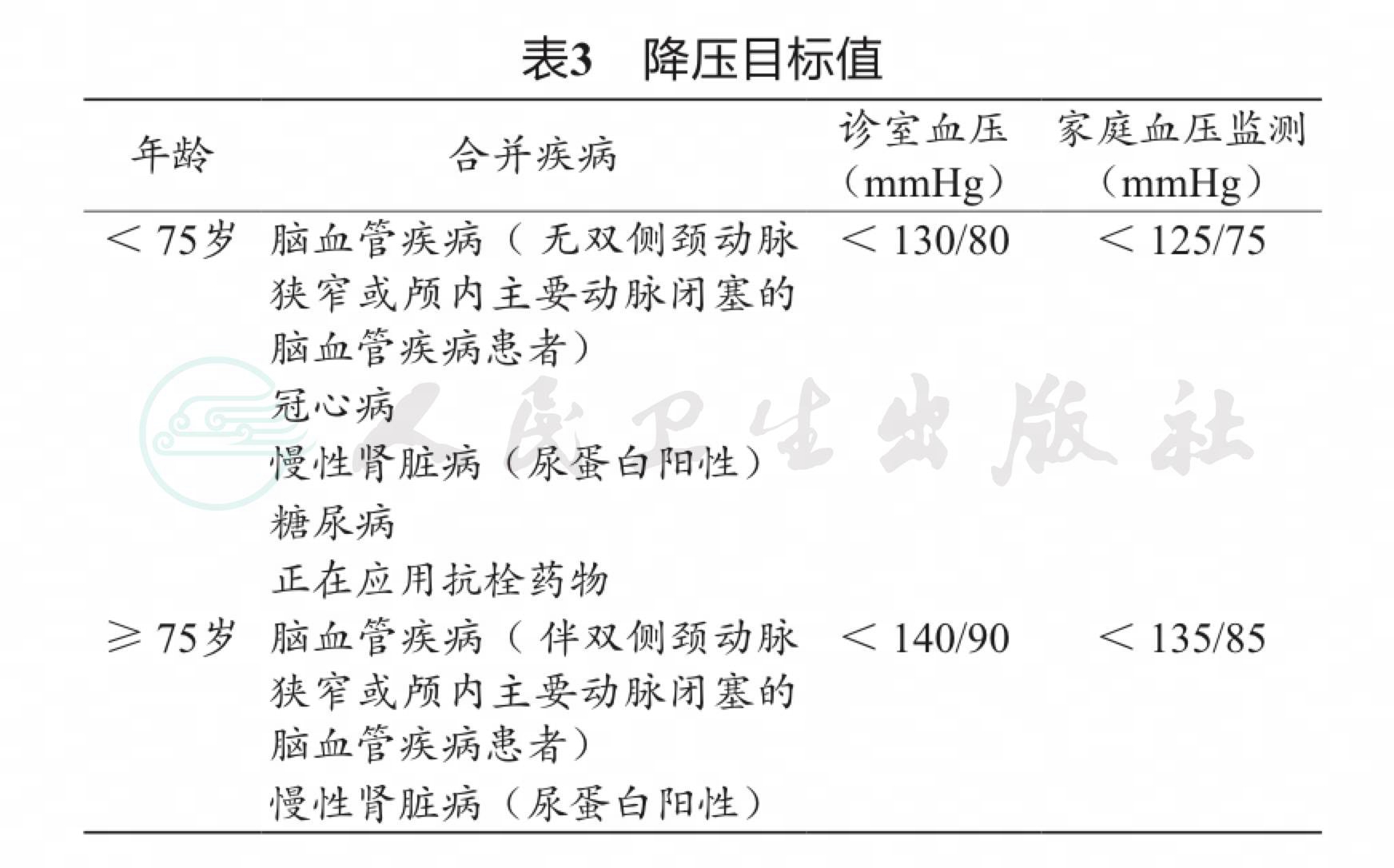
JSH 2019的降压目标较JSH 2014更为严格,建议年龄< 75岁、患有脑血管疾病(无双侧颈动脉狭窄和脑主干动脉闭塞)、冠状动脉疾病、CKD(蛋白尿阳性)、糖尿病或使用抗栓药物的患者,诊室血压控制目标为< 130/80 mmHg,HBPM < 125/75 mmHg。年龄≥75岁、患有脑血管疾病(双侧颈动脉狭窄和/ 或脑主干动脉闭塞或尚未评价)、CKD(蛋白尿阳性)的患者诊室血压控制目标为< 140/90 mmHg, HBPM < 135/85 mmHg(表3)。这一降压目标的下调与 AHA 2017高血压指南的理念更加接近。
纵观近十年间的日本高血压指南,其对中青年高血压患者的降压靶目标值进行了一系列的调整。JSH 2009推荐目标值为< 130/85mmHg,而JSH 2014 放宽为< 140/90 mmHg,当时认为此目标值血压已经使中青年患者心血管事件明显减少,进一步降低血压的获益仍缺乏循证医学证据。JSH 2019将目标值再次下调至130/80 mmHg,主要是依据SPRINT研究(降压目标值设定为< 120 mmHg)和Cardio-Sis研究(降压目标值为收缩压130 mmHg),这两项研究中严格的血压控制减少了心血管事件,且研究涉及的患者均有风险因素或并发症。另外,荟萃分析显示收缩压控制在130 mmHg以下组患者的冠状动脉疾病发病率或死亡率均显著低于收缩压控制在130 ~ 139 mmHg组。
JSH 2019并未设定降压目标值的下限,原因是迄今为止尚无旨在确定血压控制目标下限水平的临床研究。但是探讨了在降压治疗期间“血压过度下降”的问题。如果收缩压已降至< 120 mmHg,需注意过度降压引起的不良事件。如果老年患者收缩压已降至< 130 mmHg,需要注意血压过度下降的可能性。
JSH 2019推荐将舒张压降至80 mmHg以下,并未设定舒张压的下限值。
6 生活方式调整的非药物治疗方式
JSH 2019再次强调生活方式的改变对血压> 120/80 mmHg个体的重要性,且生活方式改变是任何血压类型都应该遵循的基本治疗。建议进行如下生活方式的调整:①减盐:目标为< 6 g/d ;②膳食结构:应增加水果/蔬菜摄入,减少胆固醇/饱和脂肪酸摄入;③保持适当的体重:体质指数< 25 kg/m2 ;④运动:应进行轻度有氧运动(至少30 min/d或 180 min/周);⑤减少酒精摄入量:酒精摄入量(乙醇)应限制在20 ~ 30 ml/d(男性)或10 ~ 20 ml/d (女性);⑥戒烟:应提供戒烟治疗和指导,避免被动吸烟;⑦其他:应避免接触寒冷环境,管理好情绪和压力等。联合多种生活方式的改变对于降压的效果更好。
7 降压药物的应用原则
7.1 推荐4类一线降压药物
与JSH 2014一致,JSH 2019推荐对于无药物强适应证的高血压患者,初始降压药物应选择钙通道阻滞剂(calcium channel blocker,CCB)、血管紧张素Ⅱ受体拮抗剂(angiotensinⅡreceptor blocker,ARB)、血管紧张素转化酶抑制剂(angiotensin converting enzyme inhibitor, ACEI)和利尿剂。同时应根据不同疾病的合并情况选择相应的降压药物种类。
7.2 明确β受体阻滞剂在高血压治疗中的使用指征
β受体阻滞剂在JSH 2014和JSH 2019指南中均未列入一线用药,但被列为主要降压药物。指南推荐β受体阻滞剂的使用指征为:年轻高血压患者、交感神经功能亢进、劳力性心绞痛、心肌梗死后、高血压并发心动过速、高血压伴高心输出量如甲状腺功能亢进、高肾素型高血压和主动脉夹层。
7.3 强调使用长效降压药物并在数周内使血压达标
无并发症的高血压患者原则上应每天给药1次,使24 h血压控制平稳,某些情况下可根据患者血压波动情况调整用药次数和时间,如每天给药2次,给药时间从早晨改为晚间,或晚间或睡前加服。一项荟萃分析结果显示,夜间口服1种降压药物可降低心血管疾病发生风险。一般高血压患者需逐渐降低血压,但对于Ⅲ级高血压和伴有多种危险因素的高危患者,应在数周内达到目标血压水平。
7.4 强调个体化降压药物的应用
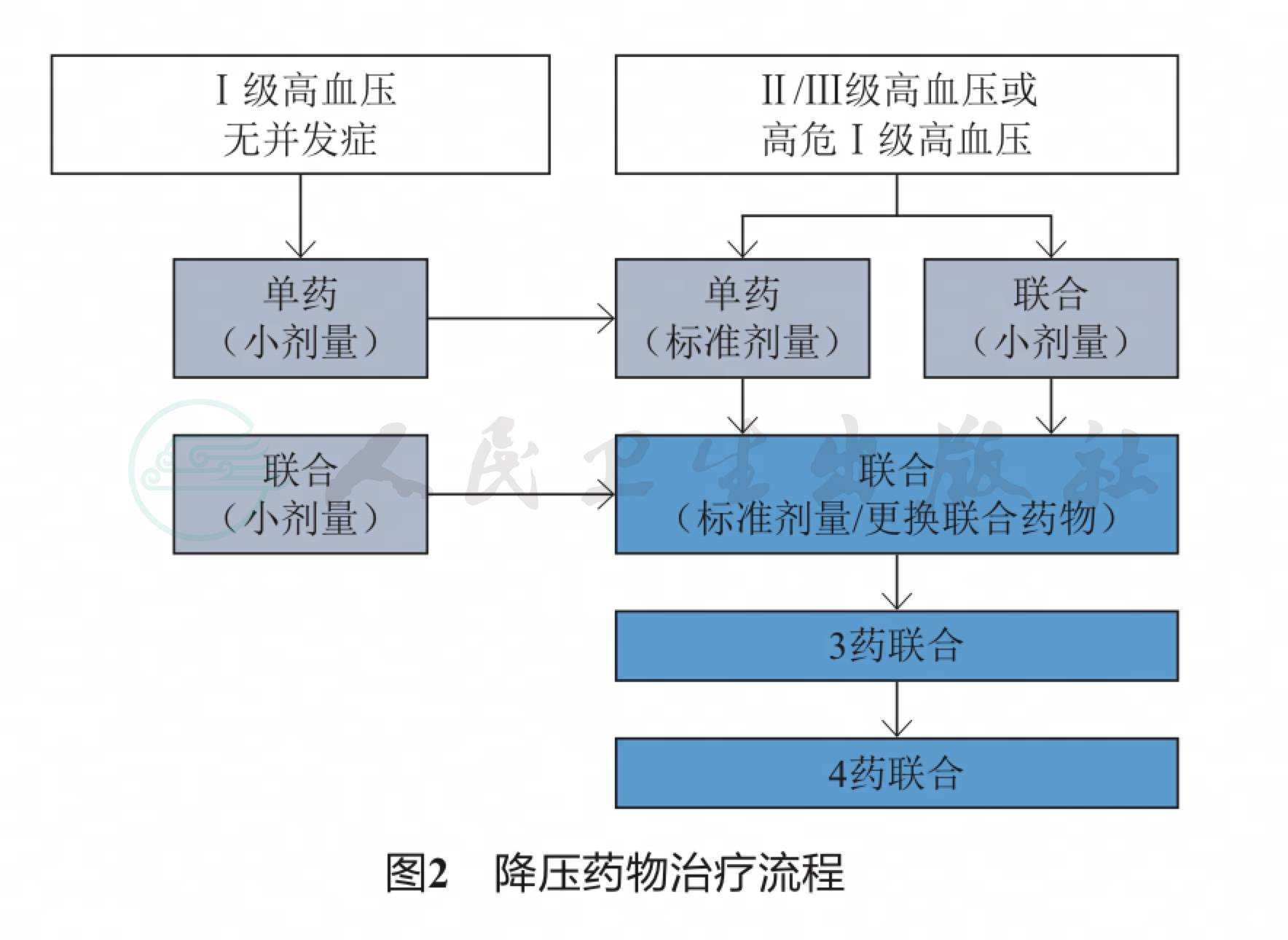
对于Ⅰ级无并发症的高血压患者,起始降压治疗主张应用小剂量单药,如果无效可小剂量联合用药;对于Ⅱ/Ⅲ级或高危Ⅰ级高血压患者,起始降压治疗主张应用单药标准剂量或小剂量联合用药,如无效再2种药物标准剂量联合治疗,或更换降压药物,如仍无效再采用3种或4种药物联合治疗(图2)。
7.5 推荐联合用药方案四部曲
推荐联合用药方案第一步A/C/D,第二步A + C/D或C + D,第三步A + C + D,第四步A + C + D +盐皮质激素受体(mineralocortieoid receptor,MR)拮抗剂/β受体阻滞剂/α受体阻滞剂/肾素抑制剂/其他(非二氢吡啶类CCB、中枢抗交感神经药物或肼屈嗪)(图3)。推荐使用固定复方制剂,有利于提高患者依从性。
7.6 顽固性高血压建议额外给予MR拮抗剂
顽固性高血压是指应用了包括利尿剂在内的3种以上的降压药物(CCB、ACEI/ARB、噻嗪类利尿剂),药物剂量合适,通过调整生活方式,血压仍未降至目标水平的高血压。JSH 2019强调在顽固/难治性高血压诊疗过程中,应考虑生活方式相关因素,同时注意评估可能的继发因素。在联合用药过程中,JSH 2019 提出无论是否存在原发性醛固酮增多症,额外给予MR拮抗剂均有助于降低血压(图3)。

8 肾脏去神经支配术
2014年发表的SYMPLICITY-3研究表明,肾脏去神经支配术组和假手术组之间的降压效应相似,其在疗效审查中由于未达到目标患者数量而中止了在日本进行的临床研究。JSH 2019认为该治疗仍存在许多问题有待解决,如长期的低血压效应和安全性,该治疗并非对所有患者均有效,以及该治疗的成功与否仅通过血压来证实等。但是对于顽固性高血压以外的轻度高血压,肾脏去神经支配术可能是一种有效的非药物治疗方式。
9 高血压并发其他疾病的治疗
9.1 高血压合并慢性缺血性卒中
JSH 2019推荐缺血性卒中慢性期患者的血压控制目标为< 130/80 mmHg。需要注意的是,对双侧颈动脉明显狭窄或大脑动脉主干闭塞的患者,不能过度降压,应以血压< 140/90 mmHg为目标,并推荐CCB、ARB、ACEI 和利尿剂为一线用药,不论脑血管疾病的亚型如何,均可用于高血压慢性期的治疗。JSH 2019对脑血管疾病的分类和治疗目标证据翔实,与JSH 2014和我国2018年高血压指南相比,其对慢性卒中患者的血压控制目标值更为积极。
9.2 高血压合并冠状动脉疾病
JSH 2019建议冠状动脉疾病患者的降压目标为< 130/80 mmHg,并以收缩压< 130 mmHg为优先目标。鉴于国际多项 RCT有关J型曲线的结果不一致,JSH 2019没有提出舒张压降低的下限。但ESC 2018高血压指南则建议此类患者的血压目标值为120 ~ 130/70 ~ 80 mmHg,增加了降压下限。《中国高血压防治指南(2018年修订版)》推荐高血压合并冠心病患者目标血压< 140/90 mmHg,如患者耐受可进一步降至130/80 mmHg,也未明确具体降压下限。
JSH 2019推荐与冠状动脉器质性狭窄有关的心绞痛的一线用药是CCB和无内源性拟交感作用的β 受体阻滞剂。血管痉挛性心绞痛的首选药物为CCB。对陈旧性心肌梗死患者,β受体阻滞剂、肾素-血管紧张素-醛固酮系统(renin-angiotensin-aldosterone system,RAAS)抑制剂和MR拮抗剂可降低病死率,改善患者预后。
9.3 高血压合并心力衰竭
降低心力衰竭患者的血压,可改善其生活质量和预后。射血分数降低的心力衰竭的标准药物治疗为RAAS抑制剂、β受体阻滞剂和利尿剂联合治疗,MR拮抗剂可进一步改善预后,但并未确定血压控制目标值。2017年日本和美国急慢性心力衰竭诊治指南均推荐将收缩压控制在110~130 mmHg。《中国高血压防治指南(2018 年修订版)》推荐高血压合并心力衰竭患者的降压目标为< 130/80 mmHg,但这一推荐尚缺乏充分的RCT证据支持。
对于射血分数保留的心力衰竭患者,JSH 2019 建议控制收缩压< 130 mmHg以防止心力衰竭再入院,但是否改善预后则证据不足。没有证据表明何种降压药物更利于伴射血分数保留的心力衰竭的高血压患者,但应使用利尿剂进行降压治疗。
9.4 高血压合并房颤
高血压是房颤的主要危险因素,严格控制血压并使收缩压< 130 mmHg可有效预防房颤发作。有研究证实RAAS抑制剂对高血压患者房颤有一级预防作用,但其在房颤二级预防(减少发作频率和预防复发/慢性房颤)的RCT研究结果却各不相同。
JSH 2019推荐房颤患者除需充分抗凝治疗和控制心率外,还应控制收缩压< 130 mmHg。特别强调高血压是抗栓药物(抗血小板和抗凝)治疗过程中发生颅内出血的危险因素,因此对此类患者应进行严格的血压控制。
9.5 高血压合并慢性肾脏病
CKD患者若合并高血压和血压昼夜节律异常,发生心血管事件的风险增加。若高血压患者合并CKD伴蛋白尿,除进行生活方式调整外,还需开始降压治疗。为了早期发现CKD,JSH 2019建议所有高血压患者均应进行尿常规检查并估算肾小球滤过率,并使用尿白蛋/白肌酐比值来评价尿白蛋白水平。
关于CKD患者血压控制目标,JSH 2019指出:如有蛋白尿应以血压< 130/80 mmHg为目标,由于目前几乎无证据显示对无糖尿病和无蛋白尿患者严格控制血压至< 130/80 mmHg对预防心血管疾病和进展为终末期肾病是有效的,故如无糖尿病、无蛋白尿应根据患者基线的肾功能和年龄进行个体化血压管理。
CKD患者降压药物选择:对于高血压合并非糖尿病CKD伴蛋白尿阳性患者,RAAS抑制剂应为首选;有研究显示使用RAAS抑制剂降压可降低蛋白尿的发生率,但对终末期肾病或心血管疾病的进展无显著影响,因此,指南推荐蛋白尿阴性患者使用RAAS抑制剂、CCB或噻嗪类利尿剂。
日本9132例接受透析患者的数据显示,透析开始时收缩压、舒张压与总死亡率之间存在U形关联,目前很难确立血液透析患者血压控制的最佳目标。对于肾移植患者,应根据其肾功能对应的CKD分期进行血压控制。
9.6 高血压合并糖尿病
JSH 2019推荐高血压合并糖尿病患者血压控制目标为诊室血压< 130/80 mmHg,HBPM<125 /75 mmHg。对于血压≥140/90 mmHg的糖尿病患者应立即开始降压药物治疗。血压在130 ~ 139/80 ~ 89 mmHg,应及时尝试改变生活方式,如未能使血压下降则应及时考虑药物治疗。药物选择除ARB和ACEI外,也推荐使用CCB 和小剂量噻嗪类利尿剂,但如果出现微量白蛋白尿或蛋白尿,应首选ARB或ACEI。
9.7 高血压合并支气管哮喘和慢性阻塞性肺疾病
高血压合并支气管哮喘患者应避免使用β和α-β受体阻滞剂,可应用CCB、ARB和小剂量利尿剂;ACEI 引起的干咳有时难以区分是否与支气管哮喘相关,因此对高血压合并支气管哮喘患者不推荐使用。伴有慢性阻塞性肺疾病的高血压患者可应用CCB、 ACEI、ARB和小剂量利尿剂,也可给予β受体阻滞剂,但应使用选择性β1受体阻滞剂。
9.8 高血压合并肝病
晚期肝硬化患者如果合并高血压,则应进行标准的降压治疗。对于伴有严重肝功能障碍的高血压患者,由于其肝脏代谢的降压药物血药浓度增加,因此在初次使用时必须谨慎,有必要减少降压药物的剂量和延长给药间隔。研究显示:非选择性β受体阻滞剂可降低肝硬化患者消化道出血和死亡的风险,RAAS抑制剂可防止肝脏纤维化,但西拉普利可能增加肝硬化腹水患者血中活性代谢物质的浓度,引起严重低血压,因此禁用本药。肝硬化患者应慎用利尿剂,如氢氯噻嗪、氯噻酮和呋塞米,因为它们可能通过快速利尿作用诱发肝性脑病。众所周知,拉贝洛尔和甲基多巴可引起药物性肝病,肝功能障碍患者不得使用这些药物。
10 特殊人群和类型的高血压
10.1 老年高血压
日本将进入超高龄社会,据日本国家健康与营养调查(2015年)显示,65 ~ 74岁人群高血压患病率为63%,75岁以上人群患病率为 74%。JSH 2019指出65 ~ 74岁的老年高血压患者降压目标值与非老年患者相同,即为< 130/80 mmHg,年龄≥75岁的降压目标值为< 140/90 mmHg,如可耐受,血压可逐步控制于< 130 mmHg。这一标准较 JSH 2014均下调了10 mmHg,更接近AHA 2017指南对老年人降压目标的推荐(≥65岁如可耐受,收缩压可降至< 130 mmHg)。
老年患者服用降压药物应从标准剂量的1/2开始,尤其是年龄≥75岁者,之后逐渐增加剂量达到血压控制的最终目标。在确认耐受性时,还必须考虑不良反应、器官损伤和生活质量。在老年虚弱患者或需要护理的患者中,血压控制目标应根据具体情况确定。
10.2 痴呆和高血压
JSH 2019在JSH 2014基础上仍然强调中年高血压是晚年认知障碍的危险因素,应从预防痴呆的角度积极治疗中年高血压。老年人使用降压药物能否预防痴呆尚未明确,也没有研究表明降压药物对认知功能有影响,但应考虑使用降压药物预防心血管疾病。
10.3 儿童高血压
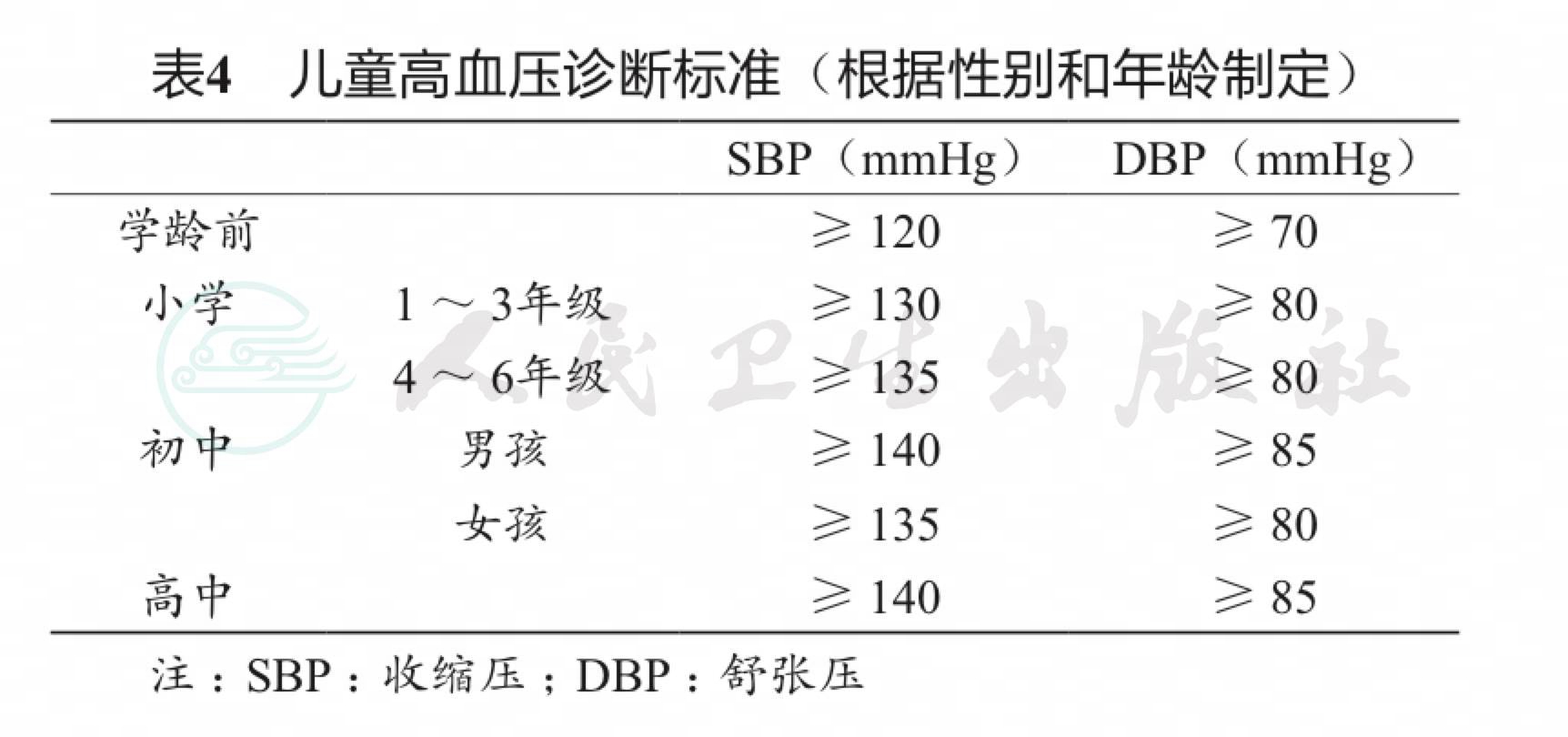
日本关于儿童高血压的流行病学研究较少,有数据显示日本儿童高血压的患病率约为3%。JSH 2019沿用了JSH 2014中的儿童高血压诊断标准(根据日本儿童年龄、性别以及血压的筛查数据制定,表4),并且首次提出了儿童降压目标为低于P90或< 130/80 mmHg,二者以较低值作为标准。血压明显升高的儿童应除外继发性高血压。儿童原发性高血压在很多情况下与肥胖有关,且可能有并发症和可追踪的成人原发性高血压,应积极改变生活方式。药物治疗推荐使用新型的降压药物,如ACEI、ARB和CCB。应用多年降压药物,如卡托普利、普萘洛尔、硝苯地平缓释片和呋塞米等由于今后不会进行临床研究,认为已不适用于儿童高血压的治疗。
10.4 术前、术后高血压管理
高血压(< 180/110 mmHg)并非围术期心血管并发症的独立危险因素,但术前血压应控制在目标血压以下。如果择期手术前血压≥180/110 mmHg应考虑推迟手术。整个围术期应通过口服或静脉降压治疗控制血压,包括手术当日早晨给药。荟萃分析显示:在非心脏手术前给予β受体阻滞剂降低了非致死性心肌梗死的发生率,但增加了卒中、死亡、低血压和心动过缓的风险。因此,JSH 2019特别强调:对于术前长期使用β受体阻滞剂治疗的患者应继续给药,但不应在手术当日给予β受体阻滞剂治疗;对于有关冠状动脉疾病的高危患者(不包括血管痉挛性心绞痛或支气管哮喘患者),也应考虑在术前≥7 d开始给予β受体阻滞剂,不应在手术当日重新开始β受体阻滞剂治疗。服用利尿剂、ARB或ACEI的患者,应注意术中/术后低血压、体液减少和肾功能障碍。消除疼痛、焦虑和兴奋对控制血压升高也是很重要的。
10.5 一过性血压升高
除嗜铬细胞瘤引起的血压明显一过性升高外,一过性血压升高不需要紧急降压治疗,除非有进行性或慢性脏器损害。压力反射机制受损的患者如老年患者和自主神经病变患者,血压明显改变,部分患者可见高血压(≥180/110 mmHg),这类患者应尽快解除导致血压升高的原因如疼痛或尿潴留,没有使用降压药物的标准,若重复测量发现血压≥180/110 mmHg,考虑年龄和全身状况可以使用降压药物。也要考虑单独休息会逐渐降低血压,即使在采用降压药物时也不需要及时使血压恢复正常,可针对性地使血压降至160/100 mmHg,避免血压过度下降。服用短效降压药物如硝苯地平,可使血压过度下降,引起脑和心脏等主要脏器缺血,因此禁用此类药物。
情绪或精神痛苦等触发血压一过性升高的患者,常以心理因素为背景,应考虑给予抗焦虑药/抗抑郁药或与心理学方法的联合治疗。
11 专栏——临床惰性
2001年Phillips等报道称临床惰性是导致高血压、糖尿病和血脂异常等主观症状疾病治疗不足的一项重要因素,涉及医疗保健提供者方面的因素、患者方面的因素以及医疗系统。JSH 2019强调了这一新术语,目的是宣传遵守指南和指出解决这个问题的重要性。
综上所述,与JSH 2014相比,JSH 2019纳入了近5年的众多研究和系统综述分析,并充分结合了当前日本高血压的流行病学现状、人群和社会特点,内容详尽。由于地理位置和饮食特点等相近,我国与日本有相近的高血压流行病学特点和人群风险因素,因此,JSH 2019的发布对我国高血压防治具有重要的借鉴作用。
[1] Shimamoto K, Ando K, Fujita T, et al. The Japanese Society of Hypertension Guidelines for the Management of Hypertension (JSH 2014)[J]. Hypertens Res, 2014, 37(4):253-387.
[2] Umemura S, Arima H, Arima S,et al. The Japanese Society of Hypertension Guidelines for the Management of Hypertension (JSH 2019)[J]. Hypertens Res, 2019, 42(9):1235-1481.
[3] Whelton PK, Carey RM, Aronow WS, et al. 2017 ACC/AHA/AAPA/ABC/ACPM/AGS/APhA/ASH/ASPC/NMA/PCNA Guideline for the Prevention, Detection, Evaluation, and Management of High Blood Pressure in Adults: Executive Summary: A Report of the American College of Cardiology/ American Heart Association Task Force on Clinical Practice Guidelines[J]. Hypertension, 2018, 71(6):1269-1324.
[4] Williams B, Mancia G, Spiering W, et al. 2018 ESC/ESH Guidelines for the management of arterial hypertension: The Task Force for the management of arterial hypertension of the European Society of Cardiology (ESC) and the European Society of Hypertension (ESH)[J]. J Hypertens, 2018, 36(10): 1953-2041.
[5] 中国高血压防治指南修订委员会,高血压联盟(中国)中华医学会心血管病学分会,中国医师协会高血压专业委员会,等.中国高血压防治指南(2018年修订版)[J].中国心血管杂志,2019,24(1):24-56.