英文名称 :gingival disease
牙龈疾病(gingival disease)是牙周疾病中的一大类别。牙周病(periodontal diseases)一词有两种含义,广义的牙周病是指发生于牙周组织(包括牙龈、牙周膜、牙槽骨和牙骨质)的疾病总称,主要为牙龈病(gingival diseases)和牙周炎(periodontitis)两大类;狭义的牙周病则仅指造成牙周支持组织破坏的牙周炎。近年来国内主张将牙周病作为广义名词,而将破坏性牙周病称为牙周炎。
牙周疾病的病因十分复杂,虽经一个多世纪的研究和争议,至今仍未完全解决。在历史上曾有主张,纯属全身原因者,如牙周组织变性、营养不良、内分泌改变等;也有主张单纯属局部原因者。自20世纪60年代中期以来,关于牙周病病因的研究进入了一个崭新的时代。目前公认牙周疾病 (尤其是牙周炎)是多因素、多基因疾病,微生物是牙周病的始动因子,但单有微生物尚不足以引起病损,宿主的易感性也是基本要素,牙周炎的发生和发展是微生物、宿主、环境相互作用的结果。牙龈炎和牙周炎的病因有很多共同之处,两者都是由于牙颈部的菌斑堆积,加上很多局部和 (或)全身因素影响细菌的堆积和致病作用,以及加强或改变炎症、破坏过程。
(一)牙菌斑
公元752年,我国的医书《外台秘要》中就有关于除去牙面沉积物以治疗牙龈疾病的记载。在西方,17世纪,Leeuwenhoek描述牙垢中有大量微生物,它们可使牙龈流血。但对于牙面沉积物及其中的微生物与牙周疾病的关系,则是在20世纪60年代以后才有了较多的了解。大量的流行病学调查表明,牙周疾病的罹患率及严重程度与口腔卫生状况和牙面的菌斑量成正比,口腔卫生差的人群,其患病率和病情远重于口腔卫生良好者。Le等所报告的实验性龈炎研究,提供了细菌引起牙龈炎的有力证据。对12名牙龈健康的年轻男性受试者彻底进行牙齿清洁后,停止刷牙等一切口腔卫生措施,逐日进行牙面的菌斑量、菌斑成分及牙龈炎症程度的观察。结果发现全体受试者均在10~21天内发生了牙龈炎,菌斑中的细菌数量和成分也发生相应的变化。在恢复刷牙后5~7天内,全体受试者的牙龈均恢复正常。其他学者也观察到动物长期堆积牙菌斑,可发生牙龈炎,并有一部分可发展为牙周炎。无菌动物即使在牙颈部结扎牙线,使食物残渣堆积,却不发生牙龈炎症;但接种细菌后,动物即发生炎症和形成牙周袋。临床上也见到对牙周病患者除去菌斑后可使病变停止或痊愈。此外,从牙周病患者的龈下菌斑中,可分离出多种毒性较大的细菌,这些细菌的数量与临床病情程度一致。将这些细菌接种于动物,可造成与人类牙周病相似的病变。从患者的血清中也可测得与这些细菌相应的特异抗体水平增高。上述事实有力地说明牙菌斑中的微生物是引起牙周疾病的主要病因,可以说,牙周疾病是感染性疾病。
1.牙菌斑的成分
牙菌斑是指黏附在牙面 (或牙齿修复体上)的软而不能被水冲掉或漱掉的堆积物。它是由大量细菌 (约占菌斑固体成分的70%~80%)及细胞间物质所组成的有一定结构的生态单位。在1mm3的菌斑中约含1亿个以上的细菌,还有少量白细胞和口腔上皮细胞。细胞之间的基质约占菌斑固体重量的1/3,主要成分为多糖,也有蛋白质和脂类。糖类主要来源于细菌从食物合成细胞外多糖,有些细菌也可将唾液糖蛋白分解为糖和蛋白。变异链球菌能利用饮食中的蔗糖合成不溶性的多糖-葡聚糖,它是形成龈上菌斑的极好黏附基质。
2.牙菌斑的形成
人类的口腔是一个多种菌杂居的环境。婴儿口腔在出生后6~10小时就能分离出少量主要为需氧生长的细菌。牙齿萌出后,口腔细菌种类变得复杂,厌氧菌比例增加。口腔菌系的种类和数量因人而异,同一个体也随牙列情况、饮食类型、口腔卫生状况、疾病及健康状况而变化。目前已能从人类口腔分离出300~500多种微生物。按其生长条件,可分为需氧菌、厌氧菌和兼性厌氧菌,其中很多是正常口腔的常驻菌群。
唾液内的细菌附着于牙面是一个复杂的物理、化学过程。首先要求有合适的牙面。在经过彻底清洗和抛光的牙面上,数分钟内即开始形成一层无结构、无细胞的薄膜(1~3μm),并迅速增厚,称为获得性薄膜 (acquired pellicle)。它来源于唾液中的糖蛋白。该薄膜是细菌在牙面附着所必需的条件。在薄膜形成约1~2小时后,即可有细菌牢固地附着其上。只有少数几种细菌具有直接黏附于薄膜的能力。最初附着的主要是革兰阳性球菌,如血链球菌、缓症链球菌等。附着机制十分复杂,通过综合的识别系统使黏附具有特异性。在一些菌体表面的附件,如菌毛、绒毛、𰬷等,含有称为黏附素(adhesin)的蛋白样大分子物质,这种含黏附素的部位称为结合点,可与牙面上具有相应糖结合物的位点 (受体)相连接而完成黏附过程。唾液中的阳离子,如Ca2+,能在带负电荷的牙面和菌体表面之间起架桥作用,从而有助于黏附,细菌的附着也受唾液成分及sIgA的影响,后者抑制细菌附着于牙面。关于龈下菌斑的形成机制了解得不多。该处获得性薄膜可能来源于龈沟液的成分。
细菌在牙面附着定居后,若不及时清除,即以极快的速度繁殖增多,形成小的集落并互相融合。这些细菌及其所产生的细菌间物质为其他菌种的定居附着提供了适当的条件。随着时间延长,菌斑增厚,其成分也日益复杂。最初1~2天的菌斑以革兰阳性球菌为主,也可逐渐出现革兰阳性短杆菌和阴性球菌,2~4天后发展为大量丝状菌和厌氧杆菌,如梭形杆菌,4~7天时形成以黏性放线菌和梭形杆菌等为主的交织结构,7天以后开始出现螺旋体、牙龈卟啉单胞菌及厌氧的能自主运动的细菌等。随着时间延长,革兰阴性厌氧菌逐渐取代革兰阳性需氧菌,菌斑的毒性增大,能刺激牙龈发炎。新形成的菌斑在24小时后即可用染料来显示,约在30天左右菌斑中微生物的量和种类达到最多,成为陈旧的成熟菌斑。滞留在龈缘附近的陈旧菌斑对牙龈的危害很大。牙菌斑中的细菌是基质包裹的互相黏附,或黏附于牙面、牙间或修复体表面的软而未矿化的细菌性群体,为不能被水冲去或漱掉的一种细菌性生物膜。生物膜概念强调牙菌斑细菌是以整体生存的微生物生态群体,它不同于悬浮的单个细菌。菌斑中的细菌凭借生物膜这种独特结构,黏附在一起生长,相互附着很紧,难以清除;另一方面菌斑生物膜的形成是一种适应过程,使细菌能抵抗宿主防御功能、表面活性剂或抗生素等的杀灭作用,能长期生存,并使各种细菌在合适的微环境中发挥不同的致病作用。
在不同个体之间,以及同一口腔内的不同部位,菌斑形成速度和成分差别很大。它受唾液的质和量、牙面光洁度、局部pH、氧和二氧化碳张力、饮食成分、龈牙结合部的免疫反应、细菌之间的竞争和相互依赖等条件的影响。唾液量少而黏稠者,以及夜间睡眠口腔静止时菌斑形成较快;进食时唾液流量增多,加上食物的摩擦作用,牙面菌斑的形成较慢。纤维性食物对牙的平滑面有一定的清洁作用,但对牙龈附近及牙齿邻面的菌斑量无影响。富含蔗糖的饮食为细菌提供了产生多糖的条件,有利于龈上菌斑的形成。其他,如牙齿排列不齐、修复体表面粗糙、口腔卫生习惯不佳者,菌斑也易堆积甚厚。
3.牙菌斑的结构
菌斑按其附着部位可分为龈上菌斑和龈下菌斑。龈上菌斑位于牙冠的近龈1/3处和其他不易清洁的部位,如窝沟、裂隙、邻接面、龋洞表面等。但对牙周组织有危害的主要是龈缘附近的龈上菌斑和龈下菌斑。菌斑量少时不易辨认,可将牙面吹干,见到乳白色无光泽的薄膜,较
牙周组织指包绕牙齿周围的组织,包括牙龈、牙周膜、牙槽骨和牙骨质。它们构成一个功能系统,将牙齿牢固地附于牙槽窝内,承担咬合功能,并构成口腔黏膜与牙齿硬组织之间良好的封闭状态,故又称为牙齿支持组织或附着装置 (attachment apparatus)。
(一)牙龈
牙龈是由覆盖牙槽突和牙颈部的口腔黏膜上皮及其下方的结缔组织构成的。它由游离龈、附着龈和牙间乳头三部分组成 (图1)。游离龈也称边缘龈,宽约1mm,呈领圈状包绕牙颈部。正常呈粉红色,菲薄而紧贴牙面,表面覆以角化的复层鳞状上皮。游离龈与牙面之间形成龈沟,正常深度为0.5~3mm,沟底位于釉牙骨质界的冠方。龈沟内壁衬以沟内上皮,为复层鳞状上皮,一般无角化层。在沟内上皮的根方呈领圈状包绕附着于牙冠或牙根的上皮称为结合上皮。
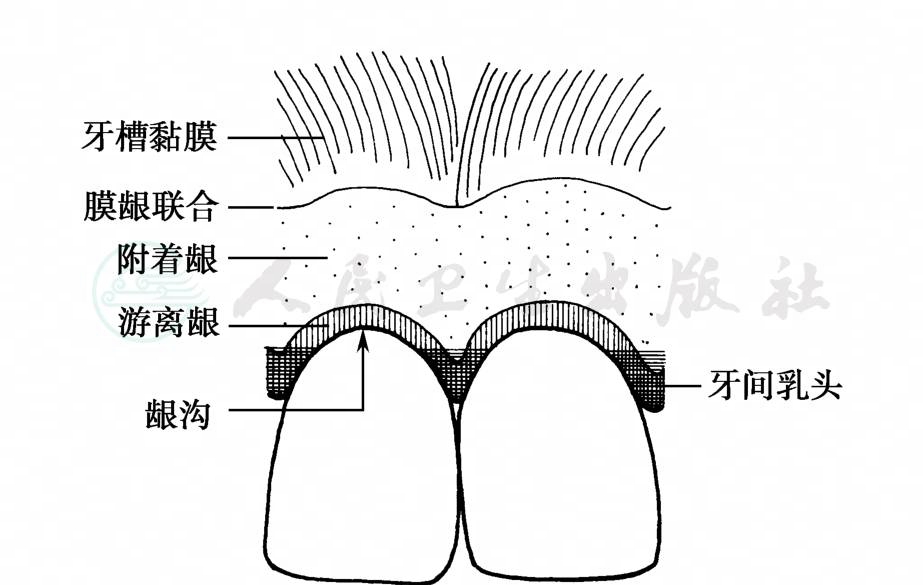
图1 牙龈的表面解剖
附着龈与游离龈相连续。由于该处的复层鳞状上皮下方没有黏膜下层,而由固有层直接紧附于牙槽骨表面的骨膜上,血管较少,故附着龈呈粉红色、坚韧、不能移动。附着龈的表面有橘皮样的点状凹陷,称为点彩。它是由数个上皮钉突融合并向结缔组织内突起所形成的。口腔内不同部位的点彩程度不一,颊侧比舌侧明显。当牙龈有炎症时点彩消失,但少数正常人也可无点彩。有些人的附着龈有色素,肤色黝黑者及黑种人较多见。
附着龈的根方为牙槽黏膜,两者间有明显的界限,称膜龈联合。牙槽黏膜的上皮角化程度较差,结缔组织较为疏松,其中血管丰富,临床表现为颜色深红,移动度较大。牵动唇、颊,观察黏膜的移动度,即可确定膜龈联合的位置,从而测量附着龈的宽度。附着龈的宽度在各个牙位不同。上颌前牙唇侧最宽 (3.5~4.5mm),后牙区较窄,第一前磨牙区最窄 (1.8~1.9mm)。有人报告最小的正常值为1mm。在上牙的腭侧,附着龈与腭部的角化黏膜相连,无明确界限。
牙间乳头呈锥形充满于相邻两牙接触区根方的龈外展隙中,由游离龈和部分附着龈所构成。每个牙齿的颊、舌侧乳头在邻面的接触区下方会合,该处略凹下,称为龈谷。该处上皮无角化、无钉突,对局部刺激物的抵抗力较低,牙周病易始发于此。
牙龈上皮的下方为纤维结缔组织,有很多胶原纤维交织排列其中 (图2)。游离龈纤维一端起自牙颈部的牙骨质,另一端呈放散状进入牙龈中;另有一些环状纤维束,这些纤维的功能均为使牙龈较紧密地附着于牙齿。牙龈中除了一半以上的细胞为成纤维细胞外,还有很多防御细胞,并能透过结合上皮和沟内上皮移出到龈沟内。
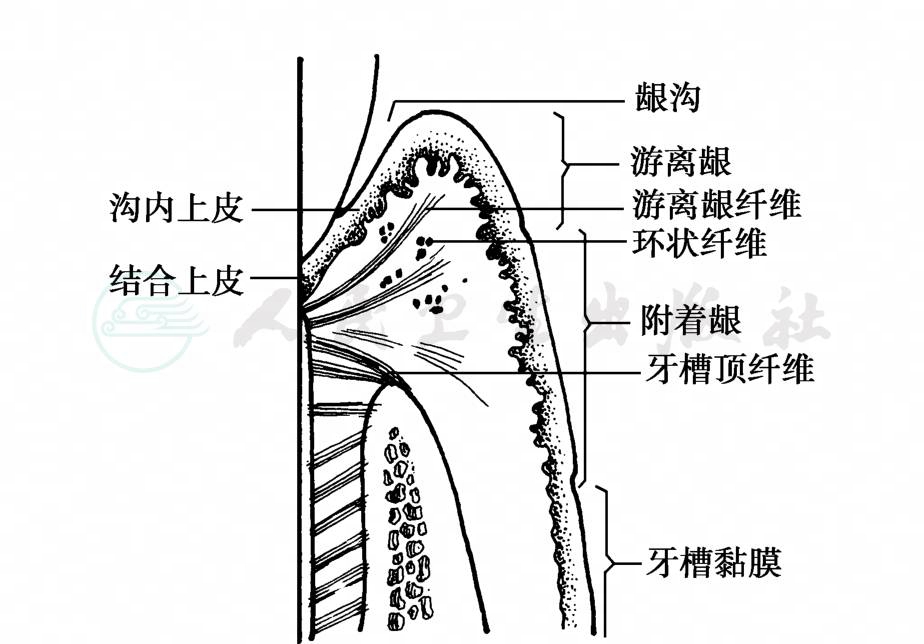
图2 牙龈组织
(二)牙周膜 (牙周韧带)
牙周膜是位于牙根和牙槽骨之间的薄层致密结缔组织,它与牙龈中的结缔组织相延续。牙周膜含有大量成束状的胶原纤维,称主纤维束。它们一端埋入牙骨质,另一端埋入牙槽骨,从而起到连接牙齿和牙槽骨的作用。主纤维束按其走行方向及功能可分为牙槽顶纤维、横纤维、斜纤维、根尖纤维和越隔纤维 (图3)。主纤维束在静止状况下略呈波纹状,使牙齿有微小的生理性动度。当牙齿受力时,张力侧的牙周膜纤维被拉直且略有伸长,并将此力传递至牙槽骨;在受压部位,牙周膜具有缓冲压力的作用,避免牙槽骨受到过大的冲击,对根尖孔处及牙周膜内的血管和神经也可起保护作用。牙齿在受到侧方𬌗力时,以位于牙根的中1/3与根尖1/3交界处的转动中心为支点,发生倾斜。磨牙的转动中心则位于诸根之间的空间。牙周膜的宽度 (厚度)随年龄及功能而变异,一般为0.15~0.38mm,以牙根中部处最窄,牙槽嵴顶及根尖孔附近较宽。但这种微小的差异在X线片上不能显示,整个牙周膜呈现为围绕牙根的窄黑线。牙周膜内的细胞具有较强的合成胶原的能力,在一生中不断形成新的主纤维、牙骨质和改建牙槽骨,这种功能对牙周组织的修复十分重要,是牙周炎治疗后形成新附着的主要来源。牙周膜中有丰富的血管和神经,除了有感受痛觉、触觉的游离神经末梢外,还有些神经末梢能感受和判断加于牙体的压力大小、位置和方向,当牙周膜发生炎症时,患者能指明患牙位置。
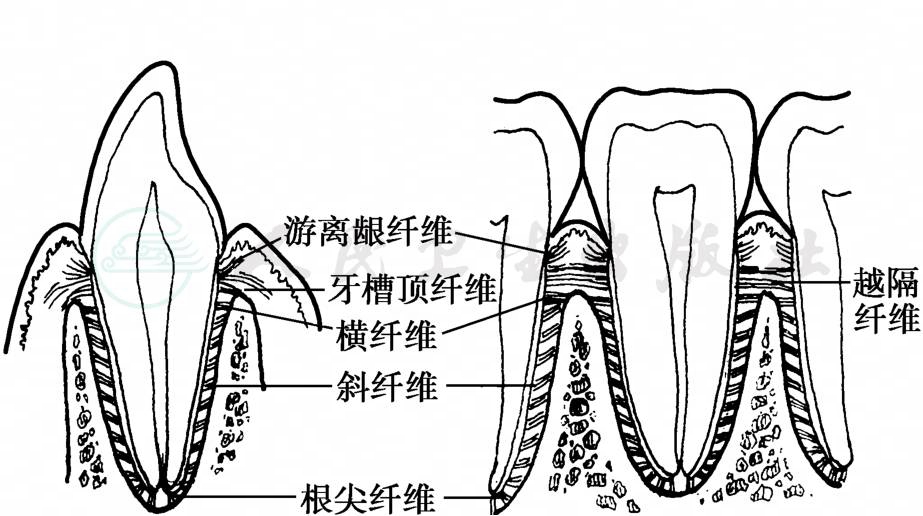
图3 牙周膜主纤维束的分布
(三)牙骨质
牙骨质虽是牙体组织的一部分,但由于它参与了使牙齿稳定于牙槽窝内、承受和分散𬌗力的生理功能,还参与牙周病变的发生和修复过程,故也可将牙骨质视为牙周组织。牙骨质在近牙颈部处最薄,仅20~50μm,向根方逐渐增厚。在牙颈部的牙骨质与釉质交界处 (釉牙骨质界)有三种形式 (图4):约60%~65%的牙齿为牙骨质覆盖釉质;约30%为两者端端相接;另5%~10%为两者不相连接,其间牙本质暴露。后一种情况,当发生牙龈退缩而牙颈部暴露后,易发生牙本质敏感。而且在牙周治疗时,牙颈部菲薄的牙骨质也容易被刮去而暴露牙本质。牙骨质在一生中不断形成、增厚,从10岁至70岁约增厚3倍,主要在根尖区和根分叉区,以代偿牙齿的𬌗面磨耗和继续萌出。牙骨质也经常发生轻微的吸收,但只有重度吸收时才能在X线片上显现。这种吸收主要由于𬌗创伤、正畸治疗、牙周炎或其他根尖周病变的压迫和吸收及埋伏牙、再植牙等。
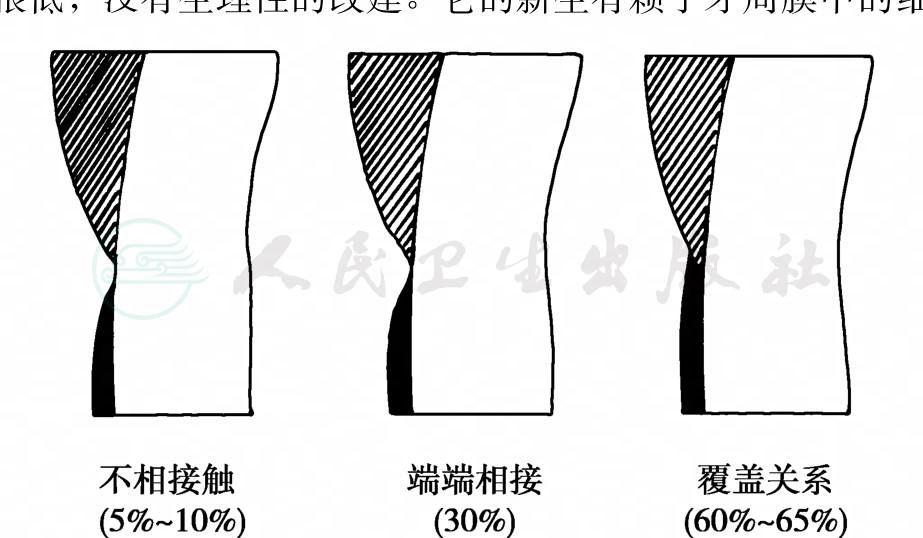
图4 釉牙骨质界处釉质与牙骨质的关系
牙骨质内只有少量细胞,无血管、神经及淋巴,代谢很低,没有生理性的改建。它的新生有赖于牙周膜中的细胞分化出成牙骨质细胞,在原有的牙根表面沉积新的成层的牙骨质,新生的牙周膜纤维也得以附着于牙齿。在牙周炎病变的愈合过程中,这种生理功能是形成牙周新附着(new attachment)所必需的。
(四)牙槽骨
牙槽骨是上、下颌骨包绕牙根的突起部分,亦称牙槽突。它是牙周组织也是全身骨骼系统中代谢和改建最活跃的部分。牙槽骨的发育、消失及形态改变,均随牙齿的位置和功能状态而变化。随着牙根的发育和牙齿萌出,牙槽突亦逐渐增高;牙齿脱落后,牙槽突随之吸收、消失。如果牙齿位置特别偏颊侧或舌侧,则该侧的牙槽骨很薄,甚至有部分缺如,致使牙根面的一部分直接与骨膜和牙龈结缔组织相连,称为“开窗”(fenestration)(图5)。如果呈V形缺口直达牙槽嵴顶,则为“骨裂开”(dehiscence) (图5)。此两种情况较多见于前牙唇侧和上颌磨牙颊侧。
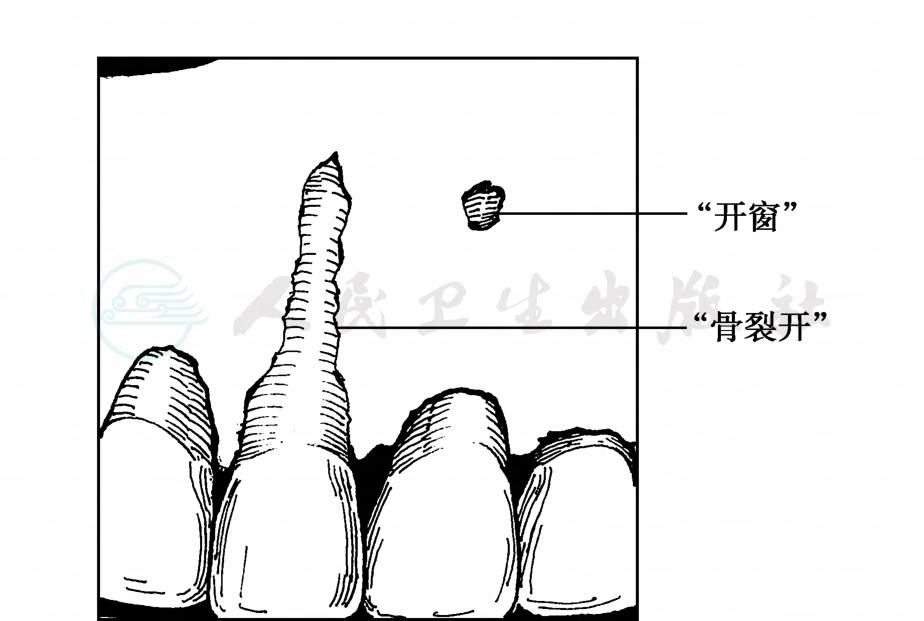
图5 “骨裂开”和“开窗”
牙齿和牙槽骨经常承受𬌗力。在受压力侧,牙槽骨发生吸收,牵引侧有新生。生理范围内的𬌗力使吸收和新生保持平衡,牙槽骨的形态和量保持相对稳定。例如:在人的一生中,由于牙齿接触区的磨耗-变平,牙齿在牙列中有逐渐近中移动的趋势。在此过程中,近中侧的牙槽骨受压力而发生吸收,其远中侧的骨则因受张力而有新骨形成,从而使牙齿得以逐渐移向近中,此为生理性的改建。
固有牙槽骨构成牙槽窝的内壁,其中有牙周膜纤维的一端埋入,称为Sharpey纤维。临床上采用X线片来观察牙槽骨的形态和结构。固有牙槽骨上虽有众多供血管、神经出入的筛状孔,但它在X线片上只显示为围绕牙根的连续、阻射的白线,称为硬骨板 (lamina dura)。在承受过大的𬌗力或牙周膜有炎症时,此硬骨板消失。与硬骨板相连的是牙槽骨的松质骨,由骨髓腔和骨小梁组成。骨小梁的数目、粗细和排列均受𬌗力大小、方向及其他全身因素的影响。
牙槽嵴顶与釉牙骨质界之间的距离比较恒定,在正常年轻人为0.96~1.22mm,一般认为此距离小于2mm时均为正常。随着年龄增大或在病变情况下,上皮附着向根方迁移,牙槽嵴顶亦随之下移。龈沟 (袋)底至牙槽嵴顶之间的距离通常保持恒定约2mm,称为生物学宽度 (biologic width),包括结合上皮 (平均宽度约0.96mm)和牙槽嵴顶以上的牙龈结缔组织 (宽度约1.07mm)。在设计牙周手术和修复体时,必须考虑保持此生物学宽度。X线片所显示的牙槽骨主要是邻面部分,颊、舌侧牙槽骨因与牙齿重叠而不能清晰显示 (图6)。
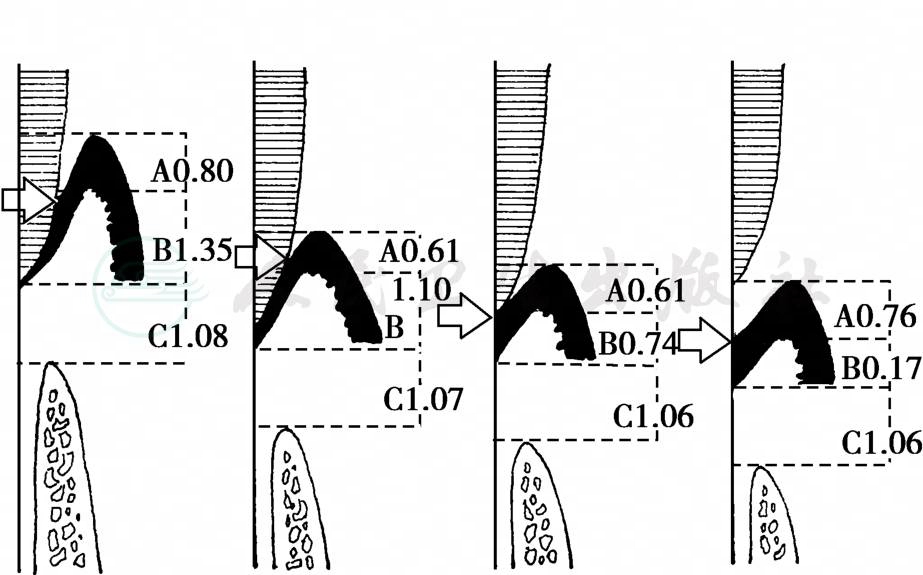
图6 牙齿萌出各阶段结合上皮的位置变化
(五)牙周组织的防御机制 (defense mechanisms of periodontal tissues)
口腔是一个开放的系统,不断受到微生物及其毒性产物和抗原成分的挑战。唾液冲洗着口腔表面,清除口腔表面附着松散的微生物。此外,龈沟液流动、口腔卫生措施和口腔黏膜上皮细胞脱落都具有去除口腔表面细菌的作用。龈牙结合部 (dento-gingival junction)是龈上、下菌斑积聚处,是宿主防御系统与细菌相互抗争的重要场所,也是牙周病的始发部位。牙周组织的防御机制包括:
1.上皮屏障 (epithelial barrier)
龈牙结合部的牙龈组织籍结合上皮与牙齿表面连接,称为上皮附着 (epithelial attachment),封闭了软硬组织的交界处。结合上皮在牙面附着的位置随着年龄及牙的不断萌出而逐渐向根方迁移。当牙在萌出过程中,结合上皮完全附着于牙釉质上。牙萌出完全后,结合上皮的一部分附于牙釉质,一部分附于牙骨质。建立咬合关系后,牙的咬合面会有不断的磨损,作为补偿牙根尖部能形成新的牙骨质,使牙继续萌出。此时,结合上皮可附着于牙骨质上,但其冠端仍位于釉牙骨质界处,构成正常的龈沟底。与牙龈表面上皮相比,结合上皮的细胞间隙较大,桥粒数目较少,细胞间的联系较松弛,上皮的通透性较高。因此它较易被机械力所穿透或撕裂。在用牙周探针探测健康的龈沟时,探针常会穿透到结合上皮内 (而不是将结合上皮从牙面剥离),致使临床探诊深度大于组织学的龈沟深度。
结合上皮是人体唯一附着于无血管、无淋巴、表面不脱落的硬组织上的上皮组织,其更新约为5天,比牙龈表面上皮的更新约快一倍。表层的衰老细胞以较快的速率脱落到龈沟内,同时使附着于结合上皮的细菌也随之脱落,这是龈牙结合部的重要防御机制之一。除了结构性屏障外,龈牙结合部还有着活跃的防御功能,即上皮附着的封闭作用、结合上皮的快速更新和修复能力、龈沟液中体液和细胞免疫因子的存在及白细胞移出到龈沟内等均构成了结合部有利的防御机制。但该处也容易堆积牙菌斑,细菌从龈沟液中摄取生长所需的营养物质及形成牙石所需的矿物质等。因此龈牙结合部是致病因子与防御机制“交战”的场所,是牙周病的始发部位。了解该处的结构、生理和功能特点十分重要。最近的研究发现,结合上皮在抗菌防御中不仅具有上皮屏障的作用,而且结合上皮细胞本身能产生有效的抗菌物质,包括防御素 (defensins)和溶酶体酶;被微生物产物激活的上皮细胞能分泌趋化因子,如IL-8,和细胞因子,如白介素-1和6,以及肿瘤坏死因子α,它们吸引并激活了专门的防御细胞,如淋巴细胞(LC)和中性多形核白细胞。这些细胞分泌的产物又依次进一步导致了结合上皮细胞的激活。
2.吞噬细胞 (phagocytic cells)
(1)中性多形核白细胞:龈沟内的中性多形核白细胞是抗牙周致病菌的第一道防线。成熟的中性多形核白细胞受细菌及其产物脂多糖 (lipopolysaccharides,LPS)等的刺激,在细胞因子、黏附因子和趋化因子的调节下,通过黏附贴壁和趋化等系列活动穿越血管内皮,到达炎症部位,吞噬细菌,再通过释放溶酶体酶或呼吸爆发活动杀灭细菌。如果中性多形核白细胞趋化或黏附功能降低或有缺陷,将严重影响中性多形核白细胞向炎症部位聚集。即便中性多形核白细胞能达到炎症部位,由于内源性或外源性吞噬或杀菌功能异常,如伴放线菌嗜血菌的白细胞毒素、或一些病原菌能躲避中性多形核白细胞的吞噬等,也会阻碍中性多形核白细胞防御作用的发挥。有证据表明,某些伴有中性多形核白细胞数目减少或功能缺陷的全身疾病,如周期性白细胞缺乏症 (cyclic neutropenia)、Chediak-Higashi综合征、掌跖角化-牙周破坏综合征 (Papillon-Lefēvre syndrome)等患者常伴有严重的牙周炎。由此可见中性多形核白细胞对牙周健康的维持是必不可少的。
中性多形核白细胞在牙周炎症过程中不仅是重要的防御细胞,而且具有致炎的双重作用。如果中性多形核白细胞对病原刺激物的反应过于激烈,便会对机体产生免疫损伤。中性多形核白细胞在其吞噬细菌的过程中产生和释放的致炎细胞因子也会加重炎症。近年来的研究表明,中性多形核白细胞在炎症过程中还具有调节作用。中性多形核白细胞具有蛋白合成能力,通过合成和释放具有免疫调节作用的细胞因子而参与免疫应答的诱导。外周血和龈沟中的中性多形核白细胞均可合成或分泌白介素1(interleukin 1,IL-1)、肿瘤坏死因子α(tumor necrosis factorα,TNF-α)、IL-6和IL-8等细胞因子及地诺前列酮 (prostaglandin E2,PGE2)。IL-1、TNF-α、PGE2等既可促进结缔组织基质的降解,也刺激骨吸收,还可通过自分泌和旁分泌途径,刺激更多的IL-1、TNF-α、和IL-8的产生,从而扩大向炎症部位聚集与激活中性多形核白细胞的能力,引起炎症的加重和扩大。中性多形核白细胞在牙周致病菌的刺激下还可产生白介素1受体拮抗剂 (interleukin 1 receptor antagonist,IL-1ra),即IL-1的抑制因子。
(2)单核-巨噬细胞:单核-巨噬细胞 (monocytes/ macrophages)是宿主防御系统的重要组成部分,在动员宿主的防御机制,抗细菌感染中发挥关键作用,维持着宿主-微生物之间的平衡。在微生物感染时,单核/巨噬细胞要发挥防御功能,必须向感染部位移出和聚集,因此单核-巨噬细胞的趋化和吞噬能力如何,直接影响其防御功能的发挥。有学者报告,有些快速进展性牙周炎患者的单核-巨噬细胞有趋化功能的异常。
单核-巨噬细胞在反应初期作为载抗原细胞,在效应期除了具有调节功能外,还作为炎症细胞、杀肿瘤细胞和杀菌细胞。一旦与外来细菌接触,巨噬细胞的杀菌能力增加,并分泌许多细胞因子刺激其他细胞的抗菌反应。这些细胞因子具有多种功能,包括放大特异性免疫系统、诱导和扩大炎症、刺激组织破坏。此外,巨噬细胞产生的细胞因子IL-1β和PGE2能刺激破骨细胞,促进骨破坏。因此巨噬细胞虽然在所有的免疫反应中起了重要的作用,但在组织破坏和骨吸收中也起了不可忽视的作用。
3.龈沟液 (gingival crevicular fluid)
龈沟液指通过龈沟内上皮和结合上皮从牙龈结缔组织渗入到龈沟内的液体。龈沟液的液体成分主要来源于血清,其他成分则分别来自血清、邻近的牙周组织 (上皮、结缔组织)及细菌。内容包括补体-抗体系统成分、各种电解质、蛋白质、葡萄糖、酶等,也含有白细胞 (主要为通过龈沟上皮迁移而出的中性白细胞)、脱落的上皮细胞等。由于龈沟液来自并通过牙周组织,疾病时牙周组织的变化可通过龈沟液成分的分析而获得早期的生化指征。
牙龈健康者只有极少量龈沟液,由组织内的渗透梯度而使组织液渗入龈沟内。龈沟液量增多是牙龈炎症早期的主要表现之一,常早于临床表征的改变。牙龈炎症明显时,龈沟液量明显增多。影响龈沟液量的因素较多,除牙龈炎症外,龈沟液量还可因机械性刺激 (咀嚼粗糙食物、刷牙、牙龈按摩、龈沟内探诊或放入滤纸条等)和化学刺激而增加。性激素可直接或间接影响毛细血管的通透性,故妇女排卵期、妊娠期或服用激素性避孕药时龈沟液量可增多。在炎症时,龈沟液中的炎症介质水平增高,如IL-1、PGE2等;龈沟液中的多种酶,如天冬氨酸转氨酶、碱性磷酸酶、髓过氧化物酶、胶原酶等亦与牙周病的严重程度和活动期等有一定的关系。有些酶不仅来自宿主,也可能来自龈沟液中的细菌,如胶原酶和碱性磷酸酶,可能由成纤维细胞或中性白细胞产生,也与龈沟液中的免疫球蛋白和口腔防御功能有关,具有针对不同致病菌的特异抗体功能。特异性抗体可通过阻止细菌附着、调理吞噬和与细菌形成抗原-抗体复合物等作用来阻止细菌的入侵。白细胞是龈沟液中的重要防御细胞。龈沟内的大多数白细胞均有活性,具有吞噬和杀菌能力。虽然在白细胞杀菌过程中也会释出有害牙周组织的物质,但一般情况下会被局限,并因牙周组织的快速更新而得到修复。因此,这些白细胞组成了一个防御外源性菌斑进入龈沟的主要防线。
从全身途径进入体内的某些药物,如抗生素等,也可进入龈沟液,并达到高而持久的浓度,因而可被利用来进行牙周治疗。如一次口服四环素后,龈沟液内的药物浓度为血清的2~7倍,16小时后仍为血清中浓度的10倍。
概括起来龈沟液具有以下作用:①通过龈沟液流冲洗龈沟内的外来物质;②含有可以促进上皮附着于牙面的血浆蛋白;③具有抗微生物的特异性抗体;④在牙龈防御机制中,其所含补体可促进抗体的活化;⑤能提供龈下细菌丰富的营养成分;⑥提供牙石矿化的物质。
龈沟液在牙龈组织的防御体系中起着重要作用,研究龈沟液的量及内容的变化,对了解牙周疾病的发生机制、病情变化及治疗效果等均有重要意义。













