佝偻病(rickets)和骨质软化症(osteomalacia)是以骨基质钙盐沉着障碍为主的慢性全身性疾病,表现为骨组织内类骨组织(未钙化骨基质)的过多聚积。病变如发生在生长中的骨骼,则成佝偻病,多见于婴幼儿,称为婴幼儿佝偻病。发生在年龄较大的儿童者称为晚期佝偻病,较为少见。如病变发生在骨生长已停止成年人则称为骨质软化症。佝偻病和骨质软化症在病因及病变方面基本相同。由于室外活动及日照减少以及城市空气污染等原因,佝偻病与骨质软化症有所增多。近年来,对其发病机制的认识有许多更新与深化。
FGF23是肿瘤性骨质软化症(tumor-induced osteomalacia,TIO)、X-性连锁低磷血症性骨质软化症/佝偻病(X-linked hypophosphatemic osteomalacia/rickets,XLH)和常染色体显性遗传性低磷血症性佝偻病(autosomal dominant hypophosphatemic rickets,ADHR)的共同病理生理基础。
磷主要储存在骨骼中,血磷受肠吸收和肾脏排泄的调节。肠吸收磷直接受饮食磷含量的影响,但也受1,25-(OH)2D的调节。血磷升高抑制PTH分泌,继而引起肾小管Ⅱ型Na依赖性Pi同转运体(NPT2a)表达,磷排泄增多,以维持血磷恒定。此外,从肿瘤性低磷血症的研究中发现,FRP4、MEPE和FGF23也是磷代谢调节的重要因素。高FGF23血症引起佝偻病/骨质软化症的共同特点是肾脏磷消耗和1,25-(OH)2D不适当降低,而FGF23升高的原因是骨细胞生成FGF23过多、肿瘤或骨纤维样发育不良(bone fibrous dysphasia)分泌过多或FGF23降解缺陷,见图6-37-49。
FGF23又称为骨矿化抑制素(inhibin)。FGF23是调节肾磷转运和骨矿化的关键性激素;许多肾磷转运障碍性疾病都与其有密切关系。FGF23是一种利磷因子(phosphaturic factor),在高血磷和1,25-(OH)2D升高情况下,骨细胞和成骨细胞分泌FGF23增多。FGF23基因突变、GALNT3基因突变(影响FGF23翻译后修饰)或klotho(FGF受体1转换为FGF23受体辅助因子)突变引起严重低磷血症和肿瘤样钙盐沉着症(tumoral calcinosis)。此外,在成骨细胞内,25-(OH)D被1α羟化酶羟化而生成1,25-(OH)2D,后者作用于核受体,启动FGF23基因表达,合成FGF23。虽然最初的研究发现,PHEX组装FGF23,但以后的研究并未证实FGF23的裂解依赖于PHEX。因此,弗林蛋白酶结构域突变是ADHR的合理解释。高FGF23血症主要发生在以下3个环节,即FGF23分泌过多、FGF23突变和PHEX突变。
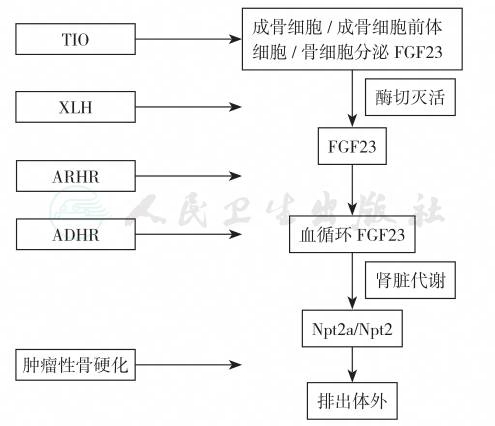
图1 FGF23相关性低磷血症的发病机制
注:TIO(tumor-induced osteomalacia):肿瘤所致的骨质软化;XLH (X-linked hypophosphatemia):X-性连锁低磷血症;ARHR(autosomal recessive hypophosphatemic rickets):常染色体隐性遗传性低磷血症性佝偻病;ADHR(autosomal dominant hypophosphatemic rickets):常染色体显性遗传性低磷血症性佝偻病;Npt2(type 2 sodium-dependent phosphate co-transporter):2型钠依赖性磷酸盐同转运体
饮食和血清的钙、磷及1,25-(OH)2D刺激FGF23生成,FGF23直接抑制1,25-(OH)2D分泌,同时抑制PTH而阻滞1,25-(OH)2D合成。FGF23抑制肾小管磷重吸收,降低血磷水平;而后者刺激1,25-(OH)2D分泌。XLH患者尽管存在明显低磷血症,但1,25-(OH)2D水平较低或正常,因此FGF23对1,25-(OH)2D的抑制作用很明显,见图6-37-50。另一方面,FGF23与肾小管受体结合后产生旁分泌因子,后者抑制Na-Pi同转运体和1α-羟化酶的活性,成骨细胞分泌PHEX使Fi转变为活性分子Fa,Fa再灭活FGF23。由于XLH PHEX突变,Fa下降,引起FGF23升高、肾磷消耗和“不适当”1,25-(OH)2D降低,见图1。













